ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Un protocollo per la preparazione di poli (acrilato pentafluorofenil) (perle di silice poly(PFPA)) innestato è presentato. La superficie funzionalizzata poly(PFPA) quindi è immobilizzata con anticorpi e utilizzata con successo per la separazione di proteine attraverso immunoprecipitazione.
Abstract
Dimostriamo un metodo semplice per preparare poli (acrilato pentafluorofenil) (poly(PFPA)) innestate perle di silice per immobilizzazione dell'anticorpo e applicazione successiva immunoprecipitazione (IP). La superficie innestate poly(PFPA) è preparata tramite un processo semplice in due fasi. Nel primo passaggio, 3-amminopropiltrietossisilano (APTES) è depositato come molecola del linker sulla superficie della silice. Nel secondo passaggio, poly(PFPA) omopolimero, sintetizzato tramite l'aggiunta reversibile e polimerizzazione di trasferimento (zattera) catena frammentazione, è innestata alla molecola del linker attraverso la reazione di scambio tra le unità pentafluorofenil (PFP) sul polimero e i gruppi amminici su APTES. La deposizione di APTES e poly(PFPA) sulla silice particelle sono confermate dalla spettroscopia fotoelettronica a raggi x (XPS), come pure monitorate dal cambiamento di dimensione delle particelle misurate tramite diffusione dinamica della luce (DLS). Per migliorare l'idrofilia superficie delle perle, parziale sostituzione di poly(PFPA) con poly(ethylene glycol) ammina-funzionalizzate (amino-PEG) viene eseguita anche. Il poly(PFPA) PEG-sostituiti innestate silice perline sono quindi immobilizzati con gli anticorpi per applicazione IP. Per la dimostrazione, un anticorpo contro la proteina chinasi attivata da RNA (PKR) è impiegato e IP efficienza è determinata mediante Western blotting. I risultati dell'analisi mostrano che le perle di anticorpo immobilizzato infatti possono essere utilizzate per arricchire PKR mentre interazioni aspecifiche della proteina sono minime.
Introduction
Pennelli di polimeri reattivi hanno ricevuto molto interesse negli ultimi anni. Sono utilizzabili per immobilizzare molecole funzionali su materiali organici o inorganici per creare superfici attivate con applicazioni in settori quali rilevamento e separazione1,2,3,4, 5. Tra i polimeri reattivi segnalati, quelli che contengono unità di estere pentafluorofenil sono particolarmente utile dovuto la loro alta reattività con le ammine e resistenza verso idrolisi6. Un tal polimero è poly(PFPA), e può essere prontamente funzionalizzati post-polimerizzazione con molecole contenenti ammine primarie o secondarie7,8,9,10. In un esempio, poly(PFPA) spazzole sono state reagite con amino-spiropyrans per creare superfici di luce-reattivo7.
La preparazione di poly(PFPA) e le sue applicazioni sono state descritte in un numero di precedenti pubblicazioni6,7,8,9,10,11,12 ,13,14,15,16,17. In particolare, Theato e collaboratori ha riferito la sintesi di poly(PFPA) spazzole via sia "innesto a" e "innesto da" metodi7,8,10,11,12 . Nel "innesto a" approccio, un poli (metilsilsesquiossano)-poli (acrilato pentafluorofenil) (polimero ibrido poly(MSSQ-PFPA)) fu sintetizzato8,10,11,12. Il componente poly(MSSQ) è stato in grado di forte adesione di forma con un numero di diverse superfici organiche ed inorganiche, consentendo in tal modo la componente poly(PFPA) formare uno strato di pennello sulla superficie del materiale rivestita. In "innesto da" approccio, superficie avviato aggiunta reversibile e polimerizzazione di frammentazione catena trasferimento (SI-zattera) è stata impiegata per preparare poly(PFPA) spazzole7. In questo caso, un agente di trasferimento di catena immobilizzati sulla superficie (SI-CTA) in primo luogo è stato fissato covalentemente al substrato tramite reazione di silice-silano. Immobilizzati SI-CTA ha partecipato quindi la polimerizzazione SI-zattera di monomeri PFPA, generando densamente poly(PFPA) spazzole con stabile covalente al substrato.
Utilizzando le spazzole poly(PFPA) sintetizzate tramite polimerizzazione SI-zattera, recentemente abbiamo dimostrato l'immobilizzazione degli anticorpi su particelle di silice poly(PFPA) innestato e la loro applicazione successiva di purificazione della proteina18. L'uso di spazzole poly(PFPA) per l'immobilizzazione dell'anticorpo è stata trovata per risolvere una serie di problemi associati all'attuale separazione delle proteine tramite IP. IP convenzionale si basa sull'uso della proteina A/G come un linker per anticorpo immobilizzazione19,20,21. Poiché l'uso della proteina A/G permette gli anticorpi essere collegato con un orientamento specifico, viene raggiunta l'efficienza di recupero di antigene target alto. Tuttavia, l'uso della proteina A/G soffre di interazione della proteina non specifici, nonché la perdita di anticorpi durante il recupero della proteina, che contribuiscono a un elevato livello di rumore di fondo. Per risolvere queste carenze, reticolazione diretto degli anticorpi ad un supporto solido è stato esplorato22,23,24. L'efficienza di tali tecniche è in genere bassa a causa dell'orientamento casuale degli anticorpi reticolato. Per il substrato poly(PFPA) innestato, l'immobilizzazione degli anticorpi è permanente, raggiunto attraverso la reazione di scambio tra unità di PFP e funzionalità di ammina sugli anticorpi. Anche se l'orientamento dell'anticorpo è ancora casuale, il sistema beneficia di avere molti siti reattivi PFP, controllabile dal grado di polimerizzazione. Inoltre, abbiamo indicato che dalla parziale sostituzione di unità PFP con amino-PEG, idrofilicità superficiale può essere sintonizzato, migliorando ulteriormente l'efficienza di recupero di proteine del sistema18. Nel complesso, le particelle di silice poly(PFPA) innestate sono state indicate per essere un'efficace alternativa alla tradizionale IP con ragionevole efficienza così come sfondo molto più pulito.
In questo contributo, segnaliamo un metodo alternativo per preparare poly(PFPA) superficie innestate per immobilizzazione dell'anticorpo e applicazione IP. In un processo semplice in due fasi, come illustrato nella Figura 1, una molecola del linker APTES prima viene depositata sulla superficie della silice, quindi il polimero di poly(PFPA) in covalenza è fissato alla molecola del linker attraverso la reazione tra le unità PFP sul polimero e le funzioni di ammina su APTES. Questo metodo di preparazione permette per la reticolazione permanente di poly(PFPA) ad una superficie di substrato, ma evita le molte complicazioni connesse con SI-CTA sintesi e polimerizzazione di SI-zattera di poly(PFPA) pennelli. Sostituzione parziale delle unità PFP con amino-PEG può ancora essere effettuato, permettendo messa a punto delle proprietà di superficie del polimero pennello. Vi mostriamo le perline di silice poly(PFPA) innestato così preparate possono essere immobilizzate con anticorpi e utilizzate per l'arricchimento di proteine tramite IP. La procedura di preparazione dettagliata perlina, immobilizzazione dell'anticorpo e IP test sono documentati in questo articolo, per i lettori interessati nella ricerca di un'alternativa ai convenzionali della proteina A/G basato su IP.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. preparazione del Poly(PFPA) omopolimero
- Dalla ricristallizzazione di AIBN
- 5 g di 2,2'-azobis(2-methylpropionitrile) (AIBN) si combinano con 25 mL di metanolo in un becher da 250 mL. Immergere il becher in un bagno di olio 60 ° C, quindi mescolare vigorosamente il composto con un'ancoretta finchè AIBN sia completamente dissolto.
- Filtrare la soluzione calda attraverso carta da filtro (ritenzione delle particelle di 5-8 μm) e memorizzare il filtrato a 4 ° C per consentire i cristalli a forma lentamente.
- Raccogliere il AIBN ricristallizzato per filtrazione. Combinare il prodotto raccolto con 25 mL di metanolo fresco e ripetere il processo di ricristallizzazione.
- Asciugare per una notte il 2x AIBN ricristallizzato in un forno sottovuoto a temperatura ambiente (TA). Conservare il prodotto al buio a <-10 ° C.
- Sintesi di benzyl dithiobenzoate25
- Preparare un pallone a sfondo sferico tre colli 500 mL dotato di un'ancoretta magnetica, un condensatore di riflusso, un imbuto e un setto di gomma. Collegare il pallone al tubo del gas di azoto attraverso il condensatore di riflusso e risciacquare l'interno aria con azoto. Inserire un termometro attraverso il setto. Aggiungere mL 41 (0,041 mol) di soluzione 1 M di bromuro di fenilmagnesio in tetraidrofurano (THF) tramite una siringa attraverso il setto stesso.
- Riscaldare la soluzione di bromuro di fenilmagnesio a 40 ° C a bagno d'olio. Quindi aggiungere g 3,1 (0,041 mol) di solfuro di carbonio mediante l'imbuto lentamente, mantenendo la temperatura della soluzione a 40 ° C.
- Aggiungere 7,1 g (0.042 mol) di bromuro di benzile per la miscela risultante mediante l'imbuto oltre 15 min aumentare la temperatura di reazione a 50 ° C. Continuare a mescolare a questa temperatura per 45 min.
- Trasferire la miscela di reazione in un imbuto separatore e diluire con 15 mL di acqua ghiacciata. Estrarre il prodotto con l'aggiunta di 15 mL di etere etilico e rimuovere lo strato di acqua inferiore. Ripetere l'estrazione con etere dietilico altre due volte.
- Le fasi organiche combinate con abbondante quantità di acqua, poi la salamoia (soluzione di 50% (p/v) NaCl in acqua) di lavare ed asciugare il prodotto sopra solfato di magnesio anidro.
- Rimuovere il solvente in vuoto a 35 ° C, utilizzando un evaporatore rotante.
- Purificare il prodotto da cromatografia a colonna con 400 mL di gel di silice (dimensione dei pori 60 Å, 63-200 maglie di dimensione delle particelle) ed etere di petrolio come l'eluente, ottenendo 5 g di benzyl dithiobenzoate (BDB) come olio rosso. 1H NMR (400 MHz, CDCl3) per confermare la purezza del prodotto: δ 8.02-7.99 (2 H, m), 7,55-7.50 (1 H, m), 7,41-7.29 (7 H, m), 4,60 (2 H, s).
- Sintesi di poly(PFPA) via zattera polimerizzazione9,26
- Commercialmente disponibile monomero PFPA contiene piccole quantità di inibitori. Prima della polimerizzazione, rimuovere gli inibitori passando il monomero attraverso una siringa monouso imballata con base allumina.
- Aggiungere 0,4 mg (0.0024 mmol) di AIBN ricristallizzato, 4,3 mg (0.018 mmol) di BDB, 1012 mg (4,25 mmol) di PFPA privo di inibitore e 0,7 mL di anisolo anidro in un pallone di Schlenk 20 mL.
- Collegare il pallone al linea di Schlenk e degassare la miscela con almeno tre cicli di gelività pompa. Brevemente, congelare la miscela di reazione in un bagno di azoto liquido. Applicare il vuoto per rimuovere il gas in spazio di testa. Tappare il matraccio quindi rimuovere dall'azoto liquido per consentire il contenuto da scongelare a TA.
- Porre la beuta in un bagno di olio 70 ° C e reagire per 4 h sotto purge2 N.
- Per terminare la reazione, togliere il pallone dal bagno di olio ed esporre il contenuto di reazione all'aria.
- Precipitare il polimero in metanolo freddo, quindi asciugare il polimero recuperato in un forno sottovuoto a 40 ° C durante la notte.
- Per misurare il peso molecolare del polimero, utilizzare cromatografia a permeazione di gel (GPC). Usare THF come percentuale di flusso della fase mobile a 35 ° C con un 1 mL/min e costruire la curva di calibrazione utilizzando standard di polistirene monodispersi. Per acquisire misura GPC, sciogliere il polimero in THF (1-2 mg/mL) e filtro attraverso il filtro di 0,2 μm monouso politetrafluoroetilene (PTFE). Iniettare 100 μL del campione nello strumento GPC. Convertire il tempo di ritenzione del campione misurato in peso molecolare utilizzando la curva di taratura in polistirolo.
2. preparazione del Poly(PFPA) funzionalizzati SiO2 perline
- Trattamento di SiO2 perline con APTES
- SiO2 particelle sono disponibili sotto forma di una sospensione acquosa di 5% (p/v). 0,8 mL di SiO2 sospensione si combinano con 40 mg di APTES e 8 mL di metanolo in un flaconcino di scintillazione 20ml dotato di una barra per l'agitazione.
- Consentire la reazione di procedere a RT per 5 ore con agitazione vigorosa.
- Trasferire la soluzione in una provetta conica. Per isolare il APTES funzionalizzati SiO2 perline, centrifugare la soluzione a 10.000 x g per 5 minuti, quindi rimuovere il surnatante. Lavare le perle disperdendo nuovamente in 3 mL di metanolo fresco. Agitare il tubo a mano per la miscelazione, ma se necessario, per migliorare la dispersione sonicazione in un bagno d'acqua per pochi secondi. Centrifugare le perline a 10.000 x g per 5 min, rimuovere il supernatante e ripetere la fase di lavaggio ancora una volta.
- Combinare il metanolo lavato SiO2 perline con 3 mL di solfossido dimetilico (DMSO). Agitare la miscela a mano, o se necessario trattare con ultrasuoni per pochi secondi, fino a quando le perline sono completamente dispersi in DMSO. Centrifugare le perline a 10.000 x g per 5 minuti, quindi rimuovere il surnatante. Ripetere il passaggio per garantire completo cambio solvente da metanolo a DMSO.
Nota: La sospensione finale contiene APTES funzionalizzati SiO2 perline dispersero in 4 mL di DMSO. - Per verificare la distribuzione granulometrica, eseguire analisi DLS. Prendere una goccia della sospensione preparata al punto 2.1.4 e posto in una cuvetta monouso di UV. Diluire il campione riempiendo la cuvetta con DMSO fresco fino a quando è 2/3 pieno. Inserire il campione nel supporto delle cellule per iniziare l'acquisizione dei dati. Per misura di dimensione delle particelle, utilizzare i seguenti parametri di installazione: temperatura: 25 ° C; Tempo di equilibramento: 120 s; Durata della misurazione: automatica.
- Per verificare la composizione della superficie, ad eseguire analisi XPS. Asciugare un piccolo campione dalla sospensione preparata al punto 2.1.4 in stufa a vuoto a 40 ° C durante la notte. Prendere il polimero secco e pack in modo uniforme in un portacampioni 0,5 x 0,5 cm. Caricare il campione nella camera del vuoto alta (10-8 torr) e iniziare l'acquisizione dei dati. Per il rispettivo strumento XPS usato, generare fotoelettroni utilizzando un monocromatico raggi x Kα Al operati a 15 kV e mA 6,7 e raccogliere utilizzando ingrandimento modalità ibrida con l'analizzatore ad un eV 50 passare energia per spettri ad alta risoluzione e un eV 100 passare energia per sondaggi Elementale.
- L'innesto di poly(PFPA) a APTES funzionalizzati SiO2 perline
- Preparare la soluzione di poly(PFPA) sciogliendo 20 mg di poly(PFPA) in 2 mL di DMSO in un flaconcino di scintillazione 20ml.
Nota: In questo studio, viene utilizzato un poly(PFPA) di peso molecolare relativamente basso (20 kg/mol). Così, nonostante la concentrazione di polimero ad alta (10 mg/mL), nessuna prova di reticolazione del polimero è osservata. Se viene utilizzato un polimero di peso molecolare più elevato, quindi concentrazione della soluzione di polimero potrebbe essere necessario essere regolata per evitare possibili reticolazione. - Aggiungere 1 mL di APTES funzionalizzati SiO2 perle sospese in DMSO (dal punto 2.1.4) per la soluzione di poly(PFPA). Reagire a temperatura ambiente per 1 h con agitazione vigorosa.
- Isolare le poly(PFPA) innestate SiO2 perline mediante centrifugazione a 10.000 x g per 5 min, seguita dalla rimozione del surnatante. Lavare le perle con l'aggiunta di 3 mL di DMSO e mescolare agitando con la mano o alcuni secondi di sonicazione. Centrifugare le perline a 10.000 x g per 5 minuti, quindi rimuovere il surnatante. Ripetere il lavaggio delle poly(PFPA) innestate SiO2 perline con DMSO due volte.
- Lavare le perle più due volte con acqua distillata tripla (TDW). In questo passaggio, unire le perline con 3 mL di TDW, poi mescolare agitando con la mano o alcuni secondi di sonicazione. Centrifugare le perline a 10.000 x g per 5 minuti, quindi rimuovere il surnatante.
- Per verificare la distribuzione granulometrica, eseguire DLS seguendo la procedura descritta al punto 2.1.5. Per controllare la chimica di superficie, eseguire XPS seguendo la procedura descritta al punto 2.1.6.
- Preparare la soluzione di poly(PFPA) sciogliendo 20 mg di poly(PFPA) in 2 mL di DMSO in un flaconcino di scintillazione 20ml.
3. preparazione di SiO2 perline innestano con Poly(PFPA) PEG-sostituiti
- Per preparare la soluzione di poly(PFPA), sciogliere 20 mg di poly(PFPA) in 2 mL di DMSO in un flaconcino di scintillazione 20ml.
- Per preparare la soluzione di PEG, sciogliere ammina-funzionalizzate PEG in 1 mL di DMSO. La quantità esatta di PEG utilizzato è determinato dal grado desiderato di sostituzione PFP, determinato dall'equazione del illustrato di seguito:
Quantità di amino-PEG (g/g-poly(PFPA)) = (N_poly(PFPA) x % PEG-Sub) x (MW_PEG / MW_poly(PFPA))
dove N_poly(PFPA) = poly(PFPA) grado di polimerizzazione
PEG-Sub % = percentuale PEG sostituzione
MW_PEG = peso molecolare di amino-PEG
MW _ poly(PFPA) = peso molecolare di poly(PFPA) - Trasferire la soluzione di PEG per la soluzione di poly(PFPA). Reagire a temperatura ambiente per 1 h con agitazione vigorosa.
- Per preparare APTES funzionalizzati SiO2 perle sospese in DMSO, seguire la stessa procedura indicata nel punto 2.1. Trasferire 1 mL della sospensione perlina in soluzione poly(PFPA) PEG-sostituiti preparata al punto 3.3. Consentire l'innesto tra poly(PFPA) e APTES funzionalizzati SiO2 perline per procedere a temperatura ambiente per 1 h con agitazione vigorosa.
- Isolare le perline mediante centrifugazione a 10.000 x g per 5 min, seguita dalla rimozione del surnatante. Lavare le perle con l'aggiunta di 3 mL di DMSO e mescolare agitando con la mano o alcuni secondi di sonicazione. Centrifugare le perline a 10.000 x g per 5 minuti, quindi rimuovere il surnatante. Ripetere due volte il lavaggio di DMSO.
- Lavare le perle due volte di più con TDW. In questo passaggio, unire le perline con 3ml TDW, poi mescolare agitando con la mano o alcuni secondi di sonicazione. Centrifugare le perline a 10.000 x g per 5 minuti, quindi rimuovere il surnatante.
- Asciugare le perline a 40 ° C in un forno sottovuoto per una notte.
4. anticorpo immobilizzazione su Poly(PFPA) innestate SiO2 perline
Nota: La stessa procedura viene utilizzata indipendentemente dalla percentuale PEG sostituzione su poly(PFPA). Preparare tamponato fosfato salino (PBS) sciogliendo compressa PBS nei TDW. Preparare la soluzione salina tamponato fosfato 0,1% (v/v) con Tween-20 (PBST) con l'aggiunta di 1/1000 di Tween-20 in PBS.
- Aggiungere 5 mg di poly(PFPA) innestate SiO2 perline per un tubo per microcentrifuga da 1,5 mL.
- Lavare le perle aggiungendo ben 800 µ l di PBS e mescolare nel Vortex. Centrifugare le perline a 10.000 x g a RT per 1 min. rimuovere il surnatante e ripetere il passaggio di lavare tre volte.
- Aggiungere 350 µ l di PBS fresco, 50 µ l 0.1% (v/v) PBST e 6.67 µ g dell'anticorpo. Incubare ~ 20 h sull'agitatore a 4 ° C.
- Lavare le perle per rimuovere gli anticorpi non legati. Centrifugare le perline a 400 x g e 4 ° C per 1 min. eliminare il surnatante e aggiungere 400 µ l di tampone di lisi con attenzione. Risospendere delicatamente le perline pipettando su e giù per cinque volte.
Nota: Usato per lavare le perle di tampone di lisi dovrebbe essere lo stesso utilizzato durante la lisi cellulare e IP, tranne che l'aggiunta di inibitore della proteasi e dithiothreitol sono facoltativi, (Vedi punto 5). - Ripetere questo passaggio lavare tre volte. Dopo il lavaggio finale, rimuovere il surnatante per quanto possibile.
5. Lisi e immunoprecipitazione delle cellule
- Preparazione del tampone di lisi e tampone di lavaggio
- Preparare il tampone di lisi (50 mM Tris-HCl (pH 8.0), 100 mM KCl, 0.5% (v/v) NP-40, glicerolo al 10% (v/v), 1 mM dithiothreitol (DTT), proteasi inibitore e cocktail).
- Preparare il tampone di lavaggio (50 mM Tris-HCl (pH 8.0), 100 mM KCl, 0.1% (v/v) NP-40 e il 10% (v/v) glicerolo).
- Memorizzare le soluzioni tampone a 4 ° C.
- Preparazione delle cellule
- Seme le cellule (cellule HeLa) uno o due giorni prima dell'esperimento IP e crescere le cellule a 37 ° C e 5% CO2.
- Raccogliere circa 1,4 x 107 cellule con un raschietto di cella e il trasferimento in una provetta conica da 15 mL. Centrifugare le cellule a 380 x g a RT per 3 min. eliminare il surnatante e risospendere con 1 mL di PBS freddo e il trasferimento in una microcentrifuga da 1,5 mL.
- Centrifugare le cellule a 10.000 x g a 4 ° C per 30 s. rimuovere il surnatante in modo pulito. Pellet di cella sono memorizzabili a-80 ° C dopo aver rimosso il supernatante.
- Preparazione dei lisati cellulari
- Risospendere il pellet cellulare con 400 µ l di tampone di lisi. Sonicare le celle utilizzando un ultrasonicatore.
- Dopo sonicazione, vortex brevemente e centrifugare il lisato a 20.000 x g a 4 ° C per 10 min.
- Trasferire il surnatante in una nuova provetta da centrifuga da 1,5 mL.
- Immunoprecipitazione
- Trasferire 300 µ l di lysate delle cellule incubata precedentemente preparato di anticorpo poly(PFPA) innestate SiO2 perline. Mantenere 30 µ l della cella lysata come l'esempio di input in un nuovo tubo del microcentrifuge. Conservare il campione di ingresso a 4 ° C.
Nota: La quantità totale di proteina nel lisato cellulare dovrebbe essere circa 4 mg. - Incubare la miscela di lisato/perline per 3 ore su un rotore a 4 ° C.
- Centrifugare la miscela a 400 x g a 4 ° C per 1 min. rimuovere il surnatante e aggiungere 400 µ l di tampone di lavaggio con attenzione. Risospendere delicatamente le perline pipettando su e giù circa cinque volte.
- Ripetere questo passaggio lavare tre volte. Dopo il lavaggio finale, rimuovere il surnatante per quanto possibile.
- Preparare 2 x sodio dodecil solfato (SDS) caricamento della tintura (25% (v/v) glicerolo, 0.1% (p/v) bromo fenolo blu (BPB), 60 mM Tris-HCl (pH 6,8), 2% (p/v) SDS e 2,75 mM 2-mercaptoetanolo). Negozio 2 x tintura di caricamento SDS a-20 ° C. Aggiungere 30 µ l di 2 x tintura di caricamento SDS le perline e l'esempio di input stored e riscaldarli per 10 min a 95 ° C.
- Dopo il riscaldamento, analizzare il campione mediante Western blotting27, o conservare il campione a-20 ° C.
- Trasferire 300 µ l di lysate delle cellule incubata precedentemente preparato di anticorpo poly(PFPA) innestate SiO2 perline. Mantenere 30 µ l della cella lysata come l'esempio di input in un nuovo tubo del microcentrifuge. Conservare il campione di ingresso a 4 ° C.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Uno schema per la preparazione di poly(PFPA) innestato SiO2 perline, con o senza PEG sostituzione è illustrato nella Figura 1. Per monitorare la APTES e poly(PFPA) processo, nudo SiO2 perline, l'innesto APTES funzionalizzati SiO2 perline e poly(PFPA) innestati SiO2 perline sono caratterizzati da XPS (Figura 3) e le liste di distribuzione (Figura 2). Efficienze IP dei branelli sono determinate mediante Western blotting. La figura 4 Mostra il Western blotting risultati per IP usando i branelli di PEG-sostituiti poly(PFPA) innestate 1%, dove le perle vengono incubate con nessun anticorpo, un anticorpo specifico non o un anticorpo anti-PKR. La figura 5 Mostra i risultati macchianti occidentali per l'utilizzo di IP 0% PEG-sostituiti poly(PFPA) innestate perle e perline 1% PEG-sostituiti poly(PFPA) innestate, entrambi incubate con anticorpi anti-PKR.

Figura 1: Schema elettrico per la preparazione di poly(PFPA) innestate SiO2 perline con APTES come una molecola del linker. (un) Poly(PFPA) innestate di perline. (b) parzialmente PEG-sostituiti poly(PFPA) innestate perline. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: misure di DLS per (a) nudo SiO2 Perline (SiO2), (b) APTES funzionalizzati SiO2 Perline (APTES-SiO2) e (c) poly(PFPA) innestate SiO2 Perline (poli (PFPA)-SiO2), disperso in DMSO. Il Z-Media diametro (d) e l'indice di polidispersione (PDI) di ciascun campione sono segnalati. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Spettri XPS per nudi SiO2 Perline (SiO2), APTES funzionalizzati SiO2 Perline (APTES-SiO2), e poly(PFPA) innestate SiO2 Perline (poli (PFPA)-SiO2). Le cime esaminate corrispondono a (un) Si 2P, (b) O 1s, (c) N 1s e (d), F 1s. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Western blotting risultati per IP usando i branelli di PEG-sostituiti poly(PFPA) innestate 1%, trattati con nessun anticorpo (lane 2), una miscela di anticorpo specifico non, coniglio normale IgG (corsia 3) o anti-PKR anticorpo (vicolo 4). Lane 1 Mostra la miscela proteica input prima di IP. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: Western blotting risultati per IP usando 0% PEG-sostituiti poly(PFPA) innestate Perline (lane 2) e 1% PEG-sostituiti poly(PFPA) innestate Perline (corsia 3), entrambi sono trattati con anticorpi anti-PKR. Lane 1 Mostra la miscela proteica input prima di IP. Clicca qui per visualizzare una versione più grande di questa figura.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
La sintesi di poly(PFPA) innestate SiO2 perline è illustrata nella Figura 1. Impiegando APTES come molecola del linker, spazzole poly(PFPA) covalentemente innestate su substrato di SiO2 possono essere preparati tramite un processo semplice in due fasi. Anche se alcune delle unità PFP sono sacrificati per la reazione con APTES, un gran numero delle unità PFP dovranno rimangono disponibili per la successiva reazione con amino-PEG o anticorpi. I gruppi PFP sono noti per formare superfici di energia bassa, in modo poly(PFPA) pennelli fanno non solvata bene in acqua28. Per applicazione IP, gli anticorpi devono essere immobilizzati sulle spazzole poly(PFPA) e questa reazione di scambio è fatto in una soluzione tampone acquosa al fine di preservare l'attività degli anticorpi. Come riportato nella nostra precedente pubblicazione, parziale sostituzione delle unità PFP con molecole idrofile quali PEG ammina-funzionalizzate possa migliorare idrofilicità superficiale, che porta a maggiore anticorpo immobilizzazione efficienza18. In questo studio, parzialmente PEG sostituito poly(PFPA) è anche preparato, poi innestati alla superficie di2 SiO utilizzando la stessa molecola del linker APTES. Nel complesso, i metodi illustrati nella Figura 1 consentono la preparazione delle superfici di poly(PFPA) innestate con diversi gradi di sostituzione PEG. Questi pennelli di polimeri con proprietà di superficie sintonizzabile forniscono una piattaforma ideale per immobilizzazione dell'anticorpo e successiva applicazione di IP.
Il processo di preparazione del branello è monitorato da XPS e liste di distribuzione. I risultati DLS per vari funzionalizzati SiO2 perline in DMSO sono riassunti nella Figura 2. Le perle di2 SiO nude esibiscono diametro idrodinamico di 666 nm, in accordo con il produttore segnalato formato del branello (0,676 μm; SD = 0,03 μm). Dopo il trattamento APTES, il diametro del tallone aumenta a 740 nm; e con il trattamento di poly(PFPA), il diametro dei grani ulteriormente aumenta a 1889 nm. È importante sottolineare che l'indice di polidispersione (PDI) per le perle di poly(PFPA) innestato è piuttosto grande (PDI = 0.76), che è indicativo di campione di scarsa qualità contenente grandi aggregati. Anche se la curva DLS Mostra solo un picco di dimensioni nanometriche, piccola quantità di aggregati possono essere presenti nella sospensione. Le perle di2 SiO funzionalizzate sono esaminate anche dal XPS per determinare la composizione superficiale (Figura 3). Dopo il trattamento APTES, N 1s picco connesso con i gruppi amminici su APTES viene rilevato. E, dopo il trattamento poly(PFPA), picco F 1s connesso con le unità PFP il polimero viene rilevato. Insieme, questi dati mostrano il successo funzionalizzazione della superficie2 SiO, prima con APTES, quindi con poly(PFPA).
Per visualizzare le perle poly(PFPA) innestato possono essere utilizzate per l'arricchimento di proteine tramite IP, abbiamo usato 1% poly(PFPA) PEG-sostituiti innestate perline e li incubati con nessun anticorpo, una miscela di anticorpi IgG Coniglio non specifico o dell'anticorpo anti-PKR. Contiene il target PKR lysate delle cellule è stata estratta dalla cella e arricchimento di PKR è stata quindi effettuata attraverso IP usando i tre tipi di perline. Per determinare l'efficienza IP, sono stati analizzati i campioni di proteine eluite contro due anticorpi differenti tramite Western blotting. Anticorpo anti-PKR è stato utilizzato per visualizzare la quantità di PKR recuperato. E, anticorpo anti-GAPDH (gliceraldeide-3-fosfato deidrogenasi) è stato usato come controllo negativo come GAPDH è una proteina abbondante che non interagisce con PKR. Come mostrato in Figura 4, perline immobilizzati con nessun anticorpo o risultato di miscela di anticorpo specifico non in nessun recupero PKR. Al contrario, i branelli incubati con l'anticorpo anti-PKR possono arricchire con successo PKR, come indicato dalla presenza di una forte banda PKR e l'assenza della banda GAPDH. Questi risultati indicano poly(PFPA) PEG-sostituito spazzole possono infatti essere funzionalizzati con anticorpi e usati per arricchimento selettivo della proteina bersaglio. Nota Quando vengono confrontate con efficienze di recupero della proteina di sistemi differenti della perla, gli esperimenti IP, nonché il successivo Western blotting analisi dovrebbe essere fatto contemporaneamente. A causa delle variazioni inerenti a questi esperimenti, i dati ottenuti su prove separate non devono essere confrontati direttamente.
Come riferito prima, l'idrofilia superficie delle spazzole poly(PFPA) svolge un ruolo chiave in IP efficienza18. La figura 5 Mostra il Western blotting dati per IP recuperato campioni proteici utilizzando perline poly(PFPA) PEG-sostituiti innestate 0% e 1% poly(PFPA) PEG-sostituiti innestate perline. In entrambi i casi, le perle sono state immobilizzate con gli anticorpi anti-PKR. Mentre l'uso di 0% PEG-sostituiti poly(PFPA) provoca bassa efficienza di recupero PKR, la poly(PFPA) di PEG-sostituiti 1% Mostra miglioramento significativo, indicato per l'arricchimento selettivo del target PKR sopra non bersaglio GAPDH. In accordo con la nostra precedente pubblicazione18, il trattamento di PEG ha aumentato l'idrofilia superficie del pennello poly(PFPA), consentendo più PFP unità essere accessibile per l'immobilizzazione dell'anticorpo, che conduce il miglioramento osservato nella efficienza IP. Notare che la sostituzione di PEG percentuale riferita in questo studio non può essere direttamente rispetto a quello segnalato nel nostro studio precedente che usato SI-zattera sintetizzato poly(PFPA) spazzole. I due casi impiegano metodi di preparazione del pennello polimero molto diversi, quindi la quantità di PFP unità disponibili con uguale PEG caricamento dovrebbe essere molto diverso. Tuttavia, le osservazioni dai due studi d'accordo qualitativamente, entrambi puntando a superficie hydrophilicity come un parametro di controllo chiave per il raggiungimento di alta efficienza IP.
Mentre idrofilicità superficiale influenza la quantità di attaccamento dell'anticorpo per le spazzole poly(PFPA), ha anche un effetto significativo su sfondo IP a causa di arricchimento non specifici. In un tipico esperimento IP, molti passaggi del lavaggio vengono eseguite per rimuovere le proteine non associati. Quando le perle sono estremamente idrofobe, ad esempio quelli con 0% sostituzione PEG, essi tendono a formare aggregati di grandi dimensioni che sono difficili da spezzare. In questo caso, proteine non specifiche possono essere intrappolati all'interno delle strutture di aggregazione e lavaggio sufficientemente non è possibile rimuovere loro, portando ad un aumento nella priorità bassa. Pertanto, quando si esegue IP, è importante per ottimizzare la proprietà di superficie della perla, e occorre prestare attenzione affinché che le perline sono ragionevolmente dispersi.
Nel complesso, abbiamo dimostrato un processo in due semplici passaggi per preparare poly(PFPA) innestate SiO2 perline e ha mostrato che l'idrofilia superficie delle perle può essere regolata con la parziale sostituzione delle unità PFP con amino-PEG. Queste spazzole di polimero sono state utilizzate con successo per arricchimento di proteina bersaglio attraverso IP, proponendosi come un'alternativa alla tradizionale proteina A/G IP tecnica basata. Ci aspettiamo poly(PFPA) spazzole per trovare applicazione in molti altri settori che richiedono immobilizzazione di biomolecole.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Gli autori non hanno nulla a rivelare.
Acknowledgments
Questo lavoro è stato supportato dall'Agenzia per lo sviluppo di difesa (Grant No. UD170039ID).
Materials
| Name | Company | Catalog Number | Comments |
| 2,2-Azobisisobutyronitrile, 99% | Daejung Chemicals | 1102-4405 | |
| Methyl alcohol for HPLC, 99.9% | Duksan Pure Chemicals | d62 | |
| Phenylmagnesium bromide solution 1.0 M in THF | Sigma-Aldrich | 331376 | |
| Carbon disulfide anhydrous, ≥99% | Sigma-Aldrich | 335266 | |
| Benzyl bromide, 98% | Sigma-Aldrich | B17905 | |
| Petroleum ether, 90% | Samchun Chemicals | P0220 | |
| Ethyl ether, 99% | Daejung Chemicals | 4025-4404 | |
| Magnesium sulfate anhydrous, powder, 99% | Daejung Chemicals | 5514-4405 | |
| Pentafluorophenyl acrylate | Santa Cruz Biotechnology | sc-264001 | contains inhibitor |
| Aluminium oxide, activated, basic, Brockmann I | Sigma-Aldrich | 199443 | |
| Sodium Chloride (NaCl) | Daejung Chemicals | 7548-4400 | |
| Anisole anhydrous, 99.7% | Sigma-Aldrich | 296295 | |
| Silica nanoparticle | Microparticles GmbH | SiO2-R-0.7 | 5% w/v aqueous suspension |
| 3-Aminopropyltrimethoxysilane, >96.0% | Tokyo Chemical Industry | T1255 | |
| Dimethyl sulfoxide for HPLC, ≥99.7% | Sigma-Aldrich | 34869 | |
| Amino-terminated poly(ethylene glycol) methyl ether | Polymer Source | P16082-EGOCH3NH2 | |
| Phosphate buffered saline tablet | Takara | T9181 | |
| Tween-20 | Calbiochem | 9480 | |
| Tris-HCl (pH 8.0) | Invitrogen | AM9855G | |
| KCl | Invitrogen | AM9640G | |
| NP-40 | VWR | E109-50ML | |
| Glycerol | Invitrogen | 15514-011 | |
| Dithiothreitol | Biosesang | D1037 | |
| Protease inhibitor | Merck | 535140-1MLCN | |
| Bromo phenol blue | Sigma-Aldrich | B5525-5G | |
| Tris-HCl (pH 6.8) | Biosolution | BT033 | |
| Sodium dodecyl sulfate | Biosolution | BS003 | |
| 2-Mercaptoethanol | Gibco | 21985-023 | |
| PKR Antibody | Cell Signaling Technology | 12297S | |
| GAPDH Antibody | Santa Cruz Biotechnology | sc-32233 | |
| Normal Rabbit IgG | Cell Signaling Technology | 2729S | |
| HeLa | Korea Cell Line Bank | 10002 | |
| Sonicator | DAIHAN Scientific | WUC-D10H | |
| Ultrasonicator | BMBio | BR2006A | |
| Centrifuge I | Eppendorf | 5424 R | |
| Centrifuge II | LABOGENE | 1736R | |
| Rotator | FINEPCR | ROTATOR/AG | |
| Vacuum oven | DAIHAN Scientific | ThermoStable OV-30 | |
| Gel permeation chromatography (THF) | Agilent Technologies | 1260 Infinity II | |
| X-ray photoelectron spectrometer | Thermo VG Scientific | Sigma Probe | |
| Dynamic light scattering | Malvern Instruments | ZEN 3690 |
References
- Johnsson, B., Löfås, S., Lindquist, G. Immobilization of proteins to a carboxymethyldextran-modified gold surface for biospecific interaction analysis in surface plasmon resonance sensors. Analytical Biochemistry. 198 (2), 268-277 (1991).
- Kurzawa, C., Hengstenberg, A., Schuhmann, W. Immobilization method for the preparation of biosensors based on pH shift-induced deposition of biomolecule-containing polymer films. Analytical Chemistry. 74 (2), 355-361 (2002).
- You, C. C., et al. Detection and identification of proteins using nanoparticle-fluorescent polymer 'chemical nose' sensors. Nature Nanotechnology. 2 (5), 318-323 (2007).
- Roberts, M. W., Ongkudon, C. M., Forde, G. M., Danquah, M. K. Versatility of polymethacrylate monoliths for chromatographic purification of biomolecules. Journal of Separation Science. 32 (15-16), 2485-2494 (2009).
- Sandison, M. E., Cumming, S. A., Kolch, W., Pitt, A. R. On-chip immunoprecipitation for protein purification. Lab on a Chip. 10 (20), 2805-2813 (2010).
- Das, A., Theato, P. Activated Ester Containing Polymers: Opportunities and Challenges for the Design of Functional Macromolecules. Chemical Reviews. 116 (3), 1434-1495 (2016).
- Choi, J., et al. Functionalization and patterning of reactive polymer brushes based on surface reversible addition and fragmentation chain transfer polymerization. Journal of Polymer Science Part A: Polymer Chemistry. 50 (19), 4010-4018 (2012).
- Kessler, D., Jochum, F. D., Choi, J., Char, K., Theato, P. Reactive surface coatings based on polysilsesquioxanes: universal method toward light-responsive surfaces. ACS Applied Materials & Interfaces. 3 (2), 124-128 (2011).
- Son, H., et al. Penetration and exchange kinetics of primary alkyl amines applied to reactive poly(pentafluorophenyl acrylate) thin films. Polymer Journal. 48 (4), 487-495 (2016).
- Kessler, D., Roth, P. J., Theato, P. Reactive surface coatings based on polysilsesquioxanes: controlled functionalization for specific protein immobilization. Langmuir. 25 (17), 10068-10076 (2009).
- Kessler, D., Theato, P. Reactive surface coatings based on polysilsesquioxanes: defined adjustment of surface wettability. Langmuir. 25 (24), 14200-14206 (2009).
- Kessler, D., Nilles, K., Theato, P. Modular approach towards multi-functional surfaces with adjustable and dual-responsive wettability using a hybrid polymer toolbox. Journal of Materials Chemistry. 19 (43), 8184-8189 (2009).
- Eberhardt, M., Mruk, R., Zentel, R., Theato, P. Synthesis of pentafluorophenyl(meth)acrylate polymers: new precursor polymers for the synthesis of multifunctional materials. European Polymer Journal. 41 (7), 1569-1575 (2005).
- Jochum, F. D., Forst, F. R., Theato, P. PNIPAM copolymers containing light-responsive chromophores: a method toward molecular logic gates. Macromolecular Rapid Communications. 31 (16), 1456-1461 (2010).
- Schattling, P., Pollmann, I., Theato, P. Synthesis of CO2-responsive polymers by post-polymerization modification. Reactive & Functional Polymers. 75, 16-21 (2014).
- He, L., Szameit, K., Zhao, H., Hahn, U., Theato, P. Postpolymerization modification using less cytotoxic activated ester polymers for the synthesis of biological active polymers. Biomacromolecules. 15 (8), 3197-3205 (2014).
- Arnold, R. M., McNitt, C. D., Popik, V. V., Locklin, J. Direct grafting of poly(pentafluorophenyl acrylate) onto oxides: versatile substrates for reactive microcapillary printing and self-sorting modification. Chemical Communications. 50 (40), 5307-5309 (2014).
- Son, H., Ku, J., Kim, Y., Li, S., Char, K. Amine-Reactive Poly(pentafluorophenyl acrylate) Brush Platforms for Cleaner Protein Purification. Biomacromolecules. 19 (3), 951-961 (2018).
- Cullen, S. E., Schwartz, B. D. An improved method for isolation of H-2 and Ia alloantigens with immunoprecipitation induced by protein A-bearing staphylococci. The Journal of Immunology. 117 (1), 136-142 (1976).
- Sisson, T. H., Castor, C. W. An improved method for immobilizing IgG antibodies on protein A-agarose. Journal of Immunology Methods. 127 (2), 215-220 (1990).
- Peritz, T., et al. Immunoprecipitation of mRNA-protein complexes. Nature Protocols. 1 (2), 577-580 (2006).
- Zhang, Z., Chen, S., Jiang, S. Dual-functional biomimetic materials: nonfouling poly (carboxybetaine) with active functional groups for protein immobilization. Biomacromolecules. 7 (12), 3311-3315 (2006).
- Yao, Y., et al. NHS-ester functionalized poly(PEGMA) brushes on silicon surface for covalent protein immobilization. Colloids and Surfaces B: Biointerfaces. 66 (2), 233-239 (2008).
- Ma, J., et al. Facile fabrication of microsphere-polymer brush hierarchically three-dimensional (3D) substrates for immunoassays. Chemical Communications. 51 (31), 6749-6752 (2015).
- Chong, Y., et al. Thiocarbonylthio compounds [SC (Ph) S− R] in free radical polymerization with reversible addition-fragmentation chain transfer (RAFT Polymerization). Role of the free-radical leaving group (R). Macromolecules. 36 (7), 2256-2272 (2003).
- Jochum, F. D., Theato, P. Temperature- and Light-Responsive Polyacrylamides Prepared by a Double Polymer Analogous Reaction of Activated Ester Polymers. Macromolecules. 42 (16), 5941-5945 (2009).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. The Western Blot. JoVE. , Cambridge, MA. (2018).
- Chua, G. B. H., Roth, P. J., Duong, H. T. T., Davis, T. P., Lowe, A. B. Synthesis and Thermoresponsive Solution Properties of Poly[oligo(ethylene glycol) (meth)acrylamide]s: Biocompatible PEG Analogues. Macromolecules. 45 (3), 1362-1374 (2012).
Tags
Chimica problema 141 poli (acrilato pentafluorofenil) 3-amminopropiltrietossisilano spazzola di polimeri reattivi funzionalizzazione post-polimerizzazione immobilizzazione dell'anticorpo immunoprecipitazioneErratum
Formal Correction: Erratum: Preparation of Poly(pentafluorophenyl acrylate) Functionalized SiO2 Beads for Protein Purification
Posted by JoVE Editors on 04/30/2019.
Citeable Link.
An erratum was issued for: Preparation of Poly(pentafluorophenyl acrylate) Functionalized SiO2 Beads for Protein Purification. Throughout the article, the term "3-aminopropyltriethoxysilane" has been replaced with "3-aminopropyltrimethoxysilane", and "APTES" with "APTMS".
The Keywords were updated from:
Poly(pentafluorophenyl acrylate), 3-aminopropyltriethoxysilane, reactive polymer brush, post-polymerization functionalization, antibody immobilization, immunoprecipitation
to:
Poly(pentafluorophenyl acrylate), 3-aminopropyltrimethoxysilane, reactive polymer brush, post-polymerization functionalization, antibody immobilization, immunoprecipitation
The Abstract was updated from:
We demonstrate a simple method to prepare poly(pentafluorophenyl acrylate) (poly(PFPA)) grafted silica beads for antibody immobilization and subsequent immunoprecipitation (IP) application. The poly(PFPA) grafted surface is prepared via a simple two-step process. In the first step, 3-aminopropyltriethoxysilane (APTES) is deposited as a linker molecule onto the silica surface. In the second step, poly(PFPA) homopolymer, synthesized via the reversible addition and fragmentation chain transfer (RAFT) polymerization, is grafted to the linker molecule through the exchange reaction between the pentafluorophenyl (PFP) units on the polymer and the amine groups on APTES. The deposition of APTES and poly(PFPA) on the silica particles are confirmed by X-ray photoelectron spectroscopy (XPS), as well as monitored by the particle size change measured via dynamic light scattering (DLS). To improve the surface hydrophilicity of the beads, partial substitution of poly(PFPA) with amine-functionalized poly(ethylene glycol) (amino-PEG) is also performed. The PEG-substituted poly(PFPA) grafted silica beads are then immobilized with antibodies for IP application. For demonstration, an antibody against protein kinase RNA-activated (PKR) is employed, and IP efficiency is determined by Western blotting. The analysis results show that the antibody immobilized beads can indeed be used to enrich PKR while non-specific protein interactions are minimal.
to:
We demonstrate a simple method to prepare poly(pentafluorophenyl acrylate) (poly(PFPA)) grafted silica beads for antibody immobilization and subsequent immunoprecipitation (IP) application. The poly(PFPA) grafted surface is prepared via a simple two-step process. In the first step, 3-aminopropyltrimethoxysilane (APTMS) is deposited as a linker molecule onto the silica surface. In the second step, poly(PFPA) homopolymer, synthesized via the reversible addition and fragmentation chain transfer (RAFT) polymerization, is grafted to the linker molecule through the exchange reaction between the pentafluorophenyl (PFP) units on the polymer and the amine groups on APTMS. The deposition of APTMS and poly(PFPA) on the silica particles are confirmed by X-ray photoelectron spectroscopy (XPS), as well as monitored by the particle size change measured via dynamic light scattering (DLS). To improve the surface hydrophilicity of the beads, partial substitution of poly(PFPA) with amine-functionalized poly(ethylene glycol) (amino-PEG) is also performed. The PEG-substituted poly(PFPA) grafted silica beads are then immobilized with antibodies for IP application. For demonstration, an antibody against protein kinase RNA-activated (PKR) is employed, and IP efficiency is determined by Western blotting. The analysis results show that the antibody immobilized beads can indeed be used to enrich PKR while non-specific protein interactions are minimal.
The fourth paragraph of the Introduction was updated from:
In this contribution, we report an alternative method to prepare poly(PFPA) grafted surface for antibody immobilization and IP application. In a simple two-step process, as illustrated in Figure 1, an APTES linker molecule is first deposited onto the silica surface, then the poly(PFPA) polymer is covalently attached to the linker molecule through the reaction between the PFP units on the polymer and the amine functions on APTES. This preparation method allows for the permanent crosslinking of poly(PFPA) to a substrate surface, but avoids the many complications associated with SI-CTA synthesis and SI-RAFT polymerization of poly(PFPA) brushes. Partial substitution of the PFP units with amino-PEG can still be performed, allowing fine-tuning of the polymer brush surface properties. We show the poly(PFPA) grafted silica beads thus prepared can be immobilized with antibodies and used for protein enrichment via IP. The detailed bead preparation procedure, antibody immobilization, and IP testing are documented in this article, for readers interested in seeking an alternative to conventional Protein A/G based IP.
to:
In this contribution, we report an alternative method to prepare poly(PFPA) grafted surface for antibody immobilization and IP application. In a simple two-step process, as illustrated in Figure 1, an APTMS linker molecule is first deposited onto the silica surface, then the poly(PFPA) polymer is covalently attached to the linker molecule through the reaction between the PFP units on the polymer and the amine functions on APTMS. This preparation method allows for the permanent crosslinking of poly(PFPA) to a substrate surface, but avoids the many complications associated with SI-CTA synthesis and SI-RAFT polymerization of poly(PFPA) brushes. Partial substitution of the PFP units with amino-PEG can still be performed, allowing fine-tuning of the polymer brush surface properties. We show the poly(PFPA) grafted silica beads thus prepared can be immobilized with antibodies and used for protein enrichment via IP. The detailed bead preparation procedure, antibody immobilization, and IP testing are documented in this article, for readers interested in seeking an alternative to conventional Protein A/G based IP.
Step 2.1 of the Protocol was updated from:
Treatment of SiO2 beads with APTES
to:
Treatment of SiO2 beads with APTMS
Step 2.1.1 of the Protocol was updated from:
SiO2 particles are available in the form of a 5% (w/v) aqueous suspension. Combine 0.8 mL of SiO2 suspension with 40 mg of APTES and 8 mL of methanol in a 20 mL scintillation vial equipped with a stir bar.
to:
SiO2 particles are available in the form of a 5% (w/v) aqueous suspension. Combine 0.8 mL of SiO2 suspension with 40 mg of APTMS and 8 mL of methanol in a 20 mL scintillation vial equipped with a stir bar.
Step 2.1.3 of the Protocol was updated from:
Transfer the solution to a conical tube. To isolate the APTES functionalized SiO2 beads, centrifuge the solution at 10,000 x g for 5 min, then remove the supernatant. Wash the beads by re-dispersing them in 3 mL of fresh methanol. Shake the tube by hand for mixing, but if necessary, improve the dispersion by sonication in a water bath for a few seconds. Centrifuge the beads at 10,000 x g for 5 min. Remove the supernatant and repeat the wash step one more time.
to:
Transfer the solution to a conical tube. To isolate the APTMS functionalized SiO2 beads, centrifuge the solution at 10,000 x g for 5 min, then remove the supernatant. Wash the beads by re-dispersing them in 3 mL of fresh methanol. Shake the tube by hand for mixing, but if necessary, improve the dispersion by sonication in a water bath for a few seconds. Centrifuge the beads at 10,000 x g for 5 min. Remove the supernatant and repeat the wash step one more time.
Step 2.1.4 of the Protocol was updated from:
NOTE: The final suspension contains the APTES functionalized SiO2 beads dispersed in 4 mL of DMSO.
to:
Combine the methanol washed SiO2 beads with 3 mL of dimethyl sulfoxide (DMSO). Shake the mixture by hand, or if necessary sonicate for a few seconds, until the beads are fully dispersed in DMSO. Centrifuge the beads at 10,000 x g for 5 min, then remove the supernatant. Repeat the step to ensure complete solvent exchange from methanol to DMSO.
NOTE: The final suspension contains the APTMS functionalized SiO2 beads dispersed in 4 mL of DMSO.
Step 2.2 of the Protocol was updated from:
Grafting poly(PFPA) to APTES functionalized SiO2 beads
to:
Grafting poly(PFPA) to APTMS functionalized SiO2 beads
Step 2.2.2 of the Protocol was updated from:
Add 1 mL of APTES functionalized SiO2 beads suspended in DMSO (from Step 2.1.4) to the poly(PFPA) solution. React at RT for 1 h with vigorous stirring.
to:
Add 1 mL of APTMS functionalized SiO2 beads suspended in DMSO (from Step 2.1.4) to the poly(PFPA) solution. React at RT for 1 h with vigorous stirring.
Step 3.4 of the Protocol was updated from:
To prepare APTES functionalized SiO2 beads suspended in DMSO, follow the same steps shown in Step 2.1. Transfer 1 mL of the bead suspension into the PEG-substituted poly(PFPA) solution prepared in Step 3.3. Allow the grafting between poly(PFPA) and APTES functionalized SiO2 beads to proceed at RT for 1 h with vigorous stirring.
to:
To prepare APTMS functionalized SiO2 beads suspended in DMSO, follow the same steps shown in Step 2.1. Transfer 1 mL of the bead suspension into the PEG-substituted poly(PFPA) solution prepared in Step 3.3. Allow the grafting between poly(PFPA) and APTMS functionalized SiO2 beads to proceed at RT for 1 h with vigorous stirring.
The first paragraph of the Representative Results was updated from:
A schematic for the preparation of poly(PFPA) grafted SiO2 beads, with or without PEG substitution is shown in Figure 1. To monitor the APTES and poly(PFPA) grafting process, bare SiO2 beads, APTES functionalized SiO2 beads, and poly(PFPA) grafted SiO2 beads are characterized by both DLS (Figure 2) and XPS (Figure 3). IP efficiencies of the beads are determined by Western blotting. Figure 4 shows the Western blotting results for IP using 1% PEG-substituted poly(PFPA) grafted beads, where the beads are incubated with no antibody, a non-specific antibody, or anti-PKR antibody. Figure 5 shows the Western blotting results for IP using 0% PEG-substituted poly(PFPA) grafted beads and 1% PEG-substituted poly(PFPA) grafted beads, both incubated with anti-PKR antibodies.
to:
A schematic for the preparation of poly(PFPA) grafted SiO2 beads, with or without PEG substitution is shown in Figure 1. To monitor the APTMS and poly(PFPA) grafting process, bare SiO2 beads, APTMS functionalized SiO2 beads, and poly(PFPA) grafted SiO2 beads are characterized by both DLS (Figure 2) and XPS (Figure 3). IP efficiencies of the beads are determined by Western blotting. Figure 4 shows the Western blotting results for IP using 1% PEG-substituted poly(PFPA) grafted beads, where the beads are incubated with no antibody, a non-specific antibody, or anti-PKR antibody. Figure 5 shows the Western blotting results for IP using 0% PEG-substituted poly(PFPA) grafted beads and 1% PEG-substituted poly(PFPA) grafted beads, both incubated with anti-PKR antibodies.
Figure 1 was updated from:
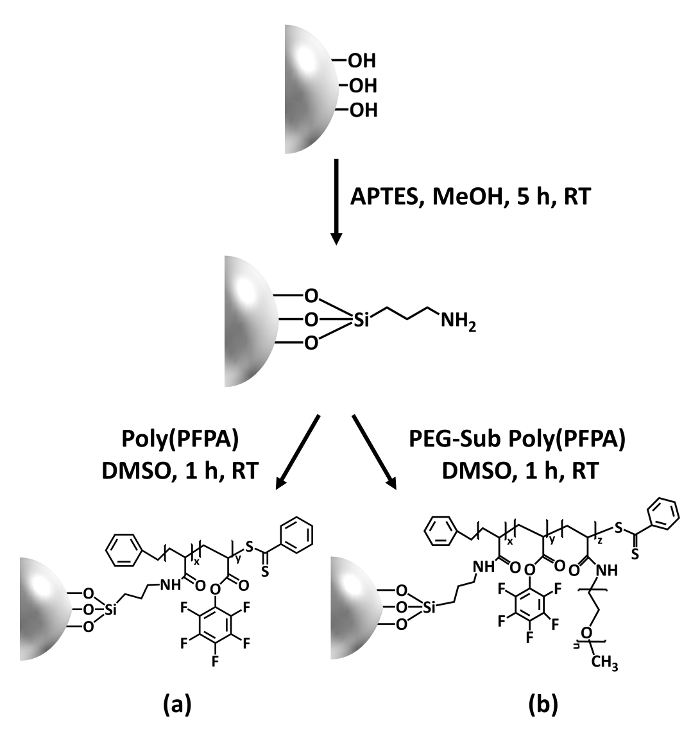
Figure 1: Schematic for the preparation of poly(PFPA) grafted SiO2 beads using APTES as a linker molecule. (a) Poly(PFPA) grafted beads. (b) Partially PEG-substituted poly(PFPA) grafted beads.
to:
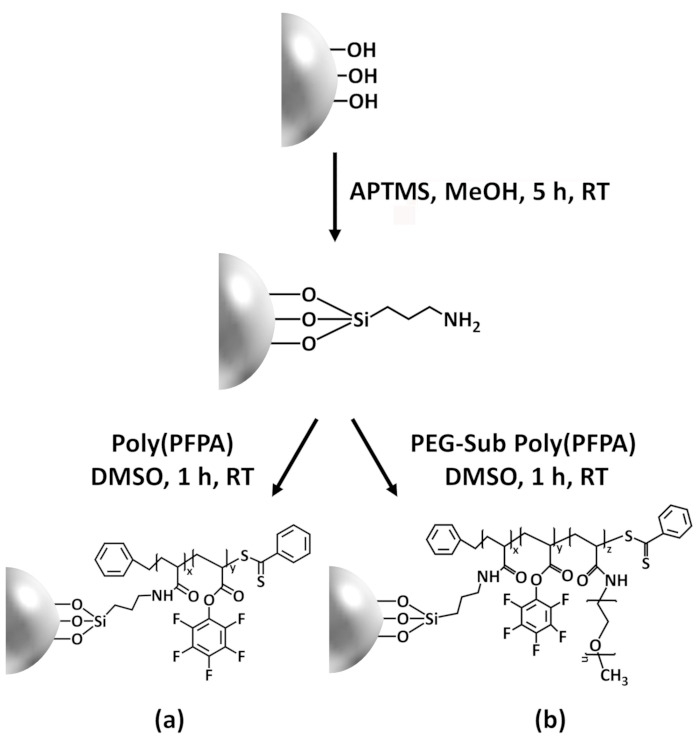
Figure 1: Schematic for the preparation of poly(PFPA) grafted SiO2 beads using APTMS as a linker molecule. (a) Poly(PFPA) grafted beads. (b) Partially PEG-substituted poly(PFPA) grafted beads.
Figure 2 was updated from:
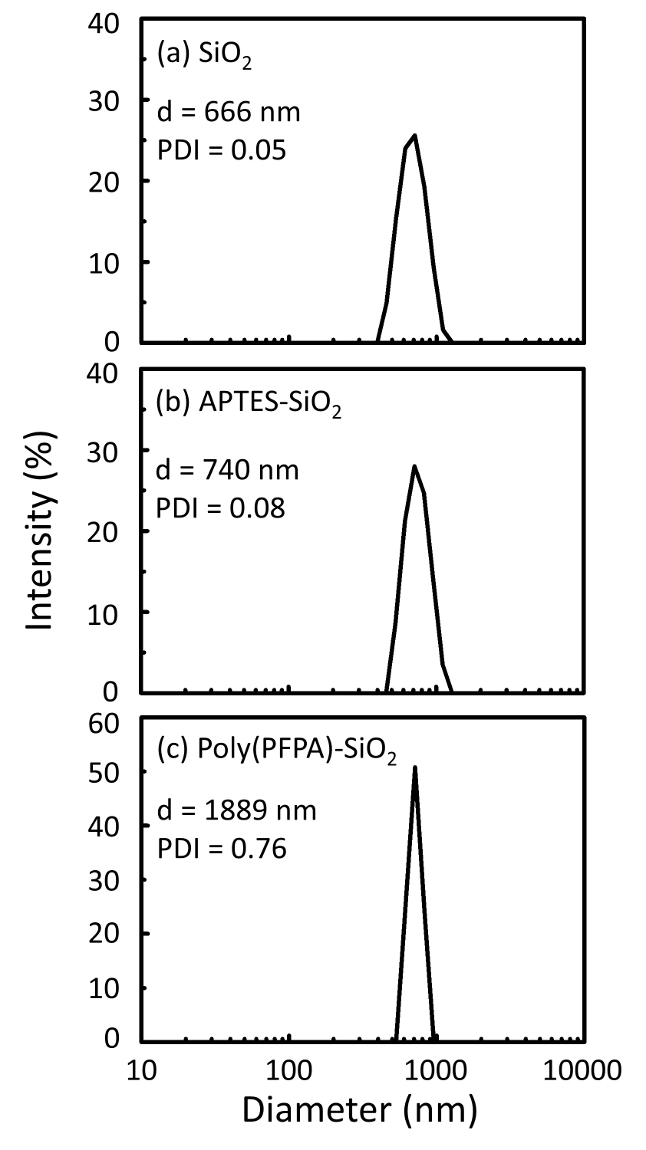
Figure 2: DLS measurements for (a) bare SiO2 beads (SiO2), (b) APTES functionalized SiO2 beads (APTES-SiO2), and (c) poly(PFPA) grafted SiO2 beads (poly(PFPA)-SiO2), dispersed in DMSO. The Z-average diameter (d) and polydispersity index (PDI) of each sample are reported.
to:
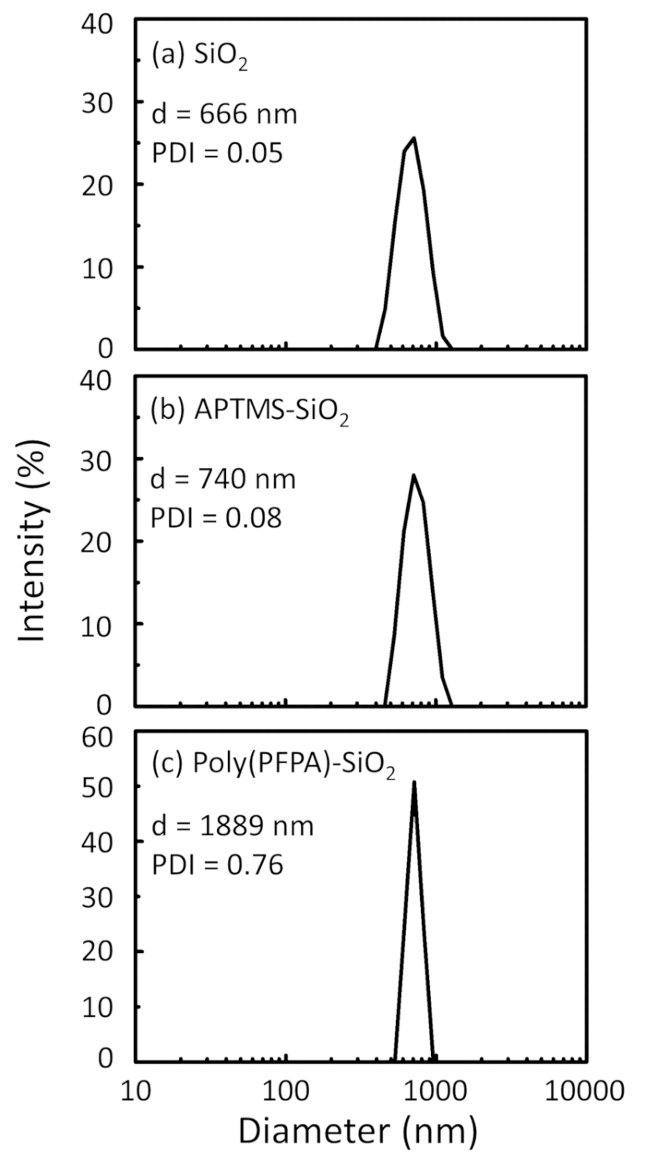
Figure 2: DLS measurements for (a) bare SiO2 beads (SiO2), (b) APTMS functionalized SiO2 beads (APTMS-SiO2), and (c) poly(PFPA) grafted SiO2 beads (poly(PFPA)-SiO2), dispersed in DMSO. The Z-average diameter (d) and polydispersity index (PDI) of each sample are reported.
Figure 3 was updated from:
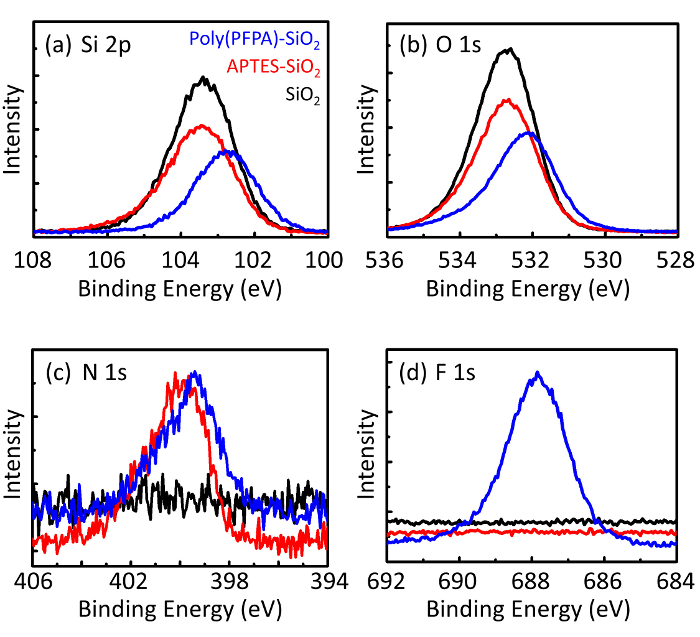
Figure 3: XPS spectra for bare SiO2 beads (SiO2), APTES functionalized SiO2 beads (APTES-SiO2), and poly(PFPA) grafted SiO2 beads (poly(PFPA)-SiO2). The peaks examined correspond to (a) Si 2p, (b) O 1s, (c) N 1s, and (d) F 1s.
to:
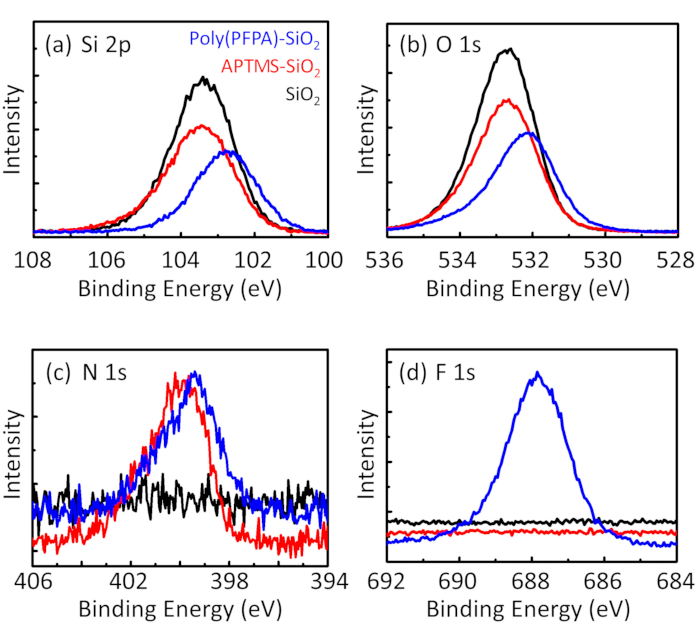
Figure 3: XPS spectra for bare SiO2 beads (SiO2), APTMS functionalized SiO2 beads (APTMS-SiO2), and poly(PFPA) grafted SiO2 beads (poly(PFPA)-SiO2). The peaks examined correspond to (a) Si 2p, (b) O 1s, (c) N 1s, and (d) F 1s.
The first and second paragraphs of the Discussion were updated from:
The synthesis of poly(PFPA) grafted SiO2 beads is illustrated in Figure 1. By employing APTES as a linker molecule, poly(PFPA) brushes covalently grafted to SiO2 substrate can be prepared via a simple two-step process. Although some of the PFP units are sacrificed for the reaction with APTES, a large number of the PFP units are expected to remain available for later reaction with either amino-PEG or antibodies. The PFP groups are known to form low energy surfaces so poly(PFPA) brushes do not solvate well in water28. For IP application, the antibodies need to be immobilized on the poly(PFPA) brushes, and this exchange reaction is done in aqueous buffer solution in order to preserve the activity of the antibodies. As reported in our previous publication, partial substitution of the PFP units with hydrophilic molecules such as amine-functionalized PEG can improve surface hydrophilicity, leading to increased antibody immobilization efficiency18. In this study, partially PEG substituted poly(PFPA) is also prepared, then grafted to the SiO2 surface using the same APTES linker molecule. Overall, the methods illustrated in Figure 1 allow the preparation of poly(PFPA) grafted surfaces with different degrees of PEG substitution. These polymer brushes with tunable surface properties provide an ideal platform for antibody immobilization and subsequent IP application.
The bead preparation process is monitored by both DLS and XPS. The DLS results for various functionalized SiO2 beads in DMSO are summarized in Figure 2. The bare SiO2 beads exhibit hydrodynamic diameter of 666 nm, in agreement with the manufacturer reported bead size (0.676 μm; SD = 0.03 μm). After APTES treatment, the bead diameter increases to 740 nm; and with poly(PFPA) treatment, the bead diameter further increases to 1889 nm. It is important to point out that the polydispersity index (PDI) for the poly(PFPA) grafted beads is rather large (PDI = 0.76), which is indicative of poor quality sample containing large aggregates. Although the DLS curve only shows one nano-sized peak, small amount of aggregates may be present in the suspension. The functionalized SiO2 beads are also examined by XPS to determine surface composition (Figure 3). Following APTES treatment, N 1s peak associated with the amine groups on APTES is detected. And, following poly(PFPA) treatment, F 1s peak associated with the PFP units on the polymer is detected. Together these data show the successful functionalization of the SiO2 surface, first with APTES, then with poly(PFPA).
to:
The synthesis of poly(PFPA) grafted SiO2 beads is illustrated in Figure 1. By employing APTMS as a linker molecule, poly(PFPA) brushes covalently grafted to SiO2 substrate can be prepared via a simple two-step process. Although some of the PFP units are sacrificed for the reaction with APTMS, a large number of the PFP units are expected to remain available for later reaction with either amino-PEG or antibodies. The PFP groups are known to form low energy surfaces so poly(PFPA) brushes do not solvate well in water28. For IP application, the antibodies need to be immobilized on the poly(PFPA) brushes, and this exchange reaction is done in aqueous buffer solution in order to preserve the activity of the antibodies. As reported in our previous publication, partial substitution of the PFP units with hydrophilic molecules such as amine-functionalized PEG can improve surface hydrophilicity, leading to increased antibody immobilization efficiency18. In this study, partially PEG substituted poly(PFPA) is also prepared, then grafted to the SiO2 surface using the same APTMS linker molecule. Overall, the methods illustrated in Figure 1 allow the preparation of poly(PFPA) grafted surfaces with different degrees of PEG substitution. These polymer brushes with tunable surface properties provide an ideal platform for antibody immobilization and subsequent IP application.
The bead preparation process is monitored by both DLS and XPS. The DLS results for various functionalized SiO2 beads in DMSO are summarized in Figure 2. The bare SiO2 beads exhibit hydrodynamic diameter of 666 nm, in agreement with the manufacturer reported bead size (0.676 μm; SD = 0.03 μm). After APTMS treatment, the bead diameter increases to 740 nm; and with poly(PFPA) treatment, the bead diameter further increases to 1889 nm. It is important to point out that the polydispersity index (PDI) for the poly(PFPA) grafted beads is rather large (PDI = 0.76), which is indicative of poor quality sample containing large aggregates. Although the DLS curve only shows one nano-sized peak, small amount of aggregates may be present in the suspension. The functionalized SiO2 beads are also examined by XPS to determine surface composition (Figure 3). Following APTMS treatment, N 1s peak associated with the amine groups on APTMS is detected. And, following poly(PFPA) treatment, F 1s peak associated with the PFP units on the polymer is detected. Together these data show the successful functionalization of the SiO2 surface, first with APTMS, then with poly(PFPA).



