ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
פרוטוקול עבור הכנת פוליפוני (pentafluorophenyl אקרילט) (חרוזים סיליקה poly(PFPA)) הושתל מוצג. לאחר מכן, השטח functionalized poly(PFPA) הוא מרותק למיטה עם נוגדנים, בעבר בהצלחה לצורך הקמת מכשול ההפרדה חלבון באמצעות immunoprecipitation.
Abstract
נדגים שיטה פשוטה להכנת פוליפוני (אקרילט pentafluorophenyl) (poly(PFPA)) הושתל חרוזים סיליקה עבור קיבעון נוגדן ויישום עוקבות immunoprecipitation (IP). השטח המושתל poly(PFPA) מוכן באמצעות תהליך בן שני שלבים פשוטים. בשלב הראשון, 3-aminopropyltriethoxysilane (APTES) מועבר כ מולקולה מקשר על גבי המשטח סיליקה. בשלב השני, homopolymer poly(PFPA), מסונתז דרך הפיך תוספת פיצול שרשרת העברת (רפסודה) פלמור, הורכבה על המולקולה מקשר דרך התגובה החליפין בין היחידות pentafluorophenyl (PFP) פולימר וקבוצות אמין על APTES. בתצהיר של APTES ו- poly(PFPA) על סיליקה חלקיקים הם אושרה על-ידי photoelectron הספקטרומטריה (XPS), כמו גם המנוטרת על-ידי שינוי גודל החלקיקים נמדד באמצעות פיזור אור דינאמי (DLS). כדי לשפר את hydrophilicity משטח של החרוזים, החלפה חלקית של poly(PFPA) עם poly(ethylene glycol) functionalized-אמין (אמינו-יתד) מבוצע גם. Poly(PFPA) שהוחלפו פג הושתל סיליקה חרוזים אז מרותק למיטה עם נוגדנים עבור יישום ה-IP. להדגמה, נוגדן כנגד חלבון קינאז מופעל RNA (PKR) הוא מועסק, יעילות IP נקבעת על-ידי סופג המערבי. מתוצאות הניתוח מראים כי החרוזים נוגדן. מרותק למיטה אכן יכול לשמש כדי להעשיר PKR בזמן אינטראקציות חלבון שאינם ספציפיים הן מינימליות.
Introduction
מברשות פולימר תגובתי קיבלו את עניין רב בשנים האחרונות. הם יכולים לשמש כדי לשתק מולקולות פונקציונלי על חומרים אורגני או לא ליצירת משטחים מופעל עם יישומים בתחומים כמו איתור והפרדה1,2,3,4, 5. בין פולימרים תגובתי דיווח, אלה המכילים pentafluorophenyl אסתר יחידות שימושיים בעיקר בשל שלהם תגובתיות גבוהה עם אמינים והתנגדות כלפי הידרוליזה6. אחד פולימר כזה הוא poly(PFPA), זה יכול להיות בקלות functionalized שלאחר הפילמור עם מולקולות המכילות אמינים ראשית או משנית7,8,9,10. בדוגמה אחת, מברשות poly(PFPA) היו הגיבו אמינו-spiropyrans ליצירת משטחים אור מגיב7.
הכנת poly(PFPA) ושימושיה תוארו במספר הקודם פרסומים6,7,8,9,10,11,12 ,13,14,15,16,17. בפרט, Theato ועמיתים דיווחו על הסינתזה של מברשות poly(PFPA) דרך "הרכבה כדי" וגם "הרכבה של" שיטות7,8,10,11,12 . ב "משתילים על" הגישה, מבחן פוליגרף (methylsilsesquioxane)-פולי (אקרילט pentafluorophenyl) (poly(MSSQ-PFPA)) היברידית פולימר היה מסונתז8,10,11,12. הרכיב poly(MSSQ) היה מסוגל הדבקה חזקה טופס עם מספר של משטחים אורגניים ואנאורגניים שונים, ובכך מאפשר את הרכיב poly(PFPA) ליצור שכבת מברשת על פני השטח חומרים מצופים. "משתילים מ" הגישה, משטח יזם תוספת הפיך, פיצול שרשרת העברת (סי-רפסודה) הפילמור הועסק להכין מברשות poly(PFPA)7. במקרה זה, סוכן העברת השטח שרשרת קיבוע (סי-CTA) היה הראשון covalently למצע באמצעות התגובה סיליקה-silane. קיבוע של סי-CTA ואז השתתפו סי-רפסודה פלמור של מונומרים PFPA, יצירת מברשות poly(PFPA) בצפיפות עם הצמדה קוולנטיות יציב המצע.
על ידי ניצול מברשות poly(PFPA) מסונתז באמצעות סי-רפסודה פלמור, לאחרונה להדגים את הנייח של נוגדנים על חלקיקי סיליקה poly(PFPA) הושתל ויישומם עוקבות חלבון טיהור18. השימוש poly(PFPA) מברשות נוגדן הנייח נמצאה כדי לפתור מספר בעיות הקשורות הנוכחי ההפרדה חלבון באמצעות ה-IP. IP קונבנציונאלי מסתמך על השימוש של חלבון A/G כמו מקשר (linker) נוגדן הנייח19,20,21. מאז השימוש של חלבון A/G מאפשר את הנוגדנים להיקשר עם כיוון הדפסה ספציפי, מושגת המטרה גבוהות אנטיגן התאוששות יעילות. עם זאת, השימוש של חלבון A/G סובל אינטראקציית חלבון שאינם ספציפיים, כמו גם האובדן של נוגדנים במהלך ההתאוששות חלבון, אשר שניהם תורמים רמה גבוהה של רעש רקע. כדי לפתור חסרונות אלה, crosslinking ישירה של הנוגדנים כדי תמיכה מלאה כבר בחנו22,23,24. היעילות של טכניקות אלה הוא בדרך כלל נמוך בגלל הכיוון האקראי של נוגדנים תפור. המצע poly(PFPA) הושתל, הנייח של נוגדנים הוא קבוע, מושגת באמצעות exchange התגובה בין יחידות ה-PFP ופונקציונליות אמין על נוגדנים. כיוון נוגדן אמנם עדיין אקראי, המערכת מועילה מהצורך תגובתי PFP אתרים רבים, לשליטה על ידי מידת פלמור. יתר על כן, הראינו כי על ידי החלפת חלקי של ה-PFP יחידות עם אמינו-פג, hydrophilicity פני השטח ניתן לכוונן, ושיפור היעילות התאוששות חלבון מערכת18. בסך הכל, חלקיקי סיליקה poly(PFPA) הושתל הוצגו להיות חלופה יעילה IP מסורתי עם יעילות סבירים, כמו גם הרבה רקע נקי יותר.
בתרומה זו, מדווחים שיטה חלופית כדי להכין משטח המושתל poly(PFPA) נוגדנים הנייח ויישום ה-IP. בתהליך בן שני שלבים פשוטים, כמופיע באיור 1, מולקולה מקשר APTES קודם הופקד על גבי המשטח סיליקה, ולאחר מכן הפולימר poly(PFPA) covalently מחובר המולקולה מקשר דרך התגובה בין היחידות PFP על פולימר ולפונקציה אמין על APTES. שיטת הכנה זו מאפשרת crosslinking קבוע של poly(PFPA) על משטח המצע, אך מונע סיבוכים רבים הקשורים סינתזה סי-CTA ו- SI-רפסודה פלמור של מברשות poly(PFPA). החלפה חלקית של יחידות ה-PFP עם אמינו-יתד ניתן עדיין לבצע, שמאפשר כוונון של המאפיינים משטח של מברשת פולימר. אנו מראים חרוזים סיליקה poly(PFPA) הושתל ובכך מוכן יכול להיות מרותק למיטה עם נוגדנים ונועד לשמש העשרה חלבונית דרך IP. הליך הכנת חרוזים מפורט, נוגדן הנייח, ובדיקות IP מתועדים במאמר זה, עבור הקוראים ומעוניינים אלטרנטיבה קונבנציונאלי חלבון A/G מבוסס IP.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. הכנת Poly(PFPA) Homopolymer
- Recrystallization של AIBN
- לשלב 5 g של 2,2'-azobis(2-methylpropionitrile) (AIBN) עם 25 מ של מתנול ב גביע 250 מ. לטבול את הספל באמבט שמן 60 ° C, ואז נמרצות ומערבבים את התערובת עם בר-מערבבים עד התפרקה לחלוטין AIBN.
- לסנן את הפתרון חמים באמצעות נייר סינון (5-8 μm חלקיקים השמירה) ולאחסן את פילטרט של 4 ° C כדי לאפשר לגבישים טופס לאט.
- לאסוף את AIBN recrystallized על ידי סינון. לשלב את המוצר שנאספו עם 25 מ של מתנול טריים וחזור על התהליך recrystallization.
- יבש את 2 x AIBN recrystallized בתנור ואקום בטמפרטורת החדר (RT) בן לילה. לאחסן את המוצר בחושך ב <-10 ° c
- סינתזה של בנזיל dithiobenzoate25
- להכין בקבוקון סיבוב למטה שלוש-צוואר 500 מ"ל מצויד עם פס מגנטי stir, הקבל refluxing, משפך יורד על מחצה גומי. לחבר את הבקבוקון אל קו גז חנקן דרך מעבה refluxing ואת לשטוף מבפנים אוויר עם חנקן. הוספת מד חום דרך מחצה. להוסיף 41 מ"ל (0.041 mol) של 1 מ' פתרון של phenylmagnesium ברומיד tetrahydrofuran (THF) באמצעות מזרק מחצה אותו.
- חממו את הפתרון phenylmagnesium ברומיד עד 40 ° צלזיוס באמבט שמן. לאחר מכן להוסיף 3.1 g (0.041 mol) של פחמן דיסולפידי דרך המשפך יורד לאט, שמירה על הטמפרטורה הפתרון ב- 40 מעלות צלזיוס.
- להוסיף 7.1 גרם (0.042 mol) בנזיל ברומיד לתערובת הנובעת דרך המשפך יורד מעל 15 דקות להגביר טמפרטורת התגובה עד 50 מעלות צלזיוס. המשך ערבוב בטמפרטורה זו למשך 45 דקות.
- להעביר את התערובת התגובה משפך, לדלל עם 15 מ"ל מים קרים קרים. לחלץ את המוצר על-ידי הוספת 15 מ"ל של דיאתיל אתר ולהסיר את שכבת מים נמוכה יותר. חזור על החילוץ עם דיאתיל אתר עוד פעמיים.
- לשטוף את שלבי אורגני בשילוב עם כמות שופע מים, אז מי מלח (פתרון של 50% (w/v) NaCl במים) ויבש המוצר מעל נטול מים מגנזיום גופרתי.
- הסר הממס בואקום ב 35 ° C באמצעות המאדה.
- לטהר את המוצר על ידי גזים עמודה באמצעות 400 מ של סיליקה ג'ל (גודל הנקבוביות 60 Å, 63-200 רשת שינוי גודל החלקיקים) ואתר נפט כמו eluent, מניב 5 גר' בנזיל dithiobenzoate (BDB) כמו שמן אדום. לאשר את הטוהר המוצר על ידי 1H NMR (400 מגה-הרץ, CDCl3): אלפא 8.02-7.99 (2 H, m), 7.55-7.50 (1 H, m), 7.41-7.29 (7 H, m), 4.60 (2 H, s).
- סינתזה של poly(PFPA) באמצעות רפסודה הפילמור9,26
- זמינים מסחרית PFPA מונומר מכיל כמות קטנה של מעכבי. לפני הפילמור, הסר את מעכבי על ידי מעבר של מונומר מזרק חד פעמיות גדוש אלומינה בסיסי.
- להוסיף 0.4 מ"ג (0.0024 mmol) של AIBN recrystallized, 4.3 מ ג (0.018 mmol) של BDB, 1012 מ ג (4.25 mmol) נטול מעכבי PFPA ו- 0.7 מ של anisole נטול מים בקבוקון schlenk ב 20 מ.
- להתחבר את הבקבוקון schlenk ב קו, דגה את התערובת לפחות שלושה מחזורים ההקפאה-משאבות-הפשרה. בקצרה, הקפאת תערובת התגובה באמבט חנקן נוזלי. החל ואקום להסיר את הגז בתוך קראוון. לאטום את הבקבוקון ולאחר מכן הסר מן חנקן נוזלי כדי לאפשר את התוכן להפשיר-RT.
- מקם את הבקבוקון באמבט שמן 70 מעלות צלזיוס, להגיב במשך 4 שעות תחת מחק לצמיתות2 N.
- לסיום התגובה, להסיר את הבקבוק. את האמבטיה שמן ולחשוף את תוכן התגובה לאוויר.
- לזרז הפולימר תוך קר מתנול, ואז לייבש הפולימר התאושש בתנור ואקום ב 40 מעלות צלזיוס למשך הלילה.
- כדי למדוד את המשקל המולקולרי של פולימר, השתמש ג'ל הסתננות כרומטוגרפיה (GPC). השתמש THF שלב ניידים 35 ° C עם 1 מ"ל לדקה קצב ושפע לבנות את עקומת כיול באמצעות סטנדרטים פוליסטירן monodisperse. לרכוש GPC מדידה, להמיס הפולימר THF (1-2 mg/mL), מסנן דרך מסנן טפלון חד פעמיות (PTFE) μm 0.2. מזריקים μL 100 המדגם לתוך הכלי GPC. להמיר את זמן השמירה מדגם נמדד משקל מולקולרי באמצעות עקומת כיול פוליסטירן.
2. הכנת Poly(PFPA) Functionalized SiO2 חרוזים
- טיפול של חרוזים2 SiO עם APTES
- חלקיקי2 SiO זמינים בצורה של השעיה מימית 5% (w/v). משלבים 0.8 מ של השעיה2 SiO עם 40 מ ג של APTES ו- 8 מ של מתנול בבקבוקון נצנוץ 20 מ ל מצויד בר מערבבים.
- לאפשר את התגובה להמשיך ב RT עבור 5 שעות עם בחישה נמרצת.
- להעביר את הפתרון צינור חרוטי. כדי לבודד את APTES functionalized SiO2 חרוזים, centrifuge את הפתרון ב g x 10,000 למשך 5 דקות ולאחר מכן להסיר את תגובת שיקוע. לשטוף את החרוזים על ידי פיזור אותם מחדש ב- 3 מ"ל של מתנול טריים. לנער את הצינורית ביד ערבוב, אבל אם יש צורך, לשפר את הפיזור מאת sonication באמבט מים במשך כמה שניות. Centrifuge החרוזים-g 10,000 x עבור 5 דק. הסר את תגובת שיקוע, חזור על השלב לשטוף עוד פעם אחת.
- לשלב את מתנול שטף חרוזים2 SiO עם 3 מ"ל של דימתיל סולפוקסיד (דימתיל סולפוקסיד). לנער את התערובת ביד, או אם יש צורך sonicate לכמה שניות, עד החרוזים מופצים באופן מלא בדימתיל סולפוקסיד. Centrifuge את החרוזים ב g x 10,000 למשך 5 דקות ולאחר מכן להסיר את תגובת שיקוע. חזור על השלב כדי להבטיח exchange הממס מלאה של מתנול דימתיל סולפוקסיד.
הערה: התליה האחרון מכיל את APTES functionalized חרוזים2 SiO התפזרו 4 מיליליטר דימתיל סולפוקסיד. - כדי לבדוק את התפלגות גודל החלקיקים, לבצע ניתוח DLS. קחו טיפה אחת של ההשעיה מוכן שלב 2.1.4 ובמקום לתוך cuvette חד פעמיות UV. לדלל את הדגימה על ידי ממלא את cuvette דימתיל סולפוקסיד טריים עד 2/3 מלא. הכנס את הדגימה בעל תא להתחיל קירור והקפאה. למדידה גודל החלקיקים, השתמש בפרמטרים ההתקנה הבאים: טמפרטורה: 25 ° C; Equilibration זמן: 120 s; משך זמן המדידה: אוטומטי.
- כדי לבדוק את ההרכב משטח, לבצע ניתוח XPS. יבש מדגם קטן של המתלה מוכן בשלב 2.1.4 בתנור ואקום ב 40 מעלות צלזיוס למשך הלילה. לוקחים את הפולימר יבשים ארוז בצורה שווה על גבי בעל מדגם 0.5 ס מ x 0.5 ס מ. לטעון את הדגימה אל החדר ואקום גבוה (10-8 טנדר של גוה של) ולהתחיל קירור והקפאה. עבור כלי XPS מסוימת בשימוש, ליצור את photoelectrons באמצעות רנטגן Kα אל מונוכרומטי פעלו בגיל 15 kV 6.7 mA ו לאסוף באמצעות הגדלה מצב היברידית במנתח-eV 50 עוברים אנרגיה ספקטרה ברזולוציה גבוהה, eV 100 להעביר אנרגיה עבור סקרים היסודות.
- הרכבה poly(PFPA) כדי APTES functionalized SiO2 חרוזים
- הכינו את הפתרון poly(PFPA) על ידי המסת 20 מ ג של poly(PFPA) ב 2 מ של דימתיל סולפוקסיד בבקבוקון נצנוץ 20 מ.
הערה: מחקר זה poly(PFPA) משקל מולקולרי נמוך יחסית (20 ק ג/mol) משמש. לכן, למרות הריכוז גבוה פולימר (10 mg/mL), אין עדות פולימר crosslinking הוא ציין. אם פולימר משקל מולקולרי גבוה, ואז פולימר פתרון ריכוז אולי צריכים להיות מותאמים כדי להימנע crosslinking אפשרי. - להוסיף 1 מ"ל של APTES functionalized חרוזים2 SiO הושעו ב דימתיל סולפוקסיד (מתוך שלב 2.1.4) לפתרון של poly(PFPA). להגיב ב RT לשעה עם בחישה נמרצת.
- לבודד את החרוזים2 SiO poly(PFPA) הושתל על ידי צנטריפוגה ב g x 10,000 למשך 5 דקות, ואחריו הסרת תגובת שיקוע. לשטוף את החרוזים על-ידי הוספת 3 מ"ל של דימתיל סולפוקסיד ואת תערובת ע י ניעור או עם היד או כמה שניות של sonication. Centrifuge את החרוזים ב g x 10,000 למשך 5 דקות ולאחר מכן להסיר את תגובת שיקוע. חזור על הכביסה של חרוזים2 SiO poly(PFPA) הושתל עם דימתיל סולפוקסיד פעמיים.
- לשטוף את החרוזים פעמיים יותר עם מים מזוקקים טריפל (TDW). בשלב זה, לשלב את החרוזים עם 3 מ של TDW, ולאחר מכן מערבבים ע י ניעור עם היד או כמה שניות של sonication. Centrifuge את החרוזים ב g x 10,000 למשך 5 דקות ולאחר מכן להסיר את תגובת שיקוע.
- כדי לבדוק את התפלגות גודל החלקיקים, לבצע DLS בעקבות ההליך שמתואר בשלב 2.1.5. כדי לבדוק את הכימיה. משטח, לבצע XPS בעקבות ההליך שמתואר בשלב 2.1.6.
- הכינו את הפתרון poly(PFPA) על ידי המסת 20 מ ג של poly(PFPA) ב 2 מ של דימתיל סולפוקסיד בבקבוקון נצנוץ 20 מ.
3. הכנת SiO2 חרוזים הושתל עם Poly(PFPA) שהוחלפו פג
- כדי להכין את הפתרון poly(PFPA), לפזר 20 מ ג של poly(PFPA) ב 2 מ של דימתיל סולפוקסיד בבקבוקון נצנוץ 20 מ.
- כדי להכין פתרון פג, התמוססות אמין-functionalized פג ב 1 מ"ל של דימתיל סולפוקסיד. הכמות המדויקת של פג להשתמש נקבעת על-פי מידת הרצוי של החלפת ה-PFP, נקבעים על-ידי המשוואה המוצג להלן:
כמות אמינו-יתד (g/g-poly(PFPA)) = (N_poly(PFPA) x % פג-Sub) x (MW_PEG / MW_poly(PFPA))
איפה N_poly(PFPA) = poly(PFPA) מידת פלמור
% פג-Sub = אחוז החלפת פג
MW_PEG = משקל מולקולרי של אמינו-יתד
MW_ poly(PFPA) = משקל מולקולרי של poly(PFPA) - להעביר את הפתרון פג הפתרון poly(PFPA). להגיב ב RT לשעה עם בחישה נמרצת.
- להכין APTES functionalized חרוזים2 SiO הושעו ב דימתיל סולפוקסיד, זהה השלבים המוצגים ב 2.1 צעד. העברת 1 מ"ל של ההשעיה חרוז בתוך תמיסת poly(PFPA) שהוחלפו פג המבושלות שלב 3.3. לאפשר משתילים בין poly(PFPA) לבין APTES functionalized חרוזים2 SiO להמשיך ב RT לשעה עם בחישה נמרצת.
- לבודד את החרוזים על ידי צנטריפוגה ב g x 10,000 למשך 5 דקות, ואחריו הסרת תגובת שיקוע. לשטוף את החרוזים על-ידי הוספת 3 מ"ל של דימתיל סולפוקסיד ואת תערובת ע י ניעור או עם היד או כמה שניות של sonication. Centrifuge את החרוזים ב g x 10,000 למשך 5 דקות ולאחר מכן להסיר את תגובת שיקוע. חזור על כביסה דימתיל סולפוקסיד פעמיים.
- לשטוף את החרוזים פעמיים יותר עם TDW. בשלב זה, לשלב את החרוזים עם 3 מ ל TDW, ואז לערבב ע י ניעור עם היד או כמה שניות של sonication. Centrifuge את החרוזים ב g x 10,000 למשך 5 דקות ולאחר מכן להסיר את תגובת שיקוע.
- יבש את החרוזים ב 40 מעלות צלזיוס בתנור ואקום למשך הלילה.
4. נוגדן הנייח על Poly(PFPA) הושתל SiO2 חרוזים
הערה: ההליך משמש בין אחוז החלפת פג ב- poly(PFPA). להכין תמיסת מלח פוספט buffered (PBS) על ידי המסת PBS טבלית TDW. להכין תמיסת מלח פוספט buffered 0.1% (v/v) עם Tween-20 (PBST) על-ידי הוספת 1/1000 Tween-20 PBS.
- הוסף 5 מ ג של poly(PFPA) הושתל חרוזים2 SiO לרכבת התחתית microcentrifuge 1.5 mL.
- לשטוף את החרוזים על-ידי הוספת µL 800 של PBS, לערבב היטב על ידי vortexing. Centrifuge החרוזים ב 10,000 x g ב- RT עבור דק 1. הסר את תגובת שיקוע, חזור על השלב שטיפת שלוש פעמים.
- להוסיף 350 µL של PBS טריים, 50 µL 0.1% (v/v) PBST µg 6.67 של הנוגדן. דגירה ~ 20 h ב- מסובב ב 4 º C.
- לשטוף את החרוזים להסיר נוגדנים לא מאוגד. Centrifuge את החרוזים ב 400 x g ו 4 ° C עבור מינימלית 1 להסיר את תגובת שיקוע והוסף µL 400 פירוק מאגר בקפידה. בעדינות מחדש להשעות את החרוזים על-ידי pipetting למעלה ולמטה במשך חמש פעמים.
הערה: פירוק מאגר נהגו לרחוץ את החרוזים צריכה להיות זהה אחד בשימוש במהלך פירוק תאים ו- IP, פרט לכך התוספת של מעכבי פרוטאז ו- dithiothreitol הם אופציונליים, (ראה שלב 5). - חזור על שלב זה שטיפת שלוש פעמים. לאחר השטיפה הסופית להסיר את תגובת שיקוע ככל האפשר.
5. התא פירוק Immunoprecipitation
- הכנת מאגר פירוק ומאגר לשטוף
- הכנת המאגר פירוק (50 מ"מ טריס-HCl (pH 8.0), 100 מ מ אשלגן כלורי, 0.5% (v/v) NP-40, 10% (v/v) גליצרול, 1 מ dithiothreitol (DTT), פרוטאז מעכב קוקטייל).
- הכנת המאגר לשטוף (50 מ מ טריס-HCl (pH 8.0), 100 מ מ אשלגן כלורי, 0.1% (v/v) NP-40, ו- 10% (v/v) גליצרול).
- לאחסן את מאגר הפתרונות ב 4 º C.
- הכנה של תאים
- זרע התאים (הלה תאים) יום או יומיים לפני הניסוי IP, לגדל את התאים-CO 37 ° C ו-5%2.
- לאסוף כ 1.4 x 107 תאים עם תא במגרדת, העברת לתוך צינור חרוטי 15 מ"ל. צנטריפוגה התאים ב g x 380-RT במשך 3 דקות להסיר את תגובת שיקוע, להשהות מחדש עם 1 מ"ל של PBS קר והעברת לתוך צינור microcentrifuge 1.5 mL.
- Centrifuge התאים ב g x 10,000 ב 4 ° C עבור הסרה ס' 30 תגובת שיקוע מהוללים. ניתן לאחסן תא כדורי ב-80 מעלות צלזיוס לאחר הסרת את תגובת שיקוע.
- הכנת תא lysates
- מחדש להשעות בגדר תא עם 400 µL של המאגר פירוק. Sonicate התאים באמצעות של ultrasonicator.
- Sonication, מערבולת בקצרה, צנטריפוגה lysate ב g 20,000 x ב 4 מעלות צלזיוס למשך 10 דקות.
- להעביר את תגובת שיקוע שפופרת צנטרפוגה 1.5 mL החדש.
- Immunoprecipitation
- העברת 300 µL תא lysate של נוגדנים מוכנים בעבר מודגרות poly(PFPA) הושתל SiO2 חרוזים. שומרים על 30 µL של התא lysate בתור מדגם קלט צינור microcentrifuge. חנות המדגם קלט ב 4 º C.
הערה: הסכום הכולל של החלבון בתא lysate צריך להיות כ- 4 מ ג. - דגירה התערובת lysate/חרוזים עבור h 3 ב מסובב ב 4 º C.
- Centrifuge התערובת ב 400 g x ב 4 ° C עבור דק 1. הסר את תגובת שיקוע והוסף µL 400 שטיפת מאגר בקפידה. בעדינות מחדש להשעות את החרוזים על-ידי pipetting למעלה ולמטה 5 פעמים.
- חזור על שלב זה שטיפת שלוש פעמים. לאחר השטיפה הסופית להסיר את תגובת שיקוע ככל האפשר.
- להכין 2 x נתרן גופרתי dodecyl (מרחביות) טוען צבען (25% (v/v) גליצרול, 0.1% (w/v) ברומו פנול כחול (BPB), 60 מ מ טריס-HCl (pH 6.8), 2% (w/v) מרחביות, מ מ 2.75 מרקפטואתנול). חנות 2 x מרחביות לצבוע טעינה ב-20 ° C. להוסיף 30 µL של 2 x מרחביות הטעינה לצבוע את החרוזים של המדגם קלט מאוחסן, וחימום 10 דקות ב 95 ° C.
- לאחר חימום, לנתח את הדגימה באמצעות ווסטרן סופג27, או לאחסן את הדגימה ב-20 ° C.
- העברת 300 µL תא lysate של נוגדנים מוכנים בעבר מודגרות poly(PFPA) הושתל SiO2 חרוזים. שומרים על 30 µL של התא lysate בתור מדגם קלט צינור microcentrifuge. חנות המדגם קלט ב 4 º C.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
מפרטים טכניים עבור הכנת poly(PFPA) הושתל SiO2 חרוזים, עם או בלי פג החלפת מוצג באיור1. כדי לנטר את APTES ואת poly(PFPA) הרכבה תהליך, חרוזים2 SiO חשופות, APTES functionalized SiO2 חרוזים, poly(PFPA) הושתל SiO2 חרוזים מאופיינים DLS (איור 2) והן XPS (איור 3). יעילות ה-IP של החרוזים נקבעים לפי סופג המערבי. איור 4 מראה המערב סופג תוצאות עבור IP באמצעות 1% פג-שהוחלפו poly(PFPA) הושתל חרוזים, איפה החרוזים מודגרת עם אין נוגדנים, שאינם ספציפיים נוגדן או נוגדן anti-PKR. איור 5 מראה את התוצאות blotting המערבי לשימוש IP 0% שהוחלפו פג poly(PFPA) הושתל חרוזים, חרוזים 1% שהוחלפו פג poly(PFPA) הושתל, שניהם מודגרות עם נוגדנים anti-PKR.

איור 1: מפרטים טכניים עבור הכנת poly(PFPA) הושתל חרוזים2 SiO באמצעות APTES כמו מולקולה מקשר. () Poly(PFPA) הושתל חרוזים. (b) חלקית פג-שהוחלפו poly(PFPA) הושתל חרוזים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 2: DLS מידות עבור (א) חשופים SiO2 חרוזים (2SiO), (b) APTES functionalized SiO2 חרוזים (APTES-SiO2) ו- (ג) poly(PFPA) הושתל SiO2 חרוזים (פוליפוני (PFPA)-SiO2), התפזרו ב דימתיל סולפוקסיד. קוטר Z-הממוצע (d) ואת האינדקס polydispersity (PDI) של כל מדגם מדווחים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 3: XPS spectra עבור SiO חשופים2 חרוזים (2SiO), APTES functionalized SiO2 חרוזים (APTES-SiO2), poly(PFPA) הושתל SiO2 חרוזים (פוליפוני (PFPA)-SiO2). הפסגות שנבדקו תואמות () Si 2, p, (b) O 1, (ג) N 1, ו- (ד) F 1s. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 4: ווסטרן סופג תוצאות עבור IP באמצעות 1% פג-שהוחלפו poly(PFPA) הושתל חרוזים, שטופלו אין נוגדנים (ליין 2), תערובת שאינם ספציפיים נוגדן, ארנב רגיל IgG (ליין 3), או אנטי-PKR נוגדנים (ליין 4). ליין 1 מציג את תערובת חלבונים קלט לפני ה-IP. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 5: ווסטרן סופג תוצאות עבור IP באמצעות 0% שהוחלפו פג poly(PFPA) הושתל חרוזים (ליין 2) ו 1% שהוחלפו פג poly(PFPA) הושתל חרוזים (ליין 3), שניהם מטופלים עם נוגדנים anti-PKR. ליין 1 מציג את תערובת חלבונים קלט לפני ה-IP. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
הסינתזה של poly(PFPA) הושתל SiO2 חרוזים מודגם באיור1. על ידי שימוש APTES כ מולקולה מקשר, ניתן להכין מברשות poly(PFPA) covalently הושתל. המצע2 SiO באמצעות תהליך בן שני שלבים פשוטים. למרות כמה יחידות ה-PFP מוקרבים על התגובה עם APTES, מספר גדול של יחידות ה-PFP צפויים להישאר זמינים עבור התגובה מאוחר יותר עם אמינו-יתד או נוגדנים. הקבוצות PFP ידועים כדי ליצור אנרגיה נמוכה משטחים אז מברשות poly(PFPA) לא solvate גם מים28. עבור יישום ה-IP, הנוגדנים צריך להיות מרותק למיטה על מברשות poly(PFPA), כזאתי החליפין מתבצעת בופר מימית כדי לשמר את הפעילות של הנוגדנים. כפי שדווח בפרסום הקודם שלנו, החלפה חלקית של יחידות ה-PFP עם מולקולות הידרופיליות כגון functionalized-אמין פג יכול לשפר את השטח hydrophilicity, שמוביל מוגברת נוגדנים בטקטיקות יעילות18. במחקר זה, באופן חלקי פג שהוחלפו poly(PFPA) גם מוכן, ואז הורכבה על פני2 SiO באמצעות המולקולה מקשר אותו APTES. בסך הכל, השיטות מאויר באיור 1 מאפשרים ההכנה של משטחי poly(PFPA) הושתל עם דרגות שונות של החלפת פג. מברשות אלה פולימר עם מאפייני משטח tunable מספקים לפלטפורמה אידיאלית נוגדן הנייח ויישום IP עוקבות.
תהליך הכנת חרוזים נמצא בפיקוח DLS והן XPS. התוצאות DLS עבור חרוזים2 SiO functionalized שונים של דימתיל סולפוקסיד מסוכמות באיור2. החרוזים2 SiO חשופות התערוכה hydrodynamic בקוטר של 666 nm, מסכים עם היצרן דיווח גודל חרוז (0.676 μm; SD = 0.03 נקודות μm). לאחר טיפול APTES, קוטר חרוז עולה ל 740 ננומטר; עם טיפול poly(PFPA), הקוטר חרוז נוסף עולה ל 1889 ננומטר. חשוב לציין כי מדד polydispersity (PDI) עבור poly(PFPA) הושתל החרוזים הוא די גדול (PDI = 0.76), וזה מעיד על איכות ירודה מדגם המכיל אגרגטים גדולים. למרות העיקול DLS מראה רק פסגה אחת בגודל ננו, כמות קטנה של אגרגטים עשוי להימצא ההשעיה. החרוזים2 SiO functionalized נבחנים גם על ידי XPS כדי לקבוע הרכב פני השטח (איור 3). לאחר הטיפול APTES, שיא N 1s המשויך הקבוצות אמין על APTES מזוהה. ומתגלה, טיפול poly(PFPA) הבאים, שיא F 1s המשויך היחידות PFP הפולימר. יחד נתונים אלה מראים את functionalization מוצלחת של המשטח2 SiO, תחילה עם APTES, עם poly(PFPA).
כדי להציג החרוזים poly(PFPA) הושתל, יכול לשמש עבור העשרה חלבונית דרך IP, אנחנו להשתמש 1% poly(PFPA) שהוחלפו פג הושתל חרוזים, ולא מתפשט אותם עם אין נוגדנים, תערובת נוגדנים IgG שאינם ספציפיים ארנב או נוגדן anti-PKR. תא lysate המכיל את המטרה PKR נעקר מן התא, העשרה PKR בוצעה לאחר מכן דרך IP באמצעות סוג 3 חרוזים. כדי לקבוע יעילות ה-IP, הדגימות חלבון eluted נותחו נגד שני נוגדנים שונים באמצעות סופג המערבי. נוגדן אנטי-PKR שימש כדי להמחיש את הכמות של PKR התאושש. נוגדן anti-GAPDH (גליצראלדהיד-3-פוספט דהידרוגנאז) שימש פקד שליליים כמו GAPDH חלבון בשפע זה אינו פועל עם PKR. כפי שמוצג באיור 4, חרוזים ללא נוגדנים או שאינם ספציפיים נוגדן תערובת תוצאה לא שחזור PKR. מרותק למיטה. לעומת זאת, החרוזים מודגרות עם נוגדן anti-PKR יכול להעשיר בהצלחה PKR, כמצוין על-ידי הנוכחות של להקה PKR חזקה ואת העדר GAPDH הלהקה. תוצאות אלו מציע מברשות poly(PFPA) שהוחלפו פג יכול אכן להיות functionalized עם נוגדנים המשמש העשרה סלקטיבי של חלבון המטרה. הערה כאשר חלבון היעילות התאוששות של מערכות חרוז שונים מושווים, הניסויים IP, כמו גם המערב עוקבות סופג ניתוחים צריך להיעשות בו זמנית. עקב הווריאציות הטבועה בביצוע ניסויים אלה, נתונים שהושגו על ניסויים נפרדים לא ישירות יש להשוות.
כפי שדווח בעבר, hydrophilicity משטח של מברשות poly(PFPA) ממלא תפקיד מפתח יעילות IP18. איור 5 מראה המערב סופג נתונים עבור IP התאושש דגימות חלבון באמצעות 0% poly(PFPA) שהוחלפו פג הושתל חרוזים, חרוזים poly(PFPA) שהוחלפו פג הושתל 1%. בשני המקרים, החרוזים היה מרותק למיטה עם נוגדנים anti-PKR. בזמן השימוש של 0% שהוחלפו פג poly(PFPA) גורמת ליעילות נמוכה של התאוששות PKR, poly(PFPA) שהוחלפו-PEG 1% מראה שיפור משמעותי, שמציין את העשרת סלקטיבי של המטרה PKR על GAPDH הלא-יעד. מסכים עם שלנו הקודם הפרסום18, הטיפול פג מוגברת של hydrophilicity משטח המברשת poly(PFPA), ומאפשר יותר יחידות ה-PFP יהיה נגיש עבור קיבעון נוגדן, מוביל לשיפור נצפתה יעילות ה-IP. שימו לב, ההחלפה פג אחוז דיווחו במחקר זה לא יכול להיות ישירות בהשוואה לזה דיווחו במחקר הקודם שלנו, אשר בשימוש סי-רפסודה מסונתז poly(PFPA) מברשות. שני המקרים מעסיקים שיטות הכנה של מברשת פולימר שונה מאוד, אז הסכום של ה-PFP יחידות זמין עם פג שווה טעינת צפוי להיות שונה מאוד. עם זאת, התצפיות במחקרים שני מסכים התשובות שני הצבעה על פני השטח hydrophilicity כפרמטר שליטה המפתח להשגת יעילות גבוהה של ה-IP.
בעוד hydrophilicity משטח משפיע על כמות נוגדנים מצורף מברשות poly(PFPA), לו גם השפעה משמעותית על רקע IP בשל העשרה שאינם ספציפיים. בניסוי IP טיפוסי, צעדים כביסה רבים מבוצעים כדי להסיר חלבונים לא מאוגד. כאשר החרוזים קלים מאוד הידרופוביות, כגון אלה עם 0% החלפת פג, הם נוטים טופס אגרגטים גדולים שקשה להפריד. במקרה זה, חלבונים שאינם ספציפיים יכול להיות לכוד בתוך המבנים הצבירה ולאחר הכביסה לא מספיק להסיר אותם, מביא לעליית ברקע. לכן, בעת ביצוע ה-IP, זה חשוב למטב את המאפיין משטח חרוז, תשומת הלב צריך להיות משולם להבטיח שהחרוזים מופצים באופן סביר.
בסך הכל, להדגים תהליך בן שני שלבים פשוטים כדי להכין poly(PFPA) הושתל SiO2 חרוזים, והראה כי hydrophilicity משטח של החרוזים ניתן לכוונן עם החלפה חלקית של יחידות ה-PFP עם אמינו-יתד. מברשות פולימר אלה שימשו בהצלחה היעד העשרה חלבונית דרך IP, מציג עצמו חלופה מסורתית חלבון A/G מבוסס IP טכניקה. אנו מצפים poly(PFPA) מברשות למצוא יישום בתחומים רבים אחרים הדורשים biomolecule הנייח.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
המחברים אין לחשוף.
Acknowledgments
עבודה זו נתמכה על ידי סוכנות לפיתוח הגנה (מענק מס ' UD170039ID).
Materials
| Name | Company | Catalog Number | Comments |
| 2,2-Azobisisobutyronitrile, 99% | Daejung Chemicals | 1102-4405 | |
| Methyl alcohol for HPLC, 99.9% | Duksan Pure Chemicals | d62 | |
| Phenylmagnesium bromide solution 1.0 M in THF | Sigma-Aldrich | 331376 | |
| Carbon disulfide anhydrous, ≥99% | Sigma-Aldrich | 335266 | |
| Benzyl bromide, 98% | Sigma-Aldrich | B17905 | |
| Petroleum ether, 90% | Samchun Chemicals | P0220 | |
| Ethyl ether, 99% | Daejung Chemicals | 4025-4404 | |
| Magnesium sulfate anhydrous, powder, 99% | Daejung Chemicals | 5514-4405 | |
| Pentafluorophenyl acrylate | Santa Cruz Biotechnology | sc-264001 | contains inhibitor |
| Aluminium oxide, activated, basic, Brockmann I | Sigma-Aldrich | 199443 | |
| Sodium Chloride (NaCl) | Daejung Chemicals | 7548-4400 | |
| Anisole anhydrous, 99.7% | Sigma-Aldrich | 296295 | |
| Silica nanoparticle | Microparticles GmbH | SiO2-R-0.7 | 5% w/v aqueous suspension |
| 3-Aminopropyltrimethoxysilane, >96.0% | Tokyo Chemical Industry | T1255 | |
| Dimethyl sulfoxide for HPLC, ≥99.7% | Sigma-Aldrich | 34869 | |
| Amino-terminated poly(ethylene glycol) methyl ether | Polymer Source | P16082-EGOCH3NH2 | |
| Phosphate buffered saline tablet | Takara | T9181 | |
| Tween-20 | Calbiochem | 9480 | |
| Tris-HCl (pH 8.0) | Invitrogen | AM9855G | |
| KCl | Invitrogen | AM9640G | |
| NP-40 | VWR | E109-50ML | |
| Glycerol | Invitrogen | 15514-011 | |
| Dithiothreitol | Biosesang | D1037 | |
| Protease inhibitor | Merck | 535140-1MLCN | |
| Bromo phenol blue | Sigma-Aldrich | B5525-5G | |
| Tris-HCl (pH 6.8) | Biosolution | BT033 | |
| Sodium dodecyl sulfate | Biosolution | BS003 | |
| 2-Mercaptoethanol | Gibco | 21985-023 | |
| PKR Antibody | Cell Signaling Technology | 12297S | |
| GAPDH Antibody | Santa Cruz Biotechnology | sc-32233 | |
| Normal Rabbit IgG | Cell Signaling Technology | 2729S | |
| HeLa | Korea Cell Line Bank | 10002 | |
| Sonicator | DAIHAN Scientific | WUC-D10H | |
| Ultrasonicator | BMBio | BR2006A | |
| Centrifuge I | Eppendorf | 5424 R | |
| Centrifuge II | LABOGENE | 1736R | |
| Rotator | FINEPCR | ROTATOR/AG | |
| Vacuum oven | DAIHAN Scientific | ThermoStable OV-30 | |
| Gel permeation chromatography (THF) | Agilent Technologies | 1260 Infinity II | |
| X-ray photoelectron spectrometer | Thermo VG Scientific | Sigma Probe | |
| Dynamic light scattering | Malvern Instruments | ZEN 3690 |
References
- Johnsson, B., Löfås, S., Lindquist, G. Immobilization of proteins to a carboxymethyldextran-modified gold surface for biospecific interaction analysis in surface plasmon resonance sensors. Analytical Biochemistry. 198 (2), 268-277 (1991).
- Kurzawa, C., Hengstenberg, A., Schuhmann, W. Immobilization method for the preparation of biosensors based on pH shift-induced deposition of biomolecule-containing polymer films. Analytical Chemistry. 74 (2), 355-361 (2002).
- You, C. C., et al. Detection and identification of proteins using nanoparticle-fluorescent polymer 'chemical nose' sensors. Nature Nanotechnology. 2 (5), 318-323 (2007).
- Roberts, M. W., Ongkudon, C. M., Forde, G. M., Danquah, M. K. Versatility of polymethacrylate monoliths for chromatographic purification of biomolecules. Journal of Separation Science. 32 (15-16), 2485-2494 (2009).
- Sandison, M. E., Cumming, S. A., Kolch, W., Pitt, A. R. On-chip immunoprecipitation for protein purification. Lab on a Chip. 10 (20), 2805-2813 (2010).
- Das, A., Theato, P. Activated Ester Containing Polymers: Opportunities and Challenges for the Design of Functional Macromolecules. Chemical Reviews. 116 (3), 1434-1495 (2016).
- Choi, J., et al. Functionalization and patterning of reactive polymer brushes based on surface reversible addition and fragmentation chain transfer polymerization. Journal of Polymer Science Part A: Polymer Chemistry. 50 (19), 4010-4018 (2012).
- Kessler, D., Jochum, F. D., Choi, J., Char, K., Theato, P. Reactive surface coatings based on polysilsesquioxanes: universal method toward light-responsive surfaces. ACS Applied Materials & Interfaces. 3 (2), 124-128 (2011).
- Son, H., et al. Penetration and exchange kinetics of primary alkyl amines applied to reactive poly(pentafluorophenyl acrylate) thin films. Polymer Journal. 48 (4), 487-495 (2016).
- Kessler, D., Roth, P. J., Theato, P. Reactive surface coatings based on polysilsesquioxanes: controlled functionalization for specific protein immobilization. Langmuir. 25 (17), 10068-10076 (2009).
- Kessler, D., Theato, P. Reactive surface coatings based on polysilsesquioxanes: defined adjustment of surface wettability. Langmuir. 25 (24), 14200-14206 (2009).
- Kessler, D., Nilles, K., Theato, P. Modular approach towards multi-functional surfaces with adjustable and dual-responsive wettability using a hybrid polymer toolbox. Journal of Materials Chemistry. 19 (43), 8184-8189 (2009).
- Eberhardt, M., Mruk, R., Zentel, R., Theato, P. Synthesis of pentafluorophenyl(meth)acrylate polymers: new precursor polymers for the synthesis of multifunctional materials. European Polymer Journal. 41 (7), 1569-1575 (2005).
- Jochum, F. D., Forst, F. R., Theato, P. PNIPAM copolymers containing light-responsive chromophores: a method toward molecular logic gates. Macromolecular Rapid Communications. 31 (16), 1456-1461 (2010).
- Schattling, P., Pollmann, I., Theato, P. Synthesis of CO2-responsive polymers by post-polymerization modification. Reactive & Functional Polymers. 75, 16-21 (2014).
- He, L., Szameit, K., Zhao, H., Hahn, U., Theato, P. Postpolymerization modification using less cytotoxic activated ester polymers for the synthesis of biological active polymers. Biomacromolecules. 15 (8), 3197-3205 (2014).
- Arnold, R. M., McNitt, C. D., Popik, V. V., Locklin, J. Direct grafting of poly(pentafluorophenyl acrylate) onto oxides: versatile substrates for reactive microcapillary printing and self-sorting modification. Chemical Communications. 50 (40), 5307-5309 (2014).
- Son, H., Ku, J., Kim, Y., Li, S., Char, K. Amine-Reactive Poly(pentafluorophenyl acrylate) Brush Platforms for Cleaner Protein Purification. Biomacromolecules. 19 (3), 951-961 (2018).
- Cullen, S. E., Schwartz, B. D. An improved method for isolation of H-2 and Ia alloantigens with immunoprecipitation induced by protein A-bearing staphylococci. The Journal of Immunology. 117 (1), 136-142 (1976).
- Sisson, T. H., Castor, C. W. An improved method for immobilizing IgG antibodies on protein A-agarose. Journal of Immunology Methods. 127 (2), 215-220 (1990).
- Peritz, T., et al. Immunoprecipitation of mRNA-protein complexes. Nature Protocols. 1 (2), 577-580 (2006).
- Zhang, Z., Chen, S., Jiang, S. Dual-functional biomimetic materials: nonfouling poly (carboxybetaine) with active functional groups for protein immobilization. Biomacromolecules. 7 (12), 3311-3315 (2006).
- Yao, Y., et al. NHS-ester functionalized poly(PEGMA) brushes on silicon surface for covalent protein immobilization. Colloids and Surfaces B: Biointerfaces. 66 (2), 233-239 (2008).
- Ma, J., et al. Facile fabrication of microsphere-polymer brush hierarchically three-dimensional (3D) substrates for immunoassays. Chemical Communications. 51 (31), 6749-6752 (2015).
- Chong, Y., et al. Thiocarbonylthio compounds [SC (Ph) S− R] in free radical polymerization with reversible addition-fragmentation chain transfer (RAFT Polymerization). Role of the free-radical leaving group (R). Macromolecules. 36 (7), 2256-2272 (2003).
- Jochum, F. D., Theato, P. Temperature- and Light-Responsive Polyacrylamides Prepared by a Double Polymer Analogous Reaction of Activated Ester Polymers. Macromolecules. 42 (16), 5941-5945 (2009).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. The Western Blot. JoVE. , Cambridge, MA. (2018).
- Chua, G. B. H., Roth, P. J., Duong, H. T. T., Davis, T. P., Lowe, A. B. Synthesis and Thermoresponsive Solution Properties of Poly[oligo(ethylene glycol) (meth)acrylamide]s: Biocompatible PEG Analogues. Macromolecules. 45 (3), 1362-1374 (2012).
Tags
כימיה גיליון 141 פוליפוני (pentafluorophenyl אקרילט) 3-aminopropyltriethoxysilane פולימר תגובתי מברשת פוסט-הפילמור functionalization נוגדן הנייח immunoprecipitationErratum
Formal Correction: Erratum: Preparation of Poly(pentafluorophenyl acrylate) Functionalized SiO2 Beads for Protein Purification
Posted by JoVE Editors on 04/30/2019.
Citeable Link.
An erratum was issued for: Preparation of Poly(pentafluorophenyl acrylate) Functionalized SiO2 Beads for Protein Purification. Throughout the article, the term "3-aminopropyltriethoxysilane" has been replaced with "3-aminopropyltrimethoxysilane", and "APTES" with "APTMS".
The Keywords were updated from:
Poly(pentafluorophenyl acrylate), 3-aminopropyltriethoxysilane, reactive polymer brush, post-polymerization functionalization, antibody immobilization, immunoprecipitation
to:
Poly(pentafluorophenyl acrylate), 3-aminopropyltrimethoxysilane, reactive polymer brush, post-polymerization functionalization, antibody immobilization, immunoprecipitation
The Abstract was updated from:
We demonstrate a simple method to prepare poly(pentafluorophenyl acrylate) (poly(PFPA)) grafted silica beads for antibody immobilization and subsequent immunoprecipitation (IP) application. The poly(PFPA) grafted surface is prepared via a simple two-step process. In the first step, 3-aminopropyltriethoxysilane (APTES) is deposited as a linker molecule onto the silica surface. In the second step, poly(PFPA) homopolymer, synthesized via the reversible addition and fragmentation chain transfer (RAFT) polymerization, is grafted to the linker molecule through the exchange reaction between the pentafluorophenyl (PFP) units on the polymer and the amine groups on APTES. The deposition of APTES and poly(PFPA) on the silica particles are confirmed by X-ray photoelectron spectroscopy (XPS), as well as monitored by the particle size change measured via dynamic light scattering (DLS). To improve the surface hydrophilicity of the beads, partial substitution of poly(PFPA) with amine-functionalized poly(ethylene glycol) (amino-PEG) is also performed. The PEG-substituted poly(PFPA) grafted silica beads are then immobilized with antibodies for IP application. For demonstration, an antibody against protein kinase RNA-activated (PKR) is employed, and IP efficiency is determined by Western blotting. The analysis results show that the antibody immobilized beads can indeed be used to enrich PKR while non-specific protein interactions are minimal.
to:
We demonstrate a simple method to prepare poly(pentafluorophenyl acrylate) (poly(PFPA)) grafted silica beads for antibody immobilization and subsequent immunoprecipitation (IP) application. The poly(PFPA) grafted surface is prepared via a simple two-step process. In the first step, 3-aminopropyltrimethoxysilane (APTMS) is deposited as a linker molecule onto the silica surface. In the second step, poly(PFPA) homopolymer, synthesized via the reversible addition and fragmentation chain transfer (RAFT) polymerization, is grafted to the linker molecule through the exchange reaction between the pentafluorophenyl (PFP) units on the polymer and the amine groups on APTMS. The deposition of APTMS and poly(PFPA) on the silica particles are confirmed by X-ray photoelectron spectroscopy (XPS), as well as monitored by the particle size change measured via dynamic light scattering (DLS). To improve the surface hydrophilicity of the beads, partial substitution of poly(PFPA) with amine-functionalized poly(ethylene glycol) (amino-PEG) is also performed. The PEG-substituted poly(PFPA) grafted silica beads are then immobilized with antibodies for IP application. For demonstration, an antibody against protein kinase RNA-activated (PKR) is employed, and IP efficiency is determined by Western blotting. The analysis results show that the antibody immobilized beads can indeed be used to enrich PKR while non-specific protein interactions are minimal.
The fourth paragraph of the Introduction was updated from:
In this contribution, we report an alternative method to prepare poly(PFPA) grafted surface for antibody immobilization and IP application. In a simple two-step process, as illustrated in Figure 1, an APTES linker molecule is first deposited onto the silica surface, then the poly(PFPA) polymer is covalently attached to the linker molecule through the reaction between the PFP units on the polymer and the amine functions on APTES. This preparation method allows for the permanent crosslinking of poly(PFPA) to a substrate surface, but avoids the many complications associated with SI-CTA synthesis and SI-RAFT polymerization of poly(PFPA) brushes. Partial substitution of the PFP units with amino-PEG can still be performed, allowing fine-tuning of the polymer brush surface properties. We show the poly(PFPA) grafted silica beads thus prepared can be immobilized with antibodies and used for protein enrichment via IP. The detailed bead preparation procedure, antibody immobilization, and IP testing are documented in this article, for readers interested in seeking an alternative to conventional Protein A/G based IP.
to:
In this contribution, we report an alternative method to prepare poly(PFPA) grafted surface for antibody immobilization and IP application. In a simple two-step process, as illustrated in Figure 1, an APTMS linker molecule is first deposited onto the silica surface, then the poly(PFPA) polymer is covalently attached to the linker molecule through the reaction between the PFP units on the polymer and the amine functions on APTMS. This preparation method allows for the permanent crosslinking of poly(PFPA) to a substrate surface, but avoids the many complications associated with SI-CTA synthesis and SI-RAFT polymerization of poly(PFPA) brushes. Partial substitution of the PFP units with amino-PEG can still be performed, allowing fine-tuning of the polymer brush surface properties. We show the poly(PFPA) grafted silica beads thus prepared can be immobilized with antibodies and used for protein enrichment via IP. The detailed bead preparation procedure, antibody immobilization, and IP testing are documented in this article, for readers interested in seeking an alternative to conventional Protein A/G based IP.
Step 2.1 of the Protocol was updated from:
Treatment of SiO2 beads with APTES
to:
Treatment of SiO2 beads with APTMS
Step 2.1.1 of the Protocol was updated from:
SiO2 particles are available in the form of a 5% (w/v) aqueous suspension. Combine 0.8 mL of SiO2 suspension with 40 mg of APTES and 8 mL of methanol in a 20 mL scintillation vial equipped with a stir bar.
to:
SiO2 particles are available in the form of a 5% (w/v) aqueous suspension. Combine 0.8 mL of SiO2 suspension with 40 mg of APTMS and 8 mL of methanol in a 20 mL scintillation vial equipped with a stir bar.
Step 2.1.3 of the Protocol was updated from:
Transfer the solution to a conical tube. To isolate the APTES functionalized SiO2 beads, centrifuge the solution at 10,000 x g for 5 min, then remove the supernatant. Wash the beads by re-dispersing them in 3 mL of fresh methanol. Shake the tube by hand for mixing, but if necessary, improve the dispersion by sonication in a water bath for a few seconds. Centrifuge the beads at 10,000 x g for 5 min. Remove the supernatant and repeat the wash step one more time.
to:
Transfer the solution to a conical tube. To isolate the APTMS functionalized SiO2 beads, centrifuge the solution at 10,000 x g for 5 min, then remove the supernatant. Wash the beads by re-dispersing them in 3 mL of fresh methanol. Shake the tube by hand for mixing, but if necessary, improve the dispersion by sonication in a water bath for a few seconds. Centrifuge the beads at 10,000 x g for 5 min. Remove the supernatant and repeat the wash step one more time.
Step 2.1.4 of the Protocol was updated from:
NOTE: The final suspension contains the APTES functionalized SiO2 beads dispersed in 4 mL of DMSO.
to:
Combine the methanol washed SiO2 beads with 3 mL of dimethyl sulfoxide (DMSO). Shake the mixture by hand, or if necessary sonicate for a few seconds, until the beads are fully dispersed in DMSO. Centrifuge the beads at 10,000 x g for 5 min, then remove the supernatant. Repeat the step to ensure complete solvent exchange from methanol to DMSO.
NOTE: The final suspension contains the APTMS functionalized SiO2 beads dispersed in 4 mL of DMSO.
Step 2.2 of the Protocol was updated from:
Grafting poly(PFPA) to APTES functionalized SiO2 beads
to:
Grafting poly(PFPA) to APTMS functionalized SiO2 beads
Step 2.2.2 of the Protocol was updated from:
Add 1 mL of APTES functionalized SiO2 beads suspended in DMSO (from Step 2.1.4) to the poly(PFPA) solution. React at RT for 1 h with vigorous stirring.
to:
Add 1 mL of APTMS functionalized SiO2 beads suspended in DMSO (from Step 2.1.4) to the poly(PFPA) solution. React at RT for 1 h with vigorous stirring.
Step 3.4 of the Protocol was updated from:
To prepare APTES functionalized SiO2 beads suspended in DMSO, follow the same steps shown in Step 2.1. Transfer 1 mL of the bead suspension into the PEG-substituted poly(PFPA) solution prepared in Step 3.3. Allow the grafting between poly(PFPA) and APTES functionalized SiO2 beads to proceed at RT for 1 h with vigorous stirring.
to:
To prepare APTMS functionalized SiO2 beads suspended in DMSO, follow the same steps shown in Step 2.1. Transfer 1 mL of the bead suspension into the PEG-substituted poly(PFPA) solution prepared in Step 3.3. Allow the grafting between poly(PFPA) and APTMS functionalized SiO2 beads to proceed at RT for 1 h with vigorous stirring.
The first paragraph of the Representative Results was updated from:
A schematic for the preparation of poly(PFPA) grafted SiO2 beads, with or without PEG substitution is shown in Figure 1. To monitor the APTES and poly(PFPA) grafting process, bare SiO2 beads, APTES functionalized SiO2 beads, and poly(PFPA) grafted SiO2 beads are characterized by both DLS (Figure 2) and XPS (Figure 3). IP efficiencies of the beads are determined by Western blotting. Figure 4 shows the Western blotting results for IP using 1% PEG-substituted poly(PFPA) grafted beads, where the beads are incubated with no antibody, a non-specific antibody, or anti-PKR antibody. Figure 5 shows the Western blotting results for IP using 0% PEG-substituted poly(PFPA) grafted beads and 1% PEG-substituted poly(PFPA) grafted beads, both incubated with anti-PKR antibodies.
to:
A schematic for the preparation of poly(PFPA) grafted SiO2 beads, with or without PEG substitution is shown in Figure 1. To monitor the APTMS and poly(PFPA) grafting process, bare SiO2 beads, APTMS functionalized SiO2 beads, and poly(PFPA) grafted SiO2 beads are characterized by both DLS (Figure 2) and XPS (Figure 3). IP efficiencies of the beads are determined by Western blotting. Figure 4 shows the Western blotting results for IP using 1% PEG-substituted poly(PFPA) grafted beads, where the beads are incubated with no antibody, a non-specific antibody, or anti-PKR antibody. Figure 5 shows the Western blotting results for IP using 0% PEG-substituted poly(PFPA) grafted beads and 1% PEG-substituted poly(PFPA) grafted beads, both incubated with anti-PKR antibodies.
Figure 1 was updated from:
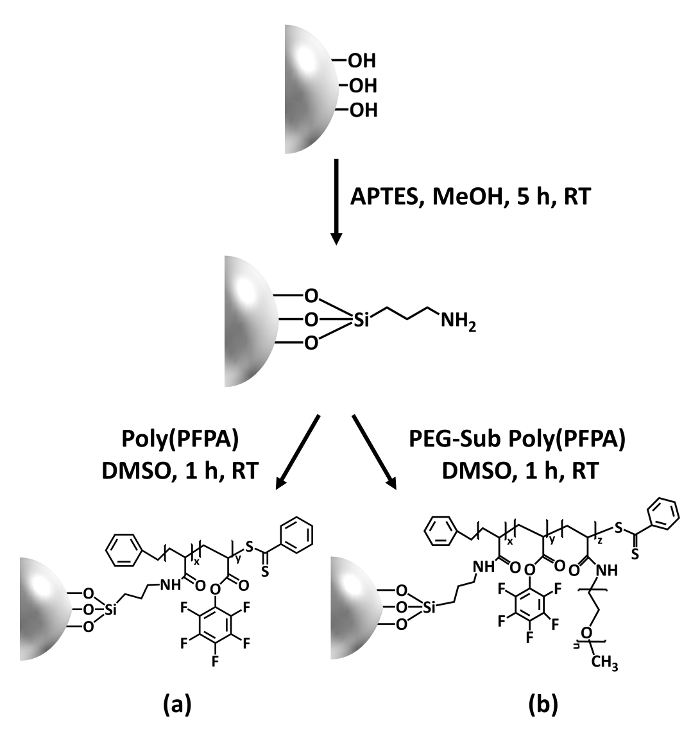
Figure 1: Schematic for the preparation of poly(PFPA) grafted SiO2 beads using APTES as a linker molecule. (a) Poly(PFPA) grafted beads. (b) Partially PEG-substituted poly(PFPA) grafted beads.
to:
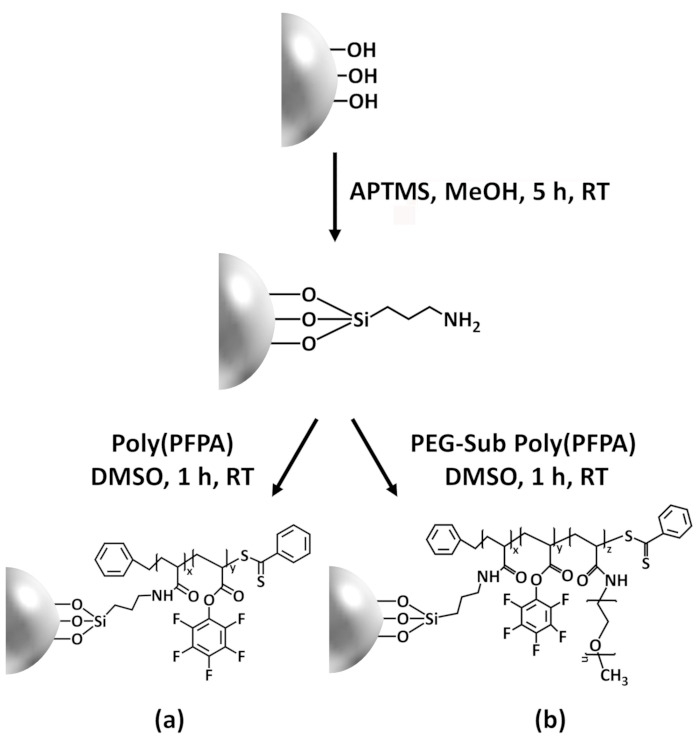
Figure 1: Schematic for the preparation of poly(PFPA) grafted SiO2 beads using APTMS as a linker molecule. (a) Poly(PFPA) grafted beads. (b) Partially PEG-substituted poly(PFPA) grafted beads.
Figure 2 was updated from:
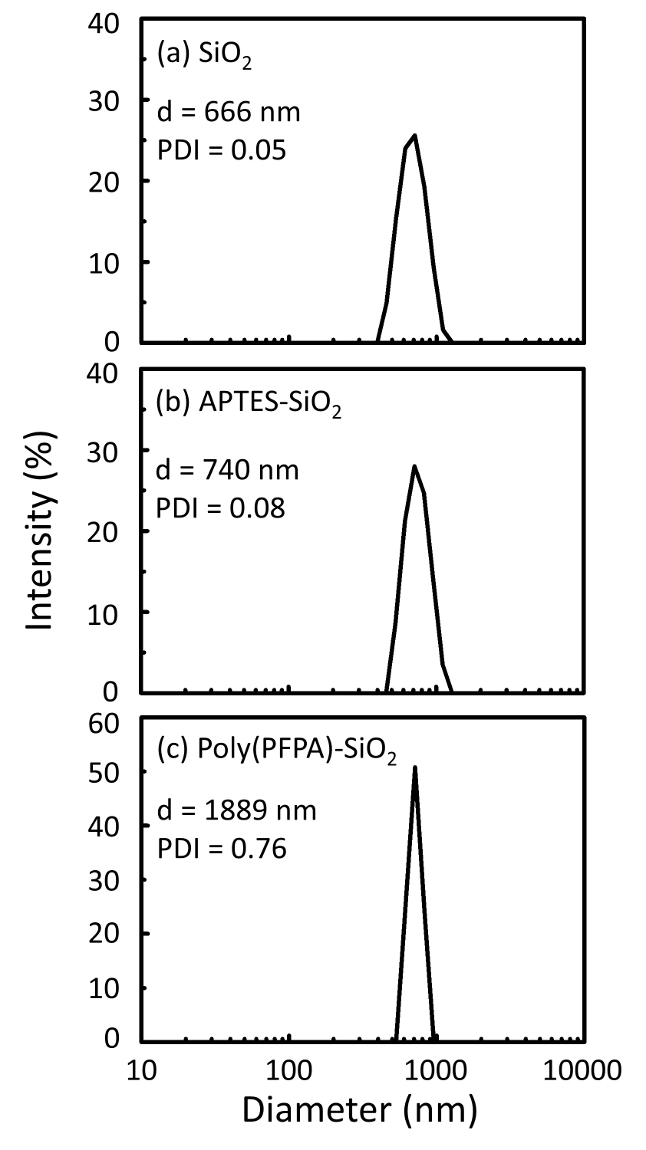
Figure 2: DLS measurements for (a) bare SiO2 beads (SiO2), (b) APTES functionalized SiO2 beads (APTES-SiO2), and (c) poly(PFPA) grafted SiO2 beads (poly(PFPA)-SiO2), dispersed in DMSO. The Z-average diameter (d) and polydispersity index (PDI) of each sample are reported.
to:
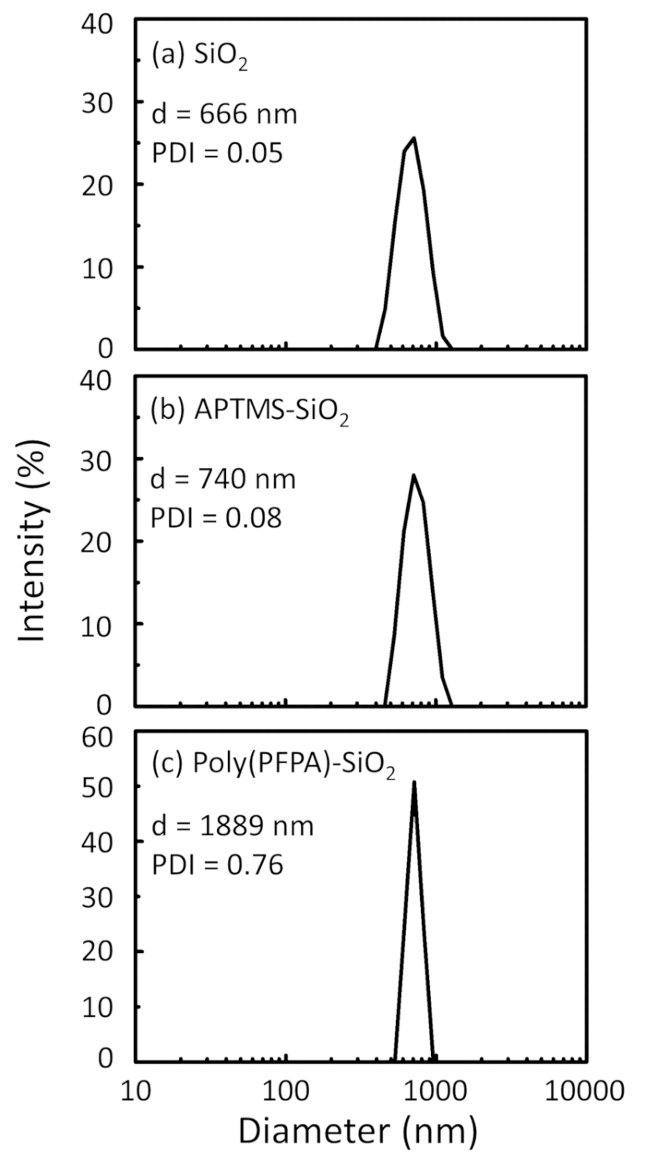
Figure 2: DLS measurements for (a) bare SiO2 beads (SiO2), (b) APTMS functionalized SiO2 beads (APTMS-SiO2), and (c) poly(PFPA) grafted SiO2 beads (poly(PFPA)-SiO2), dispersed in DMSO. The Z-average diameter (d) and polydispersity index (PDI) of each sample are reported.
Figure 3 was updated from:
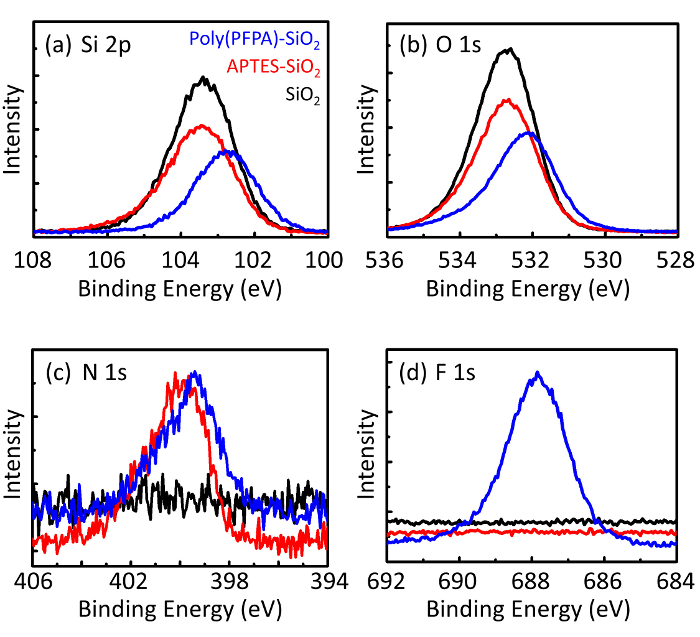
Figure 3: XPS spectra for bare SiO2 beads (SiO2), APTES functionalized SiO2 beads (APTES-SiO2), and poly(PFPA) grafted SiO2 beads (poly(PFPA)-SiO2). The peaks examined correspond to (a) Si 2p, (b) O 1s, (c) N 1s, and (d) F 1s.
to:
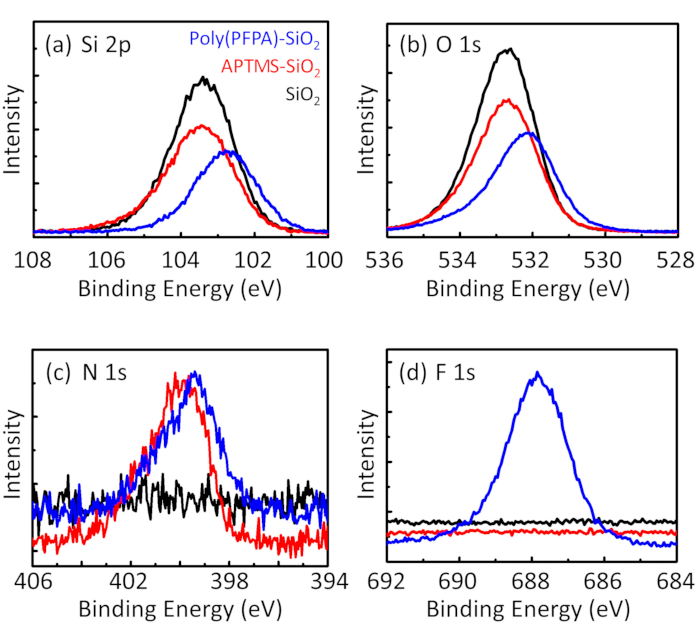
Figure 3: XPS spectra for bare SiO2 beads (SiO2), APTMS functionalized SiO2 beads (APTMS-SiO2), and poly(PFPA) grafted SiO2 beads (poly(PFPA)-SiO2). The peaks examined correspond to (a) Si 2p, (b) O 1s, (c) N 1s, and (d) F 1s.
The first and second paragraphs of the Discussion were updated from:
The synthesis of poly(PFPA) grafted SiO2 beads is illustrated in Figure 1. By employing APTES as a linker molecule, poly(PFPA) brushes covalently grafted to SiO2 substrate can be prepared via a simple two-step process. Although some of the PFP units are sacrificed for the reaction with APTES, a large number of the PFP units are expected to remain available for later reaction with either amino-PEG or antibodies. The PFP groups are known to form low energy surfaces so poly(PFPA) brushes do not solvate well in water28. For IP application, the antibodies need to be immobilized on the poly(PFPA) brushes, and this exchange reaction is done in aqueous buffer solution in order to preserve the activity of the antibodies. As reported in our previous publication, partial substitution of the PFP units with hydrophilic molecules such as amine-functionalized PEG can improve surface hydrophilicity, leading to increased antibody immobilization efficiency18. In this study, partially PEG substituted poly(PFPA) is also prepared, then grafted to the SiO2 surface using the same APTES linker molecule. Overall, the methods illustrated in Figure 1 allow the preparation of poly(PFPA) grafted surfaces with different degrees of PEG substitution. These polymer brushes with tunable surface properties provide an ideal platform for antibody immobilization and subsequent IP application.
The bead preparation process is monitored by both DLS and XPS. The DLS results for various functionalized SiO2 beads in DMSO are summarized in Figure 2. The bare SiO2 beads exhibit hydrodynamic diameter of 666 nm, in agreement with the manufacturer reported bead size (0.676 μm; SD = 0.03 μm). After APTES treatment, the bead diameter increases to 740 nm; and with poly(PFPA) treatment, the bead diameter further increases to 1889 nm. It is important to point out that the polydispersity index (PDI) for the poly(PFPA) grafted beads is rather large (PDI = 0.76), which is indicative of poor quality sample containing large aggregates. Although the DLS curve only shows one nano-sized peak, small amount of aggregates may be present in the suspension. The functionalized SiO2 beads are also examined by XPS to determine surface composition (Figure 3). Following APTES treatment, N 1s peak associated with the amine groups on APTES is detected. And, following poly(PFPA) treatment, F 1s peak associated with the PFP units on the polymer is detected. Together these data show the successful functionalization of the SiO2 surface, first with APTES, then with poly(PFPA).
to:
The synthesis of poly(PFPA) grafted SiO2 beads is illustrated in Figure 1. By employing APTMS as a linker molecule, poly(PFPA) brushes covalently grafted to SiO2 substrate can be prepared via a simple two-step process. Although some of the PFP units are sacrificed for the reaction with APTMS, a large number of the PFP units are expected to remain available for later reaction with either amino-PEG or antibodies. The PFP groups are known to form low energy surfaces so poly(PFPA) brushes do not solvate well in water28. For IP application, the antibodies need to be immobilized on the poly(PFPA) brushes, and this exchange reaction is done in aqueous buffer solution in order to preserve the activity of the antibodies. As reported in our previous publication, partial substitution of the PFP units with hydrophilic molecules such as amine-functionalized PEG can improve surface hydrophilicity, leading to increased antibody immobilization efficiency18. In this study, partially PEG substituted poly(PFPA) is also prepared, then grafted to the SiO2 surface using the same APTMS linker molecule. Overall, the methods illustrated in Figure 1 allow the preparation of poly(PFPA) grafted surfaces with different degrees of PEG substitution. These polymer brushes with tunable surface properties provide an ideal platform for antibody immobilization and subsequent IP application.
The bead preparation process is monitored by both DLS and XPS. The DLS results for various functionalized SiO2 beads in DMSO are summarized in Figure 2. The bare SiO2 beads exhibit hydrodynamic diameter of 666 nm, in agreement with the manufacturer reported bead size (0.676 μm; SD = 0.03 μm). After APTMS treatment, the bead diameter increases to 740 nm; and with poly(PFPA) treatment, the bead diameter further increases to 1889 nm. It is important to point out that the polydispersity index (PDI) for the poly(PFPA) grafted beads is rather large (PDI = 0.76), which is indicative of poor quality sample containing large aggregates. Although the DLS curve only shows one nano-sized peak, small amount of aggregates may be present in the suspension. The functionalized SiO2 beads are also examined by XPS to determine surface composition (Figure 3). Following APTMS treatment, N 1s peak associated with the amine groups on APTMS is detected. And, following poly(PFPA) treatment, F 1s peak associated with the PFP units on the polymer is detected. Together these data show the successful functionalization of the SiO2 surface, first with APTMS, then with poly(PFPA).



