مضاعفات مخفضة بعد إعادة الاتصال الشرياني في نموذج الجرذ من زرع الكبد العظام
Summary
الهدف من هذه الدراسة هو تعديل نموذج زرع الكبد العظام الفئران لتمثيل أفضل زرع الكبد البشري وتحسين البقاء على قيد الحياة المتلقي. تعيد الطريقة المعروضة إعادة تأسيس تدفق الشرايين الكبدية عن طريق ربط الشريان الكبدي المشترك للكبد المتبرع بالشريان الكبدي السليم في الكبد.
Abstract
نموذج زراعة الكبد التقويمي للفئران (OLT) هو أداة قوية لدراسة الرفض الحاد والمزمن. ومع ذلك، فإنه ليس تمثيلا كاملا من زرع الكبد البشري بسبب عدم وجود إعادة الاتصال الشرياني. وتوصف هنا هي عملية زرع معدلة تشمل دمج إعادة ربط الشريان الكبدي (HA) مما يؤدي إلى تحسن ملحوظ في نتائج الزرع. مع متوسط الوقت anhepatic من 12 دقيقة و 14 ثانية، وHA إعادة الاتصال يؤدي إلى ضخ محسنة للكبد المزروع وزيادة في البقاء على قيد الحياة على المدى الطويل المتلقي من 37.5٪ إلى 88.2٪. ويشمل هذا البروتوكول استخدام الأصفاد المطبوعة ثلاثية الأبعاد وأصحابها لربط الوريد المدخلي و الوريد السفلي الوريدي السفلي. ويمكن تنفيذها لدراسة جوانب متعددة من زرع الكبد، من الاستجابة المناعية والعدوى إلى الجوانب التقنية للعملية. من خلال دمج طريقة بسيطة وعملية لإعادة الاتصال الشرياني باستخدام تقنية الأوعية الدموية الدقيقة ، وهذا البروتوكول OLT الفئران المعدلة يحاكي عن كثب جوانب من زرع الكبد البشري ، وسوف تكون بمثابة نموذج البحوث القيمة ذات الصلة سريريا.
Introduction
ولا يزال العبء العالمي لأمراض الكبد في ازدياد، مع ارتفاع بنسبة 30 في المائة في الوفيات المرتبطة بأمراض الكبد من عام 2005 إلى عام 20131،2. غالبًا ما تكون زراعة الكبد هي الملاذ الوحيد للمرضى الذين يعانون من أمراض الكبد في المرحلة النهائية. الكبد هو ثاني أكثر الأعضاء الصلبة المزروعة في كثير من الأحيان، وعدد عمليات زرع الكبد التي أجريت على الصعيد العالمي بنسبة 7.25٪ من 2015 إلى 20161,2. على الرغم من انتشاره، أصبحت معدلات البقاء على قيد الحياة بعد زرع ركود3،4،5. 15 سنة معدل البقاء على قيد الحياة المريض هو 53٪، ومعدل البقاء على قيد الحياة 20 عاما قد يكون منخفضا كما 21٪3،5. في حين أن هناك مبادرات البيولوجيا المناعية الجديدة المثيرة التي قد تؤدي إلى علاجات جديدة وتحسين النتائج السريرية، لا يوجد حتى الآن نموذج حيواني صغير موثوق به لاختبارها.
وقد استخدمت على نطاق واسع نموذج الجرذان OLT في التحقيق في زراعة الكبد، بما في ذلك الرفض6،,7،,8،,9،,10، التسامح المناعي11، زرع 12- إصابة12، مناعة13، وإصابة شجرة الصفراوية14،15،16،17. ومع ذلك ، فإن عيب النموذج في شكله الحالي هو ارتفاع معدل الاعتلال والوفيات بعد الجراحة18،19. هذا هو العيب الخطير الذي يتعارض مع عملية الإنسان، وأنه يعرض للخطر القدرة على استخلاص استنتاجات ذات الصلة سريريا من نموذج20.
بالإضافة إلى ذلك، يمكن أن تعزى نسبة كبيرة من هذه المراضة إلى عدم وجود أو نقص في إعادة الاتصال الشريان الكبدي (HA)18. على الرغم من أن خطوة حاسمة في زرع الكبد البشري, الصعوبات التقنية تميل إلى تعريض إعادة الاتصال HA في نموذج OLT الفئران. ونتيجة لذلك، القناة الصفراوية (BD) anastomosis ضعيفة ويؤدي إلى معدلات عالية من تسرب الصفراء و BD نخر21. وراء ارتفاع نسبة المضاعفات الصفراوية22, غياب تدفق الشرايين يغير فسيولوجيا الكبد الكسب غير المشروع بعد زرع23, مع نقص الأكسجة في الكسب غير المشروع الكبد المانح24 وتلف الكبد لوحظ في الفصوص الملتهبة19,25,26. الفئران OLT دون إعادة الاتصال الشرياني يميل أيضا إلى تعزيز التليف27. الجرذان OLT البروتوكول الموصوفة أدناه يعالج هذه القضايا من خلال دمج خطوة إعادة الإعمار ها بسيطة مع الفئران التي نشرت سابقا OLT طريقة28, مما أدى إلى الحفاظ على parenchyma الكبد وتحسين معدلات البقاء على قيد الحياة.
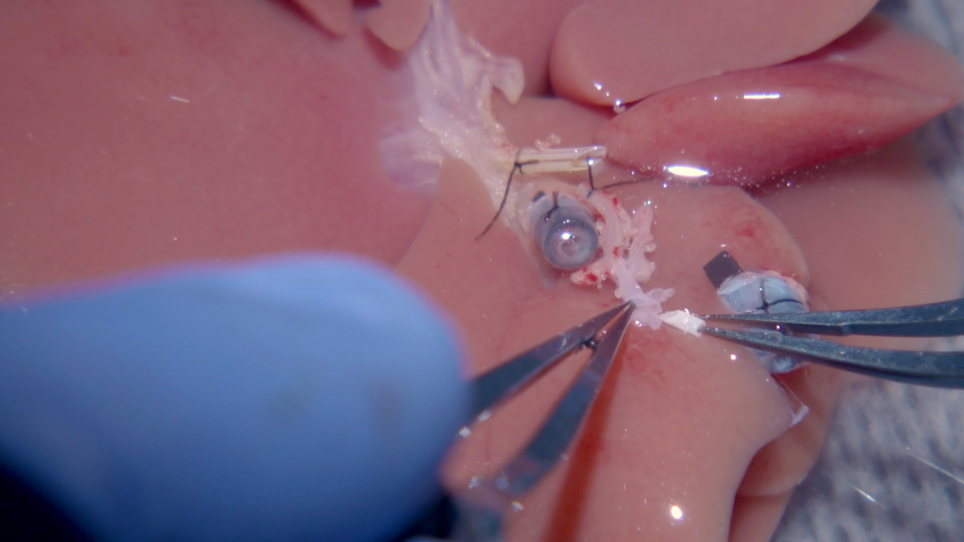
زرع الكبد له ثلاث مراحل: (1) استخراج الكسب غير المشروع للكبد من المتبرع، (2) إعداد الكسب غير المشروع الكبد المانح، و (3) استبدال الكبد المتلقي مع الكسب غير المشروع الكبد. يتضمن الإجراء التلاعب بخمسة هياكل تشريحية: الوريد السفلي فوق الوهني (SHVC) ، الوريد البوّالي (PV) ، الوريد السفلي الوريدي السفلي (IHVC) ، الشريان الكبدي (HA) ، والقناة الصفراوية (BD).
OLT في الفئران تم عرضه لأول مرة من قبل لي وآخرون باستخدام اغراس microsuture من SHVC، الكهروضوئية و IHVC، وتقنية سحب من خلال لBD29. تم تحسين هذا النموذج في وقت لاحق من خلال استخدام تقنية اثنين الكفة في 197930. ومنذ ذلك الحين، تم اقتراح العديد من التقنيات البديلة، مع التركيز على معظمها على مرض الاستئصال الوريدي واستخدام تقنية ثنائية الكفة مع بعض التعديلات31. على الرغم من أن ها anastomosis قد وصفت سابقا في نموذج OLT الفئران باستخدام تقنيات مثل microsuture، الكفة، والأكمام داخل الأرصاد26،31،32،33،34، وغالبا ما تتطلب هذه التقنيات مهارات الجرخ المدربة تدريبا عاليا ، وتغيير كبير في فسيولوجيا الفئران ، ويعوقها تجلط و / أو مضاعفات الصفراوية27،35.
وعلاوة على ذلك، فإن اختيار الإجراء الجراحي يمكن أن يؤثر أيضا على الوقت الكبدي (الوقت من لقط PV إلى إعادة ضخ الكسب غير المشروع من خلال الكهروضوئية المعاد تشكيلها)، وهو أمر بالغ الأهمية لنجاح زرع كبد الفئران. على وجه التحديد، ويلاحظ معدلات البقاء على قيد الحياة مع أوقات anhepatic من 15-20 دقيقة36، و 30 دقيقة هو الحد الأعلى للنجاح37،38. ولذلك، فإن الهدف من هذه الطريقة هو تنفيذ أقل الغازية وأكثر سهولة اعتماد فئران جراحية OLT النموذج الذي هو قادر على إعادة الاتصال الشريان الكبدي، وتعزيز ضخ كفاءة الكبد المزروعة، والحفاظ على تدفق إلى القناة الصفراوية المتلقي، والحفاظ على حالة المريض الفسيولوجية.
مفصلة هنا هي جميع الخطوات من هذا البروتوكول المنقحة، بما في ذلك التلاعب في جذع الاضطرابات الهضمية للكبد المانحة، فضلا عن استخدام 1) 1.5 مم الدعامة لأداء اتصال الأكمام خارج البلوم مع المتلقي HA السليم، 2) خياطة تشغيل لإعادة الإعمار SHVC، 3) اثنين من الأصفاد البلاستيكية المطبوعة 3D ل PV وإعادة الإعمار IHVC39،,40،4) إعادة توصيل الأكمام microvascular لH HA18،,27،,41 و 5) وهو سبق وصفها تقنية الدعامات BD28. كما تم تضمين خطوتين إضافيتين: تدفق بارد عبر PV، ونظام مضاد حيوي يستند إلى النتائج السابقة17. هذا البروتوكول OLT الأمثل يقلل من المضاعفات والأمراض في فترة ما حول العملية، ونماذج أكثر عن كثب إجراء العمليات الجراحية المستخدمة في زرع الكبد البشري.
Protocol
Representative Results
Discussion
نماذج زراعة الكبد الحيوانية الصغيرة مهمة لفهم مناعة الزراعة وتحديد الاستراتيجيات العلاجية الجديدة32. نموذج زراعة الكبد الحيوانية الصغيرة المثالية يكرر جميع خطوات الإجراء البشري، بما في ذلك التهاب الأوعية الشريانية. يمكن أن يكون تحديا لتفسير النتائج من نموذج OLT الفئران، كما أن معظم الإصدارات لا تتضمن خطوة هات الانتمائي، مما يؤدي إلى ارتفاع معدلات المضاعفات والمراضة42. وقد استخدمت بعض إجراءات إعادة الإعمار الشريان الكلوي، الأمر الذي يتطلب إزالة الكلى27. هذا البروتوكول يتجنب إزالة الأعضاء ، لأنها تتجاوز ما يحدث في الإجراء البشري.
يمكن أيضا أن تتم إعادة بناء الشرايين عن طريق التلاعب في الشريان الأورطي الفئران31. ومع ذلك، تتطلب هذه الطرق تشريح وقط واسعة النطاق من الشريان الأورطي. إذا طال وقت المشبك ، فسيكون لدى الجرذ المتلقي نتائج سيئة تتعلق بـ ischemia43. في البشر، تقنية جراحية LT ينطوي على ربط وتقسيم الشريان المعدية المعوية المتلقي (GDA). ومع ذلك، فإن السمات الفسيولوجية والتشريحية للقوارض تجعل الزرع باستخدام هذه التقنية أكثر صعوبة من الناحية الفسيولوجية وقد يؤدي إلى مضاعفات (أي نخر البنكرياس والقناة الصفراوية35 وتسرب الصفراء44). ويهدف إعادة الاتصال الشرياني في هذا البروتوكول إلى التحايل على هذا التحدي، والحفاظ على تدفق الدم في القناة، وتحسين نتائج المتلقي.
وقد وصفت استخدام الأكمام وتقنية الدعامات لإعادة بناء ها الفئران سابقا27. في هذه التقنية، يتم استخدام الدعامة كدليل، ويتم إعادة بناء الشريان من جذع الاضطرابات الهضمية المانحة إلى ها المشترك المتلقي. ثم يتم تشريح ها المشترك المتلقي بها، ويتم ربط المتلقي GDA قبالة27. ونتيجة لذلك، قد يتعرض مصدر الدم إلى الجزء السفلي من BD المتلقي ورئيس البنكرياس للخطر. ويعتقد أن التداول الجانبية إلى هذه المنطقة غالبا ما يوفر تدفق الدم غير كافية إلى القناة الصفراوية. على سبيل المثال، هذا البروتوكول اختبار المشابك المتلقي GDA أولاً مع مقطع microvascular، ثم يقسم BD المتلقي. مع GDA فرضت، BD مقسمة لا تنزف. بعد إزالة المشبك GDA, ويلاحظ نزيف سريع من BD. هذا البروتوكول، الذي يحافظ على تدفق جيد إلى القناة الصفراوية المتلقي مقسمة، يحمي فسيولوجيا أنسجة الكبد المتلقي من خلال توفير كافية كبد الدم الضخ ومنع إصابة الكبد نقص الأكسجين ما بعد OLT.
على الجانب المانح، يتم إدراج الدعامة ها في جذع الاضطرابات الهضمية أثناء إعداد الكسب غير المشروع بكل سهولة عن طريق إنشاء التصحيح من جذع الاضطرابات الهضمية، الشريان المعدي الأيسر، والشريان الزلي. يمكن إدراج الدعامة من خلال الفتحة الواسعة ، وهي أقل صعوبة من محاولة إدخال الدعامة في جذع الاضطرابات الهضمية وحدها. وقد تبين أن 24 G هو الحجم المثالي لاستخدامها في الدعامة HA. يجب أن يكون طول الدعامة 1.0-1.5 ملم، لأنه يعمل بمثابة بوابة مفتوحة للسماح للمستلم HA المناسبة ليتم سحبها بسهولة إلى HA المشترك للمانحين. مع الاهتمام الدقيق حيث يتم وضع خياطة الإثين 10-0 ، فإن الدم المتدفق من خلال هذا الاتصال لن يمس الدعامة مباشرة ، وسوف يحميه HA المناسب للمتلقي من الداخل ، مما يقلل من خطر حدوث مضاعفات. الأهم من ذلك، لا يتم فرض HA المانحة من أجل تجنب vasospasm. يتم تقييم نجاح إعادة بناء الشرايين عن طريق ترك المانحة GDA مفتوحة. نتائج استومومي ناجحة في تدفق الدم جيدة من GDA المانحة بمجرد الانتهاء من إعادة الإعمار.
في هذا البروتوكول، مشابهة للآخرين، إعادة الاتصال SHVC هو أبطأ خطوة و أخيراً يفرض مدة المرحلة anhepatic. كما يزيد من مدة الوقت anhepatic، وإصابة نقص تروية خطر والخلل الكبد يزيد45. عنصر آخر حاسم من نماذج الفئران OLT هو أحجام الكسب غير المشروع والدعامات والأصفاد. إذا كان الكسب غير المشروع صغير جدا، قد تطور الكسب غير المشروع أو الوجه، وعرقلة اتصالات الأوعية الدموية. قد يتطلب حجم الدعامات والأصفاد تعديلات وفقا للعمر والجنس والوزن والضغط من الفئران. تم اختيار حجم الأصفاد المستخدمة هنا كما سبق وصفها28، وتم استخدام حجم واحد للصفة التي تسيطر عليها لحجم الفئران. لم تكن هناك أي علامات على الضائقة أو المضاعفات (أي احتقان الكبد، وذمة، استسقاء، أو splenomegaly) خلال فترة المتابعة (حتى الآن: متوسط = 133 يوما بعد العملية، الحد الأدنى = 115 يوما بعد العملية، الحد الأقصى = 161 يوما بعد العملية). وهناك ما يبرر إجراء دراسات أخرى لتحديد الحجم المناسب لـ PV و IHVC لمختلف سلالات الفئران التي تمثل العمر والجنس.
يستخدم هذا البروتوكول OLT الفئران المعدلة الأصفاد المطبوعة 3D ل PV و IHVC، كما هو موضح سابقا39،40. وتشمل الطرق الحالية لربط PV و IHVC تقنية microsuture32، وتقنية الكفة46، وتقنية جبيرة47microsuture مؤقت. تم اختيار تقنية الكفة المطبوعة ثلاثية الأبعاد ، لأنها تسمح بتوحيد حجم الكفة وفقًا لسلالة الفئران وسهلة التحضير والاستخدام. يمكن طباعة كميات كبيرة من الأصفاد ذات الأبعاد نفسها في وقت واحد. السطح الخارجي للكمة اثنين من الأخاصر للمساعدة في تأمين العلاقات ومنع الانزلاق. كما يتم دمج ذيل في تصميم الكفة للسماح للتلاعب أسهل من الكفة. عموما، ويعتقد أن دمج الأصفاد المطبوعة 3D يؤدي إلى معدلات نجاح عالية وإعادة إنتاج الإجراء OLT عن طريق تقصير الوقت anhepatic. ومن المقرر أن هذه التقنية أيضا تقصير منحنى التعلم الجراحية.
في الختام، أنشأ البروتوكول الموصوف نموذجًا أكثر تشابهًا مع زراعة الكبد البشري من خلال دمج خطوة إعادة توصيل الشرايين. ويمكن تكييف هذا البروتوكول لدراسة العديد من الجوانب المناعية والجراحية لزراعة الكبد ويمكن أن يكون بمثابة نموذج لاختبار التدخلات العلاجية الجديدة ذات الصلة بزرع.
Disclosures
The authors have nothing to disclose.
Acknowledgements
تم تمويل هذا البحث من خلال أموال من برنامج زرع الأعضاء المتعددة في UHN ودعم من مؤسسة تورونتو العامة والغربية تورونتو.
Materials
| 10-0 Ethilon | Ethicon | 2830G | 10-0 Ethilon Black 1X5" BV100-4 Taper |
| 10mL Syringe | BD | B302995 | Luer-Lok Tip, Sterile, Disposable |
| 1mL Syringe | BD | B309628 | Luer-Lok Tip, Sterile, Disposable |
| 20mL Syringe | BD | B301031 | Luer-Lok Tip, Sterile, Disposable |
| 3D Printed Cuff for IHVC | Custom | ||
| 3D Printed Cuff for PV | Custom | ||
| 3D Printed Holder for IHVC | Custom | ||
| 3D Printed Holder for PV | Custom | ||
| 3mL Syringe | BD | B309657 | Luer-Lok Tip, Sterile, Disposable |
| 4-0 Sofsilk | Coviden | GS-835 | Wx coded braided silk, 30", Suture 1-Needle 26 mm Length 1/2 Circle Taper Point Needle |
| 5-0 Monocryl | Ethicon | Y433H | Undyed Monofilament 1X27" TF |
| 5mL Syringe | BD | B309646 | Luer-Lok Tip, Sterile, Disposable |
| 7-0 Silk | Teleflex Medical | 103-S | Black |
| 8-0 Prolene | Ethicon | 2775G | 8-0 Prolene Blue 1X24" BV130-5 EVP Double Armed |
| Barraquer Micro Needle Holder Without Catch | Aesculap Surgical Instruments | FD231R | Curved 120 mm, 4 3/4″ |
| Barraquer Needle Holder, Extra Fine Jaws 8.0mm, Curved With Out Lock | Rumex International Co. | 8-025T | Small Size, Titanium |
| Barraquer Needle Holder, Fine Jaws 12.0mm, Curved With Out Lock | Rumex International Co. | 8-021T | Small Size, Titanium |
| BD Insyte Autoguard BC 22 GA x 1.00 IN | BD Angiocath / Autoguard | 382523 | 22 G x 1.00" (0.9 mm x 25 mm) Wingless catheter, 37 mL/min |
| BDPrecisionGlide Single-use Needles: Regular Bevel – Regular Wall. | BD | B305106 | PrecisionGlide stainless-steel needles with translucent, color-coded, polypropylene hubs. 22 G |
| BD Precisionglide Syringe Needle 21G | BD | 305167 | Gauge 21, length 1.5 inch, hypodermic needle |
| BD Precisionglide Syringe Needle 30G | BD | 305128 | Gauge 30, length 1 inch, hypodermic needle |
| Betadine Solution by Purdue Products LP | Purdue Products Lp | 67618-150-17 | 10% povidone–iodine topical solution USP |
| Bupivacaine Injection BP 0.5% | SteriMax Inc. | DIN:02443694 | 0.5% (100mg/20mL) |
| Curved Tying Forceps | Duckworth & Kent | 2-501E | 6mm tying platforms, straight shafts, flat handle, length 88mm |
| DC Temperature Controller | FHC Inc. | 40-90-8D | |
| DK Iris Scissors (Curved) | Duckworth & Kent | 1-211B | Blunt tips, cut length 4mm, tip to pivot length 11mm, round handle, length 107mm |
| Ethanol, 200 proof (100%), USP, Decon Labs | Decon Labs, Inc. | 2716 | Dilute to 70% with d2H2O |
| Fine Adjustable Wire Retractor | Fine Science Tools | 17004-05 | Maximum spread: 3.5cm, Depth 5cm |
| Harvard Apparatus Isoflurane Funnel-Fill Vaporizer | Harvard Appartus Limited | 34-1040SV | |
| Heparin LEO(heparin sodium) | LEO Pharma Inc. | DIN:00453811 | 10,000 i.u./10 mL |
| Ice-Pak | Cryopak | FIP88016 | 4.00 in. x 7.00 in., thickness 1.50 inch |
| Isoflurane United States Pharmacopeia (USP) 99.9% | Piramal Healthcare Limited | DIN: 02231929 | 250 mL, Inhalation Anesthetic, NDC 66794-017-25 |
| Khaw Transconjunctival Adjustable Suture Control Forceps | Duckworth & Kent | 2-502N | 5mm highly polished tying platforms, straight shafts, flat handle, length 84mm |
| Lactate Ringer's Injected USP, 1000mL | Baxter Co. | DIN: 00061085 | JB2324 |
| McPherson Tying Forceps | Duckworth & Kent | 2-500E | 6mm tying platforms, straight shafts, flat handle, length 90mm |
| Metzenbaum Scissors – 14.5 cm | Fine Science Tools | 14024-14 | Straight Sharp/Blunt |
| Micro Kitzmiller Clamp | Scanlan | 3003-630 | Jaw length 23mm, Length 11cm |
| Microscope-Leica M525 F20 | Leica Microsystems | No catalog number | |
| Non-woven Gauze Sponges | Fisherbrand | 22-028-556 | |
| Olsen-Hegar with Suture Cutter | Fine Science Tools | 12002-14 | 15 mm cutting edge, 2mm jaw surface – 14cm |
| OptixCare Eye Lube, 25gm | OptixCare | ES-KE8O-69U1 | Formerly Optixcare Surgical Eye Lubricant |
| Piperacillin sodium salt | Sigma-Aldrich | P8396 | Penicillin analog |
| Puritan 3" Standard Cotton Swab w/Wooden Handle | Puritan Medical Products Company LLC | 803-WC | Regular Cotton Tipped Applicator with Wooden Handle |
| Round Handled Needle Holder Straight w/ Lock | Fine Science Tools | 12075-12 | Round handles allow easy fingertip adjustments – 12.5cm |
| Shea Scissors Curved Blunt | Fine Science Tools | 14105-12 | Transplant scissors with light and delicate pattern – 12cm |
| Stainless Steel Micro Serrefines Curved – 4mm | Fine Science Tools | 18055-06 | Jaw length 4mm, Jaw width 0.75mm, Total length 16mm, Jaw pressure 125g |
| Stainless Steel Micro Serrefines Curved – 6mm | Fine Science Tools | 18055-05 | Jaw length 6mm, Jaw width 1mm, Total length 17mm, Jaw pressure 100g |
| Stainless Steel Micro Serrefines Straight – 6mm | Fine Science Tools | 18055-03 | Jaw length 6mm, Jaw width 1mm, Total length 15mm, Jaw pressure 100g |
| Surgical Platform | Custom, magnetic | ||
| SurgiVet Vaporstick Anesthesia Machine | General Anesthetic Services, Inc | V7015 | |
| T/Pump Localized Therapy | Stryker | TP700 Series | |
| Vacuum-Pressure Pump | Barnant Co. | 400-1901 | |
| Vannas Scissors with Microserrations Straight | Fine Science Tools | 15070-08 | Cutting edge: 5mm, Tip diameter: 0.1mm – 8.5cm |
| Vetergesic Buprenorphine | Ceva Animal Health Ltd | NAC No.:12380352 | 0.324 mg/ml buprenorphine hydochloride Solution for Injection for Dogs and Cats |
| Vetroson V-10 Bipolar Electrosurgical Unit | Summit Hill Laboratories | No catalog number |
References
- Asrani, S. K., Devarbhavi, H., Eaton, J., Kamath, P. S. Burden of liver diseases in the world. Journal of Hepatology. 70 (1), 151-171 (2019).
- Dopazo, C., et al. Analysis of adult 20-year survivors after liver transplantation. Hepatology International. 9 (3), 461-470 (2015).
- Schoening, W. N., et al. Twenty-year longitudinal follow-up after orthotopic liver transplantation: a single-center experience of 313 consecutive cases. American Journal of Transplantation. 13 (9), 2384-2394 (2013).
- Pischke, S., et al. Factors associated with long-term survival after liver transplantation: A retrospective cohort study. World Journal of Hepatology. 9 (8), 427-435 (2017).
- Hamdani, S., et al. Delayed and short course of rapamycin prevents organ rejection after allogeneic liver transplantation in rats. World Journal of Gastroenterology. 23 (38), 6962-6972 (2017).
- Endo, K., et al. Pretransplant replacement of donor liver grafts with recipient Kupffer cells attenuates liver graft rejection in rats. Journal of Gastroenterology and Hepatology. 30 (5), 944-951 (2015).
- Zhao, Z., et al. IL-34 Inhibits Acute Rejection of Rat Liver Transplantation by Inducing Kupffer Cell M2 Polarization. Transplantation. 102 (6), e265-e274 (2018).
- Nagakawa, Y., et al. Over-expression of AIF-1 in liver allografts and peripheral blood correlates with acute rejection after transplantation in rats. American Journal of Transplantation. 4 (12), 1949-1957 (2004).
- Gao, L. H., Zeng, L. X., Chen, H. M., Wan, R. H. Cytomegalovirus infection accelerates the process of chronic rejection in rat liver transplantation. Transplantation Proceedings. 45 (6), 2536-2538 (2013).
- Wu, Y., et al. Effects of combined genes of CTLA4Ig and IDO in post-liver transplantation immune tolerance of rats. Annals of Hepatology. 15 (5), 729-737 (2016).
- He, X. S., et al. Influence of warm ischemia injury on hepatic functional status and survival of liver graft in rats. Hepatobiliary and Pancreatic Diseases International. 2 (4), 504-508 (2003).
- Tamura, A., et al. Combination effect of tacrolimus and FTY720 in liver transplantation in rats. Transplantation Proceedings. 31 (7), 2785-2786 (1999).
- Wang, Z., et al. RhGH attenuates ischemia injury of intrahepatic bile ducts relating to liver transplantation. Journal of Surgical Research. 171 (1), 300-310 (2011).
- Jiang, J. W., et al. Chronic bile duct hyperplasia is a chronic graft dysfunction following liver transplantation. World Journal of Gastroenterology. 18 (10), 1038-1047 (2012).
- Tang, Y., et al. S-Adenosylmethionine attenuates bile duct early warm ischemia reperfusion injury after rat liver transplantation. Molecular Immunology. 95, 83-90 (2018).
- Nosaka, T., Bowers, J. L., Cay, O., Clouse, M. E. Biliary complications after orthotopic liver transplantation in rats. Surgery Today. 29 (9), 963-965 (1999).
- Howden, B., Jablonski, P., Grossman, H., Marshall, V. C. The importance of the hepatic artery in rat liver transplantation. Transplantation. 47 (3), 428-431 (1989).
- Post, S., et al. The impact of arterialization on hepatic microcirculation and leukocyte accumulation after liver transplantation in the rat. Transplantation. 54 (5), 789-794 (1992).
- Hori, T., et al. Impact of hepatic arterial reconstruction on orthotopic liver transplantation in the rat. Journal of Investigative Surgery. 25 (4), 242-252 (2012).
- Zhou, S., et al. New method of stent-facilitated arterial reconstruction for orthotopic mouse liver transplantation. Journal of Surgical Research. 187 (1), 297-301 (2014).
- Noack, K., Bronk, S. F., Kato, A., Gores, G. J. The greater vulnerability of bile duct cells to reoxygenation injury than to anoxia. Implications for the pathogenesis of biliary strictures after liver transplantation. Transplantation. 56 (3), 495-500 (1993).
- Imamura, H., Rocheleau, B., Cote, J., Huet, P. M. Long-term consequence of rat orthotopic liver transplantation with and without hepatic arterial reconstruction: a clinical, pathological, and hemodynamic study. Hepatology. 26 (1), 198-205 (1997).
- Reck, T., et al. Impact of arterialization on hepatic oxygen supply, tissue energy phosphates, and outcome after liver transplantation in the rat. Transplantation. 62 (5), 582-587 (1996).
- Zhao, D., Wheatley, A. M. Orthotopic liver transplantation in the rat: comparison of models with and without rearterialization of the graft. European Surgical Research. 25 (5), 294-302 (1993).
- Chaland, P., et al. Orthotopic liver transplantation with hepatic artery anastomoses. Hemodynamics and response to hemorrhage in conscious rats. Transplantation. 49 (4), 675-678 (1990).
- Liu, X., He, C., Huang, T., Gu, J. Development of a New Technique for Reconstruction of Hepatic Artery during Liver Transplantation in Sprague-Dawley Rat. PLoS One. 10 (12), e0145662 (2015).
- Oldani, G., Lacotte, S., Morel, P., Mentha, G., Toso, C. Orthotopic liver transplantation in rats. Journal of Visualized Experiments. (65), (2012).
- Lee, S., Charters, A. C., Chandler, J. G., Orloff, M. J. A technique for orthotopic liver transplantation in the rat. Transplantation. 16 (6), 664-669 (1973).
- Kamada, N., Calne, R. Y. Orthotopic liver transplantation in the rat. Technique using cuff for portal vein anastomosis and biliary drainage. Transplantation. 28 (1), 47-50 (1979).
- Kashfi, A., et al. A review of various techniques of orthotopic liver transplantation in the rat. Transplantation Proceedings. 37 (1), 185-188 (2005).
- Chong, A. S., Alegre, M. L., Miller, M. L., Fairchild, R. L. Lessons and limits of mouse models. Cold Spring Harbor Perspectives in Medicine. 3 (12), a015495 (2013).
- Hasuike, Y., et al. A simple method for orthotopic liver transplantation with arterial reconstruction in rats. Transplantation. 45 (4), 830-832 (1988).
- Hickman, R., Engelbrecht, G. H., Duminy, F. J. A technique for liver transplantation in the rat. Transplantation. 48 (6), 1080 (1989).
- Steffen, R., Ferguson, D. M., Krom, R. A. A new method for orthotopic rat liver transplantation with arterial cuff anastomosis to the recipient common hepatic artery. Transplantation. 48 (1), 166-168 (1989).
- Shi, Y., et al. Magnetic ring anastomosis of suprahepatic vena cava: novel technique for liver transplantation in rat. Transplant International. 28 (1), 89-94 (2015).
- Dippe, B. E., et al. An improved model for rat liver transplantation including arterial reconstruction and simplified microvascular suture techniques. Journal of Investigative Surgery. 5 (4), 361-373 (1992).
- Kobayashi, E., Kamada, N., Goto, S., Miyata, M. Protocol for the technique of orthotopic liver transplantation in the rat. Microsurgery. 14 (8), 541-546 (1993).
- Oldani, G., et al. Efficient nonarterialized mouse liver transplantation using 3-dimensional-printed instruments. Liver Transplation. 22 (12), 1688-1696 (2016).
- Oldani, G., et al. Manufacturing devices and instruments for easier rat liver transplantation. Journal of Visualized Experiments. (75), e50380 (2013).
- Li, J., et al. Modified sleeve anastomosis for reconstruction of the hepatic artery in rat liver transplantation. Microsurgery. 22 (2), 62-68 (2002).
- Li, G. L., et al. High incidence of biliary complications in rat liver transplantation: can we avoid it?. World Journal of Gastroenterology. 17 (26), 3140-3144 (2011).
- Zammert, M., Gelman, S. The pathophysiology of aortic cross-clamping. Best Practice and Research: Clinical Anaesthesiology. 30 (3), 257-269 (2016).
- Gao, W., Lemasters, J. J., Thurman, R. G. Development of a new method for hepatic rearterialization in rat orthotopic liver transplantation. Reduction of liver injury and improvement of surgical outcome by arterialization. Transplantation. 56 (1), 19-24 (1993).
- Ijtsma, A. J., et al. The clinical relevance of the anhepatic phase during liver transplantation. Liver Transplation. 15 (9), 1050-1055 (2009).
- Miyata, M., Fischer, J. H., Fuhs, M., Isselhard, W., Kasai, Y. A simple method for orthotopic liver transplantation in the rat. Cuff technique for three vascular anastomoses. Transplantation. 30 (5), 335-338 (1980).
- Marni, A., Ferrero, M. E. A four-technique comparative study of orthotopic liver transplantation in the rat. American Journal of Surgery. 156 (3 Pt 1), 209-213 (1988).