Summary
O objetivo deste estudo é modificar o modelo de transplante de fígado ortotópico de ratos para representar melhor o transplante de fígado humano e melhorar a sobrevivência do receptor. O método apresentado restabelece o fluxo arterial hepático conectando a artéria hepática comum do fígado doador à artéria hepática adequada do fígado receptor.
Abstract
O modelo de transplante de fígado ortotópico de rato (OLT) é uma ferramenta poderosa para estudar a rejeição aguda e crônica. No entanto, não é uma representação completa do transplante de fígado humano devido à ausência de reconexão arterial. Descrito aqui é um procedimento de transplante modificado que inclui a incorporação da reconexão da artéria hepática (HA), levando a uma melhora acentuada nos resultados do transplante. Com um tempo anháptico médio de 12 minutos e 14 s, a reconexão ha resulta em melhor perfusão do fígado transplantado e aumento da sobrevida do receptor a longo prazo de 37,5% para 88,2%. Este protocolo inclui o uso de algemas e suportes impressos em 3D para conectar a veia do portal e a veia inferior infrahética cava. Pode ser implementado para o estudo de múltiplos aspectos do transplante hepático, desde resposta imune e infecção até aspectos técnicos do procedimento. Ao incorporar um método simples e prático de reconexão arterial utilizando uma técnica microvascular, este protocolo OLT de rato modificado imita de perto aspectos do transplante de fígado humano e servirá como um modelo de pesquisa valioso e clinicamente relevante.
Introduction
A carga global de doença hepática continua a aumentar, com um aumento de 30% nas mortes relacionadas à doença hepática de 2005 a 20131,2. O transplante de fígado é frequentemente o único recurso para pacientes com doença hepática em estágio terminal. O fígado é o segundo órgão sólido mais transplantado, e o número de transplantes hepáticos realizados globalmente aumentou 7,25% de 2015 para 20161,2. Apesar de sua prevalência, as taxas de sobrevivência pós-transplante ficaram estagnadas3,,4,5. A taxa de sobrevivência do paciente de 15 anos é de 53%, e a taxa de sobrevivência do paciente de 20 anos pode ser tão baixa quanto 21%3,5. Embora existam novas iniciativas de imunobiologia que podem levar a novos tratamentos e melhores resultados clínicos, ainda não há um modelo animal de pequeno porte confiável para testá-los.
O modelo OLT de rato tem sido amplamente utilizado na investigação de transplante de fígado, incluindo rejeição6,7,8,9,10, tolerância imune11, lesão de isquemia-reperfusão transplante12,imunossupressão13, e lesão de árvore biliar14,15,,16,17. No entanto, uma desvantagem do modelo em sua forma atual é sua alta morbidade pós-operatória e mortalidade18,19. Trata-se de uma séria desvantagem que está em desacordo com a operação humana, e compromete a capacidade de tirar conclusões clinicamente relevantes do modelo20.
Além disso, uma grande proporção dessa morbidade pode ser atribuída a uma reconexão hepática ausente ou imperfeita (HA)18. Embora seja um passo crítico no transplante de fígado humano, as dificuldades técnicas tendem a comprometer a reconexão ha no modelo OLT de rato. Como resultado, a anastomose do ducto biliar (DMC) é tênue e resulta em altas taxas de vazamento de biliares e necrose BD21. Além da alta incidência de complicações biliares22, a ausência de entrada arterial altera a fisiologia do fígado do enxerto pós-transplante23, com hipóxia no enxerto hepático doador24 e dano hepático observado em lobos inflamados19,,25,26. Rat OLT sem reconexão arterial também tende a promover a fibrose27. O protocolo OLT de rato descrito abaixo aborda essas questões incorporando uma simples etapa de reconstrução de HA com ummétodoOLT de rato publicado anteriormente, resultando na preservação do parnchyma hepático e melhores taxas de sobrevivência.
O transplante hepático tem três fases: (1) extração do enxerto hepático do doador, (2) preparação do enxerto hepático doador e (3) substituição do fígado receptor pelo enxerto hepático. O procedimento envolve a manipulação de cinco estruturas anatômicas: vena cava suprahepática inferior (SHVC), veia portal (PV), veia vena inferior infrahpática (IHVC), artéria hepática (HA) e ducto biliar (DB).
OLT no rato foi introduzido pela primeira vez por Lee et al. usando anastomose de microsutura do SHVC, PV e IHVC, e uma técnica de pull-through para o BD29. Este modelo foi posteriormente melhorado através do uso da técnica de duas algemas em 197930. Desde então, várias técnicas alternativas foram propostas, com a maioria focando na anastomose venosa e utilizando uma técnica de duas algemas com algumas modificações31. Embora a anastomose HA tenha sido descrita anteriormente no modelo OLT de rato utilizando técnicas como microsutura, manguito e mangas intraluminares26,,31,,32,,33,34, essas técnicas muitas vezes requerem habilidades microcirúrgicas altamente treinadas, alteram significativamente a fisiologia do rato, e são dificultadas por trombose e/ou complicações biliárias27,,35.
Além disso, a escolha do procedimento cirúrgico também pode influenciar o tempo anhático (tempo desde a fixação pv até a reperfusão do enxerto através do PV reconstituído), o que é fundamental para o sucesso do transplante de fígado de rato. Especificamente, altas taxas de sobrevivência são observadas com tempos anhápticos de 15-20 min36, e 30 min é o limite superior para o sucesso37,38. Portanto, o objetivo deste método é implementar um modelo OLT de rato cirúrgico menos invasivo e mais facilmente adotável que seja capaz de reconectar a artéria hepática, promover a perfusão eficiente do fígado transplantado, manter o fluxo para o ducto biliar receptor e preservar a condição fisiológica do receptor.
Detalhado aqui estão todas as etapas deste protocolo revisado, incluindo a manipulação do tronco celíaco do fígado doador, bem como o uso de 1) um stent de 1,5 mm para realizar uma conexão de manga extraluminal com o receptor adequado HA, 2) uma sutura de corrida para a reconstrução do SHVC, 3) duas algemas plásticas impressas em 3D para reconstrução pv e IHVC39,,40, 4) uma reconexão de manga microvascular para o HA18,,27,,41 e 5) uma técnica de stent BD previamente descrita28. Duas etapas adicionais também estão incluídas: uma descarga fria via PV, e um regime antibiótico que se baseia em achados anteriores17. Este protocolo OLT otimizado minimiza complicações perioperatórias e morbidade e modela mais de perto o procedimento cirúrgico utilizado no transplante de fígado humano.
Protocol
O estudo foi realizado de acordo com as diretrizes de manejo e cirurgia de roedores, e o protocolo de estudo foi aprovado pelo Comitê de Atenção Animal da Rede de Saúde Universitária (UHN AUP #: 5840.3) e segue as diretrizes do Conselho Canadense de Cuidados com Animais. O estudo usa ratos masculinos de Lewis (cepa LEW/SsNHsd), de 12 a 14 semanas de idade, pesando entre 250-300 g.
1. Configuração do equipamento
- Segure uma ponta afiada de 31 G com um suporte de agulha e crie um injetor em forma de L sem corte flexionando a ponta repetidamente para frente e para trás até que a ponta se esvaa. Usando um arquivo de metal plano, sem cortes e suavize a extremidade do injetor.
- Corte as brasas de veia portal (PV) e infrahética inferior vena cava (IHVC) da base impressa em 3D com bisturi (Material Suplementar 1, Material Suplementar 2, Figura 1, Figura Suplementar 1).
NOTA: Um software de design 3D é usado para projetar as algemas e os suportes, que são impressos em uma impressora 3D(Tabela de Materiais) utilizando resina autoclavável39,40 (especificações para todo o material impresso em 3D incluído no Material Suplementar 1-10). - Use um novo bisturi para cortar o cateter de 22 G em um tubo inclinado de duas laterais (3,5 mm de comprimento). Utilizando o bisturi, etch suavemente linhas sobre a superfície do stent do ducto biliar (BD) (não corte através da parede do tubo). Essas gravuras evitarão que os laços escorreguem durante o procedimento.
- Use um novo bisturi para cortar o cateter de 24 G em um tubo de borda inclinada unilateral (2,0 mm de comprimento), e crie vários arranhões na superfície do novo stent arterial.
NOTA: Evite o estreitamento ou oclusão do lúmen do stent BD, evitando a aplicação de pressão ao stent. Se o stent for reduzido ou ocluído, a sobrevivência do destinatário será comprometida por obstrução biliar.
- Corte as brasas de veia portal (PV) e infrahética inferior vena cava (IHVC) da base impressa em 3D com bisturi (Material Suplementar 1, Material Suplementar 2, Figura 1, Figura Suplementar 1).
2. Operação de doadores
- Coloque uma almofada de calor a 37 °C e coloque-a sob a plataforma cirúrgica. Ligue o monitor de temperatura para que a temperatura do núcleo do rato possa ser monitorada através de sonda retal. Configure o aparelho de anestesia isoflurane.
NOTA: Durante a cirurgia, monitore a profundidade da anestesia observando a frequência respiratória, frequência cardíaca, coloração das membranas órgãos/mucosas e presença de reflexos de retirada de pedal. - Organize o espaço de trabalho cirurgicamente coberto com todos os instrumentos e materiais necessários (ou seja, tesoura, fórceps, gaze, heparina, retráteis, almofada de seção média, pontas de algodão, 4-0 seda, 7-0 seda, 8-0 sutura estéril não absorvível e 10-0 não absorvível) colocada convenientemente nas laterais da plataforma cirúrgica.
- Organize a estação de trabalho com todas as soluções, incluindo a solução de lactato da Ringer e 300 UI de heparina de sódio (ver Tabela de Materiais).
- Pesar o animal. Anestesiar o rato doador colocando-o na câmara anestésico com 5% de isoflurane, 5 L/min de fluxo de ar e 70% FiO2 para indução. Quando o rato perde a consciência, diminua a anestesia para 3% isoflurane, 0,5 L/min de fluxo de ar e 70% FiO2. Verifique a falta de resposta do pedal beliscando o dedo do pé.
- Prepare a pele do abdômen. Usando uma máquina de barbear elétrica, remova a pele do lado ventral. Observe atentamente a taxa de respiração do doador até atingir uma taxa estável e profunda.
- Coloque o rato cirurgicamente drapeado para que seu lado ventral esteja voltado para o teto. Coloque o nariz em um carniceiro de anestesia com 3% de isoflurane, 0,5 L/min de fluxo de ar e 70% FiO2. Prepare a parede abdominal com povidone-iodo, trabalhando a partir da linha média para fora, seguido de 70% de etanol.
- Faça uma incisão do processo xifoide para a sífise púbica usando uma tesoura cirúrgica de ponta redonda, em seguida, melhore a exposição com uma incisão transversal bilateral. Pare qualquer sangramento da parede abdominal usando uma unidade eletrocirúrgica bipolar para cauteria. Após a incisão, diminua a manutenção isoflurane para 2%, 0,5 L/min de fluxo de ar e 70% FiO2.
NOTA: Ajuste o vaporizador isoflurane para atingir uma taxa de respiração de aproximadamente uma respiração por segundo e lembre-se de avaliar regularmente a profundidade da anestesia ao longo da operação. - Coloque um ponto de seda 4-0 no processo xiphoide e use a sutura para retrair a cefaleia da parede do peito. Tape o fio de seda no topo da estrutura que mantém o carniceiro anestesia no lugar. Mantenha a cavidade corporal do rato doador aberta com retículas impressas em 3D (ver Material Suplementar 3) colocadas em ambos os lados do abdômen (os retráteis são mantidos no lugar com elásticos ligados a ímãs na plataforma cirúrgica).
NOTA: As fórceps de mosquitos também podem ser usadas para compreender o processo xifoide e retrair a cefaleia. Conserte os fórceps do mosquito no lugar usando fita adesiva. - Use uma esponja de gaze não-aventida (4 cm x 4 cm) umedecida pela solução de lactato de Ringer para incluir os intestinos pequenos e grandes. Use uma esponja de gaze pequena, molhada e não-avena (2 cm x 4 cm) para cobrir suavemente o fígado.
- Coloque uma pequena gaze laminada sob a seção média para levantar o abdômen e melhorar a exposição da veia cava inferior suprahepática (SHVC).
- Corte o ligamento falciforme. Separe a veia diafragmática esquerda do SHVC usando micro-fórceps. Ligate a veia diafragmática esquerda com seda 7-0, ficando perto do SHVC.
NOTA: Use a esponja de gaze pequena, úmida e não misturada, umedecida com lactato de Ringer e colocada no fígado, para retirar suavemente o fígado do processo xifoide e expor a veia diafragmática esquerda. - Corte o triangular esquerdo e os ligamentos gastro-hepáticos com uma tesoura de ponta redonda.
- Exponha o lobo caudado puxando cuidadosamente os lóbulos esquerdo e médio para o processo xifoide usando uma esponja de gaze pequena, molhada e não-aventa. Solte o ligamento separando o lobo caudado do resto do fígado com uma tesoura de ponta redonda.
- Divida e separe o ligamento hepato-esofágico usando uma unidade eletrocirúrgica bipolar perto do esôfago.
NOTA: Mude suavemente os intestinos pequenos e grandes para o lado esquerdo da cavidade abdominal e cubra-os com gaze molhada e não-aventurada. - Dissecar o retroperitônio e a gordura cobrindo o IHVC. Exponha e isole o IHVC até a veia renal esquerda.
- Desloque ligeiramente o IHVC com um cotonete para expor e, em seguida, cauterizar quaisquer pequenas veias que se fundem no lado direito do IHVC, usando a unidade eletrocirúrgica bipolar. Também cauterize todas as veias lombares que se fundem ao IHVC.
- Divida a veia suprarenal direita (adrenal) entre duas ligaduras de seda 7-0, ficando perto do IHVC. Liberte o fígado de seus ligamentos posteriores cortando-os sob tração suave.
- Isole a veia renal direita da artéria renal direita e do tecido vizinho usando um cautery de ponta fina. Selar o orifício da veia renal direita com um 8-0 ligadura estéril não absorvível.
- Retire a gordura que cobre o PV para localizar a veia pilênca (veia gástrica direita) e a veia esplênica nos pontos onde eles mesclam o PV. Ligate essas veias com 7-0 de seda, reforçando o lado mais próximo do PV com um 8-0 ponto de sutura não absorvível estéril. Divida as veias entre os laços.
NOTA: Exponha o PV usando gaze pequena e úmida para retirar o duodeno. A inserção da braçadeira é mais fácil se a gordura for retirada do PV, o que também previne a estenose do manguito PV. - Injete 300 UI de sódio de heparina no IHVC, diluído a 1 mL de soro fisiológico normal, utilizando uma seringa de 1 mL (agulha de 31 G).
- Faça uma incisão 5 mm abaixo da bifurcação BD e insira o stent BD no BD comum. Fixar o stent com uma ligadura de seda de 7-0 1 mm acima da incisão. Uma gravata extra pode ser feita abaixo da incisão, que está 10 mm abaixo da bifurcação. Uma vez que o stent esteja seguro, corte o BD entre esses dois laços.
- Nunca corte o BD ou artéria hepática adequada (HA). Coloque um ponto de sutura de monofilamento cirúrgico não absorvível de 10-0 na posição de 3 horas no BD na incisão como marcador para evitar torção após a reconexão.
- Exponha o HA adequado e divida a artéria gastroduodenal (GDA) entre duas ligaduras de seda 7-0. Exponha a artéria gástrica esquerda, a artéria esplênica e o tronco celíaco. Amarre as três artérias, de forma distral e perto de suas decolagens.
- Corte a artéria gástrica esquerda, artéria esplênica e tronco celíaco entre as amarras da artéria. Injete lentamente 20 mL de solução de lactato de Ringer fria (4 °C) no PV, utilizando uma seringa de 20 mL com uma agulha de 21,5 G. Corte a veia cava abaixo do ponto em que a veia renal esquerda se funde com o IHVC para permitir o fluxo de descarga.
NOTA: A agulha deve ser mantida o mais longe possível do hilum. A perfusão fria do fígado do doador deve durar entre 1-2 min. Enquanto lava o fígado, use a outra mão para esguichar o lactato frio de Ringer na superfície do fígado. - Corte o tronco PV abaixo da veia esplênica após a descarga. Corte o IHVC logo acima da veia renal esquerda. Corte o SHVC diretamente adjacente ao diafragma.
- Corte os ligamentos e o tecido conjuntivo entre o fígado e o retroperitônio.
NOTA: Certifique-se de que há comprimentos suficientes das paredes SHVC anterior e posterior para facilitar a anastomose caval superior. É crucial cortar imediatamente adjacente ao diafragma para manter o máximo de comprimento possível. - Depois que o fígado for removido do abdômen, coloque-o rapidamente em um prato cheio com a solução de lactato de Ringer de 4 °C. Coloque o prato em cima de uma almofada de gelo para manter uma temperatura fria.
- Descarte os restos mortais do doador, seguindo as diretrizes institucionais.
3. Preparação do fígado de rato doador ("banco traseiro")
- Encha a placa de Petri fria com um volume suficiente da solução de lactato de Ringer de 4 °C para submergir o fígado de rato doador. Gire cuidadosamente o fígado doador flutuando no prato cuidadosamente para que a superfície inferior fique virada para cima. Coloque as algemas para PV e IHVC (Material Suplementar 1 e Material Suplementar 2, respectivamente) no prato.
- Puxe o PV através da braçadeira PV e dobre a ponta da veia sobre a braçadeira. Amarre o PV firmemente ao redor da braçadeira usando seda 7-0. Lave o PV com 10 mL de solução de lactato de Ringer de 4 °C.
- Repita o passo 3.2 com o IHVC, sem a descarga.
- Remova o tecido adiposo ao redor do tronco celíaco. Formar uma manguito de manga arterial maior cortando a bifurcação do tronco celíaco, artéria esplênica e artéria gástrica esquerda(Figura 2A).
NOTA: É difícil inserir o stent arterial no HA comum. Estique e endireitar a artéria com fórceps várias vezes antes de inserir o stent. Certifique-se de que o bisel do stent fique para cima e que a artéria não esteja torcida(Figura 2B). - Coloque o stent arterial de 1,5 mm de comprimento 24 G no ha comum do doador através do manguito arterial. Segure o stent com um 8-0 ligadura de polipropileno(Figura 2C) e lave o stent com a solução de lactato de Ringer(Figura 2D).
- Posicione um micro-grampo (4-6 mm de comprimento) sobre o IHVC proximal, que visa evitar a perda de sangue após a reperfusão do portal e evitar a embolia do ar.
- Gire o fígado e exponha seu lado superior. Insira dois 8-0 suturas de ponto de fita de polipropileno nas bordas laterais e medial do SHVC.
- Mantenha o fígado a 4 °C para que esteja pronto para o transplante no doador.
4. Operação do destinatário
- Consulte a seção de operação do doador acima e repita as etapas 2.1-2.4.
NOTA: Ratos masculinos de Lewis com idades entre 12 e 14 semanas são usados aqui, pesando 5-20 g mais pesados que os doadores. Durante a cirurgia, monitore a profundidade da anestesia observando a frequência respiratória, frequência cardíaca, coloração dos órgãos/membranas mucosas e presença de reflexos de retirada de pedal. - Coloque o rato cirurgicamente drapeado com seu lado ventral voltado para cima. Coloque o nariz no carniceiro da anestesia para inalação de isoflurane. Umedeça os olhos com lubrificante opthalamic. Prepare a parede abdominal com providone-iodo primeiro, depois com 70% de etanol.
- Injete 5 mL da solução de lactato de Ringer subcutâneamente em ambos os lados inferiores da parede abdominal ventral. Use um assistente cirúrgico para injetar 0,5 mL de 200 mg/kg de sódio piperacillina intramuscularmente na parede abdominal esquerda antes da laparotomia. Além disso, administre 0,5 mL de bupivacaína de 10 mg/mL subcutâneamente na parede abdominal direita.
NOTA: Administre a mesma dose de piperacilina de sódio 1x/dia durante 3 dias pós-operatório. - Prepare a parede abdominal novamente com providona-iodo primeiro e depois com 70% de etanol. Faça uma incisão midline do xiphoide severo a 1 cm acima da sífise púbica. Redução do isoflurano para 2%, fluxo de ar L/min de 0,5 L/min e FiO2 70% para manutenção da anestesia após a realização da incisão.
NOTA: As fórceps de mosquitos podem ser usadas para agarrar o processo xifoide e retrair a cefaleia. Conserte os fórceps do mosquito no lugar usando fita adesiva. A cavidade corporal é mantida aberta por retículas impressas em 3D (ver Material Suplementar 3) em ambos os lados com elásticos magneticamente mantidos na plataforma cirúrgica. - Enrole os intestinos pequenos e grandes com uma esponja de gaze molhada e não-aventeira (4 cm x 4 cm) umedecida com a solução de lactato de Ringer. Use uma esponja de gaze pequena (2 cm x 4 cm), molhada e não-aventírica, umedecida com a solução de lactato de Ringer para cobrir suavemente o fígado.
- Coloque uma pequena almofada de suporte impressa em 3D (suporte traseiro; consulte Material Suplementar 4) sob a seção média do rato para aumentar a exposição do SHVC flexionando o giro. Isso pode ser realizado com segurança em ratos e é executado por um assistente de cirurgião.
- Corte o ligamento falciforme e use a esponja de gaze pequena e úmida não-torcida para retirar suavemente o fígado do processo xifoide e expor a veia diafragmática esquerda. Separe a veia diafragmática esquerda do SHVC usando micro-fórceps. Ligate a veia diafragmática esquerda com 7-0 de seda perto do diafragma.
- Corte o triangular esquerdo e os ligamentos gastro-hepáticos com uma tesoura de ponta redonda.
- Puxe os lóbulos esquerdo e médio delicadamente em direção ao processo xiphoide com uma esponja de gaze pequena e molhada não-avennte para revelar o lobo caudado. Corte o ligamento que separa o lobo caudado do restante do fígado.
- Divida o ligamento hepato-esofágico e coagular qualquer ponto de sangramento com a unidade eletrocirúrgica bipolar, ficando perto do fígado. Corte os ligamentos no aspecto posterior do fígado.
- Retraia os intestinos pequenos e grandes cuidadosamente para o lado esquerdo da cavidade abdominal e cubra-os com gaze molhada e não-avenda.
- Dissecar o retroperitônio e a gordura no IHVC para expor e isolar o IHVC até a veia renal direita. Desloque ligeiramente o IHVC com um cotonete e cauterize quaisquer pequenas veias que se fundam no lado direito do IHVC, usando a unidade eletrocirúrgica bipolar. Da mesma forma, cauterize todas as veias lombares que entram no IHVC.
- Divida a veia suprarenal direita (adrenal) entre duas ligaduras de seda 7-0. Liberte o fígado de seus ligamentos posteriores cortando-os sob tração suave.
- Use gaze pequena e úmida umedecida com a solução de lactato de Ringer para retrair o duodeno e expor o PV. Desprender gordura da bifurcação da veia fotocânica e pilênica.
- Divida o BD 0,5 cm abaixo de sua bifurcação hilar e insira um stent BD no BD comum distal. Fixar o stent na posição com uma ligadura de 7-0 cerca de 0,2 mm abaixo da incisão. Uma gravata extra pode ser colocada acima da incisão, perto da bifurcação. Corte o BD perto do fígado, mas distal até a gravata.
- Separe o BD com fórceps e evite cortar o BD ou ha adequado. Coloque um ponto de monofilamento 10-0 não absorvível (por exemplo, ethilon) na posição das 3 horas no BD como um marcador para evitar torção após a reconexão.
- Exponha o HA adequado e a bifurcação do HA comum e GDA. Exponha a HA esquerda, ha médio e ha direita. Amarre as três artérias distal à bifurcação do ACS e corte as artérias próximas ao fígado, acima das amarras.
- Coloque um longo pedaço fino de gaze atrás do SHVC.
- Coloque um suporte IHVC impresso em 3D ou "alça" (Cava 150g 2.1; consulte Material Suplementar 5) atrás do IHVC e costurem as extremidades da "alça" impressa em 3D juntas usando sutura de monofilamento não absorvível 10-0(Figura 3A).
- Coloque um suporte PV impresso em 3D ou "alça" (Porta 1.4.1-see Material Suplementar 6) atrás do PV, diretamente inferior ao fígado, e costurem as extremidades da "alça" impressa em 3D juntas usando sutura monofilament não absorvível 10-0.
- Amarre uma ligadura de seda 7-0 abaixo dos dois suportes impressos em 3D (IHVC e PV)(Figura 3A).
- Fixar o IHVC logo acima da veia renal direita, que ainda deve estar abaixo do suporte de caval impresso em 3D.
- Fixar o PV logo acima da veia pilênica, que deve estar abaixo do suporte PV impresso em 3D. Registo o tempo anheptico, que começa neste momento. Redução para 0,5% isoflurane, fluxo de ar L/min de 0,5 L/min e 70% FiO2 para manutenção de anestesia.
- Lave 2 mL da solução de lactato de Ringer de 37 °C através da bifurcação do PV usando uma seringa de 3 mL com uma agulha de 27 G presa.
- Fixar o SHVC acima do fígado com um grampo Kitzmiller. Corte abaixo do mesmo grampo, ficando o mais perto possível do fígado.
- Corte acima dos suportes impressos em 3D tanto para o PV quanto para o IHVC(Figura 3A). Remova o fígado do receptor. Oriente cuidadosamente o fígado doador e posicione-o na cavidade corporal do receptor de tal forma que a alta anastomose caval possa ser criada.
- Use um 8-0 sutura de polipropileno para se juntar ao SHVC do doador com o SHVC do receptor perto do diafragma. Primeiro, o lugar fica suturas de 8-0 polipropileno para os aspectos esquerdo e direito do doador e receptor SHVC. Então, amarre isso do lado de fora da parede da veia.
- Use o 8-0 esquerdo polipropileno para costurar a parede posterior do SHVC da esquerda para a direita e amarrar à direita 8-0 Polipropileno. Use o 8-0 esquerdo polipropileno para costurar a parede anterior da anastomose SHVC da esquerda para a direita, deixando os últimos dois terços da linha de sutura soltos. Lave usando 20 mL de lactato de Ringer entre os pontos soltos, certificando-se de extrair quaisquer bolhas de ar.
- Aperte os pontos soltos e faça uma gravata do lado de fora do SHVC. Corte o 8-0 restante sutura de polipropileno.
NOTA: O clipe mantém o SHVC do destinatário no lugar, facilitando a costura do doador e do SHVC do receptor. Regissite a duração da anastomose SHVC. Neste ponto, as alças da porta são anexadas ao aparelho do braço do suporte (braço do suporte McGil + porta-suporte mini braço LAB + braço do suporte parte macia 1.3; ver Material Suplementar 7, Material Suplementar 8e Material Suplementar 9, respectivamente), diretamente inferior ao fígado. Este aparelho é suportado por uma base de titular impressa em 3D (base titular 3.1; ver Material Suplementar 10). - Insira a braçadeira PV (Material Suplementar 1) do doador no PV receptor e aperte a gravata de seda 7-0. Lave o PV do doador e o receptor com a solução de lactato de Ringer aquecida a 37 °C antes da conexão.
- Remova o grampo atrauático do SHVC (primeiro), depois o clipe microvascular para o PV (segundo). Re-perusumar o fígado com sangue quente; neste ponto, o tempo de fase anháptica terminou. Registo desta vez.
- Despeje 10 mL de solução de lactato quente de Ringer em cima do fígado para aquecer. Remova os suportes impressos em 3D com uma tesoura de ponta redonda (corte o ponto de fixação).
- Insira o algema doadora IHVC(Material Suplementar 2) no receptor IHVC e fixe com uma gravata de seda 7-0. Remova primeiro o clipe do doador IHVC, depois o clipe do receptor(Figura 3B). A cava é anexada ao aparelho do suporte e à base do suporte, conforme descrito acima,
- Remova os suportes da impressora 3D (porta e cava) com uma tesoura de ponta redonda (corte o ponto de fixação; Figura 3C), resultando em um IHVC conectado (Figura 3D).
- Examine cuidadosamente a área ao redor do fígado para qualquer sangramento. Instil 3 mL da solução de lactato de Ringer de 37 °C dentro da cavidade corporal.
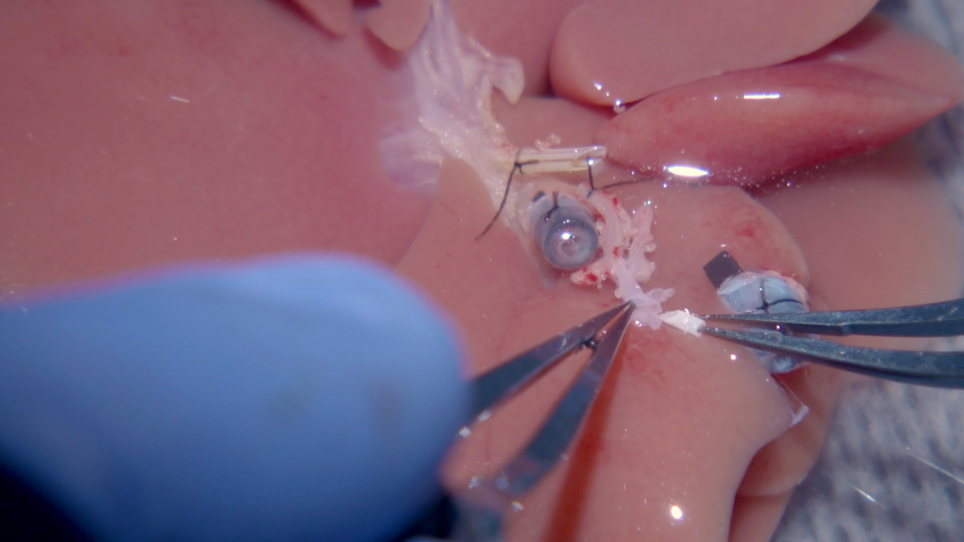
- Anastomose arterial: corte a porção do tronco celíaco do doador que se estende além do stent.
- Aperte o ha adequado do destinatário e corte a gravata no final. Corte qualquer tecido extra ao redor do vaso(Figura 4A). Com a solução de lactato de Ringer, lave os lúmens das extremidades do doador e do vaso receptor.
- Puxe o receptor ha adequado na manga do stent HA doador para realizar a anastomose HA. Coloque um ethilon 10-0 através do aspecto esquerdo do (doador) HA, 2,5 mm acima do orifício distal do stent (de fora para dentro), depois para fora através da extremidade do stent, com 10-0 ethilon (4 cm de comprimento) guiado por uma agulha curva(Figura 4B).
- Transfixe o recipiente adequado HA 0,5 mm abaixo do orifício do vaso, colocando o ponto primeiro (de dentro para fora) para o lado esquerdo do vaso, em seguida (de fora para dentro) para o lado direito da artéria.
- Coloque a sutura através da parede direita do (doador) HA de dentro para fora, a uma distância do orifício idêntico ao ponto original. Puxe para cima nas duas extremidades do monofilamento 10-0 não absorvível, que deslizará o destinatário adequado HA para cima e para o stent HA(Figura 4C).
NOTA: Observe para bombear sangue. Uma opção é cortar o doador GDA para confirmar que o sangue está bombeando através da anastomose. Certifique-se de amarrar a artéria antes de passar para a próxima etapa do procedimento se o GDA for cortado. - Amarre o monofilamento 10-0 não absorvível consigo mesmo, sobre o doador HA(Figura 4D). A anastomose arterial está completa.
- Anastomose biliar: coloque uma gravata vagamente ao redor do receptor BD e stent(Figura 5A),em seguida, remova o stent BD. Lave o BD do receptor e do doador antes que a conexão biliar esteja completa.
- Insira o stent BD do doador no ducto biliar do receptor(Figura 5B)e aperte a gravata que foi colocada anteriormente ao redor do receptor BD(Figura 5C).
- Devolva os intestinos à cavidade corporal. Incutir 2 mL da solução de lactato de Ringer de 37 °C na cavidade para lavá-la. Mergulhe um pouco da solução com gaze.
- Certifique-se de que os intestinos estão de volta em sua posição original antes de costurar o peritônio parietal e a pele com 5-0 monocril.
- Feche a incisão em duas camadas com monocríl 5-0. Injete 0,5 mL de bupivacaína de 0,5% ao redor do peritônio parietal costurado e repita isso uma vez que a pele é costurada.
- Limpe suavemente o rato receptor em uma toalha de papel ao transferir para a gaiola. Permita ao animal acesso livre à água e comida a partir do momento do despertar. Mantenha um cobertor quente circulando água sob metade da gaiola por 24-38 h. Um rato é designado para uma gaiola durante o período pós-operatório imediato.
5. Cuidados pós-operatórios
- Mergulhe pelotas de comida na água e coloque-as em uma placa de Petri no chão da gaiola.
- Monitore a frequência cardíaca, a frequência respiratória e a cor da pele do rato.
- Administre piperacillin nos dias 1, 2 e 3 pós-operatórios. Administre buprenorfina subcutâneamente e monitore quaisquer sinais de dor, como alterações comportamentais, letargia, pele sem espaço, depressão, mutilação ou perda de apetite pelas primeiras 72 h.
NOTA: A dor é avaliada pelo menos 2x por dia durante 3 dias após o transplante, depois pelo menos 1x por dia em diante.
Representative Results
Ao estabelecer um modelo OLT de ratos de anastomose não-HA usando um protocolodescrito anteriormente,nossa equipe observou taxas de sobrevivência de 50% e 37,5% em 21 dias e 60 dias após a operação, respectivamente. Embora as altas taxas de sobrevivência a longo prazo sem anastomose ha tenham sido relatadas por alguns grupos28,esses primeiros resultados destacam as desvantagens de não ter entrada arterial. Em contrapartida, o procedimento otimizado de reconexão ha aumentou significativamente a sobrevida a longo prazo de 37,5% para 88,2% (p = 0,015) (Figura 6).
A análise histológica de um subconjunto representativo de animais transplantados sem reconexão de HA (nos dias 6 e 13 pós-operação) mostrou sinais de lesão hepática hipóxica com necrose centrilobular(Figura 7). A necrose hepática extensiva esteve associada a níveis tremendamente elevados de aminotransferase de alanina (ALT) e aminotransferase aspartate (AST) nesses animais(Figura 7). Em contraste, ratos transplantados com reconexão ha não apresentaram sinais de lesão hepática, e a análise histológica revelou uma estrutura normal de parenchyma hepática com acini organizado, lobules (por exemplo, veia central e tríades portais com veia hepática), artérias e ducto biliar(Figura 7).
Embora o tempo anheptico médio ao longo de 23 operações separadas tenha sido aceitável (12 min e 14 s [± 78 s]), ainda é possível que a sobrevivência no modelo de reconexão não-HA possa eventualmente ser melhorada com o aumento da prática. No entanto, vale ressaltar que três dos quatro animais transplantados sem reconexão ha (que estavam sendo seguidos para sobrevivência a longo prazo) foram eutanizados devido à angústia nos dias 56, 96 e 111 pós-operação. Além disso, a análise histológica dos fígados revelou alterações reativas após lesão hepática hipoxica, incluindo proliferação de ducto biliar marcado, fibrose periportal e inflamação, e parênquim hepático distorcido (Figura Suplementar 2). A presença de características morfológicas de lesão hepática hipóxica corroboram os achados de que a reconexão ha é importante para a perfusão hepática eficiente e função normal.

Figura 1: Representação esquemática do desenho da braçadeira impressa em 3D para veia portal e veia inferior infrahética cava. O primeiro empate é apertado na ranhura (ii) mais próxima da alça (iii), e o segundo empate é apertado na ranhura (i) mais distante da alça. Os diâmetros externos são (iv) 2,38 mm para a veia portal (PV) e 2,15 mm para a veia inferior infrahética cava (IHVC). Os diâmetros interiores são (v) 1,74 mm para o PV e 1,38 mm para o IHVC. Os comprimentos são (vi) 2,60 mm para o PV e 2,15 mm para o IHVC (especificações exatas para todos os materiais impressos em 3D podem ser encontrados em Materiais Suplementares). Clique aqui para ver uma versão maior desta figura.

Figura 2: Inserção do stent da artéria hepática no enxerto. (A) A extremidade de abertura do tronco celíaco (i) é ampliada cortando a artéria esplênica à artéria gástrica esquerda, o que expõe a bifurcação do HA comum. (ii) O stent BD é amarrado antes da extração do fígado de rato doador. (iii) A braçadeira PV e (iv) manguito IHVC são inseridas e amarradas dobrando as extremidades dos vasos sobre a braçadeira. (B) (i) Para inserir o stent HA, o HA comum exposto é esticado várias vezes com fórceps. (C) (i) O stent HA é colocado com segurança no HA comum e empatado com 8-0 Prolene. (D) (i) O stent HA é lavado com (ii) solução de lactato de Ringer (BD = ducto biliar, IHVC = veia cava inferior infrahética, HA = artéria hepática). Clique aqui para ver uma versão maior desta figura.

Figura 3: Conexão vena cava inferior infraháptica usando suporte impresso em 3D. (A) O (i) PV está conectado utilizando a mesma técnica da conexão IHVC. O enxerto é (ii) fixado acima do (iii) manguito IHVC. A abertura do IHVC do destinatário é (iv) suturada nas laterais da abertura para um suporte impresso em 3D para mantê-lo estendido. Uma seda 7-0 solta está amarrada ao redor do receptor IHVC. (B) A braçadeira do enxerto IHVC é (i) inserida dentro do receptor IHVC. A gravata solta está agora apertada. (C) O grampo é removido, e (i) o suporte impresso em 3D é destacado com tesoura. (D) Uma seda adicional (i) 7-0 é amarrada em torno da conexão se não for segura, mas tipicamente uma gravata é suficiente (PV = veia portal, IHVC = veia inferior infrahóptica cava). Clique aqui para ver uma versão maior desta figura.

Figura 4: Conexão de manga microvascular da artéria hepática. (A) (i) O stent BD não está conectado ao destinatário. (ii) O stent HA é colocado no enxerto, que está ligado ao (iv) ha do receptor adequado. (iii) O PV está conectado. (B) 10-0 ethilon com uma (i) agulha curva é desenhada através do stent HA para os lados da extremidade de abertura ha receptor. (C) O ethilon 10-0 é puxado de volta através do stent HA; portanto, o HA adequado do destinatário é puxado através do stent como uma manga. (D) (i) Um empate com 10-0 ethilon é feito uma vez que o HA adequado do destinatário é puxado para dentro do stent para a porção que primeiro corre através do stent HA. (E) Mostrado aqui é um esquema da anastomose HA descrito em (B), (C), e (D) (BD = ducto biliar, HA = artéria hepática, PV = veia portal). *A extremidade de abertura do tronco celíaco é ampliada cortando a artéria esplênica na artéria gástrica esquerda. Clique aqui para ver uma versão maior desta figura.

Figura 5: Conexão do ducto biliar usando dois stents. (A) (i) O stent do enxerto BD é inserido no BD receptor com o auxílio do (ii) stent vagamente amarrado na abertura do BD do receptor. (iii) O PV está ligado antes da conexão BD, que está localizada atrás do BD. (B) O stent no final do BD do destinatário é removido e usado como uma abertura ampliada para (i) inserir o stent BD amarrado ao enxerto. (C) A gravata que está prendendo livremente o stent receptor é agora usada para amarrar a conexão, e (i) outra seda 7-0 é usada para manter firmemente o stent no lugar para evitar escorregar ou torcer do stent. Clique aqui para ver uma versão maior desta figura.

Figura 6: Sobrevivência por cento de transplante. Transplante ortotópico de fígado de rato sem reconexão ha (n = 8) e com reconexão HA (n = 17). Os animais são acompanhados de perto após o transplante para sinais de insuficiência hepática e/ou infecção por pelo menos 60 dias. Ratos que não apresentaram complicações após a cirurgia foram considerados sobreviventes (*p = 0,015, conforme calculado pela estimativa de Kaplan-Meier [teste de classificação longa]). Clique aqui para ver uma versão maior desta figura.

Figura 7: Avaliação histopatológica do fígado. Seções representativas de hematoxilina e eosina em animais (A) sem e (B) com religação da artéria hepática (HA) nos dias 6 e 13 após transplante de fígado (LTx). (C) Parenchyma hepático normal mostrando tríade portal (veia portal, artéria e ducto biliar), lobules incluindo veia central e acini. Hepatócitos ao lado da tríade portal são hepatócitos da zona 1; hepatócitos próximos à veia central dentro dos lobulos são hepatócitos da zona 3; e hepatócitos entre as zonas 1 e 3 são hepatócitos da zona 2 (ALT = alanina aminotransferase, AST = aspartate aminotransferase, CV = veia central). Clique aqui para ver uma versão maior desta figura.

Figura suplementar 1: Dimensões de stent e manguito. Clique aqui para ver uma versão maior desta figura.

Figura suplementar 2: Avaliação histopatológica hepática mostrando interrupção do parênquim hepático. Seções representativas de hematoxilina e eosina em animais sem reconexão ha nos dias 54, 96 e 111 após LTx. Por favor clique aqui para ver uma versão maior desta figura.
Material Suplementar 1: Porta cuff 200g - suporte 2.0. Clique aqui para ver este arquivo (clique com o botão direito do mouse para baixar).
Material Suplementar 2: Manguito cava 200g - suporte 2.0. Clique aqui para ver este arquivo (clique com o botão direito do mouse para baixar).
Material suplementar 3: Retrátil hepático 200g. Clique aqui para ver este arquivo (clique com o botão direito do mouse para baixar).
Material Suplementar 4: Suporte traseiro - 1.2. Clique aqui para ver este arquivo (clique com o botão direito do mouse para baixar).
Material Suplementar 5: Cava 150g - 2.1. Clique aqui para ver este arquivo (clique com o botão direito do mouse para baixar).
Material Suplementar 6: Porta 1.4.1. Clique aqui para ver este arquivo (clique com o botão direito do mouse para baixar).
Material suplementar 7: Braço titular McGil. Clique aqui para ver este arquivo (clique com o botão direito do mouse para baixar).
Material Suplementar 8: Porta mini braço LAB. Clique aqui para ver este arquivo (clique com o botão direito do mouse para baixar).
Material suplementar 9: Holder e braço macio parte 1.3. Clique aqui para ver este arquivo (clique com o botão direito do mouse para baixar).
Material Suplementar 10: Base do titular - 3.1. Clique aqui para ver este arquivo (clique com o botão direito do mouse para baixar).
Discussion
Modelos de transplante de fígado de animais de pequeno porte são importantes para entender a imunidade do transplante e identificar novas estratégias terapêuticas32. O modelo ideal de transplante de fígado animal replica todas as etapas do procedimento humano, incluindo a anastomose arterial. Pode ser desafiador interpretar resultados do modelo OLT de rato, já que a maioria das versões não incorpora um passo de anastomose HA, o que leva a maiores taxas de complicações e morbidade42. Alguns procedimentos de reconstrução têm utilizado a artéria renal, que requer a remoção do rim27. Este protocolo evita a remoção de órgãos, pois está além do que ocorre no procedimento humano.
Reconstruções arteriais também podem ser realizadas manipulando a aorta de rato31. No entanto, esses métodos requerem dissecção extensiva e fixação da aorta. Se o tempo do grampo for prolongado, o rato receptor terá resultados ruins relacionados à isquemia distal43. Em humanos, uma técnica cirúrgica LT envolve a ligadura e divisão da artéria gastroduodenal receptora (GDA). No entanto, as características fisiológicas e anatômicas dos roedores tornam o transplante usando essa técnica mais fisiologicamente desafiador e pode levar a complicações (ou seja, necrose do pâncreas e ductobiliar 35 e vazamento de bilia44). A reconexão arterial neste protocolo visa contornar esse desafio, manter o fluxo sanguíneo do ducto e melhorar o resultado do receptor.
O uso de uma manga e técnica de stent para reconstrução do rato HA foi descrito anteriormente27. Nesta técnica, um stent é usado como guia, e a artéria é reconstruída do tronco celíaco doador para o receptor comum HA. O HA comum do destinatário é então dissecado, e o GDA destinatário é amarrado27. Como resultado, o suprimento de sangue para a parte inferior do BD receptor e cabeça do pâncreas pode ficar comprometido. Acredita-se que a circulação colateral para esta área muitas vezes fornece fluxo sanguíneo inadequado para o ducto biliar. Por exemplo, este protocolo de teste prende o GDA receptor primeiro com um clipe microvascular e divide o BD do receptor. Com o GDA preso, o BD dividido não sangra. Após a remoção do grampo GDA, observa-se sangramento rápido do BD. Este protocolo, que mantém um bom fluxo para o ducto biliar receptor dividido, protege a fisiologia do tecido hepático receptor, fornecendo perfusão sanguínea hepática adequada e prevenindo lesões hepáticas hipoxicas pós-OLT.
Do lado do doador, o stent HA é inserido no tronco celíaco durante a preparação do enxerto com facilidade, criando um remendo do tronco celíaco, artéria gástrica esquerda e artéria esplênica. O stent pode ser inserido através da abertura ampla, o que é menos difícil do que tentar inserir o stent apenas no tronco celíaco. Descobriu-se que 24 G é um tamanho ideal para usar para o stent HA. O comprimento do stent deve ser de 1,0-1,5 mm de comprimento, pois age como um portão aberto para permitir que o HA adequado do receptor seja prontamente puxado para o HA comum do doador. Com atenção cuidadosa para onde a sutura de 10-0 ethilon é colocada, o sangue que flui através desta conexão nunca tocará diretamente no stent, e o HA adequado do receptor irá protegê-lo do interior, reduzindo o risco de complicações. É importante ressaltar que o HA do doador nunca é fixado para evitar o vasospasmo. O sucesso da reconstrução arterial é avaliado deixando o doador GDA aberto. A anastomose bem sucedida resulta em bom fluxo sanguíneo do doador GDA assim que a reconstrução é concluída.
Neste protocolo, semelhante a outros, a reconexão shvc é o passo mais lento e, em última análise, dita a duração da fase anheptica. À medida que a duração do tempo anháptico aumenta, o risco de lesão isquêmica e disfunção hepática aumenta45. Outro componente crítico dos modelos de ratos OLT são os tamanhos do enxerto, stents e algemas. Se o enxerto for muito pequeno, o enxerto pode torcer ou virar, obstruindo as conexões vasculares. O tamanho dos stents e algemas pode exigir ajustes de acordo com a idade, sexo, peso e tensão do rato. O tamanho das algemas utilizadas aqui foi escolhido como descrito anteriormente28, e foi utilizado um tamanho de manguito que controlava o tamanho do rato. Não houve sinais de angústia ou complicações (ou seja, congestionamento hepático, edema, ascites ou esplenomegalia) durante o período de seguimento (até o momento: mediana = 133 dias pós-operação, mínimo = 115 dias pós-operatório, máximo = 161 dias após a operação). Outros estudos para determinar o tamanho adequado de PV e IHVC para várias cepas de ratos que contabilizam idade e sexo são garantidos.
Este protocolo OLT de rato modificado usa algemas impressas em 3D para o PV e IHVC, conforme descrito anteriormente39,40. Os métodos existentes para conectar o PV e o IHVC incluem uma técnica de microsutura32,técnica de manguito46e técnica de tala temporária de microsutura47. A técnica de braçadeira impressa em 3D foi escolhida, pois permite que o tamanho da braçadeira seja padronizado de acordo com a cepa de rato e seja fácil de preparar e usar. Grandes quantidades de algemas com as mesmas dimensões podem ser impressas de uma só vez. A superfície externa da braçadeira tem duas ranhuras para ajudar a proteger os laços e evitar escorregar. Uma cauda também é incorporada ao design da braçadeira para permitir uma manipulação mais fácil da braçadeira. No geral, acredita-se que a incorporação de algemas impressas em 3D leva a altas taxas de sucesso e reprodutibilidade do procedimento OLT, encurtando o tempo anhático. Determina-se que essa técnica também encurta a curva de aprendizagem cirúrgica.
Em conclusão, o protocolo descrito estabeleceu um modelo mais semelhante ao transplante de fígado humano, incorporando uma etapa de reconexão arterial. Este protocolo pode ser adaptado para estudar muitos aspectos imunológicos e cirúrgicos do transplante hepático e pode servir de modelo para testar novas intervenções terapêuticas relevantes para o transplante.
Disclosures
Os autores não têm nada a revelar.
Acknowledgments
Esta pesquisa foi financiada através de fundos do programa de transplante multi-órgãos da UHN e apoio do Toronto General e toronto western foundation.
Materials
| Name | Company | Catalog Number | Comments |
| 10-0 Ethilon | Ethicon | 2830G | 10-0 Ethilon Black 1X5" BV100-4 Taper |
| 10mL Syringe | BD | B302995 | Luer-Lok Tip, Sterile, Disposable |
| 1mL Syringe | BD | B309628 | Luer-Lok Tip, Sterile, Disposable |
| 20mL Syringe | BD | B301031 | Luer-Lok Tip, Sterile, Disposable |
| 3D Printed Cuff for IHVC | Custom | ||
| 3D Printed Cuff for PV | Custom | ||
| 3D Printed Holder for IHVC | Custom | ||
| 3D Printed Holder for PV | Custom | ||
| 3mL Syringe | BD | B309657 | Luer-Lok Tip, Sterile, Disposable |
| 4-0 Sofsilk | Coviden | GS-835 | Wx coded braided silk, 30", Suture 1-Needle 26 mm Length 1/2 Circle Taper Point Needle |
| 5-0 Monocryl | Ethicon | Y433H | Undyed Monofilament 1X27" TF |
| 5mL Syringe | BD | B309646 | Luer-Lok Tip, Sterile, Disposable |
| 7-0 Silk | Teleflex Medical | 103-S | Black |
| 8-0 Prolene | Ethicon | 2775G | 8-0 Prolene Blue 1X24" BV130-5 EVP Double Armed |
| Barraquer Micro Needle Holder Without Catch | Aesculap Surgical Instruments | FD231R | Curved 120 mm, 4 3/4″ |
| Barraquer Needle Holder, Extra Fine Jaws 8.0mm, Curved With Out Lock | Rumex International Co. | 8-025T | Small Size, Titanium |
| Barraquer Needle Holder, Fine Jaws 12.0mm, Curved With Out Lock | Rumex International Co. | 8-021T | Small Size, Titanium |
| BD Insyte Autoguard BC 22 GA x 1.00 IN | BD Angiocath / Autoguard | 382523 | 22 G x 1.00" (0.9 mm x 25 mm) Wingless catheter, 37 mL/min |
| BDPrecisionGlide Single-use Needles: Regular Bevel - Regular Wall. | BD | B305106 | PrecisionGlide stainless-steel needles with translucent, color-coded, polypropylene hubs. 22 G |
| BD Precisionglide Syringe Needle 21G | BD | 305167 | Gauge 21, length 1.5 inch, hypodermic needle |
| BD Precisionglide Syringe Needle 30G | BD | 305128 | Gauge 30, length 1 inch, hypodermic needle |
| Betadine Solution by Purdue Products LP | Purdue Products Lp | 67618-150-17 | 10% povidone–iodine topical solution USP |
| Bupivacaine Injection BP 0.5% | SteriMax Inc. | DIN:02443694 | 0.5% (100mg/20mL) |
| Curved Tying Forceps | Duckworth & Kent | 2-501E | 6mm tying platforms, straight shafts, flat handle, length 88mm |
| DC Temperature Controller | FHC Inc. | 40-90-8D | |
| DK Iris Scissors (Curved) | Duckworth & Kent | 1-211B | Blunt tips, cut length 4mm, tip to pivot length 11mm, round handle, length 107mm |
| Ethanol, 200 proof (100%), USP, Decon Labs | Decon Labs, Inc. | 2716 | Dilute to 70% with d2H2O |
| Fine Adjustable Wire Retractor | Fine Science Tools | 17004-05 | Maximum spread: 3.5cm, Depth 5cm |
| Harvard Apparatus Isoflurane Funnel-Fill Vaporizer | Harvard Appartus Limited | 34-1040SV | |
| Heparin LEO(heparin sodium) | LEO Pharma Inc. | DIN:00453811 | 10,000 i.u./10 mL |
| Ice-Pak | Cryopak | FIP88016 | 4.00 in. x 7.00 in., thickness 1.50 inch |
| Isoflurane United States Pharmacopeia (USP) 99.9% | Piramal Healthcare Limited | DIN: 02231929 | 250 mL, Inhalation Anesthetic, NDC 66794-017-25 |
| Khaw Transconjunctival Adjustable Suture Control Forceps | Duckworth & Kent | 2-502N | 5mm highly polished tying platforms, straight shafts, flat handle, length 84mm |
| Lactate Ringer's Injected USP, 1000mL | Baxter Co. | DIN: 00061085 | JB2324 |
| McPherson Tying Forceps | Duckworth & Kent | 2-500E | 6mm tying platforms, straight shafts, flat handle, length 90mm |
| Metzenbaum Scissors - 14.5 cm | Fine Science Tools | 14024-14 | Straight Sharp/Blunt |
| Micro Kitzmiller Clamp | Scanlan | 3003-630 | Jaw length 23mm, Length 11cm |
| Microscope-Leica M525 F20 | Leica Microsystems | No catalog number | |
| Non-woven Gauze Sponges | Fisherbrand | 22-028-556 | |
| Olsen-Hegar with Suture Cutter | Fine Science Tools | 12002-14 | 15 mm cutting edge, 2mm jaw surface - 14cm |
| OptixCare Eye Lube, 25gm | OptixCare | ES-KE8O-69U1 | Formerly Optixcare Surgical Eye Lubricant |
| Piperacillin sodium salt | Sigma-Aldrich | P8396 | Penicillin analog |
| Puritan 3" Standard Cotton Swab w/Wooden Handle | Puritan Medical Products Company LLC | 803-WC | Regular Cotton Tipped Applicator with Wooden Handle |
| Round Handled Needle Holder Straight w/ Lock | Fine Science Tools | 12075-12 | Round handles allow easy fingertip adjustments - 12.5cm |
| Shea Scissors Curved Blunt | Fine Science Tools | 14105-12 | Transplant scissors with light and delicate pattern - 12cm |
| Stainless Steel Micro Serrefines Curved - 4mm | Fine Science Tools | 18055-06 | Jaw length 4mm, Jaw width 0.75mm, Total length 16mm, Jaw pressure 125g |
| Stainless Steel Micro Serrefines Curved - 6mm | Fine Science Tools | 18055-05 | Jaw length 6mm, Jaw width 1mm, Total length 17mm, Jaw pressure 100g |
| Stainless Steel Micro Serrefines Straight - 6mm | Fine Science Tools | 18055-03 | Jaw length 6mm, Jaw width 1mm, Total length 15mm, Jaw pressure 100g |
| Surgical Platform | Custom, magnetic | ||
| SurgiVet Vaporstick Anesthesia Machine | General Anesthetic Services, Inc | V7015 | |
| T/Pump Localized Therapy | Stryker | TP700 Series | |
| Vacuum-Pressure Pump | Barnant Co. | 400-1901 | |
| Vannas Scissors with Microserrations Straight | Fine Science Tools | 15070-08 | Cutting edge: 5mm, Tip diameter: 0.1mm - 8.5cm |
| Vetergesic Buprenorphine | Ceva Animal Health Ltd | NAC No.:12380352 | 0.324 mg/ml buprenorphine hydochloride Solution for Injection for Dogs and Cats |
| Vetroson V-10 Bipolar Electrosurgical Unit | Summit Hill Laboratories | No catalog number | |
| Surgical Drape | PDC Healthcare | DRP1824 | Multi-purpose sterile clear plastic, 18" x 24", 40/case |
References
- Global Observatory on Donation and Transplantation. Organ Donation and Transplantation Activities. , http://www.transplant-observatory.org/download/2016-activity-data-report (2016).
- Asrani, S. K., Devarbhavi, H., Eaton, J., Kamath, P. S. Burden of liver diseases in the world. Journal of Hepatology. 70 (1), 151-171 (2019).
- Dopazo, C., et al. Analysis of adult 20-year survivors after liver transplantation. Hepatology International. 9 (3), 461-470 (2015).
- Schoening, W. N., et al. Twenty-year longitudinal follow-up after orthotopic liver transplantation: a single-center experience of 313 consecutive cases. American Journal of Transplantation. 13 (9), 2384-2394 (2013).
- Pischke, S., et al. Factors associated with long-term survival after liver transplantation: A retrospective cohort study. World Journal of Hepatology. 9 (8), 427-435 (2017).
- Hamdani, S., et al. Delayed and short course of rapamycin prevents organ rejection after allogeneic liver transplantation in rats. World Journal of Gastroenterology. 23 (38), 6962-6972 (2017).
- Endo, K., et al. Pretransplant replacement of donor liver grafts with recipient Kupffer cells attenuates liver graft rejection in rats. Journal of Gastroenterology and Hepatology. 30 (5), 944-951 (2015).
- Zhao, Z., et al. IL-34 Inhibits Acute Rejection of Rat Liver Transplantation by Inducing Kupffer Cell M2 Polarization. Transplantation. 102 (6), e265-e274 (2018).
- Nagakawa, Y., et al. Over-expression of AIF-1 in liver allografts and peripheral blood correlates with acute rejection after transplantation in rats. American Journal of Transplantation. 4 (12), 1949-1957 (2004).
- Gao, L. H., Zeng, L. X., Chen, H. M., Wan, R. H. Cytomegalovirus infection accelerates the process of chronic rejection in rat liver transplantation. Transplantation Proceedings. 45 (6), 2536-2538 (2013).
- Wu, Y., et al. Effects of combined genes of CTLA4Ig and IDO in post-liver transplantation immune tolerance of rats. Annals of Hepatology. 15 (5), 729-737 (2016).
- He, X. S., et al. Influence of warm ischemia injury on hepatic functional status and survival of liver graft in rats. Hepatobiliary and Pancreatic Diseases International. 2 (4), 504-508 (2003).
- Tamura, A., et al. Combination effect of tacrolimus and FTY720 in liver transplantation in rats. Transplantation Proceedings. 31 (7), 2785-2786 (1999).
- Wang, Z., et al. RhGH attenuates ischemia injury of intrahepatic bile ducts relating to liver transplantation. Journal of Surgical Research. 171 (1), 300-310 (2011).
- Jiang, J. W., et al. Chronic bile duct hyperplasia is a chronic graft dysfunction following liver transplantation. World Journal of Gastroenterology. 18 (10), 1038-1047 (2012).
- Tang, Y., et al. S-Adenosylmethionine attenuates bile duct early warm ischemia reperfusion injury after rat liver transplantation. Molecular Immunology. 95, 83-90 (2018).
- Nosaka, T., Bowers, J. L., Cay, O., Clouse, M. E. Biliary complications after orthotopic liver transplantation in rats. Surgery Today. 29 (9), 963-965 (1999).
- Howden, B., Jablonski, P., Grossman, H., Marshall, V. C. The importance of the hepatic artery in rat liver transplantation. Transplantation. 47 (3), 428-431 (1989).
- Post, S., et al. The impact of arterialization on hepatic microcirculation and leukocyte accumulation after liver transplantation in the rat. Transplantation. 54 (5), 789-794 (1992).
- Hori, T., et al. Impact of hepatic arterial reconstruction on orthotopic liver transplantation in the rat. Journal of Investigative Surgery. 25 (4), 242-252 (2012).
- Zhou, S., et al. New method of stent-facilitated arterial reconstruction for orthotopic mouse liver transplantation. Journal of Surgical Research. 187 (1), 297-301 (2014).
- Noack, K., Bronk, S. F., Kato, A., Gores, G. J. The greater vulnerability of bile duct cells to reoxygenation injury than to anoxia. Implications for the pathogenesis of biliary strictures after liver transplantation. Transplantation. 56 (3), 495-500 (1993).
- Imamura, H., Rocheleau, B., Cote, J., Huet, P. M. Long-term consequence of rat orthotopic liver transplantation with and without hepatic arterial reconstruction: a clinical, pathological, and hemodynamic study. Hepatology. 26 (1), 198-205 (1997).
- Reck, T., et al. Impact of arterialization on hepatic oxygen supply, tissue energy phosphates, and outcome after liver transplantation in the rat. Transplantation. 62 (5), 582-587 (1996).
- Zhao, D., Wheatley, A. M. Orthotopic liver transplantation in the rat: comparison of models with and without rearterialization of the graft. European Surgical Research. 25 (5), 294-302 (1993).
- Chaland, P., et al. Orthotopic liver transplantation with hepatic artery anastomoses. Hemodynamics and response to hemorrhage in conscious rats. Transplantation. 49 (4), 675-678 (1990).
- Liu, X., He, C., Huang, T., Gu, J. Development of a New Technique for Reconstruction of Hepatic Artery during Liver Transplantation in Sprague-Dawley Rat. PLoS One. 10 (12), e0145662 (2015).
- Oldani, G., Lacotte, S., Morel, P., Mentha, G., Toso, C. Orthotopic liver transplantation in rats. Journal of Visualized Experiments. (65), (2012).
- Lee, S., Charters, A. C., Chandler, J. G., Orloff, M. J. A technique for orthotopic liver transplantation in the rat. Transplantation. 16 (6), 664-669 (1973).
- Kamada, N., Calne, R. Y. Orthotopic liver transplantation in the rat. Technique using cuff for portal vein anastomosis and biliary drainage. Transplantation. 28 (1), 47-50 (1979).
- Kashfi, A., et al. A review of various techniques of orthotopic liver transplantation in the rat. Transplantation Proceedings. 37 (1), 185-188 (2005).
- Chong, A. S., Alegre, M. L., Miller, M. L., Fairchild, R. L. Lessons and limits of mouse models. Cold Spring Harbor Perspectives in Medicine. 3 (12), a015495 (2013).
- Hasuike, Y., et al. A simple method for orthotopic liver transplantation with arterial reconstruction in rats. Transplantation. 45 (4), 830-832 (1988).
- Hickman, R., Engelbrecht, G. H., Duminy, F. J. A technique for liver transplantation in the rat. Transplantation. 48 (6), 1080 (1989).
- Steffen, R., Ferguson, D. M., Krom, R. A. A new method for orthotopic rat liver transplantation with arterial cuff anastomosis to the recipient common hepatic artery. Transplantation. 48 (1), 166-168 (1989).
- Shi, Y., et al. Magnetic ring anastomosis of suprahepatic vena cava: novel technique for liver transplantation in rat. Transplant International. 28 (1), 89-94 (2015).
- Dippe, B. E., et al. An improved model for rat liver transplantation including arterial reconstruction and simplified microvascular suture techniques. Journal of Investigative Surgery. 5 (4), 361-373 (1992).
- Kobayashi, E., Kamada, N., Goto, S., Miyata, M. Protocol for the technique of orthotopic liver transplantation in the rat. Microsurgery. 14 (8), 541-546 (1993).
- Oldani, G., et al. Efficient nonarterialized mouse liver transplantation using 3-dimensional-printed instruments. Liver Transplation. 22 (12), 1688-1696 (2016).
- Oldani, G., et al. Manufacturing devices and instruments for easier rat liver transplantation. Journal of Visualized Experiments. (75), e50380 (2013).
- Li, J., et al. Modified sleeve anastomosis for reconstruction of the hepatic artery in rat liver transplantation. Microsurgery. 22 (2), 62-68 (2002).
- Li, G. L., et al. High incidence of biliary complications in rat liver transplantation: can we avoid it? World Journal of Gastroenterology. 17 (26), 3140-3144 (2011).
- Zammert, M., Gelman, S. The pathophysiology of aortic cross-clamping. Best Practice and Research: Clinical Anaesthesiology. 30 (3), 257-269 (2016).
- Gao, W., Lemasters, J. J., Thurman, R. G. Development of a new method for hepatic rearterialization in rat orthotopic liver transplantation. Reduction of liver injury and improvement of surgical outcome by arterialization. Transplantation. 56 (1), 19-24 (1993).
- Ijtsma, A. J., et al. The clinical relevance of the anhepatic phase during liver transplantation. Liver Transplation. 15 (9), 1050-1055 (2009).
- Miyata, M., Fischer, J. H., Fuhs, M., Isselhard, W., Kasai, Y. A simple method for orthotopic liver transplantation in the rat. Cuff technique for three vascular anastomoses. Transplantation. 30 (5), 335-338 (1980).
- Marni, A., Ferrero, M. E. A four-technique comparative study of orthotopic liver transplantation in the rat. American Journal of Surgery. 156 (3 Pt 1), 209-213 (1988).