직교 간 이식의 쥐 모형에 있는 동맥 재연결 후에 감소된 합병증
Summary
이 연구의 목표는 쥐 정형 소 간 이식 모델을 수정하여 인간의 간 이식을 더 잘 나타내고 수령인 생존을 개선하는 것입니다. 제시된 방법은 기증자 간동맥을 수령인 간동맥에 연결하여 간 동맥 유입을 재확립합니다.
Abstract
쥐 직교 간 이식 (OLT) 모델은 급성 및 만성 거부를 연구하는 강력한 도구입니다. 그러나 동맥 재연결의 부재로 인해 인간 간 이식의 완전한 표현은 아닙니다. 여기에 설명된 간 동맥(HA) 재연결의 통합을 포함하는 수정된 이식 절차, 이식 결과에 있는 현저한 개선으로 이끌어 내는. 평균 간 시간 12 분 과 14s, HA 재연결 결과 이식 된 간의 향상 된 관류와 장기 받는 사람 생존의 증가 37.5% 받는 사람 88.2%. 이 프로토콜에는 포털 정맥과 적외선 베나 카바를 연결하는 3D 프린팅 커프스와 홀더의 사용이 포함됩니다. 그것은 간 이식의 여러 측면을 공부하기 위한 구현될 수 있습니다., 면역 반응 및 감염에서 절차의 기술적인 측면에. 이 수정된 쥐 OLT 프로토콜은 미세 혈관 기술을 사용하여 동맥 재연결을 위한 간단하고 실용적인 방법을 통합함으로써 인간 간 이식의 측면을 면밀히 모방하고 귀중하고 임상적으로 관련된 연구 모델로 작용할 것입니다.
Introduction
간 질환의 글로벌 부담은 2005년부터 2013년1,2까지간 질환 관련 사망자가 30% 증가하면서 계속 증가하고있습니다. 간 이식은 종종 말기 간 질환을 가진 환자에 대 한 유일한 의지. 간은 두 번째로 자주 이식된 고체 기관이며, 2015년부터 2016년1,2까지 전 세계적으로 수행된 간 이식 횟수는 7.25%증가했습니다.2 그것의 보급에도 불구하고, 이식 후 생존율은정체되고 있다 3,,4,,5. 15년 환자 생존율은 53%로 보고되고, 20년 환자 생존율은 21%3,3,5로낮을 수 있다. 새로운 치료와 향상된 임상 결과로 이끌어 낼 수 있는 흥미진진한 새로운 면역생물학 이니셔티브가 있는 동안, 그(것)들을 시험하는 믿을 수 있는 작은 동물 모형은 아직 없습니다.
쥐 OLT 모델은 거부,,6,7,8,89,10,면역 내성11,이식 허혈-재관류 부상12,면역 억제13,담즙 나무 부상,14,,15,16,17을포함한 간 이식 에 대한 조사에 널리 사용되어 왔다.,, 그러나, 현재 의 형태로 모델의 단점은 높은 수술 후 이환율과 사망률18,,19이다. 이것은 인간 적인 작동과 확률에 심각한 단점이며, 모델(20)에서임상적으로 관련 된 결론을 도출 하는 능력을 손상.
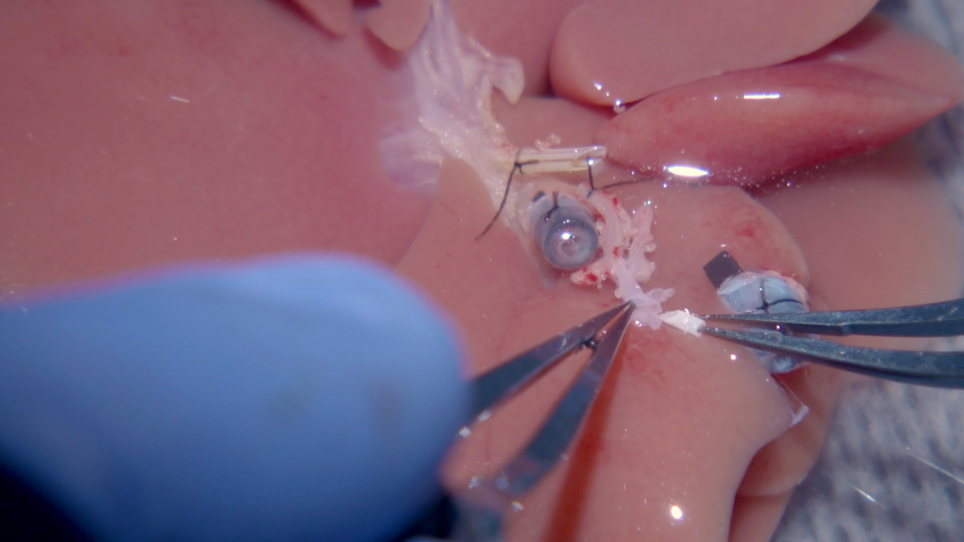
추가적으로, 이 이환율의 큰 비율은 결석하거나 불완전한 간 동맥 (HA) 재연결18에기인할 수 있습니다. 비록 인간의 간 이식에 중요 한 단계, 기술적 어려움 쥐 OLT 모델에서 HA 재연결을 손상 하는 경향이. 그 결과, 담관(BD) 해부학은 끈질기게 되어 담즙 누설 및 BD괴사(21)의높은 비율을 초래한다. 담즙합병증(22)의높은 발생률을 넘어, 동맥 유입의 부재는 이식후이식23의생리학을 변화시키고, 공여자 간이식편(24)에서 저산소증과 염증이 있는엽(19,,25,,26)에서간 손상이 관찰된다. 동맥 재연결 없이 쥐 OLT는 또한 섬유증을 촉진하는 경향이있다 (27). 아래에 설명된 쥐 OLT 프로토콜은 이전에 발표된 쥐 OLT방법(28)과간단한 HA 재건 단계를 통합하여 이러한 문제를 해결하여 간 parenchyma의 보존과 생존율 향상을 초래합니다.
간 이식은 기증자로부터 간 이식의 (1) 추출, (2) 기증자 간 이식의 준비, (3) 간 이식과 함께 받는 간 교체의 3상이 있다. 절차는 5개의 해부학 적인 구조물의 조작을 관련시킵니다: supracc 열등한 베나 카바 (SHVC), 포털 정맥 (PV), 적외선 정맥 (IHVC), 간 동맥 (HA), 및 담관 (BD).
쥐내OLT는 SHVC, PV 및 IHVC의 미세 수거 해부학, 그리고 BD29용풀스루 기술을 사용하여 이외 에 의해 처음 도입되었다. 이 모델은 나중에 1979 년30에서두 커프 기술을 사용하여 개선되었다. 그 이후로, 몇몇 대체 기술은 제안된, 대다수는 정맥 해부학에 집중하고 몇몇 수정31와2 개의 커프 기술을 사용하여. HA 해부학은 이전에 쥐 OLT 모델에서 미세 수, 커프 및 인트라루컬 슬리브(26,,31,,32,,33,34)와34같은 기술을 사용하여 쥐 OLT 모델에 설명되었지만, 이러한 기술은 종종 고도로 훈련 된 미세 수술 능력을 필요로하고 쥐 생리학을 크게 변화시키고 혈전증 및 / 또는 담즙 합병증27,,35에의해 방해된다.
더욱이, 외과적 수술의 선택은 또한 쥐 간 이식의 성공에 중요한 ancc 시간 (PV 클램핑에서 재구성된 PV를 통해 이식의 재침투에 시간)에 영향을 미칠 수 있습니다. 구체적으로, 높은 생존율은 15-20분36의간시간, 30분은성공의 상한선인 37,,38로관찰된다. 따라서, 이 방법의 목표는 간 동맥을 다시 연결하고, 이식된 간의 효율적인 관류를 촉진하고, 수령인 담관으로의 흐름을 유지하고, 수령인의 생리적 상태를 보존할 수 있는 덜 침습적이고 더 쉽게 채택할 수 있는 수술용 쥐 OLT 모델을 구현하는 것이다.
여기에 상세하여 기증자 간체 의 체강 트렁크의 조작뿐만 아니라 1) 1.5mm 스텐트의 사용을 포함하여 이 개정 된 프로토콜의 모든 단계는 받는 사람과 의외소매 연결을 수행 적절한 HA, 2) SHVC 재건을 위한 러닝 봉합사, 3) PV 및 IHVC 재건을 위한 2개의 3D 인쇄 플라스틱커프스(39,40,4) HA18,,27,,41 및 5) 이전에 설명된 BD 스텐팅,기술(28)에대한 마이크로혈관 슬리브 재연결. PV를 통한 감기 홍조와 이전 연구결과(17)를기반으로 하는 항생제 처방등 2개의 추가 단계도 포함되어 있습니다. 이 최적화된 OLT 프로토콜은 perioperative 합병증과 이환율을 최소화하고 인간 간 이식에 사용되는 수술 수술을 보다 면밀히 모델합니다.
Protocol
Representative Results
Discussion
작은 동물 간 이식 모델은 이식 면역을 이해하고 새로운 치료 전략을 식별하는 데 중요하다32. 이상적인 작은 동물 간 이식 모델은 동맥 해부학을 포함하여 인체 절차의 모든 단계를 복제합니다. 대부분의 버전이 HA 해부학 단계를 통합하지 않기 때문에 쥐 OLT 모델의 결과를 해석하는 것은 어려울 수 있으며, 이는 합병증과이환율(42)의높은 비율로 이어진다. 일부 재건 절차는 신장 27의 제거를 필요로 하는 신장 동맥을이용했습니다. 이 프로토콜은 인간 적인 절차에서 일어나는 무슨 이상이기 때문에 기관 제거를 방지합니다.
동맥 재건은 또한 쥐대동맥(31)을조작하여 수행될 수 있다. 그러나 이러한 방법은 대동맥의 광범위한 해부 및 클램핑이 필요합니다. 클램프 시간이 연장되면 받는 쥐는 탈약허혈(43)과관련된 결과가 좋지 않습니다. 인간에서, LT 외과 기술은 수신자 위장 동맥 (GDA)의 결찰 그리고 분할을 관련시킵니다. 그러나, 설치류의 생리적 및 해부학적 특징은 이 기술을 사용하여 이식을 더 생리적으로 도전하게 하고 합병증으로 이어질 수 있습니다 (즉, 췌장 및 담즙 덕트35 및 담즙누설44). 이 프로토콜의 동맥 재연결은 이 도전을 우회하고, 덕트 혈류를 유지하고, 수령인 의 결과를 개선하기 위한 것입니다.
쥐 HA의 재건을 위한 슬리브 및 스텐팅 기술의 사용은 이전에설명되었다 27. 이 기술에서 스텐트는 가이드로 사용되며, 동맥은 기증자 체강 트렁크에서 받는 사람 공통 HA로 재구성됩니다. 받는 사람 공통 HA는 해부되고 받는 사람 GDA는27로묶여 있습니다. 그 결과, 수령인 BD의 하부에 혈액 공급과 췌장의 머리가 손상될 수 있다. 이 지역에 부수적인 순환은 종종 담관에 부적당한 혈류를 제공한다는 것을 믿어집니다. 예를 들어 이 프로토콜은 먼저 받는 사람 GDA를 마이크로혈관 클립으로 클램프한 다음 받는 사람 BD를 나눕니다. GDA가 고정되어 있는 경우 분할된 BD가 출혈되지 않습니다. GDA 클램프를 제거한 후 BD로부터 활발한 출혈이 관찰됩니다. 분할 된 받는 사람 담관에 좋은 흐름을 유지 하는이 프로토콜, 적절 한 간 혈액 관혈을 제공 하 고 후 OLT hypoxic 간 손상을 방지 하 여 받는 사람 간 조직의 생리학을 보호.
기증자 측에서는, HA 스텐트는 체강 트렁크, 좌측 위동맥 및 비장 동맥에서 패치를 만들어 쉽게 이식 준비 도중 체강 트렁크에 삽입됩니다. 스텐트는 넓은 개구부를 통해 삽입할 수 있으며, 이는 스텐트를 체강 트렁크에만 삽입하는 것보다 덜 어렵습니다. 24 G는 HA 스텐트에 사용하기에 이상적인 크기인 것으로 나타났습니다. 스텐트의 길이는 1.0-1.5mm 길이여야 하는데, 이는 수령인의 적절한 HA를 기증자의 일반적인 HA로 쉽게 끌어당길 수 있도록 하는 열린 게이트 역할을 하기 때문입니다. 10-0 에틸론 봉합사가 어디에 배치되는지 주의 깊게 주의를 기울이면, 이 연결을 통해 흐르는 혈액은 스텐트를 직접 만지지 않으며, 수령인의 적절한 HA는 내부에서 이를 보호하여 합병증의 위험을 줄입니다. 중요한 것은, 기증자의 HA는 혈관 경련을 피하기 위하여 결코 고정되지 않습니다. 동맥 재건의 성공은 기증자 GDA를 열어 두어 평가됩니다. 성공적인 해부학은 재건이 완료되면 기증자 GDA에서 좋은 혈류를 초래한다.
이 프로토콜에서, 다른 사람과 유사하게, SHVC 재연결은 가장 느린 단계이고 궁극적으로 간 단계의 기간을 지시합니다. 간 시간의 지속 시간이 증가함에 따라, 위험 허혈성 손상 및 간 기능 장애 증가45. OLT 쥐 모델의 또 다른 중요한 구성 요소는 접목, 스텐트 및 커프의 크기입니다. 접목이 너무 작으면 접목이 비틀거나 뒤집어 혈관 연결을 방해할 수 있습니다. 스텐트와 커프스의 크기는 쥐의 나이, 성별, 체중 및 변형에 따라 조정이 필요할 수 있습니다. 여기에 사용된 커프스의 크기는 이전에 설명된28로선택되었으며, 쥐 크기를 조절하는 커프 사이즈 1개를 사용했습니다. 후속 기간 동안 (즉, 간 혼잡, 부종, 아스테아시 또는 비장)의 징후는 없었다 (현재까지 : 중앙값 = 133 일 수술 후, 최소 = 115 일 후, 최대 = 161 일 후). 연령과 성별 을 모두 차지하는 다양한 쥐 균주에 대한 PV 및 IHVC의 적절한 크기를 결정하는 추가 연구가 보증됩니다.
이 수정된 쥐 OLT 프로토콜은 이전에 설명된 바와 같이 PV 및 IHVC에 대해3D,프팅 커프스를사용합니다. PV 및 IHVC를 연결하는 기존 방법에는 미세 수개기술(32),커프기술(46)및 미세 수거-임시 부목기술(47)이 포함된다. 3D 프래팅 커프 기법은 쥐 의 변형에 따라 커프의 크기를 표준화할 수 있고 준비 및 사용하기 쉽기 때문에 선택되었습니다. 동일한 치수를 가진 다량의 커프를 한 번에 인쇄할 수 있습니다. 커프의 바깥쪽 표면에는 두 개의 홈이 되어 서넥타이를 고정하고 미끄러지지 않도록 돕습니다. 또한 커프 디자인에 꼬리가 통합되어 커프스를 쉽게 조작할 수 있습니다. 전반적으로, 3D 프릭 커프스를 통합하면 간 시간을 단축하여 OLT 절차의 높은 성공률과 재현성을 초래한다고 믿어집니다. 이 기술은 또한 외과 학습 곡선을 단축한다는 것을 결정됩니다.
결론적으로, 기술된 프로토콜은 동맥 재연결 단계를 통합하여 인간 간 이식과 더 유사한 모델을 확립했다. 이 프로토콜은 간 이식의 많은 면역 학적 및 외과 적 측면을 연구하도록 적응 할 수 있으며 이식과 관련된 새로운 치료 개입을 테스트하는 모델로 사용될 수 있습니다.
Disclosures
The authors have nothing to disclose.
Acknowledgements
이 연구는 UHN의 다기관 이식 프로그램의 자금과 토론토 일반 및 토론토 서부 재단의 지원을 통해 지원되었습니다.
Materials
| 10-0 Ethilon | Ethicon | 2830G | 10-0 Ethilon Black 1X5" BV100-4 Taper |
| 10mL Syringe | BD | B302995 | Luer-Lok Tip, Sterile, Disposable |
| 1mL Syringe | BD | B309628 | Luer-Lok Tip, Sterile, Disposable |
| 20mL Syringe | BD | B301031 | Luer-Lok Tip, Sterile, Disposable |
| 3D Printed Cuff for IHVC | Custom | ||
| 3D Printed Cuff for PV | Custom | ||
| 3D Printed Holder for IHVC | Custom | ||
| 3D Printed Holder for PV | Custom | ||
| 3mL Syringe | BD | B309657 | Luer-Lok Tip, Sterile, Disposable |
| 4-0 Sofsilk | Coviden | GS-835 | Wx coded braided silk, 30", Suture 1-Needle 26 mm Length 1/2 Circle Taper Point Needle |
| 5-0 Monocryl | Ethicon | Y433H | Undyed Monofilament 1X27" TF |
| 5mL Syringe | BD | B309646 | Luer-Lok Tip, Sterile, Disposable |
| 7-0 Silk | Teleflex Medical | 103-S | Black |
| 8-0 Prolene | Ethicon | 2775G | 8-0 Prolene Blue 1X24" BV130-5 EVP Double Armed |
| Barraquer Micro Needle Holder Without Catch | Aesculap Surgical Instruments | FD231R | Curved 120 mm, 4 3/4″ |
| Barraquer Needle Holder, Extra Fine Jaws 8.0mm, Curved With Out Lock | Rumex International Co. | 8-025T | Small Size, Titanium |
| Barraquer Needle Holder, Fine Jaws 12.0mm, Curved With Out Lock | Rumex International Co. | 8-021T | Small Size, Titanium |
| BD Insyte Autoguard BC 22 GA x 1.00 IN | BD Angiocath / Autoguard | 382523 | 22 G x 1.00" (0.9 mm x 25 mm) Wingless catheter, 37 mL/min |
| BDPrecisionGlide Single-use Needles: Regular Bevel – Regular Wall. | BD | B305106 | PrecisionGlide stainless-steel needles with translucent, color-coded, polypropylene hubs. 22 G |
| BD Precisionglide Syringe Needle 21G | BD | 305167 | Gauge 21, length 1.5 inch, hypodermic needle |
| BD Precisionglide Syringe Needle 30G | BD | 305128 | Gauge 30, length 1 inch, hypodermic needle |
| Betadine Solution by Purdue Products LP | Purdue Products Lp | 67618-150-17 | 10% povidone–iodine topical solution USP |
| Bupivacaine Injection BP 0.5% | SteriMax Inc. | DIN:02443694 | 0.5% (100mg/20mL) |
| Curved Tying Forceps | Duckworth & Kent | 2-501E | 6mm tying platforms, straight shafts, flat handle, length 88mm |
| DC Temperature Controller | FHC Inc. | 40-90-8D | |
| DK Iris Scissors (Curved) | Duckworth & Kent | 1-211B | Blunt tips, cut length 4mm, tip to pivot length 11mm, round handle, length 107mm |
| Ethanol, 200 proof (100%), USP, Decon Labs | Decon Labs, Inc. | 2716 | Dilute to 70% with d2H2O |
| Fine Adjustable Wire Retractor | Fine Science Tools | 17004-05 | Maximum spread: 3.5cm, Depth 5cm |
| Harvard Apparatus Isoflurane Funnel-Fill Vaporizer | Harvard Appartus Limited | 34-1040SV | |
| Heparin LEO(heparin sodium) | LEO Pharma Inc. | DIN:00453811 | 10,000 i.u./10 mL |
| Ice-Pak | Cryopak | FIP88016 | 4.00 in. x 7.00 in., thickness 1.50 inch |
| Isoflurane United States Pharmacopeia (USP) 99.9% | Piramal Healthcare Limited | DIN: 02231929 | 250 mL, Inhalation Anesthetic, NDC 66794-017-25 |
| Khaw Transconjunctival Adjustable Suture Control Forceps | Duckworth & Kent | 2-502N | 5mm highly polished tying platforms, straight shafts, flat handle, length 84mm |
| Lactate Ringer's Injected USP, 1000mL | Baxter Co. | DIN: 00061085 | JB2324 |
| McPherson Tying Forceps | Duckworth & Kent | 2-500E | 6mm tying platforms, straight shafts, flat handle, length 90mm |
| Metzenbaum Scissors – 14.5 cm | Fine Science Tools | 14024-14 | Straight Sharp/Blunt |
| Micro Kitzmiller Clamp | Scanlan | 3003-630 | Jaw length 23mm, Length 11cm |
| Microscope-Leica M525 F20 | Leica Microsystems | No catalog number | |
| Non-woven Gauze Sponges | Fisherbrand | 22-028-556 | |
| Olsen-Hegar with Suture Cutter | Fine Science Tools | 12002-14 | 15 mm cutting edge, 2mm jaw surface – 14cm |
| OptixCare Eye Lube, 25gm | OptixCare | ES-KE8O-69U1 | Formerly Optixcare Surgical Eye Lubricant |
| Piperacillin sodium salt | Sigma-Aldrich | P8396 | Penicillin analog |
| Puritan 3" Standard Cotton Swab w/Wooden Handle | Puritan Medical Products Company LLC | 803-WC | Regular Cotton Tipped Applicator with Wooden Handle |
| Round Handled Needle Holder Straight w/ Lock | Fine Science Tools | 12075-12 | Round handles allow easy fingertip adjustments – 12.5cm |
| Shea Scissors Curved Blunt | Fine Science Tools | 14105-12 | Transplant scissors with light and delicate pattern – 12cm |
| Stainless Steel Micro Serrefines Curved – 4mm | Fine Science Tools | 18055-06 | Jaw length 4mm, Jaw width 0.75mm, Total length 16mm, Jaw pressure 125g |
| Stainless Steel Micro Serrefines Curved – 6mm | Fine Science Tools | 18055-05 | Jaw length 6mm, Jaw width 1mm, Total length 17mm, Jaw pressure 100g |
| Stainless Steel Micro Serrefines Straight – 6mm | Fine Science Tools | 18055-03 | Jaw length 6mm, Jaw width 1mm, Total length 15mm, Jaw pressure 100g |
| Surgical Platform | Custom, magnetic | ||
| SurgiVet Vaporstick Anesthesia Machine | General Anesthetic Services, Inc | V7015 | |
| T/Pump Localized Therapy | Stryker | TP700 Series | |
| Vacuum-Pressure Pump | Barnant Co. | 400-1901 | |
| Vannas Scissors with Microserrations Straight | Fine Science Tools | 15070-08 | Cutting edge: 5mm, Tip diameter: 0.1mm – 8.5cm |
| Vetergesic Buprenorphine | Ceva Animal Health Ltd | NAC No.:12380352 | 0.324 mg/ml buprenorphine hydochloride Solution for Injection for Dogs and Cats |
| Vetroson V-10 Bipolar Electrosurgical Unit | Summit Hill Laboratories | No catalog number |
References
- Asrani, S. K., Devarbhavi, H., Eaton, J., Kamath, P. S. Burden of liver diseases in the world. Journal of Hepatology. 70 (1), 151-171 (2019).
- Dopazo, C., et al. Analysis of adult 20-year survivors after liver transplantation. Hepatology International. 9 (3), 461-470 (2015).
- Schoening, W. N., et al. Twenty-year longitudinal follow-up after orthotopic liver transplantation: a single-center experience of 313 consecutive cases. American Journal of Transplantation. 13 (9), 2384-2394 (2013).
- Pischke, S., et al. Factors associated with long-term survival after liver transplantation: A retrospective cohort study. World Journal of Hepatology. 9 (8), 427-435 (2017).
- Hamdani, S., et al. Delayed and short course of rapamycin prevents organ rejection after allogeneic liver transplantation in rats. World Journal of Gastroenterology. 23 (38), 6962-6972 (2017).
- Endo, K., et al. Pretransplant replacement of donor liver grafts with recipient Kupffer cells attenuates liver graft rejection in rats. Journal of Gastroenterology and Hepatology. 30 (5), 944-951 (2015).
- Zhao, Z., et al. IL-34 Inhibits Acute Rejection of Rat Liver Transplantation by Inducing Kupffer Cell M2 Polarization. Transplantation. 102 (6), e265-e274 (2018).
- Nagakawa, Y., et al. Over-expression of AIF-1 in liver allografts and peripheral blood correlates with acute rejection after transplantation in rats. American Journal of Transplantation. 4 (12), 1949-1957 (2004).
- Gao, L. H., Zeng, L. X., Chen, H. M., Wan, R. H. Cytomegalovirus infection accelerates the process of chronic rejection in rat liver transplantation. Transplantation Proceedings. 45 (6), 2536-2538 (2013).
- Wu, Y., et al. Effects of combined genes of CTLA4Ig and IDO in post-liver transplantation immune tolerance of rats. Annals of Hepatology. 15 (5), 729-737 (2016).
- He, X. S., et al. Influence of warm ischemia injury on hepatic functional status and survival of liver graft in rats. Hepatobiliary and Pancreatic Diseases International. 2 (4), 504-508 (2003).
- Tamura, A., et al. Combination effect of tacrolimus and FTY720 in liver transplantation in rats. Transplantation Proceedings. 31 (7), 2785-2786 (1999).
- Wang, Z., et al. RhGH attenuates ischemia injury of intrahepatic bile ducts relating to liver transplantation. Journal of Surgical Research. 171 (1), 300-310 (2011).
- Jiang, J. W., et al. Chronic bile duct hyperplasia is a chronic graft dysfunction following liver transplantation. World Journal of Gastroenterology. 18 (10), 1038-1047 (2012).
- Tang, Y., et al. S-Adenosylmethionine attenuates bile duct early warm ischemia reperfusion injury after rat liver transplantation. Molecular Immunology. 95, 83-90 (2018).
- Nosaka, T., Bowers, J. L., Cay, O., Clouse, M. E. Biliary complications after orthotopic liver transplantation in rats. Surgery Today. 29 (9), 963-965 (1999).
- Howden, B., Jablonski, P., Grossman, H., Marshall, V. C. The importance of the hepatic artery in rat liver transplantation. Transplantation. 47 (3), 428-431 (1989).
- Post, S., et al. The impact of arterialization on hepatic microcirculation and leukocyte accumulation after liver transplantation in the rat. Transplantation. 54 (5), 789-794 (1992).
- Hori, T., et al. Impact of hepatic arterial reconstruction on orthotopic liver transplantation in the rat. Journal of Investigative Surgery. 25 (4), 242-252 (2012).
- Zhou, S., et al. New method of stent-facilitated arterial reconstruction for orthotopic mouse liver transplantation. Journal of Surgical Research. 187 (1), 297-301 (2014).
- Noack, K., Bronk, S. F., Kato, A., Gores, G. J. The greater vulnerability of bile duct cells to reoxygenation injury than to anoxia. Implications for the pathogenesis of biliary strictures after liver transplantation. Transplantation. 56 (3), 495-500 (1993).
- Imamura, H., Rocheleau, B., Cote, J., Huet, P. M. Long-term consequence of rat orthotopic liver transplantation with and without hepatic arterial reconstruction: a clinical, pathological, and hemodynamic study. Hepatology. 26 (1), 198-205 (1997).
- Reck, T., et al. Impact of arterialization on hepatic oxygen supply, tissue energy phosphates, and outcome after liver transplantation in the rat. Transplantation. 62 (5), 582-587 (1996).
- Zhao, D., Wheatley, A. M. Orthotopic liver transplantation in the rat: comparison of models with and without rearterialization of the graft. European Surgical Research. 25 (5), 294-302 (1993).
- Chaland, P., et al. Orthotopic liver transplantation with hepatic artery anastomoses. Hemodynamics and response to hemorrhage in conscious rats. Transplantation. 49 (4), 675-678 (1990).
- Liu, X., He, C., Huang, T., Gu, J. Development of a New Technique for Reconstruction of Hepatic Artery during Liver Transplantation in Sprague-Dawley Rat. PLoS One. 10 (12), e0145662 (2015).
- Oldani, G., Lacotte, S., Morel, P., Mentha, G., Toso, C. Orthotopic liver transplantation in rats. Journal of Visualized Experiments. (65), (2012).
- Lee, S., Charters, A. C., Chandler, J. G., Orloff, M. J. A technique for orthotopic liver transplantation in the rat. Transplantation. 16 (6), 664-669 (1973).
- Kamada, N., Calne, R. Y. Orthotopic liver transplantation in the rat. Technique using cuff for portal vein anastomosis and biliary drainage. Transplantation. 28 (1), 47-50 (1979).
- Kashfi, A., et al. A review of various techniques of orthotopic liver transplantation in the rat. Transplantation Proceedings. 37 (1), 185-188 (2005).
- Chong, A. S., Alegre, M. L., Miller, M. L., Fairchild, R. L. Lessons and limits of mouse models. Cold Spring Harbor Perspectives in Medicine. 3 (12), a015495 (2013).
- Hasuike, Y., et al. A simple method for orthotopic liver transplantation with arterial reconstruction in rats. Transplantation. 45 (4), 830-832 (1988).
- Hickman, R., Engelbrecht, G. H., Duminy, F. J. A technique for liver transplantation in the rat. Transplantation. 48 (6), 1080 (1989).
- Steffen, R., Ferguson, D. M., Krom, R. A. A new method for orthotopic rat liver transplantation with arterial cuff anastomosis to the recipient common hepatic artery. Transplantation. 48 (1), 166-168 (1989).
- Shi, Y., et al. Magnetic ring anastomosis of suprahepatic vena cava: novel technique for liver transplantation in rat. Transplant International. 28 (1), 89-94 (2015).
- Dippe, B. E., et al. An improved model for rat liver transplantation including arterial reconstruction and simplified microvascular suture techniques. Journal of Investigative Surgery. 5 (4), 361-373 (1992).
- Kobayashi, E., Kamada, N., Goto, S., Miyata, M. Protocol for the technique of orthotopic liver transplantation in the rat. Microsurgery. 14 (8), 541-546 (1993).
- Oldani, G., et al. Efficient nonarterialized mouse liver transplantation using 3-dimensional-printed instruments. Liver Transplation. 22 (12), 1688-1696 (2016).
- Oldani, G., et al. Manufacturing devices and instruments for easier rat liver transplantation. Journal of Visualized Experiments. (75), e50380 (2013).
- Li, J., et al. Modified sleeve anastomosis for reconstruction of the hepatic artery in rat liver transplantation. Microsurgery. 22 (2), 62-68 (2002).
- Li, G. L., et al. High incidence of biliary complications in rat liver transplantation: can we avoid it?. World Journal of Gastroenterology. 17 (26), 3140-3144 (2011).
- Zammert, M., Gelman, S. The pathophysiology of aortic cross-clamping. Best Practice and Research: Clinical Anaesthesiology. 30 (3), 257-269 (2016).
- Gao, W., Lemasters, J. J., Thurman, R. G. Development of a new method for hepatic rearterialization in rat orthotopic liver transplantation. Reduction of liver injury and improvement of surgical outcome by arterialization. Transplantation. 56 (1), 19-24 (1993).
- Ijtsma, A. J., et al. The clinical relevance of the anhepatic phase during liver transplantation. Liver Transplation. 15 (9), 1050-1055 (2009).
- Miyata, M., Fischer, J. H., Fuhs, M., Isselhard, W., Kasai, Y. A simple method for orthotopic liver transplantation in the rat. Cuff technique for three vascular anastomoses. Transplantation. 30 (5), 335-338 (1980).
- Marni, A., Ferrero, M. E. A four-technique comparative study of orthotopic liver transplantation in the rat. American Journal of Surgery. 156 (3 Pt 1), 209-213 (1988).