Complicazioni ridotte dopo la riconnessione arteriosa in un modello di ratto di trapianto di fegato ortotopico
Summary
L’obiettivo di questo studio è quello di modificare il modello di trapianto di fegato ortotopico per rappresentare meglio il trapianto di fegato umano e migliorare la sopravvivenza del destinatario. Il metodo presentato ristabilisce l’afflusso arterioso epatico collegando l’arteria epatica comune del fegato donatore all’arteria epatica corretta del fegato ricevente.
Abstract
Il modello di trapianto di fegato ortotopico (OLT) ratto è un potente strumento per studiare il rigetto acuto e cronico. Tuttavia, non è una rappresentazione completa del trapianto di fegato umano a causa dell’assenza di riconnessione arteriosa. Descritto qui è una procedura di trapianto modificata che include l’incorporazione della riconnessione dell’arteria epatico (HA), portando ad un netto miglioramento degli esiti dei trapianti. Con un tempo anepatico medio di 12 min e 14 s, la riconnessione HA si traduce in una migliore perfusione del fegato trapiantato e un aumento della sopravvivenza dei destinatari a lungo termine dal 37,5% all’88,2%. Questo protocollo include l’uso di polsini e supporti stampati in 3D per collegare la vena del portale e l’infrahepatic inferiore vena cava. Può essere implementato per studiare più aspetti del trapianto di fegato, dalla risposta immunitaria e l’infezione agli aspetti tecnici della procedura. Incorporando un metodo semplice e pratico per la riconnessione arteriosa utilizzando una tecnica microvascolare, questo protocollo OLT del ratto modificato imita da vicino gli aspetti del trapianto di fegato umano e servirà come un modello di ricerca prezioso e clinicamente rilevante.
Introduction
Il peso globale delle malattie epatiche continua ad aumentare, con un aumento del 30% dei decessi correlati alle malattie epatiche dal 2005 al 20131,2. Il trapianto di fegato è spesso l’unico ricorso per i pazienti con malattia epatica in fase finale. Il fegato è il secondo organo solido più frequentemente trapiantato, e il numero di trapianti di fegato eseguiti a livello globale è aumentato del 7,25% dal 2015 al 20161,2. Nonostante la sua prevalenza, i tassi di sopravvivenza post-trapianto sono diventatistagnanti 3,4,5. Il tasso di sopravvivenza del paziente a 15 anni è del 53%, e il tasso di sopravvivenza del paziente a 20 anni può essere basso come 21%3,5. Mentre ci sono nuove entusiasmanti iniziative di immunobiologia che possono portare a nuovi trattamenti e migliori risultati clinici, non c’è ancora un piccolo modello animale affidabile in cui testarli.
Il modello OLT ratto è stato ampiamente utilizzato nell’indagine del trapianto di fegato, tra cui rigetto6,7,8,9,10, tolleranza immunitaria11, trapianto ischemia-reperfusione lesione12, immunosoppressione13, e lesione biliare albero14,15,16,17. Tuttavia, uno svantaggio del modello nella sua forma attuale è la sua elevata morbilità post-operatoria e mortalità18,19. Si tratta di un grave inconveniente che è in contrasto con l’operazione umana, e compromette la capacità di trarre conclusioni clinicamente rilevanti dal modello20.
Inoltre, gran parte di questa morbilità può essere attribuita a una riconnessione dell’arteria eparica (HA) assente oimperfetta 18. Anche se un passo critico nel trapianto di fegato umano, le difficoltà tecniche tendono a compromettere la riconnessione HA nel modello OLT ratto. Di conseguenza, l’anastomosi del dotto biliare (BD) è tenue e si traduce in alti tassi di perdita di bile e necrosi BD21. Al di là dell’alta incidenza di complicanze biliarie22, l’assenza di afflusso arteriosa altera la fisiologia del fegato innesto post-trapianto23, con ipossia nel donatoreepatico innesto 24 e danni al fegato osservati in lobi infiammati19,25,26. Rat OLT senza riconnessione arteriosa tende anche a promuovere la fibrosi27. Il protocollo OLT ratto descritto di seguito affronta questi problemi incorporando un semplice passo di ricostruzione HA con un metodo OLT rattoprecedentemente pubblicato 28, con conseguente conservazione del parenchyma del fegato e tassi di sopravvivenza migliorati.
Il trapianto di fegato ha tre fasi: (1) estrazione dell’innesto epatico dal donatore, (2) preparazione dell’innesto epatico del donatore e (3) sostituzione del fegato ricevente con l’innesto epatico. La procedura prevede la manipolazione di cinque strutture anatomiche: la vena cava inferiore suprahepatica (SHVC), la vena del portale (PV), la vena cava inferiore infraepatica (IHVC), l’arteria epatica (HA) e il dotto biliare (BD).
OLT nel ratto è stato introdotto per la prima volta da Lee et al. utilizzando l’anastomosi microsutura dello SHVC, PV e IHVC, e una tecnica pull-through per il BD29. Questo modello è stato successivamente migliorato attraverso l’uso della tecnica a due polsini nel 197930. Da allora, sono state proposte diverse tecniche alternative, con la maggior parte che si concentra sull’anastomosi venosa e utilizza una tecnica a due polsini con alcunemodifiche 31. Anche se l’anastomosi HA è stata descritta in precedenza nel modello OLT del ratto utilizzando tecniche come microsutura, polsino e maniche intraluminali26,31,32,33,34, queste tecniche spesso richiedono competenze microchirurgiche altamente addestrate, alterano significativamente la fisiologia del ratto e sono ostacolate da trombosi e/o complicazioni biliarie27,35.
Inoltre, la scelta della procedura chirurgica può anche influenzare il tempo anepatico (tempo dal bloccaggio fotovoltaico alla reperfusione dell’innesto attraverso il fotovoltaico ricostituito), che è fondamentale per il successo del trapianto di fegato di ratto. In particolare, alti tassi di sopravvivenza sono osservati con tempi anepatici di 15-20 min36e 30 min è il limite superiore per ilsuccesso 37,38. Pertanto, l’obiettivo di questo metodo è quello di implementare un modello OLT del ratto chirurgico meno invasivo e più facilmente adottabile che sia in grado di ricollegare l’arteria epatica, promuovere una perfusione efficiente del fegato trapiantato, mantenere il flusso al dotto biliare ricevente e preservare la condizione fisiologica del destinatario.
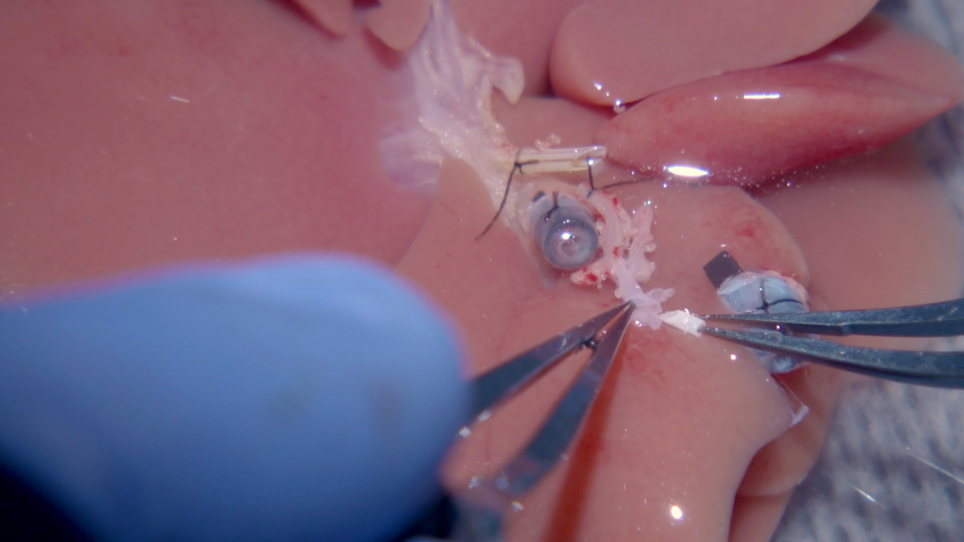
In dettaglio qui sono tutti i passaggi di questo protocollo rivisto, compresa la manipolazione del tronco celiaco del fegato donatore, nonché l’uso di 1) uno stent di 1,5 mm per eseguire una connessione manica extraluminale con il destinatario corretta HA, 2) una sutura in esecuzione per la ricostruzione SHVC, 3) due polsini in plastica stampati in 3D per la ricostruzione PV e IHVC39,40, 4) una riconnessione manica microvascolare per la HA18,27,41 e 5) una tecnica di stenting BD precedentemente descritta28. Sono inclusi anche altri due passaggi: un colore freddo attraverso il fotovoltaico e un regime antibiotico che si basa sui precedenti risultati17. Questo protocollo OLT ottimizzato riduce al minimo le complicazioni perioperatorie e la morbilità e modella più da vicino la procedura operativa chirurgica impiegata nel trapianto di fegato umano.
Protocol
Representative Results
Discussion
I modelli di trapianto di fegato di piccolo animale sono importanti per comprendere l’immunità dei trapianti e identificare nuove strategieterapeutiche 32. Il modello ideale di trapianto di fegato animale piccolo replica tutti i passaggi della procedura umana, compresa l’astatomosi arteriosa. Può essere difficile interpretare i risultati del modello OLT ratto, come la maggior parte delle versioni non incorporano un passo ANastomosi HA, che porta a tassi più elevati di complicazioni e morbilità42. Alcune procedure di ricostruzione hanno utilizzato l’arteria renale, che richiede la rimozione del rene27. Questo protocollo evita la rimozione degli organi, in quanto è al di là di ciò che accade nella procedura umana.
Le ricostruzioni arteriose possono essere eseguite anche manipolando il ratto aorta31. Tuttavia, questi metodi richiedono un’ampia dissezione e il bloccaggio dell’aorta. Se il tempo di morsetto è prolungato, il ratto ricevente avrà scarsi risultati legati all’ischemia distale43. Nell’uomo, una tecnica chirurgica LT coinvolge la legatura e la divisione dell’arteria gastroduodenale ricevente (GDA). Tuttavia, le caratteristiche fisiologiche e anatomiche dei roditori rendono il trapianto con questa tecnica più fisiologicamente impegnativo e può portare a complicazioni (cioè necrosi del pancreas e dotto biliare35 e perdita di bile44). La riconnessione arteriosa in questo protocollo ha lo scopo di aggirare questa sfida, mantenere il flusso sanguigno del condotto e migliorare l’esito del destinatario.
L’uso di una manica e di una tecnica di stenting per la ricostruzione del ratto HA è stato descritto in precedenza27. In questa tecnica, uno stent viene utilizzato come guida, e l’arteria viene ricostruita dal tronco celiaco donatore all’HA comune ricevente. Il destinatario ha detto comune viene quindi sezionato e il GDA destinatario è legato27. Di conseguenza, l’afflusso di sangue alla parte inferiore del BD ricevente e alla testa del pancreas può diventare compromessa. Si ritiene che la circolazione collaterale in questa zona spesso fornisce un flusso sanguigno inadeguato al dotto biliare. Ad esempio, questo protocollo blocca il GDA destinatario prima con una clip microvascolare, quindi divide il BD del destinatario. Con il GDA bloccato, il BD diviso non sanguina. Dopo aver rimosso il morsetto GDA, si osserva un sanguinamento rapido dal BD. Questo protocollo, che mantiene un buon flusso al dotto biliare destinatario diviso, protegge la fisiologia del tessuto epatico ricevente fornendo un’adeguata perfusione di sangue epatico e prevenendo lesioni epatiche ipossiche post-OLT.
Sul lato donatore, lo stent HA viene inserito nel tronco celiaco durante la preparazione dell’innesto con facilità creando un cerotto dal tronco celiaco, dall’arteria gastrica sinistra e dall’arteria splenica. Lo stent può essere inserito attraverso l’ampia apertura, che è meno difficile che cercare di inserire lo stent nel solo tronco celiaco. Si è scoperto che 24 G è una dimensione ideale da utilizzare per lo stent HA. La lunghezza dello stent deve essere lunga 1,0-1,5 mm, perché funge da cancello aperto per consentire all’HA corretta del ricevente di essere prontamente tirato nell’HA comune del donatore. Con un’attenta attenzione a dove è collocata la sutura di ethilon 10-0, il sangue che scorre attraverso questa connessione non toccherà mai direttamente lo stent e l’HA corretta del destinatario lo proteggerà dall’interno, riducendo il rischio di complicazioni. È importante sottolineare che l’HA del donatore non viene mai bloccato per evitare il vasospasmo. Il successo della ricostruzione arteriosa viene valutato lasciando aperto il GDA donatore. Una volta completata la ricostruzione, l’anastomosi di successo si traduce in un buon flusso sanguigno dal donatore GDA.
In questo protocollo, simile ad altri, la riconnessione SHVC è il passo più lento e, in ultima analisi, determina la durata della fase anepaziale. Con l’aumentare della durata del tempo anepatico, il rischio di lesioni ischemiche e disfunzione epatica aumenta45. Un altro componente critico dei modelli di ratto OLT sono le dimensioni dell’innesto, degli stent e dei polsini. Se l’innesto è troppo piccolo, l’innesto può ruotare o capovolgere, ostacolando le connessioni vascolari. La dimensione degli stent e polsini può richiedere regolazioni in base all’età, sesso, peso, e ceppo del ratto. La dimensione dei polsini utilizzati qui è stata scelta come descritto inprecedenza 28, ed è stata utilizzata una dimensione del polsino che controllava per le dimensioni del ratto. Non c’erano segni di angoscia o complicazioni (ad esempio, congestione epatica, edema, asciti o splenomegaly) durante il periodo di follow-up (ad oggi: mediana – 133 giorni dopo l’operazione, minimo 115 giorni dopo l’operazione, massimo 161 giorni dopo l’operazione). Ulteriori studi per determinare le dimensioni adatte di fotovoltaico e IHVC per vari ceppi di ratto che rappresentano sia l’età che il sesso sono giustificati.
Questo protocollo OLT ratto modificato utilizza polsini stampati in 3D per il PV e IHVC, come descritto inprecedenza 39,40. I metodi esistenti per collegare il fotovoltaico e l’IHVC includono una tecnica di microsezione32, la tecnicadel bracciale 46e la tecnica della stecca temporanea di microsutura47. È stata scelta la tecnica del bracciale stampato in 3D, in quanto consente di standardizzare le dimensioni del bracciale in base al ceppo del ratto ed è facile da preparare e utilizzare. Grandi quantità di polsini con le stesse dimensioni possono essere stampati contemporaneamente. La superficie esterna del bracciale ha due scanalature per aiutare con fissaggio cravatte e prevenire lo scivolamento. Una coda è anche incorporata nel design del bracciale per consentire una più facile manipolazione del bracciale. Nel complesso, si ritiene che l’incorporazione di polsini stampati in 3D porti ad alti tassi di successo e riproducibilità della procedura OLT riducendo il tempo anepatico. È determinato che questa tecnica accorcia anche la curva di apprendimento chirurgico.
In conclusione, il protocollo descritto ha stabilito un modello che è più simile al trapianto di fegato umano incorporando una fase di riconnessione arteriosa. Questo protocollo può essere adattato per studiare molti aspetti immunologici e chirurgici del trapianto di fegato e può servire da modello per testare nuovi interventi terapeutici rilevanti per il trapianto.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Questa ricerca è stata finanziata attraverso fondi del programma di trapianto Multi-Organ presso l’UHN e il sostegno della Toronto General e della Toronto Western Foundation.
Materials
| 10-0 Ethilon | Ethicon | 2830G | 10-0 Ethilon Black 1X5" BV100-4 Taper |
| 10mL Syringe | BD | B302995 | Luer-Lok Tip, Sterile, Disposable |
| 1mL Syringe | BD | B309628 | Luer-Lok Tip, Sterile, Disposable |
| 20mL Syringe | BD | B301031 | Luer-Lok Tip, Sterile, Disposable |
| 3D Printed Cuff for IHVC | Custom | ||
| 3D Printed Cuff for PV | Custom | ||
| 3D Printed Holder for IHVC | Custom | ||
| 3D Printed Holder for PV | Custom | ||
| 3mL Syringe | BD | B309657 | Luer-Lok Tip, Sterile, Disposable |
| 4-0 Sofsilk | Coviden | GS-835 | Wx coded braided silk, 30", Suture 1-Needle 26 mm Length 1/2 Circle Taper Point Needle |
| 5-0 Monocryl | Ethicon | Y433H | Undyed Monofilament 1X27" TF |
| 5mL Syringe | BD | B309646 | Luer-Lok Tip, Sterile, Disposable |
| 7-0 Silk | Teleflex Medical | 103-S | Black |
| 8-0 Prolene | Ethicon | 2775G | 8-0 Prolene Blue 1X24" BV130-5 EVP Double Armed |
| Barraquer Micro Needle Holder Without Catch | Aesculap Surgical Instruments | FD231R | Curved 120 mm, 4 3/4″ |
| Barraquer Needle Holder, Extra Fine Jaws 8.0mm, Curved With Out Lock | Rumex International Co. | 8-025T | Small Size, Titanium |
| Barraquer Needle Holder, Fine Jaws 12.0mm, Curved With Out Lock | Rumex International Co. | 8-021T | Small Size, Titanium |
| BD Insyte Autoguard BC 22 GA x 1.00 IN | BD Angiocath / Autoguard | 382523 | 22 G x 1.00" (0.9 mm x 25 mm) Wingless catheter, 37 mL/min |
| BDPrecisionGlide Single-use Needles: Regular Bevel – Regular Wall. | BD | B305106 | PrecisionGlide stainless-steel needles with translucent, color-coded, polypropylene hubs. 22 G |
| BD Precisionglide Syringe Needle 21G | BD | 305167 | Gauge 21, length 1.5 inch, hypodermic needle |
| BD Precisionglide Syringe Needle 30G | BD | 305128 | Gauge 30, length 1 inch, hypodermic needle |
| Betadine Solution by Purdue Products LP | Purdue Products Lp | 67618-150-17 | 10% povidone–iodine topical solution USP |
| Bupivacaine Injection BP 0.5% | SteriMax Inc. | DIN:02443694 | 0.5% (100mg/20mL) |
| Curved Tying Forceps | Duckworth & Kent | 2-501E | 6mm tying platforms, straight shafts, flat handle, length 88mm |
| DC Temperature Controller | FHC Inc. | 40-90-8D | |
| DK Iris Scissors (Curved) | Duckworth & Kent | 1-211B | Blunt tips, cut length 4mm, tip to pivot length 11mm, round handle, length 107mm |
| Ethanol, 200 proof (100%), USP, Decon Labs | Decon Labs, Inc. | 2716 | Dilute to 70% with d2H2O |
| Fine Adjustable Wire Retractor | Fine Science Tools | 17004-05 | Maximum spread: 3.5cm, Depth 5cm |
| Harvard Apparatus Isoflurane Funnel-Fill Vaporizer | Harvard Appartus Limited | 34-1040SV | |
| Heparin LEO(heparin sodium) | LEO Pharma Inc. | DIN:00453811 | 10,000 i.u./10 mL |
| Ice-Pak | Cryopak | FIP88016 | 4.00 in. x 7.00 in., thickness 1.50 inch |
| Isoflurane United States Pharmacopeia (USP) 99.9% | Piramal Healthcare Limited | DIN: 02231929 | 250 mL, Inhalation Anesthetic, NDC 66794-017-25 |
| Khaw Transconjunctival Adjustable Suture Control Forceps | Duckworth & Kent | 2-502N | 5mm highly polished tying platforms, straight shafts, flat handle, length 84mm |
| Lactate Ringer's Injected USP, 1000mL | Baxter Co. | DIN: 00061085 | JB2324 |
| McPherson Tying Forceps | Duckworth & Kent | 2-500E | 6mm tying platforms, straight shafts, flat handle, length 90mm |
| Metzenbaum Scissors – 14.5 cm | Fine Science Tools | 14024-14 | Straight Sharp/Blunt |
| Micro Kitzmiller Clamp | Scanlan | 3003-630 | Jaw length 23mm, Length 11cm |
| Microscope-Leica M525 F20 | Leica Microsystems | No catalog number | |
| Non-woven Gauze Sponges | Fisherbrand | 22-028-556 | |
| Olsen-Hegar with Suture Cutter | Fine Science Tools | 12002-14 | 15 mm cutting edge, 2mm jaw surface – 14cm |
| OptixCare Eye Lube, 25gm | OptixCare | ES-KE8O-69U1 | Formerly Optixcare Surgical Eye Lubricant |
| Piperacillin sodium salt | Sigma-Aldrich | P8396 | Penicillin analog |
| Puritan 3" Standard Cotton Swab w/Wooden Handle | Puritan Medical Products Company LLC | 803-WC | Regular Cotton Tipped Applicator with Wooden Handle |
| Round Handled Needle Holder Straight w/ Lock | Fine Science Tools | 12075-12 | Round handles allow easy fingertip adjustments – 12.5cm |
| Shea Scissors Curved Blunt | Fine Science Tools | 14105-12 | Transplant scissors with light and delicate pattern – 12cm |
| Stainless Steel Micro Serrefines Curved – 4mm | Fine Science Tools | 18055-06 | Jaw length 4mm, Jaw width 0.75mm, Total length 16mm, Jaw pressure 125g |
| Stainless Steel Micro Serrefines Curved – 6mm | Fine Science Tools | 18055-05 | Jaw length 6mm, Jaw width 1mm, Total length 17mm, Jaw pressure 100g |
| Stainless Steel Micro Serrefines Straight – 6mm | Fine Science Tools | 18055-03 | Jaw length 6mm, Jaw width 1mm, Total length 15mm, Jaw pressure 100g |
| Surgical Platform | Custom, magnetic | ||
| SurgiVet Vaporstick Anesthesia Machine | General Anesthetic Services, Inc | V7015 | |
| T/Pump Localized Therapy | Stryker | TP700 Series | |
| Vacuum-Pressure Pump | Barnant Co. | 400-1901 | |
| Vannas Scissors with Microserrations Straight | Fine Science Tools | 15070-08 | Cutting edge: 5mm, Tip diameter: 0.1mm – 8.5cm |
| Vetergesic Buprenorphine | Ceva Animal Health Ltd | NAC No.:12380352 | 0.324 mg/ml buprenorphine hydochloride Solution for Injection for Dogs and Cats |
| Vetroson V-10 Bipolar Electrosurgical Unit | Summit Hill Laboratories | No catalog number |
References
- Asrani, S. K., Devarbhavi, H., Eaton, J., Kamath, P. S. Burden of liver diseases in the world. Journal of Hepatology. 70 (1), 151-171 (2019).
- Dopazo, C., et al. Analysis of adult 20-year survivors after liver transplantation. Hepatology International. 9 (3), 461-470 (2015).
- Schoening, W. N., et al. Twenty-year longitudinal follow-up after orthotopic liver transplantation: a single-center experience of 313 consecutive cases. American Journal of Transplantation. 13 (9), 2384-2394 (2013).
- Pischke, S., et al. Factors associated with long-term survival after liver transplantation: A retrospective cohort study. World Journal of Hepatology. 9 (8), 427-435 (2017).
- Hamdani, S., et al. Delayed and short course of rapamycin prevents organ rejection after allogeneic liver transplantation in rats. World Journal of Gastroenterology. 23 (38), 6962-6972 (2017).
- Endo, K., et al. Pretransplant replacement of donor liver grafts with recipient Kupffer cells attenuates liver graft rejection in rats. Journal of Gastroenterology and Hepatology. 30 (5), 944-951 (2015).
- Zhao, Z., et al. IL-34 Inhibits Acute Rejection of Rat Liver Transplantation by Inducing Kupffer Cell M2 Polarization. Transplantation. 102 (6), e265-e274 (2018).
- Nagakawa, Y., et al. Over-expression of AIF-1 in liver allografts and peripheral blood correlates with acute rejection after transplantation in rats. American Journal of Transplantation. 4 (12), 1949-1957 (2004).
- Gao, L. H., Zeng, L. X., Chen, H. M., Wan, R. H. Cytomegalovirus infection accelerates the process of chronic rejection in rat liver transplantation. Transplantation Proceedings. 45 (6), 2536-2538 (2013).
- Wu, Y., et al. Effects of combined genes of CTLA4Ig and IDO in post-liver transplantation immune tolerance of rats. Annals of Hepatology. 15 (5), 729-737 (2016).
- He, X. S., et al. Influence of warm ischemia injury on hepatic functional status and survival of liver graft in rats. Hepatobiliary and Pancreatic Diseases International. 2 (4), 504-508 (2003).
- Tamura, A., et al. Combination effect of tacrolimus and FTY720 in liver transplantation in rats. Transplantation Proceedings. 31 (7), 2785-2786 (1999).
- Wang, Z., et al. RhGH attenuates ischemia injury of intrahepatic bile ducts relating to liver transplantation. Journal of Surgical Research. 171 (1), 300-310 (2011).
- Jiang, J. W., et al. Chronic bile duct hyperplasia is a chronic graft dysfunction following liver transplantation. World Journal of Gastroenterology. 18 (10), 1038-1047 (2012).
- Tang, Y., et al. S-Adenosylmethionine attenuates bile duct early warm ischemia reperfusion injury after rat liver transplantation. Molecular Immunology. 95, 83-90 (2018).
- Nosaka, T., Bowers, J. L., Cay, O., Clouse, M. E. Biliary complications after orthotopic liver transplantation in rats. Surgery Today. 29 (9), 963-965 (1999).
- Howden, B., Jablonski, P., Grossman, H., Marshall, V. C. The importance of the hepatic artery in rat liver transplantation. Transplantation. 47 (3), 428-431 (1989).
- Post, S., et al. The impact of arterialization on hepatic microcirculation and leukocyte accumulation after liver transplantation in the rat. Transplantation. 54 (5), 789-794 (1992).
- Hori, T., et al. Impact of hepatic arterial reconstruction on orthotopic liver transplantation in the rat. Journal of Investigative Surgery. 25 (4), 242-252 (2012).
- Zhou, S., et al. New method of stent-facilitated arterial reconstruction for orthotopic mouse liver transplantation. Journal of Surgical Research. 187 (1), 297-301 (2014).
- Noack, K., Bronk, S. F., Kato, A., Gores, G. J. The greater vulnerability of bile duct cells to reoxygenation injury than to anoxia. Implications for the pathogenesis of biliary strictures after liver transplantation. Transplantation. 56 (3), 495-500 (1993).
- Imamura, H., Rocheleau, B., Cote, J., Huet, P. M. Long-term consequence of rat orthotopic liver transplantation with and without hepatic arterial reconstruction: a clinical, pathological, and hemodynamic study. Hepatology. 26 (1), 198-205 (1997).
- Reck, T., et al. Impact of arterialization on hepatic oxygen supply, tissue energy phosphates, and outcome after liver transplantation in the rat. Transplantation. 62 (5), 582-587 (1996).
- Zhao, D., Wheatley, A. M. Orthotopic liver transplantation in the rat: comparison of models with and without rearterialization of the graft. European Surgical Research. 25 (5), 294-302 (1993).
- Chaland, P., et al. Orthotopic liver transplantation with hepatic artery anastomoses. Hemodynamics and response to hemorrhage in conscious rats. Transplantation. 49 (4), 675-678 (1990).
- Liu, X., He, C., Huang, T., Gu, J. Development of a New Technique for Reconstruction of Hepatic Artery during Liver Transplantation in Sprague-Dawley Rat. PLoS One. 10 (12), e0145662 (2015).
- Oldani, G., Lacotte, S., Morel, P., Mentha, G., Toso, C. Orthotopic liver transplantation in rats. Journal of Visualized Experiments. (65), (2012).
- Lee, S., Charters, A. C., Chandler, J. G., Orloff, M. J. A technique for orthotopic liver transplantation in the rat. Transplantation. 16 (6), 664-669 (1973).
- Kamada, N., Calne, R. Y. Orthotopic liver transplantation in the rat. Technique using cuff for portal vein anastomosis and biliary drainage. Transplantation. 28 (1), 47-50 (1979).
- Kashfi, A., et al. A review of various techniques of orthotopic liver transplantation in the rat. Transplantation Proceedings. 37 (1), 185-188 (2005).
- Chong, A. S., Alegre, M. L., Miller, M. L., Fairchild, R. L. Lessons and limits of mouse models. Cold Spring Harbor Perspectives in Medicine. 3 (12), a015495 (2013).
- Hasuike, Y., et al. A simple method for orthotopic liver transplantation with arterial reconstruction in rats. Transplantation. 45 (4), 830-832 (1988).
- Hickman, R., Engelbrecht, G. H., Duminy, F. J. A technique for liver transplantation in the rat. Transplantation. 48 (6), 1080 (1989).
- Steffen, R., Ferguson, D. M., Krom, R. A. A new method for orthotopic rat liver transplantation with arterial cuff anastomosis to the recipient common hepatic artery. Transplantation. 48 (1), 166-168 (1989).
- Shi, Y., et al. Magnetic ring anastomosis of suprahepatic vena cava: novel technique for liver transplantation in rat. Transplant International. 28 (1), 89-94 (2015).
- Dippe, B. E., et al. An improved model for rat liver transplantation including arterial reconstruction and simplified microvascular suture techniques. Journal of Investigative Surgery. 5 (4), 361-373 (1992).
- Kobayashi, E., Kamada, N., Goto, S., Miyata, M. Protocol for the technique of orthotopic liver transplantation in the rat. Microsurgery. 14 (8), 541-546 (1993).
- Oldani, G., et al. Efficient nonarterialized mouse liver transplantation using 3-dimensional-printed instruments. Liver Transplation. 22 (12), 1688-1696 (2016).
- Oldani, G., et al. Manufacturing devices and instruments for easier rat liver transplantation. Journal of Visualized Experiments. (75), e50380 (2013).
- Li, J., et al. Modified sleeve anastomosis for reconstruction of the hepatic artery in rat liver transplantation. Microsurgery. 22 (2), 62-68 (2002).
- Li, G. L., et al. High incidence of biliary complications in rat liver transplantation: can we avoid it?. World Journal of Gastroenterology. 17 (26), 3140-3144 (2011).
- Zammert, M., Gelman, S. The pathophysiology of aortic cross-clamping. Best Practice and Research: Clinical Anaesthesiology. 30 (3), 257-269 (2016).
- Gao, W., Lemasters, J. J., Thurman, R. G. Development of a new method for hepatic rearterialization in rat orthotopic liver transplantation. Reduction of liver injury and improvement of surgical outcome by arterialization. Transplantation. 56 (1), 19-24 (1993).
- Ijtsma, A. J., et al. The clinical relevance of the anhepatic phase during liver transplantation. Liver Transplation. 15 (9), 1050-1055 (2009).
- Miyata, M., Fischer, J. H., Fuhs, M., Isselhard, W., Kasai, Y. A simple method for orthotopic liver transplantation in the rat. Cuff technique for three vascular anastomoses. Transplantation. 30 (5), 335-338 (1980).
- Marni, A., Ferrero, M. E. A four-technique comparative study of orthotopic liver transplantation in the rat. American Journal of Surgery. 156 (3 Pt 1), 209-213 (1988).