Summary
本研究的目标是修改大鼠正畸肝移植模型,以更好地代表人类肝移植,提高接受者存活率。提出的方法通过将供体肝脏的常用肝动脉与接受者肝脏的适当的肝动脉连接,重新建立肝动脉流入。
Abstract
大鼠正畸肝移植(OLT)模型是研究急性和慢性排斥的有力工具。然而,由于缺乏动脉重联,它并不是人类肝移植的完整表现。这里描述的是一个修改后的移植程序,包括整合肝动脉(HA)重新连接,导致移植结果的显著改善。医管局平均肝期为12分钟及14秒,可改善移植肝脏的灌注,使长期受助者存活率由37.5%提高至88.2%。该协议包括使用3D打印袖口和持有人连接门户静脉和红外线劣质静脉卡瓦。它可以用于研究肝移植的多个方面,从免疫反应和感染到程序的技术方面。通过采用微血管技术结合一种简单实用的动脉重接方法,这种经过改良的大鼠OLT协议密切模仿人类肝移植的方方面面,将成为有价值的临床相关研究模型。
Introduction
全球肝病负担继续增加,从2005年到2013年,与肝病有关的死亡人数增加了30%。,2肝移植通常是最终肝病患者的唯一途径。肝脏是第二频繁的移植固体器官,从2015年到2016年,全球进行的肝脏移植数量增加了7.25%。1,2尽管其流行,移植后存活率,已停滞不前3,4,5。,45报告15年患者存活率为53%,20年患者存活率可低至21%,为,3、5。虽然有令人兴奋的新的免疫生物学倡议,可能导致新的治疗和改善的临床结果,还没有一个可靠的小动物模型来测试他们。
大鼠OLT模型已广泛应用于肝移植研究,包括,,,,,排斥6、7、8、9、10、7免疫耐受性11、移植缺血-再灌9,10注损伤12、免疫抑制13、胆道树损伤6814、15、16、17。14151617然而,该模型目前形式的缺点是其高术后发病率和死亡率18,19。18,这是一个与人体手术相左的严重缺点,它损害了从模型20中得出临床相关结论的能力。
此外,这种发病率的很大一部分可归因于肝动脉(HA)的缺失或不完善。18。虽然是人类肝移植的关键一步,但技术困难往往会损害大鼠OLT模型中的HA重新连接。因此,胆管(BD)的动脉瘤病是脆弱的,导致胆汁泄漏和BD坏死率高21。除了胆道并发症的高发病率22,动脉流入的缺乏改变了移植后移植肝脏的生理状况23,供体肝移植缺氧24和肝损伤观察在发炎叶19,25,26。19,25,26没有动脉连接的鼠OLT也倾向于促进纤维化27。下面描述的大鼠OLT协议通过将一个简单的HA重建步骤与先前公布的大鼠OLT方法28结合,解决了这些问题,从而保存了肝硬化瘤并提高了存活率。
肝移植分为三个阶段:(1)从供体中提取肝移植,(2)制备供体肝移植,(3)用肝移植置换接受肝脏。该过程涉及五个解剖结构的操作:超前低劣的静脉(SHVC),门户静脉(PV),下部低劣的静脉(IHVC),肝动脉(HA)和胆管(BD)。
大鼠的OLT首先由李等人采用SHVC、PV和 IHVC的微缝合性腺瘤,以及BD29的拉直技术。这个模型后来通过使用双袖口技术在1979年30改进。从那时起,提出了几种替代技术,其中大多数侧重于静脉动脉瘤,并使用双袖口技术与一些修改31。虽然HA性腺病以前在大鼠OLT模型中曾用微松、袖口,和宫内套管26、31、32、33、34,31,32,33等技术进行过描述,但这些技术往往需要训练有素的显微外科技能,显著改变大鼠生理,并受血栓形成和/或胆汁并发症27、35,的阻碍。
此外,手术选择也可以影响肝时间(从PV夹紧到通过重组的PV再灌注)的时间,这对大鼠肝移植的成功至关重要。具体来说,高存活率观察到的肝时间为15-20分钟36,30分钟36是成功的上限37,38。38因此,该方法的目标是实现一种侵入性更小、更容易采用的手术鼠OLT模型,该模型能够重新连接肝动脉,促进移植肝脏的高效灌注,维持输液管,保持接受者的生理状况。
这里详细说明了本修订协议的所有步骤,包括操作供体肝脏的腹腔躯干,以及使用 1) 1.5 mm 支架执行与接受者适当的 HA 的外腰套连接, 2) 用于 SHVC 重建的运行缝合线,3) 两个 3D 打印塑料袖口用于 PV 和 IHVC 重建 39、40、4) 用于 HA39,18、27、41,27,41和 5 的微血管套接重新连接,前文描述的 BD 支架技术 28。40还包括两个额外的步骤:通过PV的冷冲洗,和抗生素方案,是基于以前的发现17。这种优化的OLT协议最大限度地减少了周程并发症和发病率,并更密切地模型了人类肝移植中采用的手术手术。
Protocol
这项研究是按照啮齿动物处理和手术指南进行的,研究协议得到了大学卫生网络动物护理委员会(UHN AUP #5840.3)的批准,并遵循加拿大动物护理理事会的指导方针。这项研究使用雄性刘易斯大鼠(应变LEW/SSNHsd),12-14周大,体重在250-300克之间。
1. 设备设置
- 用针架握住 31 G 的锐尖,通过来回反复弯曲尖端,直到尖端卡开,创建钝 L 形喷油器。使用扁平金属文件,钝化和平滑喷油器的端端。
- 用手术刀从 3D 打印底座上切割入口静脉 (PV) 和红外线劣质静脉 (IHVC) 袖口(辅助材料 1,辅助材料 2,图 1,辅助图 1)。
注:3D设计软件用于设计袖口和支架,这些袖口和支架使用可自动粘合树脂39、40(,补充材料Table of Materials1-10中包含的所有3D打印材料的规格)在3D打印机(材料表)上打印。40 - 使用新的手术刀将 22 G 导管切割成双侧倾斜管(3.5 毫米长)。使用手术刀,轻轻地将线蚀刻到胆管 (BD) 支架表面(不要穿过管壁)。这些蚀刻将防止在手术过程中打滑。
- 使用新的手术刀将 24 G 导管切割成单侧倾斜边缘管(长度为 2.0 mm),并在新动脉支架表面产生多个划痕。
注:避免对支架施加压力,防止 BD 支架的流明变窄或遮挡。如果支架变窄或遮挡,接受者的生存将因胆道阻塞而受到影响。
- 用手术刀从 3D 打印底座上切割入口静脉 (PV) 和红外线劣质静脉 (IHVC) 袖口(辅助材料 1,辅助材料 2,图 1,辅助图 1)。
2. 捐助者行动
- 将热垫设置为 37 °C,并放在手术平台下方。打开温度监测器,以便通过直肠探头监测大鼠的核心温度。设置异氟麻醉装置。
注:在手术过程中,通过注意呼吸速率、心率、器官/粘膜的着色以及任何踏板退出反射的存在来监测麻醉的深度。 - 使用所有必要的乐器和材料(即剪刀、钳子、纱布、肝素、缩回器、中段垫、棉尖、4-0 丝绸、7-0 丝绸、8-0)安排手术式工作空间不可吸收无菌缝合,10-0不可吸收的单丝缝合)方便地放置在手术平台的两侧。
- 使用所有解决方案安排工作站,包括林格的乳酸溶液和 300 IU 的肝素钠( 参见材料表)。
- 称量动物。将捐赠大鼠放入麻醉室,用5%异氟、5升/分钟气流和70%FiO2 进行诱导,对捐赠大鼠进行麻醉。当大鼠失去知觉时,将麻醉量降低至3%异氟、0.5升/分钟气流和70%FiO2。通过捏脚检查踏板响应是否不足。
- 准备腹部的皮肤。使用电动剃须刀,从腹侧取下毛皮。仔细观察捐赠者的呼吸速率,直到达到稳定而深入的呼吸速率。
- 将手术披上窗帘的老鼠放在一边,使它的腹侧朝向天花板。将鼻子放在麻醉清除剂中,用3%的异氟、0.5升/分钟的气流和70%的FiO2。 用波维酮碘准备腹壁,从中线向外工作,然后是70%乙醇。
- 使用圆尖手术剪刀从 xiphoid 过程到阴响体进行切口,然后用双边横向切口改善暴露。使用双极电外科装置停止腹壁的任何出血。切口后,将维持异氟兰降至2%,0.5升/分钟气流,以及70%FiO2。
注:调整异氟蒸发器,达到大约一次呼吸/秒的呼吸速率,并记住在整个手术过程中定期评估麻醉深度。 - 在 xiphoid 过程中放置 4-0 丝线,并使用缝合线缩回胸壁头。将丝线固定到将麻醉清除器固定到位的结构顶部。用放在腹部两侧的3D打印缩回器保持供体大鼠的体腔打开(参见补充材料 3)(缩回器用橡皮筋固定到位,并附在手术平台上的磁铁上)。
注:蚊子钳子也可以用来抓住西腓的过程和收回头孢子。用胶带将蚊子钳固定到位。 - 使用无纺布纱布海绵(4 厘米 x 4 厘米),由林格的乳酸溶液抑制,以包围小肠和大肠。使用小,湿,无纺布纱布海绵(2厘米x4厘米)轻轻地覆盖肝脏。
- 将小卷纱布放在中段下,以抬起腹部,改善超低劣的维纳卡瓦 (SHVC) 的暴露。
- 切开恶性韧带。使用微钳将左隔膜静脉与 SHVC 分离。用 7 - 0 丝绸将左隔膜静脉拉平,靠近 SHVC。
注:使用小,湿,无纺布纱布海绵,用林格的乳酸打湿,并放置在肝脏上,轻轻地收回肝脏远离西腓过程,并暴露左隔膜静脉。 - 用圆尖剪刀切开左三角和胃肝韧带。
- 使用小型、湿的、无纺布的纱布海绵,小心地将左叶和中叶拉回西腓工艺,露出黄豆叶。用圆尖剪刀将胆小叶从肝脏的其他部分分离出韧带。
- 使用靠近食道的双极电外科单元分离和分离肝道韧带。
注:轻轻地将小肠和大肠转移到腹腔左侧,用湿的、无纺布的纱布盖住它们。 - 解剖覆盖 IHVC 的逆转录体和脂肪。暴露并隔离 IHVC 到左肾静脉。
- 使用棉签稍微置换 IHVC,然后使用双极电外科单元将任何小静脉烧灼到 IHVC 的右侧。也烧灼任何腰椎静脉合并到 IHVC。
- 将右超肾(肾上腺)静脉分成两个 7-0 的丝绸连字,靠近 IHVC。通过在温和的牵引力下切割这些韧带,将肝脏从后部韧带中释放。
- 使用细尖烧灼烧将右肾静脉从右肾动脉和邻近组织分离。用 8-0 密封右肾静脉孔不可吸收的无菌连结。
- 分离覆盖PV的脂肪,以定位与PV合并点的静脉(右胃静脉)和静脉。用 7 - 0 丝绸拉起这些静脉, 用 8 - 0 加强最接近 Pv 的一侧不可吸收的无菌缝合线。在领带之间划分静脉。
注:使用小湿纱布将十二指肠拉回 PV。如果脂肪与 PV 分离,则更容易插入袖口,这还可防止 PV 袖口狭窄。 - 使用 1 mL 注射器(31 G 针)将 300 IU 肝素钠注入 IHVC 中,稀释至 1 mL 的正常盐水。
- 在 BD 分叉下方进行切口 5 mm,并将 BD 支架插入公共 BD 中。用切口上方 7-0 丝连字固定支架。切口下方可额外打领带,切口下方为 10 mm。支架固定后,切断这两个关系之间的 BD。
- 切从不夹住BD或适当的肝动脉(HA)。将 10-0 不可吸收的无菌手术单丝缝合线放在切口处 BD 的 3 点钟位置,作为标记,以防止重新连接后扭曲。
- 暴露适当的HA,并在两个7-0丝结字之间划分胃肠动脉(GDA)。暴露左胃动脉、血动脉和腹腔躯干。将三条动脉紧密地连接在起飞时。
- 切断动脉之间的左胃动脉、血状动脉和腹腔躯干。使用 20 mL 注射器(21.5 G 针),缓慢将 20 mL 的冷 (4 °C) 林格的乳酸溶液注入 PV 中。将静脉切成低于左肾静脉与 IHVC 合并的点以下,以允许冲洗流出。
注:针头应尽可能远离针头。供体肝冷灌注应持续1-2分钟。冲洗肝脏时,用另一只手将冷林格的乳酸喷到肝脏表面。 - 冲洗后,将 PV 干干切到静脉下方。切开左肾静脉上方的 IHVC。切割紧邻隔膜的 SHVC。
- 切开肝脏和逆转录之间的韧带和结缔组织。
注:确保前侧和后部SHVC壁有足够的长度,以方便上腔肛门肛门病。紧邻隔膜的切口以保留尽可能多的长度至关重要。 - 肝脏从腹部取出后,迅速将其放入装满 4 °C 林格乳酸溶液的盘中。将盘子放在冰垫上,以保持低温。
- 按照机构准则丢弃捐赠鼠的遗骸。
3. 捐赠鼠肝制剂("后排")
- 用足够体积的4°C林格乳酸溶液填充冷培养皿,使供体大鼠肝脏淹没。小心地旋转漂浮在菜中的供体肝脏,使劣质表面朝上。将PV和 IHVC 的袖口(分别为补充材料 1 和补充材料 2)放入盘中。
- 将 PV 拉过 PV 袖口,将静脉的端在袖口上。使用 7-0 丝绸将 PV 牢固地系在袖口周围。用 10 mL 的 4 °C 环角乳酸溶液冲洗 PV。
- 使用 IHVC 重复步骤 3.2,无需冲洗。
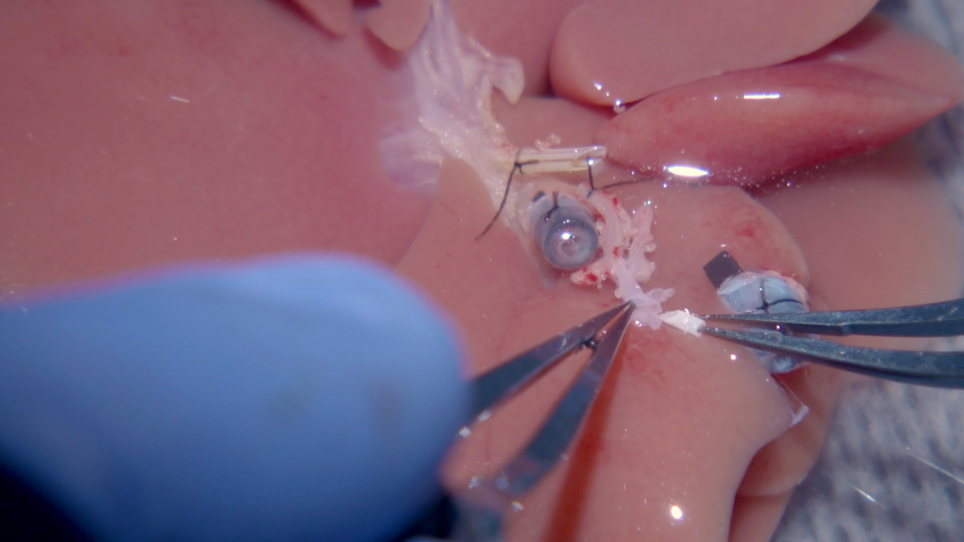
- 去除腹腔躯干周围的脂肪组织。通过切开腹腔躯干、血动脉和左胃动脉的分叉,形成更大的动脉袖口(图2A)。
注:很难将动脉支架插入公共 HA。在插入支架之前,用钳子拉伸和拉直动脉几次。确保支架的斜面朝上且动脉未扭曲(图2B)。 - 通过动脉袖口将 1.5 mm 长度 24 G 动脉支架放入供体公共 HA 中。用 8-0 固定支架聚丙烯连结 (图 2C) 和用林格的乳酸溶液冲洗支架 (图 2D).
- 将微型夹(4-6 毫米长)放在近端 IHVC 上,用于防止门户再灌注后失血,避免空气栓塞。
- 旋转肝脏并露出其优越的一面。插入两个 8-0聚丙烯锥形点缝合在 SHVC 的横向和中边缘。
- 将肝脏保持4°C,以便其准备移植到供体中。
4. 收件人操作
- 请参阅上面的捐赠者操作部分,并重复步骤 2.1-2.4。
注:12-14周大的雄性刘易斯大鼠在这里使用,体重比捐赠者重5-20克。在手术过程中,通过观察呼吸速率、心率、器官/粘膜的着色以及任何踏板退出反射的存在来监测麻醉的深度。 - 将手术披上布的老鼠放在腹侧朝上。将鼻子放在麻醉清除剂中,以吸入异氟。用视光润滑剂滋润眼睛。先用普罗维酮碘准备腹壁,然后用70%乙醇准备腹壁。
- 在腹腔壁的两侧下部注射5 mL的林格乳酸溶液。在腹腔切除术前,使用手术助理的助手将0.5 mL的200毫克/千克管霉素钠注射到左腹壁。此外,将0.5 mL的10毫克/mL的布皮瓦卡因皮下皮施以右腹壁。
注:在术后3天管理相同剂量的管霉素钠1x/天。 - 先用原碘先准备腹壁,然后用70%乙醇准备腹壁。做一个中线切口从胸骨西菲德到 1 厘米以上的阴响。将异氟兰降至2%,0.5升/分钟气流,FiO2 70%,用于切口后麻醉。
注:蚊子钳子可用于抓住西腓过程并收回头孢子。用胶带将蚊子钳固定到位。体腔由三D打印的缩回器保持打开(见补充材料 3),两侧用橡皮筋磁力固定到手术平台。 - 用湿的、无纺布的纱布海绵(4 厘米 x 4 厘米)包裹小肠和大肠,用林格的乳酸溶液打湿。使用小(2 厘米 x 4 厘米),湿的,无纺布纱布海绵用林格的乳酸溶液打湿,轻轻地覆盖肝脏。
- 将小型 3D 打印支撑垫(后架;参见补充材料 4)放在大鼠中段下,通过弯曲旋转来增加 SHVC 的曝光度。这可以在大鼠中安全地执行,并由外科医生助理执行。
- 切开假体韧带,使用小湿无纺布海绵轻轻缩回肝脏的西腓过程,露出左隔膜静脉。使用微钳将左隔膜静脉与 SHVC 分离。用7-0丝绸将左隔膜静脉靠近隔膜。
- 用圆尖剪刀切开左三角和胃肝韧带。
- 用一块小湿的无纺布纱布海绵,将左叶和中叶巧妙地拉向西腓状的工艺,露出黄豆叶。切断将卡德特叶与肝脏其余部分分离的韧带。
- 分割肝食道韧带,用双极电外科单元凝固任何出血点,靠近肝脏。切开肝脏后部的韧带。
- 小心地将小肠和大肠缩到腹腔左侧,用湿的、无纺布的纱布盖住它们。
- 解剖 IHVC 上的逆转录酮和脂肪,将 IHVC 暴露并隔离到正确的肾静脉。使用棉签稍微置换 IHVC,并使用双极电外科单元将任何小静脉烧灼到 IHVC 的右侧。同样,烧灼进入 IHVC 的任何腰椎。
- 将右超肾(肾上腺)静脉分成两个 7-0 的丝绸连字。通过轻轻的牵引下切割肝脏,将肝脏从后韧带中释放。
- 使用用林格的乳酸溶液打湿的小湿纱布来收回十二指肠,并暴露 PV。将脂肪从 PV 和双面静脉的分叉中分离。
- 将 BD 0.5 厘米分到其高毛分叉下方,并将 BD 支架插入深部常见 BD 中。将支架固定到位,在切口下方约 0.2 mm 下放置 7-0 连字。额外的领带可以放在切口上方,靠近分叉。切 Bd 接近肝脏, 但到领带。
- 用钳子分离 BD,避免剪裁 BD 或适当的 HA。将 10-0 不可吸收的单丝(例如,ethilon)缝线放在 BD 的 3 点钟位置,作为标记,以防止重新连接后出现扭曲。
- 公开适当的 HA 和通用 HA 和 GDA 的分叉。暴露左侧 HA、中间 HA 和右侧 HA。将三条动脉与CHA分叉连接,并切断靠近肝脏的动脉,在连接上方。
- 在 SHVC 后面放一块细长的纱布。
- 将 3D 打印 IHVC 支架或"手柄"(Cava 150g 2.1;参见补充材料 5)放在 IHVC 后面,并使用 10-0 不可吸收的单丝线将 3D 打印的"手柄"的末端缝合在一起(图3A)。
- 将 3D 打印的 PV 支架或"手柄"(Porta 1.4.1-参见补充材料 6)放在 PV 后面,直接低于肝脏,并使用 10-0 不可吸收的单丝缝合将 3D 打印的"手柄"的末端缝在一起。
- 松散地将 7-0 丝绸连结在两个 3D 打印支架(IHVC 和 PV)下方(图 3A)。
- 夹紧 IHVC 就在右肾静脉上方,该静脉应仍低于 3D 打印的腔架。
- 将 PV 夹在 pyloric 静脉的上方,该静脉应位于 3D 打印的 PV 支架下方。记录从此时开始的芳香时间。降低至0.5%的异氟、0.5升/分钟的气流和70%的FiO2, 用于麻醉的维持。
- 使用带有 27 G 针头的 3 mL 注射器将 PV 分叉,冲洗 2 mL 的 37 °C 环角乳酸溶液。
- 用基茨米勒夹夹将 SHVC 夹在肝脏上方。切在同一夹子下面,尽可能靠近肝脏。
- 为 PV 和 IHVC 切割高于 3D 打印支架(图 3A)。取出接受者的肝脏。小心地定位供体肝脏,并放置在接受者的体腔中,以便形成上腔肛门。
- 使用 8-0聚丙烯运行缝合线加入捐赠者的 SHVC 与接受者的 SHVC 附近的隔膜。首先, 地方保持缝合 8 - 0捐赠者和接受者SHVC的左右两个方面的聚丙烯。然后,将这些绑在静脉壁的外面。
- 使用左侧 8- 0聚丙烯从左到右缝合 SHVC 的后壁, 并绑在右侧 8 - 0聚丙烯。使用左侧 8- 0聚丙烯从左到右缝合SHVC动脉瘤前壁,使缝合线的最后三分之二松动。在松动的缝线之间使用 20 mL 的林格乳酸冲洗,同时确保提取任何气泡。
- 拧紧松动的缝线,在 SHVC 的外侧打上领带。削减剩余的 8 - 0聚丙烯缝合线。
注:剪辑将收件人的 SHVC 保留到位,从而更容易将捐赠者和接收方的 SHVC 缝在一起。记录SHVC性腺瘤的持续时间。此时,Porta 手柄连接到支架臂装置(支架臂 McGil + 支架迷你臂 LAB + 支架臂软部分 1.3;参见补充材料 7、补充材料 8和补充材料9),直接低于肝脏。此装置由 3D 打印支架底座支撑(支架底座 3.1;参见辅助材料 10)。 - 将来自捐赠者的 PV袖口 (补充材料 1) 插入接收方 PV 并拧紧 7-0 丝绸领带。使用 Ringer 的乳酸溶液在连接前将供体和接受者的 PV 冲洗至 37°C。
- 从 SHVC(第一)中拆下创伤夹,然后从 PV 的微血管夹(第二个)中拆下。用热血重新活体肝脏;在这一点上, 肝相时间已经结束。这次记录。
- 将 10 mL 的暖环环乳酸溶液倒在肝脏顶部以加热。用圆尖剪刀(切割固定缝线)拆下 3D 打印支架。
- 将捐赠者 IHVC 袖口 (补充材料 2) 插入接收者 IHVC 中,并系上 7-0 的丝绸领带。先取出供体 IHVC 剪辑,然后删除收件人的剪辑(图 3B)。如上文所述,卡瓦卡连接到支架装置和支架底座上,
- 用圆尖剪刀(切割固定缝线)拆下 3D 打印机支架(波特和卡瓦)图3C),产生连接的 IHVC(图3D)。
- 仔细检查肝脏周围的区域是否有出血。在体腔内注入 3 mL 的 37 °C 环环器乳酸溶液。
- 动脉瘤:切断从捐赠者到支架以外的腹腔躯干部分。
- 夹住接收者适当的 HA,并在末尾切断领带。切断容器周围的任何额外组织(图4A)。使用林格的乳酸溶液,冲洗供体和接受者容器末端的流明。
- 将接收器适当的 HA 拉入供体 HA 支架的套筒,以完成 HA 的动脉瘤。通过(捐赠者)HA的左侧放置一个 10-0 et克隆,比支架的远孔(从内到外)高 2.5 mm,然后穿过支架的端,用 10-0 ethilon(4 厘米长)引导弯曲的针(图 4B)。
- 将接收器正确 HA 0.5 mm 置于容器孔下方,先将缝合(从内到外)放在容器左侧,然后(从外到内)放置到动脉右侧。
- 将缝合线穿过(捐赠者)HA的右壁,从内部到外部,距离支架孔与原始缝合相同。拉上 10-0 不可吸收的单丝的两端,将接收器适当的 HA 向上滑动并插入 HA 支架(图 4C)。
注:观察抽血。一种选择是削减供体GDA,以确认血液正在通过动脉瘤泵送。如果 GDA 被切断,请确保在进入程序的下一步之前重新系上动脉。 - 将 10-0 不可吸收的单丝与自身连接在供体 HA 上(图 4D)。动脉瘤病现已完成。
- 胆道结膜:在接收方BD和支架周围松散地系上一条领带(图5A),然后取出BD支架。在胆道连接完成之前,冲洗接收方和捐赠者的 BD。
- 将捐赠者的BD支架插入接受者的胆管(图5B),并拧紧之前放在接受者BD周围的系带(图5C)。
- 将肠子返回到体腔。将 2 mL 的 37 °C 环角乳酸溶液注入腔中以冲洗。用纱布浸泡一些溶液。
- 确保肠道回到原来的位置,然后用5-0单片缝制了肠胃和皮肤。
- 用 5-0 单片将切口关闭两层。注射0.5 mL的0.5%的百吉瓦卡因周围缝制的香肠,并重复这一下,一旦皮肤缝在一起。
- 转移到笼子时,用纸巾轻轻摇动受接受的老鼠。允许动物从觉醒时免费获得水和食物。将加热的循环毯放在笼子的一半下,24-38小时。在术后立即阶段,一只老鼠被指定到一个笼子里。
5. 术后护理
- 将食物颗粒浸泡在水中,并放在笼地板上的培养皿中。
- 监测大鼠的心率、呼吸速率和肤色。
- 在术后第 1 天、第 2 天和 3 日管理管用管管杆菌素。管理丁丙诺啡皮下,并监测任何疼痛的迹象,如任何行为变化,嗜睡,未收皮,抑郁症,残废,或食欲不振的第一个72小时。
注:在移植后3天,每天至少评估疼痛2次,然后每天至少评估1次。
Representative Results
在使用上述方案28建立非HA性腺酸虫大鼠OLT模型时,我们的团队在手术后21天和60天分别观察到50%和37.5%的存活率。虽然一些组28日报告了没有HA性腺酸中毒的长期存活率高,但这些早期结果突出了没有动脉流入的缺点。相比之下,优化的HA重新连接程序显著提高了长期存活率,从37.5%增加到88.2%(p = 0.015)(图6)。
对没有HA重新连接(手术后第6天和13天)的移植动物的代表性子集进行组织学分析,发现有百分坏死缺氧肝损伤的迹象(图7)。广泛的肝坏死与这些动物中丙氨酸氨基转移酶(ALT)和阿斯巴酸氨基转移酶(AST)水平的升高有关(图7)。相比之下,移植的小鼠与HA重新连接没有肝损伤的迹象,和组织学分析显示,正常的肝膜结构与有组织的阿西尼,叶(例如,中央静脉和门户三合体与肝静脉),动脉和胆管(图7)。
虽然在23次单独操作中平均肝时间是可以接受的(12分钟和14秒[± 78 s]),但非HA重新连接模型的存活率最终仍有可能随着实践的增加而得到改善。然而,值得注意的是,在没有HA重新连接的情况下移植的四只动物中,有三只(长期存活)在手术后的第56天、第96天和111天因遇险而安乐死。此外,对肝脏的组织学分析揭示了低氧肝损伤后的反应性变化,包括明显的胆管增殖、围体纤维化和炎症,以及扭曲的肝硬化(补充图2)。低氧肝损伤的形态特征的存在证实了HA重接对有效肝灌注和正常功能的重要发现。

图1:3D打印袖口设计的示意图,用于门户静脉和红外线劣质静脉卡瓦。 第一个领带在靠近手柄 (iii) 的凹槽 (ii) 中拧紧,第二个领带拧紧在离手柄最远的凹槽 (i) 中。外径为(iv) 2.38 mm 用于入口静脉 (PV),2.15 mm 用于下部劣质静脉 (IHVC)。光伏的内径为(v)1.74 mm,IHVC 为 1.38 mm。PV 的长度为 (vi) 2.60 mm,IHVC 的长度为 2.15 mm(所有 3D 打印材料的确切规格见 补充材料)。 请单击此处查看此图的较大版本。

图2:肝动脉支架插入移植。 (A) 腹腔干干(i)的开口端通过切割腹腔动脉到左胃动脉而变宽,从而暴露了普通HA的分叉。(二) BD支架在提取捐赠鼠肝之前系上绑。(三) PV袖口和(iv)IHVC袖口通过将容器的两端折叠在袖口上来插入和绑住。(B) (i) 要插入 HA 支架,外露的常见 HA 会用钳子拉伸多次。(C) (i) HA 支架牢固地放置在公共 HA 中,并 8-0 捆绑在一起普罗内。(D) (i) HA 支架用 (ii) 林格的乳酸盐溶液 (BD + 胆管, IHVC = 下部低劣的静脉卡瓦, HA = 肝动脉) 冲洗。 请单击此处查看此图的较大版本。

图3:使用3D打印支架进行红外线劣质维纳卡瓦连接。 (A) (i) PV 使用与 IHVC 连接相同的技术进行连接。嫁接物 (ii) 夹在 (iii) IHVC 袖口上方。接收者 IHVC 开口 (iv) 在开口的两侧缝合到 3D 打印支架,以保持其拉伸打开。一个松散的 (v) 7-0 丝绸被绑在收件人 IHVC 周围。(B) 移植物 IHVC 的袖口 (i) 插入接收者 IHVC 中。松动的领带现在拧紧了。(C) 夹子被拆下,(i) 3D 打印支架用剪刀分离。(D) 另外 (i) 7-0 丝绸在连接周围绑着,如果不安全,但通常一条领带就足够了(PV = 门户静脉,IHVC = 红外线劣质的维纳卡瓦)。 请单击此处查看此图的较大版本。

图4:肝动脉的微血管套连接。 (A) (i) BD 支架未连接到接收方。(二) HA 支架放置在移植物中,与 (iv) 接受者的适当 HA 相连。(iii) PV 已连接。(B) 10-0 ethilon 与 (i) 弯曲的针通过 HA 支架绘制到接收者 HA 开口端的两侧。(C) 10-0 ethilon 通过 HA 支架拉回;因此,接收者适当的HA像套管一样通过支架。(D) (i) 一旦接收者的适当 HA 被拉入支架,然后将 10-0 ethilon 的领带拉入首次穿过 HA 支架的部分的支架中。(E) 此处显示的是(B)、 ( C ) 和 (D) 中描述的 HA 性腺病的示意图 (BD= 胆管、HA = 肝动脉、PV = 门户静脉)。*通过将腹腔动脉切到左胃动脉,腹腔干干的开口端变宽。 请单击此处查看此图的较大版本。

图5:使用两个支架连接胆管。 (A) (i) 移植 BD 支架插入接收方 BD,辅助 (ii) 支架松散地绑在接收方的 BD 开口位置。 (iii) PV 在 BD 连接之前连接,该连接位于 BD 后面。 (B) 接收方 BD 末端的支架被移除,用作加宽开口,以 (i) 插入与移植物相连的 BD 支架。(C) 松散固定接收支架的领带现在用于连接,(i) 另一个 7-0 丝绸用于牢固地保持支架到位,以避免支架滑倒或扭曲。 请单击此处查看此图的较大版本。

图6:移植百分比存活率。 正畸大鼠肝移植无HA重新连接(n = 8)和HA重新连接(n = 17)。动物在移植后被密切跟踪肝衰竭和/或感染的迹象至少60天。手术后未出现并发症的老鼠被视为幸存者(*p = 0.015,根据卡普兰-迈尔估计[长等级测试]计算)。 请单击此处查看此图的较大版本。

图7:肝脏组织病理学评估。 代表性的血氧素和 eosin 染色部分在动物 (A) 没有和 (B) 与肝动脉 (HA) 重新连接在第 6 天和 13 天后肝移植 (LTx).(C) 正常肝硬化显示门户三合(门户静脉,动脉和胆管),包括中央静脉的球状体,和acini。门户三合会旁边的肝细胞是1区肝细胞;球内中央静脉旁边的肝细胞为3区肝细胞;区域1和3之间的肝细胞是区域2肝细胞(ALT = 丙氨酸氨基转移酶,AST = 阿斯巴酸氨基转移酶,CV = 中央静脉)。 请单击此处查看此图的较大版本。

补充图1:支架和袖口尺寸。请单击此处查看此图的较大版本。

补充图2:肝脏组织病理学评估显示肝硬化功能中断。 在 Ltx 之后的第 54 天、第 96 天和 111 天, 没有 Ha 重新连接的动物中代表赤氧树脂素和 eosin 染色部分。 请点击这里查看这个数字的更大版本。
补充材料1:波尔塔袖口200g - 支持2.0。请单击此处查看此文件(右键单击以下载)。
补充材料2:卡瓦袖口200g - 支持2.0。请单击此处查看此文件(右键单击以下载)。
补充材料3:肝脏缩回器200g。请单击此处查看此文件(右键单击以下载)。
辅助材料 4:后架 - 1.2。请单击此处查看此文件(右键单击以下载)。
补充材料 5:卡瓦 150g - 2.1.请单击此处查看此文件(右键单击以下载)。
补充材料6:波尔塔1.4.1。请单击此处查看此文件(右键单击以下载)。
补充材料7:持有人手臂麦吉尔。请单击此处查看此文件(右键单击以下载)。
补充材料 8: 支架迷你臂 LAB.请单击此处查看此文件(右键单击以下载)。
辅助材料 9:支架和手臂软部分 1.3。请单击此处查看此文件(右键单击以下载)。
辅助材料 10:支架底座 - 3.1。请单击此处查看此文件(右键单击以下载)。
Discussion
小动物肝移植模型对于理解移植免疫力和确定新的治疗策略32年十分重要。理想的小动物肝移植模型复制人类程序的所有步骤,包括动脉瘤病。解释大鼠OLT模型的结果可能具有挑战性,因为大多数版本没有纳入HA性腺病步骤,这导致更高的并发症和发病率42。一些重建程序已经使用肾动脉,这需要切除肾脏27。该协议避免器官切除,因为它超出了人类程序中的情况。
动脉重建也可以通过操纵大鼠大动脉31进行。然而,这些方法需要广泛解剖和夹紧大动脉。如果夹紧时间延长,则接受大鼠的不良结果与近端缺血43有关。在人类中,LT手术技术涉及接受者胃肠动脉(GDA)的结扎和分裂。然而,啮齿动物的生理和解剖特征使使用这种技术移植更具生理挑战性,并可能导致并发症(即胰腺和胆管35 和胆汁泄漏44的坏死)。该协议中的动脉重新连接旨在规避这一挑战,保持管道血流,并改善接受者的结果。
前文27日曾介绍过使用套管和支架技术重建大鼠HA。在此技术中,支架用作导轨,动脉从供体腹腔躯干重建为接受者普通HA。然后,接收方共同的HA被解剖,接收方GDA被捆绑在27。因此,对接受者BD和胰腺头部下部的血液供应可能会受到影响。据认为,这一区域的附带循环往往提供血液流向胆管不足。例如,此协议首先使用微血管夹对接收方 GDA 进行测试,然后划分接收方 BD。在 GDA 夹紧时,分裂的 BD 不会出血。拆下 GDA 夹具后,观察到 BD 的轻快出血。该协议,保持良好的流量到分裂的接受者胆管,保护接受者肝脏组织的生理,提供足够的肝血液灌注和防止后OLT低氧肝损伤。
在供体方面,HA支架在移植准备期间通过从腹腔躯干、左胃动脉和血状动脉创建一个补丁,轻松插入腹腔躯干。支架可以通过宽阔的开口插入,这比尝试单独将支架插入腹腔后备箱难度要小。已发现 24 G 是用于 HA 支架的理想尺寸。支架的长度应为 1.0-1.5 mm 长,因为它充当一个敞开的门,使接收者的适当 HA 能够轻松拉入捐赠者的共同 HA。仔细注意10-0 ethilon缝合线的位置,通过这种连接的血液永远不会直接接触支架,并且接受者适当的HA会保护它从内部,减少并发症的风险。重要的是,捐赠者的HA从未被夹住,以避免血管膜。通过让捐赠者GDA开放,评估动脉重建的成功。一旦重建完成,成功的动脉瘤病就可从供体GDA中产生良好的血液流动。
在此协议中,与其他协议类似,SHVC 重新连接是最慢的步骤,并最终决定肝阶段的持续时间。随着肝病时间延长,缺血性损伤和肝功能障碍的风险增加45。OLT 大鼠模型的另一个关键组成部分是移植物、支架和袖口的大小。如果移植物太小,移植物可能会扭曲或翻转,阻碍血管连接。支架和袖口的大小可能需要根据年龄、性别、体重和大鼠的应变进行调整。这里使用的袖口的大小选择如前所述28,并使用了控制老鼠大小的袖口大小。随和期间(迄今为止:中位数 = 手术后133天,手术后最少=115天,手术后最多=161天),没有痛苦或并发症的迹象(即肝充血、水肿、腹水、腹水或血肿)。需要进一步研究,以确定PV和 IHVC的合适大小,各种大鼠菌株的年龄在和性别都值得。
这个修改的老鼠OLT协议使用3D打印袖口的PV和 IHVC,如前面所述的39,40。,40现有的PV和 IHVC 连接方法包括微缝合技术32、袖口技术46和微缝合临时夹板技术47。选择了3D打印袖口技术,因为它允许袖口的大小根据大鼠应变进行标准化,易于准备和使用。可以同时打印大量具有相同尺寸的袖口。袖口的外表面有两个凹槽,用于固定领带并防止滑倒。尾部也融入袖口设计,以便于操作袖口。总体而言,人们认为,采用 3D 打印袖口可缩短肝时间,从而提高 OLT 程序的成功率和可重复性。确定该技术也缩短了手术学习曲线。
最后,所述方案通过结合动脉重联步骤建立了一种与人体肝移植更相似的模型。该协议可以适应研究肝移植的许多免疫学和外科方面,并可以作为一个模型来测试与移植相关的新型治疗干预。
Disclosures
作者没有什么可透露的。
Acknowledgments
这项研究的资金来自UHN的多器官移植项目,以及多伦多将军和多伦多西部基金会的支持。
Materials
| Name | Company | Catalog Number | Comments |
| 10-0 Ethilon | Ethicon | 2830G | 10-0 Ethilon Black 1X5" BV100-4 Taper |
| 10mL Syringe | BD | B302995 | Luer-Lok Tip, Sterile, Disposable |
| 1mL Syringe | BD | B309628 | Luer-Lok Tip, Sterile, Disposable |
| 20mL Syringe | BD | B301031 | Luer-Lok Tip, Sterile, Disposable |
| 3D Printed Cuff for IHVC | Custom | ||
| 3D Printed Cuff for PV | Custom | ||
| 3D Printed Holder for IHVC | Custom | ||
| 3D Printed Holder for PV | Custom | ||
| 3mL Syringe | BD | B309657 | Luer-Lok Tip, Sterile, Disposable |
| 4-0 Sofsilk | Coviden | GS-835 | Wx coded braided silk, 30", Suture 1-Needle 26 mm Length 1/2 Circle Taper Point Needle |
| 5-0 Monocryl | Ethicon | Y433H | Undyed Monofilament 1X27" TF |
| 5mL Syringe | BD | B309646 | Luer-Lok Tip, Sterile, Disposable |
| 7-0 Silk | Teleflex Medical | 103-S | Black |
| 8-0 Prolene | Ethicon | 2775G | 8-0 Prolene Blue 1X24" BV130-5 EVP Double Armed |
| Barraquer Micro Needle Holder Without Catch | Aesculap Surgical Instruments | FD231R | Curved 120 mm, 4 3/4″ |
| Barraquer Needle Holder, Extra Fine Jaws 8.0mm, Curved With Out Lock | Rumex International Co. | 8-025T | Small Size, Titanium |
| Barraquer Needle Holder, Fine Jaws 12.0mm, Curved With Out Lock | Rumex International Co. | 8-021T | Small Size, Titanium |
| BD Insyte Autoguard BC 22 GA x 1.00 IN | BD Angiocath / Autoguard | 382523 | 22 G x 1.00" (0.9 mm x 25 mm) Wingless catheter, 37 mL/min |
| BDPrecisionGlide Single-use Needles: Regular Bevel - Regular Wall. | BD | B305106 | PrecisionGlide stainless-steel needles with translucent, color-coded, polypropylene hubs. 22 G |
| BD Precisionglide Syringe Needle 21G | BD | 305167 | Gauge 21, length 1.5 inch, hypodermic needle |
| BD Precisionglide Syringe Needle 30G | BD | 305128 | Gauge 30, length 1 inch, hypodermic needle |
| Betadine Solution by Purdue Products LP | Purdue Products Lp | 67618-150-17 | 10% povidone–iodine topical solution USP |
| Bupivacaine Injection BP 0.5% | SteriMax Inc. | DIN:02443694 | 0.5% (100mg/20mL) |
| Curved Tying Forceps | Duckworth & Kent | 2-501E | 6mm tying platforms, straight shafts, flat handle, length 88mm |
| DC Temperature Controller | FHC Inc. | 40-90-8D | |
| DK Iris Scissors (Curved) | Duckworth & Kent | 1-211B | Blunt tips, cut length 4mm, tip to pivot length 11mm, round handle, length 107mm |
| Ethanol, 200 proof (100%), USP, Decon Labs | Decon Labs, Inc. | 2716 | Dilute to 70% with d2H2O |
| Fine Adjustable Wire Retractor | Fine Science Tools | 17004-05 | Maximum spread: 3.5cm, Depth 5cm |
| Harvard Apparatus Isoflurane Funnel-Fill Vaporizer | Harvard Appartus Limited | 34-1040SV | |
| Heparin LEO(heparin sodium) | LEO Pharma Inc. | DIN:00453811 | 10,000 i.u./10 mL |
| Ice-Pak | Cryopak | FIP88016 | 4.00 in. x 7.00 in., thickness 1.50 inch |
| Isoflurane United States Pharmacopeia (USP) 99.9% | Piramal Healthcare Limited | DIN: 02231929 | 250 mL, Inhalation Anesthetic, NDC 66794-017-25 |
| Khaw Transconjunctival Adjustable Suture Control Forceps | Duckworth & Kent | 2-502N | 5mm highly polished tying platforms, straight shafts, flat handle, length 84mm |
| Lactate Ringer's Injected USP, 1000mL | Baxter Co. | DIN: 00061085 | JB2324 |
| McPherson Tying Forceps | Duckworth & Kent | 2-500E | 6mm tying platforms, straight shafts, flat handle, length 90mm |
| Metzenbaum Scissors - 14.5 cm | Fine Science Tools | 14024-14 | Straight Sharp/Blunt |
| Micro Kitzmiller Clamp | Scanlan | 3003-630 | Jaw length 23mm, Length 11cm |
| Microscope-Leica M525 F20 | Leica Microsystems | No catalog number | |
| Non-woven Gauze Sponges | Fisherbrand | 22-028-556 | |
| Olsen-Hegar with Suture Cutter | Fine Science Tools | 12002-14 | 15 mm cutting edge, 2mm jaw surface - 14cm |
| OptixCare Eye Lube, 25gm | OptixCare | ES-KE8O-69U1 | Formerly Optixcare Surgical Eye Lubricant |
| Piperacillin sodium salt | Sigma-Aldrich | P8396 | Penicillin analog |
| Puritan 3" Standard Cotton Swab w/Wooden Handle | Puritan Medical Products Company LLC | 803-WC | Regular Cotton Tipped Applicator with Wooden Handle |
| Round Handled Needle Holder Straight w/ Lock | Fine Science Tools | 12075-12 | Round handles allow easy fingertip adjustments - 12.5cm |
| Shea Scissors Curved Blunt | Fine Science Tools | 14105-12 | Transplant scissors with light and delicate pattern - 12cm |
| Stainless Steel Micro Serrefines Curved - 4mm | Fine Science Tools | 18055-06 | Jaw length 4mm, Jaw width 0.75mm, Total length 16mm, Jaw pressure 125g |
| Stainless Steel Micro Serrefines Curved - 6mm | Fine Science Tools | 18055-05 | Jaw length 6mm, Jaw width 1mm, Total length 17mm, Jaw pressure 100g |
| Stainless Steel Micro Serrefines Straight - 6mm | Fine Science Tools | 18055-03 | Jaw length 6mm, Jaw width 1mm, Total length 15mm, Jaw pressure 100g |
| Surgical Platform | Custom, magnetic | ||
| SurgiVet Vaporstick Anesthesia Machine | General Anesthetic Services, Inc | V7015 | |
| T/Pump Localized Therapy | Stryker | TP700 Series | |
| Vacuum-Pressure Pump | Barnant Co. | 400-1901 | |
| Vannas Scissors with Microserrations Straight | Fine Science Tools | 15070-08 | Cutting edge: 5mm, Tip diameter: 0.1mm - 8.5cm |
| Vetergesic Buprenorphine | Ceva Animal Health Ltd | NAC No.:12380352 | 0.324 mg/ml buprenorphine hydochloride Solution for Injection for Dogs and Cats |
| Vetroson V-10 Bipolar Electrosurgical Unit | Summit Hill Laboratories | No catalog number | |
| Surgical Drape | PDC Healthcare | DRP1824 | Multi-purpose sterile clear plastic, 18" x 24", 40/case |
References
- Global Observatory on Donation and Transplantation. Organ Donation and Transplantation Activities. , http://www.transplant-observatory.org/download/2016-activity-data-report (2016).
- Asrani, S. K., Devarbhavi, H., Eaton, J., Kamath, P. S. Burden of liver diseases in the world. Journal of Hepatology. 70 (1), 151-171 (2019).
- Dopazo, C., et al. Analysis of adult 20-year survivors after liver transplantation. Hepatology International. 9 (3), 461-470 (2015).
- Schoening, W. N., et al. Twenty-year longitudinal follow-up after orthotopic liver transplantation: a single-center experience of 313 consecutive cases. American Journal of Transplantation. 13 (9), 2384-2394 (2013).
- Pischke, S., et al. Factors associated with long-term survival after liver transplantation: A retrospective cohort study. World Journal of Hepatology. 9 (8), 427-435 (2017).
- Hamdani, S., et al. Delayed and short course of rapamycin prevents organ rejection after allogeneic liver transplantation in rats. World Journal of Gastroenterology. 23 (38), 6962-6972 (2017).
- Endo, K., et al. Pretransplant replacement of donor liver grafts with recipient Kupffer cells attenuates liver graft rejection in rats. Journal of Gastroenterology and Hepatology. 30 (5), 944-951 (2015).
- Zhao, Z., et al. IL-34 Inhibits Acute Rejection of Rat Liver Transplantation by Inducing Kupffer Cell M2 Polarization. Transplantation. 102 (6), e265-e274 (2018).
- Nagakawa, Y., et al. Over-expression of AIF-1 in liver allografts and peripheral blood correlates with acute rejection after transplantation in rats. American Journal of Transplantation. 4 (12), 1949-1957 (2004).
- Gao, L. H., Zeng, L. X., Chen, H. M., Wan, R. H. Cytomegalovirus infection accelerates the process of chronic rejection in rat liver transplantation. Transplantation Proceedings. 45 (6), 2536-2538 (2013).
- Wu, Y., et al. Effects of combined genes of CTLA4Ig and IDO in post-liver transplantation immune tolerance of rats. Annals of Hepatology. 15 (5), 729-737 (2016).
- He, X. S., et al. Influence of warm ischemia injury on hepatic functional status and survival of liver graft in rats. Hepatobiliary and Pancreatic Diseases International. 2 (4), 504-508 (2003).
- Tamura, A., et al. Combination effect of tacrolimus and FTY720 in liver transplantation in rats. Transplantation Proceedings. 31 (7), 2785-2786 (1999).
- Wang, Z., et al. RhGH attenuates ischemia injury of intrahepatic bile ducts relating to liver transplantation. Journal of Surgical Research. 171 (1), 300-310 (2011).
- Jiang, J. W., et al. Chronic bile duct hyperplasia is a chronic graft dysfunction following liver transplantation. World Journal of Gastroenterology. 18 (10), 1038-1047 (2012).
- Tang, Y., et al. S-Adenosylmethionine attenuates bile duct early warm ischemia reperfusion injury after rat liver transplantation. Molecular Immunology. 95, 83-90 (2018).
- Nosaka, T., Bowers, J. L., Cay, O., Clouse, M. E. Biliary complications after orthotopic liver transplantation in rats. Surgery Today. 29 (9), 963-965 (1999).
- Howden, B., Jablonski, P., Grossman, H., Marshall, V. C. The importance of the hepatic artery in rat liver transplantation. Transplantation. 47 (3), 428-431 (1989).
- Post, S., et al. The impact of arterialization on hepatic microcirculation and leukocyte accumulation after liver transplantation in the rat. Transplantation. 54 (5), 789-794 (1992).
- Hori, T., et al. Impact of hepatic arterial reconstruction on orthotopic liver transplantation in the rat. Journal of Investigative Surgery. 25 (4), 242-252 (2012).
- Zhou, S., et al. New method of stent-facilitated arterial reconstruction for orthotopic mouse liver transplantation. Journal of Surgical Research. 187 (1), 297-301 (2014).
- Noack, K., Bronk, S. F., Kato, A., Gores, G. J. The greater vulnerability of bile duct cells to reoxygenation injury than to anoxia. Implications for the pathogenesis of biliary strictures after liver transplantation. Transplantation. 56 (3), 495-500 (1993).
- Imamura, H., Rocheleau, B., Cote, J., Huet, P. M. Long-term consequence of rat orthotopic liver transplantation with and without hepatic arterial reconstruction: a clinical, pathological, and hemodynamic study. Hepatology. 26 (1), 198-205 (1997).
- Reck, T., et al. Impact of arterialization on hepatic oxygen supply, tissue energy phosphates, and outcome after liver transplantation in the rat. Transplantation. 62 (5), 582-587 (1996).
- Zhao, D., Wheatley, A. M. Orthotopic liver transplantation in the rat: comparison of models with and without rearterialization of the graft. European Surgical Research. 25 (5), 294-302 (1993).
- Chaland, P., et al. Orthotopic liver transplantation with hepatic artery anastomoses. Hemodynamics and response to hemorrhage in conscious rats. Transplantation. 49 (4), 675-678 (1990).
- Liu, X., He, C., Huang, T., Gu, J. Development of a New Technique for Reconstruction of Hepatic Artery during Liver Transplantation in Sprague-Dawley Rat. PLoS One. 10 (12), e0145662 (2015).
- Oldani, G., Lacotte, S., Morel, P., Mentha, G., Toso, C. Orthotopic liver transplantation in rats. Journal of Visualized Experiments. (65), (2012).
- Lee, S., Charters, A. C., Chandler, J. G., Orloff, M. J. A technique for orthotopic liver transplantation in the rat. Transplantation. 16 (6), 664-669 (1973).
- Kamada, N., Calne, R. Y. Orthotopic liver transplantation in the rat. Technique using cuff for portal vein anastomosis and biliary drainage. Transplantation. 28 (1), 47-50 (1979).
- Kashfi, A., et al. A review of various techniques of orthotopic liver transplantation in the rat. Transplantation Proceedings. 37 (1), 185-188 (2005).
- Chong, A. S., Alegre, M. L., Miller, M. L., Fairchild, R. L. Lessons and limits of mouse models. Cold Spring Harbor Perspectives in Medicine. 3 (12), a015495 (2013).
- Hasuike, Y., et al. A simple method for orthotopic liver transplantation with arterial reconstruction in rats. Transplantation. 45 (4), 830-832 (1988).
- Hickman, R., Engelbrecht, G. H., Duminy, F. J. A technique for liver transplantation in the rat. Transplantation. 48 (6), 1080 (1989).
- Steffen, R., Ferguson, D. M., Krom, R. A. A new method for orthotopic rat liver transplantation with arterial cuff anastomosis to the recipient common hepatic artery. Transplantation. 48 (1), 166-168 (1989).
- Shi, Y., et al. Magnetic ring anastomosis of suprahepatic vena cava: novel technique for liver transplantation in rat. Transplant International. 28 (1), 89-94 (2015).
- Dippe, B. E., et al. An improved model for rat liver transplantation including arterial reconstruction and simplified microvascular suture techniques. Journal of Investigative Surgery. 5 (4), 361-373 (1992).
- Kobayashi, E., Kamada, N., Goto, S., Miyata, M. Protocol for the technique of orthotopic liver transplantation in the rat. Microsurgery. 14 (8), 541-546 (1993).
- Oldani, G., et al. Efficient nonarterialized mouse liver transplantation using 3-dimensional-printed instruments. Liver Transplation. 22 (12), 1688-1696 (2016).
- Oldani, G., et al. Manufacturing devices and instruments for easier rat liver transplantation. Journal of Visualized Experiments. (75), e50380 (2013).
- Li, J., et al. Modified sleeve anastomosis for reconstruction of the hepatic artery in rat liver transplantation. Microsurgery. 22 (2), 62-68 (2002).
- Li, G. L., et al. High incidence of biliary complications in rat liver transplantation: can we avoid it? World Journal of Gastroenterology. 17 (26), 3140-3144 (2011).
- Zammert, M., Gelman, S. The pathophysiology of aortic cross-clamping. Best Practice and Research: Clinical Anaesthesiology. 30 (3), 257-269 (2016).
- Gao, W., Lemasters, J. J., Thurman, R. G. Development of a new method for hepatic rearterialization in rat orthotopic liver transplantation. Reduction of liver injury and improvement of surgical outcome by arterialization. Transplantation. 56 (1), 19-24 (1993).
- Ijtsma, A. J., et al. The clinical relevance of the anhepatic phase during liver transplantation. Liver Transplation. 15 (9), 1050-1055 (2009).
- Miyata, M., Fischer, J. H., Fuhs, M., Isselhard, W., Kasai, Y. A simple method for orthotopic liver transplantation in the rat. Cuff technique for three vascular anastomoses. Transplantation. 30 (5), 335-338 (1980).
- Marni, A., Ferrero, M. E. A four-technique comparative study of orthotopic liver transplantation in the rat. American Journal of Surgery. 156 (3 Pt 1), 209-213 (1988).