Complications réduites après reconnexion artérielle dans un modèle de rat de transplantation orthotopique de foie
Summary
Le but de cette étude est de modifier le modèle de greffe du foie orthotopique de rat pour mieux représenter la transplantation de foie humain et améliorer la survie des receveurs. La méthode présentée rétablit l’afflux artériel hépatique en reliant l’artère hépatique commune du foie de donneur à l’artère hépatique appropriée du foie de destinataire.
Abstract
Le modèle de transplantation orthotopique de foie de rat (OLT) est un outil puissant pour étudier le rejet aigu et chronique. Cependant, il ne s’agit pas d’une représentation complète de la transplantation humaine du foie en raison de l’absence de reconnexion artérielle. Décrit ici est une procédure de transplantation modifiée qui inclut l’incorporation de l’artère hépatique (HA) reconnexion, conduisant à une amélioration marquée des résultats de greffe. Avec un temps anhépatique moyen de 12 min et 14 s, la reconnexion d’HA entraîne une perfusion améliorée du foie transplanté et une augmentation de la survie à long terme de receveur de 37,5% à 88.2%. Ce protocole comprend l’utilisation de poignets imprimés en 3D et de supports pour connecter la veine du portail et le vena cava inférieur infrahepatique. Il peut être mis en œuvre pour l’étude de multiples aspects de la transplantation hépatique, de la réponse immunitaire et l’infection aux aspects techniques de la procédure. En incorporant une méthode simple et pratique pour la reconnexion artérielle à l’aide d’une technique microvasculaire, ce protocole olt de rat modifié imite étroitement les aspects de la transplantation hépatique humaine et servira de modèle de recherche précieux et cliniquement pertinent.
Introduction
Le fardeau mondial des maladies du foie continue d’augmenter, avec une augmentation de 30% des décès liés aux maladies du foie de 2005 à 20131,2. La transplantation hépatique est souvent le seul recours pour les patients atteints d’une maladie du foie en phase terminale. Le foie est le deuxième organe solide le plus fréquemment transplanté, et le nombre de greffes de foie effectuées dans le monde a augmenté de 7,25% de 2015 à 20161,2. Malgré sa prévalence, les taux de survie post-transplantation ont stagné3,4,5. Le taux de survie des patients à 15 ans serait de 53 %, et le taux de survie des patients à 20 ans pourrait être aussi bas que 21 %3,,5. Bien qu’il existe de nouvelles initiatives d’immunobiologie passionnantes qui peuvent mener à de nouveaux traitements et à l’amélioration des résultats cliniques, il n’existe pas encore de modèle fiable pour les petits animaux pour les tester.
Le modèle OLT de rat a été largement employé dans l’étude de la transplantation de foie, y compris le rejet6,7,8,9,10, tolérance immunisée11, greffe ischémie-reperfusion blessure12, immunosuppression13, et blessure d’arbre biliaire14,15,16,17. Cependant, un inconvénient du modèle dans sa forme actuelle est sa morbidité et sa mortalité postopératoires élevées18,19. Il s’agit d’un inconvénient sérieux qui est en contradiction avec l’opération humaine, et il compromet la capacité de tirer des conclusions cliniquement pertinentes à partir du modèle20.
En outre, une grande proportion de cette morbidité peut être attribuée à une reconnexion18de l’artère hépatique absente ou imparfaite (HA). Bien qu’une étape critique dans la transplantation humaine de foie, les difficultés techniques tendent à compromettre la reconnexion d’HA dans le modèle olt de rat. En conséquence, l’anastomose des canaux biliaires (BD) est ténue et entraîne des taux élevés de fuite de bile et de nécrose BD21. Au-delà de l’incidence élevée des complications biliaires22, une absence d’afflux artériel altère la physiologie du foie de greffe post-transplantation23, avec l’hypoxie dans la greffe du foie du donneur24 et les dommages au foie observés dans les lobes enflammés19,25,26. Rat OLT sans reconnexion artérielle tend également à promouvoir la fibrose27. Le protocole OLT de rat décrit ci-dessous aborde ces issues en incorporant une étape simple de reconstruction d’HA avec une méthode d’OLT de rat précédemment éditée,ayant pour résultat la conservation du parenchyme de foie et les taux améliorés de survie.
La transplantation hépatique comporte trois phases : (1) extraction de la greffe de foie du donneur, (2) préparation de la greffe de foie de donneur, et (3) remplacement du foie de destinataire avec la greffe de foie. La procédure implique la manipulation de cinq structures anatomiques : la vena cava inférieure suprahépatique (SHVC), la veine de portail (PV), la vena cava inférieure infrahépatique (IHVC), l’artère hépatique (HA) et le canal biliaire (BD).
OLT dans le rat a d’abord été introduit par Lee et al. en utilisant l’anastomose microsuture de la SHVC, PV et IHVC, et une technique de traction pour le BD29. Ce modèle a ensuite été amélioré grâce à l’utilisation de la technique à deux poignets en 197930. Depuis lors, plusieurs techniques alternatives ont été proposées, la majorité se concentrant sur l’anastomose veineuse et l’utilisation d’une technique à deux poignets avec quelques modifications31. Bien que l’anastomose HA ait été décrite précédemment dans le modèle OLT de rat utilisant des techniques telles que la microsuture, la manchette, et les manches intraluminales26,31,32,33,34, ces techniques exigent souvent des qualifications microchirurgicales fortement formées, modifient sensiblement la physiologie de rat, et sont entravées par la thrombose et/ou les complications biliaires27,35.,
En outre, le choix de la procédure chirurgicale peut également influencer le temps anhépatique (temps de serrage PV à la reperfusion de greffe par le PV reconstitué), qui est critique pour le succès de la transplantation hépatique de rat. Plus précisément, des taux de survie élevés sont observés avec des temps anhépatiques de 15-20 min36, et 30 min est la limite supérieure pour le succès37,38. Par conséquent, le but de cette méthode est de mettre en œuvre un modèle de rat chirurgical moins invasif et plus facilement adoptable OLT qui est en mesure de reconnecter l’artère hépatique, promouvoir la perfusion efficace du foie transplanté, maintenir le flux vers le canal biliaire receveur, et de préserver l’état physiologique du receveur.
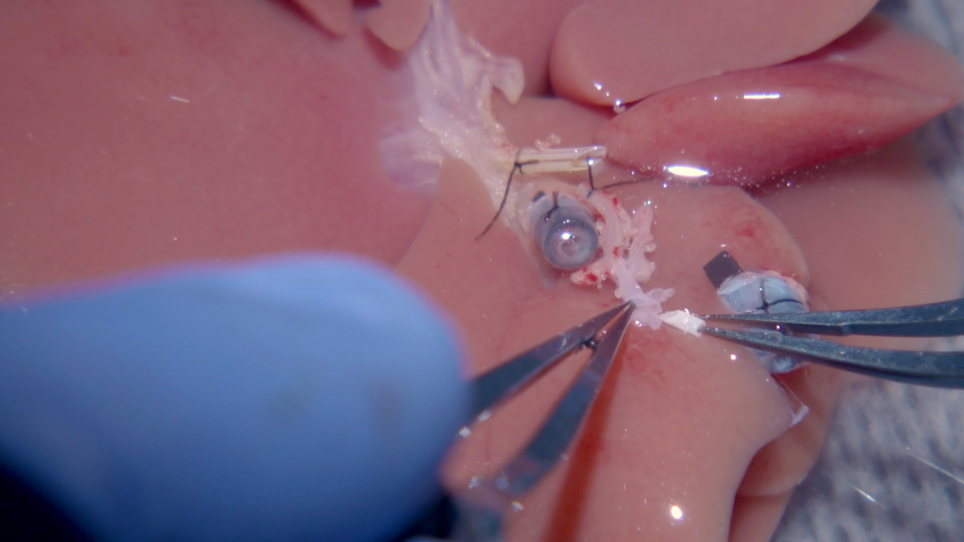
Voici toutes les étapes de ce protocole révisé, y compris la manipulation du tronc coeliaque du foie donneur ainsi que l’utilisation de 1) un stent de 1,5 mm pour effectuer une connexion extraluminale manche avec le destinataire HA approprié, 2) une suture en cours d’exécution pour la reconstruction SHVC, 3) deux manchettes en plastique imprimées en 3D pour pv et IHVC reconstruction39,40, 4) une reconnexion de manche microvasculaire pour le HA18,27,41 et 5) une technique de stenting BD précédemment décrite28. Deux étapes supplémentaires sont également incluses: une chasse d’eau froide via le PV, et un régime antibiotique qui est basé sur les résultats précédents17. Ce protocole optimisé d’OLT minimise les complications et la morbidité périopératoires et modèle plus étroitement la procédure chirurgicale d’opération employée dans la transplantation humaine de foie.
Protocol
Representative Results
Discussion
Les modèles de transplantation hépatique chez les petits animaux sont importants pour comprendre l’immunité de transplantation et identifier de nouvelles stratégies thérapeutiques32. Le modèle idéal de transplantation de foie de petit animal reproduit toutes les étapes de la procédure humaine, y compris l’anastomose artérielle. Il peut être difficile d’interpréter les résultats du modèle OLT rat, comme la plupart des versions n’intègrent pas une étape d’anastomose HA, ce qui conduit à des taux plus élevés de complications et de morbidité42. Certaines procédures de reconstruction ont utilisé l’artère rénale, qui nécessite l’ablation du rein27. Ce protocole évite l’ablation des organes, car il est au-delà de ce qui se produit dans la procédure humaine.
Les reconstructions artérielles peuvent également être effectuées en manipulant l’aorte de rat31. Cependant, ces méthodes exigent la dissection étendue et le serrage de l’aorte. Si le temps de pince est prolongé, alors le rat receveur aura de mauvais résultats liés à l’ischémie distale43. Chez l’homme, une technique chirurgicale LT implique la ligature et la division de l’artère gastro-diodenale bénéficiaire (GDA). Cependant, les caractéristiques physiologiques et anatomiques des rongeurs rendent la transplantation utilisant cette technique plus difficile physiologiquement et peuvent conduire à des complications (c.-à-d. la nécrose du pancréas et du canal biliaire35 et la fuite de bile44). La reconnexion artérielle dans ce protocole est destinée à contourner ce défi, maintenir le flux sanguin des conduits, et d’améliorer les résultats du receveur.
L’utilisation d’une manche et d’une technique de stenting pour la reconstruction du rat HA a été décrite précédemment27. Dans cette technique, un stent est employé comme guide, et l’artère est reconstruite du tronc coeliaque de donneur au HA commun de destinataire. Le destinataire ha commun est ensuite disséqué, et le destinataire GDA est attaché27. En conséquence, l’approvisionnement en sang à la partie inférieure de la BD destinataire et la tête du pancréas peut devenir compromise. On croit que la circulation collatérale vers cette région fournit souvent un flux sanguin inadéquat vers le canal biliaire. Par exemple, ce protocole teste le GDA du destinataire d’abord avec un clip microvasculaire, puis divise le BD destinataire. Avec le GDA serré, le BD divisé ne saigne pas. Après avoir enlevé la pince GDA, on observe un saignement vif de la BD. Ce protocole, qui maintient un bon flux vers le canal biliaire du destinataire divisé, protège la physiologie du tissu hépatique receveur en fournissant la perfusion sanguine hépatique adéquate et en empêchant les lésions hépatiques hypoxiques post-OLT.
Du côté du donneur, le stent HA est inséré dans le tronc coeliaque pendant la préparation de greffe avec facilité en créant un patch du tronc coeliaque, de l’artère gastrique gauche, et de l’artère splénique. Le stent peut être inséré par l’ouverture large, ce qui est moins difficile que d’essayer d’insérer le stent dans le tronc coeliaque seul. Il a été constaté que 24 G est une taille idéale à utiliser pour le stent HA. La longueur du stent doit être de 1,0 à 1,5 mm de long, car elle agit comme une porte ouverte pour permettre à l’HA appropriée du receveur d’être facilement tirée dans l’HA commune du donneur. Avec une attention particulière à l’endroit où la suture 10-0 éthilon est placé, le sang qui coule à travers cette connexion ne touchera jamais le stent directement, et ha propre du destinataire le protégera de l’intérieur, réduisant le risque de complications. Fait important, l’HA du donneur n’est jamais serré afin d’éviter le vasospasme. Le succès de la reconstruction artérielle est évalué en laissant le donneur GDA ouvert. L’anastomose réussie a commet des résultats dans le bon flux sanguin du GDA de donneur une fois que la reconstruction est terminée.
Dans ce protocole, semblable à d’autres, la reconnexion SHVC est l’étape la plus lente et dicte finalement la durée de la phase anhépatique. Comme la durée du temps anhépatique augmente, le risque de lésions ischémiques et le dysfonctionnement du foie augmentede 45. Un autre composant critique des modèles de rat OLT est la taille de la greffe, stents, et les poignets. Si la greffe est trop petite, la greffe peut se tordre ou se retourner, obstruant les connexions vasculaires. La taille des stents et des poignets peut nécessiter des ajustements en fonction de l’âge, du sexe, du poids et de la souche du rat. La taille des poignets utilisés ici a été choisie comme précédemment décrit28, et une taille de manchette qui a contrôlé pour la taille de rat a été utilisé. Il n’y avait aucun signe de détresse ou de complications (c.-à-d. congestion hépatique, œdème, ascite, ou splénomégalie) au cours de la période de suivi (à ce jour: médiane = 133 jours après l’opération, minimum = 115 jours après l’opération, maximum = 161 jours après l’opération). D’autres études visant à déterminer la taille appropriée du PV et de l’IHVC pour diverses souches de rats tenant compte de l’âge et du sexe sont justifiées.
Ce protocole OLT de rat modifié utilise des poignets imprimés en 3D pour le PV et l’IHVC, comme décrit précédemment39,40. Les méthodes existantes pour connecter le PV et l’IHVC incluent une technique de microsuture32,la technique de manchette46,et la technique d’attelle microsuture-temporaire47. La technique de manchette imprimée en 3D a été choisie, car elle permet de standardiser la taille du brassard en fonction de la souche de rat et est facile à préparer et à utiliser. De grandes quantités de poignets avec les mêmes dimensions peuvent être imprimées à la fois. La surface extérieure de la manchette a deux rainures pour aider à fixer les liens et éviter le glissement. Une queue est également incorporée dans la conception de manchette pour permettre la manipulation plus facile de la manchette. Dans l’ensemble, on croit que l’incorporation de poignets imprimés en 3D entraîne des taux de réussite élevés et une reproductibilité de la procédure OLT en raccourcissant le temps anhépatique. Il est déterminé que cette technique raccourcit également la courbe d’apprentissage chirurgical.
En conclusion, le protocole décrit a établi un modèle qui est plus semblable à la transplantation humaine de foie en incorporant une étape de reconnexion artérielle. Ce protocole peut être adapté pour étudier de nombreux aspects immunologiques et chirurgicaux de la transplantation hépatique et peut servir de modèle pour tester de nouvelles interventions thérapeutiques pertinentes à la transplantation.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Cette recherche a été financée par des fonds du programme de transplantation multiorganique de l’UHN et par le soutien de la Toronto General et de la Toronto Western Foundation.
Materials
| 10-0 Ethilon | Ethicon | 2830G | 10-0 Ethilon Black 1X5" BV100-4 Taper |
| 10mL Syringe | BD | B302995 | Luer-Lok Tip, Sterile, Disposable |
| 1mL Syringe | BD | B309628 | Luer-Lok Tip, Sterile, Disposable |
| 20mL Syringe | BD | B301031 | Luer-Lok Tip, Sterile, Disposable |
| 3D Printed Cuff for IHVC | Custom | ||
| 3D Printed Cuff for PV | Custom | ||
| 3D Printed Holder for IHVC | Custom | ||
| 3D Printed Holder for PV | Custom | ||
| 3mL Syringe | BD | B309657 | Luer-Lok Tip, Sterile, Disposable |
| 4-0 Sofsilk | Coviden | GS-835 | Wx coded braided silk, 30", Suture 1-Needle 26 mm Length 1/2 Circle Taper Point Needle |
| 5-0 Monocryl | Ethicon | Y433H | Undyed Monofilament 1X27" TF |
| 5mL Syringe | BD | B309646 | Luer-Lok Tip, Sterile, Disposable |
| 7-0 Silk | Teleflex Medical | 103-S | Black |
| 8-0 Prolene | Ethicon | 2775G | 8-0 Prolene Blue 1X24" BV130-5 EVP Double Armed |
| Barraquer Micro Needle Holder Without Catch | Aesculap Surgical Instruments | FD231R | Curved 120 mm, 4 3/4″ |
| Barraquer Needle Holder, Extra Fine Jaws 8.0mm, Curved With Out Lock | Rumex International Co. | 8-025T | Small Size, Titanium |
| Barraquer Needle Holder, Fine Jaws 12.0mm, Curved With Out Lock | Rumex International Co. | 8-021T | Small Size, Titanium |
| BD Insyte Autoguard BC 22 GA x 1.00 IN | BD Angiocath / Autoguard | 382523 | 22 G x 1.00" (0.9 mm x 25 mm) Wingless catheter, 37 mL/min |
| BDPrecisionGlide Single-use Needles: Regular Bevel – Regular Wall. | BD | B305106 | PrecisionGlide stainless-steel needles with translucent, color-coded, polypropylene hubs. 22 G |
| BD Precisionglide Syringe Needle 21G | BD | 305167 | Gauge 21, length 1.5 inch, hypodermic needle |
| BD Precisionglide Syringe Needle 30G | BD | 305128 | Gauge 30, length 1 inch, hypodermic needle |
| Betadine Solution by Purdue Products LP | Purdue Products Lp | 67618-150-17 | 10% povidone–iodine topical solution USP |
| Bupivacaine Injection BP 0.5% | SteriMax Inc. | DIN:02443694 | 0.5% (100mg/20mL) |
| Curved Tying Forceps | Duckworth & Kent | 2-501E | 6mm tying platforms, straight shafts, flat handle, length 88mm |
| DC Temperature Controller | FHC Inc. | 40-90-8D | |
| DK Iris Scissors (Curved) | Duckworth & Kent | 1-211B | Blunt tips, cut length 4mm, tip to pivot length 11mm, round handle, length 107mm |
| Ethanol, 200 proof (100%), USP, Decon Labs | Decon Labs, Inc. | 2716 | Dilute to 70% with d2H2O |
| Fine Adjustable Wire Retractor | Fine Science Tools | 17004-05 | Maximum spread: 3.5cm, Depth 5cm |
| Harvard Apparatus Isoflurane Funnel-Fill Vaporizer | Harvard Appartus Limited | 34-1040SV | |
| Heparin LEO(heparin sodium) | LEO Pharma Inc. | DIN:00453811 | 10,000 i.u./10 mL |
| Ice-Pak | Cryopak | FIP88016 | 4.00 in. x 7.00 in., thickness 1.50 inch |
| Isoflurane United States Pharmacopeia (USP) 99.9% | Piramal Healthcare Limited | DIN: 02231929 | 250 mL, Inhalation Anesthetic, NDC 66794-017-25 |
| Khaw Transconjunctival Adjustable Suture Control Forceps | Duckworth & Kent | 2-502N | 5mm highly polished tying platforms, straight shafts, flat handle, length 84mm |
| Lactate Ringer's Injected USP, 1000mL | Baxter Co. | DIN: 00061085 | JB2324 |
| McPherson Tying Forceps | Duckworth & Kent | 2-500E | 6mm tying platforms, straight shafts, flat handle, length 90mm |
| Metzenbaum Scissors – 14.5 cm | Fine Science Tools | 14024-14 | Straight Sharp/Blunt |
| Micro Kitzmiller Clamp | Scanlan | 3003-630 | Jaw length 23mm, Length 11cm |
| Microscope-Leica M525 F20 | Leica Microsystems | No catalog number | |
| Non-woven Gauze Sponges | Fisherbrand | 22-028-556 | |
| Olsen-Hegar with Suture Cutter | Fine Science Tools | 12002-14 | 15 mm cutting edge, 2mm jaw surface – 14cm |
| OptixCare Eye Lube, 25gm | OptixCare | ES-KE8O-69U1 | Formerly Optixcare Surgical Eye Lubricant |
| Piperacillin sodium salt | Sigma-Aldrich | P8396 | Penicillin analog |
| Puritan 3" Standard Cotton Swab w/Wooden Handle | Puritan Medical Products Company LLC | 803-WC | Regular Cotton Tipped Applicator with Wooden Handle |
| Round Handled Needle Holder Straight w/ Lock | Fine Science Tools | 12075-12 | Round handles allow easy fingertip adjustments – 12.5cm |
| Shea Scissors Curved Blunt | Fine Science Tools | 14105-12 | Transplant scissors with light and delicate pattern – 12cm |
| Stainless Steel Micro Serrefines Curved – 4mm | Fine Science Tools | 18055-06 | Jaw length 4mm, Jaw width 0.75mm, Total length 16mm, Jaw pressure 125g |
| Stainless Steel Micro Serrefines Curved – 6mm | Fine Science Tools | 18055-05 | Jaw length 6mm, Jaw width 1mm, Total length 17mm, Jaw pressure 100g |
| Stainless Steel Micro Serrefines Straight – 6mm | Fine Science Tools | 18055-03 | Jaw length 6mm, Jaw width 1mm, Total length 15mm, Jaw pressure 100g |
| Surgical Platform | Custom, magnetic | ||
| SurgiVet Vaporstick Anesthesia Machine | General Anesthetic Services, Inc | V7015 | |
| T/Pump Localized Therapy | Stryker | TP700 Series | |
| Vacuum-Pressure Pump | Barnant Co. | 400-1901 | |
| Vannas Scissors with Microserrations Straight | Fine Science Tools | 15070-08 | Cutting edge: 5mm, Tip diameter: 0.1mm – 8.5cm |
| Vetergesic Buprenorphine | Ceva Animal Health Ltd | NAC No.:12380352 | 0.324 mg/ml buprenorphine hydochloride Solution for Injection for Dogs and Cats |
| Vetroson V-10 Bipolar Electrosurgical Unit | Summit Hill Laboratories | No catalog number |
References
- Asrani, S. K., Devarbhavi, H., Eaton, J., Kamath, P. S. Burden of liver diseases in the world. Journal of Hepatology. 70 (1), 151-171 (2019).
- Dopazo, C., et al. Analysis of adult 20-year survivors after liver transplantation. Hepatology International. 9 (3), 461-470 (2015).
- Schoening, W. N., et al. Twenty-year longitudinal follow-up after orthotopic liver transplantation: a single-center experience of 313 consecutive cases. American Journal of Transplantation. 13 (9), 2384-2394 (2013).
- Pischke, S., et al. Factors associated with long-term survival after liver transplantation: A retrospective cohort study. World Journal of Hepatology. 9 (8), 427-435 (2017).
- Hamdani, S., et al. Delayed and short course of rapamycin prevents organ rejection after allogeneic liver transplantation in rats. World Journal of Gastroenterology. 23 (38), 6962-6972 (2017).
- Endo, K., et al. Pretransplant replacement of donor liver grafts with recipient Kupffer cells attenuates liver graft rejection in rats. Journal of Gastroenterology and Hepatology. 30 (5), 944-951 (2015).
- Zhao, Z., et al. IL-34 Inhibits Acute Rejection of Rat Liver Transplantation by Inducing Kupffer Cell M2 Polarization. Transplantation. 102 (6), e265-e274 (2018).
- Nagakawa, Y., et al. Over-expression of AIF-1 in liver allografts and peripheral blood correlates with acute rejection after transplantation in rats. American Journal of Transplantation. 4 (12), 1949-1957 (2004).
- Gao, L. H., Zeng, L. X., Chen, H. M., Wan, R. H. Cytomegalovirus infection accelerates the process of chronic rejection in rat liver transplantation. Transplantation Proceedings. 45 (6), 2536-2538 (2013).
- Wu, Y., et al. Effects of combined genes of CTLA4Ig and IDO in post-liver transplantation immune tolerance of rats. Annals of Hepatology. 15 (5), 729-737 (2016).
- He, X. S., et al. Influence of warm ischemia injury on hepatic functional status and survival of liver graft in rats. Hepatobiliary and Pancreatic Diseases International. 2 (4), 504-508 (2003).
- Tamura, A., et al. Combination effect of tacrolimus and FTY720 in liver transplantation in rats. Transplantation Proceedings. 31 (7), 2785-2786 (1999).
- Wang, Z., et al. RhGH attenuates ischemia injury of intrahepatic bile ducts relating to liver transplantation. Journal of Surgical Research. 171 (1), 300-310 (2011).
- Jiang, J. W., et al. Chronic bile duct hyperplasia is a chronic graft dysfunction following liver transplantation. World Journal of Gastroenterology. 18 (10), 1038-1047 (2012).
- Tang, Y., et al. S-Adenosylmethionine attenuates bile duct early warm ischemia reperfusion injury after rat liver transplantation. Molecular Immunology. 95, 83-90 (2018).
- Nosaka, T., Bowers, J. L., Cay, O., Clouse, M. E. Biliary complications after orthotopic liver transplantation in rats. Surgery Today. 29 (9), 963-965 (1999).
- Howden, B., Jablonski, P., Grossman, H., Marshall, V. C. The importance of the hepatic artery in rat liver transplantation. Transplantation. 47 (3), 428-431 (1989).
- Post, S., et al. The impact of arterialization on hepatic microcirculation and leukocyte accumulation after liver transplantation in the rat. Transplantation. 54 (5), 789-794 (1992).
- Hori, T., et al. Impact of hepatic arterial reconstruction on orthotopic liver transplantation in the rat. Journal of Investigative Surgery. 25 (4), 242-252 (2012).
- Zhou, S., et al. New method of stent-facilitated arterial reconstruction for orthotopic mouse liver transplantation. Journal of Surgical Research. 187 (1), 297-301 (2014).
- Noack, K., Bronk, S. F., Kato, A., Gores, G. J. The greater vulnerability of bile duct cells to reoxygenation injury than to anoxia. Implications for the pathogenesis of biliary strictures after liver transplantation. Transplantation. 56 (3), 495-500 (1993).
- Imamura, H., Rocheleau, B., Cote, J., Huet, P. M. Long-term consequence of rat orthotopic liver transplantation with and without hepatic arterial reconstruction: a clinical, pathological, and hemodynamic study. Hepatology. 26 (1), 198-205 (1997).
- Reck, T., et al. Impact of arterialization on hepatic oxygen supply, tissue energy phosphates, and outcome after liver transplantation in the rat. Transplantation. 62 (5), 582-587 (1996).
- Zhao, D., Wheatley, A. M. Orthotopic liver transplantation in the rat: comparison of models with and without rearterialization of the graft. European Surgical Research. 25 (5), 294-302 (1993).
- Chaland, P., et al. Orthotopic liver transplantation with hepatic artery anastomoses. Hemodynamics and response to hemorrhage in conscious rats. Transplantation. 49 (4), 675-678 (1990).
- Liu, X., He, C., Huang, T., Gu, J. Development of a New Technique for Reconstruction of Hepatic Artery during Liver Transplantation in Sprague-Dawley Rat. PLoS One. 10 (12), e0145662 (2015).
- Oldani, G., Lacotte, S., Morel, P., Mentha, G., Toso, C. Orthotopic liver transplantation in rats. Journal of Visualized Experiments. (65), (2012).
- Lee, S., Charters, A. C., Chandler, J. G., Orloff, M. J. A technique for orthotopic liver transplantation in the rat. Transplantation. 16 (6), 664-669 (1973).
- Kamada, N., Calne, R. Y. Orthotopic liver transplantation in the rat. Technique using cuff for portal vein anastomosis and biliary drainage. Transplantation. 28 (1), 47-50 (1979).
- Kashfi, A., et al. A review of various techniques of orthotopic liver transplantation in the rat. Transplantation Proceedings. 37 (1), 185-188 (2005).
- Chong, A. S., Alegre, M. L., Miller, M. L., Fairchild, R. L. Lessons and limits of mouse models. Cold Spring Harbor Perspectives in Medicine. 3 (12), a015495 (2013).
- Hasuike, Y., et al. A simple method for orthotopic liver transplantation with arterial reconstruction in rats. Transplantation. 45 (4), 830-832 (1988).
- Hickman, R., Engelbrecht, G. H., Duminy, F. J. A technique for liver transplantation in the rat. Transplantation. 48 (6), 1080 (1989).
- Steffen, R., Ferguson, D. M., Krom, R. A. A new method for orthotopic rat liver transplantation with arterial cuff anastomosis to the recipient common hepatic artery. Transplantation. 48 (1), 166-168 (1989).
- Shi, Y., et al. Magnetic ring anastomosis of suprahepatic vena cava: novel technique for liver transplantation in rat. Transplant International. 28 (1), 89-94 (2015).
- Dippe, B. E., et al. An improved model for rat liver transplantation including arterial reconstruction and simplified microvascular suture techniques. Journal of Investigative Surgery. 5 (4), 361-373 (1992).
- Kobayashi, E., Kamada, N., Goto, S., Miyata, M. Protocol for the technique of orthotopic liver transplantation in the rat. Microsurgery. 14 (8), 541-546 (1993).
- Oldani, G., et al. Efficient nonarterialized mouse liver transplantation using 3-dimensional-printed instruments. Liver Transplation. 22 (12), 1688-1696 (2016).
- Oldani, G., et al. Manufacturing devices and instruments for easier rat liver transplantation. Journal of Visualized Experiments. (75), e50380 (2013).
- Li, J., et al. Modified sleeve anastomosis for reconstruction of the hepatic artery in rat liver transplantation. Microsurgery. 22 (2), 62-68 (2002).
- Li, G. L., et al. High incidence of biliary complications in rat liver transplantation: can we avoid it?. World Journal of Gastroenterology. 17 (26), 3140-3144 (2011).
- Zammert, M., Gelman, S. The pathophysiology of aortic cross-clamping. Best Practice and Research: Clinical Anaesthesiology. 30 (3), 257-269 (2016).
- Gao, W., Lemasters, J. J., Thurman, R. G. Development of a new method for hepatic rearterialization in rat orthotopic liver transplantation. Reduction of liver injury and improvement of surgical outcome by arterialization. Transplantation. 56 (1), 19-24 (1993).
- Ijtsma, A. J., et al. The clinical relevance of the anhepatic phase during liver transplantation. Liver Transplation. 15 (9), 1050-1055 (2009).
- Miyata, M., Fischer, J. H., Fuhs, M., Isselhard, W., Kasai, Y. A simple method for orthotopic liver transplantation in the rat. Cuff technique for three vascular anastomoses. Transplantation. 30 (5), 335-338 (1980).
- Marni, A., Ferrero, M. E. A four-technique comparative study of orthotopic liver transplantation in the rat. American Journal of Surgery. 156 (3 Pt 1), 209-213 (1988).