Verminderde complicaties na arteriële heraansluiting in een ratmodel van orthotopische levertransplantatie
Summary
Het doel van deze studie is om de rat orthotopische levertransplantatie model te wijzigen om beter te vertegenwoordigen menselijke levertransplantatie en verbetering van de overleving van de ontvanger. De gepresenteerde methode hersteld leverslagaderlijke instroom door het aansluiten van de donor lever gemeenschappelijke lever slagader aan de juiste lever van de ontvanger slagaderslagader.
Abstract
Het rat orthotopische levertransplantatie (OLT) model is een krachtig hulpmiddel om acute en chronische afstoting te bestuderen. Het is echter geen volledige weergave van menselijke levertransplantatie als gevolg van de afwezigheid van arteriële heraansluiting. Hier beschreven is een gewijzigde transplantatie procedure die de integratie van leverslagader (HA) reconnectie omvat, wat leidt tot een duidelijke verbetering van de transplantatie resultaten. Met een gemiddelde anhepatische tijd van 12 min en 14 s resulteert HA reconnectie in een verbeterde perfusie van de getransplanteerde lever en een toename van de overlevingskans op lange termijn van 37,5% naar 88,2%. Dit protocol omvat het gebruik van 3D-geprinte manchetten en houders om de portaalader en infrahepatische inferieure vena cava aan te sluiten. Het kan worden uitgevoerd voor het bestuderen van meerdere aspecten van levertransplantatie, van immuunrespons en infectie tot technische aspecten van de procedure. Door het opnemen van een eenvoudige en praktische methode voor arteriële herconnectie met behulp van een microvasculaire techniek, dit gemodificeerde rat OLT protocol nauw nabootst aspecten van menselijke levertransplantatie en zal dienen als een waardevol en klinisch relevant onderzoeksmodel.
Introduction
De wereldwijde last van leverziekte blijft toenemen, met een stijging van 30% van de sterfgevallen aan leverziekten van 2005 tot 20131,2. Levertransplantatie is vaak het enige beroep voor patiënten met een leverziekte in het eindstadium. De lever is het op één na meest getransplanteerde vaste orgaan en het aantal wereldwijd uitgevoerde levertransplantaties steeg van 2015 tot 2016 met 7,25%1,2. Ondanks de prevalentie zijn de overlevingskansen na transplantatie gestagneerd3,4,5. De overlevingskans van 15 jaar patiënt wordt gemeld op 53%, en de 20-jarige patiënt overlevingskans kan zo laag zijn als 21%3,5. Hoewel er spannende nieuwe immunobiologie-initiatieven zijn die kunnen leiden tot nieuwe behandelingen en verbeterde klinische resultaten, is er nog geen betrouwbaar klein diermodel om ze te testen.
Het rat OLT-model is veel gebruikt bij het onderzoek naar levertransplantatie, waaronder afstoting6,7,8,9,10, immuuntolerantie11, transplantatie-reperfusieletsel12, immunosuppressie13en galboomletsel14,15,16,17. Een nadeel van het model in zijn huidige vorm is echter de hoge postoperatieve morbiditeit en mortaliteit18,19. Dit is een ernstig nadeel dat in strijd is met de menselijke operatie, en het compromitteert het vermogen om klinisch relevante conclusies te trekken uit het model20.
Bovendien kan een groot deel van deze morbiditeit worden toegeschreven aan een afwezige of onvolmaakte leverslagader (HA) reconnectie18. Hoewel een kritieke stap in menselijke levertransplantatie, hebben technische problemen de neiging om HA heraansluiting in het rat OLT-model in gevaar te brengen. Als gevolg hiervan is galkanaal (BD) anastomose zwak en resulteert dit in hoge percentages gallekkage en BD-necrose21. Naast de hoge incidentie van galcomplicaties22verandert een afwezigheid van arteriële instroom de fysiologie van de transplantaat lever na transplantatie23, met hypoxie in de donorlevertransplantt24 en leverschade waargenomen bij ontstoken lobben19,25,26. Rat OLT zonder arteriële heraansluiting heeft ook de neiging om fibrose27te bevorderen. Het hieronder beschreven rat OLT-protocol pakt deze problemen aan door een eenvoudige HA-reconstructiestap op te nemen met een eerder gepubliceerde rat OLT-methode28, wat resulteert in het behoud van lever parenchyma en verbeterde overlevingskansen.
Levertransplantatie heeft drie fasen: (1) extractie van het levertransplantaat van de donor, (2) voorbereiding van de donorlevertransplantt, en (3) vervanging van de ontvangende lever met de levertransplantatie. De procedure omvat de manipulatie van vijf anatomische structuren: de suprahepatische inferieure vena cava (SHVC), portaalader (PV), infrahepatische inferieure vena cava (IHVC), leverslagader (HA) en galkanaal (BD).
OLT in de rat werd voor het eerst geïntroduceerd door Lee et al. met behulp van microsuture anastomose van de SHVC, PV en IHVC, en een pull-through techniek voor de BD29. Dit model werd later verbeterd door het gebruik van de twee-manchet techniek in 197930. Sindsdien zijn verschillende alternatieve technieken voorgesteld, waarbij de meerderheid zich richt op veneuze anastomose en met behulp van een twee-manchettechniek met een paar wijzigingen31. Hoewel HA-anastomose eerder in het rat OLT-model is beschreven met behulp van technieken zoals microsuture, manchet en intraluminale mouwen26,,31,32,33,34, vereisen deze technieken vaak zeer getrainde microchirurgische vaardigheden, veranderen de rattenfysiologie aanzienlijk en worden ze belemmerd door trombose en/of biliaire complicaties27,35.
Bovendien kan de keuze van chirurgische ingreep ook de anhepatische tijd beïnvloeden (tijd van PV-klemmen tot reperfusie van graft via de gereconstitueerde PV), wat cruciaal is voor het succes van rattenlevertransplantatie. In het bijzonder worden hoge overlevingskansen waargenomen met anhepatische tijden van 15-20 min36, en 30 min is de bovengrens voor succes37,38. Daarom is het doel van deze methode is om een minder invasieve en gemakkelijker aanneembare chirurgische rat OLT-model dat in staat is om de leverslagader opnieuw te verbinden implementeren, het bevorderen van efficiënte perfusie van de getransplanteerde lever, handhaven stroom naar de ontvanger galkanaal, en het behoud van de ontvanger fysiologische conditie.
Hier beschreven zijn alle stappen van dit herziene protocol, met inbegrip van de manipulatie van de coeliakie stam van de donor lever evenals het gebruik van 1) een 1,5 mm stent om een extraluminale mouw verbinding met de ontvanger juiste HA uit te voeren, 2) een lopende hechting voor de SHVC reconstructie, 3) twee 3D-geprinte plastic manchetten voor PV en IHVC reconstructie39,40, 4) een microvasculaire mouw heraansluiting voor de HA18,27,41 en 5) een eerder beschreven BD stenting techniek28. Twee extra stappen zijn ook opgenomen: een cold flush via de PV, en een antibioticum regime dat is gebaseerd op eerdere bevindingen17. Dit geoptimaliseerde OLT-protocol minimaliseert perioperatieve complicaties en morbiditeit en modelleert nauwer de chirurgische operatieprocedure die wordt gebruikt bij menselijke levertransplantatie.
Protocol
Representative Results
Discussion
Kleine dierlijke levertransplantatie modellen zijn belangrijk voor het begrijpen van transplantatie immuniteit en het identificeren van nieuwe therapeutische strategieën32. Het ideale kleine dierlijke levertransplantatiemodel repliceert alle stappen van de menselijke procedure, inclusief arteriële anastomose. Het kan een uitdaging zijn om resultaten van het rat OLT-model te interpreteren, omdat de meeste versies geen HA-anastomosestap bevatten, wat leidt tot hogere percentages complicaties en morbiditeit42. Sommige reconstructieprocedures hebben gebruik gemaakt van de nierslagader, die verwijdering van de nier27vereist. Dit protocol vermijdt orgaanverwijdering, omdat het verder gaat dan wat er in de menselijke procedure gebeurt.
Arteriële reconstructies kunnen ook worden uitgevoerd door het manipuleren van de rat aorta31. Deze methoden vereisen echter uitgebreide dissectie en klemmen van de aorta. Als de klemtijd wordt verlengd, zal de ontvangende rat slechte resultaten hebben in verband met distale ischemie43. Bij mensen, een LT chirurgische techniek omvat de ligatie en de verdeling van de ontvanger gastroduodenal slagader (GDA). Echter, de fysiologische en anatomische kenmerken van knaagdieren maken transplantatie met behulp van deze techniek meer fysiologisch uitdagend en kan leiden tot complicaties (dat wil zeggen, necrose van de alvleesklier en galkanaal35 en gallekkage44). De arteriële heraansluiting in dit protocol is bedoeld om deze uitdaging te omzeilen, de bloedstroom van het kanaal te handhaven en de uitkomst van de ontvanger te verbeteren.
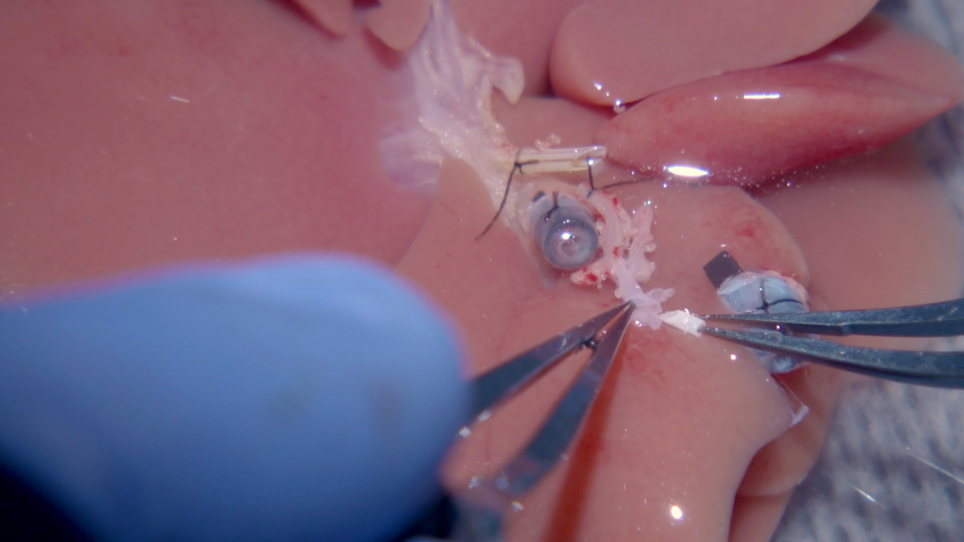
Het gebruik van een mouw en stenting techniek voor de wederopbouw van de rat HA is eerder beschreven27. In deze techniek wordt een stent gebruikt als een gids, en de slagader wordt gereconstrueerd van de donor coeliakie stam aan de ontvanger gemeenschappelijke HA. De ontvanger gemeenschappelijke HA wordt vervolgens ontleed, en de ontvanger GDA is gebonden27. Als gevolg hiervan kan de bloedtoevoer naar het onderste deel van de ontvanger BD en het hoofd van de alvleesklier in het gedrang komen. Er wordt aangenomen dat de bijkomende circulatie naar dit gebied vaak onvoldoende bloedtoevoer naar de galwegen biedt. Bijvoorbeeld, dit protocol test-klemt de ontvanger GDA eerst met een microvasculaire clip, dan verdeelt de ontvanger BD. Met de GDA geklemd, bloedt de verdeelde BD niet. Na het verwijderen van de GDA klem, stevige bloeden uit de BD wordt waargenomen. Dit protocol, dat een goede doorstroming naar de verdeelde ontvanger galkanaal onderhoudt, beschermt de fysiologie van de ontvanger leverweefsel door het verstrekken van voldoende leverbloed perfusie en het voorkomen van post-OLT hypoxische leverletsel.
Aan de donorzijde wordt de HA-stent tijdens de graftpreparaat met gemak in de celeperaming gestoken door een pleister te maken van de selderij, linker maagslagader en miltslagader. De stent kan worden ingevoegd door de brede opening, die minder moeilijk is dan het proberen om de stent in de coeliakie stam alleen. Het is gebleken dat 24 G is een ideale grootte om te gebruiken voor de HA stent. De lengte van de stent moet 1,0-1,5 mm lang zijn, omdat deze fungeert als een open poort om de juiste HA van de ontvanger gemakkelijk in de gemeenschappelijke HA van de donor te laten trekken. Met zorgvuldige aandacht voor waar de 10-0 ethilon hechting wordt geplaatst, bloed stroomt door deze verbinding zal nooit direct raken de stent, en de ontvanger de juiste HA zal beschermen van binnenuit, het verminderen van het risico op complicaties. Belangrijk is dat de HA van de donor nooit wordt geklemd om vasospasme te voorkomen. Het succes van arteriële reconstructie wordt geëvalueerd door de donor GDA open te laten. Succesvolle anastomose resulteert in een goede bloedstroom van de donor GDA zodra de reconstructie is voltooid.
In dit protocol, vergelijkbaar met anderen, SHVC opnieuw verbinden is de langzaamste stap en uiteindelijk dicteert de duur van de anhepatische fase. Naarmate de duur van de anhepatische tijd toeneemt, neemt het risico ischemische letsel en leverdisfunctie toemet 45. Een ander essentieel onderdeel van OLT rat modellen is de grootte van de graft, stents, en manchetten. Als het transplantaat te klein is, kan het transplantaat draaien of spiegelen, waardoor de vasculaire verbindingen worden belemmerd. De grootte van de stents en manchetten kan aanpassingen vereisen afhankelijk van de leeftijd, geslacht, gewicht en stam van de rat. De grootte van de manchetten die hier werden gebruikt werd gekozen zoals eerder beschreven28, en een manchet grootte die gecontroleerd voor rat grootte werd gebruikt. Er waren geen tekenen van nood of complicaties (d.w.z. levercongestie, oedeem, ascites of splenomegaly) tijdens de follow-upperiode (tot op heden: mediaan = 133 dagen na de operatie, minimum = 115 dagen na de operatie, maximum = 161 dagen na de operatie). Verdere studies om de geschikte grootte van PV en IHVC voor verschillende rattenstammen die zowel leeftijd als geslacht uitmaken te bepalen zijn gerechtvaardigd.
Dit gewijzigde rat OLT-protocol maakt gebruik van 3D-geprinte manchetten voor de PV en IHVC, zoals eerder beschreven39,40. Bestaande methoden voor het aansluiten van de PV en IHVC omvatten een microsuture techniek32, manchettechniek46, en microsuture-tijdelijke spalktechniek47. De 3D-geprinte manchettechniek is gekozen, omdat hiermee de grootte van de manchet kan worden gestandaardiseerd op basis van rattenstam en gemakkelijk te bereiden en te gebruiken is. Grote hoeveelheden manchetten met dezelfde afmetingen kunnen in één keer worden afgedrukt. Het buitenoppervlak van de manchet heeft twee groeven om te helpen met het vastzetten van banden en het voorkomen van uitglijden. Een staart is ook opgenomen in de manchet ontwerp om gemakkelijker manipulatie van de manchet mogelijk te maken. Over het geheel genomen wordt aangenomen dat de integratie van 3D-geprinte manchetten leidt tot hoge slagingspercentages en reproduceerbaarheid van de OLT-procedure door het verkorten van de anhepatische tijd. Er wordt bepaald dat deze techniek ook de chirurgische leercurve verkort.
Tot slot, de beschreven protocol een model dat meer lijkt op menselijke levertransplantatie door de integratie van een arteriële heraansluiting stap. Dit protocol kan worden aangepast om vele immunologische en chirurgische aspecten van levertransplantatie te bestuderen en kan dienen als een model om nieuwe therapeutische interventies te testen die relevant zijn voor transplantatie.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dit onderzoek werd gefinancierd door middel van fondsen van de Multi-Organ transplantatie programma aan de UHN en steun van de Toronto General en Toronto Western Foundation.
Materials
| 10-0 Ethilon | Ethicon | 2830G | 10-0 Ethilon Black 1X5" BV100-4 Taper |
| 10mL Syringe | BD | B302995 | Luer-Lok Tip, Sterile, Disposable |
| 1mL Syringe | BD | B309628 | Luer-Lok Tip, Sterile, Disposable |
| 20mL Syringe | BD | B301031 | Luer-Lok Tip, Sterile, Disposable |
| 3D Printed Cuff for IHVC | Custom | ||
| 3D Printed Cuff for PV | Custom | ||
| 3D Printed Holder for IHVC | Custom | ||
| 3D Printed Holder for PV | Custom | ||
| 3mL Syringe | BD | B309657 | Luer-Lok Tip, Sterile, Disposable |
| 4-0 Sofsilk | Coviden | GS-835 | Wx coded braided silk, 30", Suture 1-Needle 26 mm Length 1/2 Circle Taper Point Needle |
| 5-0 Monocryl | Ethicon | Y433H | Undyed Monofilament 1X27" TF |
| 5mL Syringe | BD | B309646 | Luer-Lok Tip, Sterile, Disposable |
| 7-0 Silk | Teleflex Medical | 103-S | Black |
| 8-0 Prolene | Ethicon | 2775G | 8-0 Prolene Blue 1X24" BV130-5 EVP Double Armed |
| Barraquer Micro Needle Holder Without Catch | Aesculap Surgical Instruments | FD231R | Curved 120 mm, 4 3/4″ |
| Barraquer Needle Holder, Extra Fine Jaws 8.0mm, Curved With Out Lock | Rumex International Co. | 8-025T | Small Size, Titanium |
| Barraquer Needle Holder, Fine Jaws 12.0mm, Curved With Out Lock | Rumex International Co. | 8-021T | Small Size, Titanium |
| BD Insyte Autoguard BC 22 GA x 1.00 IN | BD Angiocath / Autoguard | 382523 | 22 G x 1.00" (0.9 mm x 25 mm) Wingless catheter, 37 mL/min |
| BDPrecisionGlide Single-use Needles: Regular Bevel – Regular Wall. | BD | B305106 | PrecisionGlide stainless-steel needles with translucent, color-coded, polypropylene hubs. 22 G |
| BD Precisionglide Syringe Needle 21G | BD | 305167 | Gauge 21, length 1.5 inch, hypodermic needle |
| BD Precisionglide Syringe Needle 30G | BD | 305128 | Gauge 30, length 1 inch, hypodermic needle |
| Betadine Solution by Purdue Products LP | Purdue Products Lp | 67618-150-17 | 10% povidone–iodine topical solution USP |
| Bupivacaine Injection BP 0.5% | SteriMax Inc. | DIN:02443694 | 0.5% (100mg/20mL) |
| Curved Tying Forceps | Duckworth & Kent | 2-501E | 6mm tying platforms, straight shafts, flat handle, length 88mm |
| DC Temperature Controller | FHC Inc. | 40-90-8D | |
| DK Iris Scissors (Curved) | Duckworth & Kent | 1-211B | Blunt tips, cut length 4mm, tip to pivot length 11mm, round handle, length 107mm |
| Ethanol, 200 proof (100%), USP, Decon Labs | Decon Labs, Inc. | 2716 | Dilute to 70% with d2H2O |
| Fine Adjustable Wire Retractor | Fine Science Tools | 17004-05 | Maximum spread: 3.5cm, Depth 5cm |
| Harvard Apparatus Isoflurane Funnel-Fill Vaporizer | Harvard Appartus Limited | 34-1040SV | |
| Heparin LEO(heparin sodium) | LEO Pharma Inc. | DIN:00453811 | 10,000 i.u./10 mL |
| Ice-Pak | Cryopak | FIP88016 | 4.00 in. x 7.00 in., thickness 1.50 inch |
| Isoflurane United States Pharmacopeia (USP) 99.9% | Piramal Healthcare Limited | DIN: 02231929 | 250 mL, Inhalation Anesthetic, NDC 66794-017-25 |
| Khaw Transconjunctival Adjustable Suture Control Forceps | Duckworth & Kent | 2-502N | 5mm highly polished tying platforms, straight shafts, flat handle, length 84mm |
| Lactate Ringer's Injected USP, 1000mL | Baxter Co. | DIN: 00061085 | JB2324 |
| McPherson Tying Forceps | Duckworth & Kent | 2-500E | 6mm tying platforms, straight shafts, flat handle, length 90mm |
| Metzenbaum Scissors – 14.5 cm | Fine Science Tools | 14024-14 | Straight Sharp/Blunt |
| Micro Kitzmiller Clamp | Scanlan | 3003-630 | Jaw length 23mm, Length 11cm |
| Microscope-Leica M525 F20 | Leica Microsystems | No catalog number | |
| Non-woven Gauze Sponges | Fisherbrand | 22-028-556 | |
| Olsen-Hegar with Suture Cutter | Fine Science Tools | 12002-14 | 15 mm cutting edge, 2mm jaw surface – 14cm |
| OptixCare Eye Lube, 25gm | OptixCare | ES-KE8O-69U1 | Formerly Optixcare Surgical Eye Lubricant |
| Piperacillin sodium salt | Sigma-Aldrich | P8396 | Penicillin analog |
| Puritan 3" Standard Cotton Swab w/Wooden Handle | Puritan Medical Products Company LLC | 803-WC | Regular Cotton Tipped Applicator with Wooden Handle |
| Round Handled Needle Holder Straight w/ Lock | Fine Science Tools | 12075-12 | Round handles allow easy fingertip adjustments – 12.5cm |
| Shea Scissors Curved Blunt | Fine Science Tools | 14105-12 | Transplant scissors with light and delicate pattern – 12cm |
| Stainless Steel Micro Serrefines Curved – 4mm | Fine Science Tools | 18055-06 | Jaw length 4mm, Jaw width 0.75mm, Total length 16mm, Jaw pressure 125g |
| Stainless Steel Micro Serrefines Curved – 6mm | Fine Science Tools | 18055-05 | Jaw length 6mm, Jaw width 1mm, Total length 17mm, Jaw pressure 100g |
| Stainless Steel Micro Serrefines Straight – 6mm | Fine Science Tools | 18055-03 | Jaw length 6mm, Jaw width 1mm, Total length 15mm, Jaw pressure 100g |
| Surgical Platform | Custom, magnetic | ||
| SurgiVet Vaporstick Anesthesia Machine | General Anesthetic Services, Inc | V7015 | |
| T/Pump Localized Therapy | Stryker | TP700 Series | |
| Vacuum-Pressure Pump | Barnant Co. | 400-1901 | |
| Vannas Scissors with Microserrations Straight | Fine Science Tools | 15070-08 | Cutting edge: 5mm, Tip diameter: 0.1mm – 8.5cm |
| Vetergesic Buprenorphine | Ceva Animal Health Ltd | NAC No.:12380352 | 0.324 mg/ml buprenorphine hydochloride Solution for Injection for Dogs and Cats |
| Vetroson V-10 Bipolar Electrosurgical Unit | Summit Hill Laboratories | No catalog number |
References
- Asrani, S. K., Devarbhavi, H., Eaton, J., Kamath, P. S. Burden of liver diseases in the world. Journal of Hepatology. 70 (1), 151-171 (2019).
- Dopazo, C., et al. Analysis of adult 20-year survivors after liver transplantation. Hepatology International. 9 (3), 461-470 (2015).
- Schoening, W. N., et al. Twenty-year longitudinal follow-up after orthotopic liver transplantation: a single-center experience of 313 consecutive cases. American Journal of Transplantation. 13 (9), 2384-2394 (2013).
- Pischke, S., et al. Factors associated with long-term survival after liver transplantation: A retrospective cohort study. World Journal of Hepatology. 9 (8), 427-435 (2017).
- Hamdani, S., et al. Delayed and short course of rapamycin prevents organ rejection after allogeneic liver transplantation in rats. World Journal of Gastroenterology. 23 (38), 6962-6972 (2017).
- Endo, K., et al. Pretransplant replacement of donor liver grafts with recipient Kupffer cells attenuates liver graft rejection in rats. Journal of Gastroenterology and Hepatology. 30 (5), 944-951 (2015).
- Zhao, Z., et al. IL-34 Inhibits Acute Rejection of Rat Liver Transplantation by Inducing Kupffer Cell M2 Polarization. Transplantation. 102 (6), e265-e274 (2018).
- Nagakawa, Y., et al. Over-expression of AIF-1 in liver allografts and peripheral blood correlates with acute rejection after transplantation in rats. American Journal of Transplantation. 4 (12), 1949-1957 (2004).
- Gao, L. H., Zeng, L. X., Chen, H. M., Wan, R. H. Cytomegalovirus infection accelerates the process of chronic rejection in rat liver transplantation. Transplantation Proceedings. 45 (6), 2536-2538 (2013).
- Wu, Y., et al. Effects of combined genes of CTLA4Ig and IDO in post-liver transplantation immune tolerance of rats. Annals of Hepatology. 15 (5), 729-737 (2016).
- He, X. S., et al. Influence of warm ischemia injury on hepatic functional status and survival of liver graft in rats. Hepatobiliary and Pancreatic Diseases International. 2 (4), 504-508 (2003).
- Tamura, A., et al. Combination effect of tacrolimus and FTY720 in liver transplantation in rats. Transplantation Proceedings. 31 (7), 2785-2786 (1999).
- Wang, Z., et al. RhGH attenuates ischemia injury of intrahepatic bile ducts relating to liver transplantation. Journal of Surgical Research. 171 (1), 300-310 (2011).
- Jiang, J. W., et al. Chronic bile duct hyperplasia is a chronic graft dysfunction following liver transplantation. World Journal of Gastroenterology. 18 (10), 1038-1047 (2012).
- Tang, Y., et al. S-Adenosylmethionine attenuates bile duct early warm ischemia reperfusion injury after rat liver transplantation. Molecular Immunology. 95, 83-90 (2018).
- Nosaka, T., Bowers, J. L., Cay, O., Clouse, M. E. Biliary complications after orthotopic liver transplantation in rats. Surgery Today. 29 (9), 963-965 (1999).
- Howden, B., Jablonski, P., Grossman, H., Marshall, V. C. The importance of the hepatic artery in rat liver transplantation. Transplantation. 47 (3), 428-431 (1989).
- Post, S., et al. The impact of arterialization on hepatic microcirculation and leukocyte accumulation after liver transplantation in the rat. Transplantation. 54 (5), 789-794 (1992).
- Hori, T., et al. Impact of hepatic arterial reconstruction on orthotopic liver transplantation in the rat. Journal of Investigative Surgery. 25 (4), 242-252 (2012).
- Zhou, S., et al. New method of stent-facilitated arterial reconstruction for orthotopic mouse liver transplantation. Journal of Surgical Research. 187 (1), 297-301 (2014).
- Noack, K., Bronk, S. F., Kato, A., Gores, G. J. The greater vulnerability of bile duct cells to reoxygenation injury than to anoxia. Implications for the pathogenesis of biliary strictures after liver transplantation. Transplantation. 56 (3), 495-500 (1993).
- Imamura, H., Rocheleau, B., Cote, J., Huet, P. M. Long-term consequence of rat orthotopic liver transplantation with and without hepatic arterial reconstruction: a clinical, pathological, and hemodynamic study. Hepatology. 26 (1), 198-205 (1997).
- Reck, T., et al. Impact of arterialization on hepatic oxygen supply, tissue energy phosphates, and outcome after liver transplantation in the rat. Transplantation. 62 (5), 582-587 (1996).
- Zhao, D., Wheatley, A. M. Orthotopic liver transplantation in the rat: comparison of models with and without rearterialization of the graft. European Surgical Research. 25 (5), 294-302 (1993).
- Chaland, P., et al. Orthotopic liver transplantation with hepatic artery anastomoses. Hemodynamics and response to hemorrhage in conscious rats. Transplantation. 49 (4), 675-678 (1990).
- Liu, X., He, C., Huang, T., Gu, J. Development of a New Technique for Reconstruction of Hepatic Artery during Liver Transplantation in Sprague-Dawley Rat. PLoS One. 10 (12), e0145662 (2015).
- Oldani, G., Lacotte, S., Morel, P., Mentha, G., Toso, C. Orthotopic liver transplantation in rats. Journal of Visualized Experiments. (65), (2012).
- Lee, S., Charters, A. C., Chandler, J. G., Orloff, M. J. A technique for orthotopic liver transplantation in the rat. Transplantation. 16 (6), 664-669 (1973).
- Kamada, N., Calne, R. Y. Orthotopic liver transplantation in the rat. Technique using cuff for portal vein anastomosis and biliary drainage. Transplantation. 28 (1), 47-50 (1979).
- Kashfi, A., et al. A review of various techniques of orthotopic liver transplantation in the rat. Transplantation Proceedings. 37 (1), 185-188 (2005).
- Chong, A. S., Alegre, M. L., Miller, M. L., Fairchild, R. L. Lessons and limits of mouse models. Cold Spring Harbor Perspectives in Medicine. 3 (12), a015495 (2013).
- Hasuike, Y., et al. A simple method for orthotopic liver transplantation with arterial reconstruction in rats. Transplantation. 45 (4), 830-832 (1988).
- Hickman, R., Engelbrecht, G. H., Duminy, F. J. A technique for liver transplantation in the rat. Transplantation. 48 (6), 1080 (1989).
- Steffen, R., Ferguson, D. M., Krom, R. A. A new method for orthotopic rat liver transplantation with arterial cuff anastomosis to the recipient common hepatic artery. Transplantation. 48 (1), 166-168 (1989).
- Shi, Y., et al. Magnetic ring anastomosis of suprahepatic vena cava: novel technique for liver transplantation in rat. Transplant International. 28 (1), 89-94 (2015).
- Dippe, B. E., et al. An improved model for rat liver transplantation including arterial reconstruction and simplified microvascular suture techniques. Journal of Investigative Surgery. 5 (4), 361-373 (1992).
- Kobayashi, E., Kamada, N., Goto, S., Miyata, M. Protocol for the technique of orthotopic liver transplantation in the rat. Microsurgery. 14 (8), 541-546 (1993).
- Oldani, G., et al. Efficient nonarterialized mouse liver transplantation using 3-dimensional-printed instruments. Liver Transplation. 22 (12), 1688-1696 (2016).
- Oldani, G., et al. Manufacturing devices and instruments for easier rat liver transplantation. Journal of Visualized Experiments. (75), e50380 (2013).
- Li, J., et al. Modified sleeve anastomosis for reconstruction of the hepatic artery in rat liver transplantation. Microsurgery. 22 (2), 62-68 (2002).
- Li, G. L., et al. High incidence of biliary complications in rat liver transplantation: can we avoid it?. World Journal of Gastroenterology. 17 (26), 3140-3144 (2011).
- Zammert, M., Gelman, S. The pathophysiology of aortic cross-clamping. Best Practice and Research: Clinical Anaesthesiology. 30 (3), 257-269 (2016).
- Gao, W., Lemasters, J. J., Thurman, R. G. Development of a new method for hepatic rearterialization in rat orthotopic liver transplantation. Reduction of liver injury and improvement of surgical outcome by arterialization. Transplantation. 56 (1), 19-24 (1993).
- Ijtsma, A. J., et al. The clinical relevance of the anhepatic phase during liver transplantation. Liver Transplation. 15 (9), 1050-1055 (2009).
- Miyata, M., Fischer, J. H., Fuhs, M., Isselhard, W., Kasai, Y. A simple method for orthotopic liver transplantation in the rat. Cuff technique for three vascular anastomoses. Transplantation. 30 (5), 335-338 (1980).
- Marni, A., Ferrero, M. E. A four-technique comparative study of orthotopic liver transplantation in the rat. American Journal of Surgery. 156 (3 Pt 1), 209-213 (1988).