Ortotopik Karaciğer Transplantasyonunun Sıçan Modelinde Arteriyel Reconnection Sonrası Azaltılmış Komplikasyonlar
Summary
Bu çalışmanın amacı, sıçan ortotopik karaciğer nakli modelini insan karaciğer naklini daha iyi temsil edecek ve alıcı sağkalımını iyileştirmek için değiştirmektir. Sunulan yöntem alıcı karaciğeruygun karaciğer arter donör karaciğer ortak karaciğer arter bağlayarak hepatik arter girişini yeniden kurar.
Abstract
Sıçan ortopik karaciğer transplantasyonu (OLT) modeli akut ve kronik ret çalışması için güçlü bir araçtır. Ancak, arteriyel yeniden bağlantı olmaması nedeniyle insan karaciğer nakli tam bir temsili değildir. Burada açıklanan hepatik arter dahil içeren değiştirilmiş bir transplantasyon prosedürü (HA) reconnection, transplantsonuçlarıbelirgin bir iyileşmeye yol açan. Ortalama anhepatik süresi 12 dakika ve 14 s ile, HA reconnection transplante karaciğer in daha iyi perfüzyon ve% 37.5 den% 88.2 uzun süreli alıcı sağkalım artışı ile sonuçlanır. Bu protokol portal ven ve infrahepatik inferior vena kava bağlamak için 3D baskılı manşet ve sahipleri kullanımını içerir. Karaciğer naklinin bağışıklık yanıtı ve enfeksiyondan prosedürün teknik yönlerine kadar birçok yönünü incelemek için uygulanabilir. Bir mikrovasküler teknik kullanarak arteriyel reconnection için basit ve pratik bir yöntem birleştirerek, bu değiştirilmiş sıçan OLT protokolü yakından insan karaciğer nakli yönlerini taklit ve değerli ve klinik olarak ilgili araştırma modeli olarak hizmet verecek.
Introduction
Karaciğer hastalığının küresel yükü artmaya devam ediyor, 2005’ten 2013’e kadar1karaciğer hastalığına bağlı ölümlerde %30’luk bir artış1,2. Karaciğer nakli genellikle son dönem karaciğer hastalığı olan hastalar için tek çaredir. Karaciğer en sık nakledilen ikinci katı organdır ve 2015’ten 2016’ya kadar dünya çapında yapılan karaciğer nakli sayısı %7,25 artmıştır1,2. Prevalansına rağmen transplantasyon sonrası sağkalım3oranları 3 ,4,,5durgun hale gelmiştir. 15 yıllık hasta sağkalım oranının %53 olduğu bildirilmesi ve 20 yıllık hasta sağkalım oranının %21 gibi düşük olabileceği bildirilmesi3,5. Yeni tedavilere ve geliştirilmiş klinik sonuçlara yol açabilecek heyecan verici yeni immünobiyoloji girişimleri olmakla birlikte, bunları test etmek için henüz güvenilir bir küçük hayvan modeli yoktur.
Sıçan OLT modeli yaygın ret6dahil olmak üzere karaciğer nakli, soruşturma da kullanılmıştır6 ,7,8,9,10, bağışıklık toleransı11, nakil iskemi-reperfüzyon yaralanması12, immünsupresyon13, ve safra ağacı yaralanması14,15,16,17. Ancak, mevcut haliyle modelin bir dezavantajı yüksek post-operatif morbidite ve mortalite18,19. Bu insan operasyonu ile oran ciddi bir dezavantajı, ve model20klinik olarak ilgili sonuçlar çizmek için yeteneği ni tehlikeye attırıyor.
Ayrıca, bu morbiditenin büyük bir kısmı eksik veya kusurlu hepatik arter (HA) reconnectionatfedilebilir 18. İnsan karaciğer naklinde kritik bir adım olmasına rağmen, teknik zorluklar sıçan OLT modelinde HA reconnection tehlikeye eğilimindedir. Sonuç olarak, safra yolu (BD) anastomoz ince ve safra kaçağı ve BD nekroz21yüksek oranlarda sonuçlanır. Biliyer komplikasyonların yüksek insidansının ötesinde22, arteriyel giriş yokluğu greft karaciğer sonrası transplantasyon fizyolojisini değiştirir23, donör karaciğer grefthipoksi ile24 ve karaciğer hasarı iltihaplı loblar gözlenen19,25,26. Arteriyel reconnection olmadan Rat OLT da fibrozis teşvik eğilimindedir27. Aşağıda açıklanan sıçan OLT protokolü daha önce yayınlanmış bir sıçan OLT yöntemi ile basit bir HA rekonstrüksiyon adım birleştirerek bu sorunları giderir28, karaciğer parankim korunması ve geliştirilmiş sağkalım oranları ile sonuçlanan.
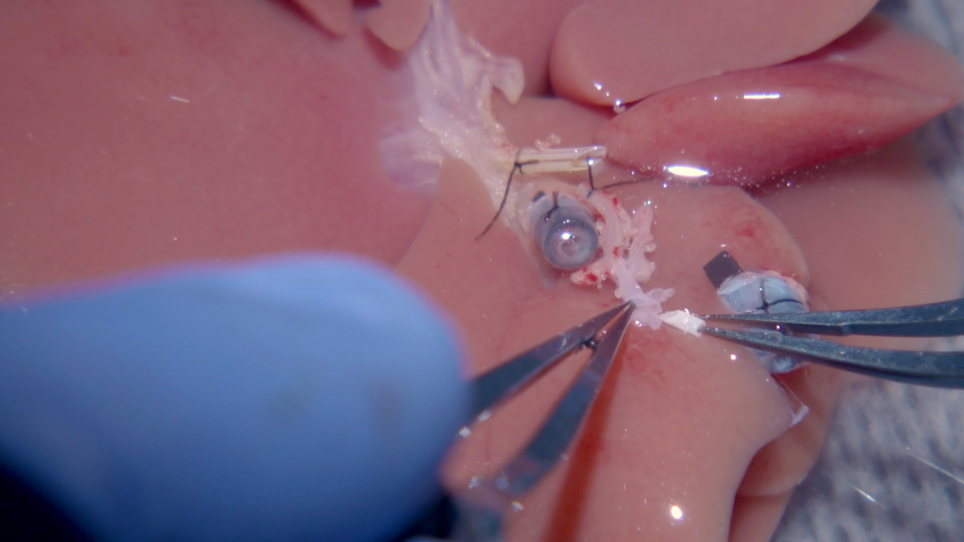
Karaciğer naklinin üç aşaması vardır: (1) donörden karaciğer greftinin çıkarılması, (2) donör karaciğer greftinin hazırlanması ve (3) alıcı karaciğerin karaciğer grefti ile değiştirilmesi. Prosedür beş anatomik yapıların manipülasyoniçerir: suprahepatik inferior vena kava (SHVC), portal ven (PV), infrahepatik inferior vena kava (IHVC), hepatik arter (HA) ve safra yolu (BD).
Sıçanda OLT ilk ShVC, PV ve IHVC mikrosutür anastomoz ve BD29için bir pull-through tekniği kullanılarak Lee ve ark tarafından tanıtıldı . Bu model daha sonra 1979 yılında iki manşet tekniği kullanılarak geliştirilmiş30. O zamandan beri, çeşitli alternatif teknikler önerilmiştir, çoğunluğu venöz anastomoz odaklanan ve birkaç değişiklik ile iki manşet tekniği kullanılarak31. HA anastomoz mikrosutür, manşet ve intraluminal kollar26,31,,32,33,34gibi teknikler kullanılarak sıçan OLT modelinde daha önce tanımlanmış olmasına rağmen, bu teknikler genellikle yüksek eğitimli mikrocerrahi becerileri gerektirir, önemli ölçüde sıçan fizyolojisi değiştirmek, ve tromboz ve / veya safra komplikasyonları 27 tarafından engellenir27,35.33
Ayrıca, cerrahi işlem seçimi de anhepatik zaman etkileyebilir (PV kıskaç gelen reperfüzyon için reperfusion reconstituted PV), sıçan karaciğer nakli başarısı için kritik olan. Özellikle, yüksek sağkalım oranları 15-20 dk36anhepatik kez gözlenir ve 30 dk başarı için üstsınır37,38. Bu nedenle, Bu yöntemin amacı hepatik arter yeniden bağlamak mümkün daha az invaziv ve daha kolay benimsenebilir cerrahi sıçan OLT modeli uygulamaktır, nakledilen karaciğer verimli perfüzyon teşvik, alıcı safra kanalına akışını korumak, ve alıcının fizyolojik durumunu korumak.
Ayrıntılı burada donör karaciğer çölyak gövde manipülasyon yanı sıra 1) 1.5 mm stent kullanımı da dahil olmak üzere bu gözden geçirilmiş protokolün tüm adımları alıcı uygun HA ile bir ekstraluminal kol bağlantısı gerçekleştirmek için, 2) SHVC rekonstrüksiyonu için çalışan bir dikiş, 3) PV ve IHVC rekonstrüksiyonu için iki 3D baskılı plastik manşet39,40, 4) HA18için bir mikrovasküler kol reconnection,27,41 ve 5) daha önce açıklanan BD stentleme tekniği28. İki ek adım da dahildir: PV üzerinden soğuk bir floş, ve önceki bulgulara dayalı bir antibiyotik rejimi17. Bu optimize OLT protokolü perioperatif komplikasyonları ve morbiditeyi en aza indirir ve insan karaciğer transplantasyonunda kullanılan cerrahi ameliyat prosedürünü daha yakından modeller.
Protocol
Representative Results
Discussion
Küçük hayvan karaciğer nakli modelleri organ bağışıklığı anlamak ve yeni tedavi stratejileri belirlemek için önemlidir32. İdeal küçük hayvan karaciğer nakli modeli arteriyel anastomoz da dahil olmak üzere insan prosedürünün tüm adımları çoğaltır. Çoğu sürümleri komplikasyonlar ve morbidite42daha yüksek oranlarda yol açan bir HA anastomoz adım dahil olmadığı gibi, sıçan OLT modeli sonuçları yorumlamak zor olabilir. Bazı rekonstrüksiyon prosedürleri böbrek arter kullandık, hangi böbrek çıkarılması gerektirir27. Bu protokol organ çıkarılmasını önler, çünkü insan prosedüründe meydana gelenin ötesindedir.
Arteriyel rekonstrüksiyonlar da sıçan aort manipüle ederek yapılabilir31. Ancak, bu yöntemler geniş diseksiyon ve aort kenetleme gerektirir. Kıskaç süresi uzamışsa, alıcı sıçan distal iskemi43ile ilgili kötü sonuçlara sahip olacaktır. İnsanlarda, lt cerrahi tekniği ligasyon ve alıcı gastroduodenal arter bölünmesi içerir (GDA). Ancak kemirgenlerin fizyolojik ve anatomik özellikleri bu tekniği kullanarak transplantasyon yapar ve komplikasyonlara yol açabilir (örneğin, pankreas ve safra kanalı nın nekrozu35 ve safra kaçağı44). Bu protokoldeki arteriyel yeniden bağlantı, bu zorluğu atlatmak, kanal kan akışını sürdürmek ve alıcı sonucunu iyileştirmek için tasarlanmıştır.
Sıçan HA rekonstrüksiyonu için bir kol ve stentleme tekniğikullanımı daha önce27açıklanmıştır . Bu teknikte, bir stent bir kılavuz olarak kullanılır, ve arter alıcı ortak HA donör çölyak gövde yeniden. Alıcı ortak HA sonra dışarı kesilir ve alıcı GDA27kapalı bağlanır. Sonuç olarak, alıcı BD alt kısmına kan akımı ve pankreas başkanı tehlikeye olabilir. Bu alana teminat dolaşımı genellikle safra kanalına yetersiz kan akışını sağlar inanılmaktadır. Örneğin, bu protokol, alıcı GDA’yı önce mikrovasküler bir kliple sıkıştırır, sonra alıcı BD’yi böler. GDA kenetlendi, bölünmüş BD kanamaz. GDA kelepçesi çıkarıldıktan sonra BD’den canlı kanama gözlenir. Bölünmüş alıcı safra kanalına iyi akışı sağlayan bu protokol, yeterli karaciğer kan perfüzyonu sağlayarak ve post-OLT hipoksik karaciğer hasarı önleyerek alıcı karaciğer dokusunun fizyolojisini korur.
Donör tarafında, HA stent çölyak gövde bir yama oluşturarak kolaylıkla greft hazırlanması sırasında çölyak gövde içine yerleştirilir, sol mide arter, ve dalak arter. Stent geniş açıklıktan takılabilir, bu da stenti tek başına çölyak gövdesine sokmaya çalışmaktan daha az zordur. Bu 24 G HA stent için kullanmak için ideal bir boyut olduğu bulunmuştur. Stentin uzunluğu 1,0-1,5 mm uzunluğunda olmalıdır, çünkü alıcının uygun HA’sının donörün ortak HA’sına kolayca çekilmesini sağlamak için açık bir kapı görevi görür. 10-0 ethilon sütür yerleştirilir nerede dikkatli dikkat ile, bu bağlantı üzerinden akan kan doğrudan stent dokunmaz, ve alıcının uygun HA komplikasyon riskini azaltarak, içeriden kalkan olacaktır. Daha da önemlisi, donörün HA vazospazm önlemek için kenetlenmiş asla. Arteriyel rekonstrüksiyonun başarısı donör GDA açık bırakılarak değerlendirilir. Rekonstrüksiyon tamamlandıktan sonra başarılı anastomoz donör GDA’dan iyi kan akışı sağlar.
Bu protokolde, diğerlerine benzer şekilde, SHVC yeniden bağlantısı en yavaş adımdır ve sonuçta anhepatik fazın süresini belirler. Anhepatik zaman arttıkça iskemik yaralanma ve karaciğer fonksiyon bozukluğu riski45’eyükselir. OLT sıçan modellerinin bir diğer kritik bileşeni greft boyutları, stentler, ve manşet. Greft çok küçükse, greft bükülebilir veya takla atarak damar bağlantılarını engelleyebilir. Stent ve manşetlerin boyutu, farenin yaşına, cinsiyetine, kilolarına ve türüne göre ayarlamalar gerektirebilir. Burada kullanılan manşetlerin boyutu daha önce28olarak tanımlanmış ve fare boyutu için kontrol edilen bir manşet boyutu kullanılmıştır. Takip süresi boyunca (bugüne kadar: ortalama = ameliyat sonrası 133 gün, en az = 115 gün ameliyat sonrası, maksimum = ameliyat sonrası 161 gün) sıkıntı veya komplikasyon (karaciğer tıkanıklığı, ödem, asit veya dalak) belirtisi yoktu. Yaş ve cinsiyet için muhasebe çeşitli sıçan suşları için PV ve IHVC uygun boyutunu belirlemek için daha fazla çalışma garanti edilir.
Bu değiştirilmiş sıçan OLT protokolü daha önce açıklandığı gibi, PV ve IHVC için3Dbaskılı manşet kullanır39 ,40. PV ve IHVC bağlamak için mevcut yöntemler bir mikrosuture tekniği32dahil , manşet tekniği46, ve mikrosuture-geçici splint tekniği47. 3D baskılı manşet tekniği seçilmiştir, çünkü manşetin boyutunun fare türüne göre standartlaştırılamasına ve hazırlanması ve kullanımı kolaydır. Aynı boyutlarda büyük miktarlarda manşet aynı anda basılabilir. Manşetin dış yüzeyinde bağların güvenliğini sağlamak ve kaymayı önlemek için iki oluk vardır. Bir kuyruk da manşet daha kolay manipülasyon sağlamak için manşet tasarımı içine dahil edilmiştir. Genel olarak, 3D baskılı manşetlerin biraraya edilmesinin anhepatik süreyi kısaltarak yüksek başarı oranlarına ve OLT prosedürünün tekrarlanabilirliğine yol açtığına inanılmaktadır. Bu tekniğin cerrahi öğrenme eğrisini de kısalttı.
Sonuç olarak, açıklanan protokol, arteriyel yeniden bağlantı adımını bir araya alarak insan karaciğer nakline daha çok benzeyen bir model oluşturmuştur. Bu protokol karaciğer transplantasyonunun birçok immünolojik ve cerrahi yönünü incelemek üzere uyarlanabilir ve transplantasyonla ilgili yeni terapötik müdahaleleri test etmek için bir model görevi görebilir.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Bu araştırma UHN’deki Çoklu Organ nakli programından gelen fonlar ve Toronto General ve Toronto Western Foundation’ın desteği ile finanse edilmiştir.
Materials
| 10-0 Ethilon | Ethicon | 2830G | 10-0 Ethilon Black 1X5" BV100-4 Taper |
| 10mL Syringe | BD | B302995 | Luer-Lok Tip, Sterile, Disposable |
| 1mL Syringe | BD | B309628 | Luer-Lok Tip, Sterile, Disposable |
| 20mL Syringe | BD | B301031 | Luer-Lok Tip, Sterile, Disposable |
| 3D Printed Cuff for IHVC | Custom | ||
| 3D Printed Cuff for PV | Custom | ||
| 3D Printed Holder for IHVC | Custom | ||
| 3D Printed Holder for PV | Custom | ||
| 3mL Syringe | BD | B309657 | Luer-Lok Tip, Sterile, Disposable |
| 4-0 Sofsilk | Coviden | GS-835 | Wx coded braided silk, 30", Suture 1-Needle 26 mm Length 1/2 Circle Taper Point Needle |
| 5-0 Monocryl | Ethicon | Y433H | Undyed Monofilament 1X27" TF |
| 5mL Syringe | BD | B309646 | Luer-Lok Tip, Sterile, Disposable |
| 7-0 Silk | Teleflex Medical | 103-S | Black |
| 8-0 Prolene | Ethicon | 2775G | 8-0 Prolene Blue 1X24" BV130-5 EVP Double Armed |
| Barraquer Micro Needle Holder Without Catch | Aesculap Surgical Instruments | FD231R | Curved 120 mm, 4 3/4″ |
| Barraquer Needle Holder, Extra Fine Jaws 8.0mm, Curved With Out Lock | Rumex International Co. | 8-025T | Small Size, Titanium |
| Barraquer Needle Holder, Fine Jaws 12.0mm, Curved With Out Lock | Rumex International Co. | 8-021T | Small Size, Titanium |
| BD Insyte Autoguard BC 22 GA x 1.00 IN | BD Angiocath / Autoguard | 382523 | 22 G x 1.00" (0.9 mm x 25 mm) Wingless catheter, 37 mL/min |
| BDPrecisionGlide Single-use Needles: Regular Bevel – Regular Wall. | BD | B305106 | PrecisionGlide stainless-steel needles with translucent, color-coded, polypropylene hubs. 22 G |
| BD Precisionglide Syringe Needle 21G | BD | 305167 | Gauge 21, length 1.5 inch, hypodermic needle |
| BD Precisionglide Syringe Needle 30G | BD | 305128 | Gauge 30, length 1 inch, hypodermic needle |
| Betadine Solution by Purdue Products LP | Purdue Products Lp | 67618-150-17 | 10% povidone–iodine topical solution USP |
| Bupivacaine Injection BP 0.5% | SteriMax Inc. | DIN:02443694 | 0.5% (100mg/20mL) |
| Curved Tying Forceps | Duckworth & Kent | 2-501E | 6mm tying platforms, straight shafts, flat handle, length 88mm |
| DC Temperature Controller | FHC Inc. | 40-90-8D | |
| DK Iris Scissors (Curved) | Duckworth & Kent | 1-211B | Blunt tips, cut length 4mm, tip to pivot length 11mm, round handle, length 107mm |
| Ethanol, 200 proof (100%), USP, Decon Labs | Decon Labs, Inc. | 2716 | Dilute to 70% with d2H2O |
| Fine Adjustable Wire Retractor | Fine Science Tools | 17004-05 | Maximum spread: 3.5cm, Depth 5cm |
| Harvard Apparatus Isoflurane Funnel-Fill Vaporizer | Harvard Appartus Limited | 34-1040SV | |
| Heparin LEO(heparin sodium) | LEO Pharma Inc. | DIN:00453811 | 10,000 i.u./10 mL |
| Ice-Pak | Cryopak | FIP88016 | 4.00 in. x 7.00 in., thickness 1.50 inch |
| Isoflurane United States Pharmacopeia (USP) 99.9% | Piramal Healthcare Limited | DIN: 02231929 | 250 mL, Inhalation Anesthetic, NDC 66794-017-25 |
| Khaw Transconjunctival Adjustable Suture Control Forceps | Duckworth & Kent | 2-502N | 5mm highly polished tying platforms, straight shafts, flat handle, length 84mm |
| Lactate Ringer's Injected USP, 1000mL | Baxter Co. | DIN: 00061085 | JB2324 |
| McPherson Tying Forceps | Duckworth & Kent | 2-500E | 6mm tying platforms, straight shafts, flat handle, length 90mm |
| Metzenbaum Scissors – 14.5 cm | Fine Science Tools | 14024-14 | Straight Sharp/Blunt |
| Micro Kitzmiller Clamp | Scanlan | 3003-630 | Jaw length 23mm, Length 11cm |
| Microscope-Leica M525 F20 | Leica Microsystems | No catalog number | |
| Non-woven Gauze Sponges | Fisherbrand | 22-028-556 | |
| Olsen-Hegar with Suture Cutter | Fine Science Tools | 12002-14 | 15 mm cutting edge, 2mm jaw surface – 14cm |
| OptixCare Eye Lube, 25gm | OptixCare | ES-KE8O-69U1 | Formerly Optixcare Surgical Eye Lubricant |
| Piperacillin sodium salt | Sigma-Aldrich | P8396 | Penicillin analog |
| Puritan 3" Standard Cotton Swab w/Wooden Handle | Puritan Medical Products Company LLC | 803-WC | Regular Cotton Tipped Applicator with Wooden Handle |
| Round Handled Needle Holder Straight w/ Lock | Fine Science Tools | 12075-12 | Round handles allow easy fingertip adjustments – 12.5cm |
| Shea Scissors Curved Blunt | Fine Science Tools | 14105-12 | Transplant scissors with light and delicate pattern – 12cm |
| Stainless Steel Micro Serrefines Curved – 4mm | Fine Science Tools | 18055-06 | Jaw length 4mm, Jaw width 0.75mm, Total length 16mm, Jaw pressure 125g |
| Stainless Steel Micro Serrefines Curved – 6mm | Fine Science Tools | 18055-05 | Jaw length 6mm, Jaw width 1mm, Total length 17mm, Jaw pressure 100g |
| Stainless Steel Micro Serrefines Straight – 6mm | Fine Science Tools | 18055-03 | Jaw length 6mm, Jaw width 1mm, Total length 15mm, Jaw pressure 100g |
| Surgical Platform | Custom, magnetic | ||
| SurgiVet Vaporstick Anesthesia Machine | General Anesthetic Services, Inc | V7015 | |
| T/Pump Localized Therapy | Stryker | TP700 Series | |
| Vacuum-Pressure Pump | Barnant Co. | 400-1901 | |
| Vannas Scissors with Microserrations Straight | Fine Science Tools | 15070-08 | Cutting edge: 5mm, Tip diameter: 0.1mm – 8.5cm |
| Vetergesic Buprenorphine | Ceva Animal Health Ltd | NAC No.:12380352 | 0.324 mg/ml buprenorphine hydochloride Solution for Injection for Dogs and Cats |
| Vetroson V-10 Bipolar Electrosurgical Unit | Summit Hill Laboratories | No catalog number |
References
- Asrani, S. K., Devarbhavi, H., Eaton, J., Kamath, P. S. Burden of liver diseases in the world. Journal of Hepatology. 70 (1), 151-171 (2019).
- Dopazo, C., et al. Analysis of adult 20-year survivors after liver transplantation. Hepatology International. 9 (3), 461-470 (2015).
- Schoening, W. N., et al. Twenty-year longitudinal follow-up after orthotopic liver transplantation: a single-center experience of 313 consecutive cases. American Journal of Transplantation. 13 (9), 2384-2394 (2013).
- Pischke, S., et al. Factors associated with long-term survival after liver transplantation: A retrospective cohort study. World Journal of Hepatology. 9 (8), 427-435 (2017).
- Hamdani, S., et al. Delayed and short course of rapamycin prevents organ rejection after allogeneic liver transplantation in rats. World Journal of Gastroenterology. 23 (38), 6962-6972 (2017).
- Endo, K., et al. Pretransplant replacement of donor liver grafts with recipient Kupffer cells attenuates liver graft rejection in rats. Journal of Gastroenterology and Hepatology. 30 (5), 944-951 (2015).
- Zhao, Z., et al. IL-34 Inhibits Acute Rejection of Rat Liver Transplantation by Inducing Kupffer Cell M2 Polarization. Transplantation. 102 (6), e265-e274 (2018).
- Nagakawa, Y., et al. Over-expression of AIF-1 in liver allografts and peripheral blood correlates with acute rejection after transplantation in rats. American Journal of Transplantation. 4 (12), 1949-1957 (2004).
- Gao, L. H., Zeng, L. X., Chen, H. M., Wan, R. H. Cytomegalovirus infection accelerates the process of chronic rejection in rat liver transplantation. Transplantation Proceedings. 45 (6), 2536-2538 (2013).
- Wu, Y., et al. Effects of combined genes of CTLA4Ig and IDO in post-liver transplantation immune tolerance of rats. Annals of Hepatology. 15 (5), 729-737 (2016).
- He, X. S., et al. Influence of warm ischemia injury on hepatic functional status and survival of liver graft in rats. Hepatobiliary and Pancreatic Diseases International. 2 (4), 504-508 (2003).
- Tamura, A., et al. Combination effect of tacrolimus and FTY720 in liver transplantation in rats. Transplantation Proceedings. 31 (7), 2785-2786 (1999).
- Wang, Z., et al. RhGH attenuates ischemia injury of intrahepatic bile ducts relating to liver transplantation. Journal of Surgical Research. 171 (1), 300-310 (2011).
- Jiang, J. W., et al. Chronic bile duct hyperplasia is a chronic graft dysfunction following liver transplantation. World Journal of Gastroenterology. 18 (10), 1038-1047 (2012).
- Tang, Y., et al. S-Adenosylmethionine attenuates bile duct early warm ischemia reperfusion injury after rat liver transplantation. Molecular Immunology. 95, 83-90 (2018).
- Nosaka, T., Bowers, J. L., Cay, O., Clouse, M. E. Biliary complications after orthotopic liver transplantation in rats. Surgery Today. 29 (9), 963-965 (1999).
- Howden, B., Jablonski, P., Grossman, H., Marshall, V. C. The importance of the hepatic artery in rat liver transplantation. Transplantation. 47 (3), 428-431 (1989).
- Post, S., et al. The impact of arterialization on hepatic microcirculation and leukocyte accumulation after liver transplantation in the rat. Transplantation. 54 (5), 789-794 (1992).
- Hori, T., et al. Impact of hepatic arterial reconstruction on orthotopic liver transplantation in the rat. Journal of Investigative Surgery. 25 (4), 242-252 (2012).
- Zhou, S., et al. New method of stent-facilitated arterial reconstruction for orthotopic mouse liver transplantation. Journal of Surgical Research. 187 (1), 297-301 (2014).
- Noack, K., Bronk, S. F., Kato, A., Gores, G. J. The greater vulnerability of bile duct cells to reoxygenation injury than to anoxia. Implications for the pathogenesis of biliary strictures after liver transplantation. Transplantation. 56 (3), 495-500 (1993).
- Imamura, H., Rocheleau, B., Cote, J., Huet, P. M. Long-term consequence of rat orthotopic liver transplantation with and without hepatic arterial reconstruction: a clinical, pathological, and hemodynamic study. Hepatology. 26 (1), 198-205 (1997).
- Reck, T., et al. Impact of arterialization on hepatic oxygen supply, tissue energy phosphates, and outcome after liver transplantation in the rat. Transplantation. 62 (5), 582-587 (1996).
- Zhao, D., Wheatley, A. M. Orthotopic liver transplantation in the rat: comparison of models with and without rearterialization of the graft. European Surgical Research. 25 (5), 294-302 (1993).
- Chaland, P., et al. Orthotopic liver transplantation with hepatic artery anastomoses. Hemodynamics and response to hemorrhage in conscious rats. Transplantation. 49 (4), 675-678 (1990).
- Liu, X., He, C., Huang, T., Gu, J. Development of a New Technique for Reconstruction of Hepatic Artery during Liver Transplantation in Sprague-Dawley Rat. PLoS One. 10 (12), e0145662 (2015).
- Oldani, G., Lacotte, S., Morel, P., Mentha, G., Toso, C. Orthotopic liver transplantation in rats. Journal of Visualized Experiments. (65), (2012).
- Lee, S., Charters, A. C., Chandler, J. G., Orloff, M. J. A technique for orthotopic liver transplantation in the rat. Transplantation. 16 (6), 664-669 (1973).
- Kamada, N., Calne, R. Y. Orthotopic liver transplantation in the rat. Technique using cuff for portal vein anastomosis and biliary drainage. Transplantation. 28 (1), 47-50 (1979).
- Kashfi, A., et al. A review of various techniques of orthotopic liver transplantation in the rat. Transplantation Proceedings. 37 (1), 185-188 (2005).
- Chong, A. S., Alegre, M. L., Miller, M. L., Fairchild, R. L. Lessons and limits of mouse models. Cold Spring Harbor Perspectives in Medicine. 3 (12), a015495 (2013).
- Hasuike, Y., et al. A simple method for orthotopic liver transplantation with arterial reconstruction in rats. Transplantation. 45 (4), 830-832 (1988).
- Hickman, R., Engelbrecht, G. H., Duminy, F. J. A technique for liver transplantation in the rat. Transplantation. 48 (6), 1080 (1989).
- Steffen, R., Ferguson, D. M., Krom, R. A. A new method for orthotopic rat liver transplantation with arterial cuff anastomosis to the recipient common hepatic artery. Transplantation. 48 (1), 166-168 (1989).
- Shi, Y., et al. Magnetic ring anastomosis of suprahepatic vena cava: novel technique for liver transplantation in rat. Transplant International. 28 (1), 89-94 (2015).
- Dippe, B. E., et al. An improved model for rat liver transplantation including arterial reconstruction and simplified microvascular suture techniques. Journal of Investigative Surgery. 5 (4), 361-373 (1992).
- Kobayashi, E., Kamada, N., Goto, S., Miyata, M. Protocol for the technique of orthotopic liver transplantation in the rat. Microsurgery. 14 (8), 541-546 (1993).
- Oldani, G., et al. Efficient nonarterialized mouse liver transplantation using 3-dimensional-printed instruments. Liver Transplation. 22 (12), 1688-1696 (2016).
- Oldani, G., et al. Manufacturing devices and instruments for easier rat liver transplantation. Journal of Visualized Experiments. (75), e50380 (2013).
- Li, J., et al. Modified sleeve anastomosis for reconstruction of the hepatic artery in rat liver transplantation. Microsurgery. 22 (2), 62-68 (2002).
- Li, G. L., et al. High incidence of biliary complications in rat liver transplantation: can we avoid it?. World Journal of Gastroenterology. 17 (26), 3140-3144 (2011).
- Zammert, M., Gelman, S. The pathophysiology of aortic cross-clamping. Best Practice and Research: Clinical Anaesthesiology. 30 (3), 257-269 (2016).
- Gao, W., Lemasters, J. J., Thurman, R. G. Development of a new method for hepatic rearterialization in rat orthotopic liver transplantation. Reduction of liver injury and improvement of surgical outcome by arterialization. Transplantation. 56 (1), 19-24 (1993).
- Ijtsma, A. J., et al. The clinical relevance of the anhepatic phase during liver transplantation. Liver Transplation. 15 (9), 1050-1055 (2009).
- Miyata, M., Fischer, J. H., Fuhs, M., Isselhard, W., Kasai, Y. A simple method for orthotopic liver transplantation in the rat. Cuff technique for three vascular anastomoses. Transplantation. 30 (5), 335-338 (1980).
- Marni, A., Ferrero, M. E. A four-technique comparative study of orthotopic liver transplantation in the rat. American Journal of Surgery. 156 (3 Pt 1), 209-213 (1988).