- 00:03Concepts
- 02:33Preparation of Materials and Dissection
- 03:39Immune Cell Isolation
- 05:22Magnetic Labeling of Immune Cells
- 06:59Magnetic Separation of CD3-Positive Cells
- 07:48Evaluation of Target-Cell Enrichment by Flow Cytometry
- 09:00Data Analysis
자기 활성화 세포 분류 (MACS): 흉선 T 림프구 분리
English
Share
Overview
출처: 뮤니에 실베인1,2,3,퍼셰 티보1,2,3,소피 노볼트4,레이첼 골럽1,2,3
1 림프포포에이시스, 면역학학과, 파스퇴르 연구소, 파리, 프랑스
2 INSERM U1223, 파리, 프랑스
3 유니버시테 파리 디드로, 소르본 파리 시테, 셀룰레 파스퇴르, 파리, 프랑스
4 흐름 세포측정플리트에서, 세포측정및 바이오마커 UtechS, 번역 과학 센터, 파스퇴르 연구소, 파리, 프랑스
병원체에 대한 방어는 면역 계통에 의한 감시에 달려 있습니다. 이 시스템은 복잡하고 많은 세포 유형, 특정 기능을 가진 각 세포 유형으로 구성됩니다. 이 복잡한 조성은 병원체와 상해의 큰 다양성에 면역 반응을 가능하게 합니다. 적응성 면역은 특정 병원체에 대한 특정 반응을 허용합니다. 면역의 이 모형을 책임지는 세포의 대다수는 림프구 (B 세포 및 T 세포)입니다. 일반적으로 B 세포는 세포 외 감염 (예 : 세균 감염)에 반응하고 T 세포는 세포 내 감염 (예 : 바이러스 감염)에 반응합니다. 림프구 집단에 있는 세포의 다른 모형은 그(것)들이 표현하는 세포 표면 단백질의 조합및/또는 분비한 사이토카인의 패널에 의해 특징지을 수 있습니다.
자기 선별은 자기 특성을 사용하여 표적 세포 집단의 농축을 허용하고 하나 또는 여러 세포 표면 단백질의 발현(1, 2). 이 기술은 세 단계로 구성됩니다. 첫째, 세포는 하나 또는 여러 개의 단일 클론 특이적 항체와 결합된 자기 구슬로 배양된다. 이러한 항체에 결합하는 표면 단백질을 표현하는 세포는 자기 구슬에 부착됩니다. 그런 다음 표적 세포 집단은 자석으로 캡처됩니다. 완료하려면 표적 세포가 자석에서 용출됩니다. 끝에, 2개의 선별 제품은 얻어지며, 하나는 라벨이 없는 세포를 포함하고 두 번째는 자기 비드와 결합된 표적 세포를 포함하는 것이다. 컬럼을 사용하여 자기 정렬의 효율성을 향상시킬 수 있습니다. 열에서 비자기 요소는 열을 통해 셀의 경로를 길게 합니다. 따라서 세포 흐름이 느려지고 자석에 의한 세포 캡처를 용이하게합니다.
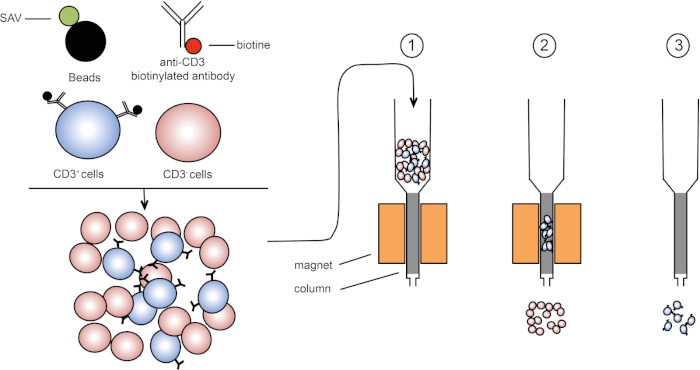
그림 1: 자기 분리의 회로도 표현. 흉백구세포는 항 CD3 바이오티니화 항체로 염색된다. 세척 후, 스트렙타비딘 (SAV) 결합 된 구슬은 특히 안티 CD3 항체에 비오틴을 고정합니다. (1) 셀은 열로 전송됩니다. (2) 자석은 표지되지 않은 세포를 유지하지 않으며 CD3 양성 셀은 열에 남아 있습니다. 마지막으로, 컬럼은 자석으로부터 분리되고 (3) CD3 양성 세포는 매체로 용출된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
자기 선별 (3)의 두 가지 유형이 있습니다. 양색 선별에서 관심 있는 셀은 자기 구슬로 포획됩니다. 음의 선별에서 원치 않는 세포는 적절한 항체를 운반하는 자기 구슬로 캡처하여 제거됩니다. 이 MACS 기술은 표적으로 한 세포의 좋은 농축을 허용하고 기관에 있는 1-20%에서 60-98%로 복구된 세포의 비율을 향상합니다. 정렬 후, 셀 순도 및 다른 방법(예: 유동 세포측정)에 의해 정렬되는지 확인해야 합니다. MACS 기술은 세포 배양 또는 세포 주기 분석과 같은 그밖 실험을 위한 표적 인구를 풍부하게 하기 위하여 이상적입니다.
이 실험실 운동에서는, 우리는 자기 세포 분류 기술을 사용하여 혼합에서 흉선 백혈구를 분리하고 그 후에 백혈구를 풍부하게 하는 방법을 보여줍니다.
Procedure
Results
In this protocol, CD3-positive cells were enriched from thymic leukocytes using magnetic cell sorting (Figure 1). Before magnetic cell enrichment CD3-positive cells represented 53.6% of the total thymic cells (Figure 2, top panels). After magnetic cell enrichment the percentage of CD3-positive cells increased to 95% (Figure 2, bottom panels). Thus, MACS is a simple, fast and efficient cell enrichment technique to enrich desired cell populations from a cell suspension mixture.

Figure 2: Gating strategy and purity test sorting. Cells are first gated based on their morphology (left: FSC-A, SSC-A), and then cells are plotted against CD3 (right: CD3, SSC-A). Top panel represents thymus cell suspension before cell enrichment. Bottom panel represents thymus cell suspension after magnetic cell sorting. Please click here to view a larger version of this figure.
Applications and Summary
Magnetic separation technology is a common method to easily and rapidly sort a target cell population. Using T cells specific antibodies and magnetic beads we enriched T cells frequency in our sample. The purity rate at the end of the experiment depends of the percentage of target cells in the initial cell suspension. Cells obtained after magnetic cell sorting can be used for various purposes such as- cell transfer or cell cycle analysis. Another sorting method, using flow cytometry, can be used to enrich cells. This technique yields have a very high purity rate after cell sorting however it requires more steps and takes more time.
References
- Owen, C. S. and Sykes, N. L. Magnetic labeling and cell sorting. Journal of Immunological Methods. 73 (1), 41-48 (1984).
- Miltenyi, S., Müller, W., Weichel, W. and Radbruch, A. High gradient magnetic cell separation with MACS. Cytometry. 11 (2), 231-238 (1990).
- Plouffe, B. D., Murthy, S. K. and Lewis, L. H. Fundamentals and application of magnetic particles in cell isolation and enrichment: a review. Reports on Progress in Physics. 78 (1), (2014).
Transcript
Magnetic-activated cell sorting, or MACS, is a technique that allows researchers to separate cells based on specific epitopes expressed on their surfaces.
The process typically begins with extraction of an organ or tissue, such as the thymus. Then, the cells are mechanically separated, usually by crushing, until the tissue is dissociated into single cells. Unwanted cells can be removed at this stage via the addition of chemicals. For example, ammonium-chloride-potassium, or ACK buffer, can be used to lyse unwanted erythrocytes.
Next, an antibody conjugated to a molecule called biotin is added to the suspension, and these complexes bind to the epitopes of the surface of the target cells. Biotin has a high affinity for another molecule called streptavidin. In the next step, streptavidin molecules fused to magnetic beads are added to the antibody labeled cells. When the biotin and streptavidin come into contact, they tightly bind. The result is that the cells of interest are coated with magnetic beads. This complex is sometimes referred to as a sandwich. In this case, CD3 on the cell membrane on the bottom, then anti-CD3 conjugated to biotin, and finally, streptavidin conjugated to magnetic beads.
These labeled cells can now be placed into a column containing a matrix which, assisted by gravity, allows the cells to pass slowly by a magnet. As they do so, the magnetic bead-labeled cells will stick to the edge of the tube nearest the magnet, while the non-labeled cells will continue on into a collection tube below. Next, the labeled cells can be removed from the column by simply removing the magnet, adding an eluent solution, and applying gentle pressure with a plunger to flush them out of the column and into a fresh collection tube. Ultimately, this process allows for 60 to 98% retrieval of the cells of interest.
In this procedure, we will isolate thymic leukocytes from a mouse and use MACS to sort out CD3-positive T-cells before confirming the efficiency of sorting using FACS.
To begin, put on any appropriate protective equipment including a lab coat and gloves. Next, wash a pair of dissecting scissors and forceps with 70% ethanol and dry them with a clean paper towel. Then prepare 200 milliliters of HBSS 2% fetal calf serum, or FCS, by mixing four milliliters of FCS with 196 milliliters of HBSS.
Pin a euthanized mouse in a supine position on a dissection plate. Using scissors and forceps, perform a longitudinal laparotomy to access the chest cavity. First, remove the heart to gain access to the thymus, which is located above the heart. Then identify the thymus, which is composed of two white lobes. Using forceps, carefully detach the thymus and place it on a Petri dish with five milliliters of HBSS 2% FCS.
To isolate the immune cells, first place the thymus on a 40 micrometer cell strainer in the Petri dish. Crush the tissue with a plunger to dissociate it into the dish. After this, rinse the plunger and strainer with HBSS 2% FCS to recover any adhered cells. Then, pipette the dissociated thymus cells and fluid from the Petri dish into a 15 milliliter centrifuge tube. Wash the Petri dish with five milliliters of HBSS 2% FCS and transfer this wash solution to the 15 milliliter centrifuge tube also.
Next, centrifuge the tube at 370 times g for seven minutes at 20 degrees Celsius. Discard the supernatant and resuspend the pellet in two milliliters of ACK lysing buffer to lyse the erythrocytes. Incubate for two minutes at room temperature on the bench top. Then, bring the volume to 14 milliliters with HBSS 2% FCS. Centrifuge the tube at 370 times g for seven minutes at 20 degrees Celsius. Then, discard the supernatant and resuspend the cells in five milliliters of HBSS 2% FCS.
Estimate the cell concentration using a Malassez slide as shown in the protocol for FACS isolation of B lymphocytes and adjust the cell concentration to 10 to the seventh cells per milliliter with HBSS 2% FCS.
Transfer 500 microliters of cell solution into two FACS tubes. Label one tube non-enriched T-cells and the other tube enriched T-cells, which will be separated using magnetic labeling.
Centrifuge the enriched T-cells tube at 370 times g for three minutes at 20 degrees Celsius. Discard the supernatant and resuspend the pellet in 250 microliters of biotin coupled anti CD3 antibody diluted one in 400 in HBSS 2% FCS. Incubate the cells for 20 minutes on ice and in the dark. Add three milliliters of HBSS 2% FCS to the tubes and centrifuge them again at 370 times g for three minutes at 20 degrees Celsius. Discard the supernatant and resuspend the pellet in 250 microliters of streptavidin-coupled beads diluted one in five in HBSS 2% FCS. Incubate the mixture of cells and beads for 20 minutes on ice. Next, add three milliliters of HBSS 2% FCS to the tube, pipette up and down to mix, and centrifuge again at 370 times g for three minutes at 20 degrees Celsius. Resuspend the pellet in two milliliters of HBSS 2% FCS.
Place the column on the magnet and add three milliliters of HBSS 2% FCS to humidify the system. Then, pipette the stained cells into the column. After the cell suspension passes through the column, wash the column three times with three milliliters of HBSS 2% FCS. Next, remove the column from the magnet and place it in a 15 milliliter tube. To elute the target cells, add five milliliters of HBSS 2% FCS to the column and flush the column with a plunger. Repeat this step with another five milliliters of HBSS 2% FCS.
To evaluate the effectiveness of target cell isolation, first transfer 500 microliters of eluted cell suspension to a FACS tube and label it enriched T-cells. Then, centrifuge both the enriched and non-enriched tubes at 370 times g for seven minutes at 20 degrees Celsius. Discard the supernatant, then add 100 microliters of fluorescent antibody diluted one in 200 in HBSS 2% FCS to both tubes. Incubate the cells for 20 minutes on ice and in the dark. Next, add three milliliters of HBSS 2% FCS to the tubes and centrifuge them at 370 times g for three minutes at 20 degrees Celsius. Discard the supernatant, then resuspend the pellets in 250 microliters of HBSS 2% FCS. Now, evaluate the CD3-positive cell enrichment rate using flow cytometry as shown in the FACS protocol.
Now, we will determine the frequency of CD3-positive lymphocytes among all thymocytes that were isolated from the mouse thymus. To start, double click on the FlowJo icon and drag the files for each tube in the all sample window. Then, double click on the enriched T-cells file to display the cells recorded from that sample on a dot plot that displays forward scatter, FSCA, on the x-axis, and side scatter, SSCA, on the y-axis.
Click on polygon to circle the lymphocyte populations. Next, double click on the circled population to create a new window. Select FSC-W on the y-axis, and FSC-A on the x-axis and circle the FSA-W negative cells. In the sub population identification window, name your cell population Single Cells. Next, click on OK on the sub population identification window, then double click on the circled population to create a new window. Select CD3 on the y-axis, and circle the CD3-positive cells. In the sub population identification window, name your cell population T-cells. Repeat with the non-enriched T-cells file. To visualize your cell population, click Layout Editor and drag the T-cell population from enriched T-cells and non-enriched T-cells files into the tab.
Dot plots representing CD3-positive lymphocytes will appear. CD3-positive cells should only appear in the population of interest in the CD3-positive enriched tube. To evaluate the enrichment of CD3-positive lymphocytes in the sorted cells, click on Table Editor and then drag the T-cells population from enriched T-cells and non-enriched T-cells files into the table. On the statistic menu, select Frequency of Lymphocyte Cells to check the percentage of CD3-positive cells in all lymphocytes. Then, click on Create Table. Parameter values will appear in a new table. For the enriched T-cells, the frequency of CD3-positive cells should be around 80% or above.
