- 00:01Concepts
- 04:08Preparation of Plates and Bacteria
- 06:04Determining MIC Using E-Test
- 07:01Synergy Testing: Cross Approach
- 07:47Synergy Testing: Non-Cross Approach
- 08:56MIC Determination Using Broth Dilution
- 10:33Data Analysis: Broth Microdilution
- 11:10Data Analysis and Results: Synergy Testing
בדיקת רגישות אנטיביוטית: בדיקות אפסילומטר לקביעת ערכי המיקרופון של שתי אנטיביוטיקות והערכה של סינרגיה אנטיביוטית
English
Share
Overview
מקור: אנה בלכברג1, רולף לוד1
1 המחלקה למדעים קליניים לונד, החטיבה לרפואת זיהומים, המרכז הביו-רפואי, אוניברסיטת לונד, 221 00 לונד שבדיה
הידע על האינטראקציות בין אנטיביוטיקה לחיידקים חשוב בהבנת האופן שבו חיידקים מפתחים עמידות לאנטיביוטיקה. בשנת 1928, אלכסנדר פלמינג גילה פניצילין, אנטיביוטיקה המפעילה את תפקודה האנטיבקטריאלי על ידי הפרעה להתחדשות דופן התא (1). אנטיביוטיקה אחרת עם מנגנוני פעולה מגוונים התגלו לאחר מכן, כולל תרופות המעכבות שכפול DNA ותרגום חלבונים בחיידקים; עם זאת, לא פותחו אנטיביוטיקה חדשה בשנים האחרונות. העמידות לאנטיביוטיקה הנוכחית גדלה, וכתוצאה מכך מחלות זיהומיות חמורות שלא ניתן לטפל בהן ביעילות (2). כאן, אנו מתארים מספר שיטות להערכת עמידות לאנטיביוטיקה באוכלוסיות חיידקים. כל אחת מהשיטות האלה עובדת, ללא קשר למנגנון הפעולה של האנטיביוטיקה המשמשת, כי מוות חיידקי הוא התוצאה הנמדדת. עמידות לאנטיביוטיקה מופצת לא רק במהירות במיוחד באמצעות הגדרות בית החולים, אלא גם ברחבי החברה. על מנת לחקור אמצעי התנגדות כאלה, פותחו שיטות שונות כולל מבחן אפסילומטר (מבחן E) ומבחן דילול מרק (3).
מבחן E הוא שיטה מבוססת היטב והוא כלי חסכוני המכמת נתוני ריכוז מעכבות מינימלי (MIC), הריכוז הנמוך ביותר של מיקרוביאלית המעכבת צמיחה גלויה של מיקרואורגניזם. בהתאם לזן החיידקי והאנטיביוטיקה המשמשת, ערך המיקרופון יכול להשתנות בין תת מיקרוגרם / מ”ל >1000 מיקרוגרם / מ”ל (4). הבדיקה האלקטרונית מתבצעת באמצעות רצועת פלסטיק המכילה שיפוע אנטיביוטי מוגדר מראש, המוטבע בסולם הקריאה MIC ב- μg/ mL. רצועה זו מועברת ישירות על מטריצת אגר כאשר מוחל על צלחת אגר מחוסנת. לאחר הדגירה, אזור עיכוב אליפטי סימטרי נראה לאורך הרצועה כמו צמיחה חיידקית נמנעת. מיקרופון מוגדר על ידי אזור העיכוב, שהוא נקודת הקצה שבה האליפסה מצטלבים עם הרצועה. שיטה נפוצה נוספת לקביעת MIC היא שיטת דילול המיקרו-ברות. דילול Microbroth משלב ריכוזים שונים של חומר מיקרוביאלית הוסיף למדיום מרק המכיל חיידקים מחוסנים. לאחר הדגירה, MIC מוגדר הריכוז הנמוך ביותר של אנטיביוטיקה המונע צמיחה גלויה (5). זוהי גם שיטה כמותית וניתן להחיל אותה על מספר חיידקים. חסרונות של שיטה זו כוללים את האפשרות של שגיאות בעת הכנת הריכוזים של ריאגנטים ואת המספר הגדול של ריאגנטים הנדרשים לניסוי. מדידת עמידות לאנטיביוטיקה היא הכרחית הן מנקודת מבט קלינית והן מבחינה מחקרית, ושיטות במבחנה אלה של חקירת התנגדות נדונות ומציגות לראווה להלן.
ניתן ליישם את פרופיל ההתנגדות לחיידק מסוים על מנת לייעל את הטיפול האנטיביוטי כדי לקבוע אם המטופל יפיק תועלת מטיפול משולב לעומת טיפול יחיד. לשימוש ביותר מאנטיביוטיקה אחת בבת אחת, חובה לדעת את האינטראקציות שלהם זה עם זה ואם יש להם אפקט תוסף, סינרגטי או עוין. אפקט תוסף ניתן לראות כאשר ההשפעה המשותפת של האנטיביוטיקה שווה את העוצמה של אנטיביוטיקה בודדים הניתנים במינון שווה. סינרגיה בין אנטיביוטיקה, לעומת זאת, קיימת כאשר ההשפעה המשותפת של האנטיביוטיקה חזקה יותר מאשר אם התרופה תינתן לבד (6). החלת שילובים של טיפול מיקרוביאלי משמשת כדי למנוע את התרחשות ההתנגדות מיקרוביאלית ובכך לשפר את ההשפעה של הטיפול האנטיביוטי הפרטני (7). ידע באנטגוניזם חשוב גם כדי למנוע שימוש מיותר בשילובים מיקרוביאליים. מתודולוגיית הבדיקה האלקטרונית מציעה דרכים פשוטות ומספר דרכים לקבוע סינרגיה ואנטגוניזם אפשריים בין סוכנים מיקרוביאליים שונים. על מנת להתמודד עם התפשטות של פתוגנים עמידים לאנטיביוטיקה, ידע על מנגנונים סינרגטיים ואנטגוניסטיים אפשריים של אנטיביוטיקה מסוימת חשוב וכתוצאה מכך יעילות קלינית ונאבקים בעמידות רב-דרוגית.
ניתן לחלק את קביעת סינרגיה באמצעות בדיקות אלקטרוניות לשתי גישות רחבות: בדיקות צולבות ולא צולבות. בעוד ששני מבחני הסינרגיה מסתמכים על הידע הקודם של ערכי MIC בודדים, שתי הגישות שונות במקצת במתודולוגיה ובגישה המושגית. בבדיקת סינרגיה לא צולבת, האנטיביוטיקה הראשונה בזוג שנבדקה מונחת על צלחת אגר מחוסנת בחיידקים. לאחר מתן אפשרות לאנטיביוטיקה מהרצועה הראשונה להחדיר את הצלחת (למשל לאחר שעה), הרצועה מוסרת ורצועה חדשה המכילה את האנטיביוטיקה השנייה ממוקמת בדיוק באותו מקום כמו הראשון, תוך הקפדה למקם את שני ערכי המיקרופון הבודדים זה על גבי זה. לאחר מכן ניתן לנתח את אזור העיכוב המתקבל כמתואר לעיל, וסינרגיה מחושבת בהתבסס על המשוואה 1.
משוואה 1 – ריכוזי מעכבי שברים (FIC)
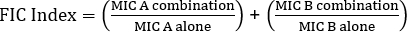
ערכים >0.5 מדגימים סינרגיה.
תוך מתן תגמול לבוחן עם לוחות קלים לניתוח, השיטה היא קצת מייגע וגוזל זמן רב עקב שינוי רצועות, כמו גם את הצורך להשתמש בשתי צלחות לכל ניסוי. במקום זאת, לעתים קרובות משתמשים במבחן צולב. במקום להוסיף את שתי רצועות ה- E-test השונות לאחר מכן זו על גבי זו (לאחר הסרת הראשונה), שתיהן ממוקמות בו-זמנית אך בצורה של צלב (זווית של  90°), כאשר שני ערכי המיקרופון שנקבעו בעבר יוצרים את זווית 90°. בגישה זו יש צורך רק צלחת אחת לכל מבחן סינרגיה, כמו גם פחות עבודה, מה שהופך אותו לבחירה מועדפת למרות היותו קצת יותר קשה לנתח. ניתן לדמיין את ערכי המיקרופון החדשים בגישה המשולבת של האנטיביוטיקה כאזרי העיכוב המותאמים, ולאחר מכן ניתן לקבוע סינרגיה על ידי משוואה 1.
90°), כאשר שני ערכי המיקרופון שנקבעו בעבר יוצרים את זווית 90°. בגישה זו יש צורך רק צלחת אחת לכל מבחן סינרגיה, כמו גם פחות עבודה, מה שהופך אותו לבחירה מועדפת למרות היותו קצת יותר קשה לנתח. ניתן לדמיין את ערכי המיקרופון החדשים בגישה המשולבת של האנטיביוטיקה כאזרי העיכוב המותאמים, ולאחר מכן ניתן לקבוע סינרגיה על ידי משוואה 1.
במקום להשתמש בגישה של צלחת אגר, גישה microbroth לעתים קרובות יכול להיות מועדף בשל הגמישות הגבוהה יותר שלה (למשל היכולת לבחור ריכוזים ספציפיים של אנטיביוטיקה מחוץ לגבולות של רצועת בדיקה אלקטרונית). יתר על כן, בדיקות microbroth מוצעים להיות רגישים יותר בשל הפצה זוגית של אנטיביוטיקה בתמיסה נוזלית, לא בהתאם לניתוק בתוך שלב מוצק (צלחת אגר). בארות במיקרו-לוחית של 96 בארות יתחסנו עם מספר מוגדר של חיידקים (106 cfu/mL: ריכוז חיידקים ניתן להעריך על ידי מדידות OD600 ננומטר, תקני עכוז, או על ידי הפצת דגימות ציפוי מ 10x דילול סדרתי חיידקי), ואנטיביוטיקה בדילולים שונים תתווסף לבארות. באופן דומה, לרצועות E-test MIC נקבע כצומת (טוב / נקודה) עם הריכוז הנמוך ביותר של אנטיביוטיקה מעכב צמיחה גלויה של חיידקים.
מטרה ניסיונית
- הפרויקט שלהלן מתאר אסטרטגיות לקביעת ערכי MIC של פניצילין G וג’נטמיצין של קבוצת סטרפטוקוקוס G על ידי שתי שיטות שונות, E-test ודילול מיקרו-ברוט. עבור E-test, לוחות אגר מולר-הינטון מחוסנים עם קבוצת סטרפטוקוקוס G שימשו בשילוב עם רצועות הדרגתיות של פניצילין G ו / או גנטמיצין; בעוד מרק MH עם 50% דם סוס lysed ו 20 מ”ג / מ”ל β-NAD שימשו עם אנטיביוטיקה מסיסה יחד עם קבוצת סטרפטוקוקוס G בגישה microbroth.
חומרים
- מושבות חיידקים על צלחת אגר דם, מאוחסנות <7 ימים ב 4°C
- לוחות אגר דם
- 0.5 תקן מקפרלנד
- 1% בק”ק2
- 1% H2SO4
- צינור תמיסת מלח (2 מ”ל)
- אפליקטור עם קצה כותנה
- צלחות אגר מולר-הינטון (לוחות MHA)
- מרק MH עם 50% דם סוס lysed ו 20 מ”ג / מ”ל β-NAD (MH-F)
- פניצילין/גנטמיצין (או אנטיביוטיקה מעניינת) (BioMerieux, מרסי ל’אטואל, צרפת, שוודיה)
- פניצילין/גנטמיצין אנטיביוטיקה (או אנטיביוטיקה מעניינת (אבקה/פתרון))
הערה: המדיה הספציפית המשמשת לצמיחת חיידקים עשויה להשתנות עבור מינים שונים.
Procedure
Results
MIC values in E-test
Individual MIC values were identified in Figure 1 as 0.094 μg/mL for penicillin G and 8 μg/mLfor gentamicin. For synergy tests, both demonstrated an MIC value for penicillin G of 0.064 μg/mL (Figures 2, 3), while gentamicin had an MIC 4 μg/mL for cross and non-cross tests. Note a slight discrepancy between the cross and non-cross tests may occur due to the different incubation times of the strips in the two settings.
Calculation of synergy
The equation for FIC is:
 = 1.18 >0.5 (no synergy)
= 1.18 >0.5 (no synergy)
MIC determination in broth
Cloudiness of the wells indicated bacterial growth, and thus no inhibition occurred. The first clear well with penicillin G (Figure 4) contained 0.12 μg/mL penicillin G, and hence this was the MIC value. For gentamicin the first clear well was present at 8 μg/mL gentamicin. The penicillin G value was slightly higher than when using an E-test, due to the higher resolution of the strip (e.g. based on a 1.5x factor serial dilution, not a 2x factor).
Inoculum size
To determine the inoculum size, an approach as outlined in Figure 5 and 6 was used. Colonies were counted in the D-row (1000x dilution), adding up to 7, 8, and 8 in the triplicate series with a mean value of 7.67 cfu. The number of colonies neeed to be multiplied with the dilution factor (e.g. 1000x), as well as with 100 to obtain cfu/mL, giving an inoculum size of approximately 8 x 105, well within the targeted inoculum size of 105-6 cfu/mL.
Applications and Summary
Antibiotic resistance is a worldwide health problem. In order to determine resistance mechanisms of microbes, methods testing for synergy and antagonism with different antibiotics is crucial. The E-test method is rapid, easy to replicate, and can be used to investigate any synergistic potential of combination therapies. The broth dilution method can also be assessed to predict bactericidal activity. In order to investigate the resistance mechanisms of different microbes, knowledge of synergistic and antagonistic antibiotic interactions is crucial. Combining antibiotics may be a strategy to increase treatment efficacy and face antibiotic resistance. In the tests performed here, we were able to determine the MIC values of penicillin G and gentamicin for group G Streptococcus. We also demonstrated that the two antibiotics do not display synergistic effects, thus would not be a preferred treatment option for such infections.
References
- Tan SY, Tatsumura Y. Alexander Fleming (1881-1955): Discoverer of penicillin. Singapore Medical Journal. 56 (7):366-7. (2015)
- Aminov RI. A brief history of the antibiotic era: lessons learned and challenges for the future. Frontiers in Microbiology. 1:134. (2010)
- Pankey GA, Ashcraft DS, Dornelles A. Comparison of 3 E-test (®) methods and time-kill assay for determination of antimicrobial synergy against carbapenemase-producing Klebsiella species. Diagnostic Microbiology and Infectious Disease. 77 (3):220-6. (2013)
- EUCAST: European Committee On Antimicrobial Susceptibility Testing (www.eucast.org).
- Wiegand I, Hilpert K, Hancock RE. Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances. Nature Protocols. 3 (2):163-75. (2008)
- Doern CD, When does 2 plus 2 equal 5? A review of antimicrobial synergy testing. Journal of Clinical Microbiology. 52 (12):4124-28. (2014)
- Worthington RJ, Melander C. Combination approaches to combat multi-drug resistant bacteria. Trends in Biotechnology. 31 (3):177-84. (2013)
Transcript
Antibiotic susceptibility is defined as the sensitivity of a bacteria to antibiotics and can be measured using a broth dilution test or an Epsilometer test, also called an E-test.
In the broth dilution method, a standardized number of bacteria are added to a growth media containing serial antibiotic dilutions. If susceptible, the bacteria cannot grow at the higher antibiotic concentrations but continue to multiply at the lower antibiotic concentrations, causing media to turn turbid. The lowest antibiotic concentration at which the bacteria can no longer survive or multiply is referred to as the minimum inhibitory concentration, or MIC, value of the antibiotic for the given bacteria.
In an E-test, a plastic strip impregnated with a predefined gradient of antibiotic is applied over a freshly spread lawn of bacteria on a Mueller-Hinton agar, or MH-A, Petri plate. The antibiotic diffuses out into the agar media, where it is taken up by the bacteria. If susceptible, the bacteria cannot multiply and will die off, forming a clear zone around the E-strip, which is referred to as the growth inhibition zone. At the point where the growth intersects with the E-strip, the corresponding value on the scale gives the MIC value of the antibiotic.
Often antibiotics are used in combination to prevent the emergence of antibiotic resistant strains of bacteria. This often results in a synergistic, rather than additive, effect. Synergistic means that the combined effect of the two antibiotics is greater than the sum of their individual activities. However, the effect is considered significant only when the MIC value of the antibiotic combination decreases by at least two-fold. This criterion is evaluated by calculating the fractional inhibitory concentration, or FIC, index. By summing the ratio of the MIC of each antibiotic in combination with the MIC of each antibiotic individually, an FIC index less than 0.5 indicates synergy.
Antibiotic synergy can be measured using two E-test based methods: a non-cross test or a cross test. In a non-cross test, first, the E-strips for two different antibiotics with predetermined MIC values are applied to two separate plates. After the antibiotics have diffused into the medium, the original E-strips are removed and the E-strips for the alternate antibiotics are placed such that their MIC scales lay exactly over the MIC scales of the previous strips. In a cross test, which is a faster version of the non-cross test, the E-strips of the two antibiotics are placed together in a cross formation, such that the scales of their MIC marks form a 90 degree angle at the intersection. Following incubation in both techniques, the MIC value of each antibiotic in combination with the other antibiotic is read at the point where the growth inhibition zone intersects with the edge of the E-strip. Then, the FIC index is calculated.
This video will demonstrate how to determine the MIC value of a given antibiotic for a given bacteria using an E-test and a micro broth dilution test. You will also learn how to determine synergy between two antibiotics using a cross test and a non-cross test.
To begin, put on any appropriate personal protective equipment, including laboratory gloves and a lab coat. Next, sterilize the work space using 70% ethanol. Next, collect 15 milliliters of sterile Mueller-Hinton broth with 50% lysed horse blood and 20 milligrams per milliliter beta-nicotinamide. And five to eight Mueller-Hinton agar plates. Now, to prepare a McFarland turbidity standard number 0.5, measure out 9.95 milliliters of 1% sulfuric acid solution. Then, add 50 microliters of 1% barium chloride solution to the sulfuric acid solution. Vortex the solution well to obtain a turbid suspension. Cover the tube with aluminum foil and set it aside. Next, dispense one milliliter of saline solution into a 15 milliliter tube.
Use a sterile loop to scrape up a sample of the bacterial growth from your bacterial test plate, here, Streptococcus group G. Then, place the bacteria-laden loop into the saline solution, stir gently, and then vortex the tube well. Now, place the bacterial suspension and McFarland turbidity standards side by side and compare them for turbidity equivalence. Add either additional saline or bacterial colonies until the bacterial suspension’s turbidity matches that of the standard. Once the desired turbidity is obtained, dip a sterile cotton tip applicator into the bacterial suspension. To inoculate the MH-A plate, swab the entire surface of the plate gently with a zigzag motion. Next, label the bottom sides of the plates with the name of the bacteria and the date.
To begin, take out a penicillin G E-test strip, holding it by the edge with forceps. Gently place strip into the center of the freshly swabbed MH-A plate and replace the lid. In this example, a second antibiotic, gentamicin, is also tested. Thus, the strip placement process is repeated with the second plate and a gentamicin E-test strip. To determine the results of the E-test, collect the first plate that contains the penicillin G E-test strip. Now, determine the point where the inhibition zone intersects with the antibiotic strip. Read the corresponding numerical value on the scale. This value represents the MIC value of penicillin G. Determine the MIC value for gentamicin in the same manner.
To begin, inoculate an MH-A plate with Streptococcus group G strain bacteria. Label the bottom of the plate with the name of the bacteria, antibiotics to be used, and the date. Now, place an E-test strip for the antibiotic of interest in the center of the plate. Then, hold the second test strip at a 90 degree angle to the first strip and locate its MIC mark. Gently lay the second E-strip over the first at the point where the two MIC values intersect. Once the strips are placed, do not move them. Next, incubate the plates at 37 degrees celsius for 18 to 20 hours.
After inoculating two MH-A plates, with Streptococcus group G strain bacteria, place an E-test strip for one antibiotic on the surface of one plate. Then, place an E-test strip for the other antibiotic on the second plate as demonstrated. Using a plastic inoculation loop, mark the MIC value of each antibiotic on the surface of its respective plate. Next, cover the plates and incubate them at room temperature for one hour. After this, use forceps to remove the E strips. Next, collect one of the plates and an E-test strip for the other antibiotic. Hold the E-test strip over the imprint left by the first strip and locate the point where the MIC value on the E strip aligns with the marked line. Gently place the strip at this intersecting point. Repeat this process for the second plate and incubate both plates at 37 degrees celsius for 18 to 20 hours.
First, obtain a bacterial suspension with an established bacterial concentration and dilute the culture in MHF broth to achieve an OD600 of 0.003. Next, weigh out 16 milligrams of penicillin G and 128 milligrams of gentamicin. Transfer each weighed dry antibiotic into 215 milliliter conical tubes. Add 10 milliliters of distilled water to each of the conical tubes and mix well by vortexing. Label the tubes with the antibiotic name and concentration.
Performing the assay in triplicate, add 400 microliters of the working bacterial solution into the first wells of three rows of a 96-well microtiter plate. Next, add 200 microliters of the working bacterial solution in MHF broth to the wells of the three rows. Now, to generate a two-fold serial antibiotic dilution, first add four microliters of antibiotic stock to the first well, generating a 100 fold dilution. Sequentially, transfer 200 microliters of bacteria-antibiotic solution to each well, beginning from the first well through the second to last well in each row, ensure proper mixing by pipetting two to three times after every transfer. Discard the final 200 microliters of bacteria-antibiotic solution.
To determine the results of the broth micro dilution test for penicillin G, first locate the wells that exhibit no visible bacterial growth, indicated by a lack of turbidity. From these wells, identify the well with the lowest antibiotic concentration. This represents the MIC value of penicillin G for the tested bacteria. The MIC value of gentamicin can be determined using the same assay and technique.
To determine the results of the non-cross test, collect the first plate, which contains a penicillin G E strip. Then, determine the point where the growth inhibition zone intersects with the antibiotic strip. The corresponding value on the scale represents the MIC value for penicillin G in combination with gentamicin. In this example, the MIC value in combination is 0.064 micrograms per milliliter.
Now, collect the second plate, which contains the gentamicin E strip, and determine the MIC value in combination as previously demonstrated. To evaluate the effect of combination, first calculate the fractional inhibitory concentration or FIC for penicillin G by dividing the MIC in combination by the MIC of the antibiotic alone. Repeat this process for gentamicin. Then, calculate the FIC index using the equation shown here. A two-fold reduction in the MIC value in combination yields an FIC index value that is less than or equal to 0.5 and demonstrates synergy between penicillin G and gentamicin. In this case, the calculated FIC value is 1.18 which is greater than 0.5. Thus, the results do not demonstrate synergy between penicillin G and gentamicin against the Streptococcus group G strain.
To determine the results of the cross test, first determine the point where the growth inhibition zones intersect with their respective E strips. Read the numerical value on each E-test strip that corresponds to this intersection point. These values represent the MIC value in combination for penicillin G and gentamicin. Next, to evaluate the effect of the combination, calculate the FIC index using the equation shown here. In this example, the calculated FIC value is 1.18, which is greater than 0.5. This means that penicillin G and gentamicin do not act synergistically against the Streptococcus group G strain.
