- 00:01Concepts
- 04:08Preparation of Plates and Bacteria
- 06:04Determining MIC Using E-Test
- 07:01Synergy Testing: Cross Approach
- 07:47Synergy Testing: Non-Cross Approach
- 08:56MIC Determination Using Broth Dilution
- 10:33Data Analysis: Broth Microdilution
- 11:10Data Analysis and Results: Synergy Testing
Teste de sucetibilidade a antibióticos: testes de epsilômetro para determinar valores de MIC de dois antibióticos e avaliar a sinergia de antibióticos
English
Share
Overview
Fonte: Anna Bläckberg1, Rolf Lood1
1 Departamento de Ciências Clínicas Lund, Divisão de Medicina de Infecção, Centro Biomédico, Universidade de Lund, 221 00 Lund Suécia
O conhecimento das interações entre antibióticos e bactérias é importante para entender como micróbios evoluem a resistência a antibióticos. Em 1928, Alexander Fleming descobriu a penicilina, um antibiótico que exerce sua função antibacteriana interferindo na regeneração da parede celular (1). Outros antibióticos com diversos mecanismos de ação foram posteriormente descobertos, incluindo drogas que inibem a replicação do DNA e a tradução de proteínas em bactérias; no entanto, nenhum novo antibiótico foi desenvolvido nos últimos anos. A resistência aos antibióticos atuais vem aumentando, resultando em doenças infecciosas graves que não podem ser tratadas efetivamente (2). Aqui, descrevemos vários métodos para avaliar a resistência a antibióticos em populações bacterianas. Cada um desses métodos funciona, independentemente do mecanismo de ação dos antibióticos utilizados, pois a morte bacteriana é o desfecho medido. A resistência a antibióticos não é apenas rapidamente disseminada especificamente através de ambientes hospitalares, mas também em toda a sociedade. Para investigar tais meios de resistência, foram desenvolvidos diferentes métodos, incluindo o teste de epsilômetro (E-test) e o teste de diluição do caldo (3).
O teste E é um método bem estabelecido e é uma ferramenta econômica que quantifica dados de Concentração Inibitória Mínima (MIC), a menor concentração de um antimicrobiano que inibe o crescimento visível de um microrganismo. Dependendo da cepa bacteriana e dos antibióticos utilizados, o valor mic pode variar entre sub μg/mL a >1000 μg/mL (4). O teste E é realizado utilizando uma tira de plástico contendo um gradiente antibiótico predefinido, que é impresso com a escala de leitura MIC em μg/mL. Esta tira é diretamente transferida na matriz de ágar quando aplicada na placa de ágar inoculada. Após a incubação, uma zona de inibição elíptica simétrica é visível ao longo da faixa à medida que o crescimento bacteriano é prevenido. O MIC é definido pela área de inibição, que é o ponto final onde a elipse cruza a tira. Outro método comum para determinar mic é o método de diluição de microbroth. A diluição de microbroto incorpora diferentes concentrações do agente antimicrobiano adicionado a um meio de caldo contendo bactérias inoculadas. Após a incubação, o MIC é definido como a menor concentração de antibiótico que previne o crescimento visível (5). É também um método quantitativo e pode ser aplicado a várias bactérias. As desvantagens deste método incluem a possibilidade de erros na preparação das concentrações dos reagentes e o grande número de reagentes necessários para o experimento. Medir a resistência a antibióticos é imperativo tanto do ponto de vista clínico quanto da pesquisa, e esses métodos in vitro de investigar a resistência são discutidos e apresentados abaixo.
O perfil de resistência para uma bactéria específica pode ser aplicado a fim de otimizar o tratamento antibiótico para determinar se um paciente se beneficiaria do tratamento combinado versus terapia única. Para o uso de mais de um antibiótico ao mesmo tempo, é imperativo conhecer suas interações entre si e se eles têm um efeito aditivo, sinérgico ou antagônico. Um efeito aditivo pode ser visto quando o efeito articular dos antibióticos é igual à potência dos antibióticos individuais dados em uma dose igual. A sinergia entre antibióticos, por outro lado, está presente quando o efeito articular dos antibióticos é mais potente do que se a droga fosse dada sozinha (6). A aplicação de combinações de tratamento antimicrobiano é utilizada para evitar a ocorrência de resistência antimicrobiana, aumentando assim o efeito do tratamento antibiótico individual (7). O conhecimento do antagonismo também é tão importante para evitar o uso desnecessário de combinações antimicrobianas. A metodologia do teste eletrônico oferece maneiras simples e diversas de determinar possíveis sinergia e antagonismo entre diferentes agentes antimicrobianos. Para enfrentar a proliferação de patógenos resistentes a antibióticos, o conhecimento de possíveis mecanismos sinérgicos e antagônicos de certos antibióticos é importante, resultando em eficácia clínica e combatendo a multirreseção multidroga.
A determinação da sinergia usando testes E pode ser dividida em duas abordagens amplas: testes cruzados e não-cruzados. Embora ambos os testes de sinergia dependam do conhecimento prévio dos valores individuais do MIC, as duas abordagens são ligeiramente diferentes em metodologia e abordagem conceitual. Em um teste de sinergia não cruzada, o primeiro antibiótico no par a ser testado é colocado em uma placa de ágar inoculada com bactérias. Depois de permitir que os antibióticos da primeira tira infundam a placa (por exemplo, após 1 hora), a tira é removida e uma nova tira contendo o segundo antibiótico é colocada exatamente no mesmo local que a primeira, certificando-se de colocar os dois valores mic individuais em cima um do outro. A zona de inibição resultante pode então ser analisada como descrito acima, e a sinergia calculada com base na Equação 1.
Equação 1 – Concentrações Inibitórias Fracionárias (FIC)
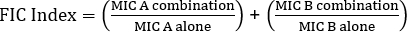
Valores >0,5 demonstram sinergia.
Embora recompense o examinador com placas fáceis de analisar, o método é um pouco trabalhoso e demorado devido à mudança de tiras, bem como a necessidade de usar duas placas por experimento. Em vez disso, um teste cruzado é frequentemente empregado. Em vez de adicionar as duas diferentes tiras de teste E posteriormente em cima uma da outra (após a remoção da primeira), ambas são colocadas simultaneamente, mas na forma de uma cruz  (ângulo de 90°), com os dois valores MIC previamente determinados formando o ângulo de 90°. Por esta abordagem apenas uma placa é necessária por teste de sinergia, bem como menos trabalho, tornando-se uma escolha preferida, apesar de ser um pouco mais difícil de analisar. Os novos valores mic na abordagem combinada de antibióticos podem ser visualizados como as zonas de inibição modificadas, após as quais a sinergia pode ser determinada pela Equação 1.
(ângulo de 90°), com os dois valores MIC previamente determinados formando o ângulo de 90°. Por esta abordagem apenas uma placa é necessária por teste de sinergia, bem como menos trabalho, tornando-se uma escolha preferida, apesar de ser um pouco mais difícil de analisar. Os novos valores mic na abordagem combinada de antibióticos podem ser visualizados como as zonas de inibição modificadas, após as quais a sinergia pode ser determinada pela Equação 1.
Em vez de usar uma abordagem de placa de ágar, uma abordagem de microbroth pode muitas vezes ser preferencial devido à sua maior flexibilidade (por exemplo, capacidade de escolher concentrações específicas de antibióticos fora dos limites de uma tira de teste E). Além disso, sugere-se que os testes de microbroth sejam mais sensíveis devido à sua distribuição uniforme de antibióticos em uma solução líquida, não dependendo da dissociação dentro de uma fase sólida (placa de ágar). Poços em uma microplaca de 96 poços serão inoculados com um número definido de bactérias (106 cfu/mL: a concentração bacteriana pode ser estimada por medidas de OD600 nm, padrões de turbidez, ou por amostras de revestimento espalhadas de diluições bacterianas 10x), e antibióticos em diferentes diluições serão adicionados aos poços. Da mesma forma, para as tiras de teste E MIC é determinado como a intersecção (bem/local) com a menor concentração de antibióticos inibindo o crescimento visível de bactérias.
Objetivo Experimental
- O projeto abaixo descreve estratégias para determinar os valores MIC da penicilina G e gentamicina do grupo G de Streptococcus por dois métodos diferentes, e-test e diluição de microbroth. Para o teste eletrônico, as placas de ágar Mueller-Hinton inoculadas com o grupo Streptococcus G foram utilizadas em combinação com tiras gradientes de penicilina G e/ou gentamicina; enquanto o caldo MH com 50% de sangue de cavalo e 20 mg/mL β-NAD foram usados com antibióticos solúveis juntamente com o grupo G em uma abordagem de microbroth.
Materiais
- Colônias bacterianas em uma placa de ágar de sangue, armazenadas <7 dias em 4°C
- Placas de ágar de sangue
- 0.5 Padrão McFarland
- 1% BaCl2
- 1% H2SO4
- Tubo salino (2 mL)
- Aplicador de ponta de algodão
- Placas de ágar Mueller-Hinton (placas de MHA)
- Caldo de MH com 50% de sangue de cavalo e 20 mg/mL β-NAD (MH-F)
- Penicilina/gentamicina de teste de e-test (ou antibióticos de interesse) (BioMerieux, Marcy l’Etoile, França, Suécia)
- Antibióticos penicilina/gentamicina (ou antibióticos de interesse (pó/solução))
Nota: As mídias específicas utilizadas para o crescimento bacteriano podem variar para diferentes espécies.
Procedure
Results
MIC values in E-test
Individual MIC values were identified in Figure 1 as 0.094 μg/mL for penicillin G and 8 μg/mLfor gentamicin. For synergy tests, both demonstrated an MIC value for penicillin G of 0.064 μg/mL (Figures 2, 3), while gentamicin had an MIC 4 μg/mL for cross and non-cross tests. Note a slight discrepancy between the cross and non-cross tests may occur due to the different incubation times of the strips in the two settings.
Calculation of synergy
The equation for FIC is:
 = 1.18 >0.5 (no synergy)
= 1.18 >0.5 (no synergy)
MIC determination in broth
Cloudiness of the wells indicated bacterial growth, and thus no inhibition occurred. The first clear well with penicillin G (Figure 4) contained 0.12 μg/mL penicillin G, and hence this was the MIC value. For gentamicin the first clear well was present at 8 μg/mL gentamicin. The penicillin G value was slightly higher than when using an E-test, due to the higher resolution of the strip (e.g. based on a 1.5x factor serial dilution, not a 2x factor).
Inoculum size
To determine the inoculum size, an approach as outlined in Figure 5 and 6 was used. Colonies were counted in the D-row (1000x dilution), adding up to 7, 8, and 8 in the triplicate series with a mean value of 7.67 cfu. The number of colonies neeed to be multiplied with the dilution factor (e.g. 1000x), as well as with 100 to obtain cfu/mL, giving an inoculum size of approximately 8 x 105, well within the targeted inoculum size of 105-6 cfu/mL.
Applications and Summary
Antibiotic resistance is a worldwide health problem. In order to determine resistance mechanisms of microbes, methods testing for synergy and antagonism with different antibiotics is crucial. The E-test method is rapid, easy to replicate, and can be used to investigate any synergistic potential of combination therapies. The broth dilution method can also be assessed to predict bactericidal activity. In order to investigate the resistance mechanisms of different microbes, knowledge of synergistic and antagonistic antibiotic interactions is crucial. Combining antibiotics may be a strategy to increase treatment efficacy and face antibiotic resistance. In the tests performed here, we were able to determine the MIC values of penicillin G and gentamicin for group G Streptococcus. We also demonstrated that the two antibiotics do not display synergistic effects, thus would not be a preferred treatment option for such infections.
References
- Tan SY, Tatsumura Y. Alexander Fleming (1881-1955): Discoverer of penicillin. Singapore Medical Journal. 56 (7):366-7. (2015)
- Aminov RI. A brief history of the antibiotic era: lessons learned and challenges for the future. Frontiers in Microbiology. 1:134. (2010)
- Pankey GA, Ashcraft DS, Dornelles A. Comparison of 3 E-test (®) methods and time-kill assay for determination of antimicrobial synergy against carbapenemase-producing Klebsiella species. Diagnostic Microbiology and Infectious Disease. 77 (3):220-6. (2013)
- EUCAST: European Committee On Antimicrobial Susceptibility Testing (www.eucast.org).
- Wiegand I, Hilpert K, Hancock RE. Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances. Nature Protocols. 3 (2):163-75. (2008)
- Doern CD, When does 2 plus 2 equal 5? A review of antimicrobial synergy testing. Journal of Clinical Microbiology. 52 (12):4124-28. (2014)
- Worthington RJ, Melander C. Combination approaches to combat multi-drug resistant bacteria. Trends in Biotechnology. 31 (3):177-84. (2013)
Transcript
Antibiotic susceptibility is defined as the sensitivity of a bacteria to antibiotics and can be measured using a broth dilution test or an Epsilometer test, also called an E-test.
In the broth dilution method, a standardized number of bacteria are added to a growth media containing serial antibiotic dilutions. If susceptible, the bacteria cannot grow at the higher antibiotic concentrations but continue to multiply at the lower antibiotic concentrations, causing media to turn turbid. The lowest antibiotic concentration at which the bacteria can no longer survive or multiply is referred to as the minimum inhibitory concentration, or MIC, value of the antibiotic for the given bacteria.
In an E-test, a plastic strip impregnated with a predefined gradient of antibiotic is applied over a freshly spread lawn of bacteria on a Mueller-Hinton agar, or MH-A, Petri plate. The antibiotic diffuses out into the agar media, where it is taken up by the bacteria. If susceptible, the bacteria cannot multiply and will die off, forming a clear zone around the E-strip, which is referred to as the growth inhibition zone. At the point where the growth intersects with the E-strip, the corresponding value on the scale gives the MIC value of the antibiotic.
Often antibiotics are used in combination to prevent the emergence of antibiotic resistant strains of bacteria. This often results in a synergistic, rather than additive, effect. Synergistic means that the combined effect of the two antibiotics is greater than the sum of their individual activities. However, the effect is considered significant only when the MIC value of the antibiotic combination decreases by at least two-fold. This criterion is evaluated by calculating the fractional inhibitory concentration, or FIC, index. By summing the ratio of the MIC of each antibiotic in combination with the MIC of each antibiotic individually, an FIC index less than 0.5 indicates synergy.
Antibiotic synergy can be measured using two E-test based methods: a non-cross test or a cross test. In a non-cross test, first, the E-strips for two different antibiotics with predetermined MIC values are applied to two separate plates. After the antibiotics have diffused into the medium, the original E-strips are removed and the E-strips for the alternate antibiotics are placed such that their MIC scales lay exactly over the MIC scales of the previous strips. In a cross test, which is a faster version of the non-cross test, the E-strips of the two antibiotics are placed together in a cross formation, such that the scales of their MIC marks form a 90 degree angle at the intersection. Following incubation in both techniques, the MIC value of each antibiotic in combination with the other antibiotic is read at the point where the growth inhibition zone intersects with the edge of the E-strip. Then, the FIC index is calculated.
This video will demonstrate how to determine the MIC value of a given antibiotic for a given bacteria using an E-test and a micro broth dilution test. You will also learn how to determine synergy between two antibiotics using a cross test and a non-cross test.
To begin, put on any appropriate personal protective equipment, including laboratory gloves and a lab coat. Next, sterilize the work space using 70% ethanol. Next, collect 15 milliliters of sterile Mueller-Hinton broth with 50% lysed horse blood and 20 milligrams per milliliter beta-nicotinamide. And five to eight Mueller-Hinton agar plates. Now, to prepare a McFarland turbidity standard number 0.5, measure out 9.95 milliliters of 1% sulfuric acid solution. Then, add 50 microliters of 1% barium chloride solution to the sulfuric acid solution. Vortex the solution well to obtain a turbid suspension. Cover the tube with aluminum foil and set it aside. Next, dispense one milliliter of saline solution into a 15 milliliter tube.
Use a sterile loop to scrape up a sample of the bacterial growth from your bacterial test plate, here, Streptococcus group G. Then, place the bacteria-laden loop into the saline solution, stir gently, and then vortex the tube well. Now, place the bacterial suspension and McFarland turbidity standards side by side and compare them for turbidity equivalence. Add either additional saline or bacterial colonies until the bacterial suspension’s turbidity matches that of the standard. Once the desired turbidity is obtained, dip a sterile cotton tip applicator into the bacterial suspension. To inoculate the MH-A plate, swab the entire surface of the plate gently with a zigzag motion. Next, label the bottom sides of the plates with the name of the bacteria and the date.
To begin, take out a penicillin G E-test strip, holding it by the edge with forceps. Gently place strip into the center of the freshly swabbed MH-A plate and replace the lid. In this example, a second antibiotic, gentamicin, is also tested. Thus, the strip placement process is repeated with the second plate and a gentamicin E-test strip. To determine the results of the E-test, collect the first plate that contains the penicillin G E-test strip. Now, determine the point where the inhibition zone intersects with the antibiotic strip. Read the corresponding numerical value on the scale. This value represents the MIC value of penicillin G. Determine the MIC value for gentamicin in the same manner.
To begin, inoculate an MH-A plate with Streptococcus group G strain bacteria. Label the bottom of the plate with the name of the bacteria, antibiotics to be used, and the date. Now, place an E-test strip for the antibiotic of interest in the center of the plate. Then, hold the second test strip at a 90 degree angle to the first strip and locate its MIC mark. Gently lay the second E-strip over the first at the point where the two MIC values intersect. Once the strips are placed, do not move them. Next, incubate the plates at 37 degrees celsius for 18 to 20 hours.
After inoculating two MH-A plates, with Streptococcus group G strain bacteria, place an E-test strip for one antibiotic on the surface of one plate. Then, place an E-test strip for the other antibiotic on the second plate as demonstrated. Using a plastic inoculation loop, mark the MIC value of each antibiotic on the surface of its respective plate. Next, cover the plates and incubate them at room temperature for one hour. After this, use forceps to remove the E strips. Next, collect one of the plates and an E-test strip for the other antibiotic. Hold the E-test strip over the imprint left by the first strip and locate the point where the MIC value on the E strip aligns with the marked line. Gently place the strip at this intersecting point. Repeat this process for the second plate and incubate both plates at 37 degrees celsius for 18 to 20 hours.
First, obtain a bacterial suspension with an established bacterial concentration and dilute the culture in MHF broth to achieve an OD600 of 0.003. Next, weigh out 16 milligrams of penicillin G and 128 milligrams of gentamicin. Transfer each weighed dry antibiotic into 215 milliliter conical tubes. Add 10 milliliters of distilled water to each of the conical tubes and mix well by vortexing. Label the tubes with the antibiotic name and concentration.
Performing the assay in triplicate, add 400 microliters of the working bacterial solution into the first wells of three rows of a 96-well microtiter plate. Next, add 200 microliters of the working bacterial solution in MHF broth to the wells of the three rows. Now, to generate a two-fold serial antibiotic dilution, first add four microliters of antibiotic stock to the first well, generating a 100 fold dilution. Sequentially, transfer 200 microliters of bacteria-antibiotic solution to each well, beginning from the first well through the second to last well in each row, ensure proper mixing by pipetting two to three times after every transfer. Discard the final 200 microliters of bacteria-antibiotic solution.
To determine the results of the broth micro dilution test for penicillin G, first locate the wells that exhibit no visible bacterial growth, indicated by a lack of turbidity. From these wells, identify the well with the lowest antibiotic concentration. This represents the MIC value of penicillin G for the tested bacteria. The MIC value of gentamicin can be determined using the same assay and technique.
To determine the results of the non-cross test, collect the first plate, which contains a penicillin G E strip. Then, determine the point where the growth inhibition zone intersects with the antibiotic strip. The corresponding value on the scale represents the MIC value for penicillin G in combination with gentamicin. In this example, the MIC value in combination is 0.064 micrograms per milliliter.
Now, collect the second plate, which contains the gentamicin E strip, and determine the MIC value in combination as previously demonstrated. To evaluate the effect of combination, first calculate the fractional inhibitory concentration or FIC for penicillin G by dividing the MIC in combination by the MIC of the antibiotic alone. Repeat this process for gentamicin. Then, calculate the FIC index using the equation shown here. A two-fold reduction in the MIC value in combination yields an FIC index value that is less than or equal to 0.5 and demonstrates synergy between penicillin G and gentamicin. In this case, the calculated FIC value is 1.18 which is greater than 0.5. Thus, the results do not demonstrate synergy between penicillin G and gentamicin against the Streptococcus group G strain.
To determine the results of the cross test, first determine the point where the growth inhibition zones intersect with their respective E strips. Read the numerical value on each E-test strip that corresponds to this intersection point. These values represent the MIC value in combination for penicillin G and gentamicin. Next, to evaluate the effect of the combination, calculate the FIC index using the equation shown here. In this example, the calculated FIC value is 1.18, which is greater than 0.5. This means that penicillin G and gentamicin do not act synergistically against the Streptococcus group G strain.
