- 00:01Concepts
- 04:08Preparation of Plates and Bacteria
- 06:04Determining MIC Using E-Test
- 07:01Synergy Testing: Cross Approach
- 07:47Synergy Testing: Non-Cross Approach
- 08:56MIC Determination Using Broth Dilution
- 10:33Data Analysis: Broth Microdilution
- 11:10Data Analysis and Results: Synergy Testing
항생 물질 감수성 시험: 두 항생제의 MIC 값을 결정하고 항생 시너지를 평가하기 위한 Epsilometer 검사
English
Share
Overview
출처: 안나 블렉버그1,롤프 루드1
1 임상 과학 룬드학과, 감염 의학 학과, 생물 의학 센터, 룬드 대학, 221 00 룬드 스웨덴
항생제와 박테리아 사이의 상호 작용에 대한 지식은 미생물이 항생제 저항을 어떻게 진화하는지 이해하는 데 중요합니다. 에서 1928, 알렉산더 플레밍 페니실린발견, 세포 벽 재생을 방해 하 여 항균 기능을 발휘 하는 항생제 (1). 행동의 다양 한 메커니즘을 가진 다른 항생제 는 이후 발견 되었습니다., DNA 복제 및 박테리아에 단백질 번역을 억제 하는 약물을 포함 하 여; 그러나, 새로운 항생제는 최근 몇 년 동안 개발되지 않았습니다. 현재 항생제에 대한 내성이 증가하여 효과적으로 치료할 수 없는 심각한 전염병(2)이 발생하고 있습니다. 여기에서, 우리는 세균성 인구에 있는 항생 저항을 평가하기 위하여 몇몇 방법을 기술합니다. 세균성 죽음이 측정된 결과이기 때문에 이러한 방법의 각각은 사용되는 항생제의 작용 메커니즘에 관계없이 작동합니다. 항생 저항은 병원 설정을 통해 특히 급속하게 전파될 뿐만 아니라 사회 전반에 걸쳐 전파됩니다. 이러한 저항 수단을 조사하기 위해 엡실로미터 시험(E-test) 및 국물 희석 시험(3)을 포함한 다양한 방법이 개발되었다.
E-test는 잘 확립된 방법이며 미생물의 눈에 보이는 성장을 억제하는 항균제의 가장 낮은 농도인 최소한의 억제 농도(MIC) 데이터를 정량화하는 비용 효율적인 도구입니다. 사용되는 세균균 및 항생제에 따라 MIC 값은 서브 μg/mL에서 >1000 μg/mL(4)에 따라 달라질 수 있습니다. E-Test는 미리 정의된 항생제 그라데이션을 포함하는 플라스틱 스트립을 사용하여 수행되며, 이는 Μg/mL의 MIC 판독 척도로 각인됩니다. 이 스트립은 접종된 한천 판에 적용될 때 한천 매트릭스에 직접 전달됩니다. 인큐베이션 후, 대칭 타원형 억제 영역은 세균 성장이 방지됨에 따라 스트립을 따라 볼 수 있습니다. MIC는 타원이 스트립과 교차하는 끝점인 억제 영역에 의해 정의됩니다. MIC를 결정하는 또 다른 일반적인 방법은 마이크로브로스 희석 방법입니다. 마이크로브로스 희석은 접종된 박테리아를 함유하는 국물 배지에 첨가된 항균제의 상이한 농도를 통합한다. 배양 후, MIC는 가시성장을 방지하는 항생제의 가장 낮은 농도로 정의된다(5). 또한 정량적 방법이며 여러 박테리아에 적용 될 수 있습니다. 이 방법의 단점은 시약의 농도를 준비할 때 오류의 가능성과 실험에 필요한 많은 수의 시약이 포함된다. 항생 저항을 측정하는 것은 임상 및 연구 관점 둘 다에서 필수적이며, 저항을 조사하는 이 체외 방법은 토론되고 아래에 전시됩니다.
특정 박테리아에 대한 저항의 프로파일은 환자가 단일 치료 대 조합 치료에서 혜택을 받을 지 여부를 결정하기 위해 항생제 치료를 최적화하기 위해 적용 될 수 있습니다. 한 번에 하나 이상의 항생제를 사용하려면 서로상호 작용하고 첨가제, 시너지 효과 또는 적대적 효과가 있는 경우 알아야 합니다. 항생제의 관절 효과가 동일한 용량으로 주어진 개별 항생제의 효능과 같을 때 첨가제 효과를 볼 수 있습니다. 항생제 간의 시너지 효과, 다른 한편으로는, 항생제의 관절 효과 혼자 주어진 것 보다 더 강력한 경우 존재 (6). 항균 치료의 조합을 적용하면 항균 성 내성의 발생을 피하기 위해 개별 항생제 치료 (7)의 효과를 향상시키기 위해 사용됩니다. 길항증에 대한 지식은 항균 조합의 불필요한 사용을 방지하는 것도 중요합니다. E-Test 방법론은 다른 항균제 간의 가능한 시너지 효과와 적대감을 결정하는 간단하고 여러 가지 방법을 제공합니다. 항생제 내성 병원균의 증식에 직면하기 위해 특정 항생제의 가능한 시너지 및 길항 메커니즘에 대한 지식은 임상 효능과 다제 내성을 퇴치하는 데 중요합니다.
E-테스트를 사용하여 시너지 효과를 결정하는 것은 교차 및 비교차 테스트의 두 가지 광범위한 접근 법으로 나눌 수 있습니다. 두 시너지 테스트 모두 개별 MIC 값에 대한 이전 지식에 의존하지만 두 가지 방법은 방법론과 개념적 접근 방식에서 약간 다릅니다. 비 교차 시너지 테스트에서, 시험할 쌍의 첫 번째 항생제는 박테리아로 접종된 한천 판에 놓입니다. 제1 스트립에서 항생제를 허용한 후 플레이트(예: 1시간 후)를 주입한 후, 스트립이 제거되고 두 번째 항생제를 함유하는 새로운 스트립이 제1과 동일한 지점에 배치되어 두 개의 개별 MIC 값을 서로 위에 배치하도록 합니다. 결과 억제 영역은 전술한 바와 같이 분석될 수 있으며, 수학식 1을 기반으로 계산된 시너지 효과이다.
방정식 1 – 분수 억제 농도 (FIC)
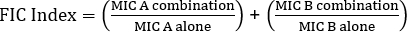
값 >0.5는 시너지 효과를 보여 줍니다.
분석하기 쉬운 플레이트로 심사관에게 보상하는 동안, 이 방법은 스트립의 변경뿐만 아니라 실험당 두 개의 플레이트를 사용해야 하기 때문에 다소 힘들고 시간이 많이 걸립니다. 대신, 교차 테스트는 종종 사용됩니다. 두 개의 서로 다른 E-테스트 스트립을 추가하는 대신(첫 번째 제거 후) 둘 다 동시에 동시에 배치되지만  교차(90° 각도)의 형태로 배치되며, 이전에 결정된 두 개의 MIC 값이 90° 각도를 형성합니다. 이 접근법에 의해 시너지 테스트당 하나의 플레이트만 필요하며, 적은 작업으로 분석하기가 약간 더 어려웠음에도 불구하고 선호하는 선택이 될 수 있습니다. 결합된 항생제 접근법에 있는 새로운 MIC 값은 수정된 억제 영역으로 시각화될 수 있고, 그 후에 시너지는 방정식 1에 의해 결정될 수 있다.
교차(90° 각도)의 형태로 배치되며, 이전에 결정된 두 개의 MIC 값이 90° 각도를 형성합니다. 이 접근법에 의해 시너지 테스트당 하나의 플레이트만 필요하며, 적은 작업으로 분석하기가 약간 더 어려웠음에도 불구하고 선호하는 선택이 될 수 있습니다. 결합된 항생제 접근법에 있는 새로운 MIC 값은 수정된 억제 영역으로 시각화될 수 있고, 그 후에 시너지는 방정식 1에 의해 결정될 수 있다.
한천 판 접근법을 사용하는 대신, 마이크로브로스 접근법은 종종 높은 유연성(예: E-test 스트립의 한계 밖에서 항생제의 특정 농도를 선택하는 능력)으로 인해 우선적일 수 있습니다. 또한, 마이크로브로스 검사는 고체 상(agar plate)내의 해리에 의존하지 않고 액체 용액에 항생제의 균등한 분포로 인해 더 민감하도록 제안된다. 96웰 마이크로플레이트의 우물은 정해진 수의 박테리아(106cfu/mL: 세균 농도는 OD600 nm 측정, 탁도 기준 또는 10x 세균 연쇄 희석제로부터 도금 시료를 확산시킴으로써 추정될 수 있음)으로 접종될 것이며, 다른 희석제의 항생제가 우물에 첨가될 것이다. 유사하게, E-test 스트립MIC는 박테리아의 눈에 보이는 성장을 억제하는 항생제의 가장 낮은 농도를 가진 교차(well/spot)로 결정된다.
실험 적 목표
- 아래 프로젝트는 페니실린 G의 MIC 값과 연쇄상 구균 그룹 G의 젠타미신을 두 가지 방법으로 결정하는 전략을 설명합니다. E-Test의 경우, 연쇄상 구균 그룹 G로 접종된 뮬러-힌튼 천 플레이트는 페니실린 G 및/또는 젠타미신의 그라데이션 스트립과 함께 사용되었습니다. MH-국물은 50% 용액 말 혈액과 20 mg/mL β-NAD를 마이크로브로스 접근법으로 연쇄상 구균 그룹 G와 함께 용해성 항생제로 사용하였다.
자료
- 혈액 한천 판에 세균성 식민지, 저장 <7 4°C
- 혈액 한천 접시
- 0.5 맥팔랜드 표준
- 1% 바클2
- 1% H2SO4
- 식염수 튜브 (2 mL)
- 면 팁 어플리케이터
- 뮬러-힌튼 한천 플레이트 (MHA 플레이트)
- 50% 용액 말 혈액과 20 mg /mL β-NAD (MH-F)와 MH 국물
- E-테스트 페니실린/젠타미신(또는 관심 있는 항생제) (BioMerieux, Marcy l’Etoile, 프랑스, 스웨덴)
- 항생제 페니실린/젠타미신(또는 관심 있는 항생제(분말/용액))
참고: 세균 성장에 사용되는 특정 미디어는 다른 종에 따라 다를 수 있습니다.
Procedure
Results
MIC values in E-test
Individual MIC values were identified in Figure 1 as 0.094 μg/mL for penicillin G and 8 μg/mLfor gentamicin. For synergy tests, both demonstrated an MIC value for penicillin G of 0.064 μg/mL (Figures 2, 3), while gentamicin had an MIC 4 μg/mL for cross and non-cross tests. Note a slight discrepancy between the cross and non-cross tests may occur due to the different incubation times of the strips in the two settings.
Calculation of synergy
The equation for FIC is:
 = 1.18 >0.5 (no synergy)
= 1.18 >0.5 (no synergy)
MIC determination in broth
Cloudiness of the wells indicated bacterial growth, and thus no inhibition occurred. The first clear well with penicillin G (Figure 4) contained 0.12 μg/mL penicillin G, and hence this was the MIC value. For gentamicin the first clear well was present at 8 μg/mL gentamicin. The penicillin G value was slightly higher than when using an E-test, due to the higher resolution of the strip (e.g. based on a 1.5x factor serial dilution, not a 2x factor).
Inoculum size
To determine the inoculum size, an approach as outlined in Figure 5 and 6 was used. Colonies were counted in the D-row (1000x dilution), adding up to 7, 8, and 8 in the triplicate series with a mean value of 7.67 cfu. The number of colonies neeed to be multiplied with the dilution factor (e.g. 1000x), as well as with 100 to obtain cfu/mL, giving an inoculum size of approximately 8 x 105, well within the targeted inoculum size of 105-6 cfu/mL.
Applications and Summary
Antibiotic resistance is a worldwide health problem. In order to determine resistance mechanisms of microbes, methods testing for synergy and antagonism with different antibiotics is crucial. The E-test method is rapid, easy to replicate, and can be used to investigate any synergistic potential of combination therapies. The broth dilution method can also be assessed to predict bactericidal activity. In order to investigate the resistance mechanisms of different microbes, knowledge of synergistic and antagonistic antibiotic interactions is crucial. Combining antibiotics may be a strategy to increase treatment efficacy and face antibiotic resistance. In the tests performed here, we were able to determine the MIC values of penicillin G and gentamicin for group G Streptococcus. We also demonstrated that the two antibiotics do not display synergistic effects, thus would not be a preferred treatment option for such infections.
References
- Tan SY, Tatsumura Y. Alexander Fleming (1881-1955): Discoverer of penicillin. Singapore Medical Journal. 56 (7):366-7. (2015)
- Aminov RI. A brief history of the antibiotic era: lessons learned and challenges for the future. Frontiers in Microbiology. 1:134. (2010)
- Pankey GA, Ashcraft DS, Dornelles A. Comparison of 3 E-test (®) methods and time-kill assay for determination of antimicrobial synergy against carbapenemase-producing Klebsiella species. Diagnostic Microbiology and Infectious Disease. 77 (3):220-6. (2013)
- EUCAST: European Committee On Antimicrobial Susceptibility Testing (www.eucast.org).
- Wiegand I, Hilpert K, Hancock RE. Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances. Nature Protocols. 3 (2):163-75. (2008)
- Doern CD, When does 2 plus 2 equal 5? A review of antimicrobial synergy testing. Journal of Clinical Microbiology. 52 (12):4124-28. (2014)
- Worthington RJ, Melander C. Combination approaches to combat multi-drug resistant bacteria. Trends in Biotechnology. 31 (3):177-84. (2013)
Transcript
Antibiotic susceptibility is defined as the sensitivity of a bacteria to antibiotics and can be measured using a broth dilution test or an Epsilometer test, also called an E-test.
In the broth dilution method, a standardized number of bacteria are added to a growth media containing serial antibiotic dilutions. If susceptible, the bacteria cannot grow at the higher antibiotic concentrations but continue to multiply at the lower antibiotic concentrations, causing media to turn turbid. The lowest antibiotic concentration at which the bacteria can no longer survive or multiply is referred to as the minimum inhibitory concentration, or MIC, value of the antibiotic for the given bacteria.
In an E-test, a plastic strip impregnated with a predefined gradient of antibiotic is applied over a freshly spread lawn of bacteria on a Mueller-Hinton agar, or MH-A, Petri plate. The antibiotic diffuses out into the agar media, where it is taken up by the bacteria. If susceptible, the bacteria cannot multiply and will die off, forming a clear zone around the E-strip, which is referred to as the growth inhibition zone. At the point where the growth intersects with the E-strip, the corresponding value on the scale gives the MIC value of the antibiotic.
Often antibiotics are used in combination to prevent the emergence of antibiotic resistant strains of bacteria. This often results in a synergistic, rather than additive, effect. Synergistic means that the combined effect of the two antibiotics is greater than the sum of their individual activities. However, the effect is considered significant only when the MIC value of the antibiotic combination decreases by at least two-fold. This criterion is evaluated by calculating the fractional inhibitory concentration, or FIC, index. By summing the ratio of the MIC of each antibiotic in combination with the MIC of each antibiotic individually, an FIC index less than 0.5 indicates synergy.
Antibiotic synergy can be measured using two E-test based methods: a non-cross test or a cross test. In a non-cross test, first, the E-strips for two different antibiotics with predetermined MIC values are applied to two separate plates. After the antibiotics have diffused into the medium, the original E-strips are removed and the E-strips for the alternate antibiotics are placed such that their MIC scales lay exactly over the MIC scales of the previous strips. In a cross test, which is a faster version of the non-cross test, the E-strips of the two antibiotics are placed together in a cross formation, such that the scales of their MIC marks form a 90 degree angle at the intersection. Following incubation in both techniques, the MIC value of each antibiotic in combination with the other antibiotic is read at the point where the growth inhibition zone intersects with the edge of the E-strip. Then, the FIC index is calculated.
This video will demonstrate how to determine the MIC value of a given antibiotic for a given bacteria using an E-test and a micro broth dilution test. You will also learn how to determine synergy between two antibiotics using a cross test and a non-cross test.
To begin, put on any appropriate personal protective equipment, including laboratory gloves and a lab coat. Next, sterilize the work space using 70% ethanol. Next, collect 15 milliliters of sterile Mueller-Hinton broth with 50% lysed horse blood and 20 milligrams per milliliter beta-nicotinamide. And five to eight Mueller-Hinton agar plates. Now, to prepare a McFarland turbidity standard number 0.5, measure out 9.95 milliliters of 1% sulfuric acid solution. Then, add 50 microliters of 1% barium chloride solution to the sulfuric acid solution. Vortex the solution well to obtain a turbid suspension. Cover the tube with aluminum foil and set it aside. Next, dispense one milliliter of saline solution into a 15 milliliter tube.
Use a sterile loop to scrape up a sample of the bacterial growth from your bacterial test plate, here, Streptococcus group G. Then, place the bacteria-laden loop into the saline solution, stir gently, and then vortex the tube well. Now, place the bacterial suspension and McFarland turbidity standards side by side and compare them for turbidity equivalence. Add either additional saline or bacterial colonies until the bacterial suspension’s turbidity matches that of the standard. Once the desired turbidity is obtained, dip a sterile cotton tip applicator into the bacterial suspension. To inoculate the MH-A plate, swab the entire surface of the plate gently with a zigzag motion. Next, label the bottom sides of the plates with the name of the bacteria and the date.
To begin, take out a penicillin G E-test strip, holding it by the edge with forceps. Gently place strip into the center of the freshly swabbed MH-A plate and replace the lid. In this example, a second antibiotic, gentamicin, is also tested. Thus, the strip placement process is repeated with the second plate and a gentamicin E-test strip. To determine the results of the E-test, collect the first plate that contains the penicillin G E-test strip. Now, determine the point where the inhibition zone intersects with the antibiotic strip. Read the corresponding numerical value on the scale. This value represents the MIC value of penicillin G. Determine the MIC value for gentamicin in the same manner.
To begin, inoculate an MH-A plate with Streptococcus group G strain bacteria. Label the bottom of the plate with the name of the bacteria, antibiotics to be used, and the date. Now, place an E-test strip for the antibiotic of interest in the center of the plate. Then, hold the second test strip at a 90 degree angle to the first strip and locate its MIC mark. Gently lay the second E-strip over the first at the point where the two MIC values intersect. Once the strips are placed, do not move them. Next, incubate the plates at 37 degrees celsius for 18 to 20 hours.
After inoculating two MH-A plates, with Streptococcus group G strain bacteria, place an E-test strip for one antibiotic on the surface of one plate. Then, place an E-test strip for the other antibiotic on the second plate as demonstrated. Using a plastic inoculation loop, mark the MIC value of each antibiotic on the surface of its respective plate. Next, cover the plates and incubate them at room temperature for one hour. After this, use forceps to remove the E strips. Next, collect one of the plates and an E-test strip for the other antibiotic. Hold the E-test strip over the imprint left by the first strip and locate the point where the MIC value on the E strip aligns with the marked line. Gently place the strip at this intersecting point. Repeat this process for the second plate and incubate both plates at 37 degrees celsius for 18 to 20 hours.
First, obtain a bacterial suspension with an established bacterial concentration and dilute the culture in MHF broth to achieve an OD600 of 0.003. Next, weigh out 16 milligrams of penicillin G and 128 milligrams of gentamicin. Transfer each weighed dry antibiotic into 215 milliliter conical tubes. Add 10 milliliters of distilled water to each of the conical tubes and mix well by vortexing. Label the tubes with the antibiotic name and concentration.
Performing the assay in triplicate, add 400 microliters of the working bacterial solution into the first wells of three rows of a 96-well microtiter plate. Next, add 200 microliters of the working bacterial solution in MHF broth to the wells of the three rows. Now, to generate a two-fold serial antibiotic dilution, first add four microliters of antibiotic stock to the first well, generating a 100 fold dilution. Sequentially, transfer 200 microliters of bacteria-antibiotic solution to each well, beginning from the first well through the second to last well in each row, ensure proper mixing by pipetting two to three times after every transfer. Discard the final 200 microliters of bacteria-antibiotic solution.
To determine the results of the broth micro dilution test for penicillin G, first locate the wells that exhibit no visible bacterial growth, indicated by a lack of turbidity. From these wells, identify the well with the lowest antibiotic concentration. This represents the MIC value of penicillin G for the tested bacteria. The MIC value of gentamicin can be determined using the same assay and technique.
To determine the results of the non-cross test, collect the first plate, which contains a penicillin G E strip. Then, determine the point where the growth inhibition zone intersects with the antibiotic strip. The corresponding value on the scale represents the MIC value for penicillin G in combination with gentamicin. In this example, the MIC value in combination is 0.064 micrograms per milliliter.
Now, collect the second plate, which contains the gentamicin E strip, and determine the MIC value in combination as previously demonstrated. To evaluate the effect of combination, first calculate the fractional inhibitory concentration or FIC for penicillin G by dividing the MIC in combination by the MIC of the antibiotic alone. Repeat this process for gentamicin. Then, calculate the FIC index using the equation shown here. A two-fold reduction in the MIC value in combination yields an FIC index value that is less than or equal to 0.5 and demonstrates synergy between penicillin G and gentamicin. In this case, the calculated FIC value is 1.18 which is greater than 0.5. Thus, the results do not demonstrate synergy between penicillin G and gentamicin against the Streptococcus group G strain.
To determine the results of the cross test, first determine the point where the growth inhibition zones intersect with their respective E strips. Read the numerical value on each E-test strip that corresponds to this intersection point. These values represent the MIC value in combination for penicillin G and gentamicin. Next, to evaluate the effect of the combination, calculate the FIC index using the equation shown here. In this example, the calculated FIC value is 1.18, which is greater than 0.5. This means that penicillin G and gentamicin do not act synergistically against the Streptococcus group G strain.
