Summary
Hier wordt een originele experimentele opstelling voor het verwarmen van cellen in een cultuurschotel met behulp van 1,94 μm continu-wave laserstraling geïntroduceerd. Met behulp van deze methode kunnen de biologische reacties van retinale pigmentepitheliale cellen (RPE) na verschillende thermische blootstellingen worden onderzocht.
Abstract
Hier wordt een originele methode voor het verwarmen van gekweekte cellen met behulp van een 1,94 μm continu-golf thuliumlaser voor biologische beoordeling. Thulium laserstraling wordt sterk geabsorbeerd door water en de cellen aan de onderkant van de kweekschotel worden verwarmd door thermische diffusie. Een laservezel met een diameter van 365 μm is ongeveer 12 cm boven de kweekbak geplaatst, zonder optica, zodat de laserbundeldiameter bijna gelijk is aan de binnendiameter van de kweekschotel (30 mm). Door in elk experiment een consistente hoeveelheid kweekmedium te houden, is het mogelijk om de cellen te irradieren met een zeer reproduceerbare temperatuurverhoging.
Om de temperatuurverhoging en de verdeling ervan in één celcultuurschotel te kalibreren voor elke vermogensinstelling, werd de temperatuur gedurende 10 seconden bestraald bij verschillende posities en op het cellulaire niveau. De temperatuurverdeling werd weergegeven met behulp van een wiskundige grafische softwareProgramma, en het patroon over de cultuurschotel was in Gaussische vorm. Na laserbestraling kunnen verschillende biologische experimenten worden uitgevoerd om temperatuurafhankelijke celreacties te beoordelen. In dit manuscript wordt levensvatbaarheidsverf ( dwz onderscheiden van levende, apoptotische en dode cellen) geïntroduceerd om de drempeltemperaturen voor celapoptose en de dood na verschillende tijdstippen te bepalen.
De voordelen van deze methode zijn de precisie van de temperatuur en de tijd van verwarming, evenals het hoge rendement bij het verwarmen van cellen in een hele celcultuurschotel. Bovendien staat het in staat om te studeren met een grote variëteit aan temperaturen en tijdsduur, die goed gecontroleerd kan worden door een geautomatiseerd besturingssysteem.
Introduction
Het begrijpen van temperatuurafhankelijke celbiologische reacties is van groot belang voor succesvolle hyperthermiebehandelingen. Retinale laserfotocoagulatie met een thermische laser, gebruikt in oogheelkunde, is een van de meest opgestelde laserbehandelingen in de geneeskunde. Zichtbaar licht, meestal van groene tot gele golflengten, wordt gebruikt in retinale laserbehandeling. Het licht wordt sterk geabsorbeerd door de melanine in retinale pigmentepitheliale (RPE) cellen, die de buitenste celmonolaag van het netvlies vormen. Er is recente interesse geweest bij artsen en onderzoekers bij zeer zachte thermische bestraling (sub-zichtbare fotocoagulatie) als een nieuwe therapeutische strategie voor verschillende soorten retinale aandoeningen 1 , 2 . Naar aanleiding van deze trend is onze interesse in RPE-cellen onder lethal verwarmen onder nauwkeurige temperatuurregeling, een techniek genaamd temperatuurgestuurde fotothermische therapie (TC-PTT).
Recente optoAkoestische technologie van ons instituut heeft de real-time meting van temperatuurstijgingen op bestraalde plaatsen in het netvlies mogelijk gemaakt. Dit maakt het mogelijk om de temperatuur te verhogen tijdens bestraling 3 . Aangezien de sub-dodelijke hyperthermie op het retina, veroorzaakt door het verwarmen van RPE-cellen subletaal, niet eerder is overwogen door de onmogelijkheid om de temperatuur te meten en te reguleren, hebben de temperatuurafhankelijke celreacties van RPE-cellen na thermische laserbestraling Tot op heden zeer weinig bestudeerd. Bovendien is niet alleen het temperatuurverschil in detail besproken, maar ook het verschil in het celgedrag van de overlevende cellen na sublodale en dodelijke bestraling. Daarom, om wetenschappelijk bewijs op TC-PTT gebaseerde behandelingen te verzamelen, streven we ernaar om de temperatuurafhankelijke RPE-celbiologische reacties en hun mechanismen toe te lichten door gebruik te maken van in vitro experimentele opstellingen.
Voor tZijn doel is het opzetten van een celverwarmingsinstallatie die voldoet aan de volgende voorwaarden: 1) een mogelijkheid tot snelle temperatuurstijgingen, 2) een nauwkeurig geregelde tijd en temperatuur en 3) een relatief groot aantal onderzochte cellen voor biologische experimenten . Wat de verwarmingsmethode betreft, is een klinische laser, zoals een frequentieverdubbelde Nd.YAG laser (532 nm), helaas ongeschikt voor celcultuurverwarming. Dit komt door het sterk verminderde aantal melanosomen in gekweekte RPE cellen. De laserlichtabsorptie kan inhomogeen zijn, en de temperatuurstijging op het cellulaire niveau is variabel tussen experimenten, zelfs bij bestraling met dezelfde stralingskracht. Verscheidene eerdere studies hebben melding gemaakt van het gebruik van zwart papier onder de schotelbodem tijdens bestraling 4 of het gebruik van extra melanosomen die gefagocytiseerd zijn door de cultuurcellen voor de experimenten 5 , 6 . Veel vanDe in vitro biologische studies om hyperthermie geïnduceerde celreacties te beoordelen zijn uitgevoerd met behulp van een kookplaat, een waterbad of een CO 2- incubator met een temperatuurinstelling 7 . Deze methoden vereisen een lange verwarmingsperiode, omdat het enige tijd duren ( dwz enkele minuten) om de gewenste temperatuur te bereiken. Bovendien is het moeilijk om een gedetailleerde thermische geschiedenis ( dwz temperatuur vermenigvuldigd met de tijd) op het cellulaire niveau te verkrijgen door gebruik te maken van deze methoden. Bovendien kan de temperatuur tussen de cellen op verschillende posities in één kweekschotel verschillen door diffusie van variabele temperatuur. In de meeste gevallen is deze informatie over temporale en ruimtelijke temperatuur tijdens hyperthermie niet in aanmerking genomen voor biologische analyses, ook al kan de biologische celreactie kritisch beïnvloed worden door de temperatuur en de tijdsduur van de verhoogde temperatuur.
Om deze problemen te overwinnen, een contiNuuwe-golf thulium laser werd hier gebruikt om de cellen te verwarmen. Thulium laserstraling (λ = 1,94 μm) wordt sterk geabsorbeerd door water 8 , en de cellen aan de onderkant van de kweekschotel worden thermisch gestimuleerd uitsluitend door thermische diffusie. De laservezel met een diameter van 365 μm ligt ongeveer 12 cm boven de kweekschotel, zonder enige optica tussenin. De diameter van de laserstraal divergeert zodanig dat het bijna gelijk is aan de binnendiameter van de cultuurschotel (30 mm) op het oppervlak van het kweekmedium. Met een consistente hoeveelheid kweekmedium is het mogelijk om de cellen te irradieren met de temperatuurverhoging Van hoge herhaalbaarheid. Met variabele energie instellingen kunt u bestraling met maximaal 20 W, en de gemiddelde temperatuur op het cellulaire niveau worden verhoogd tot ΔT ≈ 26 ° C in 10 s.
Door de bestralingsomstandigheden te wijzigen is het ook mogelijk om het laserstraalprofiel te veranderen om de temperatuurverdeling te variërenOp in een cultuurschotel. Het is bijvoorbeeld mogelijk om met een Gauss-achtige temperatuurverdeling, zoals in de huidige studie, of met een homogene temperatuurdistributie te onderzoeken. Het laatste kan voordelig zijn voor het onderzoeken van de effecten van temperatuurafhankelijke celreacties, meer specifiek voor sublodale temperatuurstijgingen, maar niet voor celdoodspanning of wondgenezingsresponsen.
In totaal kan thuliumlaserbestraling het onderzoek mogelijk maken van verschillende soorten biologische factoren, zoals gen / eiwituitdrukking, celdoodkinetiek, cel proliferatie en ontwikkeling van celfunctionaliteit, na verschillende thermische blootstellingen.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. RPE Cell Culture
- Isolatie van RPE-cellen uit de ogen van de varkens
- Verkrijg verse enucleated porcine ogen van het lokale slachthuis. Houd ze koel (4 ° C) en in een donkere omgeving.
- Verwijder extracellulaire weefsels met een schaar en week de ogen in een antiseptische oplossing gedurende 5 minuten.
- Plaats de ogen in gesteriliseerde fosfaatgebufferde zoutoplossing zonder calcium en magnesium (PBS (-)) tot gebruik.
- Door middel van een scalpel dringt u de sclera ongeveer 5 mm achter de corneale limbus in. Resect het hele voorste gedeelte van het oog door middel van een schaar doorheen, parallel met de hoornvlies limbus.
- Verwijder het voorste gedeelte van het oog (dat wil zeggen de hoornvlies en de lens) en de glasplaat. Voeg 1 ml PBS (-) toe en verwijder het neurale retina voorzichtig.
OPMERKING: Deze "oogbeker", bestaande uit de sclera, choroid en RPE, is nu klaar. - Voeg voorverwarmd (37 ° C) 0,25% trypsine toe in PBS (-) naar de oogbeker. Pas het volume zodanig aan dat ongeveer 80% van de oogbeker gevuld is met deze trypsine oplossing.
- Incubeer de oogbeker met de trypsineoplossing in een 5% C02 incubator bij 37 ° C gedurende 10 minuten.
- Verwijder de oogbeker uit de incubator en vervang de 0,25% trypsinoplossing met een PBS (-) oplossing met 0,05% trypsine + 0,2% ethylendiaminetetraazijnzuurtetrasodiumzout (EDTA · 4N). Incubeer de oogbeker gedurende 45 minuten in de incubator.
OPMERKING: na 45 minuten zijn de RPE-cellen ofwel losweg verbonden aan het membraan van de Bruch of al vrijgekomen en drijvend in de trypsine-EDTA-oplossing. - Verzamel de RPE-cellen door zacht pipetten. Verzamel de cellen en de oplossing in een conische buis gevuld met 10 ml kweekmedium (DMEM hoge glucose met L-glutamine), inclusief 10% varkens serum, antibioticum / antimycotische en natriumpyruvaat (1 mM).
OPMERKING: Het serum kan het effect van trypsine neutraliseren. - Centrifugeer deCel suspensie bij 400 xg gedurende 5 min bij kamertemperatuur.
- Verwijder de supernatant en voeg 10 ml fris medium toe. Centrifugeer opnieuw onder dezelfde omstandigheden gedurende 5 minuten.
- Verwijder de supernatant en voeg een nieuw medium toe, zodat de celconcentratie resulteert in 5 x 10 5 cellen / ml (bepaald door de cellen te tellen met behulp van een hemocytometer). Meng goed door zacht pipetten.
- Verdeel de celsuspensie in celcultuurschotels. Gebruik 3 ml per 60 mm diameter kweekschotel.
OPMERKING: Deze cultuur heet passage nul (P0). - Bewaar de cellen in een 5% CO 2- incubator bij 37 ° C. Verander de helft van het gecondenseerde medium elke dag op fris medium.
- Subcultuur (stap 1.2) als het confluent wordt.
- Subcultuur van de RPE-celkweek
- Verwijder het kweekmedium en spoel de cellen tweemaal met PBS (-).
- Incubeer de cellen met PBS (-) oplossing met 0,05% trypsine + 0,2% EDTA iNa 5% CO 2 incubator bij 37 ° C gedurende 5 min.
- Verwijder de RPE-cellen door zacht pipetteren en verzamel de cel suspensie in een conische buis gevuld met 10 ml kweekmedium, inclusief 10% varkens serum.
- Centrifugeer de cel suspensie bij 400 xg gedurende 5 minuten bij kamertemperatuur.
- Verwijder de supernatant en voeg een nieuw kweekmedium toe, waarbij de celconcentratie 5 x 10 5 cellen / ml wordt (bepaald door het cijfer met een hemocytometer te tellen). Verdeel de cellen in nieuwe kweekschotels van 60 mm diameter, zoals beschreven in stap 1.1.13.
OPMERKING: De celcultuur is nu passage 1 (P1). - Nadat confluentie is bereikt, subcultuur de P1-cultuur naar P2, onder toepassing van dezelfde procedure beschreven in stappen 1.2.1-1.2.5. Vanuit de P2-cultuur zaaien de cellen op kleinere cultuurgerechten (30 mm binnendiameter) in plaats van 60 mm-diameter cultuurgerechten.
- Voor de experimenten gebruik P2 of P3 culturen.
2. ThulIum laserbestraling
- Constructie van het bestralingsstation
- Sluit een thuliumlaserapparaat (1,94 μm, vermogensbereik: 0-20 W) aan op een 0,22-NA, 365 μm kerndiametervezel.
- Mechanisch fixeer de vezelpunt aan de metalen arm die horizontaal is bevestigd aan de verticale metalen post van het bestralingsstation. Plaats de verticale post zodanig dat de punt van de laservezel boven de kookplaat ligt waarop de celkweekschotel tijdens bestraling moet worden geplaatst.
- Leg een wit papier op de hete plaat en draai de richtingstraal aan (λ = 635 nm, max = 1 mW, diameter op papierniveau ≈ 30 mm). Merk de omtrek van de doelbundel op het wit papier, zodat de positie waar de cultuurschotel wordt geplaatst tijdens bestraling, bekend is.
OPMERKING: Het z-vlak van de vezelpunt kan veranderlijk zijn. Zonder enige extra beeldoptiek, wordt de diameter van de laserpunt op het celcultuurvlak 12 cm onder de vezelpunt geplaatst, iS ongeveer 30 mm, die bijna gelijk is aan de binnendiameter van de celcultuurschotel. Een schematische tekening van de installatie is weergegeven in figuur 1 .

Figuur 1: Schematisch beeld van het Thulium Laser Bestralingsstation. Op de verwarmingsplaat wordt een kweekschotel geplaatst. De cellen worden 12 cm onder de thulium laservezelpunt geplaatst, zodat de bundelgrootte bijna identiek is aan de binnendiameter van de kweekschotel (ongeveer 30 mm). De laserbestralingsprocedure wordt geregeld door een tijdgestuurde routine van het op maat gemaakte systeemontwerpplatform. De stroominstelling moet worden bepaald voordat het bestralingsprogramma is gestart. Klik hier om een grotere versie van deze figuur te bekijken.
- 1 uur voor bestraling, vervang het kweekmedium volledig met 1,2 ml vers medium.
OPMERKING: Dit is een CRITICAL STEP en moet strikt gevolgd worden. - Plaats het bestralingsstation (dat wil zeggen de kookplaat en de post waarmee de laservezel moet worden aangebracht) op een schone bank.
- Verwijder de celcultuurschotel uit de incubator en plaats deze op de gemarkeerde positie op het kookplaat (stap 2.1.3).
- Draag beschermende bril. Zet de thuliumlaser aan. Stel de stroom in zoals gewenst op het laserapparaat (afstemming van 0 - 20 W). Zet de emissie op.
- Start een systeem design platform dat de laser bestraling en timing protocol (aanvullend bestand) regelt.
- Onmiddellijk nadat u de kweekschotel op het hete plaat plaatst, klikt u op de "voorverwarmingstijd" om de timer voor 140 s te starten ("voorverwarmingstijd 1"); Dit houdt de temperatuur van het kweekmedium op 37 ° C voor bestraling.
OPMERKING: na 140 seconden gaat een pieptoon aan en de volgende timer ("voorverwarmingsduur 2") begint automatisch met 8 s. Gedurende deze 8 s kan de examinator de cultuurschotel openen. Na 148 seconden van voorverwarming wordt automatisch een 10 s-lange laserbestraling op de celcultuur uitgevoerd. In geval van nood moet u het laserapparaat uitgerust met een krachtstopknop om de laser onmiddellijk te stoppen. Dit is een CRITICAL STEP en moet streng gevolgd worden. Een bijzonder punt van voorzichtigheid heeft betrekking op het openen van de deksel van de schotel net voor bestraling, aan het begin van de 8 s voorverwarmingstijd. Het openen van de afdekking kan heel snel het medium oppervlak afkoelen. - Plaats het deksel onmiddellijk na het bestralen op de kweekbak, laat het koken op de kookplaat nog eens 7 s achter en plaats deze terug in de 5% CO 2- incubator bij 37 ° C.
- Maak kleine gaten (ongeveer 300 μm in diameter) dicht bij de bodem aan vier kanten (elke 90 °) van een 30 mm diameter kweekschotel (zonder cellen); Gebruik de tip van een naald (20G), verwarmd met een Bunsen-brander. Zet de gaten met elektrische isolatieband van buitenaf en maak een klein gat met een fijne naald, zodat alleen een fijne thermokoppel (200 μm in diameter) door dit gat onder waterdichte omstandigheden kan worden ingebracht.
- Aan de buitenkant van de cultuurschotel onderkant trekt u 2 loodrechte diameters en zet u het kruispunt ( dwz het midden van de onderkant) als het coördinaat nul (0). Markeer elke 3 mm radiaal naar buiten naar buiten (ongeveer 0, 3, 6, 9, 12 en 15 mm) in elke richting langs de lijnen ( Figuur 2 , blauwe punten); Het aantal punten moet in totaal 21 zijn.
- Vul de celcultuurschotel met 1,2 ml nieuw kweekmedium. Plaats de cultuur dZet een fijne thermokoppel (200 μm in diameter) in het zijgat en plaats de gevoelige punt op een gemarkeerde positie die moet worden gemeten.
- Draag beschermende bril. Zet de thuliumlaser aan en stel de stroom handmatig in (tussen 0 en 20 W, in stappen van 0,1 W) van de laserontwerp.
OPMERKING: Voor temperatuurkalibratie moeten metingen met de stroom in stappen van 3 W voldoende zijn. - Zet het systeem ontwerpplatform aan en klik op de knop "Start Temp Acquisition" (aanvullend bestand) om de temperatuurmeting te starten.
- Voer dezelfde procedure uit als in stap 2.2.6.
OPMERKING: Het controleprogramma meet de temperatuur van het ingebouwde thermokoppel elke 100 ms en toont de temperatuurprogressie tijdens bestraling in de GUI. - Voer deze procedures uit voor alle 21 meetpunten en bij verschillende stroominstellingen. Herhaal de hele procedure drie maal voor alle punten en voor alle krachtinstellingenGS om betrouwbare gegevens te verkrijgen.
- De temperatuurgegevens exporteren als csv-gegevens, die uiteindelijk kunnen worden omgezet in een spreadsheet. Gemiddelde de maximale temperatuur aan het einde van de bestraling voor de triplicate metingen op elk punt. Gemiddelde de waarden van de punten op dezelfde cirkel (4 punten in totaal, behalve het centrale punt).
- Bepaal de gemiddelde gemiddelde temperatuur op een grafiek, waarbij de afstand van het midden van de schotel (mm) als de x-as en de temperatuur stijgt (ΔT, ° C) als de y-as. Gebruik de fitfunctie van een wiskundig softwareprogramma om een Gaussisch model aan te passen aan de rauwe data. Maak een Gaussische fit temperatuurverdeling.

Figuur 2: De punten voor temperatuurkalibratie in een celcultuurschotel. De temperatuurgegevens werden gemeten in het midden en op 5Radiale punten over 4 verschillende hoeken (blauwe punten). Klik hier om een grotere versie van deze figuur te bekijken.
3. Biologische beoordelingen voor celreacties na verschillende thermische bestralingen
- Evaluatie van de levensvatbaarheid van cellen ( dwz levend, apoptotisch en dood) op basis van verschillende krachtinstellingen en de bepaling van de celdooddrempel
- Op de aangegeven tijdspunten ( dwz 3, 24 en 48 uur na bestraling), wassen de cellen met PBS (-) en gebruik een in de handel verkrijgbare kit om de levensvatbaarheid van de cel ( dwz vitaal, apoptotisch, dood) te beoordelen volgens de fabrikant protocol.
- Bereid een kleuroplossing door 5 μL fluoresceïne isothiocyanaat (FITC) -annexine V, 5 μl ethidium homodimer III en 5 μL Hoechst 33342 tot 100 μl 1x bindingsbuffer toe te voegen (alle zijn kitcomponenten). Bereid genoeg vlekoplossing voor om de cellen te bedekken. Incubeer de cellen gedurende 15 minuten.
- Was de celkweek tweemaal met de bindingsbuffer, vervang de bindingsbuffer met PBS (-) en zet de kweek op het stadium van een fluorescentiemicroscoop.
- Schakel het lichtpad over naar de ooglens, selecteer het 4 ', 6-Diamidin-2-fenylindol (DAPI) filter, schakel het verlichtingslicht in en zoek het geconcentreerde vlak met de 4x-doelstelling.
- Verander het lichtpad naar de camera, zoek de afbeelding op het computerscherm in de microscoopbeeldsoftware en pas de focus aan.
- Gebruik de steekfunctie ( dwz de functie om meerdere afbeeldingen over de schotel op te nemen en dan een enkel groot beeld te maken) van de microscoopspecifieke software om het fluorescentiebeeld van de gehele celcultuurschotel te verkrijgen. Gebruik 3 verschillende filtersets-DAPI, FITC, en tetramethylrhodamine (TRITC) - naar beeld Hoechst 33342-positieve cellen (alle celkernen), FITC-annexine V-positiVe-cellen (apoptotische) en respectievelijk ethidium homodimeer III-positieve cellen (dood).
- Meet de straal (mm) van het dode (ethidium homodimer III-positief) gebied en de buitenste / binnenste straal van het apoptotische (annexine V-positieve) bandvormgebied in de gekleurde celculturen. Breng deze radii aan op de gemonteerde Gaussische functie van de temperatuurverdeling voor de bijbehorende vermogensinstelling. Bereken de exacte temperatuur op de rand van de doden of apoptotische regio om de drempeltemperaturen voor de cel dood en apoptotische verandering te verduidelijken.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Temperatuurverdeling na verschillende stroominstellingen
Alle temperatuurontwikkelingen voor elke enkele bestraling werden gecontroleerd bij de temperatuurkalibratie. Uit deze gegevens werd de maximale temperatuur op het gemeten punt verkregen en gedefinieerd als T max (° C). Zoals getoond in Figuur 3A , werd het programma uitgevoerd op het tijdstip wanneer de kweekschotel op de verwarmingsplaat werd geplaatst. Na de 140 s "voorverwarmingstijd 1," die nodig was om een stabiele mediumtemperatuur bij 37 ° C te archiveren, werd de omhulling van de kweekschotel gedurende de 8 s "voorverwarmen tijd 2 verwijderd." Aan het einde van de "voorverwarmingstijd 2," begon de laseremissie automatisch. Deze curve is een representatieve temperatuurprogressie voor een 10 s bestraling. Tijdens bestraling nam de temperatuur toe en direct na de laseremissieUitgeschakeld, de temperatuur begon te dalen. De maximale temperatuur in het midden van de cultuurschotel werd in deze studie gedefinieerd als T max (° C). De T max was evenredig aan de laservermogen ( Figuur 3B ). Figuur 3C toont de verdeling van de maximale temperatuur voor elke stroom over de kweekschotel. De verdelingen zijn klokvormig, zoals getoond in figuur 3C , en passen bij een Gaussische functie volgens de volgende formule:
T (r) = t basis + A · 
Waar r, t basis A en w staan voor de afstand van het midden (mm), respectievelijk de laagste temperatuur voor de kromme, de amplitude en de breedte van de kromme. De parameters (t basis , A, en w) van de gemonteerde GAussische curve voor elke stroominstelling, namelijk voor elke T max , worden in de tabel naast de grafiek getoond.
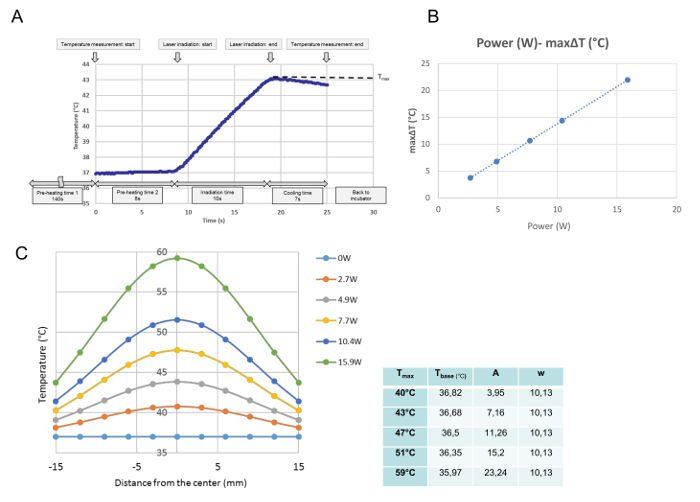
Figuur 3: Temperatuurkalibratiegegevens. Een representatieve temperatuurontwikkeling bij de centrale positie na een enkele bestraling bij 4,9 W (T max = 43 ° C) ( A ), de verhoudingele verhouding tussen de laserkracht en de maximale ΔT bij de centrale positie van een celcultuur ( B ) En temperatuurverspreidingen over de cultuurschotel na verschillende krachtinstellingen (C). (A) Het programma wordt uitgevoerd vanaf het tijdstip waarop de cultuurschotel op de verwarmingsplaat is geplaatst. Na 140 seconden van de "pre-verwarmingstijd 1," die nodig is om een stabiele mediumtemperatuur bij 37 ° C te archiveren, wordt het deksel van de kweekschotel verwijderd voor de 8-s "voorverwarmingstijd2. "Aan het einde van de voorverwarmingsduur 2," start de laseremissie automatisch. Deze curve is een representatieve temperatuurprogressie in de centrale positie tijdens een bestraling van 10 s bij 4,9 W. Bij bestraling neemt de temperatuur toe en Onmiddellijk nadat de laseremissie is uitgeschakeld, begint de temperatuur te dalen. De maximale temperatuur wordt verkregen aan het einde van de bestraling, die in deze studie wordt gedefinieerd als T max (° C). (B) De laservermogen en de maximale De temperatuurverhoging (ΔT max ) is evenredig. (C) De gemonteerde Gaussische functies van de gemeten temperatuurverdelingen over de kweekschotel. De parameters voor de functies, bepaald met een wiskundig softwareprogramma, worden weergegeven in de tabel aan de zijkant van de grafiek Klik hier om een grotere versie van deze figuur te bekijken.
Cell levensvatbaarheid na thermische bestraling
Zoals blijkt uit Figuur 4A zijn er drie verschillende kleurspatronen die de levensvatbaarheid van de cellen aanduiden na laserbestraling: 1) geen bijlage V / ethidium homodimer III-positief ( dwz alleen levend), 2) annexine V-positief in het midden ( dwz bijna Alleen vroege apoptose), en 3) ethidium homodimer III-positief in het centrum ( dwz dode cellen) omringd door apoptotische cellen aan de grens tussen dode en levende cellen ( Figuur 4B ). De afmeting van het doden / apoptotische gebied is doorgaans afhankelijk van T max en de na bestralingstijd tot 48 uur na bestraling. Er werd geen duidelijke levensvatbaarheidsverandering gedetecteerd in de culturen bestraald met T max ≤43 ° C. De enige apoptotische verandering kon op een vroegtijdig punt (3 uur) gevolgd worden, gevolgd door een late Celdood na een bestraling met T max = 47 ° C. Onmiddellijke of vroege celdood (tot 3 uur) werd gevonden in de culturen bestraald met T max ≥ 51 ° C (Tabel 1).

Figuur 4: Patroon van levensvatbaarheidsvlek na verschillende krachtinstellingen (A) en een voorbeeldbeeld bij de rand van de doden en apoptotische gebieden na dodelijke laserbestralingen (B).
(A) Drie patronen van kleuring kunnen optreden, afhankelijk van de temperatuur. (B) De apoptotische zone (FITC-annexine V-positief: groen) rond het dode gebied (ethidium homodimer III-positief: rood). Alle cellen zijn positief voor Hoechst 33342 (blauw), en de cellen met blauwe kernen zijn de levende cellen. De afbeelding werd 24 uur genomen na een bestraling bij T max = 59 ° C. Bar = 100 μm./files/ftp_upload/54326/54326fig4large.jpg "target =" _ blank "> Klik hier om een grotere versie van deze figuur te zien.

Tabel 1: Bijlagen V en Ethidium Homodimer III Reacties bij verschillende temperaturen en tijden.
Bepaling van de drempel temperatuur voor de cel dood
De gemiddelde radius van het dode gebied (rood) en het apoptotische gebied (groen) werden gemeten en toegepast op de Gaussische functie van de temperatuurverdeling om de drempelpiektemperatuur voor celdood en apoptose na 10 s bestraling te bepalen. Volgens deze analyse waren de gemiddelde drempeltemperaturen voor de volledige celdood 3 uur, 24 uur en 48 uur na bestraling respectievelijk 54,0 ° C, 50,9 ° C en 50,1 ° C. De gemiddelde threshoLd temperatuur voor cel apoptotische verandering waren lager bij ongeveer 2 - 3 ° C, met de drempel temperaturen gedurende 3 uur, 24 uur en 48 uur bij 51,7 ° C, 48,0 ° C en 47,0 ° C respectievelijk ( Figuur 5 ).
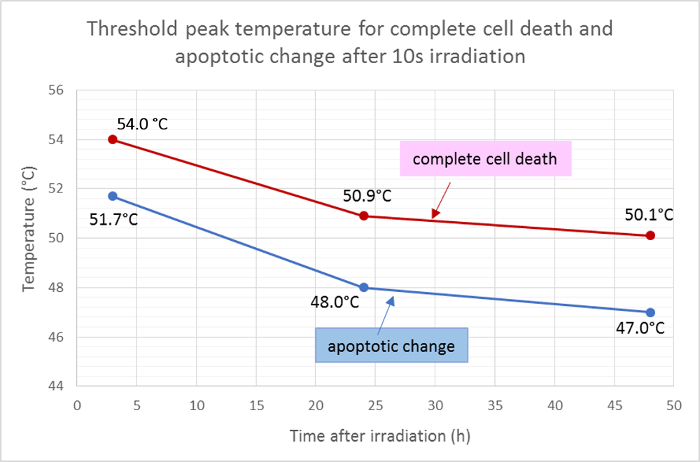
Figuur 5: Drempel Temperaturen voor Apoptose en Cell Death.
Gemiddelde drempeltemperaturen voor volledige celdood (positief voor Hoechst 33342, annexine V en ethidium homodimer III) en voor apoptose (alleen positief voor Hoechst 33342 en annexine V) op verschillende tijdstippen na bestraling, berekend uit de resultaten van fluorescentie levensvatbaarheid . Klik hier om een grotere versie van deze figuur te bekijken.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Bij het bespreken van temperatuurgerelateerde biologische cellulaire reacties is niet alleen de temperatuur, maar ook de tijdsduur van de verhoogde temperatuur van belang, aangezien de meeste biochemische processen tijdafhankelijk zijn. Met name op het gebied van lasergeïnduceerde hyperthermie in oogheelkunde, door het korte tijdsbestek van milliseconden tot seconden, is het moeilijk om celthermische effecten te onderzoeken met precieze temperatuurregeling. Daarom is een laserbestralingsopstelling geschikt voor het celcultuurmodel en met een operatiesysteem dat strenge temperatuur- en tijdsregeling mogelijk maakt gewenst. De biologische beoordeling van celreacties na thermische blootstelling, zoals eiwituitdrukking of afscheiding, vereist herhaalde kwantitatieve evaluaties op een voldoende aantal getroffen cellen. Dit is een obstakel voor studies met behulp van laservlekjes die honderd micrometer in diameter zijn, zoals bij klinische behandelingen. Kwantitatieve analyse op een enkele laserpunt is nogal burdensome. In deze studie zijn pogingen gedaan om zoveel mogelijk aan deze eisen te voldoen. Door gebruik te maken van een 1,94 μm golflengte continu-golf thulium laser met een bestralingscontrole programma, kan een temporele temperatuurstijging in een hele celcultuur binnen een kort tijdsbestek worden uitgevoerd. Aangezien de temperatuurverdeling kan worden aangepast door het lichtpad te veranderen, kunnen verschillende soorten hyperthermie-gerelateerde experimenten worden uitgevoerd met deze instelling.
De beperking van de gepresenteerde techniek is de onmogelijkheid om gelijktijdige temperatuurmetingen te voeren tijdens de laserbestraling van de cellen. Aangezien het gebruik van thermokoppels niet geschikt is voor gesteriliseerde celculturen, moet de temperatuurkalibratie afzonderlijk van de bestraling van de cellen worden uitgevoerd. Rekening houdend met de mogelijke variaties in de laservermogenuitgang, zouden realtime temperatuurmetingen tijdens elke laserbestraling ideaal zijn om de cellulaire reacties die overeenkomen met deThermische dosis. Bovendien werd de hierbij gebruikte temperatuurverdeling gecreëerd door middel van data interpolatie op basis van de metingen op 21 punten op een kweekschotel en bij verschillende krachtinstellingen. Om deze beperkingen en kritische punten te overwinnen is het daarom ons doel om een alternatieve methode te ontwikkelen die de temperatuur van de cultuurschotel toelaat, terwijl laserbestraling wordt uitgevoerd. We streven er ook naar om de ruimtetemperatuur informatie tegelijk te verkrijgen. Infrarood beeldvorming (thermografie) is een mogelijke methode om de temperatuur te meten tijdens de laserbestraling 10 . Het grote voordeel van deze methode is de real-time temperatuurmeting op het cellulaire niveau voor elke bestraling; Daaropvolgende celbiologische reacties kunnen altijd individueel worden vergeleken met de temperatuurgeschiedenis tijdens bestraling. Gezien de kosteneffectiviteit en bruikbaarheid, is het echter niet mogelijk voor elke laboratorium gebruik te maken van thermografie voor celverwarmingsexperimentenory.
In de methode met behulp van een thuliumlaser bij een golflengte van 1,94 μm wordt het water in de celkweekschotel verwarmd op het oppervlak ervan, en thermische diffusie en convectie worden gebruikt om de cellen te verhitten. De hoogte van het kweekmedium in deze bestralingsopstelling, met 1,2 ml kweekmedium, is 935 μm in de centrale positie (van een eerdere meting onder gebruikmaking van optische coherentietomografie). Het absorptieniveau van de thuliumlaser in water is zeer hoog (absorptiecoëfficiënt: 127 cm -1 bij 35 ° C) en 72% van het licht wordt geabsorbeerd in de eerste 100 μm van het kweekmedium. Er is bijna geen absorptie (0,0007%) op een diepte van 935 μm.
Het is belangrijk om op te merken dat een van de kritieke punten in het protocol dezelfde hoeveelheid medium (1200 μL) voor elke bestraling toevoegt. Het gebruik van verschillende hoeveelheden cultuurmedium kan leiden tot de hoogteverschillen, die verschillen in de temperatuur kunnen veroorzaken. INcrease van de cellen. Het tweede kritieke punt heeft betrekking op de timing van de opening van de cultuurschotel. Het moet tegelijkertijd worden uitgevoerd in deze studie, 8 s voor het begin van de bestraling, wanneer het systeem een geluid maakt. Verschillen in deze timing kunnen de basis temperatuur verschillen door de koeling veroorzaakt door de omringende lucht (ongeveer 23 ° C). Dit kan leiden tot significante verschillen in de door laser geïnduceerde temperatuur.
Voor temperatuurkalibratie werd dezelfde hoeveelheid medium (1,2 ml) die in de experimenten werd gebruikt, gebruikt om de temperatuurverdeling aan de onderkant van celvrije kweekschotels te meten. Echter, de gemiddelde hoogte met een cel monolaag kan verschillend zijn dan die zonder cellen, zelfs met hetzelfde volume medium toegevoegd. De meting met behulp van optische coherentie-tomografie onthulde dat er een 58 μm verschil is in de centrale positie tussen gerechten met en zonder confluente celmonolaag (877 μm zonder cellen, vergeleken tO 935 μm met cellen). Dit verschil is mogelijk door de capillaire werking van de cellen. Het hoogteverschil van 58 μm in de centrale positie kan veroorzaakt worden door ongeveer 40 μL medium (gemeten data). Het werd ook bevestigd dat dit verschil in hoogte geen significante verschillen in T max veroorzaakte bij alle energie instellingen. Daarom hebben we geconcludeerd dat dit verschil de resultaten van de analyses in deze studie niet significant beïnvloedt. Niettemin, om meer nauwkeurige temperatuurinformatie te verzamelen, zoals hierboven beschreven, moet een werkwijze worden ontwikkeld om de temperatuur te kalibreren met behulp van een celcultuurschotel die een celmonolaag bevat. Bovendien is ook de wiskundige modellering van thermische diffusie en convectie in het gehele kweekmedium nodig.
In deze studie werden de cellen verwarmd met een Gaussische temperatuurverdeling. Er zijn verschillende mogelijke methoden om het hele medium gelijkmatig te verhitten. een Is het gebruik van een laserbron met een lagere absorptiecoëfficiënt in water. Het nadeel is echter dat de lasers in dit geval een hogere kracht moeten hebben, omdat slechts een klein percentage van het licht over 0,9 mm geabsorbeerd wordt. Een andere mogelijkheid is om de distale vezeltip van een multimode optische vezel weer te geven die het laserlicht in het vlak van de kweekschotel overbrengt; De vergroting kan willekeurig door de optica gekozen worden.
Het tweede hoogtepunt van dit protocol is het vermogen om de drempeltemperatuur voor celdood en apoptose te bepalen met behulp van het fluorescerende beeld van levensvatbaarheidsverf en de laterale temperatuurverdeling. Een langetermijndoelstelling is niet alleen om de levensvatbaarheid van de cel te bepalen, maar ook om het temperatuurbereik voor celbiologische reacties die betrekking hebben op celfunctionaliteit, zoals eiwituitdrukking en celproliferatie, te verduidelijken. De bepaling van de celdood drempel temperatuur is van groot belang voor onderzoekers"> 10. Met behulp van deze methode kan het mogelijk zijn om de kritische factoren voor celdood, inclusief apoptose, te bepalen. Kritieke factoren voor thermische laser geïnduceerde celdood kunnen niet alleen worden bepaald door de temperatuurgeschiedenis, maar ook door de endogene factoren ( Dat wil zeggen intra- / extracellulaire factoren op het moleculaire niveau.) Beantwoording van deze vragen kan de weg voor het begrijpen van celdoodmechanismen en kinetiek na verschillende thermische blootstellingen en in verschillende retinale pathologieën bouwen. Bovendien kan het ook helpen om klinisch waargenomen problemen te verduidelijken, Zoals het inter-individueel verschil in reactie op laserbehandeling of de variabiliteit in litteken na retinale fotocoagulatie, zelfs wanneer de initiële stipgrootte bijna identiek was ("atrofische kruip") 11 .
Het einddoel van deze studie is het helpen bij het ontwikkelen van temperatuurbeheerde fotothermische therapie van het netvlies. Om dit te bereiken, parallel wiDe technische vooruitgang van de temperatuurmeting 3 , verdere toelichting op RPE-celgedrag na thermische blootstelling, bepaald met behulp van deze methode, zal van groot nut zijn.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
De auteurs hebben niets te onthullen.
Acknowledgments
Dit werk werd ondersteund door een onderzoeksbijdrage van het Duitse Federale Ministerie van Onderwijs en Onderzoek (BMBF) (subsidie # 13GW0043C) en en een Europees Bureau voor Ruimtevaart Onderzoek en Ontwikkeling (EOARD, subsidie # FA9550-15-1-0443)
Materials
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Dulbecco’s Modified Eagle’s Medium - high glucose | Sigma-Aldrich | D5796-500ML | Add (2)-(4) before use. Warm in 37 °C water bath before use. |
| Antibiotic Antimycotic Solution (100 ×) | Sigma-Aldrich | A5955-100ML | Containing 10,000 units penicillin, 10 mg streptomycin and 25 μg Amphotericin B in 1mL. Add 5.5 mL in 500 mL medium bottle (1) before use. |
| Sodium pyruvate (100 mM) | Sigma-Aldrich | S8636-100ML | Add 5.5 mL in 500 mL medium bottle (1) before use (final concentration: 1 mM) |
| Porcine serum | Sigma-Aldrich | 12736C-500ML | Add 50 mL in 500 mL medium bottole (1) before use (final: 10%) |
| Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537-500ML | |
| Trypsin from porcine pancreas | Sigma-Aldrich | T4799-25G | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | ED-100G | |
| Human VEGF Quantikine ELISA Kit | R&D System | DVE00 | |
| Oxiselect Total Glutathione Assay Kit | Cell Biolabs, Inc | STA-312 | |
| Apoptotic/Necrotic/Healthy Cells Detection Kit | PromoKine | PK-CA707-30018 | |
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Thulium laser | Starmedtec GmbH | Prototype | 0-20 W |
| 365 mm core diameter fiber | LASER COMPONENTS Germany | CF01493-52 | |
| Thermocouple | Omega Engineering Inc | HYP-0- 33-1-T-G-60-SMPW-M | |
| Heating plate | MEDAX | ||
| Microplate reader (spectrofluorometer) | Molecular Device | Spectramax M4 | |
| cell homogenizer | QIAGEN | TissueLyser LT | |
| Fluorescence microscope | Nikon | ECLIPSE Ti | |
| mathematical software program | The Mathworks. Inc | MATLAB Release 2015b | |
| system-design platform | National Instrument | Labview | Laboratory Virtual Instrument Engineering Workbench |
References
- Inagaki, K., et al. Comparative efficacy of pure yellow (577-nm) and 810-nm subthreshold micropulse laser photocoagulation combined with yellow (561-577-nm) direct photocoagulation for diabetic macular edema. Jpn J Ophthalmol. 59 (1), 21-28 (2015).
- Roider, J., et al. Selective retina therapy (SRT) for clinically significant diabetic macular edema. Graefes Arch Clin Exp Ophthalmol. 248 (9), 1263-1272 (2010).
- Brinkmann, R., et al. Real-time temperature determination during retinal photocoagulation on patients. J Biomed Opt. 17 (6), 061219 (2012).
- Yoshimura, N., et al. Photocoagulated human retinal pigment epithelial cells produce an inhibitor of vascular endothelial cell proliferation. Invest Ophthalmol Vis Sci. 36 (8), 1686-1691 (1995).
- Denton, M. L., et al. Damage Thresholds for Exposure to NIR and Blue Lasers in an In Vitro RPE Cell System. Invest Ophthalmol Vis Sci. 47 (7), 3065-3073 (2006).
- Shrestha, R., Choi, T. Y., Chang, W., Kim, D. A high-precision micropipette sensor for cellular-level real-time thermal characterization. Sensors (Basel). 11 (9), 8826-8835 (2011).
- Gao, F., Ye, Y., Zhang, Y., Yang, J. Water bath hyperthermia reduces stemness of colon cancer cells. Clin Biochem. 46 (16-17), 1747-1750 (2013).
- Jansen, E. D., van Leeuwen, T. G., Motamedi, M., Borst, C., Welch, A. J. Temperature dependence of the absorption coefficient of water for midinfrared laser radiation. Lasers Surg Med. 14 (3), 258-268 (1994).
- Iwami, H., Pruessner, J., Shiraki, K., Brinkmann, R., Miura, Y. Protective effect of a laser-induced sub-lethal temperature rise on RPE cells from oxidative stress. Exp Eye Res. 124, 37-47 (2014).
- Denton, M. L., et al. Spatially correlated microthermography maps threshold temperature in laser-induced damage. J Biomed Optics. 16 (3), (2011).
- Morgan, C. M., Schatz, H. Atrophic creep of the retinal pigment epithelium after focal macular photocoagulation. Ophthalmology. 96 (1), 96-103 (1989).



