Summary
Здесь вводится оригинальная экспериментальная установка для нагрева клеток в культуральной чаше с использованием лазерного излучения непрерывной волны 1,94 мкм. Используя этот метод, можно исследовать биологические реакции эпителиальных клеток эпителия сетчатки (РПЭ) после различных термических воздействий.
Abstract
Здесь вводится оригинальный метод нагрева культивируемых клеток с использованием непрерывного волнового лазера с непрерывной волной 1,94 мкм для биологической оценки. Тулиевое лазерное излучение сильно поглощается водой, а клетки на дне культуральной чашки нагреваются посредством тепловой диффузии. Лазерное волокно диаметром 365 мкм устанавливается около 12 см над культуральной чашкой без какой-либо оптики, так что диаметр лазерного луча почти эквивалентен внутреннему диаметру культуральной тарелки (30 мм). Сохраняя постоянное количество культуральной среды в каждом эксперименте, можно облучать клетки с сильно воспроизводимым повышением температуры.
Для калибровки увеличения температуры и ее распределения в одной чашке для культивирования клеток для каждой установки мощности измеряли температуру в течение 10 с облучения в разных положениях и на клеточном уровне. Распределение температуры было представлено с использованием программного обеспечения для математической графикиПрограмма, и ее образец в блюде культуры был в гауссовой форме. После лазерного облучения можно было провести различные биологические эксперименты для оценки зависимых от температуры реакций клеток. В этой рукописи вводится окраска жизнеспособности ( т. Е. Различение живых, апоптотических и мертвых клеток), чтобы помочь определить пороговые температуры для апоптоза клеток и смерти после разных точек времени.
Достоинствами этого метода являются точность температуры и времени нагрева, а также ее высокая эффективность в нагревании ячеек в блюде культуры целых клеток. Кроме того, он позволяет проводить исследования с широким диапазоном температур и продолжительности времени, которые могут быть хорошо контролируемыми компьютеризированной операционной системой.
Introduction
Понимание зависимых от температуры клеточных биологических реакций имеет большое значение для успешного лечения гипертермии. Лазерная фотокоагуляция сетчатки с термическим лазером, используемая в офтальмологии, является одним из наиболее известных методов лечения лазеров в медицине. Видимый свет, в основном от зеленой до желтой длины волны, используется при лазерной обработке сетчатки. Свет сильно поглощается меланином в эпителиальных клетках сетчатки сетчатки (РПЭ), которые образуют внешний клеточный монослой сетчатки. Недавно среди врачей и исследователей был интерес к очень мягкому термическому облучению (субвидимая фотокоагуляция) в качестве новой терапевтической стратегии для различных видов нарушений сетчатки 1 , 2 . Следуя этой тенденции, наш интерес заключается в подсолевом нагревании клеток RPE при точном контроле температуры, методе терморегулируемой фототермической терапии (TC-PTT).
Недавний оптАкустическая технология нашего института позволила измерять повышение температуры в реальном времени на облученных участках сетчатки. Это позволяет контролировать увеличение температуры при облучении 3 . Однако, поскольку сублетальная гипертермия на сетчатке, вызванная нагреванием клеток РПЭ подлето, ранее не рассматривалась из-за невозможности измерения и контроля температуры, зависящие от температуры реакции клеток клеток РПЭ после термического лазерного облучения Были очень мало изучены до настоящего времени. Кроме того, не только различие температур не обсуждалось подробно, но также и разница в поведении клеток выживших клеток после сублетального и летального облучения. Поэтому, чтобы собрать научные данные о методах, основанных на ТС-РТТ, мы стремимся выяснить связанные с температурой биологические реакции клеток РПЭ и их механизмы, используя экспериментальные установки in vitro .
Для tЕго цель, необходимо установить установку нагрева ячейки, которая удовлетворяет следующим условиям: 1) возможность быстрого повышения температуры, 2) точно контролируемое время и температура и 3) относительно большое количество исследованных клеток для биологических экспериментов , Что касается метода нагрева, то, к сожалению, для нагрева клеточной культуры клейкий лазер, такой как лазер Nd.YAG с частотным удлинением (532 нм), не подходит. Это связано с сильно уменьшенным числом меланосом в культивируемых клетках RPE. Поглощение лазерного света может быть неоднородным, и повышение температуры на клеточном уровне является переменным между экспериментами, даже при облучении той же мощностью излучения. В нескольких предыдущих исследованиях сообщалось об использовании черной бумаги под днищем тарелки во время облучения 4 или использовании дополнительных меланосом, фагоцитированных клетками культуры до экспериментов 5 , 6 . Многие изБиологические исследования in vitro для оценки гипертермических реакций клеток проводились с использованием горячей плиты, водяной бани или инкубатора CO 2 с установлением температуры 7 . Эти методы требуют длительного периода нагрева, так как для достижения желаемой температуры требуется некоторое время ( т. Е. Несколько минут). Кроме того, используя эти методы, трудно получить подробную температурную историю ( т. Е. Температуру, умноженную на время) на клеточном уровне. Более того, температура между клетками в разных положениях в одной блюде культуры может отличаться из-за переменной температурной диффузии. В большинстве случаев эта временная и пространственная информация о температуре во время гипертермии не была принята во внимание для биологических анализов, даже если реакция биологических клеток может быть критически затронута температурой и продолжительностью времени повышенной температуры.
Чтобы преодолеть эти проблемы,Для нагрева ячеек использовался тюль-лазер с непрерывной волной. Тулиевое лазерное излучение (λ = 1,94 мкм) сильно поглощается водой 8 , а клетки на дне культуральной чашки термически стимулируются исключительно за счет тепловой диффузии. Лазерное волокно диаметром 365 мкм установлено примерно на 12 см выше чашки для культивирования, без какой-либо оптики между ними. Диаметр лазерного луча расходится так, что он почти эквивалентен внутреннему диаметру культуральной чашки (30 мм) на поверхности культуральной среды. При постоянном количестве культуральной среды можно облучать клетки с повышением температуры Высокой повторяемости. Переменные параметры мощности позволяют облучать до 20 Вт, а температура среды на клеточном уровне может быть увеличена до ΔT ≈ 26 ° C за 10 секунд.
Модифицируя условия облучения, можно также изменить профиль лазерного луча, чтобы изменить распределение температурыНа блюде культуры. Например, можно исследовать гауссовское распределение температуры, как в текущем исследовании, или с однородным распределением температуры. Последнее может быть выгодным для исследования эффектов зависимых от температуры реакций на клетки более конкретно для повышения уровня смертности, а не для стресса со смертельным исходом или реакции заживления ран.
В целом облучение тулиевым лазером может позволить исследовать различные виды биологических факторов, таких как экспрессия гена / белка, кинетика смерти клеток, клеточная пролиферация и развитие функциональных свойств клеток после различных термических воздействий.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Культура клеток RPE
- Выделение клеток РПЭ из глаз свиней
- Получите свежевыраженные глаза с свиней с местной бойни. Держите их прохладно (4 ° C) и в темной среде.
- Удалите внеклеточные ткани с помощью ножниц и промойте глаза в антисептическом растворе в течение 5 мин.
- Поместите глаза в стерилизованный забуференный фосфатом физиологический раствор без кальция и магния (PBS (-)) до использования.
- Используя скальпель, пронизывайте склеру примерно на 5 мм позади лимбомы роговицы. Резекция всей передней части глаза, разрезая ножницами на всем пути, параллельно роговице лимба.
- Удалите переднюю часть глаза ( то есть роговицу и линзу) и стекловидное тело. Добавьте 1 мл PBS (-) и осторожно удалите нервную сетчатку.
ПРИМЕЧАНИЕ. Эта «глазная чаша», состоящая из склеры, хориоидов и RPE, теперь готова. - Добавить предварительно нагретый (37 ° C) 0,25% трипсин в PBS (-) в глазную чашку. Отрегулируйте громкость таким образом, чтобы около 80% чашки для глаз заполняли этим раствором трипсина.
- Инкубируйте глазную чашку с раствором трипсина в 5% -ном инкубаторе СО 2 при 37 ° С в течение 10 мин.
- Удалите глазную чашку из инкубатора и замените 0,25% раствор трипсина раствором PBS (-) с 0,05% трипсином + 0,2% этиленаминометауксусной кислоты тетранатриевой соли (EDTA · 4N). Инкубируйте глазную чашку в инкубаторе в течение 45 мин.
ПРИМЕЧАНИЕ. Через 45 минут клетки RPE будут либо просто прикреплены к мембране Бруха, либо уже отсоединены и будут перемещаться в растворе трипсин-ЭДТА. - Собирайте клетки RPE, осторожно пипетируя. Соберите клетки и раствор в конической трубке, заполненной 10 мл культуральной среды (DMEM с высокой глюкозой с L-глутамином), включая 10% сыворотки свиньи, антибиотик / антимикотик и пируват натрия (1 мМ).
ПРИМЕЧАНИЕ. Сыворотка может нейтрализовать действие трипсина. - ЦентрифугаКлеточной суспензии при 400 мкг в течение 5 мин при комнатной температуре.
- Удалите супернатант и добавьте 10 мл свежей среды. Центрифуга снова при тех же условиях в течение 5 мин.
- Удалите супернатант и добавьте новую среду, так что концентрация клеток приводит к 5 × 10 5 клеток / мл (определяется путем подсчета клеток с использованием гемоцитометра). Хорошо перемешать, осторожно пипетируя.
- Распределите клеточную суспензию в блюдах культуры клеток. Используйте 3 мл на культуральную чашку диаметром 60 мм.
ПРИМЕЧАНИЕ. Эта культура называется прохождением нуля (P0). - Поддерживайте клетки в 5% -ном инкубаторе CO 2 при 37 ° C. Изменяйте половину кондиционированной среды на свежую среду каждый второй день.
- Субкультура (шаг 1.2), если она становится конфлюэнтной.
- Субкультура культуры клеток RPE
- Удалите культуральную среду и промойте клетки дважды PBS (-).
- Инкубируйте клетки с PBS (-) раствором с 0,05% трипсином + 0,2% ЭДТА iNa 5% CO 2 инкубатор при 37 ° C в течение 5 мин.
- Отделите клетки RPE осторожной пипетированием и соберите суспензию клеток в конической трубке, наполненной 10 мл культуральной среды, включая 10% сыворотки свиньи.
- Центрифугируют клеточную суспензию при 400 мкг в течение 5 мин при комнатной температуре.
- Удаляют супернатант и добавляют новую культуральную среду, делая концентрацию клеток 5 · 10 5 клеток / мл (определяется путем подсчета числа клеток с помощью гемоцитометра). Распределите ячейки в новых культуральных чашках диаметром 60 мм, как описано в шаге 1.1.13.
ПРИМЕЧАНИЕ. Культура клеток теперь проходит через 1 (P1). - После достижения слияния субкультура культуры P1 до P2, используя ту же процедуру, что и на этапах 1.2.1-1.2.5. Из культуры P2 высевают клетки на более мелкие культуральные блюда (внутренний диаметр 30 мм) вместо культуральных блюд диаметром 60 мм.
- Для экспериментов используйте культуры P2 или P3.
2. ТулЛазерное облучение ium
- Строительство станции облучения
- Подключите устройство тулиевого лазера (1,94 мкм, диапазон мощности: 0-20 Вт) к волокну диаметром сердцевины 0,22-NA, 365 мкм.
- Механически зафиксируйте наконечник волокна металлическим кронштейном, который горизонтально закреплен на вертикальной металлической стойке станции облучения. Поместите вертикальную стойку таким образом, чтобы кончик лазерного волокна располагался над горячей плитой, на которой должна быть размещена чашка для культивирования клеток во время облучения.
- Положите белую бумагу на горячую плиту и включите луч направленного света (λ = 635 нм, макс = 1 мВт, диаметр на уровне бумаги ≈ 30 мм). Отметьте окружность направляющей балки на белой бумаге так, чтобы было известно положение, в которое должна быть размещено блюдо для культивирования во время облучения.
ПРИМЕЧАНИЕ. Z-плоскость наконечника волокна может быть изменчивой. Без какой-либо дополнительной оптической оптики диаметр лазерного пятна на плоскости культуры клеток, расположенный на 12 см ниже наконечника волокна, iПримерно 30 мм, что почти эквивалентно внутреннему диаметру чашки для культивирования клеток. Схематический чертеж установки показан на рисунке 1 .

Рисунок 1: Схематическое изображение станции облучения тулиевым лазером. На нагревательную плиту помещают блюдо для культивирования. Ячейки размещены на 12 см ниже наконечника тонкого лазерного волокна, так что размер пучка почти идентичен внутреннему диаметру культуральной чашки (около 30 мм). Процедура лазерного облучения контролируется регулируемой по времени процедурой пользовательской системы проектирования системы. Настройка мощности должна определяться до запуска программы облучения. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- За 1 ч до облучения полностью замените культуральную среду 1,2 мл свежей среды.
ПРИМЕЧАНИЕ. Это КРИТИЧЕСКИЙ ШАГ, и его необходимо строго соблюдать. - Поместите облучательную станцию ( то есть, горячую пластину и столбик для фиксации лазерного волокна) на чистую скамью.
- Удалите блюдо для культивирования клеток из инкубатора и поместите его в отмеченное положение на плите (шаг 2.1.3).
- Наденьте защитные очки. Включите тулиевый лазер. Установите мощность по желанию на лазерное устройство (с возможностью настройки от 0 до 20 Вт). Включите эмиссию.
- Запустите платформу системного проектирования, которая контролирует протокол лазерного облучения и синхронизации (дополнительный файл).
- Сразу же после помещения культуральной тарелки на горячую плиту нажмите «время предварительного нагрева», чтобы запустить таймер на 140 с («время предварительного нагрева 1»); Это будет поддерживать температуру питательной среды на уровне 37 ° C до облучения.
ПРИМЕЧАНИЕ. Через 140 секунд включается звуковой сигнал, и следующий таймер («время предварительного нагрева 2») автоматически начнет отсчет 8 секунд. В течение этого 8 секунд экзаменатор может открыть блюдо для культуры. После 148 секунд предварительного нагрева 10-длинное лазерное облучение на культуре клеток будет проводиться автоматически. В случае возникновения чрезвычайной ситуации оснастите лазерное устройство кнопкой принудительного закрытия, чтобы немедленно остановить лазер. Это КРИТИЧЕСКИЙ ШАГ, и его необходимо строго соблюдать. Особое внимание следует уделить открытию крышки блюда непосредственно перед облучением в начале 8-секундного времени предварительного нагрева. Открытие крышки может очень быстро охладить поверхность среды. - После облучения немедленно положите крышку обратно на блюдо для культивирования, оставьте чашку для культивирования на горячей плите еще на 7 с и положите ее обратно в 5% -ный инкубатор CO 2 при 37 ° C.
- Сделайте небольшие отверстия (около 300 мкм в диаметре) близко к основанию с четырех сторон (каждые 90 °) культуральной чашки диаметром 30 мм (без ячеек); Используйте наконечник иглы (20G), нагретый горелкой Бунзена. Уплотните отверстия изоляционной изоляцией снаружи и сделайте небольшое отверстие тонкой иглой так, чтобы через это отверстие в водонепроницаемых условиях можно было вставить только тонкую термопару (диаметр 200 мкм).
- На внешней стороне дна культуры, нарисуйте 2 перпендикулярных диаметра и установите точку пересечения ( т. Е. Центр нижней стороны) в качестве нулевой координаты (0). Отметьте каждые 3 мм радиально наружу из блюда ( т. Е. 0, 3, 6, 9, 12 и 15 мм) в каждом направлении вдоль линий ( рис. 2 , синие точки); Количество очков должно составлять 21.
- Заполните блюдо для культивирования клеток 1,2 мл новой культуральной среды. Поместите культуру dИш на горячую плиту при 37 ° С, вставьте тонкую термопару (диаметр 200 мкм) в боковое отверстие и поместите ее чувствительный наконечник в измеренное положение.
- Наденьте защитные очки. Включите тулиевый лазер и вручную установите мощность (от 0 до 20 Вт с шагом 0,1 Вт) лазерного устройства.
ПРИМЕЧАНИЕ. Для калибровки температуры необходимо провести измерения с мощностью с шагом 3 Вт. - Включите платформу проектирования системы и нажмите кнопку «Start Temp. Acquisition» (дополнительный файл), чтобы начать измерение температуры.
- Проделайте ту же процедуру, что и на шаге 2.2.6.
ПРИМЕЧАНИЕ. Программа управления измеряет температуру вставленной термопары каждые 100 мс и показывает прогрессирование температуры во время облучения в графическом интерфейсе. - Проведите эти процедуры для всех 21 точки измерения и при разных параметрах питания. Повторите всю процедуру три раза для всех точек и для всех настроек мощностиGs для получения надежных данных.
- Экспортировать данные о температуре как данные csv, которые в конечном итоге могут быть преобразованы в электронную таблицу. Средняя максимальная температура в конце облучения для трех измерений в каждой точке. Средние значения из точек на одном круге (всего 4 балла, за исключением центральной точки).
- Постройте полученную усредненную максимальную температуру на графике, сделав расстояние от центра чашки (мм) в виде оси x и увеличения температуры (ΔT, ° C) в виде оси y. Используйте функцию соответствия математической программы для подгонки модели Гаусса к необработанным данным. Создайте распределение температуры по Гауссу.

Рисунок 2: Точки для калибровки температуры в одной ячейке культуры. Температурные данные измеряли в центре и при 5Радиальные точки на 4 разных углах (синие точки). Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Биологические оценки клеточных реакций после различных тепловых облучений
- Оценка жизнеспособности клеток ( т. Е. Живых, апоптотических и мертвых) после различных настроек мощности и определения порога смертности клеток
- В указанные моменты времени ( т. Е. Через 3, 24 и 48 ч после облучения) промывайте клетки PBS (-) и используйте коммерчески доступный комплект для оценки жизнеспособности клеток ( то есть жизненно важных, апоптозных, мертвых) в соответствии с протокол.
- Подготовьте окрашивающий раствор, добавив 5 мкл изотиоцианата флуоресцеина (FITC) -аннексина V, 5 мкл гомодимера III этидия и 5 мкл Hoechst 33342 до 100 мкл 1x связывающего буфера (все они являются наборамикомпоненты). Подготовьте достаточное количество окрашивающего раствора для покрытия клеток. Инкубируйте клетки в течение 15 мин.
- Вымойте культуру клеток с помощью связующего буфера дважды, замените связывающий буфер на PBS (-) и установите культуру на стадии флуоресцентного микроскопа.
- Переключите световой путь в окулярную линзу, выберите фильтр 4 ', 6-Diamidin-2-фенилиндол (DAPI), включите подсветку и найдите плоскость с прицелом 4x.
- Измените путь света к камере, найдите изображение на экране компьютера в программном обеспечении для обработки микроскопа и отрегулируйте фокус.
- Используйте функцию строчки ( т. Е. Функцию записи нескольких изображений по тарелке, а затем создайте одно крупное изображение) программного обеспечения, специфичного для микроскопа, для получения флуоресцентного изображения блюдо для всей клеточной культуры. Используйте 3 разных набора фильтров - DAPI, FITC и тетраметилборамин (TRITC) - к изображениям Hoechst 33342-положительных клеток (все клеточные ядра), FITC-аннексин V-positiVe (апоптоз) и III-позитивные клетки гомодимера этидия (мертвые), соответственно.
- Измерьте радиус (мм) мертвой (III-позитивной) гомодимера этидия и внешний / внутренний радиус области зонной формы (аннексин V-позитивный) в окрашенных клеточных культурах. Примените эти радиусы к установленной гауссовой функции распределения температуры для соответствующей настройки мощности. Вычислите точную температуру на краю мертвой или апоптотической области, чтобы уточнить пороговые температуры для гибели клеток и апоптоза.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Распределение температуры после различных настроек мощности
Все температурные изменения для каждого отдельного облучения контролировались при калибровке температуры. Из этих данных была получена максимальная температура в измеренной точке и определена как T max (° C). Как показано на фиг.3А , программа была выполнена в момент времени, когда блюдо для культуры было помещено на нагревательную пластину. После 140 с «времени предварительного нагрева 1», который необходим для архивирования стабильной температуры среды при 37 ° С, крышка культуральной чашки была удалена в течение 8 с «времени предварительного нагрева 2». В конце «времени предварительного нагрева 2» лазерное излучение запускается автоматически. Эта кривая представляет собой типичную прогрессию температуры при облучении 10 с. При облучении температура возрастала, и сразу же после лазерной эмиссииВыключен, температура начала уменьшаться. Максимальная температура в центре культуральной чашки определялась в этом исследовании как T max (° C). T max был пропорционален мощности лазера ( рис. 3B ). На рисунке 3C показано распределение максимальной температуры для каждой мощности в блюде культуры. Распределения имеют колоколообразную форму, как показано на рисунке 3C , и соответствуют гауссовой функции по следующей формуле:
T (r) = t base + A · 
Где r, t base , A и w означают расстояние от центра (mm), самую низкую температуру для кривой, амплитуду и ширину кривой, соответственно. Параметры (t base , A и w) установленного GAussian curve для каждой настройки мощности, а именно для каждого T max , показаны в таблице рядом с графиком.
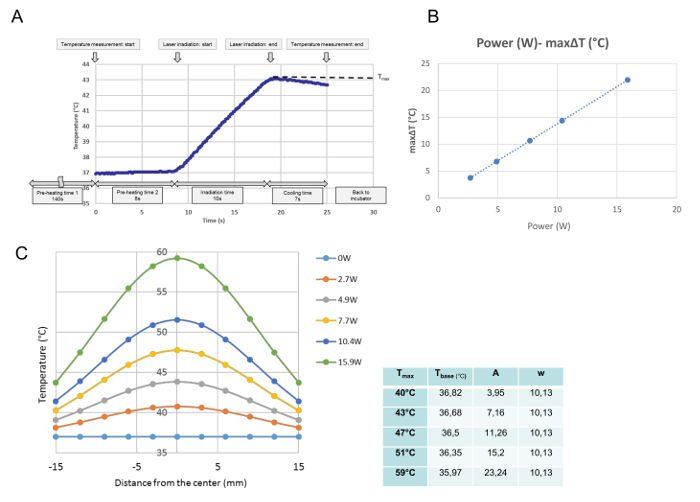
Рисунок 3: Данные калибровки температуры. Репрезентативное температурное развитие в центральной позиции после однократного облучения при 4,9 Вт (T max = 43 ° C) ( A ), пропорциональная связь между мощностью лазера и максимальным ΔT в центральном положении клеточной культуры ( B ), И распределения температуры во всех культурах после различных настроек питания (C). (A) Программа выполняется с момента, когда блюдо культуры помещается на нагревательную плиту. После 140 с «времени предварительного нагрева 1», необходимого для архивирования стабильной температуры среды при 37 ° С, крышка культуральной чашки удаляется для 8-секундного времени предварительного нагрева2. «В конце« времени предварительного нагрева 2 »лазерная эмиссия начинается автоматически. Эта кривая представляет собой типичную прогрессию температуры в центральном положении при облучении 10 с при 4,9 Вт. При облучении температура увеличивается и Сразу после того, как лазерное излучение выключено, температура начинает уменьшаться. Максимальная максимальная температура получается в конце облучения, которая определена в этом исследовании как T max (° C). (B) Мощность лазера и максимальная (C) Установленные гауссовы функции измеренных температурных распределений в блюде культуры. Параметры для функций, определенные с помощью математической программы, показаны в таблице на стороне графика Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Жизнеспособность клеток после термического облучения
Как показано на фиг. 4А , существует три разных рисунка окраски, указывающих на жизнеспособность клеток после лазерного облучения: 1) не аннексин V / этидиум-гомодимер III-позитивный ( т.е. только живой), 2) аннексин V-положительный в центре ( т. Е. Почти Только ранний апоптоз) и 3) гомодимер этидия III-положительный в центре ( т. Е. Мертвые клетки), окруженный апоптозными клетками на границе между мертвыми и живыми клетками ( рис. 4B ). Размер мертвой / апоптотической области обычно зависит от T max и времени после облучения до 48 ч после облучения. В культурах, облученных T max ≤43 ° C, не было обнаружено явного изменения жизнеспособности. Единственное апоптотическое изменение можно было наблюдать в ранний момент времени (3 часа), после чего Клеточной смерти после облучения T max = 47 ° C. Немедленная или ранняя гибель клеток (до 3 ч) была обнаружена в культурах, облученных T max ≥ 51 ° C (таблица 1).

Рисунок 4: Схема окраски жизнеспособности после различных настроек мощности (A) и образцового изображения на краю мертвых и апоптотической области после летальных лазерных облучений (B).
(A) В зависимости от температуры могут наблюдаться три картины окрашивания. (B) Апоптотическая зона (FITC-аннексин V-позитивная: зеленая) вокруг мертвой зоны (гомодимер этидия III-позитивный: красный). Все клетки положительны для Hoechst 33342 (синий), а клетки с синими ядрами являются живыми клетками. Изображение было снято через 24 часа после облучения при T max = 59 ° C. Бар = 100 мкм./files/ftp_upload/54326/54326fig4large.jpg "target =" _ blank "> Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Таблица 1: Ответы на приложе ние V и Ethidium Homodimer III при различных температурах и временах.
Определение пороговой температуры для гибели клеток
Средние радиусы мертвой зоны (красный) и апоптотическая область (зеленый) были измерены и применены к гауссовой функции распределения температуры для определения пороговых пиковых температур для гибели клеток и апоптоза через 10 с облучения. Согласно этому анализу, средние пороговые температуры для полной гибели клеток в течение 3 ч, 24 ч и 48 ч после облучения составляли 54,0 ° С, 50,9 ° С и 50,1 ° С соответственно. Среднее threshoLd для изменения апоптоза клеток были ниже примерно на 2-3 градуса, с пороговыми температурами в течение 3 ч, 24 ч и 48 ч при 51,7 ° С, 48,0 ° С и 47,0 ° С соответственно ( рис. 5 ).
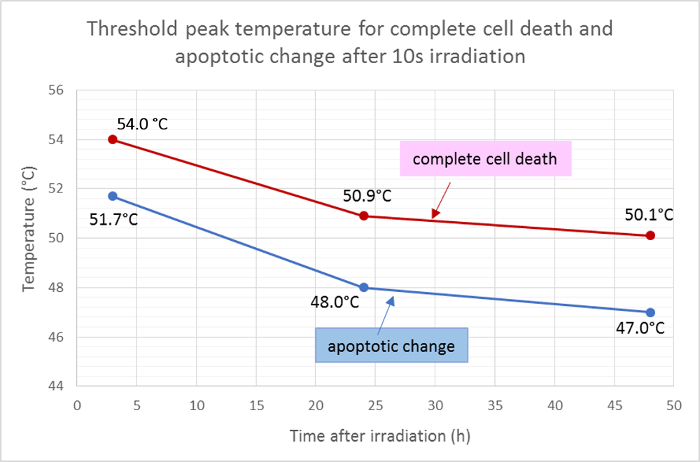
Рисунок 5: Пороговые температуры для апоптоза и смерти клеток.
Средние пороговые температуры для полной гибели клеток (положительные для Hoechst 33342, аннексин V и гомодимер III этидия) и для апоптоза (положительные только для Hoechst 33342 и аннексина V) в разные моменты времени после облучения, рассчитанные по результатам окрашивания жизнеспособности флуоресценции , Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
При обсуждении связанных с температурой биологических клеточных реакций важна не только температура, но также и продолжительность времени повышенной температуры, поскольку большинство биохимических процессов зависят от времени. В частности, в области лазерной гипертермии в офтальмологии из-за короткого промежутка времени - от миллисекунд до нескольких секунд - трудно исследовать клеточные тепловые эффекты с точным контролем температуры. Поэтому желательна установка лазерного облучения, подходящая для модели клеточной культуры, и с операционной системой, которая обеспечивает строгую регулировку температуры и времени. Биологическая оценка реакции клеток после термического воздействия, такого как экспрессия белка или секреция, требует повторных количественных оценок на достаточном количестве пораженных клеток. Это было препятствием для исследований с использованием лазерных пятен диаметром в несколько сотен микрометров, как и при клинических исследованиях. Количественный анализ на одном лазерном пятне довольно широкrdensome. В этом исследовании были предприняты попытки максимально удовлетворить эти требования. Используя длинноволновый волновой лазер с длиной волны 1,94 мкм с программой управления облучением, временной рост температуры может быть проведен в цельной культуре клеток за короткий промежуток времени. Поскольку распределение температуры может регулироваться путем изменения пути света, различные эксперименты, связанные с гипертермией, могут быть проведены с использованием этой установки.
Ограничением представленного метода является невозможность проведения одновременных измерений температуры при лазерном облучении клеток. Поскольку использование термопар не подходит для стерилизованных культур клеток, калибровка температуры должна проводиться отдельно от облучения клеток. Учитывая возможные изменения мощности лазерной мощности, измерения температуры в режиме реального времени во время каждого лазерного облучения были бы идеальными для прямой оценки клеточных ответов, соответствующихТепловая доза. Более того, используемое здесь распределение температуры создавалось с помощью интерполяции данных на основе измерений в 21 точке на блюде культуры и при различных настройках мощности. Поэтому для преодоления этих ограничений и критических моментов наша цель - разработать альтернативный метод, позволяющий измерять температуру культуральной посуды при лазерном облучении. Мы также стремимся сразу получить информацию о пространственной температуре. Инфракрасное изображение (термография) является одним из возможных методов измерения температуры при лазерном облучении 10 . Большим преимуществом этого метода является измерение температуры в реальном времени на клеточном уровне для каждого облучения; Последующие клеточные биологические ответы всегда могут быть индивидуально сопоставлены с историей температуры во время облучения. Однако, учитывая экономическую эффективность и удобство использования, использование термографии для экспериментов по нагреву клеток не представляется возможным для каждого трудаORY.
В способе, использующем тулиевый лазер на длине волны 1,94 мкм, вода в чашке для культивирования клеток нагревается на ее поверхности, а термическая диффузия и конвекция используются для нагрева клеток. Высота культуральной среды в этой установке облучения с 1,2 мл культуральной среды составляет 935 мкм в центральном положении (из предыдущего измерения с использованием оптической когерентной томографии). Уровень поглощения тулиевого лазера в воде очень высок (коэффициент поглощения: 127 см -1 при 35 ° С), а 72% света поглощается в первых 100 мкм культуральной среды. Поглощения (0,0007%) практически нет на глубине 935 мкм.
Важно отметить, что одна из критических точек в протоколе состоит в том, чтобы добавить одно и то же количество среды (1200 мкл) для каждого облучения. Использование различных количеств культуральной среды может привести к разности высот, что может вызвать различия в температуре iNcrease клеток. Вторая критическая точка относится к срокам открытия блюд культуры. Это должно быть сделано одновременно - в этом исследовании за 8 с до начала облучения, когда система производит звук. Различия в этом времени могут варьировать базовую температуру из-за охлаждения, вызванного окружающим воздухом (около 23 ° C). Это может привести к значительным различиям в температуре, вызванной лазерным излучением.
Для калибровки температуры использовалось такое же количество среды (1,2 мл), которое использовалось в экспериментах, для измерения распределения температуры на дне бесклеточных культуральных блюд. Однако высота среды с монослоем ячейки может отличаться от высоты, не содержащей клеток, даже при том же объеме добавленной среды. Измерение с использованием оптической когерентной томографии показало, что разница в 58 мкм в центральном положении между чашками с и без сливного монослоя (877 мкм без клеток, по сравнению с tO 935 мкм с ячейками). Это различие потенциально связано с капиллярным действием клеток. Разница в высоте 58 мкм в центральном положении может быть вызвана приблизительно 40 мкл среды (измеренные данные). Было также подтверждено, что эта разница в высоте не вызывала существенных различий в T max при всех настройках мощности. Поэтому мы пришли к выводу, что это различие существенно не влияет на результаты анализа, проведенного в этом исследовании. Тем не менее, для сбора более точной информации о температуре, как указано выше, следует разработать способ калибровки температуры с использованием чашки для культивирования клеток, содержащей клеточный монослой. Кроме того, требуется также математическое моделирование тепловой диффузии и конвекции во всей культуральной среде.
В этом исследовании клетки нагревались с распределением по Гауссову. Существует несколько возможных способов более равномерно нагревать всю среду со временем. Один Заключается в использовании лазерного источника с меньшим коэффициентом поглощения в воде. Однако недостатком является то, что в этом случае лазеры должны иметь более высокую мощность, так как только небольшой процент света поглощается примерно на 0,9 мм. Другая возможность заключается в изображении наконечника дистального волокна многомодового оптического волокна, который передает лазерный свет в плоскость культуральной чашки; Увеличение может быть выбрано произвольно оптикой.
Второй изюминкой этого протокола является его способность определять пороговую температуру для гибели клеток и апоптоза с использованием флуоресцентного изображения окраски жизнеспособности и бокового распределения температуры. Долгосрочная цель заключается не только в определении жизнеспособности клеток, но также для выяснения температурного диапазона биологических реакций клеток, связанных с функциональностью клеток, таких как экспрессия белка и пролиферация клеток. Определение пороговой температуры смерти клеток представляет большой интерес для исследователей«> 10. Используя этот метод, можно было бы определить критические факторы для гибели клеток, включая апоптоз. Критические факторы для термоядерной гибели клеток могут быть определены не только по истории температуры, но и через эндогенные факторы ( Т. Е. Внутриклеточные / внеклеточные факторы на молекулярном уровне). Отвечая на эти вопросы, можно проложить путь для понимания механизмов и кинетики клеточной смерти после различных термических воздействий и различных патологий сетчатки.Кроме того, это также может помочь прояснить клинически наблюдаемые проблемы, Таких как межличностное различие в ответ на лазерное лечение или изменчивость размера рубца после фотокоагуляции сетчатки, даже когда начальный размер пятна был почти идентичным («атрофическая ползучесть») 11 .
Конечной целью этого исследования является помощь в разработке термотермической терапии сетчатки. Для этого параллельноТо техническое улучшение температурного измерения 3 , дальнейшее выяснение поведения элементов РПЭ после термического воздействия, определенное с использованием этого метода, будет иметь большую пользу.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Авторам нечего раскрывать.
Acknowledgments
Эта работа была поддержана грантом исследования Федерального министерства образования и исследований Германии (BMBF) (грант № 13GW0043C) и Европейского бюро аэрокосмических исследований и разработок (EOARD, грант # FA9550-15-1-0443)
Materials
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Dulbecco’s Modified Eagle’s Medium - high glucose | Sigma-Aldrich | D5796-500ML | Add (2)-(4) before use. Warm in 37 °C water bath before use. |
| Antibiotic Antimycotic Solution (100 ×) | Sigma-Aldrich | A5955-100ML | Containing 10,000 units penicillin, 10 mg streptomycin and 25 μg Amphotericin B in 1mL. Add 5.5 mL in 500 mL medium bottle (1) before use. |
| Sodium pyruvate (100 mM) | Sigma-Aldrich | S8636-100ML | Add 5.5 mL in 500 mL medium bottle (1) before use (final concentration: 1 mM) |
| Porcine serum | Sigma-Aldrich | 12736C-500ML | Add 50 mL in 500 mL medium bottole (1) before use (final: 10%) |
| Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537-500ML | |
| Trypsin from porcine pancreas | Sigma-Aldrich | T4799-25G | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | ED-100G | |
| Human VEGF Quantikine ELISA Kit | R&D System | DVE00 | |
| Oxiselect Total Glutathione Assay Kit | Cell Biolabs, Inc | STA-312 | |
| Apoptotic/Necrotic/Healthy Cells Detection Kit | PromoKine | PK-CA707-30018 | |
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Thulium laser | Starmedtec GmbH | Prototype | 0-20 W |
| 365 mm core diameter fiber | LASER COMPONENTS Germany | CF01493-52 | |
| Thermocouple | Omega Engineering Inc | HYP-0- 33-1-T-G-60-SMPW-M | |
| Heating plate | MEDAX | ||
| Microplate reader (spectrofluorometer) | Molecular Device | Spectramax M4 | |
| cell homogenizer | QIAGEN | TissueLyser LT | |
| Fluorescence microscope | Nikon | ECLIPSE Ti | |
| mathematical software program | The Mathworks. Inc | MATLAB Release 2015b | |
| system-design platform | National Instrument | Labview | Laboratory Virtual Instrument Engineering Workbench |
References
- Inagaki, K., et al. Comparative efficacy of pure yellow (577-nm) and 810-nm subthreshold micropulse laser photocoagulation combined with yellow (561-577-nm) direct photocoagulation for diabetic macular edema. Jpn J Ophthalmol. 59 (1), 21-28 (2015).
- Roider, J., et al. Selective retina therapy (SRT) for clinically significant diabetic macular edema. Graefes Arch Clin Exp Ophthalmol. 248 (9), 1263-1272 (2010).
- Brinkmann, R., et al. Real-time temperature determination during retinal photocoagulation on patients. J Biomed Opt. 17 (6), 061219 (2012).
- Yoshimura, N., et al. Photocoagulated human retinal pigment epithelial cells produce an inhibitor of vascular endothelial cell proliferation. Invest Ophthalmol Vis Sci. 36 (8), 1686-1691 (1995).
- Denton, M. L., et al. Damage Thresholds for Exposure to NIR and Blue Lasers in an In Vitro RPE Cell System. Invest Ophthalmol Vis Sci. 47 (7), 3065-3073 (2006).
- Shrestha, R., Choi, T. Y., Chang, W., Kim, D. A high-precision micropipette sensor for cellular-level real-time thermal characterization. Sensors (Basel). 11 (9), 8826-8835 (2011).
- Gao, F., Ye, Y., Zhang, Y., Yang, J. Water bath hyperthermia reduces stemness of colon cancer cells. Clin Biochem. 46 (16-17), 1747-1750 (2013).
- Jansen, E. D., van Leeuwen, T. G., Motamedi, M., Borst, C., Welch, A. J. Temperature dependence of the absorption coefficient of water for midinfrared laser radiation. Lasers Surg Med. 14 (3), 258-268 (1994).
- Iwami, H., Pruessner, J., Shiraki, K., Brinkmann, R., Miura, Y. Protective effect of a laser-induced sub-lethal temperature rise on RPE cells from oxidative stress. Exp Eye Res. 124, 37-47 (2014).
- Denton, M. L., et al. Spatially correlated microthermography maps threshold temperature in laser-induced damage. J Biomed Optics. 16 (3), (2011).
- Morgan, C. M., Schatz, H. Atrophic creep of the retinal pigment epithelium after focal macular photocoagulation. Ophthalmology. 96 (1), 96-103 (1989).



