Summary
Ein ursprünglicher experimenteller Aufbau zum Erwärmen von Zellen in einer Kulturschale unter Verwendung von 1,94 μm kontinuierlicher Laserstrahlung wird hier eingeführt. Mit dieser Methode können die biologischen Reaktionen von retinalen Pigmentepithel- (RPE) -Zellen nach unterschiedlichen thermischen Expositionen untersucht werden.
Abstract
Ein originelles Verfahren zur Erwärmung von kultivierten Zellen mit einem 1,94 μm kontinuierlichen Thulium-Laser für die biologische Beurteilung wird hier vorgestellt. Die Thulium-Laserstrahlung wird stark von Wasser absorbiert und die Zellen am Boden der Kulturschale werden durch thermische Diffusion erwärmt. Eine Laserfaser mit einem Durchmesser von 365 μm wird etwa 12 cm oberhalb der Kulturschale ohne jegliche Optik eingestellt, so dass der Laserstrahldurchmesser nahezu dem Innendurchmesser der Kulturschale (30 mm) entspricht. Indem man in jedem Experiment eine konsistente Menge an Kulturmedium hält, ist es möglich, die Zellen mit einer hoch reproduzierbaren Temperaturerhöhung zu bestrahlen.
Um die Temperaturerhöhung und ihre Verteilung in einer Zellkulturschale für jede Leistungseinstellung zu kalibrieren, wurde die Temperatur während 10 s der Bestrahlung an verschiedenen Positionen und auf zellulärer Ebene gemessen. Die Temperaturverteilung wurde mit einer mathematischen Grafiksoftware dargestelltProgramm, und sein Muster über die Kulturschale war in Gaußsche Form. Nach der Laserbestrahlung konnten verschiedene biologische Experimente durchgeführt werden, um temperaturabhängige Zellreaktionen zu bestimmen. In diesem Manuskript wird die Viabilitätsfärbung ( dh die Unterscheidung von lebenden, apoptotischen und toten Zellen) eingeführt, um die Schwellentemperaturen für die Zellapoptose und den Tod nach verschiedenen Zeitpunkten zu bestimmen.
Die Vorteile dieser Methode sind die Präzision der Temperatur und die Zeit des Heizens sowie die hohe Effizienz bei Heizzellen in einer ganzen Zellkulturschale. Darüber hinaus ermöglicht es das Studium mit einer Vielzahl von Temperaturen und Zeitdauern, die durch ein computerisiertes Betriebssystem gut kontrolliert werden können.
Introduction
Das Verständnis der temperaturabhängigen zellbiologischen Reaktionen ist für erfolgreiche Hyperthermie-Behandlungen von großer Bedeutung. Retinale Laser-Photokoagulation mit einem thermischen Laser, in der Ophthalmologie verwendet, ist eine der etabliertesten Laser-Behandlungen in der Medizin. Sichtbares Licht, meist von grün bis gelb Wellenlängen, wird in der Netzhaut Laserbehandlung verwendet. Das Licht wird durch das Melanin in retinalen Pigment-Epithel- (RPE-) Zellen stark absorbiert, die die äußerste Zellmonoschicht der Retina bilden. Es gab jüngstes Interesse bei Ärzten und Forschern in einer sehr milden thermischen Bestrahlung (sub-sichtbare Photokoagulation) als neue therapeutische Strategie für verschiedene Arten von Netzhautstörungen 1 , 2 . Nach diesem Trend liegt unser Interesse an der sub-letalen Erwärmung von RPE-Zellen unter präziser Temperaturregelung, einer Technik namens temperaturgesteuerte photothermische Therapie (TC-PTT).
Neueste optoAkustiktechnologie aus unserem Institut hat die Echtzeitmessung von Temperaturerhöhungen an bestrahlten Stellen in der Netzhaut ermöglicht. Dies ermöglicht die Kontrolle über die Temperaturerhöhung während der Bestrahlung 3 . Da jedoch eine sub-letale Hyperthermie auf der Netzhaut, die durch das Erhitzen von RPE-Zellen sub-lethally verursacht wurde, bisher aufgrund der Unmöglichkeit der Messung und Kontrolle der Temperatur nicht berücksichtigt wurde, haben die temperaturabhängigen Zellreaktionen von RPE-Zellen nach der thermischen Laserbestrahlung Wurde bislang sehr wenig studiert. Darüber hinaus wurde nicht nur die Temperaturdifferenz nicht im Detail diskutiert, sondern auch der Unterschied im Zellverhalten der überlebenden Zellen nach sub-letaler und tödlicher Bestrahlung. Um wissenschaftliche Erkenntnisse über TC-PTT-basierte Behandlungen zu sammeln, wollen wir die temperaturabhängigen biologischen Reaktionen der RPE-Zelle und ihre Mechanismen unter Verwendung von in vitro- Versuchsaufbauten erläutern.
Für tSein Zweck ist es notwendig, einen Zelle-Heizungsaufbau herzustellen, der die folgenden Bedingungen erfüllt: 1) eine Möglichkeit für schnelle Temperaturerhöhungen, 2) eine präzise kontrollierte Zeit und Temperatur und 3) eine relativ hohe Anzahl von untersuchten Zellen für biologische Experimente . Hinsichtlich des Heizverfahrens ist ein klinischer Laser, wie ein frequenzverdoppelter Nd.YAG-Laser (532 nm), leider für die Zellkulturerwärmung ungeeignet. Dies liegt an der stark reduzierten Anzahl von Melanosomen in kultivierten RPE-Zellen. Die Laserlichtabsorption könnte inhomogen sein, und die Temperaturerhöhung auf zellulärer Ebene ist zwischen den Experimenten variabel, auch wenn sie mit derselben Strahlungsleistung bestrahlt wird. Mehrere frühere Studien berichteten über die Verwendung von schwarzem Papier unter dem Tellerboden während der Bestrahlung 4 oder die Verwendung von zusätzlichen Melanosomen, die vor den Experimenten 5 , 6 durch die Kulturzellen phagozytiert werden. Viele vonDie in vitro biologischen Studien zur Beurteilung von hyperthermieinduzierten Zellreaktionen wurden unter Verwendung einer Kochplatte, eines Wasserbades oder eines CO 2 -Inkubators mit einer Temperatureinstellung 7 durchgeführt . Diese Verfahren erfordern eine lange Heizperiode, da es einige Zeit dauert ( dh mehrere Minuten), um die gewünschte Temperatur zu erreichen. Weiterhin ist es mit diesen Verfahren schwierig, auf zellulärer Ebene eine detaillierte thermische Geschichte ( dh Temperatur multipliziert mit der Zeit) zu erhalten. Darüber hinaus kann sich die Temperatur unter den Zellen an verschiedenen Positionen in einer Kulturschale aufgrund der variablen Temperaturdiffusion unterscheiden. In den meisten Fällen wurde diese zeitliche und räumliche Temperaturinformation während der Hyperthermie bei biologischen Analysen nicht berücksichtigt, obwohl die biologische Zellreaktion durch die Temperatur und die Zeitdauer der erhöhten Temperatur kritisch beeinflusst werden kann.
Um diese Probleme zu überwinden,Dünnwellen-Thulium-Laser wurde hier verwendet, um die Zellen zu erhitzen. Die Thulium-Laserstrahlung (λ = 1,94 μm) wird stark von Wasser 8 absorbiert und die Zellen am Boden der Kulturschale werden ausschließlich durch thermische Diffusion thermisch stimuliert. Die Laserfaser mit einem Durchmesser von 365 μm ist etwa 12 cm über der Kulturschale, ohne jegliche Optik. Der Laserstrahldurchmesser divergiert so, dass er nahezu dem Innendurchmesser der Kulturschale (30 mm) an der Oberfläche des Kulturmediums entspricht. Mit einer konsistenten Menge an Kulturmedium ist es möglich, die Zellen mit der Temperaturerhöhung zu bestrahlen Von hoher Wiederholbarkeit. Variable Leistungseinstellungen ermöglichen die Bestrahlung mit bis zu 20 W und die mittlere Temperatur auf zellulärer Ebene kann bis zu ΔT ≈ 26 ° C in 10 s erhöht werden.
Durch Modifizieren der Bestrahlungsbedingungen ist es auch möglich, das Laserstrahlprofil zu ändern, um die Temperaturverteilung zu variierenIn einer Kulturschale. So ist es beispielsweise möglich, mit einer Gauß-artigen Temperaturverteilung wie in der aktuellen Studie oder mit einer homogenen Temperaturverteilung zu untersuchen. Letzteres kann für die Untersuchung der Effekte von temperaturabhängigen Zellreaktionen genauer für subtotale Temperaturerhöhungen, aber nicht für Zelltodstress oder Wundheilungsreaktionen vorteilhaft sein.
Insgesamt kann die Thulium-Laser-Bestrahlung die Untersuchung verschiedener Arten von biologischen Faktoren wie Gen / Protein-Expression, Zelltodkinetik, Zellproliferation und Zellfunktionalität nach verschiedenen thermischen Expositionen ermöglichen.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. RPE-Zellkultur
- Isolierung von RPE-Zellen aus Schweineaugen
- Erhalten Sie frisch entkernte Schweineaugen aus dem örtlichen Schlachthaus. Halten Sie sie kühl (4 ° C) und in einer dunklen Umgebung.
- Entfernen Sie extrazelluläre Gewebe mit einer Schere und tränken Sie die Augen in einer antiseptischen Lösung für 5 min.
- Legen Sie die Augen in sterilisiertem phosphatgepufferten Kochsalzlösung ohne Calcium und Magnesium (PBS (-)) bis zur Verwendung.
- Mit einem Skalpell, dringen Sie die Sklera bei etwa 5 mm hinter dem Hornhaut limbus. Resect den ganzen vorderen Teil des Auges durch Schneiden mit Schere den ganzen Weg durch, parallel zum Hornhaut limbus.
- Entfernen Sie den vorderen Teil des Auges ( dh die Hornhaut und das Objektiv) und den Glaskörper. Füge 1 ml PBS (-) hinzu und neide die neurale Retina vorsichtig ab.
HINWEIS: Diese "Augenschale", bestehend aus Sklera, Aderhaut und RPE, ist nun fertig. - Vorgewärmtes (37 ° C) 0,25% Trypsin in P hinzufügenBS (-) zur Augenschale. Stellen Sie das Volumen so ein, dass etwa 80% der Augenschale mit dieser Trypsinlösung gefüllt ist.
- Inkubieren Sie die Augenschale mit der Trypsinlösung in einem 5% CO 2 -Inkubator bei 37 ° C für 10 min.
- Entfernen Sie die Augenschale vom Inkubator und ersetzen Sie die 0,25% Trypsinlösung durch eine PBS (-) - Lösung mit 0,05% Trypsin + 0,2% Ethylendiamintetraessigsäure Tetranatriumsalz (EDTA · 4N). Inkubieren Sie die Augenschale im Inkubator für 45 min.
ANMERKUNG: Nach 45 min werden die RPE-Zellen entweder einfach lose an die Bruch-Membran gebunden oder bereits abgelöst und in der Trypsin-EDTA-Lösung schwimmen. - Sammle die RPE-Zellen durch sanftes Pipettieren. Sammeln Sie die Zellen und die Lösung in einem konischen Röhrchen, gefüllt mit 10 ml Kulturmedium (DMEM-Hochglukose mit L-Glutamin), einschließlich 10% Schweineserum, Antibiotikum / Antimykotikum und Natriumpyruvat (1 mM).
HINWEIS: Das Serum kann die Wirkung von Trypsin neutralisieren. - Zentrifuge dieZellsuspension bei 400 xg für 5 min bei Raumtemperatur.
- Den Überstand entfernen und 10 ml frisches Medium zugeben. Noch zweimal unter den gleichen Bedingungen zentrifugieren
- Entfernen Sie den Überstand und fügen Sie ein neues Medium hinzu, so dass die Zellkonzentration 5 x 10 & sup5; Zellen / ml ergibt (bestimmt durch Zählen der Zellen unter Verwendung eines Hämocytometers). Mischen Sie gut durch sanftes Pipettieren.
- Verteilen Sie die Zellsuspension in Zellkulturschalen. Verwenden Sie 3 ml pro 60 mm Durchmesser Kulturschale.
HINWEIS: Diese Kultur heißt Durchgangsnull (P0). - Halten Sie die Zellen in einem 5% CO 2 -Inkubator bei 37 ° C. Ändern Sie die Hälfte des konditionierten Mediums zu jedem zweiten Tag auf frisches Medium.
- Subkultur (Schritt 1.2), wenn es konfluent wird.
- Subkultur der RPE-Zellkultur
- Das Kulturmedium entfernen und die Zellen zweimal mit PBS (-) spülen.
- Inkubieren der Zellen mit PBS (-) - Lösung mit 0,05% Trypsin + 0,2% EDTA iNa 5% CO 2 -Inkubator bei 37 ° C für 5 min.
- Die RPE-Zellen werden durch sanftes Pipettieren abgetrennt und die Zellsuspension in einem konischen Röhrchen, gefüllt mit 10 ml Kulturmedium, einschließlich 10% Schweineserum, gesammelt.
- Die Zellsuspension bei 400 xg für 5 min bei Raumtemperatur zentrifugieren.
- Entfernen Sie den Überstand und fügen Sie ein neues Kulturmedium hinzu, wodurch die Zellkonzentration 5 x 10 5 Zellen / ml (bestimmt durch Zählen der Zellzahl mit einem Hämocytometer). Verteilen Sie die Zellen in neuen Kulturschalen von 60 mm Durchmesser, wie in Schritt 1.1.13 beschrieben.
HINWEIS: Die Zellkultur ist nun Passage 1 (P1). - Nachdem die Konfluenz erreicht ist, subkultur die P1-Kultur zu P2, unter Verwendung des gleichen Verfahrens, wie in den Schritten 1.2.1-1.2.5 beschrieben. Aus der P2-Kultur werden die Zellen auf kleineren Kulturschalen (30 mm Innendurchmesser) anstelle von 60 mm Durchmesser Kulturschalen gesät.
- Für die Experimente verwenden Sie P2- oder P3-Kulturen.
2. ThulIum Laser Bestrahlung
- Aufbau der Bestrahlungsstation
- Verbinden Sie eine Thulium-Laservorrichtung (1,94 μm, Leistungsbereich: 0-20 W) mit einer 0,22-NA, 365 μm Kerndurchmesser-Faser.
- Mechanische Befestigung der Faserspitze an dem Metallarm, der horizontal an der vertikalen Metallpfosten der Bestrahlungsstation befestigt ist. Setzen Sie den senkrechten Pfosten so ein, dass sich die Spitze der Laserfaser oberhalb der heißen Platte befindet, auf der die Zellkulturschale während der Bestrahlung platziert werden soll.
- Legen Sie ein weißes Papier auf die heiße Platte und drehen Sie den Zielstrahl auf (λ = 635 nm, max = 1 mW, Durchmesser auf Papierniveau ≈ 30 mm). Markieren Sie den Umfang des Zielstrahls auf dem weißen Papier, so dass die Position, wo die Kulturschale während der Bestrahlung platziert werden soll, bekannt ist.
HINWEIS: Die z-Ebene der Faserspitze kann veränderbar sein. Ohne jede zusätzliche Abbildungsoptik wurde der Laserfleckdurchmesser auf der Zellkulturebene, 12 cm unterhalb der Faserspitze, angeordnetS etwa 30 mm, was fast dem Innendurchmesser der Zellkulturschale entspricht. Eine schematische Darstellung des Aufbaus ist in Abbildung 1 dargestellt .

Abbildung 1: Schematische Darstellung der Thulium-Laser-Bestrahlungsstation. Eine Kulturschale wird auf die Heizplatte gelegt. Die Zellen werden 12 cm unterhalb der Thulium-Laserfaserspitze platziert, so dass die Strahlgröße nahezu identisch mit dem Innendurchmesser der Kulturschale (ca. 30 mm) ist. Der Laserbestrahlungsvorgang wird durch eine zeitgesteuerte Routine der maßgeschneiderten Systemdesignplattform gesteuert. Die Leistungseinstellung muss vor dem Start des Bestrahlungsprogramms ermittelt werden. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
- 1 h vor der Bestrahlung, ersetzen Sie das Kulturmedium vollständig mit 1,2 mL frischem Medium.
HINWEIS: Dies ist ein CRITICAL STEP und muss unbedingt eingehalten werden. - Legen Sie die Bestrahlungsstation ( dh die Heizplatte und den Pfosten, mit dem die Laserfaser fixiert werden soll) auf eine saubere Bank.
- Entfernen Sie die Zellkulturschale aus dem Inkubator und legen Sie sie auf die markierte Position auf der Heizplatte (Schritt 2.1.3).
- Schutzbrille tragen. Schalte den Thulium-Laser ein. Stellen Sie die Leistung wie gewünscht auf die Laservorrichtung ein (einstellbar von 0 - 20 W). Schalte die Emission ein.
- Starten Sie eine System-Design-Plattform, die die Laser-Bestrahlung und Timing-Protokoll (ergänzende Datei) steuert.
- Unmittelbar nach dem Auflegen der Kulturschale auf die Heizplatte klicken Sie auf die "Vorheizzeit", um den Timer für 140 s zu starten ("Vorheizzeit 1"); Dies wird die Kultur Mitteltemperatur bei 3 halten7 ° C vor der Bestrahlung
HINWEIS: Nach 140 s schaltet sich ein Signalton ein, und der nächste Timer ("Vorheizzeit 2") startet automatisch 8 s. Während dieser 8 s kann der Prüfer die Kulturschale öffnen. Nach 148 s Vorheizen wird eine 10-s-lange Laserbestrahlung auf die Zellkultur automatisch durchgeführt. Im Notfall rüsten Sie das Lasergerät mit einer Kraft-Taste aus, um den Laser sofort zu stoppen. Dies ist ein KRITISCHER SCHRITT und muss unbedingt eingehalten werden. Ein besonderer Vorsicht ist die Öffnung der Abdeckung der Schale kurz vor der Bestrahlung, zu Beginn der 8-s-Vorheizzeit. Das Öffnen der Abdeckung kann die mittlere Oberfläche sehr schnell abkühlen. - Nach der Bestrahlung sofort die Deckel wieder auf die Kulturschale legen, die Kulturschale auf die Heizplatte für weitere 7 s ablassen und in den 5% CO 2 -Inkubator bei 37 ° C zurücklegen.
- Machen Sie kleine Löcher (ca. 300 μm Durchmesser) in der Nähe des Bodens auf vier Seiten (alle 90 °) einer 30 mm Durchmesser Kulturschale (ohne Zellen); Benutzen Sie die Spitze einer Nadel (20G), die mit einem Bunsenbrenner erwärmt wird. Die Löcher mit dem elektrischen Isolationsband von außen abdichten und ein kleines Loch mit einer feinen Nadel herstellen, so dass nur ein feines Thermoelement (200 μm Durchmesser) durch dieses Loch unter wasserdichten Bedingungen eingeführt werden kann.
- An der Außenseite des Kulturschalenbodens 2 senkrechte Durchmesser zeichnen und den Kreuzungspunkt ( dh die Mitte der Unterseite) als Koordinaten Null (0) einstellen. Markieren Sie alle 3 mm radial nach außen aus der Schale ( dh 0, 3, 6, 9, 12 und 15 mm) in jede Richtung entlang der Linien ( Abbildung 2 , blaue Punkte); Die Anzahl der Punkte sollte insgesamt 21 sein.
- Füllen Sie die Zellkultur mit 1,2 ml neuem Kulturmedium. Lege die Kultur dAuf eine heiße Platte bei 37 ° C aufsetzen, ein feines Thermoelement (200 μm Durchmesser) in das Seitenloch einführen und die empfindliche Spitze auf eine markierte Position bringen, die gemessen werden soll.
- Schutzbrille tragen. Schalte den Thulium-Laser ein und schalte manuell die Leistung ein (zwischen 0 und 20 W, in 0,1-W-Schritten) des Lasers.
HINWEIS: Für die Temperaturkalibrierung sollten Messungen mit der Leistung in Schritten von 3 W ausreichen. - Schalten Sie die System-Design-Plattform ein und klicken Sie auf die Schaltfläche "Tempo erhöhen" (Zusatzdatei), um die Temperaturmessung zu starten.
- Gleiches Vorgehen wie in Schritt 2.2.6 durchführen.
HINWEIS: Das Steuerprogramm misst die Temperatur des eingesetzten Thermoelements alle 100 ms und zeigt den Temperaturverlauf während der Bestrahlung im GUI. - Führen Sie diese Verfahren für alle 21 Messpunkte und bei verschiedenen Leistungseinstellungen durch. Wiederholen Sie die ganze Prozedur dreimal für alle Punkte und für alle Macht einzahlenGs zuverlässige Daten zu erhalten.
- Exportieren Sie die Temperaturdaten als CSV-Daten, die eventuell in eine Tabellenkalkulation konvertiert werden können. Durchschnitt die maximale Temperatur am Ende der Bestrahlung für die dreifachen Messungen an jedem Punkt. Durchschnitt die Werte aus den Punkten auf dem gleichen Kreis (insgesamt 4 Punkte, außer dem Mittelpunkt).
- Zeichnen Sie die erhaltene durchschnittliche maximale Temperatur auf einem Graphen, so dass der Abstand von der Mitte der Schale (mm) als x-Achse und der Temperaturerhöhung (ΔT, ° C) als y-Achse. Verwenden Sie die Fit-Funktion eines mathematischen Software-Programms, um ein Gauß-Modell an die Rohdaten anzupassen. Erstellen Sie eine Gaußsche Anpassung der Temperaturverteilung.

Abbildung 2: Die Punkte für die Temperaturkalibrierung in einer Zellkultur Dish. Die Temperaturdaten wurden in der Mitte und bei 5 gemessenRadiale Punkte über 4 verschiedene Winkel (blaue Punkte). Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
3. Biologische Assessments für Zellreaktionen nach verschiedenen thermischen Bestrahlungen
- Beurteilung der Zelllebensfähigkeit ( dh leben, apoptotisch und tot) nach verschiedenen Leistungseinstellungen und der Bestimmung der Zelltodschwelle
- Zu den angegebenen Zeitpunkten ( dh 3, 24 und 48 h nach der Bestrahlung) werden die Zellen mit PBS (-) gewaschen und ein handelsübliches Kit zur Beurteilung der Zelllebensfähigkeit ( dh vital, apoptotisch, tot) nach dem Hersteller verwendet Protokoll.
- Eine Färbelösung durch Zugabe von 5 μl Fluoresceinisothiocyanat (FITC) -Lanxin V, 5 μl Ethidiumhomodimer III und 5 μl Hoechst 33342 auf 100 μl 1x Bindungspuffer (alle sind KitKomponenten). Bereiten Sie genug Färbe-Lösung vor, um die Zellen zu bedecken. Inkubieren Sie die Zellen für 15 min.
- Die Zellkultur zweimal mit dem Bindungspuffer waschen, den Bindungspuffer durch PBS (-) ersetzen und die Kultur auf die Stufe eines Fluoreszenzmikroskops stellen.
- Schalten Sie den Lichtweg auf die Okularlinse, wählen Sie den 4 ', 6-Diamidin-2-Phenylindol (DAPI) -Filter, schalten Sie das Beleuchtungslicht ein und finden Sie die fokussierte Ebene mit dem 4x-Objektiv.
- Ändern Sie den Lichtweg zur Kamera, finden Sie das Bild auf dem Computerbildschirm in der Mikroskop-Imaging-Software und stellen Sie den Fokus ein.
- Verwenden Sie die Stichfunktion ( dh die Funktion, um mehrere Bilder über die Schale aufzuzeichnen und dann ein einzelnes, großes Bild zu erzeugen) der mikroskopspezifischen Software, um das Fluoreszenzbild der gesamten Zellkulturschale zu erhalten. Verwenden Sie 3 verschiedene Filter-Sets - DAPI, FITC und Tetramethylrhodamin (TRITC) - zum Bild Hoechst 33342-positive Zellen (alle Zellkerne), FITC-Annexin V-PositiVe-Zellen (apoptotisch) und Ethidium-Homodimer-III-positiven Zellen (tot).
- Messen Sie den Radius (mm) der toten (Ethidium-Homodimer-III-positiven) Region und den äußeren / inneren Radius der apoptotischen (Annexin-V-positiven) Bandform-Region in den gefärbten Zellkulturen. Tragen Sie diese Radien auf die passende Gaußsche Funktion der Temperaturverteilung für die entsprechende Leistungseinstellung an. Berechnen Sie die genaue Temperatur am Rand des toten oder apoptotischen Bereichs, um die Schwellentemperaturen für den Zelltod und die apoptotische Veränderung zu klären.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Temperaturverteilung nach verschiedenen Leistungseinstellungen
Alle Temperaturentwicklungen für jede einzelne Bestrahlung wurden bei der Temperaturkalibrierung überwacht. Aus diesen Daten wurde die maximale Temperatur am gemessenen Punkt erhalten und als T max (° C) definiert. Wie in Fig. 3A gezeigt , wurde das Programm zu dem Zeitpunkt ausgeführt, an dem die Kulturschale auf die Heizplatte gelegt wurde. Nach der 140 s "Vorheizzeit 1", die benötigt wurde, um eine stabile Mediumtemperatur bei 37 ° C zu archivieren, wurde die Abdeckung der Kulturschale während der 8 s "Vorheizzeit 2" entfernt. Am Ende der "Vorheizzeit 2" begann die Laseremission automatisch. Diese Kurve ist ein repräsentativer Temperaturverlauf für eine 10-s-Bestrahlung. Während der Bestrahlung erhöhte sich die Temperatur und unmittelbar nach der LaseremissionAusgeschaltet, die Temperatur begann zu sinken. Die maximale Temperatur im Zentrum der Kulturschale wurde in dieser Studie als T max (° C) definiert. Der T max war proportional zur Laserleistung ( Bild 3B ). Abbildung 3C zeigt die Verteilung der maximalen Temperatur für jede Kraft über die Kulturschale. Die Verteilungen sind glockenförmig, wie in Fig. 3C gezeigt , und passen zu einer Gaußschen Funktion gemäß der folgenden Formel:
T (r) = t base + A · 
Wobei r, t base , A und w für den Abstand von der Mitte (mm), die niedrigste Temperatur für die Kurve, die Amplitude und die Breite der Kurve stehen. Die Parameter (t base , A und w) der passenden GAussische Kurve für jede Leistungseinstellung, nämlich für jedes T max , sind in der Tabelle neben dem Graphen dargestellt.
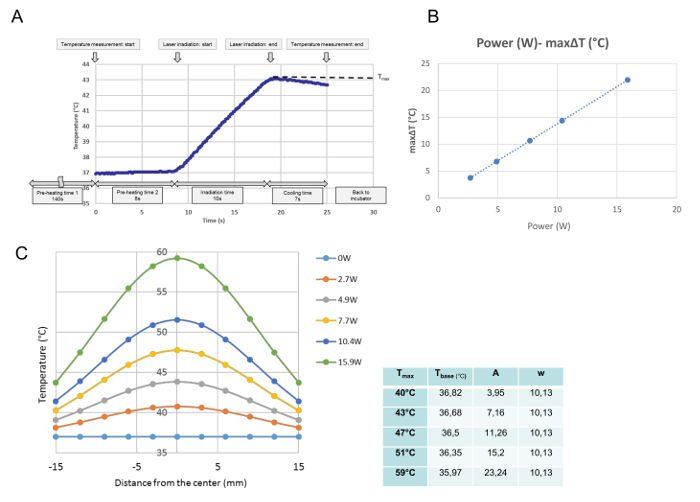
Abbildung 3: Temperaturkalibrierungsdaten. Eine repräsentative Temperaturentwicklung an der zentralen Position nach einer einzigen Bestrahlung bei 4,9 W (T max = 43 ° C) ( A ), die proportionale Beziehung zwischen der Laserleistung und dem Maximal ΔT an der zentralen Position einer Zellkultur ( B ), Und Temperaturverteilungen über die Kulturschale nach verschiedenen Leistungseinstellungen (C). (A) Das Programm wird ab dem Zeitpunkt durchgeführt, an dem die Kulturschale auf die Heizplatte gelegt wird. Nach 140 s der "Vorheizzeit 1", die benötigt wird, um eine stabile Mediumtemperatur bei 37 ° C zu archivieren, wird die Deckschicht der Kulturschale für die 8-s-Vorheizzeit entfernt2. "Am Ende der" Vorheizzeit 2 "startet die Laseremission automatisch. Diese Kurve ist eine repräsentative Temperaturprogression an der Mittelstellung während einer 10-s-Bestrahlung bei 4,9 W. Bei der Bestrahlung steigt die Temperatur und Unmittelbar nach dem Abschalten der Laseremission beginnt die Temperatur zu sinken, die maximale Temperatur wird am Ende der Bestrahlung erreicht, die in dieser Studie als T max (° C) definiert ist. (B) Die Laserleistung und die Maximalität Temperaturerhöhung (ΔT max ) sind proportional (C) Die eingebauten Gaußschen Funktionen der gemessenen Temperaturverteilungen über die Kulturschale Die Parameter für die Funktionen, die mit einem mathematischen Softwareprogramm bestimmt wurden, sind in der Tabelle an der Seite des Graphen dargestellt Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Zelllebensfähigkeit nach thermischer Bestrahlung
Wie in Abbildung 4A gezeigt , gibt es drei verschiedene Färbungsmuster, die die Zelllebensfähigkeit nach der Laserbestrahlung angeben: 1) kein Annexin V / Ethidium Homodimer III-positiv ( dh nur leben), 2) Annexin V-positiv in der Mitte ( dh fast Nur frühe Apoptose) und 3) Ethidium-Homodimer III-positiv im Zentrum ( dh tote Zellen), umgeben von apoptotischen Zellen an der Grenze zwischen toten und lebenden Zellen ( Abbildung 4B ). Die Größe des toten / apoptotischen Bereichs ist in der Regel abhängig von T max und der Nachbestrahlungszeit bis zu 48 h nach der Bestrahlung. In den mit T max ≤43 ° C bestrahlten Kulturen wurde keine offensichtliche Lebensfähigkeitsänderung festgestellt. Die einzige apoptotische Veränderung konnte zu einem frühen Zeitpunkt (3 Std.) Beobachtet werden, gefolgt von einem späten Zelltod nach einer Bestrahlung mit T max = 47 ° C. Sofortiger oder frühzeitiger Zelltod (bis zu 3 h) wurde in den mit T max ≥ 51 ° C bestrahlten Kulturen gefunden (Tabelle 1).

Abbildung 4: Muster der Lebensfähigkeitsfärbung nach verschiedenen Leistungseinstellungen (A) und ein Beispielbild am Rand des toten und apoptotischen Bereichs nach tödlichen Laserbestrahlungen (B).
(A) Je nach Temperatur können drei Muster der Färbung auftreten. (B) Die apoptotische Zone (FITC-Annexin V-positiv: grün) um den toten Bereich (Ethidium-Homodimer III-positiv: rot). Alle Zellen sind positiv für Hoechst 33342 (blau), und die Zellen mit blauen Kernen sind die lebenden Zellen. Das Bild wurde 24 h nach einer Bestrahlung bei T max = 59 ° C aufgenommen. Bar = 100 μm/files/ftp_upload/54326/54326fig4large.jpg "target =" _ blank "> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Tabelle 1: Annexin V und Ethidium Homodimer III Reaktionen an verschiedenen Temperaturen und Zeiten.
Bestimmung der Schwellentemperatur für den Zelltod
Die durchschnittlichen Radien des toten Bereichs (rot) und des apoptotischen Bereichs (grün) wurden gemessen und auf die Gaußsche Funktion der Temperaturverteilung angewendet, um die Schwellenspitzentemperaturen für Zelltod und Apoptose nach 10 s Bestrahlung zu bestimmen. Nach dieser Analyse betrugen die mittleren Schwellentemperaturen für den vollständigen Zelltod 3 h, 24 h und 48 h nach der Bestrahlung 54,0 ° C, 50,9 ° C bzw. 50,1 ° C. Der mittlere SchwellenwertLd-Temperatur für die zell-apoptotische Veränderung um etwa 2 - 3 ° C niedriger waren, wobei die Schwellentemperaturen für 3 h, 24 h und 48 h bei 51,7 ° C, 48,0 ° C bzw. 47,0 ° C betrugen ( Abbildung 5 ).
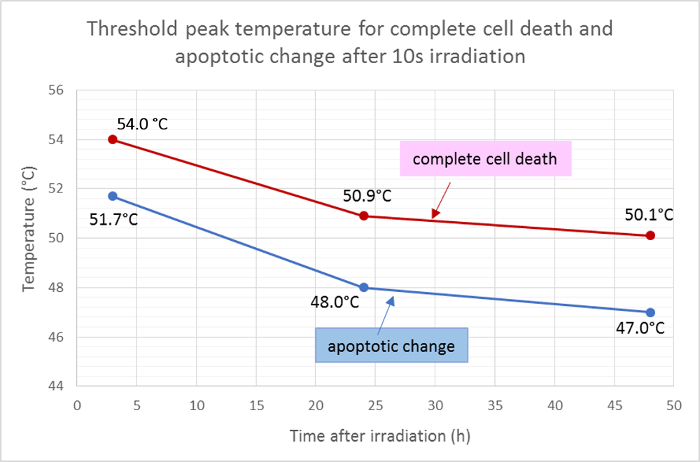
Abbildung 5: Schwellentemperaturen für Apoptose und Zelltod.
Mittlere Schwellentemperaturen für den vollständigen Zelltod (positiv für Hoechst 33342, Annexin V und Ethidiumhomodimer III) und für die Apoptose (positiv nur für Hoechst 33342 und Annexin V) zu verschiedenen Zeitpunkten nach der Bestrahlung, berechnet aus den Ergebnissen der Fluoreszenzfähigkeitsfärbung . Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Bei der Erörterung von temperaturbedingten biologischen Zellreaktionen ist nicht nur die Temperatur, sondern auch die Zeitdauer der erhöhten Temperatur von Bedeutung, da die meisten biochemischen Prozesse zeitabhängig sind. Besonders auf dem Gebiet der laserinduzierten Hyperthermie in der Ophthalmologie ist es aufgrund des kurzen Zeitbereichs - von Millisekunden bis zu Sekunden - schwierig, zelluläre thermische Effekte mit präziser Temperaturkontrolle zu untersuchen. Daher ist ein Laserbestrahlungsaufbau, der für das Zellkulturmodell geeignet ist, und mit einem Betriebssystem, das eine strenge Temperatur- und Zeitsteuerung ermöglicht, erwünscht. Die biologische Beurteilung von Zellreaktionen nach thermischer Exposition, wie Protein-Expression oder Sekretion, erfordert wiederholte quantitative Auswertungen an einer ausreichenden Anzahl von betroffenen Zellen. Dies war ein Hindernis für Studien mit Laser-Spots mehrere hundert Mikrometer im Durchmesser, wie in klinischen Behandlungen. Die quantitative Analyse an einem einzigen Laserpunkt ist ziemlich buHöflich In dieser Studie wurden Versuche unternommen, diese Forderungen so weit wie möglich zu erfüllen. Durch die Verwendung eines 1,94 μm-Wellenlängen-Durchlaufwellen-Thuliumlasers mit einem Bestrahlungssteuerungsprogramm konnte innerhalb einer kurzen Zeitspanne ein zeitlicher Temperaturanstieg in einer ganzen Zellkultur durchgeführt werden. Da die Temperaturverteilung durch Veränderung des Lichtweges eingestellt werden kann, können mit dieser Einrichtung verschiedene Arten von hyperthermiebezogenen Experimenten durchgeführt werden.
Die Begrenzung der dargestellten Technik ist die Unmöglichkeit, simultane Temperaturmessungen während der Laserbestrahlung der Zellen durchzuführen. Da die Verwendung von Thermoelementen nicht für sterilisierte Zellkulturen geeignet ist, muss die Temperaturkalibrierung getrennt von der Zellbestrahlung durchgeführt werden. Unter Berücksichtigung der möglichen Variationen in der Laserleistungsausgabe wäre die Echtzeit-Temperaturmessung während jeder Laserbestrahlung ideal, um zelluläre Reaktionen entsprechend derThermische Dosis. Darüber hinaus wurde die hier verwendete Temperaturverteilung durch Dateninterpolation auf Basis der Messungen an 21 Punkten auf einer Kulturschale und bei mehreren verschiedenen Leistungseinstellungen erstellt. Um diese Einschränkungen und kritischen Punkte zu überwinden, ist es unser Ziel, eine alternative Methode zu entwickeln, die die Messung der Temperatur der Kulturschale ermöglicht, während die Laserbestrahlung durchgeführt wird. Wir zielen auch darauf ab, die räumliche Temperaturinformation sofort zu erhalten. Infrarot-Bildgebung (Thermographie) ist eine mögliche Methode zur Messung der Temperatur während der Laserbestrahlung 10 . Der große Vorteil dieser Methode ist die Echtzeit-Temperaturmessung auf zellulärer Ebene für jede Bestrahlung; Nachfolgende zellbiologische Reaktionen können bei der Bestrahlung immer individuell mit der Temperaturhistorie verglichen werden. Unter Berücksichtigung von Kostenwirksamkeit und Verwendbarkeit ist jedoch die Verwendung von Thermografie für Zelleingangsexperimente für jedes Labor nicht möglichOry
Bei dem Verfahren, bei dem ein Thuliumlaser bei einer Wellenlänge von 1,94 μm verwendet wird, wird das Wasser in der Zellkulturschale an seiner Oberfläche erwärmt und thermische Diffusion und Konvektion werden zur Erwärmung der Zellen verwendet. Die Höhe des Kulturmediums in diesem Bestrahlungsaufbau mit 1,2 mL Kulturmedium beträgt 935 μm an der zentralen Stelle (von einer früheren Messung mit optischer Kohärenztomographie). Der Absorptionsgrad des Thuliumlasers in Wasser ist sehr hoch (Absorptionskoeffizient: 127 cm -1 bei 35 ° C) und 72% des Lichts werden in den ersten 100 μm des Kulturmediums absorbiert. Es gibt fast keine Absorption (0,0007%) in einer Tiefe von 935 μm.
Es ist wichtig zu beachten, dass einer der kritischen Punkte im Protokoll ist, die gleiche Menge an Medium (1.200 μL) für jede Bestrahlung hinzuzufügen. Die Verwendung unterschiedlicher Mengen an Kulturmedium kann zu Höhenunterschieden führen, die zu Unterschieden in der Temperatur führen könnenNcrease der Zellen. Der zweite kritische Punkt bezieht sich auf den Zeitpunkt der Eröffnung der Kulturschale. Es muss gleichzeitig getan werden - in dieser Studie, 8 s vor dem Beginn der Bestrahlung, wenn das System einen Ton macht. Unterschiede in dieser Zeit können die Grundtemperatur aufgrund der durch die Umgebungsluft verursachten Kühlung (etwa 23 ° C) variieren. Dies kann zu signifikanten Unterschieden in der laserinduzierten Temperatur führen.
Für die Temperaturkalibrierung wurde die gleiche Menge an Medium (1,2 ml) verwendet, die in den Experimenten verwendet wurde, um die Temperaturverteilung am Boden von zellfreien Kulturschalen zu messen. Jedoch kann die mittlere Höhe mit einer Zellmonoschicht anders sein als diejenige ohne Zellen, sogar mit dem gleichen Mediumvolumen. Die Messung mit der optischen Kohärenztomographie ergab, dass es eine 58-μm-Differenz an der zentralen Position zwischen Gerichten mit und ohne konfluierende Zellmonoschicht (877 μm ohne Zellen, verglichen tO 935 μm mit Zellen). Dieser Unterschied ist potentiell auf die Kapillarwirkung der Zellen zurückzuführen. Der 58-μm-Höhenunterschied an der Mittelstellung kann durch ca. 40 μl Medium (Messdaten) verursacht werden. Es wurde auch bestätigt, dass dieser Höhenunterschied bei allen Leistungseinstellungen keine signifikanten Unterschiede in T max zur Folge hatte. Daher haben wir festgestellt, dass dieser Unterschied die Ergebnisse der in dieser Studie durchgeführten Analysen nicht wesentlich beeinflusst. Trotzdem sollte, um eine genauere Temperaturinformation zu sammeln, wie oben beschrieben, ein Verfahren zur Kalibrierung der Temperatur unter Verwendung einer Zellkulturschale, die eine Zellmonoschicht enthält, entwickelt werden. Darüber hinaus ist auch die mathematische Modellierung der thermischen Diffusion und Konvektion im gesamten Kulturmedium erforderlich.
In dieser Studie wurden die Zellen mit einer Gaußschen Temperaturverteilung erwärmt. Es gibt mehrere mögliche Methoden, um das gesamte Medium im Laufe der Zeit gleichmäßiger zu heizen. Eins Ist es, eine Laserquelle mit einem niedrigeren Absorptionskoeffizienten in Wasser zu verwenden. Allerdings ist der Nachteil, dass in diesem Fall die Laser eine höhere Leistung haben müssen, da nur ein kleiner Prozentsatz des Lichts über etwa 0,9 mm absorbiert wird. Eine andere Möglichkeit besteht darin, die distale Faserspitze einer Multimode-Lichtleitfaser abzubilden, die das Laserlicht in die Ebene der Kulturschale überträgt; Die Vergrößerung kann beliebig durch die Optik gewählt werden.
Der zweite Höhepunkt dieses Protokolls ist seine Fähigkeit, die Schwellentemperatur für den Zelltod und die Apoptose unter Verwendung des Fluoreszenzbildes der Lebensfähigkeitsfärbung und der lateralen Temperaturverteilung zu bestimmen. Ein langfristiges Ziel ist es nicht nur, die Lebensfähigkeit der Zelle zu bestimmen, sondern auch den Temperaturbereich für zellbiologische Reaktionen in Bezug auf die Zellfunktionalität, wie die Proteinexpression und die Zellproliferation, zu ermitteln. Die Bestimmung der Zelltod-Schwellentemperatur ist für Forscher von großem Interesse"> 10. Mit dieser Methode können die kritischen Faktoren für den Zelltod, einschließlich der Apoptose, bestimmt werden. Kritische Faktoren für den thermisch laserinduzierten Zelltod konnten nicht nur durch die Temperaturgeschichte, sondern auch durch die endogenen Faktoren bestimmt werden ( Dh intra / extrazelluläre Faktoren auf molekularer Ebene) Die Beantwortung dieser Fragen könnte den Weg für das Verständnis von Zelltodmechanismen und Kinetik nach verschiedenen thermischen Expositionen und in verschiedenen retinalen Pathologien ebnen und kann auch dazu beitragen, klinisch beobachtete Probleme zu klären, Wie der interindividuelle Unterschied in Reaktion auf die Laserbehandlung oder die Variabilität der Narbengröße nach der Netzhaut-Photokoagulation, auch wenn die Anfangsfleckgröße nahezu identisch war ("atrophisches Kriechen") 11 .
Das Ziel dieser Studie ist es, bei der Entwicklung einer temperaturgesteuerten photothermischen Therapie der Netzhaut zu helfen. Um dies zu erreichen, wiTh der technische Fortschritt der Temperaturmessung 3 , weitere Aufklärung des RPE-Zellverhaltens nach thermischer Belastung, bestimmt nach dieser Methode, wird von großem Nutzen sein.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Die Autoren haben nichts zu offenbaren.
Acknowledgments
Diese Arbeit wurde von einem Forschungsstipendium des Bundesministeriums für Bildung und Forschung (BMBF) (Zuschuss Nr. 13GW0043C) und einem Europäischen Amt für Luft- und Raumfahrtforschung und -entwicklung (EOARD, Grant # FA9550-15-1-0443) unterstützt.
Materials
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Dulbecco’s Modified Eagle’s Medium - high glucose | Sigma-Aldrich | D5796-500ML | Add (2)-(4) before use. Warm in 37 °C water bath before use. |
| Antibiotic Antimycotic Solution (100 ×) | Sigma-Aldrich | A5955-100ML | Containing 10,000 units penicillin, 10 mg streptomycin and 25 μg Amphotericin B in 1mL. Add 5.5 mL in 500 mL medium bottle (1) before use. |
| Sodium pyruvate (100 mM) | Sigma-Aldrich | S8636-100ML | Add 5.5 mL in 500 mL medium bottle (1) before use (final concentration: 1 mM) |
| Porcine serum | Sigma-Aldrich | 12736C-500ML | Add 50 mL in 500 mL medium bottole (1) before use (final: 10%) |
| Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537-500ML | |
| Trypsin from porcine pancreas | Sigma-Aldrich | T4799-25G | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | ED-100G | |
| Human VEGF Quantikine ELISA Kit | R&D System | DVE00 | |
| Oxiselect Total Glutathione Assay Kit | Cell Biolabs, Inc | STA-312 | |
| Apoptotic/Necrotic/Healthy Cells Detection Kit | PromoKine | PK-CA707-30018 | |
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Thulium laser | Starmedtec GmbH | Prototype | 0-20 W |
| 365 mm core diameter fiber | LASER COMPONENTS Germany | CF01493-52 | |
| Thermocouple | Omega Engineering Inc | HYP-0- 33-1-T-G-60-SMPW-M | |
| Heating plate | MEDAX | ||
| Microplate reader (spectrofluorometer) | Molecular Device | Spectramax M4 | |
| cell homogenizer | QIAGEN | TissueLyser LT | |
| Fluorescence microscope | Nikon | ECLIPSE Ti | |
| mathematical software program | The Mathworks. Inc | MATLAB Release 2015b | |
| system-design platform | National Instrument | Labview | Laboratory Virtual Instrument Engineering Workbench |
References
- Inagaki, K., et al. Comparative efficacy of pure yellow (577-nm) and 810-nm subthreshold micropulse laser photocoagulation combined with yellow (561-577-nm) direct photocoagulation for diabetic macular edema. Jpn J Ophthalmol. 59 (1), 21-28 (2015).
- Roider, J., et al. Selective retina therapy (SRT) for clinically significant diabetic macular edema. Graefes Arch Clin Exp Ophthalmol. 248 (9), 1263-1272 (2010).
- Brinkmann, R., et al. Real-time temperature determination during retinal photocoagulation on patients. J Biomed Opt. 17 (6), 061219 (2012).
- Yoshimura, N., et al. Photocoagulated human retinal pigment epithelial cells produce an inhibitor of vascular endothelial cell proliferation. Invest Ophthalmol Vis Sci. 36 (8), 1686-1691 (1995).
- Denton, M. L., et al. Damage Thresholds for Exposure to NIR and Blue Lasers in an In Vitro RPE Cell System. Invest Ophthalmol Vis Sci. 47 (7), 3065-3073 (2006).
- Shrestha, R., Choi, T. Y., Chang, W., Kim, D. A high-precision micropipette sensor for cellular-level real-time thermal characterization. Sensors (Basel). 11 (9), 8826-8835 (2011).
- Gao, F., Ye, Y., Zhang, Y., Yang, J. Water bath hyperthermia reduces stemness of colon cancer cells. Clin Biochem. 46 (16-17), 1747-1750 (2013).
- Jansen, E. D., van Leeuwen, T. G., Motamedi, M., Borst, C., Welch, A. J. Temperature dependence of the absorption coefficient of water for midinfrared laser radiation. Lasers Surg Med. 14 (3), 258-268 (1994).
- Iwami, H., Pruessner, J., Shiraki, K., Brinkmann, R., Miura, Y. Protective effect of a laser-induced sub-lethal temperature rise on RPE cells from oxidative stress. Exp Eye Res. 124, 37-47 (2014).
- Denton, M. L., et al. Spatially correlated microthermography maps threshold temperature in laser-induced damage. J Biomed Optics. 16 (3), (2011).
- Morgan, C. M., Schatz, H. Atrophic creep of the retinal pigment epithelium after focal macular photocoagulation. Ophthalmology. 96 (1), 96-103 (1989).



