Summary
1.94 सुक्ष्ममापी निरंतर तरंग लेजर विकिरण का उपयोग करते हुए एक संस्कृति पकवान में गरम कोशिकाओं के लिए एक मूल प्रायोगिक सेटअप पेश किया गया है। इस पद्धति का प्रयोग करते हुए, विभिन्न थर्मल एक्सपोजर के बाद रेटिना वर्णक उपकला (आरपीई) कोशिकाओं के जैविक प्रतिक्रियाओं की जांच की जा सकती है।
Abstract
जैविक मूल्यांकन के लिए 1.94 सुक्ष्ममापी निरंतर तरंग थ्यूलियम लेजर का उपयोग करके सुसंस्कृत कोशिकाओं को गर्मी के लिए एक मूल विधि यहां प्रस्तुत की गई है। थुलीयम लेजर विकिरण को पानी से जोरदार रूप से अवशोषित किया जाता है, और संस्कृति डिश के निचले भाग में कोशिकाओं को थर्मल प्रसार के माध्यम से गरम किया जाता है 365 सुक्ष्ममापी व्यास के साथ एक लेजर फाइबर संस्कृति डिश के ऊपर से 12 सेमी ऊपर किसी भी प्रकाशिकी के बिना सेट किया जाता है, जैसे कि लेजर बीम व्यास संस्कृति डिश (30 मिमी) के भीतरी व्यास के बराबर है। प्रत्येक प्रयोग में सांस्कृतिक माध्यम की लगातार मात्रा रखते हुए, कोशिकाओं को अत्यधिक प्रतिलिपि प्रस्तुत करने योग्य तापमान वृद्धि के साथ विकिरण करना संभव है।
प्रत्येक शक्ति सेटिंग के लिए एक सेल कल्चर डिश में तापमान में वृद्धि और इसके वितरण को जांचने के लिए, तापमान 10 डिग्री के विकिरण के दौरान विभिन्न स्थानों पर और सेलुलर स्तर पर मापा गया। एक गणितीय ग्राफिक्स सॉफ्टवेयर का उपयोग करके तापमान वितरण का प्रतिनिधित्व किया गया थाकार्यक्रम, और संस्कृति डिश भर में इसका पैटर्न गाऊसी रूप में था। लेजर विकिरण के बाद, तापमान पर निर्भर सेल प्रतिक्रियाओं का आकलन करने के लिए विभिन्न जैविक प्रयोग किए जा सकते हैं। इस पांडुलिपि में, समय के विभिन्न बिंदुओं के बाद सेल एपोपोसिस और मौत के लिए थ्रेसहोल्ड तापमान निर्धारित करने में मदद करने के लिए व्यवहार्यता धुंधला हो जाना ( यानी, जीवित, अपोपचारिक और मृत कोशिकाओं को भेद करना) पेश किया गया है।
इस पद्धति के फायदे तापमान और हीटिंग के समय की सटीकता, साथ ही एक पूरे सेल कल्चर डिश में ताप कोशिकाओं में इसकी उच्च क्षमता है। इसके अलावा, यह तापमान और समय के विभिन्न प्रकारों के अध्ययन के लिए अनुमति देता है, जो कम्प्यूटरीकृत ऑपरेटिंग सिस्टम द्वारा नियंत्रित किया जा सकता है।
Introduction
तापमान-आश्रित कोशिका को समझना जैविक प्रतिक्रिया सफल हाइपरथर्मिया उपचारों के लिए बहुत महत्वपूर्ण है। ऑप्थाल्मोलॉजी में प्रयुक्त थर्मल लेजर के साथ रेटिना लेजर फोटोकॉएग्यूलेशन, दवा में सबसे अधिक स्थापित लेजर उपचारों में से एक है। दर्शनीय प्रकाश, ज्यादातर हरे रंग से पीले तरंग दैर्ध्य के लिए, रेटिना लेजर उपचार में प्रयोग किया जाता है। रेटिना वर्णक उपकला (आरपीई) कोशिकाओं में मेलेनिन द्वारा प्रकाश को अत्यधिक अवशोषित किया जाता है, जो रेटिना के सबसे बाहरी सेल मोनोलायर होते हैं। बहुत हल्के विकिरण (उप दृश्यमान फोटोकॉएग्यूलेशन) में चिकित्सकों और शोधकर्ताओं के बीच हाल ही में दिलचस्पी हुई है कि रेटिना संबंधी विकार 1 , 2 के विभिन्न प्रकारों के लिए एक नई चिकित्सीय रणनीति के रूप में। इस प्रवृत्ति के बाद, हमारे हित, सटीक तापमान नियंत्रण के तहत उप-घातक हीटिंग आरपीईई कोशिकाओं में है, जिसे तापमान-नियंत्रित फोटोथर्मल थेरेपी (टीसी-पीटीटी) कहते हैं।
हाल के ऑप्टोहमारे संस्थान के ध्वनिक प्रौद्योगिकी ने रेटिना में विकिरणित साइटों पर तापमान बढ़ने की वास्तविक-समय माप के लिए अनुमति दी है। यह विकिरण 3 के दौरान तापमान में वृद्धि पर नियंत्रण को सक्षम बनाता है हालांकि, आरटीई कोशिकाओं को उप-घातक रूप से हीटिंग के कारण रेटिना पर उप-घातक हाइपरथेरिया, तापमान को मापने और नियंत्रित करने की असंभवता से पहले नहीं माना गया है, थर्मल लेजर विकिरण के बाद आरपीई कोशिकाओं के तापमान पर निर्भर सेल प्रतिक्रियाएं तिथि करने के लिए बहुत कम अध्ययन किया गया है। इसके अलावा, न केवल तापमान के अंतर पर विस्तार से चर्चा की गई है, बल्कि उप-घातक और घातक विकिरण के बाद जीवित कोशिकाओं के सेल व्यवहार में अंतर भी शामिल नहीं है। इसलिए, टीसी-पीटीटी-आधारित उपचार पर वैज्ञानिक प्रमाणों को इकट्ठा करने के लिए, हम इन-विट्रो प्रयोगात्मक सेटअप में तापमान-निर्भर आरपीई सेल जैविक प्रतिक्रियाओं और उनके तंत्र को स्पष्ट करने के उद्देश्य हैं।
टी के लिएउनका उद्देश्य, सेल-हीटिंग सेटअप स्थापित करने के लिए आवश्यक है जो निम्नलिखित शर्तों को पूरा करता है: 1) तेजी से तापमान बढ़ने की संभावना, 2) ठीक से नियंत्रित समय और तापमान, और 3) जैविक प्रयोगों के लिए जांच की गई कोशिकाओं की एक अपेक्षाकृत उच्च संख्या । हीटिंग विधि के बारे में, एक नैदानिक लेजर, जैसे कि आवृत्ति-दोगुनी एनडी। वाईएजी लेजर (532 एनएम), दुर्भाग्य से सेल संस्कृति हीटिंग के लिए अनुपयुक्त है। यह सुसंस्कृत RPE कोशिकाओं में मेलेनोसॉम्स की दृढ़ता से कम संख्या के कारण है। लेजर प्रकाश अवशोषण अछाल हो सकता है, और सेलुलर स्तर पर तापमान में वृद्धि प्रयोगों के बीच चरखी होती है, भले ही एक ही विकिरण शक्ति से विकिरण हो। पिछले कई अध्ययनों में विकिरण 4 के दौरान डिश के नीचे काली कागज के प्रयोग की सूचना दी गई है या प्रयोगात्मक 5 , 6 से पहले संस्कृति कोशिकाओं द्वारा फागोगिटाइज किए गए अतिरिक्त मेलेनोसॉम्स के उपयोग के बारे में बताया है। के कईहाइपरथेरिया से प्रेरित सेल प्रतिक्रियाओं का आकलन करने के लिए इन विट्रो जैविक अध्ययनों को एक गर्म प्लेट, एक पानी के स्नान या तापमान सेटिंग 7 के साथ सीओ 2 इनक्यूबेटर का उपयोग कर किया गया है। इन विधियों को एक लंबी हीटिंग अवधि की आवश्यकता होती है क्योंकि वांछित तापमान तक पहुंचने के लिए कुछ समय ( यानी, कुछ मिनट) लगते हैं। इसके अलावा, इन विधियों का उपयोग करते हुए, सेलुलर स्तर पर एक विस्तृत थर्मल इतिहास ( यानी, समय से तापमान गुणा) प्राप्त करना मुश्किल है। इसके अलावा, एक संस्कृति डिश में विभिन्न स्थानों पर कोशिकाओं के बीच का तापमान चर तापमान प्रसार के कारण भिन्न हो सकता है। अधिकांश मामलों में, जैविक विश्लेषण के लिए जैविक सेल प्रतिक्रिया को गंभीर रूप से प्रभावित किया जा सकता है, जबकि तापमान और तापमान बढ़ने की अवधि के दौरान, hyperthermia के दौरान इस अस्थायी और स्थानिक तापमान जानकारी जैविक विश्लेषण के लिए विचार नहीं किया गया है।
इन समस्याओं को दूर करने के लिए, एक contiनुकीली लहर थ्यूलियम लेजर कोशिकाओं को गर्म करने के लिए यहां इस्तेमाल किया गया था। थ्यूलियम लेजर विकिरण (λ = 1.94 सुक्ष्ममापी) को दृढ़ता से 8 पानी से अवशोषित किया जाता है, और संस्कृति डिश के निचले भाग में कोशिकाओं को थर्मल प्रसार के माध्यम से पूरी तरह प्रेरित किया जाता है। 365-माइक्रिया व्यास वाले लेजर फाइबर को संस्कृति डिश के ऊपर से 12 सेमी ऊपर सेट किया जाता है, बिना किसी प्रकाशिकी के। लेजर बीम का व्यास इस तरह बदल जाता है कि संस्कृति संस्कृति की सतह पर लगभग 30 मिलीमीटर संस्कृति डिश के समान है। संस्कृति के माध्यम के अनुरूप मात्रा के साथ, तापमान वृद्धि के साथ कोशिकाओं को विकिरण करना संभव है उच्च पुनरावृत्ति की वैरिएबल पावर सेटिंग्स 20 डब्ल्यू के साथ विकिरण को सक्षम करती हैं, और सेलुलर स्तर पर मध्यम तापमान 10 एस में ΔT ≈ 26 डिग्री सेल्सियस तक बढ़ाया जा सकता है
विकिरण की स्थिति को संशोधित करके, तापमान के वितरण में बदलाव के लिए लेजर बीम प्रोफाइल को बदलना भी संभव हैएक संस्कृति डिश में उदाहरण के लिए, गौसी जैसे तापमान वितरण की जांच करना संभव है, जैसा कि वर्तमान अध्ययन में है, या एक समरूप तापमान वितरण के साथ। उत्तरार्द्ध तापमान पर निर्भर सेल प्रतिक्रियाओं के अधिक विशेष रूप से उप घातक तापमान बढ़ने के प्रभावों की जांच के लिए फायदेमंद हो सकता है, लेकिन सेल मृत्यु तनाव या घाव भरने वाले प्रतिक्रियाओं के लिए नहीं।
कुल मिलाकर, थ्यूलियम लेजर विकिरण विभिन्न थर्मल एक्सपोजर के बाद विभिन्न प्रकार के जैविक कारकों की जांच, जैसे कि जीन / प्रोटीन अभिव्यक्ति, कोशिका मृत्यु कैनेटीक्स, सेल प्रसार, और सेल कार्यक्षमता विकास की जांच कर सकते हैं।
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. आरपीई सेल संस्कृति
- पोर्क आंखों से आरपीई कोशिकाओं का अलगाव
- स्थानीय कत्तलखाने से ताजा न्यूक्लाइज्ड पोर्क आंखें प्राप्त करें उन्हें शांत रखें (4 डिग्री सेल्सियस) और एक अंधेरे वातावरण में।
- कैंची के साथ बाह्य ऊतकों को निकालें और 5 मिनट के लिए एंटीसेप्टिक समाधान में आँखों को सोखें।
- उपयोग किए जाने तक कैल्शियम और मैग्नीशियम (पीबीएस (-)) के बिना निष्फल फॉस्फेट-बफ़ेड खारा में आँखें रखें।
- स्केलपेल का उपयोग करना, श्वेतपटल को कोर्नियल लम्बास के पीछे के बारे में 5 मिमी पर घुसना कैंची से हर तरह से काटने के द्वारा कान के पूरे पूर्वकाल भाग को कास्ट करें, कॉर्नियल लम्बस के समानांतर।
- आंख के पूर्वकाल भाग को निकालें ( यानी, कॉर्निया और लेंस) और कांच का पीबीएस (-) के 1 एमएल जोड़ें और धीरे से तंत्रिका रेटिना हटा दें।
नोट: यह "नेत्र कप", जिसमें श्वेतक्रोन, कोरोज़ और आरपीई शामिल है, अब तैयार है। - पी में प्री-वार्मिंग (37 डिग्री सेल्सियस) 0.25% ट्रिप्सिन जोड़ेंबीएस (-) आंखों के कप में मात्रा को समायोजित करें जैसे आंखों का लगभग 80% कप इस ट्रिप्सिन समाधान से भर जाता है।
- 10 मिनट के लिए 37 डिग्री सेल्सियस पर 5% सीओ 2 इनक्यूबेटर में ट्रिप्सिन समाधान के साथ आंखों का प्याला सेते हैं।
- इनक्यूबेटर से आंखों का प्याला निकालें और 0.25% ट्रिप्सिन समाधान को पीबीएस (-) समाधान के साथ 0.05% ट्रिप्टिसिन + 0.2% एथिलेनेडाइमेटेट्रैटेसेटिक एसिड टेट्रोसोडियम नमक (ईडीटीए · 4 एन) के साथ बदलें। 45 मिनट के लिए इनक्यूबेटर में आंखों का प्याला सेते हैं
नोट: 45 मिनट के बाद, आरपीई कोशिकाओं को या तो ब्रुच की झिल्ली से ढीले जुड़ा होगा या ट्रिप्सिन-ईडीटीए समाधान में पहले से ही अलग और फ्लोटिंग होगा। - कोमल pipetting द्वारा RPE कोशिकाओं को ले लीजिए। 10% पोर्किन सीरम, एंटीबायोटिक / एंटीम्योटिक, और सोडियम प्यूरवेट (1 एमएम) सहित 10 मिलीलीटर संस्कृति माध्यम (एल-ग्लूटामाइन युक्त डीएमईएम उच्च ग्लूकोज) से युक्त एक शंक्वाकार ट्यूब में कोशिकाओं और समाधान को लीजिए।
नोट: सीरम ट्रिप्सिन के प्रभाव को बेअसर कर सकता है। - अपकेंद्रित्रकमरे के तापमान पर 5 मिनट के लिए 400 xg पर सेल निलंबन
- सतह पर तैरनेवाला निकालें और ताजा माध्यम के 10 एमएल जोड़ें। 5 मिनट के लिए एक ही परिस्थितियों में फिर से अपकेंद्रित्र
- सतह पर तैरनेवाला निकालें और नया माध्यम जोड़ें, जैसे सेल एकाग्रता का परिणाम 5 x 10 5 कोशिकाओं / एमएल (एक हेमोसाइटोमीटर का उपयोग कर कोशिकाओं की गणना के द्वारा निर्धारित) में होता है। कोमल pipetting द्वारा अच्छी तरह मिक्स।
- सेल संस्कृति व्यंजन में सेल निलंबन वितरित करें। प्रति 60 मिमी-व्यास संस्कृति डिश के लिए 3 एमएल का उपयोग करें।
नोट: इस संस्कृति को पारेज शून्य (पी 00) कहा जाता है। - 37% सेल्सियस पर 5% सीओ 2 इनक्यूबेटर में कोशिकाओं को बनाए रखें कंडिशन माध्यम का आधा हिस्सा हर दूसरे दिन ताजा माध्यम से बदलें।
- उपसंस्कृति (चरण 1.2) अगर यह मिला हुआ हो जाता है
- आरपीई सेल संस्कृति के उपसंस्कृति
- संस्कृति माध्यम को निकालें और पीबीएस (-) के साथ दो बार कोशिकाओं को कुल्ला।
- पीबीएस (-) समाधान वाले 0.05% trypsin + 0.2% EDTA के साथ कोशिकाओं को सेते हैं I5 मिनट के लिए 37 डिग्री सेल्सियस पर 5% सीओ 2 इनक्यूबेटर
- सौम्य pipetting द्वारा RPE कोशिकाओं को अलग करें और 10% पोर्किमा सीरम सहित 10 मिलीलीटर संस्कृति माध्यम से भरी शंख्य ट्यूब में सेल निलंबन एकत्र करें।
- कक्ष के तापमान पर 5 मिनट के लिए 400 एक्सजी पर सेल निलंबन अपकेंद्रित्र
- सतह पर तैरनेवाला निकालें और सेल संस्कृति एकाग्रता बनाने के लिए, 5 x 10 5 कोशिकाओं / एमएल (एक हेमोसाइटोमीटर के साथ सेल नंबर की गणना करके निर्धारित) स्टेप 1.1.13 में वर्णित अनुसार, 60 मिमी-व्यास संस्कृति व्यंजनों में कोशिकाओं को वितरित करें।
नोट: सेल संस्कृति अब बीतने 1 (पी 1) है। - सामंजस्य पर पहुंच जाने के बाद, पी 1 संस्कृति को पी 2 में उप-संस्कृति, चरण 1.2.1-1.2.5 में वर्णित समान प्रक्रिया का उपयोग कर रहा है। पी 2 संस्कृति से, 60 मिमी-व्यास संस्कृति व्यंजनों के बजाय छोटे संस्कृति बर्तन (30-मिमी भीतरी व्यास) पर कोशिकाओं को बीज दें।
- प्रयोगों के लिए, पी 2 या पी 3 संस्कृतियों का उपयोग करें
2. थुलआईयूएम लेजर इरडिडाएशन
- विकिरण स्टेशन का निर्माण
- एक थ्यूलियम लेजर डिवाइस (1.94 माइक्रोन, पावर रेंज: 0-20 डब्ल्यू) से 0.22-एनए, 365-माइक्रोन कोर व्यास फाइबर से कनेक्ट करें।
- यंत्रवत् विकिरण स्टेशन के ऊर्ध्वाधर धातु पद में क्षैतिज रूप से तय की गई धातु के हाथ में फाइबर टिप को ठीक करें। ऊर्ध्वाधर पोस्ट रखें जैसे कि लेजर फाइबर की नोक गरम प्लेट के ऊपर स्थित होती है जिस पर विकिरण के दौरान सेल कल्चर डिश रखा जाता है।
- गर्म प्लेट पर एक श्वेत पत्र रखो और लक्ष्य के बीम को चालू करें (λ = 635 एनएम, अधिकतम = 1 मेगावाट, कागज स्तर पर व्यास 30 ≈ 30 मिमी)। श्वेत पत्र पर लक्ष्य बीम के परिधि को चिह्नित करें ताकि स्थिति में जहां विकिरण के दौरान संस्कृति डिश रखा जा सके, ज्ञात हो।
नोट: फाइबर टिप के z- विमान अस्थिर हो सकता है। किसी भी अतिरिक्त इमेजिंग प्रकाशिकी के बिना, सेल संस्कृति विमान पर लेजर स्पॉट व्यास, फाइबर टिप से 12 सेमी नीचे रखा, मैंएस के बारे में 30 मिमी, जो सेल संस्कृति डिश के भीतरी व्यास के बराबर है। सेटअप का एक योजनाबद्ध चित्रण चित्रा 1 में दिखाया गया है।

चित्रा 1: थुलीयम लेजर इरडिडाएशन स्टेशन की योजनाबद्ध छवि। एक संस्कृति डिश हीटिंग प्लेट पर रखा गया है थैलियम लेजर फाइबर टिप से कोशिकाओं को 12 सेमी नीचे रखा जाता है ताकि बीम का आकार संस्कृति डिश (लगभग 30 मिमी) के भीतरी व्यास के समान हो। लेजर विकिरण प्रक्रिया को कस्टम-निर्मित सिस्टम डिज़ाइन प्लेटफॉर्म के समय-नियंत्रित रूटीन द्वारा नियंत्रित किया जाता है। विकिरण कार्यक्रम शुरू होने से पहले बिजली की स्थापना निर्धारित की जानी चाहिए। इस आंकड़े के एक बड़े संस्करण को देखने के लिए कृपया यहां क्लिक करें
- 1 घंटे पहले विकिरण, ताजी माध्यम के 1.2 एमएल के साथ पूरी तरह से संस्कृति माध्यम की जगह।
नोट: यह एक गंभीर कदम है और कड़ाई से पालन किया जाना चाहिए। - एक साफ बेंच पर किरणन स्टेशन ( यानी, गरम प्लेट और पोस्ट जिसके साथ लेजर फाइबर को ठीक करना है) रखें।
- इनक्यूबेटर से सेल कल्चर डिश निकालें और इसे गर्म प्लेट (चरण 2.1.3) पर चिह्नित स्थान पर रखें।
- सुरक्षात्मक चश्मा पहनें थ्यूलियम लेजर चालू करें लेज़र डिवाइस (0 - 20 डब्ल्यू से ट्यून योग्य) पर वांछित शक्ति सेट करें उत्सर्जन को चालू करें
- लेजर विकिरण और समय प्रोटोकॉल (पूरक फ़ाइल) को नियंत्रित करने वाले सिस्टम डिज़ाइन प्लेटफ़ॉर्म को प्रारंभ करें
- गर्म प्लेट पर संस्कृति पकवान रखने के तुरंत बाद, 140 सेकंड ("प्री-हीटिंग टाइम 1") के लिए टाइमर शुरू करने के लिए "प्री-हीटिंग टाइम" पर क्लिक करें; यह 3 में संस्कृति का मध्यम तापमान रखेगाविकिरण से पहले 7 डिग्री सेल्सियस
नोट: 140 एस के बाद, एक बीप ध्वनि चालू हो जाएगी, और अगले टाइमर ("प्री-हीटिंग टाइम 2") स्वचालित रूप से 8 एस की गिनती शुरू कर देगा। इस 8 एस के दौरान, परीक्षक संस्कृति डिश खोल सकता है 148-एस प्री-हीटिंग के बाद, सेल संस्कृति पर 10 एस-लार्ज लेजर विकिरण स्वचालित रूप से आयोजित किया जाएगा। आपातकाल के मामले में लेजर डिवाइस को लेजर को तुरंत बंद करने के लिए बल-आउट बटन के साथ तैयार करें। यह एक गंभीर कदम है और कड़ाई से पालन किया जाना चाहिए। सावधानी के लिए एक विशेष बिंदु 8 कि पूर्व हीटिंग समय की शुरुआत में विकिरण से पहले डिश के कवर को खोलने से संबंधित है। आवरण खोलने से मध्यम सतह को बहुत जल्दी शांत हो सकता है - विकिरण के बाद, तुरंत क्रीम को संस्कृति डिश पर रखें, एक अतिरिक्त 7 एस के लिए हॉट प्लेट पर संस्कृति डिश को छोड़ दें, और 37 डिग्री सेल्सियस पर 5% सीओ 2 इनक्यूबेटर में इसे वापस रखें।
- एक 30 मिमी व्यास संस्कृति डिश (कोशिकाओं के बिना) के चार पक्षों (हर 90 डिग्री) पर नीचे के करीब छेद (लगभग 300 सुक्ष्ममापी व्यास) बनाएं; एक ब्यूसेन बर्नर के साथ गरम सूई (20 जी) की नोक का उपयोग करें। छिद्रों को विद्युत अलगाव टेप से बाहर से सील करें और एक छोटे से छेद को सुई से सुई दें जिससे कि इस छिद्र के जरिये सिर्फ एक ठीक थर्मोकॉल (200 माइक्रोग्राम का व्यास) डाली जा सके।
- संस्कृति के डिश के नीचे, 2 लंबित व्यास आकर्षित करें और समतल शून्य (0) के रूप में क्रॉसिंग बिंदु ( यानी, नीचे की ओर का केंद्र) सेट करें। प्रत्येक दिशा में ( चित्रा 2 , नीली डॉट्स) प्रत्येक दिशा में डिश ( यानी, 0, 3, 6, 9, 12 और 15 मिमी) के बाहर हर 3 मिमी को त्रिज्या रूप से चिह्नित करें; अंकों की संख्या कुल में 21 होनी चाहिए।
- नई संस्कृति माध्यम के 1.2 एमएल के साथ सेल कल्चर डिशर भरें। संस्कृति डालें37 डिग्री सेल्सियस पर एक गर्म प्लेट पर आईश, साइड होल में एक ठीक थर्माकोपल (200 माइक्रोग्राम व्यास) डालें, और इसकी संवेदनशील टिप को मापा जाने की स्थिति में रखें।
- सुरक्षात्मक चश्मा पहनें थ्यूलियम लेजर को चालू करें और लेजर के लिए तैयार की गई मैन्युअल रूप से शक्ति (0 और 20 डब्ल्यू के बीच में, 0.1-W वेतन वृद्धि में)।
नोट: तापमान अंशांकन के लिए, 3 डब्ल्यू की वृद्धि में बिजली के साथ माप पर्याप्त होना चाहिए। - सिस्टम डिज़ाइन प्लेटफॉर्म को चालू करें और तापमान माप शुरू करने के लिए "स्टार्ट अस्थायी अधिग्रहण" बटन (पूरक फाइल) पर क्लिक करें।
- चरण 2.2.6 के अनुसार उसी प्रक्रिया का संचालन करें।
नोट: नियंत्रण कार्यक्रम, डाइरेक्ट थर्माकोपल के तापमान को प्रत्येक 100 एमएस को मापता है और जीयूआई में विकिरण के दौरान तापमान प्रगति को दर्शाता है। - सभी 21 माप अंक और विभिन्न बिजली सेटिंग्स पर इन प्रक्रियाओं का संचालन करें। पूरी प्रक्रिया को सभी बिंदुओं के लिए और सभी शक्तियों के लिए तीन बार दोहराएंजीएस विश्वसनीय डेटा प्राप्त करने के लिए
- सीएसवी डेटा के रूप में तापमान डेटा निर्यात करें, जिसे अंततः एक स्प्रेडशीट में कनवर्ट किया जा सकता है। हर बिंदु पर तीन प्रतियों के लिए विकिरण के अंत में अधिकतम तापमान औसत। एक ही वृत्त पर अंक (केंद्रीय अंक को छोड़कर कुल में 4 अंक) के मूल्यों का औसत।
- एक्स-अक्ष के रूप में पकवान (मिमी) के केंद्र से दूरी और तापमान में वृद्धि (ΔT, डिग्री सेल्सियस) वाई-अक्ष के रूप में दूरी हासिल करने के लिए ग्राफ़ पर औसत से अधिक तापमान प्राप्त करें। गौशी मॉडल को फिट करने के लिए गणितीय सॉफ़्टवेयर प्रोग्राम के फिट फ़ंक्शन का उपयोग करें। एक गाऊसी फिट तापमान वितरण बनाएँ

चित्रा 2: एक सेल संस्कृति डिश में तापमान अंशांकन के लिए अंक तापमान डेटा को केंद्र में और 5 पर मापा गया थारेडियल अंक 4 भिन्न कोणों (नीले डॉट्स) से अधिक हैं इस आंकड़े के एक बड़े संस्करण को देखने के लिए कृपया यहां क्लिक करें
3. थर्मल इरिडियेशन के बाद सेल प्रतिक्रियाओं के लिए जैविक मूल्यांकन
- सेल की व्यवहार्यता का मूल्यांकन ( यानि, जीवित, अपोप्रोटिक और मृत) विभिन्न बिजली सेटिंग्स और सेल मृत्यु सीमा के निर्धारण के बाद
- निर्देशित समय बिंदुओं ( यानी, 3, 24, और 48 घंटे के विकिरण के बाद), पीबीएस (-) के साथ कोशिकाओं को धो लें और निर्माता के अनुसार सेल व्यवहार्यता ( यानी, महत्वपूर्ण, अपोपिक, मृत) का आकलन करने के लिए व्यावसायिक रूप से उपलब्ध किट का उपयोग करें मसविदा बनाना।
- 5 μL फ्लोरोसिसिन isothiocyanate (एफआईटीसी) -नेंक्सिन वी, 5 μL ethidium homodimer III, और 5 μL के hoechst 33342 से 1x बाइंडिंग बफर के 100 μL (सभी किट जोड़कर एक धुंधला समाधान तैयार करेंअवयव)। कोशिकाओं को कवर करने के लिए पर्याप्त धुंधला समाधान तैयार करें। 15 मिनट के लिए कोशिकाओं को सेते हैं
- बाध्यकारी बफर के साथ सेल संस्कृति को दो बार धोएं, पीबीएस (-) के साथ बाध्यकारी बफर की जगह दें, और प्रतिदीप्ति सूक्ष्मदर्शी के स्तर पर संस्कृति को निर्धारित करें।
- ओक्यूलर लेंस के लिए प्रकाश पथ को स्विच करें, 4 ', 6-डायिडिन-2-फेनिलिंडोल (डीएपीआई) फिल्टर का चयन करें, रोशनी की रोशनी को चालू करें और 4x उद्देश्य के साथ केंद्रित विमान को ढूंढें।
- कैमरे में प्रकाश पथ बदलें, माइक्रोस्कोप इमेजिंग सॉफ्टवेयर में कंप्यूटर स्क्रीन पर छवि को ढूंढें, और फोकस समायोजित करें
- संपूर्ण सेल संस्कृति डिश की प्रतिदीप्ति छवि प्राप्त करने के लिए माइक्रोस्कोप-विशिष्ट सॉफ़्टवेयर के सिलाई फ़ंक्शन ( यानी, डिश में एकाधिक छवियों को रिकॉर्ड करने के लिए फ़ंक्शन और फिर एक एकल, बड़ी छवि बनाएं) का उपयोग करें। 3 अलग फिल्टर सेटों का उपयोग करें- डीएपीआई, एफआईटीसी, और टेट्रामिथिलोहाडामाइन (टीआरआईटीसी) -एचओचस्ट 33342-पॉजिटिव कोशिकाएं (सभी सेल नाभिक), एफआईटीसी-एनेक्सिन वी-पॉजिटिवे कोशिकाओं (एपोपोटिक) और एथिडियम होमोडीमर III पॉजिटिव कोशिकाएं (मृत) क्रमशः हैं।
- मरे हुए (त्रिभुज homodimer III-positive) क्षेत्र के त्रिज्या (मिमी) और स्टेन्ड सेल संस्कृतियों में एपोपोटिक (एनेक्सिन वी-पॉजिटिव) बैंड-फॉर्म क्षेत्र के बाहरी / आंतरिक त्रिज्या को मापें। इसी त्रिज्या को इसी विद्युत सेटिंग के लिए तापमान वितरण के फिट गाऊसी फ़ंक्शन पर लागू करें। कोशिका मृत्यु और अपोपेटिक परिवर्तन के लिए थ्रेसहोल्ड तापमान स्पष्ट करने के लिए मृत या अपोप्टीक क्षेत्र के रिम पर सटीक तापमान की गणना करें।
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
विभिन्न बिजली सेटिंग्स के बाद तापमान वितरण
तापमान कैलिब्रेशन में प्रत्येक एकल विकिरण के लिए सभी तापमान विकास की निगरानी की गई थी। इस डेटा से, मापा बिंदु पर अधिकतम तापमान प्राप्त किया गया था और टी अधिकतम (डिग्री सेल्सियस) के रूप में परिभाषित किया गया था। जैसा कि चित्रा 3 ए में दिखाया गया है, इस कार्यक्रम को समय-समय पर क्रियान्वित किया गया था जब संस्कृति डिश हीटिंग प्लेट पर रखा गया था। 140 के "प्री-हीटिंग टाइम 1" के बाद, जो कि एक स्थिर मध्यम तापमान को 37 डिग्री सेल्सियस पर संग्रहित करने के लिए आवश्यक था, संस्कृति पकवान के कवर को 8 के "प्री-हीटिंग समय 2" के दौरान हटा दिया गया था। "पूर्व हीटिंग समय 2" के अंत में, लेजर उत्सर्जन स्वचालित रूप से शुरू हो गया। यह वक्र एक 10 एस विकिरण के लिए एक प्रतिनिधि तापमान प्रगति है। विकिरण के दौरान, तापमान में वृद्धि हुई, और तुरंत लेजर उत्सर्जन के बाद थाबंद, तापमान कम करने के लिए शुरू कर दिया। संस्कृति पकवान के केंद्र में अधिक से अधिक तापमान को इस अध्ययन में टी अधिकतम (डिग्री सेल्सियस) के रूप में परिभाषित किया गया था। टी अधिकतम लेजर शक्ति ( चित्रा 3 बी ) के समान था। चित्रा 3C संस्कृति पकवान भर में प्रत्येक शक्ति के लिए अधिकतम तापमान का वितरण दिखाता है। वितरण घंटी के आकार का होते हैं, जैसा कि चित्रा 3C में दिखाया गया है, और निम्नलिखित सूत्र के अनुसार गौसी फ़ंक्शन के लिए फिट है:
टी (आर) = टी आधार + ए 
जहां आर, टी बेस , ए, और डब्ल्यू, केंद्र से दूरी (मिमी) के लिए खड़ा है, वक्र के लिए सबसे कम तापमान, आयाम और वक्र की चौड़ाई क्रमशः है। फिट जी के पैरामीटर (टी बेस , ए और डब्ल्यू)प्रत्येक शक्ति सेटिंग के लिए प्रत्येक टी मैक्स के लिए एक रूसी वक्र, ग्राफ के बगल में तालिका में दिखाया गया है।
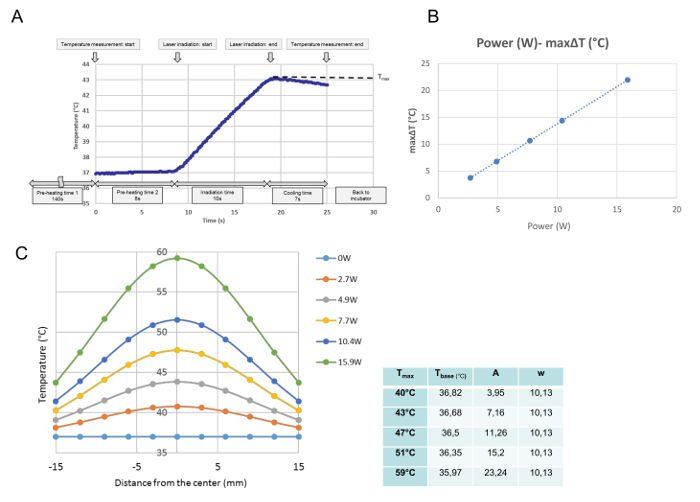
चित्रा 3: तापमान अंशांकन डेटा 4.9 डब्ल्यू (टी अधिकतम = 43 डिग्री सेल्सियस) ( ए ), लेजर पावर के बीच आनुपातिक रिश्ते और एक सेल कल्चर ( बी ) की केंद्रीय स्थिति में अधिकतम एक Δ टी पर एक एकल इर्रियाडिएशन के बाद केंद्रीय स्थान पर एक प्रतिनिधि तापमान विकास। और विभिन्न पावर सेटिंग्स के बाद संस्कृति डिश के पार तापमान डिस्ट्रीब्यूशन (सी) (ए) कार्यक्रम उस समय के बिंदु से कार्यान्वित किया जाता है जिस पर संस्कृति डिश हीट प्लेट पर रखा जाता है। "पूर्व-ताप समय 1" के 140 एस के बाद, जो 37 डिग्री सेल्सियस पर एक स्थिर मध्यम तापमान को संग्रहित करने के लिए आवश्यक है, संस्कृति पकवान के कवर को 8-"पूर्व-हीटिंग समय2. "प्री-हीटिंग समय 2" के अंत में, "लेजर उत्सर्जन स्वचालित रूप से शुरू होता है। यह वक्र 4.9 डब्ल्यू पर 10-एस विकिरण के दौरान केंद्रीय स्थिति में एक प्रतिनिधि तापमान प्रगति है। विकिरण के दौरान, तापमान बढ़ता है, और लेजर उत्सर्जन बंद होने के तुरंत बाद, तापमान में कमी आती है। अधिकतम तापमान विकिरण के अंत में प्राप्त होता है, जिसे टी अधिकतम (डिग्री सेल्सियस) के रूप में इस अध्ययन में परिभाषित किया जाता है। (बी) लेजर शक्ति और अधिकतम तापमान वृद्धि (Δ टी अधिकतम ) आनुपातिक है (सी) संस्कृति डिश में मापा तापमान वितरण के सज्जित गाऊसी फ़ंक्शंस। गणितीय सॉफ्टवेयर प्रोग्राम के साथ निर्धारित कार्यों के पैरामीटर, ग्राफ़ के किनारे तालिका में दिखाए जाते हैं कृपया इस आंकड़े के एक बड़े संस्करण को देखने के लिए यहां क्लिक करें।
थर्मल विकिरण के बाद सेल व्यवहार्यता
जैसा कि चित्रा 4 ए में दिखाया गया है, लेजर विकिरण के बाद सेल व्यवहार्यता का संकेत करने वाले तीन अलग-अलग धुंधले पैटर्न हैं: 1) कोई एनेक्सिन वि / एथिडियम होमोडाइमर III-पॉजिटिव ( यानी, केवल लाइव), 2) एनेक्सिन सेंटर में वी पॉजिटिव (लगभग , लगभग केवल प्रारंभिक एपोप्टोसिस), और 3) मृत और जीवित कोशिकाओं ( चित्रा 4 बी ) के बीच सीमा पर एपोपोटिक कोशिकाओं से घिरे केंद्र ( यानी, मृत कोशिकाओं) में एथिडियम होमोडिमर III पॉजिटिव। मृत / अपोपोटीक क्षेत्र का आकार आमतौर पर टी अधिकतम और विकिरण के बाद के विकिरण के समय 48 घंटे तक निर्भर होता है। टी अधिकतम ≤43 डिग्री सेल्सियस के साथ विकिरणित संस्कृतियों में कोई स्पष्ट व्यवहार्यता परिवर्तन नहीं पाया गया था एकमात्र apoptotic परिवर्तन समय (3 घंटे) में एक प्रारंभिक बिंदु पर देखा जा सकता है, एक देर से पीछा किया टी अधिकतम = 47 डिग्री सेल्सियस के साथ विकिरण के बाद कोशिका मृत्यु तत्काल या प्रारंभिक कोशिका मृत्यु (अप करने के लिए 3 घंटे) टी अधिकतम ≥ 51 डिग्री सेल्सियस (तालिका 1) के साथ विकिरणित संस्कृतियों में पाया गया था।

चित्रा 4: घातक लेजर इरिडियेशन (बी) के बाद डेड एंड अपोपॉटिक एरिया के रिम पर विभिन्न पावर सेटिंग्स (ए) और एक अनुकरणीय छवि के बाद वायबिलिटी स्टीनिंग का पैटर्न।
(ए) तापमान पर निर्भर करते हुए धुंधला हो जाना के तीन पैटर्न हो सकते हैं। (बी) मृत क्षेत्र के आसपास एपोपोटिक जैनोन (एफआईटीसी-एनेक्सिन वी-पॉजिटिव: हरे) (एथिडियम होमोडाइमर III पॉजिटिव: रेड)। सभी कोशिकाओं होच्स्ट 33342 (नीला) के लिए सकारात्मक हैं, और नीले नाभिक वाले कोशिकाएं जीवित कोशिकाएं हैं टी अधिकतम = 59 डिग्री सेल्सियस पर एक विकिरण के बाद छवि को 24 घंटे लिया गया था बार = 100 माइक्रोन/files/ftp_upload/54326/54326fig4large.jpg "target =" _ blank "> कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।

तालिका 1: विभिन्न तापमान और टाइम्स पर एनेक्सिन वी और एथिडियम होमोडीर III प्रतिक्रियाएं
सेल मृत्यु के लिए थ्रेसहोल्ड तापमान का निर्धारण
मृत क्षेत्र (लाल) और अपोपाटिक क्षेत्र (हरा) का औसत त्रिज्या मापा गया और 10 से विकिरण के बाद कोशिका मृत्यु और एपप्टोसिस के लिए थ्रेशोल्ड पीक तापमान निर्धारित करने के लिए तापमान वितरण के गौसीयन फ़ंक्शन पर लागू किया गया। इस विश्लेषण के अनुसार, विकिरण के बाद पूर्ण सेल मृत्यु 3 घंटे, 24 घंटे और 48 घंटे के लिए औसत थ्रेसहोल्ड तापमान क्रमशः 54.0 डिग्री सेल्सियस, 50.9 डिग्री सेल्सियस और 50.1 डिग्री सेल्सियस रहा। मतलब threshoसेल apoptotic परिवर्तन के लिए एलडी तापमान के बारे में 2 - 3 डिग्री सेल्सियस, 3 घंटे, 24 घंटे, और 48 घंटे के लिए थ्रेसहोल्ड तापमान 51.7 डिग्री सेल्सियस, 48.0 डिग्री सेल्सियस, और 47.0 डिग्री सेल्सियस, क्रमशः ( चित्रा 5 ) के साथ कम थे।
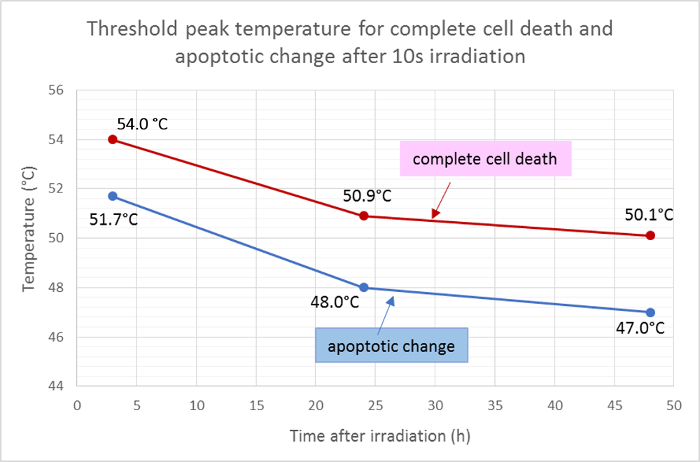
चित्रा 5: एपोप्टोसिस और सेल मौत के लिए थ्रेसहोल्ड तापमान।
पूर्ण कोशिका मृत्यु के लिए थ्रेशोल्ड तापमान का मतलब (हईचस्ट 33342, एनेक्सिन वी और एसिडियम होमोडाइमर III के लिए सकारात्मक) और एपोप्टोसिस के लिए (होक्स्ट 33342 और एनेक्सिन वी के लिए सकारात्मक) विकिरण के बाद अलग-अलग समय बिंदुओं पर, प्रतिदीप्ति व्यवहार्यता धुंधला के परिणामों की गणना । इस आंकड़े के एक बड़े संस्करण को देखने के लिए कृपया यहां क्लिक करें
Subscription Required. Please recommend JoVE to your librarian.
Discussion
तापमान से संबंधित जैविक सेलुलर प्रतिक्रियाओं पर चर्चा करते हुए, न केवल तापमान, बल्कि तापमान में वृद्धि की अवधि भी महत्त्वपूर्ण है, क्योंकि अधिकांश जैव रासायनिक प्रक्रियाएं समय-निर्भर हैं। विशेष रूप से नेत्र विज्ञान में लेसर प्रेरित हाइपरथेरिया के क्षेत्र में, मिलीसेकेंड से सेकंड तक छोटी अवधि के कारण-सटीक तापमान नियंत्रण वाले सेलुलर थर्मल प्रभावों की जांच करना मुश्किल है। इसलिए, सेल संस्कृति मॉडल के लिए उपयुक्त एक लेजर विकिरण सेटअप और एक ऑपरेशन सिस्टम के साथ जो कड़े तापमान और समय नियंत्रण को सक्षम बनाता है। प्रोटीन अभिव्यक्ति या स्राव जैसे थर्मल एक्सपोजर के बाद सेल प्रतिक्रियाओं का जैविक मूल्यांकन, पर्याप्त मात्रा में प्रभावित कोशिकाओं पर मात्रात्मक मूल्यांकन की आवश्यकता होती है। नैदानिक उपचार के रूप में लेजर के व्यास में कई सौ micrometers स्पॉट का उपयोग कर अध्ययन करने में यह एक बाधा रही है। एक लेजर स्पॉट पर क्वांटिटेटिव विश्लेषण काफी बू हैrdensome। इस अध्ययन में, इन मांगों को यथासंभव संभव पूरा करने का प्रयास किया गया है। एक विकिरण नियंत्रण कार्यक्रम के साथ 1.94 माइक्रोन तरंगदैर्ध्य निरंतर तरंग थुलीयम लेजर का उपयोग करके, एक अस्थायी तापमान वृद्धि एक छोटी अवधि के भीतर एक पूरी सेल संस्कृति में आयोजित की जा सकती है। चूंकि तापमान वितरण को हल्के मार्ग से बदलकर समायोजित किया जा सकता है, इसलिए इस सेटअप का उपयोग करके विभिन्न प्रकार के हाइपरथेरिया से संबंधित प्रयोग किया जा सकता है।
प्रस्तुत तकनीक की सीमा कोशिकाओं के लेजर विकिरण के दौरान एक साथ तापमान माप कराने की असंभव है। चूंकि थर्माकोपल्स का उपयोग निष्फल सेल संस्कृतियों के लिए उपयुक्त नहीं है, इसलिए तापमान अंशांकन सेल विकिरण से अलग से आयोजित किया जाना चाहिए। लेजर-पावर उत्पादन में संभावित भिन्नताओं को ध्यान में रखते हुए, प्रत्येक लेजर विकिरण के दौरान वास्तविक समय का तापमान माप आदर्श रूप से सेलुलर प्रतिक्रियाओं का मूल्यांकन करने के लिए आदर्श होगाथर्मल खुराक इसके अलावा, यहाँ इस्तेमाल किया जाने वाला तापमान वितरण एक सांस्कृतिक डिश पर 21 अंकों के माप और कई अलग-अलग पावर सेटिंग्स पर आधारित डेटा प्रक्षेपन के माध्यम से बनाया गया था। इसलिए, इन सीमाओं और महत्वपूर्ण बिंदुओं पर काबू पाने के लिए, हमारा एक वैकल्पिक तरीका विकसित करना हमारा लक्ष्य है जो संस्कृति के डिश के तापमान की माप के लिए अनुमति देता है जबकि लेजर विकिरण किया जा रहा है। हम यह भी लक्ष्य करते हैं कि एक ही बार में स्थानिक तापमान जानकारी प्राप्त करें इन्फ्रारेड इमेजिंग (थर्मोग्राफ़ी) लेजर इरबिएशन 10 के दौरान तापमान को मापने के लिए एक संभव तरीका है। इस विधि का महान लाभ प्रत्येक विकिरण के लिए सेलुलर स्तर पर वास्तविक समय का तापमान माप है; बाद के कोशिका जैविक प्रतिक्रियाएं हमेशा विकिरण के दौरान तापमान के इतिहास की तुलना में अलग-अलग हो सकती हैं। लागत-प्रभावशीलता और प्रयोज्यता को देखते हुए, हालांकि, प्रत्येक प्रयोगशाला के लिए सेल हीटिंग प्रयोगों के लिए थर्मोग्राफी का उपयोग करना संभव नहीं हैory।
1.94 माइक्रोन के तरंग दैर्ध्य पर थ्यूलियम लेजर का प्रयोग करते हुए विधि में, सेल कल्चर डिश में पानी इसकी सतह पर गरम किया जाता है और थर्मल प्रसार और संवहन कोशिकाओं को गर्मी के लिए उपयोग किया जाता है। इस विकिरण की स्थापना में संस्कृति माध्यम की ऊंचाई, 1.2 मिलीलीटर संस्कृति माध्यम के साथ, 935 माइक्रोन केंद्रीय स्थान पर है (पिछले माप से ऑप्टिकल कॉसहेंस टोमोग्राफी का उपयोग कर)। थ्यूलियम लेजर के पानी में अवशोषण का स्तर बहुत अधिक है (अवशोषण गुणांक: 127 सेमी -1 35 डिग्री सेल्सियस), और 72% प्रकाश संस्कृति के पहले 100 माइक्रोन में अवशोषित होता है। 935 माइक्रोन की गहराई में लगभग कोई अवशोषण (0.0007%) नहीं है
यह ध्यान रखना महत्वपूर्ण है कि प्रोटोकॉल में महत्वपूर्ण बिंदुओं में से एक में प्रत्येक विकिरण के लिए समान मात्रा (1,200 μL) जोड़ना है संस्कृति के माध्यम से अलग-अलग मात्रा का इस्तेमाल करना ऊँचाई का कारण बन सकता है, जिससे तापमान में अंतर हो सकता है Iकोशिकाओं की कमी दूसरा महत्वपूर्ण बिंदु संस्कृति पकवान के उद्घाटन के समय से संबंधित है। यह एक ही समय में किया जाना चाहिए- इस अध्ययन में, विकिरण की शुरुआत से 8 s पहले, जब सिस्टम ध्वनि बनाता है आसपास के वायु (लगभग 23 डिग्री सेल्सियस) के कारण ठंडा करने के कारण इस समय के अंतर बेस तापमान में भिन्न हो सकते हैं। इससे लेजर प्रेरित तापमान में महत्वपूर्ण अंतर हो सकता है।
तापमान अंशांकन के लिए, प्रयोगों में उपयोग किए जाने वाले माध्यम (1.2 एमएल) की समान मात्रा का उपयोग सेल मुक्त संस्कृति व्यंजन के नीचे तापमान वितरण को मापने के लिए किया गया था। हालांकि, एक सेल मोनोलएयर के साथ मध्यम ऊंचाई कोशिकाओं के बिना एक से अलग हो सकती है, यहां तक कि मध्यम के समान मात्रा के साथ जोड़ा गया। ऑप्टिकल कन्फरेन्स टोमोग्राफी का उपयोग करते हुए माप से पता चला है कि एक मिला हुआ सेल मोनोलएयर (कोशिकाओं के बिना 877 माइक्रोन के साथ व्यंजन के बीच और बिना व्यंजन के बीच की केंद्रीय स्थिति में 58-माइक्रोन का अंतर होता हैओ 935 कोशिकाओं के साथ माइक्रोन)। यह अंतर संभवतः कोशिकाओं की केशिका क्रिया के कारण होता है। केन्द्रीय स्थिति में ऊंचाई में 58-माइक्रमी अंतर लगभग 40 μL मध्यम (मापा डेटा) के कारण हो सकता है। यह भी पुष्टि की गई थी कि ऊँचाई में इस अंतर ने सभी शक्ति सेटिंग्स पर टी मैक्स में महत्वपूर्ण अंतर नहीं पैदा किए। इसलिए, हमने यह निष्कर्ष निकाला है कि यह अंतर इस अध्ययन में किए गए विश्लेषणों के परिणामों को महत्वपूर्ण रूप से प्रभावित नहीं करता है। फिर भी, अधिक सटीक तापमान जानकारी इकट्ठा करने के लिए, जैसा कि ऊपर लिखा गया है, एक सेल मोनोलायरे वाले सेल कल्चर डिश के उपयोग से तापमान को जांचने का एक तरीका विकसित किया जाना चाहिए। इसके अलावा, पूरे संस्कृति माध्यम में थर्मल प्रसार और संवहन के गणितीय मॉडलिंग भी आवश्यक है।
इस अध्ययन में, कोशिकाओं को एक गाऊसी तापमान वितरण के साथ गरम किया गया था। समय के साथ पूरे मध्यम अधिक समान रूप से गर्मी के लिए कई संभव तरीके हैं। एक पानी में कम अवशोषण गुणांक के साथ एक लेजर स्रोत का उपयोग करना है हालांकि, यह दोष यह है कि, इस मामले में, पराबैंगनीकिरण एक उच्च शक्ति होनी चाहिए, क्योंकि प्रकाश का केवल एक छोटा प्रतिशत 0.9 मिमी से अधिक अवशोषित होता है। एक अन्य संभावना है कि एक मल्टीमोड ऑप्टिकल फाइबर के डिस्टल फाइबर टिप को चित्रित करना है जो लेज़र लाइट को संस्कृति डिश के विमान में स्थानांतरित करता है; आवर्धन प्रकाशिकी द्वारा स्वैच्छिक रूप से चुना जा सकता है
इस प्रोटोकॉल का दूसरा आकर्षण यह है कि सेल मृत्यु और एपोपोसिस के लिए थ्रेसहोल्ड तापमान को व्यवहार्यता धुंधला हो जाना और पार्श्व तापमान वितरण की फ्लोरोसेंट छवि का उपयोग करने की क्षमता है। एक दीर्घकालिक लक्ष्य न केवल सेल व्यवहार्यता निर्धारित करने के लिए है, बल्कि सेल की जैविक प्रतिक्रियाओं के लिए तापमान की सीमा को स्पष्ट करने के लिए भी है, जैसे कि प्रोटीन अभिव्यक्ति और सेल प्रसार। शोधकर्ताओं के लिए कोशिका मृत्यु सीमा के तापमान का निर्धारण बहुत ही बढ़िया है"> 10 इस विधि का उपयोग करना, एपोपोसिस सहित सेल मृत्यु के लिए महत्वपूर्ण कारकों को निर्धारित करना संभव हो सकता है। थर्मल लेजर प्रेरित कोशिका मृत्यु के लिए महत्वपूर्ण कारक न केवल तापमान के इतिहास के माध्यम से, बल्कि अंतर्जात कारकों यानी, आणविक स्तर पर अंतर / अतिरिक्त सेलुलर कारक) इन सवालों के जवाब देने से विभिन्न थर्मल एक्सपोज़र और विभिन्न रेटिनल विषाणुओं के बाद कोशिका मृत्यु तंत्र और कैनेटीक्स को समझने का मार्ग प्रशस्त हो सकता है। इसके अलावा, यह चिकित्सकीय रूप से मनाया गया मुद्दों को स्पष्ट करने में भी मदद कर सकता है, जैसे कि लेजर उपचार या रेटिना फोटोकॉएग्यूलेशन के बाद निशान आकार में परिवर्तनशीलता के जवाब में अंतर-अलग-अलग अंतर, भले ही शुरुआती स्थान का आकार लगभग समान ("एट्रोपिक रेंगना") 11 था ।
इस अध्ययन का अंतिम उद्देश्य रेटिना की तापमान-नियंत्रित फोटोथर्मल थेरेपी विकसित करने में सहायता करना है। इसे प्राप्त करने के लिए, समानांतर वाई मेंतापमान माप 3 की तकनीकी प्रगति, थर्मल एक्सपोज़र के बाद आरपीई सेल व्यवहार के आगे स्पष्टता, इस पद्धति का उपयोग करके निर्धारित किया गया, यह महान लाभ का होगा।
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
लेखकों के पास खुलासे के लिए कुछ भी नहीं है।
Acknowledgments
यह काम जर्मन फेडरल मिनिस्ट्री ऑफ़ एजुकेशन एंड रिसर्च (बीबीएफएफ) (अनुदान # 13GW0043C) और एक यूरोपीय कार्यालय ऑफ एरोस्पेस रिसर्च एंड डेवलपमेंट (ईओएडीएडी, # एफएएम 9550-15-1-0443 अनुदान) से किया गया था।
Materials
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Dulbecco’s Modified Eagle’s Medium - high glucose | Sigma-Aldrich | D5796-500ML | Add (2)-(4) before use. Warm in 37 °C water bath before use. |
| Antibiotic Antimycotic Solution (100 ×) | Sigma-Aldrich | A5955-100ML | Containing 10,000 units penicillin, 10 mg streptomycin and 25 μg Amphotericin B in 1mL. Add 5.5 mL in 500 mL medium bottle (1) before use. |
| Sodium pyruvate (100 mM) | Sigma-Aldrich | S8636-100ML | Add 5.5 mL in 500 mL medium bottle (1) before use (final concentration: 1 mM) |
| Porcine serum | Sigma-Aldrich | 12736C-500ML | Add 50 mL in 500 mL medium bottole (1) before use (final: 10%) |
| Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537-500ML | |
| Trypsin from porcine pancreas | Sigma-Aldrich | T4799-25G | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | ED-100G | |
| Human VEGF Quantikine ELISA Kit | R&D System | DVE00 | |
| Oxiselect Total Glutathione Assay Kit | Cell Biolabs, Inc | STA-312 | |
| Apoptotic/Necrotic/Healthy Cells Detection Kit | PromoKine | PK-CA707-30018 | |
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Thulium laser | Starmedtec GmbH | Prototype | 0-20 W |
| 365 mm core diameter fiber | LASER COMPONENTS Germany | CF01493-52 | |
| Thermocouple | Omega Engineering Inc | HYP-0- 33-1-T-G-60-SMPW-M | |
| Heating plate | MEDAX | ||
| Microplate reader (spectrofluorometer) | Molecular Device | Spectramax M4 | |
| cell homogenizer | QIAGEN | TissueLyser LT | |
| Fluorescence microscope | Nikon | ECLIPSE Ti | |
| mathematical software program | The Mathworks. Inc | MATLAB Release 2015b | |
| system-design platform | National Instrument | Labview | Laboratory Virtual Instrument Engineering Workbench |
References
- Inagaki, K., et al. Comparative efficacy of pure yellow (577-nm) and 810-nm subthreshold micropulse laser photocoagulation combined with yellow (561-577-nm) direct photocoagulation for diabetic macular edema. Jpn J Ophthalmol. 59 (1), 21-28 (2015).
- Roider, J., et al. Selective retina therapy (SRT) for clinically significant diabetic macular edema. Graefes Arch Clin Exp Ophthalmol. 248 (9), 1263-1272 (2010).
- Brinkmann, R., et al. Real-time temperature determination during retinal photocoagulation on patients. J Biomed Opt. 17 (6), 061219 (2012).
- Yoshimura, N., et al. Photocoagulated human retinal pigment epithelial cells produce an inhibitor of vascular endothelial cell proliferation. Invest Ophthalmol Vis Sci. 36 (8), 1686-1691 (1995).
- Denton, M. L., et al. Damage Thresholds for Exposure to NIR and Blue Lasers in an In Vitro RPE Cell System. Invest Ophthalmol Vis Sci. 47 (7), 3065-3073 (2006).
- Shrestha, R., Choi, T. Y., Chang, W., Kim, D. A high-precision micropipette sensor for cellular-level real-time thermal characterization. Sensors (Basel). 11 (9), 8826-8835 (2011).
- Gao, F., Ye, Y., Zhang, Y., Yang, J. Water bath hyperthermia reduces stemness of colon cancer cells. Clin Biochem. 46 (16-17), 1747-1750 (2013).
- Jansen, E. D., van Leeuwen, T. G., Motamedi, M., Borst, C., Welch, A. J. Temperature dependence of the absorption coefficient of water for midinfrared laser radiation. Lasers Surg Med. 14 (3), 258-268 (1994).
- Iwami, H., Pruessner, J., Shiraki, K., Brinkmann, R., Miura, Y. Protective effect of a laser-induced sub-lethal temperature rise on RPE cells from oxidative stress. Exp Eye Res. 124, 37-47 (2014).
- Denton, M. L., et al. Spatially correlated microthermography maps threshold temperature in laser-induced damage. J Biomed Optics. 16 (3), (2011).
- Morgan, C. M., Schatz, H. Atrophic creep of the retinal pigment epithelium after focal macular photocoagulation. Ophthalmology. 96 (1), 96-103 (1989).



