Summary
הגדרה ניסיונית מקורי לחימום תאים בצלחת תרבות באמצעות 1.94 מיקרומטר גל רציף הקרנת לייזר מוצג כאן. באמצעות שיטה זו, התגובות הביולוגיות של פיגמנט רשתית אפיתל (RPE) תאים לאחר חשיפות תרמיות שונות ניתן לחקור.
Abstract
שיטה מקורית לחמם תאים בתרבית באמצעות 1.94 מיקרומטר גל רציף גל tholium להערכה ביולוגית הוא הציג כאן. קרינת לייזר תוליום נקלט מאוד על ידי מים, ואת התאים בחלק התחתון של צלחת התרבות מחוממים באמצעות דיפוזיה תרמית. סיבי לייזר עם קוטר של 365 מיקרומטר מוגדר כ 12 ס"מ מעל צלחת התרבות, ללא כל אופטיקה, כך קוטר קרן הלייזר הוא כמעט שווה את הקוטר הפנימי של צלחת תרבות (30 מ"מ). על ידי שמירה על כמות עקבית של המדיום תרבות בכל ניסוי, אפשר להקרין את התאים עם עלייה בטמפרטורה לשחזור מאוד.
כדי לכייל את עליית הטמפרטורה ואת התפוצה שלה בצלחת אחת התא התרבות עבור כל הגדרה כוח, הטמפרטורה נמדדה במהלך 10 s של הקרנה בעמדות שונות ברמה התאית. חלוקת הטמפרטורה יוצגה באמצעות תוכנת גרפיקה מתמטיתתוכנית, ואת התבנית שלה על פני צלחת התרבות היה טופס גאוס. לאחר הקרנת לייזר, ניסויים ביולוגיים שונים יכולים להתבצע על מנת להעריך תגובות תא תלוי טמפרטורה. בכתב היד הזה, מכתים הכדאיות ( כלומר, הבחנה בין תאים חיים, אפופטוטיים, מתים) הוא הציג כדי לסייע לקבוע את טמפרטורות הסף אפופטוזיס התא ומוות לאחר נקודות שונות בזמן.
היתרונות של שיטה זו הם דיוק של הטמפרטורה ואת הזמן של חימום, כמו גם יעילות גבוהה שלה תאים חימום בתא שלם תרבות התא. יתר על כן, הוא מאפשר ללמוד עם מגוון רחב של טמפרטורות ומשך זמן, אשר יכול להיות נשלט היטב על ידי מערכת הפעלה ממוחשבת.
Introduction
הבנת התגובות הביולוגיות לתאים תלויי טמפרטורה היא בעלת חשיבות רבה לטיפולי היפרתרמיה מוצלחים. לייזר photocagulation לייזר עם לייזר תרמי, המשמשים אופתלמולוגיה, הוא אחד הטיפולים לייזר הוקמה ביותר ברפואה. אור גלוי, בעיקר מ אור ירוק אור צהוב, משמש בטיפול לייזר ברשתית. האור הוא נספג מאוד על ידי מלנין בתאי אפיתל פיגמנט רשתית (RPE) תאים, המהווים את monolayer התא החיצוני של הרשתית. יש לאחרונה התעניינות בקרב רופאים וחוקרים בקרינה תרמית קלה מאוד (photocagulation תת גלוי) כאסטרטגיה טיפולית חדשה עבור סוגים שונים של הפרעות רשתית 1 , 2 . בעקבות מגמה זו, האינטרס שלנו הוא תת חיטה תת תאים RPE תחת בקרת טמפרטורה מדויקת, טכניקה המכונה טמפרטורה מבוקרת פוטותרמית (TC-PTT).
אופטו אחרוניםטכנולוגיה אקוסטית של המכון שלנו אפשרה את המדידה בזמן אמת של עליית הטמפרטורה באתרי מוקרן הרשתית. זה מאפשר שליטה על עליית הטמפרטורה במהלך קרינה 3 . עם זאת, מאז היפרתרמיה תת-קטלנית על הרשתית, הנגרמת על ידי חימום תאים RPE תת תת קטלני, לא נחשב בעבר בשל חוסר האפשרות של מדידה ושליטה על הטמפרטורה, תגובות תא תלוי טמפרטורה של תאים RPE בעקבות הקרנה בלייזר תרמי יש נחקרו מעט מאוד עד כה. יתר על כן, לא רק ההבדל הטמפרטורה לא נדונו בפירוט, אלא גם את ההבדל בהתנהגות התא של תאים ששרדו לאחר הקרנה תת קטלני קטלני. לכן, כדי לאסוף ראיות מדעיות על TC-PTT מבוססי טיפולים, אנו שואפים להבהיר את התאים תלויי הטמפרטורה תא RPE התא והמנגנונים שלהם באמצעות setups ניסיוני חוץ גופית .
עבור tמטרתו, יש צורך להקים התא חימום המערכת העומדת בתנאים הבאים: 1) אפשרות להגדלת הטמפרטורה מהר, 2) זמן מבוקרים מדויק טמפרטורה, 3) מספר גבוה יחסית של תאים שנבדקו עבור ניסויים ביולוגיים . לגבי שיטת החימום, לייזר קליני, כגון תדר Nd.YAG הכפול תדר (532 ננומטר), הוא למרבה הצער לא מתאים לתא התרבות התא. הסיבה לכך היא מספר מופחת של מלנוזומים בתאי RPE תרבותי. הקליטה של אור הלייזר עשויה להיות בלתי-הומוגנית, ועליית הטמפרטורה ברמת הסלולר משתנה בין ניסויים, גם כאשר מוקרנת עם אותה עוצמת קרינה. מספר מחקרים קודמים דיווחו על שימוש בנייר שחור מתחת לתחתית התבשיל במהלך הקרנה 4 או שימוש במלנוזומים נוספים, כי הם phagocytized על ידי תאים התרבות לפני הניסויים 5 , 6 . הרבה מבמבחנה ביולוגית מחקרים להערכת תגובות התא המושרה היפרתרמיה בוצעו באמצעות צלחת חמה, אמבט מים, או CO 2 חממה עם הגדרת טמפרטורה 7 . שיטות אלה דורשות תקופת חימום ארוכה כי זה לוקח קצת זמן ( כלומר, כמה דקות) כדי להגיע לטמפרטורה הרצויה. יתר על כן, בשיטות אלה, קשה להשיג היסטוריה תרמית מפורט ( כלומר, טמפרטורה כפול זמן) ברמה התאית. יתר על כן, הטמפרטורה בין התאים בעמדות שונות בצלחת תרבות אחת עשויים להשתנות בשל דיפוזיה טמפרטורה משתנה. ברוב המקרים, מידע טמפרטורתי וזמני מרחבי זה במהלך היפרתרמיה לא נלקח בחשבון לצורך ניתוחים ביולוגיים, למרות שתגובת התא הביולוגי עלולה להיות מושפעת בצורה קריטית מהטמפרטורה ומהמשך הזמן של הטמפרטורה המוגברת.
כדי להתגבר על בעיות אלה, contiהלייזר גל thulium נוזל שימש כאן כדי לחמם את התאים. קרינת לייזר תוליום (λ = 1.94 מיקרומטר) הוא נספג מאוד על ידי מים 8 , ואת התאים בחלק התחתון של צלחת תרבות הם מגורה תרמית אך ורק באמצעות דיפוזיה תרמית. סיבי הלייזר עם קוטר 365 מיקרומטר מוגדר כ 12 ס"מ מעל צלחת התרבות, ללא כל אופטיקה בין לבין. קוטר קרן הלייזר מפריד כזה שהוא כמעט שווה את הקוטר הפנימי של צלחת תרבות (30 מ"מ) על פני השטח של המדיום תרבות.עם כמות עקבית של המדיום תרבות, אפשר להקרין את התאים עם עליית הטמפרטורה של הדירות גבוהה. הגדרות כוח משתנה מאפשרות הקרנה עם עד 20 ואט, והטמפרטורה בינונית ברמה התאית יכולה להיות מוגברת עד ΔT ≈ 26 ° C ב 10 שניות.
על ידי שינוי תנאי הקרנה, ניתן גם לשנות את פרופיל קרן הלייזר כדי לשנות את הטמפרטורה distributiעל בצלחת תרבותית. לדוגמה, ניתן לחקור עם הפצה טמפרטורה כמו גאוס, כמו במחקר הנוכחי, או עם חלוקת טמפרטורה הומוגנית. זה האחרון עשוי להיות מועיל לחקר ההשפעות של התגובות הטמפרטורה תלויי תא יותר ספציפי עבור טמפרטורות קטלניות מתחת לטמפרטורות, אבל לא ללחץ מוות של תאים או תגובות ריפוי הפצע.
בסך הכל, קרינה לייזר תוליום עשוי לאפשר את החקירה של סוגים שונים של גורמים ביולוגיים, כגון ביטוי גנים / חלבון, קינטיקה מוות של תאים, התפשטות תאים, ופיתוח פונקציונליות התא, לאחר חשיפות תרמיות שונות.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. תרבות תא RPE
- בידוד של תאים RPE מעיניים חזירי
- השג עיניים טריות מחורצות טרי מבית המטבחיים המקומי. שמור אותם מגניב (4 ° C) בסביבה חשוכה.
- הסר רקמות תאיים עם מספריים להשרות את העיניים בתמיסה חיטוי במשך 5 דקות.
- מניחים את העיניים במי מלח פוספט מעוקרים ללא סידן ומגנזיום (PBS (-)) עד לשימוש.
- באמצעות אזמל, לחדור את sclera על 5 מ"מ האחורי אל ליבת הקרום. משמרים את החלק הקדמי של העין על ידי חיתוך במספריים לכל אורך הדרך, במקביל לאיבר הקרום.
- הסר את החלק הקדמי של העין ( כלומר, הקרנית ואת העדשה) ואת זגוגית. הוסף 1 מ"ל של PBS (-) בעדינות להסיר את הרשתית העצבית.
הערה: זה "כוס העין", המורכב sclera, choroid, ו RPE, מוכן כעת. - הוסף מראש חימם (37 מעלות צלזיוס) 0.25% טריפסין ב PBS (-) על כוס העין. התאם את עוצמת הקול כך כ 80% של כוס העין מלא פתרון זה טריפסין.
- דגירה את כוס העין עם פתרון טריפסין 5% CO 2 באינקובטור ב 37 מעלות צלזיוס למשך 10 דקות.
- הסר את כוס העין מן האינקובטור ולהחליף את הפתרון טריפסין 0.25% עם פתרון PBS (-) עם 0.05% טריפסין + 0.2% ethylenediaminetetraetetic מלח טטרסודיום (EDTA · 4N). דגירה את כוס העין באינקובטור במשך 45 דקות.
הערה: לאחר 45 דקות, תאי RPE יהיה גם מחובר רק רופף קרום של ברוץ או כבר מנותקים וצפים פתרון טריפסין-EDTA. - איסוף תאים RPE ידי pipetting עדין. לאסוף את התאים ואת הפתרון בצינור חרוטי מלא 10 מ"ל של המדיום תרבות (DMEM גלוקוז גבוהה עם L- גלוטמין), כולל 10% בסרום חזיר, אנטיביוטיקה / antimycotic, pyruvate נתרן (1 מ"מ).
הערה: הסרום עשוי לנטרל את ההשפעה של טריפסין. - צנטריפוגהההשעיה תא ב XG 400 במשך 5 דקות בטמפרטורת החדר.
- הסר את supernatant ולהוסיף 10 מ"ל של מדיום טרי. צנטריפוגה שוב תחת אותם תנאים במשך 5 דקות.
- הסר את supernatant ולהוסיף בינוני חדש, כך ריכוז התא תוצאות 5 x 10 5 תאים / מ"ל (שנקבע על ידי ספירת התאים באמצעות hemocytometer). מערבבים היטב על ידי pipetting עדין.
- להפיץ את ההשעיה התא בצלחות תרבות התא. השתמש 3 מ"ל לכל צלחת 60 מ"מ קוטר התרבות.
הערה: תרבות זו נקראת מעבר אפס (P0). - לשמור על התאים 5% CO 2 באינקובטור ב 37 ° C. שנה חצי בינוני מותנה בינוני טרי מדי יום שני.
- Subculture (שלב 1.2) אם הוא הופך להיות confluent.
- תת התרבות של התרבות התא RPE
- הסר את המדיום תרבות לשטוף את התאים פעמיים עם PBS (-).
- דגירה התאים עם PBS (-) פתרון עם 0.05% טריפסין + 0.2% EDTA אניNa 5% CO 2 באינקובטור ב 37 מעלות צלזיוס למשך 5 דקות.
- לנתק את תאים RPE ידי pipetting עדין ולאסוף את ההשעיה התא בצינור חרוטי מלא 10 מ"ל של המדיום תרבות, כולל 10% בסרום חזיר.
- צנטריפוגה ההשעיה התא ב XG 400 במשך 5 דקות בטמפרטורת החדר.
- הסר את supernatant ולהוסיף בינוני תרבות חדשה, מה שהופך את ריכוז התא 5 x 10 5 תאים / מ"ל (שנקבע על ידי ספירת מספר התא עם hemocytometer). להפיץ את התאים חדשים 60 מ"מ קוטר מנות התרבות, כמתואר בשלב 1.1.13.
הערה: תרבות התא הוא עכשיו מעבר 1 (P1). - לאחר confluency הוא הגיע, תת תרבות P1 ל P2, תוך שימוש באותו הליך המתואר צעדים 1.2.1-1.2.5. מן התרבות P2, זרע התאים על מנות תרבות קטנות יותר (30 מ"מ קוטר פנימי) במקום 60 מ"מ קוטר מנות תרבות.
- עבור הניסויים, השתמש P2 או תרבויות P3.
2. ת'ולהקרנת לייזר
- הקמת תחנת ההקרנה
- חיבור מכשיר הליום תוליום (1.94 מיקרומטר, טווח כוח: 0-20 W) כדי 0.22-NA, 365 מיקרומטר סיבי קוטר הליבה.
- מכני לתקן את קצה סיב הזרוע המתכת כי הוא קבוע אופקית אל עמדת מתכת אנכית של תחנת הקרנה. מניחים את ההודעה אנכי כך קצה סיבי הלייזר נמצא מעל צלחת חמה שעליו צלחת התרבות התא הוא להיות ממוקם במהלך הקרנה.
- הנח נייר לבן על צלחת חם ולהפוך את הקורה מכוון על (λ = 635 ננומטר, מקסימום = 1 mW, קוטר ברמת נייר ≈ 30 מ"מ). סמן את היקף הקורה מכוונת על הנייר הלבן, כך המיקום שבו צלחת התרבות היא להיות ממוקם במהלך הקרנה ידוע.
הערה: המטוס z של קצה סיב ניתן לשינוי. ללא כל אופטיקה הדמיה נוספת, קוטר נקודה לייזר על המטוס התרבות תאים, להציב 12 ס"מ מתחת קצה סיב, אני S על 30 מ"מ, אשר כמעט שווה את הקוטר הפנימי של צלחת תרבות התא. ציור סכמטי של ההתקנה מוצג באיור 1 .

איור 1: תמונה סכמטית של תחנת הלייזר תוליום לייזר. צלחת תרבות מונחת על צלחת החימום. התאים ממוקמים 12 ס"מ מתחת עצה סיבי הליום תוליום כך גודל הקרן הוא כמעט זהה לקוטר הפנימי של צלחת תרבות (כ 30 מ"מ). הלייזר הקרנה לייזר נשלטת על ידי שבשגרה זמן בשליטה של פלטפורמת עיצוב מערכת בהתאמה אישית. יש לקבוע את הגדרת הכוח לפני הפעלת תוכנית ההקרנה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
- Start = "2">
- הקרנה בלייזר של תרבות התא
- 1 שעה לפני הקרנה, להחליף את המדיום התרבות לחלוטין עם 1.2 מ"ל של המדיום הטרי.
הערה: זהו שלב קריטי ויש לעקוב אחריו בקפידה. - מניחים את תחנת ההקרנה ( כלומר, את הצלחת החמה ואת ההודעה שבה כדי לתקן את סיבי הלייזר) על ספסל נקי.
- הסר את צלחת התרבות התא מן החממה ומניחים אותו על המיקום מסומן על צלחת חמה (שלב 2.1.3).
- ללבוש משקפי מגן. הפעל את הלייזר תוליום. הגדר את העוצמה הרצויה במכשיר הלייזר (מתכוונן מ - 20 - 20 W). הפעל את הפליטה.
- התחל פלטפורמת תכנון מערכת השולטת על קרינה בלייזר ופרוטוקול תזמון (קובץ משלים).
- מיד לאחר הנחת צלחת התרבות על צלחת חם, לחץ על "זמן חימום מראש" כדי להפעיל את הטיימר עבור 140 s ("זמן חימום מראש 1"); זה ישמור על הטמפרטורה בינוני בינוני ב 37 ° C לפני הקרנה.
הערה: לאחר 140 שניות, צליל ביפ יופעל, והקוצב הבא ("זמן החימום המוקדם") יתחיל לספור באופן אוטומטי 8 שניות. במהלך 8 זה, הבוחן עשוי לפתוח את צלחת התרבות. לאחר 148 של חימום מראש, 10-s הקרנה בלייזר ארוך על התרבות התא יתבצע באופן אוטומטי. במקרה חירום, הצייד את מכשיר הלייזר בלחיצת עצירה כדי לעצור את הלייזר באופן מיידי. זהו שלב קריטי חייב להיות אחריו בהחלט. נקודה מיוחדת של זהירות מתייחסת לפתיחת הכיסוי של המנה בדיוק לפני ההקרנה, בתחילת זמן 8 חימום מראש. פתיחת המכסה עלולה להתקרר מהר מאוד. - לאחר הקרנה, מיד במקום לכסות בחזרה על צלחת התרבות, לעזוב את צלחת תרבות על צלחת חמה במשך 7 שניות נוספות, ומניחים אותו בחזרה 5% CO 2 באינקובטור ב 37 ° C.
- 1 שעה לפני הקרנה, להחליף את המדיום התרבות לחלוטין עם 1.2 מ"ל של המדיום הטרי.
- מדידת התפלגות הטמפרטורה ברמה תאית (כיול טמפרטורה)
- הפוך חורים קטנים (כ 300 מיקרומטר בקוטר) קרוב לתחתית על ארבעה צדדים (כל 90 מעלות) של צלחת 30 מ"מ קוטר תרבות (ללא תאים); להשתמש קצה מחט (20G) מחומם עם מבער Bunsen. חותם את החורים עם סרט בידוד חשמלי מבחוץ ולעשות חור קטן עם מחט בסדר כך שרק תרמי קנס (200 מיקרומטר בקוטר) ניתן להכניס דרך חור זה בתנאים אטום למים.
- בחלק החיצוני של צלחת בתחתית התרבות, לצייר 2 בקוטר אנכי ולהגדיר את נקודת המעבר ( כלומר, במרכז הצד התחתון) כמו קואורדינטות אפס (0). סמן כל 3 מ"מ רדיאלי החוצה את המנה ( כלומר, 0, 3, 6, 9, 12, ו -15 מ"מ) בכל כיוון לאורך השורות ( איור 2 , נקודות כחולות); מספר הנקודות צריך להיות 21 בסך הכל.
- ממלאים את צלחת תרבות התא עם 1.2 מ"ל של המדיום תרבות חדשה. מניחים את התרבות dIsh על צלחת חמה על 37 מעלות צלזיוס, הכנס תרמית בסדר (200 מיקרומטר בקוטר) לתוך החור בצד, ומניחים קצה רגיש שלה על מיקום מסומן להימדד.
- ללבוש משקפי מגן. הפעל את הלייזר תוליום באופן ידני להגדיר את הכוח (בין 0 ל 20 W, ב 0.1-W במרווחים) של לייזר לתכנן.
הערה: עבור כיול טמפרטורה, מדידות עם הספק במרווחים של 3W צריך להיות מספיק. - הפעל את פלטפורמת תכנון המערכת ולחץ על הלחצן "התחל טמפ. רכישה" (קובץ משלים) כדי להתחיל את מדידת הטמפרטורה.
- בצע את הנוהל כמו בשלב 2.2.6.
הערה: תוכנית הבקרה מודדת את טמפרטורת הצינור המותקן בכל 100 אלפיות השנייה ומראה את התקדמות הטמפרטורה במהלך ההקרנה בממשק הגרפי. - בצע פעולות אלה עבור כל 21 נקודות המדידה ובגדרות צריכת חשמל שונות. חזור על התהליך כולו שלוש פעמים עבור כל נקודות עבור כל כוח settinGs כדי להשיג נתונים אמינים.
- ייצוא נתוני טמפרטורה כמו נתוני csv, אשר בסופו של דבר ניתן להמיר לגיליון אלקטרוני. ממוצע הטמפרטורה המקסימלית בסוף הקרנה למדידות בשלושה עותקים בכל נקודה. ממוצע הערכים מנקודות על אותו מעגל (4 נקודות בסך הכל, למעט הנקודה המרכזית).
- קנו את הטמפרטורה המקסימלית הממוצעת על הגרף, מה שהופך את המרחק ממרכז המנה (מ"מ) כמו ציר x ואת עליית הטמפרטורה (ΔT, C °) כמו ציר y. השתמש בפונקציית ההתאמה של תוכנה מתמטית שתתאים למודל גאוס לנתונים הגולמיים. יצירת הפצה טמפרטורה להתאים גאוס.

איור 2: הנקודות לכיול טמפרטורה בתרבות אחת תא תרבות. נתוני הטמפרטורה נמדדו במרכז ובגיל 5נקודות רדיאלי מעל 4 זוויות שונות (נקודות כחולות). אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
3. הערכות ביולוגיות עבור תגובות תאים לאחר אירי תרמי שונים
- הערכה של הכדאיות התא ( כלומר, חיים, אפופטוטיים, מת) בעקבות הגדרות כוח שונות וקביעת סף המוות התא
- בנקודות הזמן שצוינו ( כלומר, 3, 24, ו 48 שעות לאחר הקרנה), לשטוף את התאים עם PBS (-) ולהשתמש בערכה זמין מסחרית להעריך כדאיות התא ( כלומר, חיוני, אפופטוטי, מת) פרוטוקול.
- הכן פתרון מכתים על ידי הוספת 5 μL של isothiocyanate פלואורסצין (FITC) -annexin V, 5 μL של ethidium homodimer III, ו 5 μL של Hoechst 33342 100 μL של חיץ 1x מחייב (כל ערכתרכיבים). הכן פתרון מכתים מספיק כדי לכסות את התאים. דגירה התאים במשך 15 דקות.
- שטפו את התרבות התא עם חיץ מחייב פעמיים, להחליף את חיץ מחייב עם PBS (-), ולהגדיר את התרבות על הבמה של מיקרוסקופ פלואורסצנטי.
- החלף את הנתיב האור אל העדשה העין, בחר את 4 ', 6-Diamidin-2-phenylindol (DAPI) מסנן, להדליק את האור תאורה, ולמצוא את המטוס ממוקדת עם המטרה 4x.
- לשנות את הנתיב האור אל המצלמה, למצוא את התמונה על מסך המחשב של תוכנת הדמיה מיקרוסקופ, ולהתאים את המיקוד.
- השתמש בפונקציה תפר ( כלומר, את הפונקציה כדי להקליט מספר תמונות על פני המנה ולאחר מכן ליצור תמונה אחת גדולה) של התוכנה ספציפית מיקרוסקופ כדי לקבל את התמונה הקרינה של צלחת התרבות כולה התא. השתמש 3 ערכות מסנן שונים, DAPI, FITC, ו tetramethylrhodamine (TRITC) לתמונה Hoechst 33342 תאים חיוביים (כל גרעיני התא), FITC-Annexin V-positiתאים ותאים (אפופטוטיים), ותאי ה- ethidium homodimer III חיובי (מת), בהתאמה.
- למדוד את רדיוס (מ"מ) של המת (ethidium homodimer III חיובי) האזור ואת רדיוס החיצוני / הפנימי של אפופטוטיים (Annexin V חיובי) הלהקה טופס באזור בתרביות תאים מוכתמים. החל רדיוס זה על הפונקציה גאוס מצויד של הפצה הטמפרטורה עבור הגדרת הכוח המקביל. חישוב הטמפרטורה המדויקת בשולי האזור מת או אפופטוטיים כדי להבהיר את טמפרטורות הסף למוות התא שינוי אפופטוטי.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
חלוקת טמפרטורה לאחר הגדרות צריכת חשמל שונות
כל ההתפתחויות טמפרטורה עבור כל הקרנה אחת היו פיקוח בכיול הטמפרטורה. מנתונים אלה, הטמפרטורה המקסימלית בנקודה הנמדדת הושגה ומוגדרת כ- T max (° C). כפי שמוצג בתרשים 3A , התוכנית בוצעה בנקודת זמן כאשר צלחת התרבות הונח על צלחת החימום. לאחר 140 "זמן לחימום מראש 1", אשר היה צורך ארכיון בטמפרטורה בינונית יציבה על 37 מעלות צלזיוס, העטיפה של צלחת התרבות הוסר במהלך 8 "זמן חימום מראש 2." בסוף "זמן חימום מראש 2", פליטת לייזר החלה באופן אוטומטי. עקומה זו היא התקדמות הטמפרטורה נציג עבור הקרנה 10 של. במהלך ההקרנה, הטמפרטורה עלתה, ומיד לאחר פליטת לייזר היהכבוי, הטמפרטורה החלה לרדת. הטמפרטורה המקסימלית במרכז צלחת התרבות הוגדרה במחקר זה כ T מקס (C °). מקס T היה יחסי כוח לייזר ( איור 3 ב ). איור 3C מציג את התפלגות הטמפרטורה המקסימלית עבור כל כוח על פני צלחת התרבות. ההפצות הן בצורת פעמון, כפי שמוצג באיור 3 ג , ומתאימות לתפקוד גאוס על פי הנוסחה הבאה:
T (r) = בסיס t + A · 
כאשר r, t בסיס , A, ו w לעמוד במרחק מהמרכז (מ"מ), הטמפרטורה הנמוכה ביותר עבור העקומה, משרעת, ואת רוחב העקום, בהתאמה. הפרמטרים (t הבסיס , A, ו- w) של G מצוידעקומה אווסית עבור כל הגדרה כוח, כלומר עבור כל T מקס , מוצגים בטבלה ליד התרשים.
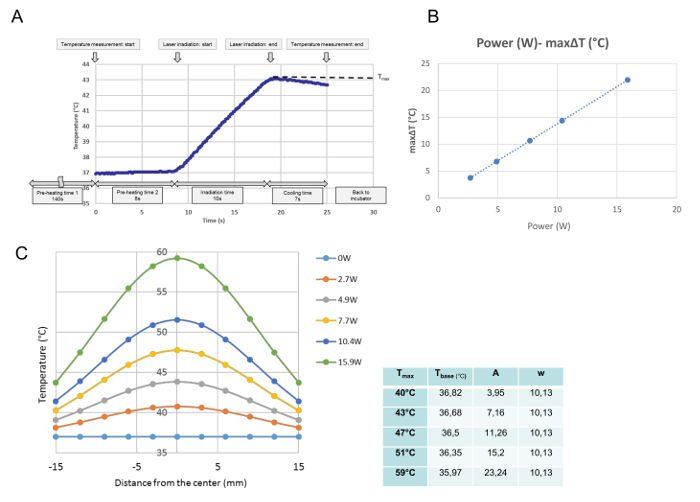
איור 3: נתוני כיול טמפרטורה. טמפרטורת התפתחות נציג בעמדה המרכזית לאחר הקרנה יחידה ב -4.9 W (T max = 43 ° C) ( A ), היחס היחסי בין כוח הלייזר לבין Maximal ΔT במיקום המרכזי של תרבות תאים ( B ), ו חלוקת טמפרטורות מעבר לצלחת תרבות לאחר הגדרות כוח שונות (C). (א) התוכנית מבוצעת מנקודת הזמן שבה צלחת התרבות ממוקמת על צלחת החימום. לאחר 140 של "זמן חימום מראש 1", אשר נדרש ארכיון טמפרטורה בינונית יציבה על 37 מעלות צלזיוס, את הכיסוי של צלחת תרבות מוסר עבור 8-S "זמן חימום מראש2. "בסוף" חימום טרום זמן 2 ", פליטת הלייזר מתחילה באופן אוטומטי, עקומה זו היא התקדמות טמפרטורת נציג במיקום המרכזי במהלך קרינה של 10 שניות ב 4.9 W. במהלך ההקרנה, הטמפרטורה עולה, מיד לאחר פליטת הלייזר מכובה, הטמפרטורה מתחילה לרדת, הטמפרטורה המקסימלית מתקבלת בסוף ההקרנה, המוגדרת במחקר זה כ T מקס (° C). (ב) כוח הלייזר ואת מקסימלית (ΔT max ) הם פרופורציונליים (ג) הפונקציות הגאוסיות המותאמות של התפלגות הטמפרטורה הנמדדת על פני צלחת התרבות הפרמטרים של הפונקציות, שנקבעו עם תוכנה מתמטית, מוצגים בטבלה שבצד התרשים אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
הכדאיות התא לאחר הקרנה תרמית
כפי שמוצג בתרשים 4A , ישנם שלושה דפוסים שונים מכתים המציין כדאיות התא לאחר הקרנת לייזר: 1) לא Annexin V / ethidium homodimer III חיובי ( כלומר, רק לחיות), 2) Annexin V חיובי במרכז ( כלומר, כמעט רק אפופטוזיס מוקדם), 3) ethidium homodimer III חיובי במרכז ( כלומר, תאים מתים) מוקף תאים אפופטוטיים על הגבול בין תאים מתים חיים ( איור 4 ב ). גודלו של אזור מת / אפופטוטי הוא בדרך כלל תלוי T מקס ואת זמן שלאחר קרינה עד 48 שעות לאחר הקרנה. לא ניכר שינוי הכדאיות זוהה התרבויות מוקרן עם מקסימום t ≤43 ° C. שינוי אפופטוטי רק ניתן לצפות בנקודת זמן מוקדמת (3 שעות), ואחריו מאוחר מוות של תאים לאחר הקרנה עם מקסימום T = 47 ° C. מוות מוקדם או מוקדם של התא (עד 3 שעות) נמצא בתרבויות מוקרן עם T מקס ≥ 51 ° C (טבלה 1).

איור 4: דפוס של מכתים קביעות לאחר הגדרות כוח שונות (א) ותמונה למופת על שפת המתים ואזור אפופטוטי לאחר Irradiations לייזר קטלני (B).
(א) שלוש תבניות של מכתים יכול להתרחש, בהתאם לטמפרטורה. (ב) אזור אפופטוטי (FITC-Annexin V חיובי: ירוק) סביב אזור מת (ethidium homodimer III חיובי: אדום). כל התאים חיוביים עבור Hoechst 33342 (כחול), ואת התאים עם גרעינים כחולים הם תאים חיים. התמונה צולמה 24 שעות לאחר הקרנה ב מקסימום 59 מעלות צלסיוס. בר = 100 מיקרומטר./ אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו. "Target =" _ blank "

טבלה 1: נספיין V והאידידיום הומידימר 3 תגובות בטמפרטורות שונות ובזמנים שונים.
קביעת טמפרטורת הסף למוות התא
רדיוס הממוצע של השטח המת (אדום) והאזור האפופטוטי (ירוק) נמדדו והוחלו על הפונקציה גאוס של חלוקת הטמפרטורה כדי לקבוע את הטמפרטורות שיא הסף למוות תאים אפופטוזיס לאחר 10 של הקרנה. על פי ניתוח זה, הטמפרטורות הממוצעות של סף המוות השלמות של התא 3 שעות, 24 שעות ו -48 שעות לאחר ההקרנה היו 54.0 מעלות צלזיוס, 50.9 מעלות צלזיוס ו- 50.1 מעלות צלזיוס, בהתאמה. הטרש הממוצעטמפרטורה ld לשינוי התא אפופטוטיים היו נמוכים יותר על ידי כ 2 - 3 מעלות צלזיוס, עם טמפרטורות סף במשך 3 שעות, 24 שעות ו 48 שעות ב 51.7 מעלות צלזיוס, 48.0 מעלות צלזיוס, ו 47.0 מעלות צלזיוס, בהתאמה ( איור 5 ).
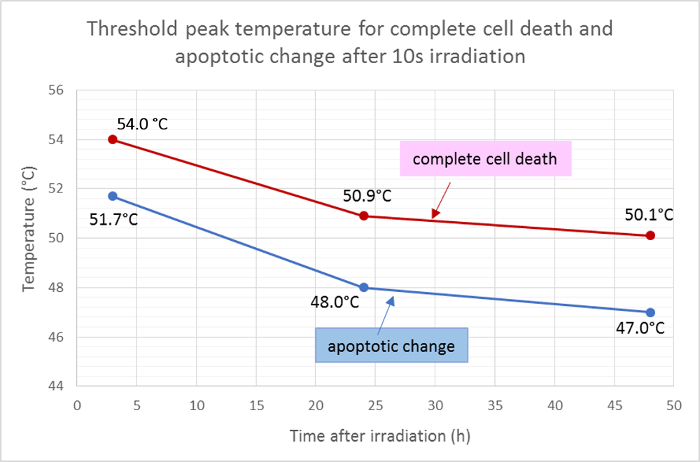
איור 5: טמפרטורות סף אפופטוזיס ומוות Cell.
טמפרטורות הסף הממוצעת למוות התא השלילי (חיובי עבור Hoechst 33342, Annexin V, ואת ethidium homodimer III) ועל אפופטוזיס (חיובי רק עבור Hoechst 33342 ו Annexin V) בנקודות זמן שונות לאחר הקרנה, מחושב על ידי התוצאות של מכתים הקרינה מכתים . אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
בהתייחסות לתגובות תאולוגיות ביולוגיות הקשורות לטמפרטורה, לא רק הטמפרטורה, אלא גם משך הזמן של הטמפרטורה המוגברת, היא בעלת חשיבות, שכן רוב התהליכים הביוכימיים תלויים בזמן. במיוחד בתחום של היפרתרמיה המושרה בלייזר ברפואת עיניים, בשל טווח הזמן הקצר - בין אלפיות השנייה לשניות - קשה לחקור תופעות תרמיות תאיות עם בקרת טמפרטורה מדויקת. לכן, תוכנית הקרנה בלייזר מתאים למודל התרבות התא, עם מערכת הפעלה המאפשרת בקרת טמפרטורה קפדנית זמן שליטה. ההערכה הביולוגית של תגובות התא לאחר חשיפה תרמית, כגון ביטוי חלבון או הפרשת, דורש הערכות כמותיות חוזרות ונשנות על מספר מספיק של תאים מושפעים. זה היה מכשול ללימודים באמצעות כתמי לייזר כמה מאות מיקרומטר בקוטר, כמו בטיפולים קליניים. ניתוח כמותי בנקודה אחת לייזר הוא די buארדנסום. במחקר זה נעשו ניסיונות להגשים את הדרישות הללו ככל האפשר. באמצעות 1.94 מיקרומטר אורך גל גל רציף תוליום עם תוכנית בקרת הקרנה, עלייה טמפרטורת הזמן יכול להתנהל בתרבות תאים שלמה בתוך פרק זמן קצר. מאז חלוקת הטמפרטורה עשוי להיות מותאם על ידי שינוי נתיב האור, סוגים שונים של ניסויים הקשורים היפרתרמיה יכול להתבצע באמצעות התקנה זו.
המגבלה של הטכניקה המוצגת היא חוסר האפשרות לבצע מדידות טמפרטורה בו זמנית במהלך הקרנה בלייזר של התאים. מאז השימוש בצמדים תרמיים אינו מתאים תרבויות תאים מעוקרים, כיול טמפרטורה חייב להתבצע בנפרד הקרנה תא. בהתחשב בשינויים אפשריים בתפוקת הלייזר, מדידות טמפרטורה בזמן אמת במהלך כל הקרנה בלייזר יהיו אידיאליות להערכה ישירה של תגובות תאמינון תרמי. יתר על כן, התפלגות הטמפרטורה בשימוש כאן נוצר באמצעות אינטרפולציה נתונים המבוססים על מדידות ב 21 נקודות על צלחת תרבות בכמה הגדרות צריכת חשמל שונים. לכן, כדי להתגבר על מגבלות אלה ונקודות קריטיות, היא המטרה שלנו לפתח שיטה חלופית המאפשרת למדידת הטמפרטורה של צלחת תרבות בזמן הקרנת לייזר מתבצע. אנו גם שואפים להשיג את המידע הטמפרטורה מרחבית בבת אחת. הדמיה אינפרא אדום (תרמוגרפיה) היא שיטה אחת אפשרית למדוד את הטמפרטורה במהלך קרינה בלייזר 10 . היתרון הגדול של שיטה זו הוא מדידת הטמפרטורה בזמן אמת ברמה התאית עבור כל הקרנה; התגובות הביולוגיות הבאות תא תמיד יכול להיות בנפרד לעומת ההיסטוריה הטמפרטורה במהלך הקרנה. בהתחשב עלות יעילות ושימושיות, עם זאת, באמצעות תרמוגרפיה עבור ניסויים חימום התא אינו אפשרי עבור כל workatאורי.
בשיטה באמצעות לייזר thulium באורך גל של 1.94 מיקרומטר, המים בצלחת תרבות התא מחומם על פני השטח שלו, דיפוזיה תרמית הסעה משמשים לחמם את התאים. גובה המדיום התרבותי בתצורת ההקרנה, עם 1.2 מ"ל של המדיום התרבותי, הוא 935 מיקרומטר במיקום המרכזי (ממדידה קודמת באמצעות טומוגרפיית קוהרנטיות אופטית). רמת הקליטה של הליום תוליום במים גבוהה מאוד (מקדם הקליטה: 127 ס"מ -1 ב 35 ° C), ו 72% של האור נספג ב 100 מיקרומטר הראשון של המדיום התרבות. אין כמעט ספיגה (0.0007%) בעומק של 935 מיקרומטר.
חשוב לציין כי אחת הנקודות הקריטיות בפרוטוקול היא להוסיף את אותה כמות של בינוני (1,200 μL) עבור כל הקרנה. שימוש בכמויות שונות של המדיום התרבות עשוי להוביל להבדלים גובה, אשר עלול לגרום להבדלים הטמפרטורה אניNcrease של התאים. הנקודה הקריטית השנייה מתייחסת לעיתוי פתיחת צלחת התרבות. זה חייב להיעשות באותו זמן - במחקר זה, 8 s לפני תחילת ההקרנה, כאשר המערכת משמיעה קול. הבדלים בעיתוי זה עשויים להשתנות את טמפרטורת הבסיס בשל הקירור הנגרם על ידי האוויר הסובב (כ 23 ° C). זה יכול להוביל להבדלים משמעותיים בטמפרטורת לייזר המושרה.
עבור כיול טמפרטורה, אותה כמות של מדיום (1.2 מ"ל) ששימש בניסויים שימש למדוד את התפלגות הטמפרטורה בתחתית של מנות תרבות ללא תאים. עם זאת, גובה בינוני עם monolayer התא עשוי להיות שונה מזו ללא תאים, אפילו עם נפח זהה של בינוני הוסיף. המדידה באמצעות טומוגרפיה קוהרנטית אופטי גילה כי יש הבדל 58 מיקרון במיקום המרכזי בין מנות עם וללא monolayer תא ומחוברות (877 מיקרומטר ללא תאים, לעומתO 935 מיקרומטר עם תאים). הבדל זה הוא פוטנציאלי בשל פעילות נימית של התאים. ההבדל 58 מיקרומטר גובה במיקום המרכזי עלול להיגרם על ידי כ 40 μL של המדיום (נתונים נמדדים). זה היה גם אישר כי הבדל זה גובה לא לגרום הבדלים משמעותיים ב מקס בכל הגדרות החשמל. לפיכך, הגענו למסקנה כי הבדל זה אינו משפיע באופן משמעותי על תוצאות הניתוחים שנעשו במחקר זה. עם זאת, כדי לאסוף מידע טמפרטורה מדויקת יותר, כפי שצוין לעיל, שיטה לכייל את הטמפרטורה באמצעות צלחת תרבות התא המכיל monolayer התא צריך להיות מפותח. יתר על כן, מודלים מתמטיים של דיפוזיה תרמית הסעה במדיום התרבות כולה נדרשת גם.
במחקר זה, התאים היו מחוממים עם הפצה טמפרטורה גאוס. ישנן מספר שיטות אפשריות כדי לחמם את המדיום כולו בצורה אחידה לאורך זמן. אחד היא להשתמש במקור לייזר עם מקדם ספיגה נמוך יותר במים. עם זאת, החיסרון הוא, כי במקרה זה, לייזרים חייב להיות בעל כוח גבוה יותר, שכן רק אחוז קטן של האור נספג מעל 0.9 מ"מ. אפשרות נוספת היא דימוי קצה סיב דיסטלי של סיב אופטי multimode המעביר את אור הלייזר לתוך המטוס של צלחת התרבות; את ההגדלה ניתן לבחור באופן שרירותי על ידי אופטיקה.
הדגש השני של פרוטוקול זה הוא היכולת לקבוע את טמפרטורת הסף למוות תאים אפופטוזיס באמצעות התמונה ניאון של מכתים הכדאיות ואת חלוקת הטמפרטורה לרוחב. מטרה ארוכת טווח היא לא רק כדי לקבוע את הכדאיות התא, אלא גם כדי להבהיר את טווח הטמפרטורות לתגובות ביולוגיות התא הקשורים לתפקוד התא, כגון ביטוי חלבון התפשטות תאים. קביעת הטמפרטורה סף המוות התא הוא עניין רב לחוקריםבעזרת שיטה זו ניתן לקבוע את הגורמים הקריטיים למוות של תאים, כולל אפופטוזיס.גורמים קריטיים למוות תרמי באמצעות לייזר תרמי עשויים להיקבע לא רק באמצעות ההיסטוריה הטמפרטורה, אלא גם באמצעות הגורמים האנדוגניים ( כלומר גורמים אינטרה / חוץ-תאיים ברמה המולקולרית) .תשובה לשאלות אלו עשויה לסלול את הדרך להבנת מנגנוני מוות של תאים וקינטיקה לאחר חשיפות תרמיות שונות ובפתולוגיות רשתיות שונות, כמו כן, היא יכולה לסייע בהבהרת נושאים קליניים, כגון ההבדל בין הפרט בתגובה לטיפול בלייזר או השתנות בגודל הצלקת לאחר צילום פוטוגרפי של הרשתית, גם כאשר גודל הנקודה ההתחלתית היה כמעט זהה ("זחילה אטרופית").
המטרה הסופית של מחקר זה היא לסייע בפיתוח טיפולי photothermal טמפרטורה מבוקרת של הרשתית. כדי להשיג זאת, במקבילה התקדמות הטכנית של המדידה טמפרטורה 3 , הבהרה נוספת של התנהגות התא RPE לאחר חשיפה תרמית, נקבע באמצעות שיטה זו, יהיה תועלת רבה.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
למחברים אין מה לגלות.
Acknowledgments
עבודה זו נתמכה על ידי מענק מחקר של משרד החינוך הגרמני הפדרלי לחקר ומחקר (BMBF) (מענק # 13GW0043C) וכן משרד אירופי של מחקר ופיתוח חלל (EOARD, מענק # FA9550-15-1-0443)
Materials
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Dulbecco’s Modified Eagle’s Medium - high glucose | Sigma-Aldrich | D5796-500ML | Add (2)-(4) before use. Warm in 37 °C water bath before use. |
| Antibiotic Antimycotic Solution (100 ×) | Sigma-Aldrich | A5955-100ML | Containing 10,000 units penicillin, 10 mg streptomycin and 25 μg Amphotericin B in 1mL. Add 5.5 mL in 500 mL medium bottle (1) before use. |
| Sodium pyruvate (100 mM) | Sigma-Aldrich | S8636-100ML | Add 5.5 mL in 500 mL medium bottle (1) before use (final concentration: 1 mM) |
| Porcine serum | Sigma-Aldrich | 12736C-500ML | Add 50 mL in 500 mL medium bottole (1) before use (final: 10%) |
| Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537-500ML | |
| Trypsin from porcine pancreas | Sigma-Aldrich | T4799-25G | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | ED-100G | |
| Human VEGF Quantikine ELISA Kit | R&D System | DVE00 | |
| Oxiselect Total Glutathione Assay Kit | Cell Biolabs, Inc | STA-312 | |
| Apoptotic/Necrotic/Healthy Cells Detection Kit | PromoKine | PK-CA707-30018 | |
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Thulium laser | Starmedtec GmbH | Prototype | 0-20 W |
| 365 mm core diameter fiber | LASER COMPONENTS Germany | CF01493-52 | |
| Thermocouple | Omega Engineering Inc | HYP-0- 33-1-T-G-60-SMPW-M | |
| Heating plate | MEDAX | ||
| Microplate reader (spectrofluorometer) | Molecular Device | Spectramax M4 | |
| cell homogenizer | QIAGEN | TissueLyser LT | |
| Fluorescence microscope | Nikon | ECLIPSE Ti | |
| mathematical software program | The Mathworks. Inc | MATLAB Release 2015b | |
| system-design platform | National Instrument | Labview | Laboratory Virtual Instrument Engineering Workbench |
References
- Inagaki, K., et al. Comparative efficacy of pure yellow (577-nm) and 810-nm subthreshold micropulse laser photocoagulation combined with yellow (561-577-nm) direct photocoagulation for diabetic macular edema. Jpn J Ophthalmol. 59 (1), 21-28 (2015).
- Roider, J., et al. Selective retina therapy (SRT) for clinically significant diabetic macular edema. Graefes Arch Clin Exp Ophthalmol. 248 (9), 1263-1272 (2010).
- Brinkmann, R., et al. Real-time temperature determination during retinal photocoagulation on patients. J Biomed Opt. 17 (6), 061219 (2012).
- Yoshimura, N., et al. Photocoagulated human retinal pigment epithelial cells produce an inhibitor of vascular endothelial cell proliferation. Invest Ophthalmol Vis Sci. 36 (8), 1686-1691 (1995).
- Denton, M. L., et al. Damage Thresholds for Exposure to NIR and Blue Lasers in an In Vitro RPE Cell System. Invest Ophthalmol Vis Sci. 47 (7), 3065-3073 (2006).
- Shrestha, R., Choi, T. Y., Chang, W., Kim, D. A high-precision micropipette sensor for cellular-level real-time thermal characterization. Sensors (Basel). 11 (9), 8826-8835 (2011).
- Gao, F., Ye, Y., Zhang, Y., Yang, J. Water bath hyperthermia reduces stemness of colon cancer cells. Clin Biochem. 46 (16-17), 1747-1750 (2013).
- Jansen, E. D., van Leeuwen, T. G., Motamedi, M., Borst, C., Welch, A. J. Temperature dependence of the absorption coefficient of water for midinfrared laser radiation. Lasers Surg Med. 14 (3), 258-268 (1994).
- Iwami, H., Pruessner, J., Shiraki, K., Brinkmann, R., Miura, Y. Protective effect of a laser-induced sub-lethal temperature rise on RPE cells from oxidative stress. Exp Eye Res. 124, 37-47 (2014).
- Denton, M. L., et al. Spatially correlated microthermography maps threshold temperature in laser-induced damage. J Biomed Optics. 16 (3), (2011).
- Morgan, C. M., Schatz, H. Atrophic creep of the retinal pigment epithelium after focal macular photocoagulation. Ophthalmology. 96 (1), 96-103 (1989).



