Summary
Une configuration expérimentale originale pour le chauffage des cellules dans un plat de culture utilisant un rayonnement laser à onde continue de 1,94 μm est présentée ici. En utilisant cette méthode, les réponses biologiques des cellules épithéliales du pigment rétinien (RPE) après différentes expositions thermiques peuvent être étudiées.
Abstract
Une méthode originale pour chauffer des cellules cultivées à l'aide d'un laser à thulium à ondes continues de 1,94 μm pour une évaluation biologique est présentée ici. Le rayonnement laser Thulium est fortement absorbé par l'eau, et les cellules au fond du plat de culture sont chauffées par diffusion thermique. Une fibre laser avec un diamètre de 365 μm est réglée à environ 12 cm au-dessus du plat de culture, sans aucune optique, de sorte que le diamètre du faisceau laser soit presque équivalent au diamètre intérieur du plat de culture (30 mm). En conservant une quantité constante de milieu de culture dans chaque expérience, il est possible d'irradier les cellules avec une augmentation de température hautement reproductible.
Pour étalonner l'augmentation de la température et sa distribution dans un plat de culture cellulaire pour chaque réglage de puissance, la température a été mesurée pendant 10 s d'irradiation à différentes positions et au niveau cellulaire. La distribution de la température a été représentée à l'aide d'un logiciel graphique mathématiqueProgramme, et son modèle à travers le plat de la culture était sous forme gaussienne. Après l'irradiation au laser, différentes expériences biologiques pourraient être effectuées pour évaluer les réponses cellulaires dépendantes de la température. Dans ce manuscrit, la coloration de la viabilité ( c'est-à-dire la distinction des cellules vivantes, apoptotiques et mortes) est introduite pour déterminer les températures de seuil pour l'apoptose cellulaire et la mort après différents moments.
Les avantages de cette méthode sont la précision de la température et du temps de chauffage, ainsi que son efficacité élevée dans les cellules de chauffage dans un plat de culture de cellules entières. En outre, il permet d'étudier avec une grande variété de températures et de durées de temps, qui peuvent être bien contrôlés par un système d'exploitation informatisé.
Introduction
Comprendre les réponses biologiques cellulaires dépendantes de la température est d'une grande importance pour les traitements hyperthermia réussis. La photocoagulation au laser rétinienne avec un laser thermique, utilisé en ophtalmologie, est l'un des traitements laser les plus établis en médecine. La lumière visible, principalement de la longueur d'onde verte à jaune, est utilisée dans le traitement au laser de la rétine. La lumière est fortement absorbée par la mélanine dans les cellules épithéliales du pigment rétinien (RPE), qui forment la monocouche cellulaire la plus externe de la rétine. Les médecins et les chercheurs s'intéressent récemment à une irradiation thermique très douce (photocoagulation sous-visible) comme nouvelle stratégie thérapeutique pour différents types de troubles rétiniens 1 , 2 . À la suite de cette tendance, notre intérêt est de subalternément chauffer les cellules RPE sous un contrôle précis de la température, une technique appelée traitement photothermique à température contrôlée (TC-PTT).
Option récenteLa technologie acoustique de notre institut a permis la mesure en temps réel des augmentations de température dans les sites irradiés de la rétine. Cela permet de contrôler l'augmentation de la température pendant l'irradiation 3 . Cependant, étant donné que l'hyperthermie sous-létale sur la rétine, causée par le chauffage de cellules RPE sous-létalement, n'a pas été considérée auparavant en raison de l'impossibilité de mesurer et de contrôler la température, les réponses cellulaires dépendant de la température des cellules RPE suite à une irradiation laser thermique Ont été étudiés très peu à ce jour. En outre, non seulement la différence de température n'a pas été discutée en détail, mais aussi la différence dans le comportement cellulaire des cellules survivantes après une irradiation sub-létale et mortelle. Par conséquent, pour recueillir des preuves scientifiques sur les traitements basés sur TC-PTT, nous cherchons à élucider les réponses biologiques des cellules RPE dépendantes de la température et leurs mécanismes en utilisant des configurations expérimentales in vitro .
Pour tIl est nécessaire d'établir une installation de chauffage cellulaire répondant aux conditions suivantes: 1) une possibilité pour une augmentation rapide de la température, 2) un temps et une température précisément contrôlés, et 3) un nombre relativement élevé de cellules examinées pour des expériences biologiques . En ce qui concerne la méthode de chauffage, un laser clinique, tel qu'un laser Nd.YAG à fréquence double (532 nm), n'est malheureusement pas adapté au chauffage de la culture cellulaire. Ceci est dû au nombre fortement réduit de mélanosomes dans les cellules RPE cultivées. L'absorption de la lumière laser peut être inhomogène, et la température augmente au niveau cellulaire est variable entre les expériences, même lorsqu'elles sont irradiées avec une même puissance de rayonnement. Plusieurs études précédentes ont rapporté l'utilisation de papier noir sous le fond du plat pendant l'irradiation 4 ou l'utilisation de mélanosomes supplémentaires qui sont phagocytisés par les cellules de culture avant les expériences 5 , 6 . Un grand nombre deLes études biologiques in vitro pour évaluer les réponses cellulaires induites par l'hyperthermie ont été effectuées à l'aide d'une plaque chauffante, d'un bain-marie ou d'un incubateur de CO 2 avec un réglage de température 7 . Ces méthodes nécessitent une longue période de chauffage car cela prend du temps ( c'est-à-dire plusieurs minutes) pour atteindre la température souhaitée. En outre, en utilisant ces méthodes, il est difficile d'obtenir un historique thermique détaillé ( c'est-à-dire une température multipliée par le temps) au niveau cellulaire. En outre, la température entre les cellules à différentes positions dans un plat de culture peut différer en raison de la diffusion variable de la température. Dans la plupart des cas, cette information de température temporelle et spatiale pendant l'hyperthermie n'a pas été prise en considération pour les analyses biologiques, même si la réponse biologique des cellules peut être affectée de manière critique par la température et la durée de la température augmentée.
Pour surmonter ces problèmes, un contiLe laser à thulium à ondes nuous a été utilisé ici pour chauffer les cellules. Le rayonnement laser Thulium (λ = 1,94 μm) est fortement absorbé par l'eau 8 et les cellules au fond du plat de culture sont stimulées thermiquement uniquement par diffusion thermique. La fibre laser avec un diamètre de 365 μm est réglée à environ 12 cm au-dessus du plat de culture, sans aucune optique entre les deux. Le diamètre du faisceau laser diverge de sorte qu'il soit presque équivalent au diamètre intérieur du plat de culture (30 mm) à la surface du milieu de culture. Avec une quantité constante de milieu de culture, il est possible d'irradier les cellules avec l'augmentation de température De haute répétabilité. Les réglages de puissance variables permettent une irradiation jusqu'à 20 W, et la température moyenne au niveau cellulaire peut être augmentée jusqu'à ΔT ≈ 26 ° C en 10 s.
En modifiant les conditions d'irradiation, il est également possible de modifier le profil du faisceau laser pour faire varier la distribution de la températureDans un plat culturel. Par exemple, il est possible d'étudier avec une répartition de la température Gaussienne, comme dans l'étude actuelle, ou avec une répartition homogène de la température. Ce dernier peut être avantageux pour étudier les effets des réponses cellulaires dépendantes de la température plus spécifiquement pour les augmentations de la température sous-létales, mais pas pour le stress de la mort cellulaire ou les réponses de guérison des plaies.
Au total, l'irradiation au laser Thulium peut permettre d'étudier différents types de facteurs biologiques, tels que l'expression génétique / protéique, la cinétique de la mort cellulaire, la prolifération cellulaire et le développement de la fonctionnalité cellulaire, après différentes expositions thermiques.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Culture Cellulaire RPE
- Isolation des cellules RPE des yeux porcins
- Obtenir des yeux de porc nouvellement énucléés de l'abattoir local. Gardez-les frais (4 ° C) et dans un environnement sombre.
- Retirer les tissus extracellulaires avec des ciseaux et tremper les yeux dans une solution antiseptique pendant 5 min.
- Placez les yeux dans une solution salée tamponnée au phosphate stérilisée sans calcium et magnésium (PBS (-)) jusqu'à l'utilisation.
- À l'aide d'un scalpel, pénétrer dans la sclérotique à environ 5 mm postérieure au limbo cornéen. Reposer toute la partie antérieure de l'œil en coupant avec des ciseaux tout au long du parallèle au limbo cornéen.
- Retirer la partie antérieure de l'œil ( c.-à-d. La cornée et la lentille) et le vitré. Ajouter 1 ml de PBS (-) et retirer doucement la rétine neurale.
REMARQUE: Cette «coupe-yeux», composée de la sclère, de la choroïde et du RPE, est maintenant prête. - Ajouter une trypsine préchauffée (37 ° C) 0,25% en PBS (-) à la coupe des yeux. Réglez le volume de manière à ce que près de 80% de la tache d'oeil soit remplie avec cette solution de trypsine.
- Incuber l'oeil avec la solution de trypsine dans un incubateur à 5% de CO 2 à 37 ° C pendant 10 min.
- Retirez la tache de l'oeuf de l'incubateur et remplacez la solution de trypsine à 0,25% par une solution de PBS (-) avec 0,05% de trypsine + 0,2% de sel de tétrasulfate d'acide éthylènediaminetétracétique (EDTA · 4N). Incuber l'oculaire dans l'incubateur pendant 45 minutes.
REMARQUE: après 45 min, les cellules RPE seront soit simplement attachées à la membrane de Bruch, soit déjà détachées et flottant dans la solution trypsine-EDTA. - Collectez les cellules RPE par pipetage doux. Recueillir les cellules et la solution dans un tube conique rempli de 10 ml de milieu de culture (DMEM haute glucose avec L-glutamine), y compris 10% de sérum de porc, antibiotique / antimycotique et pyruvate de sodium (1 mM).
NOTE: Le sérum peut neutraliser l'effet de la trypsine. - Centrifugez leSuspension cellulaire à 400 xg pendant 5 min à température ambiante.
- Retirer le surnageant et ajouter 10 ml de milieu frais. Centrifuger à nouveau dans les mêmes conditions pendant 5 min.
- Retirer le surnageant et ajouter un nouveau milieu, de telle sorte que la concentration de la cellule aboutit à 5 x 10 5 cellules / mL (déterminé en comptant les cellules en utilisant un hémocytomètre). Mélangez bien avec du pipetage doux.
- Distribuer la suspension cellulaire dans des boîtes de culture cellulaire. Utilisez 3 mL par plat de culture de 60 mm de diamètre.
NOTE: Cette culture s'appelle passage zéro (P0). - Maintenir les cellules dans un incubateur à 5% de CO 2 à 37 ° C. Changez la moitié du milieu conditionné au milieu frais tous les deux jours.
- Subculture (étape 1.2) si elle devient confluente.
- Sous-culture de la culture de cellules RPE
- Retirer le milieu de culture et rincer les cellules deux fois avec du PBS (-).
- Incuber les cellules avec une solution PBS (-) avec 0,05% de trypsine + 0,2% EDTA iNa 5% incubateur de CO 2 à 37 ° C pendant 5 min.
- Détachez les cellules RPE par pipetage doux et collectez la suspension cellulaire dans un tube conique rempli de 10 ml de milieu de culture, y compris 10% de sérum de porc.
- Centrifuger la suspension cellulaire à 400 xg pendant 5 minutes à température ambiante.
- Retirez le surnageant et ajoutez un nouveau milieu de culture, ce qui rend la concentration de cellules 5 x 10 5 cellules / mL (déterminée en comptant le nombre de cellules avec un hémocytomètre). Distribuer les cellules dans de nouvelles boîtes de culture de 60 mm de diamètre, comme décrit à l'étape 1.1.13.
NOTE: La culture cellulaire est maintenant le passage 1 (P1). - Une fois la confluence atteinte, subcotentez la culture P1 à P2, en utilisant la même procédure décrite aux étapes 1.2.1-1.2.5. À partir de la culture P2, semer les cellules sur des boîtes de culture plus petites (diamètre intérieur de 30 mm) au lieu de plats de culture de 60 mm de diamètre.
- Pour les expériences, utilisez des cultures P2 ou P3.
2. ThulIrradiation au laser ium
- Construction de la station d'irradiation
- Connectez un appareil à laser thulium (1,94 μm, gamme de puissance: 0 à 20 W) à une fibre de diamètre de noyau de 0,22-NA, 365 μm.
- Fixez mécaniquement la pointe de la fibre au bras métallique qui est fixé horizontalement au poteau métallique vertical de la station d'irradiation. Placez le poteau vertical de sorte que la pointe de la fibre laser soit située au-dessus de la plaque chauffante sur laquelle le plat de culture cellulaire doit être placé pendant l'irradiation.
- Posez un papier blanc sur la plaque chauffante et activez le faisceau de visée (λ = 635 nm, max = 1 mW, diamètre au niveau du papier ≈ 30 mm). Marquez la circonférence du faisceau de visée sur le papier blanc de manière à ce que la position où le plat de culture soit placé pendant l'irradiation soit connue.
REMARQUE: Le plan z de la pointe de la fibre peut être modifiable. Sans aucune optique d'imagerie supplémentaire, le diamètre du spot laser sur le plan de culture cellulaire, placé à 12 cm sous la pointe de la fibre, iS environ 30 mm, ce qui est presque équivalent au diamètre intérieur du plat de culture cellulaire. Un schéma de la configuration est illustré à la figure 1 .

Figure 1: Image schématique de la station d'irradiation au laser Thulium. Un plat de culture est placé sur la plaque chauffante. Les cellules sont placées à 12 cm sous la pointe de la fibre laser de thulium, de sorte que la taille du faisceau est presque identique au diamètre intérieur du plat de culture (environ 30 mm). La procédure d'irradiation au laser est contrôlée par une routine contrôlée dans le temps de la plate-forme de conception de systèmes sur mesure. Le réglage de puissance doit être déterminé avant le démarrage du programme d'irradiation. Cliquez ici pour voir une version plus grande de ce chiffre.
- 1 heure avant l'irradiation, remplacez complètement le milieu de culture par 1,2 ml de milieu frais.
REMARQUE: Il s'agit d'une ÉTAPE CRITIQUE et doit être strictement suivie. - Placez la station d'irradiation ( c'est-à-dire la plaque chauffante et le poteau pour fixer la fibre laser) sur un banc propre.
- Retirez le plat de culture cellulaire de l'incubateur et placez-le sur la position marquée sur la plaque chauffante (étape 2.1.3).
- Portez des lunettes de protection. Allumez le laser Thulium. Réglez la puissance souhaitée sur le périphérique laser (réglable de 0 à 20 W). Activez l'émission.
- Démarrez une plate-forme de conception de système qui contrôle le rayonnement laser et le protocole de temporisation (fichier supplémentaire).
- Immédiatement après avoir placé le plat de culture sur la plaque chauffante, cliquez sur le "temps de préchauffage" pour démarrer la minuterie pendant 140 s ("temps de préchauffage 1"); Cela maintiendra la température du milieu de culture à 37 ° C avant l'irradiation.
REMARQUE: après 140 s, un bip sonore s'allume et la minuterie suivante ("temps de préchauffage 2") commencera à compter automatiquement 8 s. Au cours de ces 8 s, l'examinateur peut ouvrir le plat de culture. Après 148 s de préchauffage, une irradiation au laser de 10 s sur la culture cellulaire se déroulera automatiquement. En cas d'urgence, équiper le périphérique laser avec un bouton force-quit pour arrêter immédiatement le laser. Il s'agit d'une ÉTAPE CRITIQUE et doit être strictement suivie. Un point particulier de précaution concerne l'ouverture du couvercle avant l'irradiation, au début du temps de préchauffage de 8 s. L'ouverture du couvercle peut refroidir très rapidement la surface moyenne. - Après l'irradiation, placez immédiatement le couvercle sur le plat de culture, laissez le plat de culture sur la plaque chauffante pendant 7 s supplémentaires et remettez-la dans l'incubateur à 5% de CO 2 à 37 ° C.
- Faire de petits trous (environ 300 μm de diamètre) près du fond sur quatre côtés (tous les 90 °) d'un plat de culture de 30 mm de diamètre (sans cellules); Utilisez la pointe d'une aiguille (20G) chauffée avec un brûleur Bunsen. Sceller les trous avec un ruban d'isolation électrique de l'extérieur et faire un petit trou avec une aiguille fine de sorte que seul un thermocouple fin (200 μm de diamètre) puisse être inséré dans ce trou dans des conditions étanches.
- À l'extérieur du fond de la cuvette de culture, dessiner 2 diamètres perpendiculaires et régler le point de croisement ( c'est-à-dire le centre du côté inférieur) en tant que coordonnées zéro (0). Marquez tous les 3 mm radialement à l'extérieur du plat ( c.-à-d. 0, 3, 6, 9, 12 et 15 mm) dans chaque direction le long des lignes ( Figure 2 , points bleus); Le nombre de points devrait être de 21 au total.
- Remplir le plat de culture cellulaire avec 1,2 ml de nouveau milieu de culture. Placez la culture dIsh sur une plaque chauffante à 37 ° C, insérer un thermocouple fin (200 μm de diamètre) dans le trou latéral, et placer son extrémité sensible sur une position marquée à mesurer.
- Portez des lunettes de protection. Activez le laser Thulium et réglez manuellement la puissance (entre 0 et 20 W, par incréments de 0,1 W) du dispositif laser.
REMARQUE: Pour l'étalonnage de la température, les mesures avec la puissance par incréments de 3 W devraient être suffisantes. - Activez la plate-forme de conception du système et cliquez sur le bouton "Démarrer Temp. Acquisition" (fichier supplémentaire) pour commencer la mesure de la température.
- Effectuez la même procédure qu'à l'étape 2.2.6.
REMARQUE: Le programme de contrôle mesure la température du thermocouple inséré toutes les 100 ms et montre la progression de la température pendant l'irradiation dans l'interface graphique. - Effectuez ces procédures pour tous les 21 points de mesure et à différents paramètres d'alimentation. Répétez l'opération entière trois fois pour tous les points et pour toutes les configurations de puissanceGs pour obtenir des données fiables.
- Exporter les données de température en tant que données csv, qui peuvent éventuellement être converties en une feuille de calcul. Moyenne de la température maximale à la fin de l'irradiation pour les mesures en triple en tous points. Moyenne des valeurs des points sur le même cercle (4 points au total, sauf le point central).
- Tracez la température maximale moyenne obtenue sur un graphique, ce qui fait que la distance entre le centre du plat (mm) est l'axe des abscisses et l'augmentation de la température (ΔT, ° C) en tant qu'huscule y. Utilisez la fonction d'ajustement d'un logiciel mathématique pour adapter un modèle gaussien aux données brutes. Créez une distribution Gaussian de la température d'ajustement.

Figure 2: Les points pour l'étalonnage de la température dans un plat de culture cellulaire. Les données de température ont été mesurées au centre et à 5Points radiaux sur 4 angles différents (points bleus). Cliquez ici pour voir une version plus grande de ce chiffre.
3. Évaluations biologiques des réponses cellulaires après différentes irradiations thermiques
- Évaluation de la viabilité cellulaire ( c.-à-d. , Vivante, apoptotique et morte) suivant différents paramètres de puissance et la détermination du seuil de mort cellulaire
- Aux points de temps indiqués ( c.-à-d., 3, 24 et 48 h après l'irradiation), lavez les cellules avec PBS (-) et utilisez un kit disponible dans le commerce pour évaluer la viabilité cellulaire ( c'est-à-dire vital, apoptotique, mort) selon le fabricant protocole.
- Préparer une solution de coloration en ajoutant 5 μL d'isothiocyanate de fluorescéine (FITC) -annexine V, 5 μL d'homodimère III d'éthidium et 5 μL de Hoechst 33342 à 100 μL de 1x tampon de liaison (tous sont kitComposants). Préparez une solution de coloration suffisante pour couvrir les cellules. Incuber les cellules pendant 15 min.
- Laver la culture cellulaire avec le tampon de liaison deux fois, remplacer le tampon de liaison par PBS (-) et régler la culture sur le stade d'un microscope à fluorescence.
- Mettez le chemin de lumière vers la lentille oculaire, sélectionnez le filtre 4 ', 6-Diamidin-2-phénylindol (DAPI), allumez le voyant d'éclairage et trouvez le plan focalisé avec l'objectif 4x.
- Modifiez le chemin de l'éclairage vers l'appareil photo, trouvez l'image sur l'écran de l'ordinateur dans le logiciel d'imagerie du microscope et ajustez la mise au point.
- Utilisez la fonction de point ( c.-à-d., La fonction pour enregistrer plusieurs images dans le plat, puis créez une image unique et large) du logiciel spécifique au microscope pour obtenir l'image de fluorescence du plat de culture de cellules entière. Utilisez 3 ensembles de filtres différents - DAPI, FITC et tétraméthylrhodamine (TRITC) - pour l'image Hoechst 33342-cellules positives (tous les noyaux cellulaires), FITC-annexin V-positiCellules ve (cellules apoptotiques) et éthidium homodimère III (mortes), respectivement.
- Mesurez le rayon (mm) de la région morte (ethidium homodimer III-positive) et le rayon externe / interne de la région de forme de bande apoptotique (annexine V-positive) dans les cultures de cellules colorées. Appliquer ces rayons à la fonction gaussienne ajustée de la distribution de température pour le réglage de puissance correspondant. Calculez la température exacte à la jante de la région morte ou apoptotique pour clarifier les températures seuils pour la mort cellulaire et le changement apoptotique.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Distribution de la température après différents réglages d'alimentation
Tous les développements de la température pour chaque irradiation unique ont été surveillés dans l'étalonnage de la température. À partir de ces données, la température maximale au point mesuré a été obtenue et définie comme T max (° C). Comme le montre la figure 3A , le programme a été exécuté au moment où le plat de culture a été placé sur la plaque chauffante. Après le «temps de préchauffage 1» de 140 s, qui était nécessaire pour archiver une température moyenne stable à 37 ° C, le couvercle du plat de culture a été retiré pendant les 8 s «temps de préchauffage 2.» À la fin de "temps de préchauffage 2", l'émission laser a commencé automatiquement. Cette courbe est une progression de température représentative pour une irradiation de 10 s. Pendant l'irradiation, la température a augmenté, et immédiatement après l'émission laserDésactivé, la température a commencé à diminuer. La température maximale au centre du plat de culture a été définie dans cette étude sous la forme de T max (° C). Le T max était proportionnel à la puissance laser ( Figure 3B ). La figure 3C montre la répartition de la température maximale pour chaque puissance à travers le plat de culture. Les distributions sont en forme de cloche, comme le montre la figure 3C , et s'adaptent à une fonction gaussienne selon la formule suivante:
T (r) = t base + A · 
Où r, t base , A et w représentent la distance du centre (mm), la température la plus basse pour la courbe, l'amplitude et la largeur de la courbe, respectivement. Les paramètres ( base t, A et w) du G ajustéLa courbe aussienne pour chaque réglage de puissance, à savoir pour chaque T max , est indiquée dans le tableau à côté du graphique.
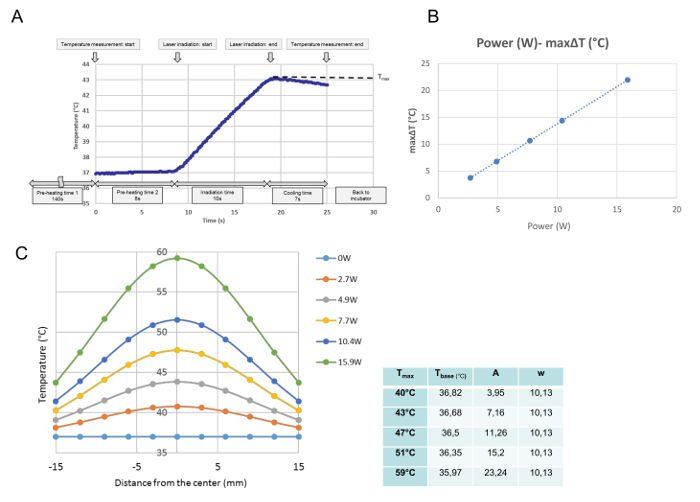
Figure 3: Données d'étalonnage de la température. Un développement de température représentatif à la position centrale après une irradiation unique à 4,9 W (T max = 43 ° C) ( A ), la relation proportionnelle entre la puissance laser et la ΔT maximale à la position centrale d'une culture cellulaire ( B ) Et les distributions de température à travers le plat de culture après différents réglages d'alimentation (C). (A) Le programme est exécuté à partir du moment où le plat de culture est placé sur la plaque chauffante. Après 140 s de "temps de préchauffage 1", nécessaire pour archiver une température moyenne stable à 37 ° C, le couvercle du plat de culture est retiré pour le temps de préchauffage de 8 s2. "À la fin du" temps de préchauffage 2 ", l'émission laser commence automatiquement. Cette courbe est une progression de température représentative en position centrale lors d'une irradiation de 10 s à 4,9 W. Pendant l'irradiation, la température augmente et Immédiatement après l'étection du laser, la température commence à diminuer. La température maximale est obtenue à la fin de l'irradiation, qui est définie dans cette étude comme T max (° C). (B) La puissance du laser et le maximum L'augmentation de la température (ΔT max ) est proportionnelle. (C) Les fonctions gaussiennes ajustées des distributions de température mesurées à travers le plat de culture. Les paramètres pour les fonctions, déterminés avec un logiciel mathématique, sont présentés dans le tableau à côté du graphique . Cliquez ici pour voir une version plus grande de cette figure.
Viabilité cellulaire après irradiation thermique
Comme le montre la figure 4A , il existe trois modèles de coloration différents indiquant la viabilité cellulaire après irradiation au laser: 1) pas d'annexine V / ethidium homodimère III-positif ( c. -à- d. Seulement en direct), 2) annexine V-positive au centre ( c.-à-d. Presque Seulement l'apoptose précoce) et 3) l'homodimère III d'éthidium positif au centre ( c.-à-d. Cellules mortes) entouré de cellules apoptotiques à la frontière entre les cellules mortes et les cellules vivantes ( figure 4B ). La taille de la zone mort / apoptotique dépend généralement de T max et du temps de post-irradiation jusqu'à 48 h après l'irradiation. Aucun changement de viabilité apparente n'a été détecté dans les cultures irradiées avec T max ≤43 ° C. Le seul changement apoptotique pourrait être observé à un stade précoce (3 h), suivi d'un retard Mort cellulaire après une irradiation avec T max = 47 ° C. La mort cellulaire immédiate ou prématurée (jusqu'à 3 h) a été trouvée dans les cultures irradiées avec T max ≥ 51 ° C (Tableau 1).

Figure 4: Modèle de coloration de la viabilité après différents réglages d'alimentation (A) et une image exemplaire à la limite de la zone morte et apoptotique après les irradiation laser létale (B).
(A) Trois modèles de coloration peuvent se produire, en fonction de la température. (B) La zone apoptotique (FITC-annexine V-positive: vert) autour de la zone morte (ethidium homodimer III-positif: rouge). Toutes les cellules sont positives pour Hoechst 33342 (bleu), et les cellules avec des noyaux bleus sont les cellules vivantes. L'image a été prise 24 h après une irradiation à T max = 59 ° C. Bar = 100 μm./files/ftp_upload/54326/54326fig4large.jpg "target =" _ blank "> Cliquez ici pour voir une version plus grande de cette figure.

Tableau 1: Réponses de l'annexine V et Ethidium Homodimer III à différentes températures et temps.
Détermination de la température seuil pour la mort cellulaire
Les rayons moyens de la zone morte (rouge) et la zone apoptotique (verte) ont été mesurés et appliqués à la fonction gaussienne de la distribution de la température pour déterminer les températures maximales de seuil pour la mort cellulaire et l'apoptose après 10 s d'irradiation. Selon cette analyse, les températures de seuil moyen pour la mort cellulaire complète 3 h, 24 h et 48 h après irradiation étaient respectivement de 54,0 ° C, 50,9 ° C et 50,1 ° C. Le thresho moyenLa température de ld pour le changement d'apoptotic cellulaire était inférieure d'environ 2 à 3 ° C, avec des températures de seuil de 3 h, 24 h et 48 h à 51,7 ° C, 48,0 ° C et 47,0 ° C respectivement ( figure 5 ).
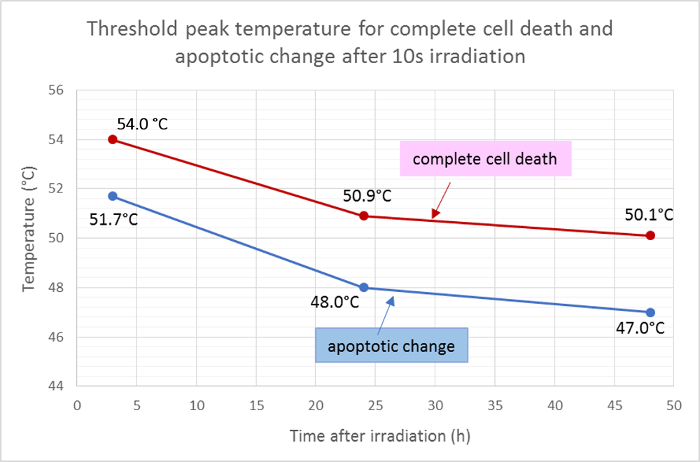
Figure 5: Températures seuil pour l'apoptose et la mort cellulaire.
Températures de seuil moyen pour la mort cellulaire complète (positive pour Hoechst 33342, annexine V et homodimère III d'éthidium) et pour l'apoptose (positive seulement pour Hoechst 33342 et annexine V) à des moments différents après l'irradiation, calculés à partir des résultats de la coloration de la viabilité de fluorescence . Cliquez ici pour voir une version plus grande de ce chiffre.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
En discutant des réponses cellulaires biologiques liées à la température, non seulement la température, mais aussi la durée de la température augmentée, est importante, car la plupart des processus biochimiques dépendent du temps. En particulier dans le domaine de l'hyperthermie induite par laser dans l'ophtalmologie, en raison de la courte période, de millisecondes à secondes, il est difficile d'étudier les effets thermiques cellulaires avec un contrôle précis de la température. Par conséquent, une installation d'irradiation au laser adaptée au modèle de culture cellulaire et à un système d'opération qui permet de contrôler strictement la température et le temps. L'évaluation biologique des réponses cellulaires après exposition thermique, telle que l'expression ou la sécrétion de protéines, nécessite des évaluations quantitatives répétées sur un nombre suffisant de cellules affectées. Cela a été un obstacle aux études utilisant des taches laser de plusieurs centaines de micromètres de diamètre, comme dans les traitements cliniques. L'analyse quantitative à un seul point laser est assez buRdensome. Dans cette étude, des tentatives ont été faites pour répondre à ces exigences autant que possible. En utilisant un laser thulium à onde continue à longueur d'onde de 1,94 μm avec un programme de contrôle d'irradiation, une élévation de température temporelle pourrait être effectuée dans une culture cellulaire entière dans un court intervalle de temps. Étant donné que la distribution de la température peut être ajustée en modifiant le chemin de la lumière, différents types d'expériences liées à l'hyperthermie peuvent être menées à l'aide de cette configuration.
La limitation de la technique présentée est l'impossibilité de réaliser des mesures simultanées de la température lors de l'irradiation laser des cellules. Étant donné que l'utilisation de thermocouples ne convient pas aux cultures cellulaires stérilisées, l'étalonnage de la température doit être effectué séparément de l'irradiation cellulaire. Compte tenu des variations possibles de la puissance laser, les mesures de température en temps réel pendant chaque irradiation au laser seraient idéales pour évaluer directement les réponses cellulaires correspondant à laDose thermique. De plus, la distribution de la température utilisée ici a été créée grâce à une interpolation de données basée sur les mesures à 21 points sur un plat de culture et à plusieurs réglages de puissance différents. Par conséquent, pour surmonter ces limites et points critiques, notre but est de développer une méthode alternative permettant la mesure de la température du plat de culture pendant l'exécution d'une irradiation au laser. Nous visons également à obtenir l'information de température spatiale à la fois. L'imagerie infrarouge (thermographie) est une méthode possible pour mesurer la température pendant l'irradiation au laser 10 . Le grand avantage de cette méthode est la mesure de la température en temps réel au niveau cellulaire pour chaque irradiation; Les réponses biologiques cellulaires subséquentes peuvent toujours être comparées individuellement à l'historique de la température pendant l'irradiation. Compte tenu de la rentabilité et de la facilité d'utilisation, cependant, l'utilisation de la thermographie pour les expériences de chauffage cellulaire n'est pas possible pour chaque laboratOry.
Dans la méthode utilisant un laser thulium à une longueur d'onde de 1,94 μm, l'eau dans le plat de culture cellulaire est chauffée à sa surface, et la diffusion thermique et la convection sont utilisées pour chauffer les cellules. La hauteur du milieu de culture dans cette configuration d'irradiation, avec 1,2 mL de milieu de culture, est de 935 μm en position centrale (à partir d'une mesure précédente en utilisant la tomographie de cohérence optique). Le niveau d'absorption du laser au thulium dans l'eau est très élevé (coefficient d'absorption: 127 cm -1 à 35 ° C) et 72% de la lumière est absorbée dans les premiers 100 μm du milieu de culture. Il n'y a pratiquement pas d'absorption (0.0007%) à une profondeur de 935 μm.
Il est important de noter que l'un des points critiques du protocole consiste à ajouter la même quantité de moyen (1 200 μl) pour chaque irradiation. L'utilisation de différentes quantités de milieu de culture peut conduire à des différences de hauteur, ce qui peut entraîner des différences de température iAugmentation des cellules. Le deuxième point critique concerne le moment de l'ouverture du plat de culture. Cela doit être fait en même temps - dans cette étude, 8 s avant le début de l'irradiation, lorsque le système fait un son. Les différences dans ce temps peuvent varier la température de base due au refroidissement provoqué par l'air environnant (environ 23 ° C). Cela peut entraîner des différences significatives dans la température induite par laser.
Pour l'étalonnage de la température, on a utilisé la même quantité de milieu (1,2 ml) dans les expériences pour mesurer la répartition de la température au fond des plats de culture sans cellule. Cependant, la hauteur moyenne avec une monocouche cellulaire peut être différente de celle sans cellules, même avec le même volume de moyen ajouté. La mesure utilisant la tomographie de cohérence optique a révélé qu'il existe une différence de 58 μm à la position centrale entre les plats avec et sans monocouche cellulaire confluente (877 μm sans cellules, comparé à tO 935 μm avec des cellules). Cette différence est potentiellement due à l'action capillaire des cellules. La différence de hauteur de 58 μm en position centrale peut être causée par environ 40 μL de moyen (données mesurées). Il a également été confirmé que cette différence de hauteur n'a pas causé de différences significatives dans T max à tous les paramètres d'alimentation. Par conséquent, nous avons conclu que cette différence n'influence pas de manière significative les résultats des analyses effectuées dans cette étude. Néanmoins, pour recueillir des informations de température plus précises, tel qu'écrit ci-dessus, une méthode d'étalonnage de la température à l'aide d'un plat de culture cellulaire contenant une monocouche cellulaire devrait être développée. En outre, la modélisation mathématique de la diffusion thermique et de la convection dans tout le milieu de culture est également nécessaire.
Dans cette étude, les cellules ont été chauffées avec une distribution de température gaussienne. Il existe plusieurs méthodes possibles pour chauffer tout le milieu de manière plus uniforme au fil du temps. Un Est d'utiliser une source laser avec un coefficient d'absorption inférieur dans l'eau. Cependant, l'inconvénient est que, dans ce cas, les lasers doivent avoir une puissance supérieure, car seul un faible pourcentage de la lumière est absorbé sur environ 0,9 mm. Une autre possibilité est d'imaginer la pointe de fibre distale d'une fibre optique multimode qui transmet la lumière laser dans le plan du plat de culture; Le grossissement peut être choisi arbitrairement par l'optique.
Le deuxième point fort de ce protocole est sa capacité à déterminer la température de seuil pour la mort cellulaire et l'apoptose à l'aide de l'image fluorescente de la coloration de la viabilité et de la distribution latérale de la température. Un but à long terme n'est pas seulement de déterminer la viabilité cellulaire, mais aussi d'élucider la plage de température pour les réponses biologiques cellulaires relatives à la fonctionnalité cellulaire, telles que l'expression des protéines et la prolifération cellulaire. La détermination de la température du seuil de mort cellulaire est d'un grand intérêt pour les chercheurs"> 10. En utilisant cette méthode, il pourrait être possible de déterminer les facteurs critiques pour la mort de la cellule, y compris l'apoptose. Les facteurs critiques pour la mort cellulaire provoquée par laser thermique peuvent être déterminés non seulement par l'histoire de la température, mais aussi par les facteurs endogènes ( C'est-à-dire les facteurs intra / extra-cellulaires au niveau moléculaire). Répondre à ces questions pourrait ouvrir la voie à la compréhension des mécanismes de la mort cellulaire et de la cinétique après différentes expositions thermiques et dans différentes pathologies rétiniennes. En outre, cela peut également aider à clarifier les problèmes cliniquement observés, Tels que la différence inter-individuelle en réponse au traitement au laser ou à la variabilité de la taille de la cicatrice après la photocoagulation de la rétine, même si la taille initiale des taches était presque identique ("traits atrophiques") 11 .
Le but final de cette étude est d'aider à développer une thérapie photothermique à température contrôlée de la rétine. Pour ce faire, en parallèle avecL'avancement technique de la mesure de la température 3 , une élucidation supplémentaire du comportement des cellules RPE après exposition thermique, déterminée selon cette méthode, sera très avantageuse.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Les auteurs n'ont rien à dévoiler.
Acknowledgments
Ce travail a été soutenu par une subvention de recherche du ministère fédéral de l'Éducation et de la Recherche (BMBF) (subvention N ° 13GW0043C) et d'un Bureau européen de recherche et de développement aérospatiaux (EOARD, numéro de dossier FA9550-15-1-0443)
Materials
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Dulbecco’s Modified Eagle’s Medium - high glucose | Sigma-Aldrich | D5796-500ML | Add (2)-(4) before use. Warm in 37 °C water bath before use. |
| Antibiotic Antimycotic Solution (100 ×) | Sigma-Aldrich | A5955-100ML | Containing 10,000 units penicillin, 10 mg streptomycin and 25 μg Amphotericin B in 1mL. Add 5.5 mL in 500 mL medium bottle (1) before use. |
| Sodium pyruvate (100 mM) | Sigma-Aldrich | S8636-100ML | Add 5.5 mL in 500 mL medium bottle (1) before use (final concentration: 1 mM) |
| Porcine serum | Sigma-Aldrich | 12736C-500ML | Add 50 mL in 500 mL medium bottole (1) before use (final: 10%) |
| Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537-500ML | |
| Trypsin from porcine pancreas | Sigma-Aldrich | T4799-25G | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | ED-100G | |
| Human VEGF Quantikine ELISA Kit | R&D System | DVE00 | |
| Oxiselect Total Glutathione Assay Kit | Cell Biolabs, Inc | STA-312 | |
| Apoptotic/Necrotic/Healthy Cells Detection Kit | PromoKine | PK-CA707-30018 | |
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Thulium laser | Starmedtec GmbH | Prototype | 0-20 W |
| 365 mm core diameter fiber | LASER COMPONENTS Germany | CF01493-52 | |
| Thermocouple | Omega Engineering Inc | HYP-0- 33-1-T-G-60-SMPW-M | |
| Heating plate | MEDAX | ||
| Microplate reader (spectrofluorometer) | Molecular Device | Spectramax M4 | |
| cell homogenizer | QIAGEN | TissueLyser LT | |
| Fluorescence microscope | Nikon | ECLIPSE Ti | |
| mathematical software program | The Mathworks. Inc | MATLAB Release 2015b | |
| system-design platform | National Instrument | Labview | Laboratory Virtual Instrument Engineering Workbench |
References
- Inagaki, K., et al. Comparative efficacy of pure yellow (577-nm) and 810-nm subthreshold micropulse laser photocoagulation combined with yellow (561-577-nm) direct photocoagulation for diabetic macular edema. Jpn J Ophthalmol. 59 (1), 21-28 (2015).
- Roider, J., et al. Selective retina therapy (SRT) for clinically significant diabetic macular edema. Graefes Arch Clin Exp Ophthalmol. 248 (9), 1263-1272 (2010).
- Brinkmann, R., et al. Real-time temperature determination during retinal photocoagulation on patients. J Biomed Opt. 17 (6), 061219 (2012).
- Yoshimura, N., et al. Photocoagulated human retinal pigment epithelial cells produce an inhibitor of vascular endothelial cell proliferation. Invest Ophthalmol Vis Sci. 36 (8), 1686-1691 (1995).
- Denton, M. L., et al. Damage Thresholds for Exposure to NIR and Blue Lasers in an In Vitro RPE Cell System. Invest Ophthalmol Vis Sci. 47 (7), 3065-3073 (2006).
- Shrestha, R., Choi, T. Y., Chang, W., Kim, D. A high-precision micropipette sensor for cellular-level real-time thermal characterization. Sensors (Basel). 11 (9), 8826-8835 (2011).
- Gao, F., Ye, Y., Zhang, Y., Yang, J. Water bath hyperthermia reduces stemness of colon cancer cells. Clin Biochem. 46 (16-17), 1747-1750 (2013).
- Jansen, E. D., van Leeuwen, T. G., Motamedi, M., Borst, C., Welch, A. J. Temperature dependence of the absorption coefficient of water for midinfrared laser radiation. Lasers Surg Med. 14 (3), 258-268 (1994).
- Iwami, H., Pruessner, J., Shiraki, K., Brinkmann, R., Miura, Y. Protective effect of a laser-induced sub-lethal temperature rise on RPE cells from oxidative stress. Exp Eye Res. 124, 37-47 (2014).
- Denton, M. L., et al. Spatially correlated microthermography maps threshold temperature in laser-induced damage. J Biomed Optics. 16 (3), (2011).
- Morgan, C. M., Schatz, H. Atrophic creep of the retinal pigment epithelium after focal macular photocoagulation. Ophthalmology. 96 (1), 96-103 (1989).



