Summary
1.94 μm sürekli dalga lazer radyasyonunu kullanarak bir kültür çanağındaki hücreleri ısıtmak için orijinal bir deney düzeneği burada tanıtıldı. Bu yöntemi kullanarak, farklı termal pozlamalardan sonra retina pigment epitel (RPE) hücrelerinin biyolojik cevapları araştırılabilir.
Abstract
Biyolojik değerlendirme için 1.94 mikronluk sürekli dalga tulium lazer kullanılarak kültürlenmiş hücreleri ısıtmak için özgün bir yöntem buraya girilmiştir. Tülyum lazer radyasyonu su ile kuvvetli bir şekilde emilir ve kültür çanağının altındaki hücreler termal difüzyon yoluyla ısıtılır. 365 μm'lik bir çapa sahip bir lazer fiber, herhangi bir optik olmadan kültür çanağının yaklaşık 12 cm üzerinde ayarlanır, böylece lazer ışını çapı, kültür çanağının (30 mm) iç çapıyla neredeyse eşdeğerdir. Her deneyde tutarlı bir miktarda kültür ortamı tutarak, hücreleri çok tekrarlanabilir sıcaklık artışı ile ışınlamak mümkündür.
Sıcaklık artışını ve her güç ayarı için bir hücre kültürü çanağındaki dağılımını kalibre etmek için sıcaklık, farklı konumlarda ve hücresel düzeyde 10 saniye boyunca ölçülmüştür. Sıcaklık dağılımı, matematik grafik yazılımıProgramı ve kültür örneğindeki örneği Gauss formunda idi. Lazer ışınlamasından sonra, sıcaklığa bağlı hücre yanıtlarını değerlendirmek için farklı biyolojik deneyler gerçekleştirilebilir. Bu el yazmasında canlı apoptozis ve ölüm zamanlarındaki farklı noktalardan sonra ölüm sıcaklıklarının belirlenmesine yardımcı olmak için canlılık boyaması ( yani, canlı, apoptotik ve ölü hücreleri ayıran) tanıtıldı.
Bu yöntemin avantajları, sıcaklığın ve ısıtmanın zamanının hassaslığı ve aynı zamanda bir hücre kültürü çanağındaki ısıtma hücrelerindeki yüksek verimliliğidir. Ayrıca, bilgisayarlı bir işletim sistemi tarafından iyi kontrol edilebilen çok çeşitli sıcaklıklar ve zaman süreleri ile çalışma yapılmasına olanak tanır.
Introduction
Sıcaklığa bağlı hücre biyolojik tepkilerini anlamak, başarılı hipertermi tedavileri için büyük önem taşır. Oftalmolojide kullanılan termal lazerli retina lazer fotokoagülasyon, tıpta en köklü lazer tedavilerinden biridir. Görünür ışık, çoğunlukla yeşil-sarı dalga boylarına, retinal lazer tedavisinde kullanılır. Işık retinal pigment epitelyal (RPE) hücrelerindeki melanin yüksek derecede emdiği retinanın en dıştaki hücre tek tabakasını oluşturur. Farklı retina bozuklukları türleri için yeni bir terapötik strateji olarak doktorlar ve araştırmacılar arasında son derece ilginç bir ışık ısısı ışınlaması (görünmeyen fotokoagülasyon) bulunmaktadır 1 , 2 . Bu eğilimi takiben, sıcaklık kontrollü fototermal terapi (TC-PTT) adı verilen bir teknik olan hassas sıcaklık kontrolü altında RPE hücrelerini ölümcül derecede ısıtmaktadır.
Son optoEnstitümüzden akustik teknoloji, retina ışınlanmış bölgelerdeki sıcaklık artışlarının gerçek zamanlı ölçümüne izin verdi. Bu, ışınlama sırasında sıcaklık artışının kontrolü sağlar 3 . Bununla birlikte, RPE hücrelerinin ölümcül derecede ısıtılmasından kaynaklanan, retina üzerine ölümcül olmayan hipertermi, sıcaklığın ölçülmesi ve kontrol edilememesi nedeniyle daha önce düşünülmediğinden termal lazer ışınlamasını takiben RPE hücrelerinin sıcaklığa bağlı hücre yanıtları Bugüne kadar çok az çalışılmıştır. Dahası, sıcaklık farkı ayrıntılı olarak tartışılmakla kalmamakla birlikte, ölümcül ve ölümcül ışınlama sonrasında hayatta kalan hücrelerin hücre davranışındaki farkı da tartışmamaktadır. Bu nedenle, TC-PTT'ye dayalı tedaviler hakkında bilimsel kanıt toplamak için, sıcaklık bağımlı RPE hücresi biyolojik tepkilerini ve bunların in vitro deney düzeneklerini kullanarak mekanizmalarını aydınlatmayı amaçlıyoruz.
Kale1) hızlı sıcaklık artışına, 2) hassas bir şekilde kontrol edilen zaman ve sıcaklığa ve 3) biyolojik deneyler için nispeten yüksek sayıda incelenen hücreye gereksinim duyan bir hücre ısıtma düzeneğinin kurulması gereklidir. . Isıtma yöntemi ile ilgili olarak, frekans katlamalı Nd.YAG lazer (532 nm) gibi klinik bir lazer, ne yazık ki hücre kültürü ısıtması için uygun değildir. Bunun nedeni, kültür RPE hücrelerindeki melanozomların sayısının çok az olmasıdır. Lazer ışığı emilimi homojen olmayabilir ve hücresel seviyedeki sıcaklık artışı, aynı radyasyon enerjisi ile ışınlansa bile deneyler arasında değişkenlik göstermektedir. Daha önceki bazı araştırmalar ışınlama 4 sırasında bulaşık dipinin altında siyah kağıt kullandığını veya 5 , 6 deneyleri öncesinde kültür hücreleri tarafından fagositize edilen ek melanozomların kullanımını bildirmiştir. ÇoğuHipertermi kaynaklı hücre tepkilerini değerlendirmek için in vitro biyolojik çalışmalar, sıcak bir tabla, bir su banyosu veya sıcaklık ayarı olan bir CO 2 inkübatör kullanılarak gerçekleştirildi. Bu yöntemler, istenen sıcaklığa erişmek biraz zaman ( yani birkaç dakika) alması nedeniyle uzun bir ısıtma periyodu gerektirir. Dahası, bu yöntemleri kullanarak, hücresel düzeyde detaylı bir termal öykü ( yani, sıcaklık zamanla çarpılan sıcaklık) elde etmek zordur. Dahası, bir kültür çanağındaki farklı konumlardaki hücreler arasındaki sıcaklık, değişken sıcaklık difüzyonundan dolayı farklılık gösterebilir. Çoğu vakada, hipertermi sırasında bu geçici ve uzaysal sıcaklık bilgileri, biyolojik hücre tepkisi artan sıcaklığın sıcaklığı ve süresi ile kritik olarak etkilense bile, biyolojik analizler için dikkate alınmamıştır.
Bu sorunların üstesinden gelmek içinHücreleri ısıtmak için nuts dalga tulium lazer kullanıldı. Tülium lazer radyasyonu (λ = 1.94 μm) su 8 tarafından kuvvetle emilir ve kültür çanağının altındaki hücreler termal olarak sadece termal difüzyon yoluyla uyarılır. 365 μm çaplı lazer elyafı, kültür çanağının yaklaşık 12 cm üstünde, herhangi bir optik olmadan aralarında bulunur. Lazer ışını çapı, kültür ortamının yüzeyindeki kültür çanağının (30 mm) iç çapıyla neredeyse eşdeğer olacak şekilde diverjiktir. Tutarlı bir miktarda kültür ortamı ile, hücreleri sıcaklık artışıyla ışınlamak mümkündür Yüksek tekrarlanabilirlik. Değişken güç ayarları 20 W'a kadar ışınlamayı mümkün kılar ve hücresel seviyedeki orta sıcaklık 10 saniyede ΔT ≈ 26 ° C'ye kadar yükseltilebilir.
Işınlama koşullarını değiştirerek, sıcaklık dağılımını değiştirmek için lazer ışını profilini değiştirmek de mümkündürBir kültür çanağında. Örneğin, mevcut çalışmadaki gibi Gauss benzeri sıcaklık dağılımıyla veya homojen bir sıcaklık dağılımıyla araştırmak mümkündür. İkincisi, sıcaklığa bağlı hücre yanıtlarının ölümcül olmayan sıcaklık artışları için daha spesifik olarak etkilerini araştırmak için avantajlı olabilir, ancak hücre ölüm stresinde veya yara iyileştirme yanıtlarında geçerli değildir.
Tülyum lazer ışınlaması, farklı termal pozlamalardan sonra gen / protein ifadesi, hücre ölüm kinetiği, hücre çoğalması ve hücre işlevsellik geliştirme gibi farklı biyolojik faktörlerin araştırılmasını sağlayabilir.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. RPE Hücre Kültürü
- Domuz gözlerinden RPE hücrelerinin izolasyonu
- Yerel mezbaha yeni çekirdekli domuz gözleri elde edin. Onları soğuk (4 ° C) ve karanlık bir ortamda tutun.
- Hücre dışı dokuları makasla çıkarın ve gözleri antiseptik bir solüsyonda 5 dakika bekletin.
- Gözleri kullanana kadar kalsiyum ve magnezyum (PBS (-)) olmadan steril fosfat tamponlu salin içine yerleştirin.
- Bir bisturi kullanarak sklera kornea limbusunun yaklaşık 5 mm arka kısmına nüfuz edin. Korneal limbusa paralel olarak, makasla tümüyle keserek gözün ön kısmını yeniden kesin.
- Gözün ön kısmını ( örn . Kornea ve mercek) ve vitrini çıkarın. 1 mL PBS (-) ekleyin ve yavaşça sinir retinasını çıkarın.
NOT: Sklera, koroid ve RPE'den oluşan bu "göz bardağı" hazırdır. - P'de önceden ısıtılmış (37 ° C)% 0.25 tripsin ekleyinGöz kapağına (-) bas. Göz kapının yaklaşık% 80'i bu tripsin çözeltisi ile dolacak şekilde ses seviyesini ayarlayın.
- Göz kapını, 37 ° C'de% 5'lik bir CO2 inkübatöründe tripsin çözeltisiyle inkübe edin. ° C'de 10 dakika.
- Kuluçka makinesinden göz banyosunu çıkarın ve% 0.25 tripsin solüsyonunu% 0.05 tripsin +% 0.2 etilendiamintetraasetik asit tetrasodyum tuzu (EDTA · 4N) ile PBS (-) solüsyonu ile değiştirin. 45 dakika inkübatör göz kap kuluçkalayın.
NOT: 45 dakika sonra, RPE hücreleri ya sadece gevşek olarak Bruch membranına tutturulacak ya da halihazırda ayrılmış ve tripsin-EDTA çözeltisinde yüzecektir. - RPE hücrelerini yavaşça pipetleyerek toplayın. Hücreleri ve çözeltiyi,% 10 domuz serumu, antibiyotik / antimikotik ve sodyum piruvat (1 mM) de dahil olmak üzere 10 mL kültür ortamı (L-glutamin ile DMEM yüksek glikoz) ile dolu konik bir tüp içerisinde toplayın.
NOT: Serum, tripsin etkisini nötralize edebilir. - SantrifüjOda sıcaklığında 5 dakika 400 xg'de hücre süspansiyonu.
- Süpernatantı çıkarın ve 10 mL taze ortam ekleyin. Aynı koşullar altında 5 dakika boyunca tekrar santrifüjleyin.
- Süpernatantı çıkarın ve hücre konsantrasyonunun 5 x 10 5 hücre / mL (bir hemocytometer kullanarak hücreleri sayarak belirlenir) olacak şekilde yeni ortam ekleyin. Nazik pipetleme ile iyice karıştırın.
- Hücre kültürü yemeklerinde hücre süspansiyonu dağıtın. 60 mm çaplı kültür çanağı başına 3 mL kullanın.
NOT: Bu kültür pasaj sıfır (P0) olarak adlandırılır. - 37 ° C'de% 5 CO2 inkübatör hücreleri koruyun. Klimalı ortamın yarısını her ikinci günde taze orta değere değiştirin.
- Altkültür (adım 1.2) konfluent hale gelirse.
- RPE hücre kültürünün altkültürü
- Kültür ortamı çıkarın ve hücreleri PBS (-) ile iki kez durulayın.
- Hücreleri PBS (-) solüsyonu ile% 0.05 tripsin +% 0.2 EDTA iNa 5% CO2 inkübatör 37 ° C'de 5 dakika.
- Nazik pipetleme ile RPE hücrelerini ayırın ve 10% domuz serumunu içeren 10 mL kültür ortamı ile dolu konik bir tüpe hücre süspansiyonu toplayın.
- Oda sıcaklığında 5 dakika 400 xg'de hücre süspansiyonu santrifüjleyin.
- Süpernatantı çıkarın ve hücre konsantrasyonunu 5 x 10 5 hücre / mL (bir hemositometre ile hücre sayısını sayarak belirlenir) yapan yeni kültür ortamı ekleyin. Hücreleri, adım 1.1.13'te açıklandığı gibi yeni 60 mm çaplı kültür kaplarına dağıtın.
NOT: Hücre kültürü şimdi pasaj 1'dir (P1). - Konflüansa erişildikten sonra, 1.2.1-1.2.5 adımlarında anlatılanla aynı işlemi kullanarak P1 kültürünü P2'ye ikiye ayırın. P2 kültüründen, hücreleri 60 mm çaplı kültür kapları yerine daha küçük kültür kaplarına (30 mm iç çap) tohumlayın.
- Deneyler için P2 veya P3 kültürlerini kullanın.
2. ThulLazer ışınlaması
- Işınlama istasyonunun inşası
- Tülyum lazer aygıtını (1.94 mikron, güç aralığı: 0-20 W) 0.22-NA, 365-μm çekirdek çaplı fiberle bağlayın.
- Elyaf ucunu ışınlama istasyonunun dikey metal direğine yatay olarak sabitlenmiş metal kola mekanik olarak sabitleyin. Dikey direği, lazer fiberinin ucu, ışınlama sırasında hücre kültürü çanağının yerleştirileceği sıcak plakanın üzerinde olacak şekilde yerleştirin.
- Sıcak plakaya beyaz bir kağıt koyun ve hedefleme kirişini açın (λ = 635 nm, maks = 1 mW, kağıt seviyesindeki çap ≈ 30 mm). Hedefleme kirişinin çevresini beyaz kağıt üzerine işaretleyin, böylece ışınlama sırasında kültür çanağının yerleştirileceği yer bilinir.
NOT: Fiber ucu z-düzlemi değiştirilebilir. İlave bir görüntüleme optiği olmaksızın, hücre kültürü düzlemindeki lazer spot çapı, lif ucunun 12 cm altına yerleştirilir, iYaklaşık 30 mm, hücre kültürü çanağının iç çapına neredeyse eşdeğerdir. Kurulumun şematik bir çizimi Şekil 1'de gösterilmektedir.

Şekil 1: Tülyum Lazer Işınlama İstasyonunun Şematik Görüntüsü. Isıtma plakasının üzerine bir kültür tabağı konur. Hücreler, kiriş boyutunun kültür çanağının iç çapıyla (yaklaşık 30 mm) hemen hemen aynı olduğu şekilde, tülyum lazer elyaf ucunun 12 cm altına yerleştirilir. Lazer ışınlama prosedürü, özel tasarlanmış sistem tasarım platformunun zaman kontrollü rutini ile kontrol edilir. Güç ayarı ışınlama programı başlamadan önce belirlenmelidir. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
- Işınlamadan 1 saat önce, kültür ortamını tamamen 1.2 mL taze ortam ile değiştirin.
NOT: Bu bir ÖNEMLİ ADIM ve kesinlikle uyulmalıdır. - Işınlama istasyonunu ( örn . Lazerli fiberin sabitleneceği sıcak plaka ve direk) temiz tezgah üzerine yerleştirin.
- İnkübatörden hücre kültürü çanağını çıkarın ve sıcak plaka üzerinde işaretlenmiş konuma yerleştirin (adım 2.1.3).
- Koruyucu gözlük takın. Tulum lazerini açın. Lazer cihazında gücü istediğiniz gibi ayarlayın (0 - 20 W arasında ayarlanabilir). Emisyonu açın.
- Lazer ışınlama ve zamanlama protokolünü (tamamlayıcı dosya) kontrol eden bir sistem tasarım platformu başlatın.
- Kültür tabağını sıcak plakaya yerleştirdikten hemen sonra, zamanlayıcıyı 140 s süreyle başlatmak için "ön ısıtma süresi" ne tıklayın ("ön ısıtma süresi 1"); Bu kültür ortam sıcaklığını 3'te tutacaktırIşınlama öncesi 7 ° C.
NOT: 140 s sonra bir bip sesi açılır ve bir sonraki zamanlayıcı ("ön ısıtma süresi 2") 8 saniyelik otomatik sayma işlemine başlar. Bu 8 saniyede, muayene eden kişi kültür çanağını açabilir. 148 s ön ısıtmadan sonra, otomatik olarak hücre kültürü üzerinde 10 s uzunluğunda bir lazer ışınlaması yapılır. Acil bir durumda, lazeri anında durdurmak için lazer cihazını zorla bırakma düğmesi ile donatın. Bu bir kritik basamaktır ve kesinlikle takip edilmelidir. Dikkatli olunması gereken özel bir nokta, 8 s ön ısıtma süresinin başlangıcında ışınlamadan hemen önce tabağın açılmasıyla ilgilidir. Kapağın açılması, orta yüzeyi çok hızlı soğutabilir. - Işınlama sonrasında, kapağı tekrar kültür çanağına koyun, ek bir 7 saniye boyunca sıcak tablaya bırakın ve 37 ° C'de% 5 CO2 inkübatörüne yerleştirin.
- 30 mm çaplı bir kültür çanağının (hücreler olmadan) dört tarafında (her 90 °'de) küçük deliklere (çap olarak yaklaşık 300 μm) yakın olun; Bir Bunsen brülörü ile ısıtılan bir iğnenin ucunu (20G) kullanın. Delikleri elektrik izolasyon bandı ile dışarıdan sızdırmaz kılın ve ince bir iğne ile küçük bir delik açın, böylece su geçirmez koşullar altında bu deliğe sadece 200 metrelik ince bir termokupl takılabilir.
- Kültür çanağının dış tarafında, 2 dikey çap çizin ve çapraz noktayı ( örneğin, alt tarafın ortası) sıfır koordinatı (0) olarak ayarlayın. Her 3 mm'lik çizgileri boyunca her yönde çanak dışına ( yani, 0, 3, 6, 9, 12 ve 15 mm) radyal olarak işaretleyin ( Şekil 2 , mavi noktalar); Toplam puan 21 olmalı.
- 1.2 mL yeni kültür ortamı ile hücre kültürü çanağını doldurun. Kültürü yerleştirin d37 ° C'de sıcak plakaya yerleştirin, yan delikte ince bir termokupl (200 μm çapında) yerleştirin ve hassas uçunu ölçülecek işaretlenmiş bir yere yerleştirin.
- Koruyucu gözlük takın. Tülyum lazerini açın ve lazer cihazının gücünü (0 ila 20 W, 0,1 W artırımlarla) manüel olarak ayarlayın.
NOT: Sıcaklık kalibrasyonu için, 3 W'lik artışlarla yapılan ölçümler yeterli olmalıdır. - Sistem tasarım platformunu açın ve sıcaklık ölçümünü başlatmak için "Start Temp Acquisition" düğmesine tıklayın (ek dosya).
- Adım 2.2.6'daki prosedürü uygulayın.
NOT: Kontrol programı her 100 ms'de takılı termokuplun sıcaklığını ölçer ve GUI'de ışınlama sırasında sıcaklık ilerlemesini gösterir. - Bu prosedürleri 21 ölçüm noktasının hepsi için ve farklı güç ayarlarında uygulayın. Tüm prosedürleri, tüm noktalar için ve tüm güç settin için üç kez tekrarlayınGs güvenilir veri elde etmek için.
- Sıcaklık verilerini csv verileri olarak dışa aktarın ve sonuçta elektronik tabloya dönüştürülebilir. Her noktadaki üçlü ölçümler için ışınlamanın bitimindeki maksimum sıcaklığı ortalaması alın. Aynı daire üzerindeki noktalardan değerleri ortalaması alın (merkez nokta hariç toplam 4 puan).
- Elde edilen ortalama maksimal sıcaklığı, çanak merkezinden x ekseni ve sıcaklık artışı (ΔT, ° C) y ekseni olarak mesafeye getirerek bir grafikte çizin. Ham verilere bir Gauss modeli uydurmak için bir matematiksel yazılım programının fit fonksiyonunu kullanın. Gauss fit sıcaklık dağılımı oluşturun.

Şekil 2: Bir Hücre Kültür Tabağındaki Sıcaklık Kalibrasyonunun Noktaları. Sıcaklık verileri merkezde ve 54 farklı açıdan radyal noktalar (mavi noktalar). Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
3. Farklı Termal Işınlamalardan Sonra Hücre Yanıtları İçin Biyolojik Değerlendirme
- Farklı güç ayarlarını takiben hücre yaşayabilirliğinin ( yani, canlı, apoptotik ve ölü) ve hücre ölüm eşiğinin belirlenmesinin değerlendirilmesi
- Belirtilen zaman noktalarında (ışınlama sonrası 3, 24 ve 48 saat sonra), hücreleri PBS (-) ile yıkayın ve üreticinin talimatlarına göre hücre yaşayabilirliğini ( yani yaşamsal, apoptotik, ölü) değerlendirmek için piyasada bulunan bir kit kullanın protokol.
- Floresan izotiyosiyanat (FITC) -anneksin V 5 μL, etidyum homodimer III 5 mcL ve Hekschst 33342'nin 5 uL'sini 1x bağlama tamponunun 100 μL'sine ekleyerek bir boyama çözümü hazırlayın (hepsi kittirbileşenler). Hücreleri örtmek için yeterli boyama solüsyonu hazırlayın. Hücreleri 15 dakika inkübe edin.
- Bağlayıcı tampon ile hücre kültürü iki kez yıkayın, bağlayıcı tampon PBS (-) ile değiştirin ve bir floresan mikroskop sahnesinde kültür ayarlayın.
- Işık yolunu oküler lense çevirin, 4 ', 6-Diamidin-2-fenilindol (DAPI) filtresini seçin, aydınlatma lambasını açın ve odaklanan düzlemi 4x objektifle bulun.
- Kameraya giden ışık yolunu değiştirin, görüntüyü bilgisayar ekranında mikroskop görüntüleme yazılımında bulun ve odaklamayı ayarlayın.
- Tüm hücre kültürü çanağının flüoresans görüntüsünü elde etmek için dikiş işlevini (diğer bir deyişle çanak boyunca birden fazla görüntüyü kaydetmek ve daha sonra tek bir büyük resim oluşturmak için işlev) kullanın. Hoechst 33342 pozitif hücrelere (tüm hücre çekirdeği), FITC-annexin V-positi'ye 3 farklı filtre seti (DAPI, FITC ve tetrametilrohidamin (TRITC))Ve hücreler (apoptotik) ve etidyum homodimeri III-pozitif hücreler (ölü) olarak sıralanabilir.
- Boyanan hücre kültürlerinde ölü (etidyum homodimer III pozitif) bölgesinin yarıçapını (mm) ve apoptotik (anneksin V-pozitif) bant form bölgesinin dış / iç yarıçapını ölçün. Bu yarıçapları, ilgili gç ayarı için sıcaklık dağılımının uydurma Gauss fonksiyonuna uygulayın. Hücre ölümü ve apoptotik değişim için eşik sıcaklıklarını açıklığa kavuşturmak için ölü veya apoptotik bölgenin kenarındaki tam sıcaklığı hesaplayın.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Farklı güç ayarlarından sonra sıcaklık dağılımı
Her bir ışınlama için tüm sıcaklık gelişmeleri sıcaklık kalibrasyonunda izlenmiştir. Bu veriden, ölçülen noktalardaki maksimal sıcaklık elde edildi ve T max (° C) olarak tanımlandı. Şekil 3A'da gösterildiği gibi, program, kültür çanağı ısıtma plakasına yerleştirildiği zaman noktasında yürütülmüştür. 37 ° C'de kararlı bir orta sıcaklığın arşivlenmesine ihtiyaç duyulan 140 saniyelik "ön ısıtma süresi 1" sonrasında, kültür çanağının kapağı 8 saniyelik "ön ısıtma süresi 2" süresince çıkarıldı. "Ön ısıtma süresi 2" nin sonunda, lazer emisyonu otomatik olarak başladı. Bu eğri, 10 saniyelik ışınlama için temsili bir sıcaklık ilerlemesidir. Işınlama sırasında sıcaklık artmış ve lazer emisyonundan hemen sonraKapandı, sıcaklık düşmeye başladı. Bu çalışmada, kültür çanağının merkezinde maksimum sıcaklık T max (° C) olarak tanımlanmıştır. Tmax , lazer gücü ile orantılıydı ( Şekil 3B ). Şekil 3C , kültür çanağının her bir gücünün maksimum sıcaklığının dağılımını göstermektedir. Dağılımlar, Şekil 3C'de gösterildiği gibi çan şeklindedir ve aşağıdaki formüle göre bir Gauss fonksiyonuna uyarlar:
T (r) = t taban + A · 
Burada r, t taban , A ve w, merkezden mesafeye (mm), eğimin en düşük sıcaklığına, eğimin genişliğine ve genişliğine işaret eder. Takılan G'nin parametreleri (t baz , A ve w)Her güç ayarı için, yani her bir Tmax için auss eğrisi, grafiğin yanındaki tabloda gösterilmiştir.
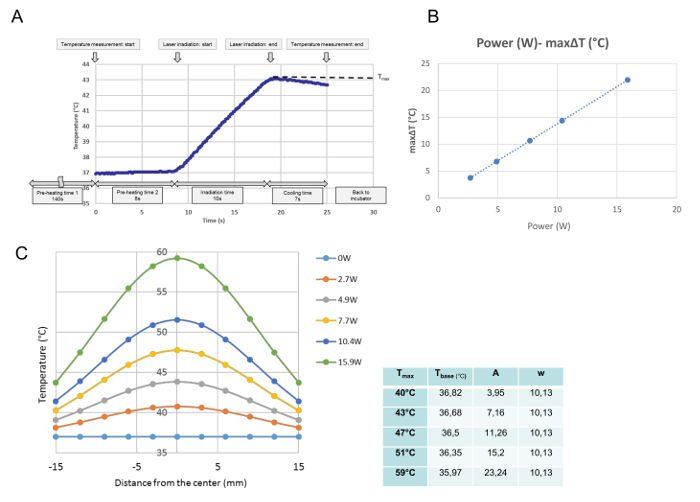
Şekil 3: Sıcaklık Kalibrasyon Verileri. 4.9 W ( Tmax = 43 ° C) ( A ) 'da Tek Işınlama Sonrasında Merkezi Konumda Bir Temsilci Sıcaklık Gelişimi, Bir Hücre Kültürünün ( B ) Merkezî Konumundaki Lazer Gücü ile Maksimum ΔT Arasındaki Oransal İlişki, Ve Farklı Sıcaklık Ayarlamaları (C) sonrasında Kültür Tabağında Sıcaklık Dağılımları. (A) Program, kültür çanağının ısıtma plakasına yerleştirildiği zaman noktasından yürütülür. 37 ° C'de kararlı bir orta sıcaklığın arşivlenmesi için gerekli olan 140 s "ön ısıtma süresi 1" sonrasında, kültür çanağının kapağı 8 s "ön ısıtma süresi için çıkarılır2. "Ön ısıtma süresi 2" nin sonunda, lazer emisyonu otomatik olarak başlar.Bu eğri, 4,9 W'de 10 s'lik bir ışınlama sırasında merkezi konumda temsili bir sıcaklık ilerlemesidir. Işınlama sırasında sıcaklık artar ve Lazer emisyonu kapatıldıktan hemen sonra sıcaklık düşmeye başlar Maksimum sıcaklık, bu çalışmada T max (° C) olarak tanımlanan ışınlamanın sonunda elde edilir. (B) Lazer gücü ve maksimum Sıcaklık artışı (ΔTmax) orantılıdır (C) Kültür çanağında ölçülen sıcaklık dağılımlarının uydurulmuş Gauss fonksiyonları Matematiksel bir yazılım programı ile belirlenen fonksiyonlar için parametreler grafikte Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
Isıl ışınlamadan sonra hücre canlılığı
Şekil 4A'da gösterildiği gibi, lazer ışınlamasından sonra hücre yaşayabilirliğini gösteren üç farklı boyama kalıbı vardır: 1) hiçbir anneksin V / etidyum homodimeri III-pozitif (sadece canlı), 2) merkezi anneksin V-pozitif ( yani neredeyse Sadece erken apoptoz) ve 3) ölü ve canlı hücreler arasındaki sınırda apoptotik hücrelerle çevrelenmiş merkezde ( yani ölü hücreler) III pozitif olan etidyum homodimeri ( Şekil 4B ). Ölü / apoptotik alanın büyüklüğü genel olarak T max'a ve ışınlama sonrası 48 saate kadar ışınlama sonrası zamana bağlıdır. T max ≤43 ° C ile ışınlanmış kültürlerde belirgin canlılık değişimi tespit edilmedi. Tek apoptotik değişiklik zamanın erken bir noktasında (3 saat) görülebilir, ardından geç Tmax = 47 ° C olan bir ışınlama sonrası hücre ölümü. T max ≥ 51 ° C ile ışınlanmış kültürlerde ani veya erken hücre ölümleri (en fazla 3 saat) bulundu (Tablo 1).

Şekil 4: Farklı Güç Ayarlamaları (A) sonrasında Canlılık Boyanması Örneği ve Ölümcül Lazer Işınlamalardan Sonra Ölü ve Apoptotik Alanın Kenarında Örnek Bir Görüntü (B).
(A) Sıcaklığa bağlı olarak üç desen oluşabilir. (B) Ölü bölge çevresinde apoptotik bölge (FITC-annexin V-pozitif: yeşil) (etidyum homodimer III-pozitif: kırmızı). Hoechst 33342 (mavi) için tüm hücreler pozitiftir ve mavi çekirdekli hücreler canlı hücrelerdir. Görüntü, Tmax = 59 ° C'de bir ışınlamadan 24 saat sonra çekilmiştir. Bar = 100 um./files/ftp_upload/54326/54326fig4large.jpg "target =" _ blank "> Bu şekli daha geniş bir sürümünü görmek için lütfen buraya tıklayınız.

Tablo 1: Çeşitli Sıcaklık ve Zamanlarda Annexin V ve Etidyum Homodimer III Yanıtları.
Hücre ölümünde eşik sıcaklığının belirlenmesi
Ölüm alanının (kırmızı) ve apoptotik alanın (yeşille) ortalama yarıçapı ölçülmüş ve sıcaklık dağılımının Gauss fonksiyonuna uygulanarak hücre ölümü ve apoptoz için 10s ışınlama sonrası eşik pik sıcaklıkları belirlenmiştir. Bu analize göre, ışınlamadan 3 saat, 24 saat ve 48 saat sonra tam hücre ölümü için ortalama eşik sıcaklıkları sırasıyla 54.0 ° C, 50.9 ° C ve 50.1 ° C idi. Ortalama seferHücre apoptotik değişim sıcaklığı, sırasıyla 51.7 ° C, 48.0 ° C ve 47.0 ° C'de 3 saat, 24 saat ve 48 saat eşik sıcaklıkları ile yaklaşık 2 - 3 ° C daha düşüktü ( Şekil 5 ).
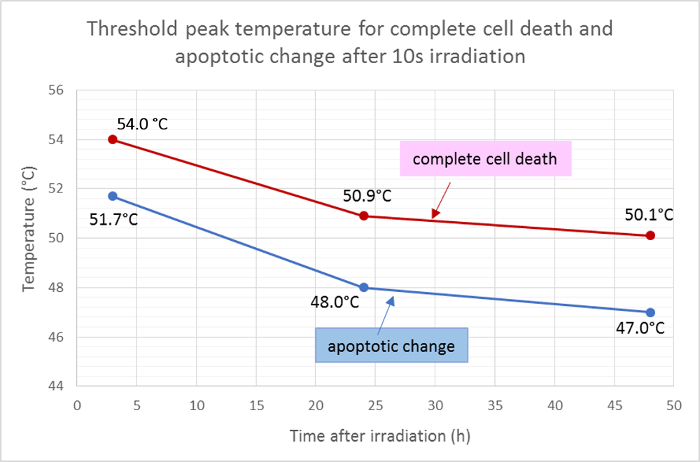
Şekil 5: Apoptoz ve Hücre Ölümü için Eşik Sıcaklıkları.
Floresan yaşayabilirlik boyamasının sonuçlarına göre, ışınlama sonrası farklı zaman noktalarında, hücre ölümünün tamamı (Hoechst 33342, anneksin V ve etidyum homodimeri III için pozitif) ve apoptoz için ortalama eşik sıcaklıkları (sadece Hoechst 33342 ve anneksin V için pozitif) . Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Sıcaklığa bağlı biyolojik hücresel tepkileri tartışırken, çoğu biyokimyasal süreçler zamana bağlı olduğu için sadece sıcaklık değil artan sıcaklığın süresi de önemlidir. Özellikle oftalmolojideki lazerle indüklenen hipertermi alanında, milisaniyeleri ile saniyeler arasındaki kısa zaman aralıklarından dolayı, hassas sıcaklık kontrolü ile hücresel termal etkileri araştırmak zordur. Bu nedenle, hücre kültürü modeline uygun ve sıkı sıcaklık ve zaman kontrolü sağlayan bir çalışma sistemi ile birlikte lazer ışınlama düzeneği arzu edilmektedir. Protein ekspresyonu veya sekresyonu gibi termal maruziyetten sonraki hücre yanıtlarının biyolojik değerlendirilmesi, yeterli sayıda etkilenen hücre üzerinde tekrarlanan kantitatif değerlendirmeler gerektirir. Bu, klinik tedavilerde olduğu gibi, birkaç yüz mikrometre çapında lazer noktaları kullanan çalışmalar için bir engel oluşturmuştur. Tek bir lazer spotundaki nicel analiz oldukça basittirrdensome. Bu çalışmada, bu talepleri mümkün olduğunca yerine getirmek için girişimlerde bulunulmuştur. Bir ışınlama kontrol programı olan 1.94 mikron dalga boyu sürekli dalga tulyum lazer kullanarak, kısa bir süre içinde tüm hücre kültüründe geçici bir sıcaklık artışı gerçekleştirilebilir. Sıcaklık dağılımı ışık yolunun değiştirilmesi ile ayarlanabileceğinden, bu kurulum kullanılarak farklı hipertermi ile ilgili deneyler yapılabilir.
Sunulan tekniğin sınırlandırılması, hücrelerin lazerle ışınlanması sırasında eşzamanlı sıcaklık ölçümleri yapmanın imkansızlığıdır. Termokuplların kullanımı sterilize edilmiş hücre kültürleri için uygun olmadığından, sıcaklık kalibrasyonu hücre ışınlamasından ayrı olarak yapılmalıdır. Lazer-güç çıkışındaki olası değişiklikleri göz önüne alındığında, her lazer ışınlaması sırasında gerçek zamanlı sıcaklık ölçümleri,Termal doz. Ayrıca, burada kullanılan sıcaklık dağılımı, bir kültür çanağında 21 noktadaki ölçümlere ve birkaç farklı güç ayarına dayanan veri enterpolasyonuyla oluşturuldu. Bu nedenle, bu sınırlamaların ve kritik noktaların üstesinden gelmek için, lazer ışınlaması yapılırken kültür çanağının sıcaklığının ölçülmesine izin veren alternatif bir yöntem geliştirmek bizim amacımızdır. Aynı zamanda mekânsal sıcaklık bilgisini de elde etmeyi amaçlıyoruz. Kızılötesi görüntüleme (termografi), lazer ışınlaması 10 sırasında sıcaklık ölçmek için olası bir yöntemdir. Bu yöntemin en büyük avantajı, her ışınlama için hücresel seviyedeki gerçek zamanlı sıcaklık ölçümüdür; Sonraki hücre biyolojik tepkileri her zaman ışınlama sırasında sıcaklık geçmişiyle bireysel olarak karşılaştırılabilir. Bununla birlikte, maliyet etkinliği ve kullanılabilirlik göz önüne alındığında, hücre ısıtma deneyleri için termografi kullanılması, her laborat için mümkün değildirveyahut senin.
1.94 μm dalga boyunda bir tulium lazer kullanan yöntemde, hücre kültürü kabındaki su yüzeyinde ısıtılır ve hücreleri ısıtmak için termal difüzyon ve konveksiyon kullanılır. 1.2 mL kültür ortamı ile, bu ışınlama düzeneğindeki kültür ortamının yüksekliği, merkezi konumda (optik koherens tomografi kullanılarak önceki bir ölçümden) 935 um'dir. Tülyum lazerin sudaki emilim düzeyi çok yüksek (absorpsiyon katsayısı: 35 ° C'de 127 cm -1 ) ve ışığın% 72'si kültür ortamının ilk 100 mikronunda absorbe edilmektedir. 935 μm derinlikte emilim neredeyse hiç olmaz (% 0.0007).
Protokoldeki kritik noktalardan birinin her ışınlama için aynı miktarda ortam (1,200 μL) eklemek olduğunu belirtmek önemlidir. Farklı miktarlarda kültür ortamı kullanmak, sıcaklık farklılıklarına neden olabilecek yükseklik farklarına yol açabilir. IHücrelerin sayısını arttırın. İkinci kritik nokta, kültür çanağının açılma zamanlaması ile ilgilidir. Aynı zamanda, ışınlamanın başlangıcından 8 saniye önce, sistemin ses çıkardığı bu çalışmada da yapılması gerekir. Bu zamanlamadaki farklılıklar, çevredeki havanın neden olduğu soğuma (yaklaşık 23 ° C) nedeniyle taban sıcaklığını değiştirebilir. Bu, lazer kaynaklı sıcaklıkta önemli farklılıklara neden olabilir.
Sıcaklık kalibrasyonu için, deneylerde kullanılan aynı miktarda ortam (1.2 mL), hücresiz kültür bulaşıkları altındaki sıcaklık dağılımını ölçmek için kullanıldı. Bununla birlikte, hücre tek katmanı ile orta boy, aynı hacimde eklenmiş ortam olsa bile, hücreler içermeyen hücre yoğunluğundan farklı olabilir. Optik koherens tomografi kullanılarak yapılan ölçümde, konfluent hücre tek tabaka içeren ve bulunmayan bulaşıkların arasındaki orta konumda 58-μm'lik bir fark olduğu ortaya çıkmıştır (877 μm, hücreler olmadan, tO 935 μm hücre ile). Bu fark muhtemelen hücrelerin kılcal damar hareketinden kaynaklanmaktadır. Orta konumdaki yükseklikteki 58 μm'lik farklılık, yaklaşık 40 μL orta madde (ölçülen veriler) neden olabilir. Bu yükseklik farkının tüm güç ayarlarında Tmax değerlerinde önemli farklara neden olmadığı da teyit edildi. Bu nedenle, bu farkın bu çalışmada yapılan analizlerin sonuçlarını önemli ölçüde etkilemediği sonucuna varıldık. Bununla birlikte, daha hassas sıcaklık bilgileri toplamak için, yukarıda yazılmış olduğu gibi, bir hücre tek tabaka içeren bir hücre kültürü çanak kullanarak sıcaklık kalibre için bir yöntem geliştirilmelidir. Ayrıca, termal difüzyonun ve konveksiyonun tüm kültür ortamı içindeki matematiksel modellenmesi de gereklidir.
Bu çalışmada hücreler Gauss sıcaklık dağılımı ile ısıtılmıştır. Bütün maddenin zamanla daha eşit bir şekilde ısıtılması için birkaç olası yöntem vardır. Bir Suda daha düşük absorpsiyon katsayısına sahip bir lazer kaynağı kullanmaktır. Bununla birlikte dezavantaj, bu durumda, lazerlerin daha yüksek bir enerjiye sahip olması gerektiği, çünkü ışığın sadece küçük bir yüzdesi 0.9 mm'den fazla emilir. Bir başka olasılık, lazer ışığını kültür tabağının düzlemine ileten çok modlu bir optik elyafın distal fiber ucu görüntüsüne getirmektir; Büyütme, optikler tarafından keyfi olarak seçilebilir.
Bu protokolün ikinci önemli noktası canlılık boyamasının flüoresan görüntüsünü ve yanal sıcaklık dağılımını kullanarak hücre ölümü ve apoptoz için eşik sıcaklığının belirlenebilmesidir. Uzun vadeli bir amaç, yalnızca hücre yaşayabilirliğini belirlemek değil aynı zamanda protein ifadesi ve hücre çoğalması gibi hücre işlevselliğine ilişkin hücre biyolojik tepkileri için sıcaklık aralığını aydınlatmaktır. Hücre ölüm eşiği sıcaklığının belirlenmesi araştırmacılar için büyük önem taşır"> 10. Bu yöntemi kullanarak, apoptoz dahil olmak üzere hücre ölümü için kritik faktörlerin belirlenmesi mümkün olabilir Termal lazer kaynaklı hücre ölümü için kritik faktörler sadece sıcaklık geçmişi boyunca değil, aynı zamanda endojen faktörler yoluyla da tespit edilebilir ( Moleküler düzeyde intra / ekstra hücresel faktörler) Bu soruları yanıtlamak, farklı termal pozlamalardan sonra ve farklı retinal patolojilerde hücre ölüm mekanizmalarını ve kinetiklerini anlama yolunu açabilir.Ayrıca, klinik olarak gözlemlenen konuları açıklığa kavuşturmaya, Lazer tedavisine cevaben kişiler arası fark veya retinal fotokoagülasyondan sonra skar boyutundaki değişkenlik gibi başlangıçtaki spot boyutu neredeyse aynı olduğunda ("atrofik sürünme") 11 .
Bu çalışmanın nihai amacı retinanın sıcaklık kontrollü fototermal tedavisinin geliştirilmesine yardımcı olmaktır. Bunu başarmak için, paralel olarakSıcaklık ölçümü 3'ün teknik ilerlemesi, termal maruziyetten sonra bu yöntem kullanılarak belirlenen RPE hücresi davranışının daha fazla aydınlatılması büyük fayda sağlayacaktır.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Yazarların açıklayacak bir şeyi yok.
Acknowledgments
Bu çalışma Alman Federal Eğitim ve Araştırma Bakanlığı (BMBF) (hibe # 13GW0043C) ve Avrupa Uzay Araştırma ve Geliştirme Ofisi (EOARD, hibe # FA9550-15-1-0443) tarafından yapılan bir araştırma yardımıyla desteklendi.
Materials
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Dulbecco’s Modified Eagle’s Medium - high glucose | Sigma-Aldrich | D5796-500ML | Add (2)-(4) before use. Warm in 37 °C water bath before use. |
| Antibiotic Antimycotic Solution (100 ×) | Sigma-Aldrich | A5955-100ML | Containing 10,000 units penicillin, 10 mg streptomycin and 25 μg Amphotericin B in 1mL. Add 5.5 mL in 500 mL medium bottle (1) before use. |
| Sodium pyruvate (100 mM) | Sigma-Aldrich | S8636-100ML | Add 5.5 mL in 500 mL medium bottle (1) before use (final concentration: 1 mM) |
| Porcine serum | Sigma-Aldrich | 12736C-500ML | Add 50 mL in 500 mL medium bottole (1) before use (final: 10%) |
| Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537-500ML | |
| Trypsin from porcine pancreas | Sigma-Aldrich | T4799-25G | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | ED-100G | |
| Human VEGF Quantikine ELISA Kit | R&D System | DVE00 | |
| Oxiselect Total Glutathione Assay Kit | Cell Biolabs, Inc | STA-312 | |
| Apoptotic/Necrotic/Healthy Cells Detection Kit | PromoKine | PK-CA707-30018 | |
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Thulium laser | Starmedtec GmbH | Prototype | 0-20 W |
| 365 mm core diameter fiber | LASER COMPONENTS Germany | CF01493-52 | |
| Thermocouple | Omega Engineering Inc | HYP-0- 33-1-T-G-60-SMPW-M | |
| Heating plate | MEDAX | ||
| Microplate reader (spectrofluorometer) | Molecular Device | Spectramax M4 | |
| cell homogenizer | QIAGEN | TissueLyser LT | |
| Fluorescence microscope | Nikon | ECLIPSE Ti | |
| mathematical software program | The Mathworks. Inc | MATLAB Release 2015b | |
| system-design platform | National Instrument | Labview | Laboratory Virtual Instrument Engineering Workbench |
References
- Inagaki, K., et al. Comparative efficacy of pure yellow (577-nm) and 810-nm subthreshold micropulse laser photocoagulation combined with yellow (561-577-nm) direct photocoagulation for diabetic macular edema. Jpn J Ophthalmol. 59 (1), 21-28 (2015).
- Roider, J., et al. Selective retina therapy (SRT) for clinically significant diabetic macular edema. Graefes Arch Clin Exp Ophthalmol. 248 (9), 1263-1272 (2010).
- Brinkmann, R., et al. Real-time temperature determination during retinal photocoagulation on patients. J Biomed Opt. 17 (6), 061219 (2012).
- Yoshimura, N., et al. Photocoagulated human retinal pigment epithelial cells produce an inhibitor of vascular endothelial cell proliferation. Invest Ophthalmol Vis Sci. 36 (8), 1686-1691 (1995).
- Denton, M. L., et al. Damage Thresholds for Exposure to NIR and Blue Lasers in an In Vitro RPE Cell System. Invest Ophthalmol Vis Sci. 47 (7), 3065-3073 (2006).
- Shrestha, R., Choi, T. Y., Chang, W., Kim, D. A high-precision micropipette sensor for cellular-level real-time thermal characterization. Sensors (Basel). 11 (9), 8826-8835 (2011).
- Gao, F., Ye, Y., Zhang, Y., Yang, J. Water bath hyperthermia reduces stemness of colon cancer cells. Clin Biochem. 46 (16-17), 1747-1750 (2013).
- Jansen, E. D., van Leeuwen, T. G., Motamedi, M., Borst, C., Welch, A. J. Temperature dependence of the absorption coefficient of water for midinfrared laser radiation. Lasers Surg Med. 14 (3), 258-268 (1994).
- Iwami, H., Pruessner, J., Shiraki, K., Brinkmann, R., Miura, Y. Protective effect of a laser-induced sub-lethal temperature rise on RPE cells from oxidative stress. Exp Eye Res. 124, 37-47 (2014).
- Denton, M. L., et al. Spatially correlated microthermography maps threshold temperature in laser-induced damage. J Biomed Optics. 16 (3), (2011).
- Morgan, C. M., Schatz, H. Atrophic creep of the retinal pigment epithelium after focal macular photocoagulation. Ophthalmology. 96 (1), 96-103 (1989).



