Summary
1.94μmの連続波レーザー放射を用いた培養皿内の細胞を加熱するための元の実験装置をここに導入する。この方法を用いて、異なる熱暴露後の網膜色素上皮(RPE)細胞の生物学的応答を調べることができる。
Abstract
生物学的評価のために1.94μmの連続波ツリウムレーザーを用いて培養細胞を加熱する独自の方法をここに導入する。ツリウムレーザー放射は水に強く吸収され、培養皿の底の細胞は熱拡散によって加熱される。直径365μmのレーザーファイバーは培養ディッシュの約12cm上に置かれ、レーザービーム直径は培養ディッシュの内径(30mm)とほぼ等しくなるように光学的には設定されていない。各実験において培地の量を一定に保つことにより、再現性の高い温度上昇を細胞に照射することが可能である。
1つの細胞培養皿中の各パワー設定についての温度上昇およびその分布を較正するために、異なる位置および細胞レベルで10秒の照射中に温度を測定した。温度分布は、数学的グラフィックスソフトウェアプログラムであり、文化皿全体のパターンはガウス型であった。レーザー照射後、異なる生物学的実験を行って、温度依存性細胞応答を評価することができた。この原稿では、異なる時点後の細胞アポトーシスおよび死亡の閾値温度を決定するのを助けるために、生存率染色( すなわち 、生存細胞、アポトーシス細胞および死細胞の区別)を導入する。
この方法の利点は、温度および加熱時間の正確さ、ならびに細胞培養皿全体における加熱細胞におけるその高い効率である。さらに、コンピュータ化されたオペレーティングシステムによって十分に制御され得る、多種多様な温度および時間間隔での学習が可能になる。
Introduction
温度依存性の細胞生物学的応答を理解することは、温熱治療を成功させるために非常に重要である。眼科で使用される熱レーザーによる網膜レーザー光凝固は、医学において最も確立されたレーザー治療の1つである。主に緑色から黄色の波長の可視光線が、網膜レーザー治療に使用されます。光は、網膜の最も外側の細胞単層を形成する網膜色素上皮(RPE)細胞のメラニンによって高度に吸収される。様々な種類の網膜障害に対する新しい治療戦略として、非常に軽度の熱照射(目に見える光凝固)の医師および研究者の間で最近の関心があった1,2 。この傾向に続いて、私たちの関心は、温度制御型光熱治療(TC-PTT)と呼ばれる技術である正確な温度制御下でRPE細胞を致死的に加熱することにあります。
最近のオプト我々の研究所の音響技術は、網膜の照射部位における温度上昇のリアルタイム測定を可能にしている。これにより、照射中の温度上昇を制御することができます3 。しかし、網膜上の致死量以下の温熱療法は、温度を測定し制御することが不可能であることから以前は考慮されていなかったため、熱レーザー照射後のRPE細胞の温度依存性細胞応答は、今日までほとんど研究されていない。さらに、温度差は詳細に議論されていないだけでなく、致死量以下の照射後の生き残った細胞の細胞挙動の差異も有する。したがって、TC-PTTに基づく治療法に関する科学的証拠を収集するために、温度依存性RPE細胞の生物学的応答およびそれらのメカニズムをin vitro実験装置を用いて解明することを目的とする。
t彼の目的は、1)迅速な温度上昇の可能性、2)正確に制御された時間および温度、および3)生物学的実験のための検査細胞の比較的高い数の条件を満たす細胞加熱装置を確立することが必要である。加熱方法に関しては、周波数が倍増されたNd.YAGレーザー(532nm)のような臨床レーザーは、残念なことに、細胞培養加熱には不適当である。これは、培養されたRPE細胞におけるメラノソームの数が著しく減少したためである。レーザ光の吸収は不均質であり、細胞レベルでの温度上昇は、同じ放射能を照射した場合であっても、実験の間に可変である。いくつかの以前の研究では、照射4の間の皿の底の下の黒い紙の使用、または実験5,6の前に培養細胞によって貪食された追加のメラノソームの使用が報告されている。たくさんの温熱プレート、水浴、または温度設定7の CO 2インキュベーターを使用して、温熱療法によって誘発された細胞応答を評価するためのin vitro生物学的研究を行った。これらの方法は、所望の温度に到達するまでにある時間( すなわち、数分)を要するため、長い加熱期間を必要とする。さらに、これらの方法を使用すると、細胞レベルでの詳細な熱履歴( すなわち、時間を掛けた温度)を得ることは困難である。さらに、1つの培養ディッシュ内の異なる位置にある細胞間の温度は、可変温度拡散によって異なる場合がある。大部分の場合、生物学的細胞応答は、温度の上昇および温度の持続時間によって致命的な影響を受ける可能性があるが、温熱療法中のこの時間的および空間的温度情報は、生物学的分析のため考慮されていない。
これらの問題を克服するために、contiここでは、セルを加熱するために裸波ツリウムレーザーを使用した。ツリウムレーザー放射(λ=1.94μm)は水8に強く吸収され、培養皿の底の細胞は熱拡散のみによって熱刺激される。直径365μmのレーザーファイバーは培養皿の約12cm上に置かれ、その間に光学機器はありません。レーザービームの直径は、培地の表面で培養ディッシュ(30mm)の内径とほぼ等しくなるように発散する。一定量の培養培地を用いて、温度上昇を細胞に照射することが可能である高い再現性があります。可変出力設定では最大20Wの照射が可能で、細胞レベルでの媒体温度は10秒でΔT≈26℃まで上昇する可能性があります。
照射条件を変更することにより、レーザビームプロファイルを変更して温度分布を変化させることも可能である文化皿で。例えば、現在の研究のように、ガウス様の温度分布で、または均一な温度分布で調べることが可能である。後者は、温度依存性細胞応答の影響を、より具体的には致死量以下の温度上昇について調べるのに有利であり得るが、細胞死ストレスまたは創傷治癒応答についてはそうではない。
総合的には、ツリウムレーザー照射は、異なる熱曝露の後に、遺伝子/タンパク質発現、細胞死速度論、細胞増殖、および細胞機能発現などの異なる種類の生物学的因子の調査を可能にすることができる。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1.RPE細胞培養
- ブタの眼からのRPE細胞の単離
- 地元の屠殺場から新しく除核されたブタの目を入手する。冷暗所に保管してください(4℃)。
- はさみで細胞外組織を除去し、5分間消毒液に目を浸します。
- 使用するまでカルシウムとマグネシウムを含まない滅菌リン酸緩衝生理食塩水(PBS( - ))に眼を入れます。
- メスを使用して、角膜輪部の約5mm後に強膜に浸透する。はさみで角膜輪部に平行に切開して、眼の前部全体を切除する。
- 眼の前部( すなわち、角膜およびレンズ)および硝子体を除去する。 1mLのPBS( - )を加え、穏やかに神経網膜を除去する。
注:強膜、脈絡膜およびRPEからなるこの「眼球カップ」は、今すぐ準備ができています。 - Pで予熱した(37℃)0.25%トリプシンを添加する。BS( - )をアイカップに送る。アイカップの約80%がこのトリプシン溶液で満たされるように容量を調整する。
- 5%CO 2インキュベーター内で37℃で10分間、トリプシン溶液とアイカップをインキュベートする。
- インキュベーターからアイカップを取り出し、0.05%トリプシン+ 0.2%エチレンジアミン四酢酸四ナトリウム塩(EDTA・4N)を含むPBS( - )溶液で0.25%トリプシン溶液を交換する。アイカップをインキュベーター内で45分間インキュベートする。
注:45分後、RPE細胞はブルッフ膜にちょうど緩く付着しているか、またはすでに剥離してトリプシン-EDTA溶液に浮遊しているかのいずれかである。 - 穏やかなピペッティングでRPE細胞を集める。 10%ブタ血清、抗生物質/抗真菌剤、およびピルビン酸ナトリウム(1mM)を含む10mLの培養培地(L-グルタミンを含むDMEM高グルコース)で満たされたコニカルチューブに細胞および溶液を集める。
注:血清はトリプシンの作用を中和することがあります。 - 遠心分離機室温で5分間、400×gでの細胞懸濁液。
- 上清を除去し、新鮮な培地10 mLを加える。同じ条件で再度5分間遠心分離する。
- 上清を除去し、細胞濃度が5×10 5細胞/ mL(血球計数器を用いて細胞を計数することによって決定される)になるように、新しい培地を加える。穏やかなピペッティングでよく混合する。
- 細胞懸濁液を細胞培養皿に分配する。直径60 mmの培養皿あたり3 mLを使用する。
注:この培養は継代ゼロ(P0)と呼ばれます。 - 37℃で5%CO 2インキュベーター内で細胞を維持する。条件培地の半分を2日ごとに新鮮な培地に交換する。
- コンフルエントになる場合は継代培養(ステップ1.2)。
- RPE細胞培養の継代培養
- 培地を除去し、細胞をPBS( - )で2回リンスします。
- 0.05%トリプシン+ 0.2%EDTAを含むPBS( - )溶液と細胞をインキュベートするi5%CO 2インキュベーター中、37℃で5分間インキュベートした。
- 穏やかなピペッティングによりRPE細胞を分離し、10%ブタ血清を含む10mLの培養培地で満たした円錐管内で細胞懸濁液を収集する。
- 室温で5分間400xgで細胞懸濁液を遠心分離する。
- 上清を除去し、細胞濃度を5×10 5細胞/ mL(血球計数器で細胞数を数えることによって決定)とする新しい培地を加える。ステップ1.1.13に記載されているように、直径60mmの新しい培養皿に細胞を分配する。
注:細胞培養は現在、継代1(P1)です。 - コンフルエントに達した後、ステップ1.2.1〜1.2.5に記載したのと同じ手順を用いて、P1培養物をP2に継代培養する。 P2培養物から、直径60mmの培養皿の代わりに、より小さい培養皿(内径30mm)上に細胞を播種する。
- 実験のために、P2またはP3培養物を使用する。
2. Thuliumレーザー照射
- 照射ステーションの構造
- ツリウムレーザー装置(1.94μm、出力範囲:0-20 W)を0.22 NA、365μmのコア径のファイバーに接続します。
- 照射ステーションの垂直金属ポストに水平に固定された金属アームにファイバ先端を機械的に固定する。照射中にレーザーファイバーの先端が細胞培養皿が置かれるホットプレートの上に位置するように垂直ポストを置く。
- ホットプレート上に白い紙を置き、エイミングビームをオンにします(λ= 635 nm、最大= 1 mW、紙面の直径≈30 mm)。白い紙にエイミングビームの周囲をマークし、照射中に培養皿を置く位置がわかるようにします。
注:ファイバチップのz面は変更可能です。追加の結像光学系がなければ、ファイバー先端より12cm下に置かれた細胞培養面上のレーザースポット直径、i約30mmであり、これは細胞培養皿の内径とほぼ同等である。セットアップの概略図を図1に示します 。

図1:ツリウムレーザー照射ステーションの模式図培養プレートを加熱プレート上に置く。ビームサイズが培養皿の内径(約30mm)とほぼ同じになるように細胞をツリウムレーザーファイバーチップの12cm下に置く。レーザー照射手順は、カスタムメイドのシステム設計プラットフォームの時間制御ルーチンによって制御されます。照射プログラムを開始する前に、出力設定を決定する必要があります。 この図の拡大版を見るには、ここをクリックしてください。
- 照射の1時間前に、1.2mLの新鮮な培地で完全に培地を交換する。
注:これは重要なステップであり、厳密に従わなければなりません。 - クリーンベンチに照射ステーション( すなわち、ホットプレートとレーザーファイバーを固定するポスト)を置きます。
- インキュベーターから細胞培養皿を取り出し、ホットプレート上のマークされた位置に置く(ステップ2.1.3)。
- 保護眼鏡を着用してください。ツリウムレーザーをオンにします。レーザー装置に必要に応じてパワーを設定します(0〜20 W調整可能)。エミッションをオンにします。
- レーザー照射とタイミングプロトコル(補足ファイル)を制御するシステム設計プラットフォームを開始します。
- 培養プレートをホットプレート上に置いた直後に、「予熱時間」をクリックして140秒間タイマーを開始する(「予熱時間1」)。これは培地の温度を3℃に保つ照射前7℃。
注:140秒後、ビープ音が鳴り、次のタイマー(「予熱時間2」)が自動的に8秒カウントを開始します。この8秒間に、審査官は培養皿を開けることができる。 148秒の予熱後、細胞培養上で10秒間のレーザー照射が自動的に行われる。緊急時にはレーザー装置を強制停止ボタンで操作してレーザーを直ちに停止させてください。これは重要なステップであり、厳密に従わなければなりません。注意の特別な点は、8秒の予熱時間の開始時に、照射の直前に皿のカバーを開くことに関する。カバーを開くと、メディア表面が非常に急速に冷却されることがあります。 - 照射後、直ちにカバーを培養皿の上に置き、培養皿をホットプレート上にさらに7秒間放置し、37℃、5%CO 2インキュベーターに戻す。
- 直径30mmの培養皿(細胞なし)の4辺(90°ごと)の底に近い小さな穴(直径約300μm)を作る。ブンゼンバーナーで加熱したニードル(20G)の先端を使用してください。外部から電気絶縁テープで穴を塞ぎ、細い針で小さな穴を作って、水密状態でこの穴に微細な熱電対(直径200μm)のみを挿入できるようにします。
- 培養皿の底の外側で、2つの垂直直径を描き、交差点( すなわち、底辺の中央)を座標ゼロ(0)として設定する。線に沿って各方向にディッシュ( すなわち、 0、3、6、9、12、および15 mm)を外側に放射状に3 mmごとに印を付ける( 図2の青い点)。ポイント数は合計で21でなければなりません。
- 1.2 mLの新しい培地で細胞培養皿を満たします。文化dを置く37℃でホットプレート上に置いて、細い熱電対(直径200μm)を側面の穴に挿入し、感知先端を測定すべきマークされた位置に置きます。
- 保護眼鏡を着用してください。ツリウムレーザーをオンにして、レーザー装置のパワー(0.1W単位で0Wと20Wの間)を手動で設定します。
注記:温度校正の場合、電力を3 W単位で測定するだけで十分です。 - システム設計プラットフォームの電源を入れ、 "Start Temp。Acquisition"ボタン(補足ファイル)をクリックして温度測定を開始します。
- 手順2.2.6と同じ手順を実行します。
注記:制御プログラムは、挿入された熱電対の温度を100 msごとに測定し、GUIでの照射中の温度の変化を示します。 - これらの手順は21の測定点すべてと異なる電力設定で実施してください。すべてのポイントとすべてのパワーセッティングについて、手順全体を3回繰り返します信頼性の高いデータを得ることができます。
- 温度データをcsvデータとしてエクスポートし、最終的にスプレッドシートに変換することができます。すべての点で3回測定した場合の照射終了時の最高温度の平均値。同じ円上の点からの値を平均します(中心点を除いて合計4点)。
- 得られた平均最高温度をグラフ上にプロットし、ディッシュの中心からの距離(mm)をx軸、温度上昇(ΔT、℃)をy軸とする。数学的ソフトウェアプログラムのフィット関数を使用して、ガウスモデルを生データに適合させます。ガウス適合温度分布を作成します。

図2:1つの細胞培養プレートにおける温度較正のポイント。温度データを中央で測定し、5℃で測定した。4つの異なる角度(青い点)上の放射状の点。 この図の拡大版を見るには、ここをクリックしてください。
異なる熱照射後の細胞応答の生物学的評価
- 異なるパワー設定および細胞死閾値の決定後の細胞生存度( すなわち、生存、アポトーシスおよび死亡)の評価
- 示された時点( すなわち、照射後3時間、24時間および48時間)で、細胞をPBS( - )で洗浄し、市販のキットを使用して、細胞生存度( すなわち生存、アポトーシス、プロトコル。
- 5μLのフルオレセインイソチオシアネート(FITC) - アネキシンV、5μLのエチジウムホモダイマーIII、および5μLのHoechst 33342を100μLの1×結合緩衝液に添加することによって染色溶液を調製する(全てキットコンポーネント)。細胞を覆うのに十分な染色溶液を調製する。細胞を15分間インキュベートする。
- 結合緩衝液で細胞培養液を2回洗浄し、結合緩衝液をPBS( - )で置換し、蛍光顕微鏡の段階で培養物をセットする。
- 光路を接眼レンズに切り替え、4 '、6-Diamidin-2-phenylindol(DAPI)フィルターを選択し、照明灯を点灯させ、4倍の対物レンズで焦点面を見つけます。
- カメラへの光路を変更し、顕微鏡イメージングソフトウェアでコンピュータ画面上の画像を見つけて、焦点を調整します。
- 細胞培養皿全体の蛍光画像を得るために、顕微鏡特有のソフトウェアのステッチ機能( すなわち、ディッシュ全体に複数の画像を記録し、次いで単一の大きな画像を作成する機能)を使用する。 DAPI、FITC、およびテトラメチルローダミン(TRITC)の3種類のフィルターセットを使用して、Hoechst 33342陽性細胞(すべての細胞核)、FITCアネキシンV陽性細胞ve細胞(アポトーシス)、およびエチジウムホモダイマーIII-陽性細胞(死滅)を示した。
- 染色された細胞培養物中の死んだ(エチジウムホモダイマーIII陽性)領域の半径(mm)およびアポトーシス(アネキシンV陽性)バンド形態領域の外側/内側半径を測定する。これらの半径を、対応する出力設定の温度分布のフィットしたガウス関数に適用します。細胞死およびアポトーシス変化の閾値温度を明らかにするために、死んだまたはアポトーシス領域の縁の正確な温度を計算する。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
異なる電源設定後の温度分布
温度較正では、各単一照射のすべての温度の変化を監視した。このデータから、測定された点における最大温度が得られ、T max (℃)として定義された。 図3Aに示すように、培養皿を加熱プレート上に置いた時点でプログラムを実行した。安定した培地温度を37℃で保存するために必要とされた140秒の「予熱時間1」の後、培養皿のカバーを8秒の「予熱時間2」の間に除去した。 「予熱時間2」の終わりに、レーザ発光が自動的に開始された。この曲線は、10秒照射の代表的な温度進行である。照射中、温度が上昇し、レーザー放出直後にオフになり、温度が低下し始めた。培養皿の中央の最大温度をこの研究ではT max (℃)と定義した。 T maxはレーザー出力に比例していた( 図3B )。 図3Cは、培養皿を横切る各電力の最大温度の分布を示す。これらの分布は、 図3Cに示すようにベル型であり、以下の式に従ってガウス関数に適合する。
t(r)= t base + A・
ここで、r、t base 、A、およびwは、それぞれ中心からの距離(mm)、曲線の最低温度、振幅、および曲線の幅を表します。装着されたGのパラメータ(t base 、A、w)は、グラフの横のテーブルには、各電力設定、すなわち各T maxについてのオーステンカーブが示されている。
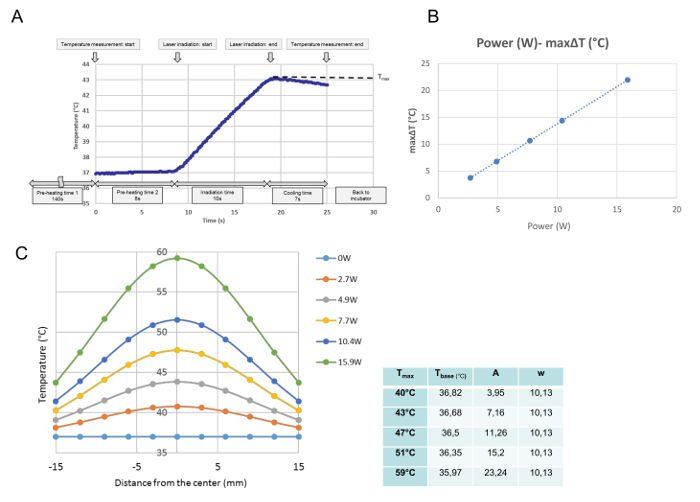
図3:温度較正データ。 4.9W(T max = 43℃)での単一照射後の中央位置における代表的な温度発生( A )、細胞培養の中心位置におけるレーザー出力と最大ΔTとの間の比例関係( B )、異なる電力設定後の培養皿を横切る温度分布(C)。 (A)プログラムは、培養皿が加熱プレート上に置かれた時点から実行される。安定した培地温度を37℃で保存するのに必要な140秒の「予熱時間1」の後、培養皿のカバーを8秒間の予熱時間「予熱時間2」の終了時に自動的にレーザ発光が開始され、この曲線は4.9Wの10秒間の照射中の中心位置の代表的な温度進行である。照射中は温度が上昇し、本研究ではT max (℃)と定義されている照射終了時に最大温度が得られます。 (B)レーザ出力と最大値温度上昇(ΔTmax)は比例する(C)培養ディッシュ全体にわたる測定された温度分布のフィッティングされたガウス関数数学的ソフトウェアプログラムで決定された関数のパラメータはグラフの表の表に示されているこの図の拡大版を見るには、ここをクリックしてください。
熱照射後の細胞生存率
図4Aに示すように、1)アネキシンV /エチジウムホモダイマーIII陽性( すなわち、生きている)、2)中央にアネキシンV陽性( すなわち、早期アポトーシスのみ)、および3)死細胞と生存細胞の境界でアポトーシス細胞に囲まれた中心( すなわち死細胞)でエチジウムホモダイマーIII陽性( 図4B )。死滅/アポトーシス領域のサイズは、一般に、T maxおよび照射後48時間までの照射後時間に依存する。 T max ≦43℃で照射された培養物において、明らかな生存率の変化は検出されなかった。唯一のアポトーシスの変化は、早期の時点(3時間)に観察され、その後に遅く T max = 47℃での照射後の細胞死。 T max ≧51℃で照射された培養物では、即時または早期の細胞死(3時間まで)が見られた(表1)。

図4:致命的なレーザー照射後の死亡およびアポトーシス領域の縁における異なる出力設定(A)および模範的画像後の生存性染色パターン(B)。
(A)温度によっては、3通りの染色パターンが起こります。 (B)死んだ領域(エチジウムホモダイマーIII-陽性:赤色)周辺のアポトーシスゾーン(FITC-アネキシンV-陽性:緑色)。すべての細胞はHoechst 33342(青色)に対して陽性であり、青色核を有する細胞は生細胞である。画像は、T max = 59℃での照射の24時間後に撮影した。バー=100μm。/files/ftp_upload/54326/54326fig4large.jpg "target =" _ blank ">この図の拡大版を見るには、ここをクリックしてください。

表1:様々な温度および時間におけるアネキシンVおよびエチジウムホモダイマーIII応答。
細胞死の閾値温度の決定
死亡領域(赤色)およびアポトーシス領域(緑色)の平均半径を測定し、温度分布のガウス関数に適用して、照射10秒後の細胞死およびアポトーシスの閾値ピーク温度を決定した。この分析によれば、照射後3時間、24時間および48時間の完全細胞死の平均閾値温度は、それぞれ54.0℃、50.9℃および50.1℃であった。平均値51.7℃、48.0℃、および47.0℃でそれぞれ3時間、24時間および48時間の閾値温度で、細胞アポトーシス変化のld温度は約2〜3℃低下した( 図5 )。
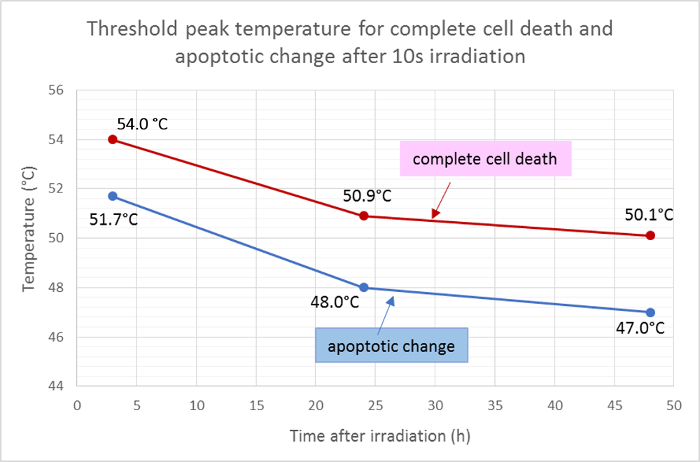
図5:アポトーシスおよび細胞死の閾値温度。
蛍光生存性染色の結果から計算して、照射後の異なる時点での完全な細胞死(Hoechst 33342、アネキシンVおよびエチジウムホモダイマーIII陽性)およびアポトーシス(Hoechst 33342およびアネキシンVのみ陽性)の平均閾値温度。 この図の拡大版を見るには、ここをクリックしてください。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
温度に関連する生物学的細胞応答を議論する際には、ほとんどの生化学的過程が時間依存的であるので、温度だけでなく、温度の上昇時間も重要である。特に、眼科におけるレーザー誘発高熱症の分野では、ミリ秒から秒までの短い時間範囲のため、正確な温度制御による細胞熱作用を調べることは困難である。したがって、厳密な温度および時間制御を可能にする操作システムを有する細胞培養モデルおよび適切なレーザー照射設定が望まれる。タンパク質発現または分泌などの熱暴露後の細胞応答の生物学的評価は、十分な数の罹患細胞についての反復定量評価を必要とする。これは、臨床治療の場合と同様に、直径数百マイクロメートルのレーザースポットを用いた研究の障害となっている。 1つのレーザースポットでの定量分析は非常に効率的ですrdensome。本研究では、これらの要求を可能な限り達成しようとする試みがなされている。照射制御プログラムを用いて1.94μm波長の連続波ツリウムレーザを使用することにより、時間的な温度上昇を、短い時間枠内で細胞培養全体で実施することができた。温度分布は光路を変えることによって調整できるので、この設定を使用して異なる種類の温熱関連実験を行うことができる。
提示された技術の限界は、細胞のレーザー照射中に同時に温度測定を行うことが不可能であることである。熱電対の使用は滅菌細胞培養には適していないので、細胞較正とは別に温度較正を行う必要があります。レーザ出力の可能な変動を考慮すると、各レーザ照射中のリアルタイムの温度測定は、熱量。さらに、ここで使用した温度分布は、培養皿上の21点の測定値およびいくつかの異なる出力設定値に基づくデータ補間によって作成した。したがって、これらの限界および臨界点を克服するために、レーザー照射が行われている間に培養皿の温度を測定することを可能にする代替方法を開発することが我々の目標である。我々はまた、空間温度情報を一度に得ることを目指している。赤外線イメージング(サーモグラフィー)は、レーザー照射中に温度を測定する方法の1つです。この方法の大きな利点は、各照射の細胞レベルでのリアルタイムの温度測定である。その後の細胞生物学的応答は、照射中の温度履歴と常に個々に比較することができる。しかし、コスト効率とユーザビリティを考慮すると、セル加熱実験にサーモグラフィーを使用することは、各ラボでは不可能ですオーリー。
波長1.94μmのツリウムレーザーを用いる方法では、細胞培養皿内の水をその表面で加熱し、熱拡散と対流を用いて細胞を加熱する。 1.2mLの培養培地を用いたこの照射装置における培養培地の高さは、中心位置(光干渉断層撮影を用いた以前の測定から)で935μmである。水中でのツリウムレーザーの吸収レベルは非常に高く(吸収係数:35℃で127cm -1 )、光の72%が培地の最初の100μmに吸収される。 935μmの深さにはほとんど吸収(0.0007%)はありません。
このプロトコルの重要なポイントの1つは、各照射に同じ量の培地(1,200μL)を加えることです。異なる量の培地を使用すると、高さの差異が生じることがあり、これは温度i細胞の増加。第2の重要な点は、培養皿の開口のタイミングに関する。この研究では、照射が開始される8秒前、システムが音を出すのと同時に、これを同時に行う必要があります。このタイミングの違いは、周囲の空気(約23℃)によって引き起こされる冷却のためにベース温度を変える可能性があります。これは、レーザー誘起温度に大きな差をもたらす可能性がある。
温度較正のために、実験で使用した同量の培地(1.2mL)を用いて、無細胞培養皿の底部の温度分布を測定した。しかし、細胞単層を有する培地の高さは、培地の添加量が同じであっても、細胞を含まないものと異なる場合がある。光干渉断層撮影法を用いた測定では、コンフルエントな細胞単層の有無にかかわらず、皿間の中心位置に58μmの差があることが明らかとなった(細胞なしの877μm、細胞で935μm)。この差は潜在的に細胞の毛細管作用に起因する。中心位置における58μmの高さの差は、約40μLの培地(測定データ)によって引き起こされる可能性がある。この高さの差は、すべての出力設定でT maxに有意差を生じさせないことも確認された。したがって、この差はこの研究で行われた分析の結果に大きな影響を与えないと結論した。それにもかかわらず、より正確な温度情報を収集するために、上記のように、細胞単層を含む細胞培養皿を用いて温度を較正する方法を開発すべきである。さらに、培地全体における熱拡散および対流の数学的モデリングもまた必要である。
この研究では、細胞をガウス温度分布で加熱した。時間の経過とともに媒体全体をより均一に加熱する方法はいくつかあります。 1水中でより低い吸収係数を有するレーザー源を使用することである。しかし、欠点は、この場合には、光のわずかな割合しか約0.9mmに吸収されないので、レーザーはより高いパワーを有していなければならないということである。別の可能性は、レーザー光を培養皿の平面に透過するマルチモード光ファイバーの遠位ファイバー先端をイメージングすることである。倍率は光学系によって任意に選択することができる。
このプロトコールの第2のハイライトは、生存率染色の蛍光画像および側方温度分布を用いて、細胞死およびアポトーシスの閾値温度を決定する能力である。長期的な目的は、細胞生存率を決定することだけでなく、タンパク質発現および細胞増殖などの細胞機能に関連する細胞生物学的応答の温度範囲を解明することでもある。細胞死の閾値温度の決定は研究者にとって大きな関心事であるこの方法を用いると、アポトーシスを含む細胞死の重要な因子を決定することができる可能性があります。熱レーザー誘発細胞死の重要な要因は、温度履歴だけでなく、内因性因子これらの質問に答えることは、異なる熱曝露後および異なる網膜病変における細胞死のメカニズムおよび動力学を理解するための道を開くかもしれないし、臨床的に観察された問題を明らかにするのにも役立ち、初期のスポットサイズがほぼ同一であっても(「萎縮性クリープ」)、レーザー治療に応答した個体差や網膜光凝固後の瘢痕の大きさの変動など、
この研究の最終目的は、網膜の温度制御された光熱治療を開発するのを助けることである。これを達成するために、並行して温度測定3の技術的進歩、この方法を用いて決定された熱曝露後のRPE細胞挙動のさらなる解明は大きな利点となる。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
著者は何も開示することはない。
Acknowledgments
この研究は、ドイツ連邦教育研究省(BMBF)(助成金#13GW0043C)と欧州航空宇宙研究開発局(EOARD、助成金#FA9550-15-1-0443)
Materials
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Dulbecco’s Modified Eagle’s Medium - high glucose | Sigma-Aldrich | D5796-500ML | Add (2)-(4) before use. Warm in 37 °C water bath before use. |
| Antibiotic Antimycotic Solution (100 ×) | Sigma-Aldrich | A5955-100ML | Containing 10,000 units penicillin, 10 mg streptomycin and 25 μg Amphotericin B in 1mL. Add 5.5 mL in 500 mL medium bottle (1) before use. |
| Sodium pyruvate (100 mM) | Sigma-Aldrich | S8636-100ML | Add 5.5 mL in 500 mL medium bottle (1) before use (final concentration: 1 mM) |
| Porcine serum | Sigma-Aldrich | 12736C-500ML | Add 50 mL in 500 mL medium bottole (1) before use (final: 10%) |
| Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537-500ML | |
| Trypsin from porcine pancreas | Sigma-Aldrich | T4799-25G | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | ED-100G | |
| Human VEGF Quantikine ELISA Kit | R&D System | DVE00 | |
| Oxiselect Total Glutathione Assay Kit | Cell Biolabs, Inc | STA-312 | |
| Apoptotic/Necrotic/Healthy Cells Detection Kit | PromoKine | PK-CA707-30018 | |
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Thulium laser | Starmedtec GmbH | Prototype | 0-20 W |
| 365 mm core diameter fiber | LASER COMPONENTS Germany | CF01493-52 | |
| Thermocouple | Omega Engineering Inc | HYP-0- 33-1-T-G-60-SMPW-M | |
| Heating plate | MEDAX | ||
| Microplate reader (spectrofluorometer) | Molecular Device | Spectramax M4 | |
| cell homogenizer | QIAGEN | TissueLyser LT | |
| Fluorescence microscope | Nikon | ECLIPSE Ti | |
| mathematical software program | The Mathworks. Inc | MATLAB Release 2015b | |
| system-design platform | National Instrument | Labview | Laboratory Virtual Instrument Engineering Workbench |
References
- Inagaki, K., et al. Comparative efficacy of pure yellow (577-nm) and 810-nm subthreshold micropulse laser photocoagulation combined with yellow (561-577-nm) direct photocoagulation for diabetic macular edema. Jpn J Ophthalmol. 59 (1), 21-28 (2015).
- Roider, J., et al. Selective retina therapy (SRT) for clinically significant diabetic macular edema. Graefes Arch Clin Exp Ophthalmol. 248 (9), 1263-1272 (2010).
- Brinkmann, R., et al. Real-time temperature determination during retinal photocoagulation on patients. J Biomed Opt. 17 (6), 061219 (2012).
- Yoshimura, N., et al. Photocoagulated human retinal pigment epithelial cells produce an inhibitor of vascular endothelial cell proliferation. Invest Ophthalmol Vis Sci. 36 (8), 1686-1691 (1995).
- Denton, M. L., et al. Damage Thresholds for Exposure to NIR and Blue Lasers in an In Vitro RPE Cell System. Invest Ophthalmol Vis Sci. 47 (7), 3065-3073 (2006).
- Shrestha, R., Choi, T. Y., Chang, W., Kim, D. A high-precision micropipette sensor for cellular-level real-time thermal characterization. Sensors (Basel). 11 (9), 8826-8835 (2011).
- Gao, F., Ye, Y., Zhang, Y., Yang, J. Water bath hyperthermia reduces stemness of colon cancer cells. Clin Biochem. 46 (16-17), 1747-1750 (2013).
- Jansen, E. D., van Leeuwen, T. G., Motamedi, M., Borst, C., Welch, A. J. Temperature dependence of the absorption coefficient of water for midinfrared laser radiation. Lasers Surg Med. 14 (3), 258-268 (1994).
- Iwami, H., Pruessner, J., Shiraki, K., Brinkmann, R., Miura, Y. Protective effect of a laser-induced sub-lethal temperature rise on RPE cells from oxidative stress. Exp Eye Res. 124, 37-47 (2014).
- Denton, M. L., et al. Spatially correlated microthermography maps threshold temperature in laser-induced damage. J Biomed Optics. 16 (3), (2011).
- Morgan, C. M., Schatz, H. Atrophic creep of the retinal pigment epithelium after focal macular photocoagulation. Ophthalmology. 96 (1), 96-103 (1989).



