Summary
这里介绍了使用1.94μm连续波激光辐射在培养皿中加热细胞的原始实验装置。使用这种方法,可以研究不同热暴露后视网膜色素上皮(RPE)细胞的生物反应。
Abstract
这里介绍一种使用1.94μm连续波ium激光加热培养细胞进行生物评估的原始方法。钍激光辐射被水强烈吸收,培养皿底部的细胞通过热扩散加热。直径为365μm的激光纤维设置在培养皿上方约12cm处,没有任何光学元件,使得激光束直径几乎等于培养皿的内径(30mm)。通过在每个实验中保持一定量的培养基,可以以高度可重现的温度升高来照射细胞。
为了校准每个功率设置的一个细胞培养皿中的温度升高及其分布,在不同位置和细胞水平的10秒照射期间测量温度。使用数学图形软件表示温度分布节目,其文化菜肴的格局是高斯形式。激光照射后,可以进行不同的生物实验来评估温度依赖性细胞反应。在本手稿中,介绍了活力染色( 即区分活细胞,凋亡细胞和死细胞),以帮助确定不同时间点后细胞凋亡和死亡的阈值温度。
该方法的优点是温度和加热时间的精确度以及其在整个细胞培养皿中加热细胞的高效率。此外,它允许学习各种各样的温度和时间,这可以由计算机操作系统良好控制。
Introduction
了解温度依赖性细胞生物学反应对于成功的高热治疗非常重要。用于眼科的热激光视网膜激光凝固是医学中最成熟的激光治疗之一。视网膜激光治疗使用可见光,主要由绿色到黄色波长。光被视网膜色素上皮(RPE)细胞中的黑色素高度吸收,其形成视网膜的最外层细胞单层。医学界和研究人员近来对非常温和的热辐射(sub-visible光凝)感兴趣,作为不同种类的视网膜疾病1,2的新治疗策略。按照这种趋势,我们的兴趣在于在精确温度控制下,即温控光热疗法(TC-PTT)的技术在低温加热RPE细胞。
最近光电我们研究所的声学技术允许实时测量视网膜辐射部位的温度升高。这样可以控制照射期间的温度升高3 。然而,由于由于不可能测量和控制温度,以前没有考虑过由致死的RPE细胞引起的视网膜上的亚致死热疗,热激光照射后RPE细胞的温度依赖性细胞反应具有迄今为止研究很少。此外,不仅没有详细讨论温差,而且在致死和致死辐射后存活细胞的细胞行为的差异。因此,为了收集基于TC-PTT的治疗的科学证据,我们的目的是通过体外实验设置来阐明温度依赖性RPE细胞的生物反应及其机制。
对于t他的目的是建立满足以下条件的电池加热装置:1)快速升温的可能性,2)精确控制的时间和温度,3)生物实验检测细胞数量相对较多。关于加热方法,临床激光,例如倍频Nd.YAG激光(532nm),不幸的是不适合于细胞培养加热。这是因为培养的RPE细胞中黑素体数量大大减少。激光吸收可能是不均匀的,并且在实验之间,细胞水平的温度升高是可变的,即使用相同的辐射功率照射也是如此。以前的几项研究报道了在照射期间使用黑色纸底部的黑纸4或使用在实验5,6之前被培养细胞吞噬的其他黑素体。许多使用热板,水浴或温度为7 ℃的CO 2培养箱进行用于评估热疗诱导的细胞应答的体外生物学研究。这些方法需要较长的加热周期,因为它需要一些时间( 即几分钟)达到所需的温度。此外,使用这些方法,难以在细胞水平上获得详细的热历史( 即,温度乘以时间)。此外,一个培养皿中不同位置的细胞之间的温度可能由于可变的温度扩散而不同。在大多数情况下,即使生物细胞反应可能严重受温度升高和持续时间的影响,生物分析尚未考虑过热过程中的这种时间和空间温度信息。
为了克服这些问题,在这里使用湍流湍流激光来加热细胞。钍激光辐射(λ=1.94μm)被水8强烈吸收,培养皿底部的细胞仅通过热扩散热刺激。具有365μm直径的激光纤维设置在培养皿上方约12cm处,两者之间没有任何光学器件。激光束直径发散,几乎等于培养基表面培养皿(30mm)的内径。用一致量的培养基可以照射温度升高的细胞重复性高。可变功率设置可实现高达20 W的照射,细胞水平的介质温度可能会在10秒内增加到ΔT≈26°C。
通过改变照射条件,也可以改变激光束轮廓以改变温度分布在一个文化菜。例如,可以用当前研究中的高斯样温度分布或均匀的温度分布进行研究。后者可能有利于调查温度依赖性细胞反应对于亚致死温度升高的影响,而不是用于细胞死亡应激或伤口愈合反应。
总之,不同热暴露后,ium激光照射可以调查不同种类的生物因子,如基因/蛋白质表达,细胞死亡动力学,细胞增殖和细胞功能发育。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
RPE细胞培养
- 从猪眼中分离RPE细胞
- 从当地屠宰场获取新鲜去核的猪眼。保持凉爽(4°C),并在黑暗的环境中。
- 用剪刀去除细胞外组织,并将眼睛浸泡在消毒溶液中5分钟。
- 将眼睛置于无钙和镁(PBS( - ))的无菌磷酸盐缓冲盐水中直至使用。
- 使用手术刀,在角膜缘后方约5毫米处穿透巩膜。用剪刀切割,平行于角膜缘,切除眼睛的整个前部。
- 去除眼睛前部( 即角膜和晶状体)和玻璃体。加入1 mL PBS( - ),轻轻取出神经视网膜。
注意:这个“眼杯”,由巩膜,脉络膜和RPE组成,现在已经准备好了。 - 在P中加入预热(37℃)0.25%胰蛋白酶BS( - )到眼杯。调节体积,使眼睛杯的大约80%充满这种胰蛋白酶溶液。
- 使用胰蛋白酶溶液将眼杯在5%CO 2培养箱中于37℃孵育10分钟。
- 从培养箱中取出眼罩,用含有0.05%胰蛋白酶+ 0.2%乙二胺四乙酸四钠盐(EDTA·4N)的PBS( - )溶液代替0.25%胰蛋白酶溶液。将孵育器中的眼杯孵育45分钟。
注意:45分钟后,RPE细胞将松弛地连接到Bruch膜上,或者已经分离并漂浮在胰蛋白酶-EDTA溶液中。 - 通过温和吸液收集RPE细胞。将细胞和溶液收集在装有10mL培养基(含有L-谷氨酰胺的DMEM高葡萄糖)的锥形管中,包括10%猪血清,抗生素/抗真菌剂和丙酮酸钠(1mM)。
注意:血清可能会中和胰蛋白酶的作用。 - 离心机室温400×g细胞悬液5分钟。
- 取上清液加入10毫升新鲜培养基。在相同条件下再次离心5分钟。
- 去除上清液并加入新培养基,使得细胞浓度达到5×10 5个细胞/ mL(通过使用血细胞计数器计数细胞测定)。通过温和移液混匀。
- 在细胞培养皿中分配细胞悬浮液。每60毫米直径的培养皿使用3毫升。
注意:这种文化称为通过零(P0)。 - 将细胞保持在37℃的5%CO 2培养箱中。将条件培养基的一半每隔一天更换成新鲜培养基。
- 亚文化(步骤1.2)如果变得融合。
- RPE细胞培养的亚文化
- 取出培养基,用PBS( - )冲洗细胞两次。
- 用含有0.05%胰蛋白酶+ 0.2%EDTA的PBS( - )溶液孵育细胞na 5%CO 2培养箱中37℃5分钟。
- 通过轻轻移液分离RPE细胞,并将细胞悬浮液收集在装有10mL培养基(包括10%猪血清)的锥形管中。
- 在室温下将细胞悬浮液以400xg离心5分钟。
- 去除上清液并添加新的培养基,使细胞浓度为5×10 5个细胞/ mL(通过用血细胞计数器计数细胞数确定)。将细胞分布在新的60毫米直径的培养皿中,如步骤1.1.13中所述。
注意:细胞培养现在是第1(P1)号。 - 达到融合后,使用步骤1.2.1-1.2.5中所述的相同步骤将P1培养基传代培养至P2。从P2培养物中,将细胞种在更小的培养皿(30mm内径)上,而不是直径为60mm的培养皿。
- 对于实验,使用P2或P3培养。
Thul镭激光照射
- 辐照站的建设
- 将ium激光器件(1.94μm,功率范围:0-20W)连接到0.22-NA,365μm芯直径的光纤。
- 将纤维头机械地固定在水平固定在照射台的垂直金属柱上的金属臂上。放置垂直柱,使得激光纤维的尖端位于照射期间放置细胞培养皿的热板上方。
- 在热板上放置白纸,并将瞄准光束(λ= 635 nm,max = 1 mW,纸张直径≈30 mm)。将目标光束的圆周标记在白纸上,使得在照射期间放置培养皿的位置是已知的。
注意:纤维尖端的z平面可能是可变的。没有任何额外的成像光学元件,细胞培养平面上的激光光斑直径,放置在纤维尖端12厘米处,约30mm,几乎相当于细胞培养皿的内径。设置的示意图如图1所示。

图1:ium激光照射站示意图。将培养皿放置在加热板上。将细胞放置在ium激光纤维尖端下方12cm处,使得束尺寸几乎与培养皿的内径相同(约30mm)。激光照射程序由定制系统设计平台的时间控制程序控制。功率设置必须在照射程序启动前确定。 请点击此处查看此图的较大版本。
- 照射前1 h,用1.2 mL新鲜培养基完全取代培养基。
注意:这是一个关键步骤,必须严格遵循。 - 将辐射站( 即热板和固定激光光纤的柱)放在干净的工作台上。
- 从培养箱中取出细胞培养皿,并将其放在热板上的标记位置(步骤2.1.3)。
- 戴防护眼镜。打开ium激光。根据需要在激光设备上设置电源(可调0 - 20 W)。打开排放物。
- 启动控制激光照射和定时协议(补充文件)的系统设计平台。
- 将培养皿放置在热板上后,点击“预热时间”开始定时器140秒(“预热时间1”);这将使培养基温度保持在3℃照射前7°C。
注意:140秒后,哔声会打开,下一个定时器(“预热时间2”)将自动开始计数8秒。在这8年的时间里,考官可以打开文化菜。在预热148秒后,将自动进行细胞培养10秒长的激光照射。在紧急情况下,为激光设备配备强制退出按钮,以立即停止激光。这是一个关键步骤,必须严格遵循。特别要注意的是,在8秒的预热时间开始之前,打开辐照前的盘盖。打开盖可能非常快地冷却介质表面。 - 照射后立即将盖子放回培养皿中,将培养皿放置在热板上另外7秒,然后放回5%CO 2培养箱中37℃。
- 在30毫米直径的培养皿(无细胞)的四面(每90°)处接近底部的小孔(直径约300μm);使用用本生灯加热的针头(20G)。用外部电隔离带密封孔,并用细针形成一个小孔,使得只有一个细微的热电偶(直径200μm)可以在水密条件下穿过该孔插入。
- 在培养皿底部的外侧,绘制2个垂直直径,并将交叉点( 即底侧的中心)设为坐标零点(0)。在沿着线的每个方向( 图2 ,蓝点),每3mm径向向外标出盘( 即, 0,3,6,9,12和15mm);总分数应为21个。
- 用1.2mL新培养基填充细胞培养皿。放置文化d在37℃的热板上,将一个细微的热电偶(直径200μm)插入侧孔,并将其敏感尖端放在要测量的标记位置。
- 戴防护眼镜。打开ium激光器,并手动设置激光设备的功率(0到20 W,以0.1-W为增量)。
注意:对于温度校准,以3W为增量的功率测量应足够。 - 打开系统设计平台,点击“开始温度采集”按钮(补充文件)开始温度测量。
- 执行与步骤2.2.6相同的步骤。
注意:控制程序每100 ms测量插入的热电偶的温度,并显示在GUI中照射期间的温度进行。 - 对所有21个测量点和不同的功率设置执行这些程序。对所有点和所有功率设置重复整个程序三次gs来实现可靠的数据。
- 将温度数据导出为csv数据,最终可以将其转换为电子表格。在每一点对于一式三份的测量,平均照射结束时的最高温度。从同一个圆上的点平均值(总共4个点,中心点除外)。
- 将获得的平均最大温度绘制在曲线图上,使得距离中心的距离(mm)为x轴,温度升高(ΔT,°C)为y轴。使用数学软件程序的拟合函数将高斯模型拟合到原始数据。创建高斯拟合温度分布。

图2:一个细胞培养皿中的温度校准点。温度数据在中心和5处测量4个不同角度的径向点(蓝点)。 请点击此处查看此图的较大版本。
3.不同热辐射后细胞反应的生物学评估
- 在不同的功率设置和细胞死亡阈值的确定之后,评估细胞活力( 即,生活,凋亡和死亡)
- 在指定的时间点( 即照射后3,24和48小时),用PBS( - )洗涤细胞,并使用市售试剂盒来评估细胞活力( 即,重要的,凋亡的,死亡的),根据制造商的协议。
- 通过加入5μL异硫氰酸荧光素(FITC)-annexin V,5μL乙锭均质二聚体III和5μLHoechst 33342至100μL的1x结合缓冲液(均为试剂盒)来制备染色溶液组件)。准备足够的染色溶液以覆盖细胞。孵育细胞15分钟。
- 用结合缓冲液洗涤细胞培养物两次,用PBS( - )替换结合缓冲液,并将培养物置于荧光显微镜的阶段。
- 将光路切换到眼镜,选择4',6-脒基-2-苯基吲哚(DAPI)过滤器,打开照明光,并用4x物镜找到聚焦平面。
- 将光路更改为相机,在显微镜成像软件中在计算机屏幕上找到图像,并调整焦点。
- 使用针迹功能( 即,该功能在整个盘上记录多个图像,然后创建单个大图像)的显微镜专用软件,以获得整个细胞培养皿的荧光图像。使用3种不同的过滤器组--DAPI,FITC和四甲基罗丹明(TRITC)至图像Hoechst 33342阳性细胞(全细胞核),FITC-膜联蛋白V-定位ve细胞(凋亡)和同源二聚体III-阳性细胞(死亡)。
- 测量染色细胞培养物中死亡(同源二聚体III-阳性)亚区域的半径(mm)和凋亡(膜联蛋白V阳性)带状区域的外/内半径。将这些半径应用于相应功率设置的温度分布的拟合高斯函数。计算死亡或凋亡区域边缘处的确切温度,以澄清细胞死亡和凋亡改变的阈值温度。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
不同功率设置后的温度分布
在温度校准中监测每个单次照射的所有温度发展。根据该数据,得到测定点的最高温度,定义为T max (℃)。 如图3A所示,在将培养皿放置在加热板上的时间点执行程序。在37℃下保存稳定的培养基温度需要140s的“预热时间1”之后,在8秒的“预热时间2”内除去培养皿的盖子。在“预热时间2”结束时,激光发射自动开始。该曲线是10秒照射的代表性温度进程。在照射期间,温度升高,激光发射后立即升高关闭,温度开始下降。在本研究中将培养皿中心的最高温度定义为T max (℃)。 T max与激光功率成比例( 图3B )。 图3C显示了跨越培养皿的每个功率的最大温度的分布。分布是钟形的, 如图3C所示,并根据下列公式适合高斯函数:
t(r)= t base + A· 
其中r,t base ,A和w分别代表中心(mm)的距离,曲线的最低温度,曲线的幅度和宽度。拟合G的参数(t base ,A和w)每个功率设置的高斯曲线,即对于每个T max ,在图表旁边显示。
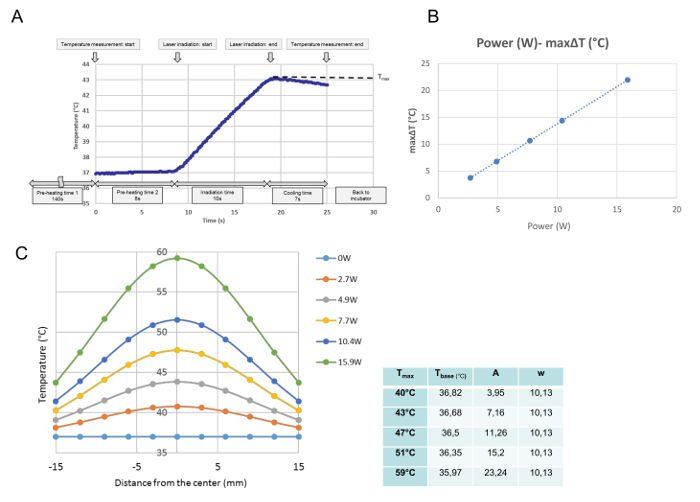
图3:温度校准数据。在4.9 W(T max = 43°C)( A )单次照射后中心位置的代表性温度发展,激光功率与细胞培养中心位置的最大ΔT之间的比例关系( B ),和不同功率设置后的培养皿中的温度分布(C)。 (A)从培养皿放置在加热板上的时间点执行程序。在37℃保存稳定的培养基温度需要140s的“预热时间1”之后,将培养皿的盖子除去8秒的“预热时间2.“在”预热时间2“结束时,激光发射自动开始,该曲线是在4.9W的10秒照射期间的中心位置处的代表性温度进行。在照射期间,温度升高,在激光发射关闭后,温度开始下降,在本研究中定义的最大温度为T max (°C); (B)激光功率和最大值温度升高(ΔTmax)是成比例的(C)培养皿中测量温度分布的拟合高斯函数,用数学软件程序确定的功能参数显示在图表侧面请点击此处查看此图的较大版本。
热辐射后细胞活力
如图4A所示,激光照射后有三种不同的染色模式,表明细胞存活力:1)没有膜联蛋白V /同型二聚体III阳性( 即仅活),2)膜中心V阳性( 即几乎只有早期凋亡),和3)在死亡细胞和活细胞之间的边界处凋亡细胞包围的中心( 即死细胞)的中心( 即死细胞)的同源二聚体III-阳性( 图4B )。死亡/凋亡区域的大小通常取决于T max和照射后48小时的照射后时间。在用T max≤43℃照射的培养物中没有检测到明显的活力变化。在早期的时间点(3 h)可以观察到唯一的凋亡变化,其次是晚期 T max = 47°C照射后细胞死亡。在T max≥51°C照射的培养物中发现立即或早期细胞死亡(最多3 h)(表1)。

图4:不同功率设置(A)后的活力染色模式和致死激光辐照后死亡和凋亡区域的示例性图像(B)。
(A)取决于温度,可能会发生三种染色方式。 (B)死区周围的凋亡区(FITC-膜联蛋白V阳性:绿色)(同源二聚体III-阳性:红色)。所有细胞均为Hoechst 33342(蓝色)阳性,具有蓝色核的细胞为活细胞。在T max = 59℃照射后24小时拍摄图像。 Bar =100μm。/files/ftp_upload/54326/54326fig4large.jpg“target =”_ blank“>请点击此处查看此图的较大版本。

表1:各种温度和时间的膜联蛋白V和异源二聚体III反应。
确定细胞死亡的阈值温度
测量死区(红色)和凋亡面积(绿色)的平均半径,并将其应用于温度分布的高斯函数,以确定10秒照射后细胞死亡和凋亡的阈值峰值温度。根据这一分析,照射后3 h,24 h和48 h完全细胞死亡的平均阈值温度分别为54.0°C,50.9°C和50.1°C。平均thresho细胞凋亡变化的温度低于约2-3℃,阈值温度分别为51.7℃,48.0℃和47.0℃,为3小时,24小时和48小时( 图5 )。
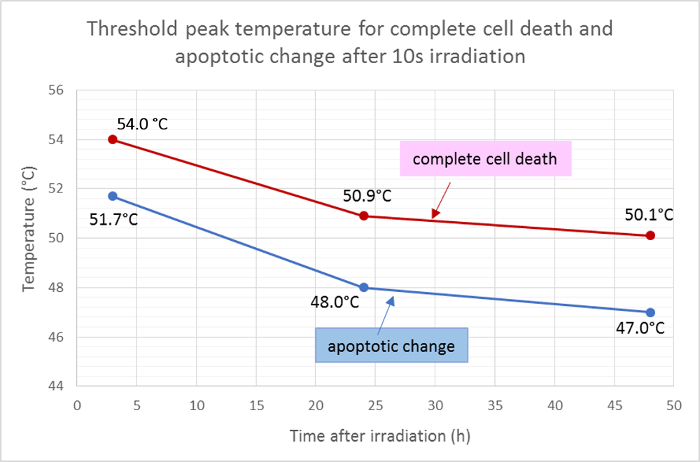
图5:凋亡和细胞死亡的阈值温度。
从荧光活力染色结果计算,完全细胞死亡的平均阈值温度(Hoechst 33342,膜联蛋白V和同源二聚体III的阳性)和凋亡(在Hoechst 33342和膜联蛋白V阳性)在照射后的不同时间点。 请点击此处查看此图的较大版本。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
在讨论温度相关的生物细胞反应时,不仅温度升高,而且温度升高的持续时间也是重要的,因为大多数生化过程都是时间依赖性的。特别是在激光诱导的眼科热疗领域,由于时间范围很短(从几毫秒到几秒),很难用精确的温度控制来研究细胞热效应。因此,期望适用于细胞培养模型的激光照射装置和能够进行严格的温度和时间控制的操作系统。热暴露后细胞反应(如蛋白质表达或分泌)的生物学评估需要对足够数量的受影响细胞进行重复定量评估。如在临床治疗中那样,使用直径几百微米的激光斑点进行研究是一个障碍。单个激光点的定量分析是相当的rdensome。在这项研究中,已经尝试尽可能地满足这些需求。通过使用具有照射控制程序的1.94μm波长连续波ium激光器,可以在短时间内在整个细胞培养物中进行时间温度升高。由于可以通过改变光路来调节温度分布,可以使用该设置进行不同种类的热疗相关实验。
所提出的技术的局限性是在电池的激光照射期间不可能进行同时的温度测量。由于使用热电偶不适合灭菌细胞培养,因此温度校准必须与细胞照射分开进行。考虑到激光功率输出的可能变化,每次激光照射期间的实时温度测量将是理想的,直接评估对应于热剂量。此外,这里使用的温度分布是通过基于在培养皿上21点的测量和几种不同功率设置下的测量的数据插值产生的。因此,为了克服这些局限性和关键点,我们的目标是开发一种替代方法,允许在进行激光照射时测量培养皿的温度。我们也瞄准一次获得空间温度信息。红外成像(热成像)是在激光照射期间测量温度的一种可能的方法10 。该方法的优点是每次照射时细胞水平上的实时温度测量;随后的细胞生物反应总是可以单独地与照射期间的温度历史进行比较。然而,考虑到成本效益和可用性,对于每个实验室来说,使用热成像进行电池加热实验是不可能的ORY。
在使用波长为1.94μm的ium激光的方法中,细胞培养皿中的水在其表面被加热,并且使用热扩散和对流来加热细胞。在该照射装置中,1.2mL培养基的培养基的高度在中心位置为935μm(来自使用光学相干断层摄影的先前测量)。镭激光在水中的吸收水平非常高(35℃时的吸收系数为127cm -1 ),72%的光在培养基的第一个100μm中被吸收。 935μm深度几乎没有吸收(0.0007%)。
重要的是要注意,方案的关键点之一是为每次照射添加相同量的培养基(1,200μL)。使用不同量的培养基可能导致高度差异,这可能导致温度差异i细胞增殖。第二个关键点与培养皿开放的时间有关。必须在同一时间完成 - 在本研究中,在照射开始前8秒,当系统发出声音时。该时间的差异可能会由于周围空气(约23°C)引起的冷却而改变基础温度。这可能导致激光诱导温度的显着差异。
对于温度校准,使用与实验中使用的相同量的培养基(1.2mL)来测量无细胞培养皿底部的温度分布。然而,具有细胞单层的中等高度可以与不含细胞的培养基高度不同,即使加入相同体积的培养基也是如此。使用光学相干断层扫描的测量显示,在具有和不具有汇合细胞单层的培养皿之间的中心位置处存在58μm的差异(没有细胞的877μm,比较to 935微米与细胞)。这种差异可能是由于细胞的毛细作用。中心位置的高度差异为58微米,可能由大约40微升的介质(测量数据)引起。还证实,在所有功率设置下,这种高度差异并没有导致T max的显着差异。因此,我们得出结论,这种差异不会对本研究中进行的分析结果产生重大影响。然而,如上所述,为了收集更精确的温度信息,应开发使用含有细胞单层的细胞培养皿校准温度的方法。此外,还需要在整个培养基中的热扩散和对流的数学建模。
在这项研究中,细胞被加热与高斯温度分布。有几种可能的方法可以随时间均匀地加热整个介质。一是在水中使用吸收系数较低的激光源。然而,缺点在于,在这种情况下,激光器必须具有更高的功率,因为只有一小部分光被吸收在约0.9mm以上。另一种可能性是将多模光纤的远端光纤尖端成像,其将激光传输到培养皿的平面中;放大倍率可以由光学器件任意选择。
该方案的第二个亮点是其使用活力染色的荧光图像和横向温度分布来确定细胞死亡和凋亡的阈值温度的能力。长期目标不仅是确定细胞存活力,还要阐明与细胞功能相关的细胞生物反应的温度范围,如蛋白质表达和细胞增殖。细胞死亡阈值温度的测定是研究人员非常感兴趣的“10,使用这种方法,可能有可能确定细胞死亡的关键因素,包括凋亡,热激光诱导的细胞死亡的关键因素不仅可以通过温度历史,还可以通过内源性因素即分子水平的细胞内/细胞外因子)回答这些问题可能为不同的热暴露和不同的视网膜病变之间了解细胞死亡机制和动力学铺平道路,此外还有助于澄清临床观察到的问题,例如即使初始斑点大小几乎相同(“萎缩蠕变”) 11时,激光治疗反应的个体间差异或视网膜光凝后瘢痕尺寸的变异性。
本研究的最终目的是帮助开发视网膜的温度控制光热疗法。为了达到这个目的,温度测量的技术进步3 ,进一步阐明热暴露后的RPE电池行为,使用这种方法确定将会有很大的好处。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
作者没有什么可以披露的。
Acknowledgments
这项工作得到了德国联邦教育研究部(BMBF)(授权号13GW0043C)和欧洲航空航天研究和开发办公室(EOARD,授权号FA9550-15-1-0443)的研究资助。
Materials
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Dulbecco’s Modified Eagle’s Medium - high glucose | Sigma-Aldrich | D5796-500ML | Add (2)-(4) before use. Warm in 37 °C water bath before use. |
| Antibiotic Antimycotic Solution (100 ×) | Sigma-Aldrich | A5955-100ML | Containing 10,000 units penicillin, 10 mg streptomycin and 25 μg Amphotericin B in 1mL. Add 5.5 mL in 500 mL medium bottle (1) before use. |
| Sodium pyruvate (100 mM) | Sigma-Aldrich | S8636-100ML | Add 5.5 mL in 500 mL medium bottle (1) before use (final concentration: 1 mM) |
| Porcine serum | Sigma-Aldrich | 12736C-500ML | Add 50 mL in 500 mL medium bottole (1) before use (final: 10%) |
| Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537-500ML | |
| Trypsin from porcine pancreas | Sigma-Aldrich | T4799-25G | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | ED-100G | |
| Human VEGF Quantikine ELISA Kit | R&D System | DVE00 | |
| Oxiselect Total Glutathione Assay Kit | Cell Biolabs, Inc | STA-312 | |
| Apoptotic/Necrotic/Healthy Cells Detection Kit | PromoKine | PK-CA707-30018 | |
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Thulium laser | Starmedtec GmbH | Prototype | 0-20 W |
| 365 mm core diameter fiber | LASER COMPONENTS Germany | CF01493-52 | |
| Thermocouple | Omega Engineering Inc | HYP-0- 33-1-T-G-60-SMPW-M | |
| Heating plate | MEDAX | ||
| Microplate reader (spectrofluorometer) | Molecular Device | Spectramax M4 | |
| cell homogenizer | QIAGEN | TissueLyser LT | |
| Fluorescence microscope | Nikon | ECLIPSE Ti | |
| mathematical software program | The Mathworks. Inc | MATLAB Release 2015b | |
| system-design platform | National Instrument | Labview | Laboratory Virtual Instrument Engineering Workbench |
References
- Inagaki, K., et al. Comparative efficacy of pure yellow (577-nm) and 810-nm subthreshold micropulse laser photocoagulation combined with yellow (561-577-nm) direct photocoagulation for diabetic macular edema. Jpn J Ophthalmol. 59 (1), 21-28 (2015).
- Roider, J., et al. Selective retina therapy (SRT) for clinically significant diabetic macular edema. Graefes Arch Clin Exp Ophthalmol. 248 (9), 1263-1272 (2010).
- Brinkmann, R., et al. Real-time temperature determination during retinal photocoagulation on patients. J Biomed Opt. 17 (6), 061219 (2012).
- Yoshimura, N., et al. Photocoagulated human retinal pigment epithelial cells produce an inhibitor of vascular endothelial cell proliferation. Invest Ophthalmol Vis Sci. 36 (8), 1686-1691 (1995).
- Denton, M. L., et al. Damage Thresholds for Exposure to NIR and Blue Lasers in an In Vitro RPE Cell System. Invest Ophthalmol Vis Sci. 47 (7), 3065-3073 (2006).
- Shrestha, R., Choi, T. Y., Chang, W., Kim, D. A high-precision micropipette sensor for cellular-level real-time thermal characterization. Sensors (Basel). 11 (9), 8826-8835 (2011).
- Gao, F., Ye, Y., Zhang, Y., Yang, J. Water bath hyperthermia reduces stemness of colon cancer cells. Clin Biochem. 46 (16-17), 1747-1750 (2013).
- Jansen, E. D., van Leeuwen, T. G., Motamedi, M., Borst, C., Welch, A. J. Temperature dependence of the absorption coefficient of water for midinfrared laser radiation. Lasers Surg Med. 14 (3), 258-268 (1994).
- Iwami, H., Pruessner, J., Shiraki, K., Brinkmann, R., Miura, Y. Protective effect of a laser-induced sub-lethal temperature rise on RPE cells from oxidative stress. Exp Eye Res. 124, 37-47 (2014).
- Denton, M. L., et al. Spatially correlated microthermography maps threshold temperature in laser-induced damage. J Biomed Optics. 16 (3), (2011).
- Morgan, C. M., Schatz, H. Atrophic creep of the retinal pigment epithelium after focal macular photocoagulation. Ophthalmology. 96 (1), 96-103 (1989).



