Summary
Dit protocol beschrijft een efficiënte elektroporatiemethode voor de transfection van vier verschillende gastro-intestinale organoïde entiteiten met grotere plasmiden (in de mate van 10 kB). Het kan binnen één dag worden uitgevoerd en heeft geen uitgebreide voorbereiding of speciale, kostenintensieve elektroporatiebuffers nodig.
Abstract
Elektroporatie is een veel voorkomende methode voor transfection met verschillende soorten moleculen door elektrische permeabilisatie van het plasmamembraan. Met het toenemende gebruik van organoïden als kweekmethode voor primair patiëntmateriaal in de afgelopen jaren zijn efficiënte overdrachtsmethoden van componenten voor genetische manipulatie in dit 3D-kweeksysteem in nood. Vooral voor organoïden hangt de efficiëntie van genetische manipulaties af van een succesvolle transfection. Zo werd dit protocol ontwikkeld om de elektroporatie van organoïden te vergemakkelijken en de universele functionaliteit ervan in verschillende entiteiten te bewijzen. Menselijke colorectale, alvleesklier-, lever- en maagkankerorganoïden werden met succes geëlekporated met kleine en grote plasmiden in vergelijking. Op basis van GFP-coderingsvectoren werd de transfection-efficiëntie bepaald door FACS. Er zijn geen uitgebreide voorbereiding van de cellen of speciale, kostenintensieve elektroporatiebuffers nodig en het protocol kan binnen één dag worden uitgevoerd.
Introduction
In de afgelopen jaren werd een nieuw 3D-celkweeksysteem ontwikkeld, organoïden genoemd, ontwikkeld voor verschillende normale en kankerweefsel. Organoïden zijn functioneel en morfologisch zeer dicht bij hun weefsel van oorsprong. Ze kunnen worden gegenereerd uit verschillende soorten, zijn gemakkelijk uitbreidbaar, genomisch stabiel en genetisch aanpasbaar, waardoor ze een ideaal modelsysteem voor genetische onderzoeken1,2,3. Genetische engineering technieken zoals de CRISPR (Geclusterd Regelmatig Interspaced Short Palindrmic Repeats)/Cas9 systeem maken diverse manipulaties mogelijk. De selectie van klonen kan worden gerealiseerd door gedefinieerde mediavoorwaarden, bijvoorbeeld door WNT ligand terugtrekking voor APC (Adenomatose Polyposis Coli) knock-out klonen4,5. Als alternatief moeten selectiemarkeringen worden geïntroduceerd door homologe gerichte reparatie van een targetingvector6,7. Doordat er vaak meer dan één plasmid moet worden ingevoerd, wordt een efficiënte transfection een cruciale parameter. Bovendien is een tijdelijke uitdrukking van de Cas9 endonuclease wenselijk om niet-specifieke off-target effecten teverminderen.
Elektroporatie is een relatief eenvoudige methode om cellen te transfectmet DNA, RNA, eiwitten of andere macromoleculen. Door middel van elektrische pulsen wordt het celmembraan doorlatender en veroorzaakt het een verhoogde opname9. In een eerder gepubliceerd elektroporatieprotocol van colonorganoïden werd een efficiëntie van 30 % met een piggy-bac GFP (groen fluorescerend eiwit) dat vector (7,4 kB) uitdrukt, bereikt in een vierdaagse procedure10. Het volgende protocol is ontwikkeld om een efficiënte transfection van kanker of gezonde organoïden met grote plasmiden codering voor single guide RNA (sgRNA) en de Cas9 endonuclease sequentie (bijvoorbeeld px458 als vector met 9.3 kb) te vergemakkelijken. Het hele elektroporratieproces kan binnen één dag worden uitgevoerd, zonder speciale elektroporatiebuffers, en met ten minste vergelijkbare efficiëntietussen verschillende gastro-intestinale organoïden, namelijk pancreaskanaaladenocarcinoma (PDAC), colorectale kanker (CRC), cholangiocarcinoma (CCC) en maagkanker (GC) organoïden.
Protocol
De ethische goedkeuring werd verkregen van de ethische commissie van de TU Dresden (#EK451122014).
1. Organoïde cultuur en preparaten vóór elektroporatie
- Vestig organoïden door weefselvertering zoals eerder beschreven en breid ze uit met hun overeenkomstige entiteitspecifieke kweekmedium in een keldermatrix (overzicht zie tabel 1 en Materiaaltabel)11,12,13,14,15,16,17.
OPMERKING: Voor menselijke weefselmonsters is geïnformeerde toestemming en goedkeuring van de studie door een ethische commissie noodzakelijk. - Prewarm 48-well platen bij 37 °C voor post-elektroporatie zaaien.
- Bereid basale medium w/o-antibiotica en entiteitsspecifieke organoïde kweekmedium w/o-antibiotica (zie tabel 1) inclusief 10 μM Y-27632 en 3 μM CHIR99021.
OPMERKING: De intrekking van antibiotica is belangrijk om toxische effecten te verminderen. Y-27632 en CHIR99021 verbeteren celherstel10. -
Bereiding van de organoïden (zie figuur 1)
- Cultiver 5 putten van organoïden in een 48-put plaat per elektroporatie monster in kweekmedium.
OPMERKING: Proliferative organoïden moeten worden gebruikt (ongeveer 2-3 dagen na de laatste splitsing). - Bereid 230 μL dissociatiereagen (zie Materiaaltabel)voor, inclusief 10 μM Y-27632 per put.
- Verwijder het kweekmedium uit elke put en distantieer de organoïden mechanisch in 230 μL van het bereide dissociatiemengsel. Pool 5 putten per elektroporatie monster in een 15 mL buis.
- Meng door vortexing en incubeer gedurende 5-15 min bij 37 °C tot clusters van 10-15 cellen optreden. Controleer daarom microscopisch de dissociatie. Stop de spijsvertering door het toevoegen van basale medium w / o antibiotica tot 10 mL.
LET OP: Deze stap is zeer kritisch! De elektroporatie-efficiëntie zal worden verminderd, wanneer de incubatie te kort is, maar lange spijsvertering zal de overlevingskansverminderen. - Centrifugeer bij 450 x g voor 5 min bij kamertemperatuur, gooi de supernatant weg en was twee maal met 4 mL elektroporatiebuffer (zie Tabel met materialen).
- Cultiver 5 putten van organoïden in een 48-put plaat per elektroporatie monster in kweekmedium.
2. Elektroporatie
OPMERKING: Het volgende protocol is ontwikkeld voor elektroporators die in staat zijn om vierkante golven en gescheiden poring en overdracht puls sequenties (zie figuur 2). Optioneel kunnen impedantiewaarden en de spanningen, stromen en energieën die in het monster worden overgebracht, worden gemeten als controle voor reproduceerbare experimenten.
- Resuspend de organoïde pellet in 100 μL elektroporatiebuffer (zie Tabel met materialen)met 30 μg plasmidDNA.
OPMERKING: De concentratie van het gebruikte plasmide-DNA moet meer dan 5 μg/μL bedragen voor een optimale zoutconcentratie tijdens het elektroporatieproces. Daarom worden endofree plasmid maxi kits (zie Tabel met materialen)voor de bereiding van vectoren aanbevolen. Een totale hoeveelheid tot 45 μg DNA kan worden gebruikt zonder cytotoxische effecten. - Giet het volledige DNA-organoïde mengsel af in een elektroporatiecuvette met een tussenbreedte van 2 mm zonder luchtbellen te produceren.
- Stel de elektroporratieparameters in op Fujii et al.10 (zie tabel 2, figuur 2).
- Meng de cellen iets zonder schuimen door met een vinger op de cuvette te tikken. Plaats de cuvette in de cuvette kamer.
- Druk op de Ω-knop van de elektroporator en noteer de impedantiewaarde.
LET OP: Een impedantie tussen 30-40 Ω toonde de beste resultaten. In het algemeen moet het in het bereik tussen 30-55 Ω. Als dit niet het geval is, controleer dan de volgende aspecten: gap breedte van de gebruikte cuvette, kabelverbindingen van de elektroporator, mogelijke luchtbellen, juiste volume en zoutconcentratie van het elektroporratiemengsel. - Druk op de startknop om het elektroporatieprogramma uit te voeren en de waarden van weergegeven stromen, spanningen en energieën te regelen.
OPMERKING: De waarden van gemeten spanningen, stromen en energieën moeten overeenkomen met de ingestelde elektroporatieparameters. Voor de vergelijking van herhaalde experimenten kan het handig zijn om deze gegevens op te merken. - Voeg na elektroporatie onmiddellijk 500 μL kweekmedium w/o antibiotica toe (met CHIR99021 en Y-27632; zie stap 1.3). Meng door op en neer te stampen om het witte schuim te scheiden.
OPMERKING: Het witte schuim verschijnt na het elektroporatieproces en er is een aanzienlijk aantal cellen aan bevestigd. Dus, dissociatie van het is zeer belangrijk voor het niet verliezen van cellen. - Breng het monster volledig van de cuvette over in een nieuwe buis van 15 mL met behulp van de pipet die behoort tot de elektroporatiecuvettes (zie Tabel met materialen). Het spoelen van de cuvette opnieuw met basale medium wordt aanbevolen om resterende cellen te verkrijgen.
- Voor regeneratie van de cellen, incubeer ze voor 40 min bij kamertemperatuur.
3. Zaaien van cellen
- Centrifugeer de cellen op 450 x g gedurende 5 min bij kamertemperatuur en gooi de supernatant weg.
- Zet de pellet opnieuw op in 100 μL keldermatrix en zaad 20 μL druppels in een voorverwarmde 48-put plaat (zie stap 1.2). Incubeer gedurende 10 min bij 37 °C voor polymerisatie en voeg 250 μL kweekmedium toe, dat wordt aangevuld met Y-27632 en CHIR99021 tot de volgende splitsing van de volwassen organoïden (ongeveer 5-7 dagen).
4. Bepaling van de transfection-efficiëntie
OPMERKING: In het algemeen wordt aanbevolen om een vector met een fluorescentiemarker te elektropoleren als extra transfection-controle. Afhankelijk van de gekozen marker en de chromophore rijping zal de fluorescentie zichtbaar zijn binnen ongeveer 24-48 uur na transfection18.
- Controleer de fluorescentie microscopisch na 24-48 uur in de transfection control (zie figuur 4B).
-
Fluorescerende geactiveerde celscannen (FACS)
- Oogst de cellen analoog aan stap 1.4.2-1.4.4 en verteer rond 10-20 min tot er enkele cellen zijn. Voeg tot 10 mL fosfaatgebufferde zoutoplossing (PBS) toe.
- Centrifugeer bij 450 x g voor 5 min bij kamertemperatuur en gooi de supernatant weg.
- Optioneel voor discriminatie van levende cellen: Schorsde de pellet in 1 mL fosfaatgebufferde zoutoplossing (PBS) en voeg een geschikt antilichaam toe (zie Materiaaltabel) of propidiumjodide (PI). Meng zeer zorgvuldig alleen door te tikken en uitbroeden voor 30 min bij kamertemperatuur in het donker. Was met 10 mL PBS, centrifugeer en gooi de supernatant weg.
- Zet de celpellet opnieuw op in 200 μL PBS en filtreer de vering optioneel door een 100 μm celzeef in een FACS-buis.
- Analyseer de cellen door een FACS-machine met behulp van een geschikte gatingstrategie (zie figuur 3; Figuur 4A) en bepaal de transfection-efficiëntie.
Representative Results
Organoïden van vier verschillende kankerentiteiten (CRC, CCC, PDAC, GC) werden ten minste 3 keer geëlekporated met behulp van 30 μg van een kleine plasmid (pCMV-EGFP, 4,2 kb) of een grote plasmid (px458, 9,3 kb). Beide vectoren dragen een GFP-cassette waardoor de bepaling van transfection-efficiëntie 48 uur na elektroporatie door stroomcytometrie mogelijk is. Om alleen levende cellen te analyseren, werd vlekken met een levensdoodsantilichaam vóór het scannen uitgevoerd. De gatingstrategie wordt weergegeven in figuur 3.
In alle vier de organoïde entiteiten werd de plasmid van 4,2 kB-formaat met een hogere efficiëntie getransfecteerd in vergelijking met de grotere (zie figuur 4). De meest efficiënte transfection van de kleine plasmid werd bereikt in PDAC-organoïden met 92,1 ± 5,2 % GFP-positieve cellen, terwijl de grote plasmid werd getransfecteerd met een rendement van 46,7 ± 3,7 % (gemiddelde ± standaarddeviatie, n = 3). In vergelijking met pancreaskanker-organoïden werd de grotere plasmid efficiënter omgezet in CRC-organoïden met een gemiddelde efficiëntie van 53,4 ± 11,7 %, terwijl de kleine plasmid werd getransfecteerd met een gemiddelde efficiëntie van 84,3 ± 5,8 %. De moeilijkste entiteit om te transfectwaren waren orgaanoïden van maagkanker: voor zowel de grote als de kleine plasmid werd in deze entiteit de laagste transfection-efficiëntie bereikt (respectievelijk 32,3 ± 12,7 % en 74,1 ± 5,5 %).). CCC-organoïden vertoonden een gemiddelde transfection-efficiëntie van 83,0 ± 13,1 % voor de kleine plasmid en voor het grote plasmidaat werd 39,5 ± 10,4 % verkregen.
Als proof of concept werden menselijke normale maagorganoïden geëleklegeerd met een px458_Conc2 plasmidcodering voor Cas9, GFP en twee sgRNAs gericht op TP53. De door Cas9 geïnduceerde dubbele strengbreuken op exon 8 werden gerepareerd door niet-homologe eindtoetreding (NHEJ), wat resulteerde in frameverschuivingen en bijgevolg een knock-out van het gen (zie Aanvullende figuur 1).
Tabel 1: Samenstelling van basale media, spijsverteringsmengsels en teeltmedia. Klik hier om dit bestand te bekijken (Klik met de rechtermuisknop om te downloaden).

Tabel 2: Elektroporatie-instellingen volgens Fujii et al.10.

Figuur 1: Elektroporatie voorbereiding workflow. Ten eerste moeten organoïden worden losgekoppeld van clusters van 10-15 cellen en antibiotica moeten worden uitgewassen. Na elektroporatie moet het witte schuim worden gescheiden. Cellen kunnen worden gezaaid na regenereren voor 40 min bij kamertemperatuur. Klik hier om een grotere versie van dit cijfer te bekijken.

Figuur 2: Elektroporatie in twee stappen. Twee poring pulsen met hogere spanning en korte duur (175 V en 157.5 V, elk voor 5 ms, pauze voor 50 ms, spanningverval 10%) leiden tot de vorming van poriën in celmembranen. De volgende overdrachtspulsen leveren het DNA in de cellen: vijf positieve overdrachtspulsen (met 20 V, 12 V, 7.2 V, 4.32 V en 2.592 V, elk voor 50 ms, pauze voor 50 ms, spanningsverval 40%), gevolgd door vijf polariteit uitgewisselde overdrachtpulsen (met 20 V, 12 V, 7.2 V, 4.32 V en 2.592 V, elk voor 50 ms, pauze voor 50 ms, spanningverval 40%). Klik hier om een grotere versie van dit cijfer te bekijken.

Figuur 3: Representatieve gatingstrategie getoond door CCC-organoïden. Alle geëlekbedeelde organoïden werden geanalyseerd door flow cytometrie 48 uur na elektroporatie. Cellen geëlektrocuteerd zonder plasmide DNA werden gebruikt als negatieve controles. De poorten werden als volgt ingesteld: (A) gating voor celvorm, (B,C) gating voor enkele cellen (doublet discriminatie), (D) gating voor levende cellen (bevlekt met een antilichaam voor apoptotische cellen) en (E,F) eindelijk gating voor eGFP uitdrukken cellen (FITC kanaal). FSC = voorwaartse verstrooiing; SSC = zijverstrooiing. Klik hier om een grotere versie van dit cijfer te bekijken.

Figuur 4: Elektroporatie-efficiëntie van vier organoïde entiteiten. (A) FACS-analyse (n = 34, gemiddelde standaarddeviatie en elke enkele waarde worden weergegeven) en (B) visuele vergelijking door fluorescentiemicroscoop. Schaalbalk = 1.000 μm. BF = helder veld; CCC = cholangiocarcinoma; CRC = colorectale kanker; GC = maagkanker; PDAC = pancreasductal adenocarcinoma. Klik hier om een grotere versie van dit cijfer te bekijken.

Aanvullende figuur 1: Voorbeeldige CRISPR/Cas9-gebaseerde knock-out van TP53 bij normale menselijke maagorganoïden. De px458_Conc2 vector (zie Tabel met materialen)werd gekloond door het combineren van de 2 gRNA concatemer vector, een genereus geschenk van Bon-Kyoung Koo19, met px45820, wat resulteert in een plasmid codering voor 2 sgRNAs, Cas9 en GFP. Twee sgRNAs gericht op TP53 werden geïntroduceerd in px458_Conc2 vector door gouden poort klonen (analoog aan Andersson-Rolf et al.19). 10 μg plasmidDNA werd geëlekdrinteerd bij normale maagorganoïden van de mens (A). Klonen werden geselecteerd door Nutlin3 administratie (B) en de TP53 knock-out werd bevestigd door TOPO TA klonen en volgorde van de allelen, hier voorbeeldig getoond voor een kloon (C). De sgRNAs worden onderstreept in de verwijzing. Schaalbalk = 200 μm. BF = helder veld. Klik hier om een grotere versie van dit cijfer te bekijken.
Discussion
Dit protocol geeft gedetailleerde instructies voor een efficiënte, snelle en eenvoudig uit te voeren elektroporatie van verschillende organoïde entiteiten. Naast de gepresenteerde tumororganoïden van PDAC, CRC, CCC en GC, werkt het ook met succes voor organoïden die uit gezond weefsel zijn afgeleid. Het protocol kan binnen één dag worden uitgevoerd. In gepubliceerde organoïde transfection protocollen duurde de hele procedure vier dagen, waaronder twee dagen van preparaten met verschillende soorten teelt media10,21. In ons protocol is geen speciale voorbehandeling vereist. Door te wassen met elektroporatiebuffer vóór elektroporatie werden de antibioticacomponenten van de media uitgewassen en werd een aanpassing van zoutconcentraties voor optimale impedantiewaarden bereikt. Niettemin moeten enkele kritische aspecten in aanmerking worden genomen voor een succesvolle elektroporatie:
Cellen
In het elektroporatieprotocol van Fujii et al.10 wordt aanbevolen organoïden te scheiden van enkele cellen en deze te filteren door middel van een celzeef van 20 μm. In onze handen vertering aan enkele cellen sterk vermindert de overlevingskansen van cellen. Zoals voorgesteld in Merenda et al.21,distantieerden we ook organoïden tot clusters van 10-15 cellen en konden we geen verminderde efficiëntie bepalen in vergelijking met eencellige dissociatie. Na elektroporatie is het een zeer belangrijke stap om het witte schuim te scheiden, zodat er geen aangesloten cellen verloren gaan.
Voor de 2D-celcultuur is aangetoond dat een regeneratietijd na elektroporatie van meer dan 10 min tot 40 min de overlevingskansen en transfection-efficiëntie verhoogt, vooral van grote plasmiden22. In testexperimenten kan hetzelfde worden gedocumenteerd voor organoïden, wat leidt tot een incubatietrap van 40 min na elektroporatie in dit protocol. Om het herstel van de elektroporatie te verhogen, hebben we ze gekweekt met Rho-geassocieerde eiwitkinase (ROCK) remmer Y-27632 gedurende vijf tot zeven dagen23. Op dezelfde manier is de extra suppletie van glycogeen synthase kinase 3 (GSK3) remmer CHIR99021 bedoeld om enkele cellen te helpen om10te herstellen .
Instellingen
Een van de voordelen van de gebruikte elektroporator is dat de impedantie kan worden gemeten vóór elektroporratie voor optimale omstandigheden. Volgens de fabrikant moeten de impedantiewaarden 30-55 Ω zijn. In onze handen hebben impedantiewaarden van 30-40 Ω een optimale efficiëntie laten zien. In een voorlopig experiment werden verschillende spanningen en pulslengtewaarden van de poringpuls gevarieerd om het optimale aandeel van efficiëntie in overlevingskansen te vinden. Samengevat kunnen we de beschreven waarden van Fujii et al.10 bevestigen in de verschillende entiteiten die hier worden beschreven.
Dna
Het effect van verschillende DNA-hoeveelheden werd getest in voorbereidende experimenten tot 45 μg DNA per monster. Er kunnen geen cytotoxische effecten worden gedetecteerd. Transfection efficiëntie werd verhoogd in een dosis afhankelijke manier met verzadiging > 30 μg. We gebruikten 30 μg per monster in het uiteindelijke protocol, maar het kan natuurlijk worden verhoogd (bijvoorbeeld voor de elektroporatie van meer plasmiden parallel). Daarnaast lijkt de zuiverheid en concentratie van het DNA erg belangrijk. Een concentratie van meer dan 5 μg/μL heeft een optimale transfection-efficiëntie aangetoond.
Zoals verwacht zou de plasmid van 9,3 kB kunnen worden getransfecteerd met een lagere efficiëntie dan de kleinere plasmia van 4,2 kB (zie figuur 4). Het gebruik van nog grotere plasmiden dan 10 kB zal naar verwachting de efficiëntie verder verminderen. Voor toekomstige toepassingen kan het interessant zijn om minicircle DNA als vector te testen, omdat deze gendragers de bacteriële ruggengraat van een plasmid missen waardoor ze kleiner zijn24. Dit moet leiden tot een verbeterde transfection-efficiëntie. Bovendien zou voor CRISPR-gebaseerde manipulaties van organoïden een directe elektroporatie van sgRNAs gebonden aan Cas9 als ribonucleoprotein (RNP) complex een alternatief of toevoeging25kunnen zijn.
Disclosures
De auteurs hebben niets te onthullen.
Acknowledgments
Wij danken Juliane Fohgrub, Ann-Christin Meinecke en Max Heiduk voor uitstekende technische assistentie. De financiering werd verstrekt door Deutsche Krebshilfe (nr. 111350 en 70112925), Sander Stiftung (nr. 2014.104.1), Hector Stiftung (nr. M65.2) en de Europese Unie (ERC nr. 639050).
Materials
| Name | Company | Catalog Number | Comments |
| For establishment and culture medium | |||
| [Leu15] Gastrin | Sigma-Aldrich | G9145 | |
| A83-01 | Tocris Bioscience | 2939 | |
| Advanced DMEM/F-12 | Invitrogen | 12634010 | |
| B27 | Invitrogen | 17504044 | |
| B27 Supplement, minus vitamin A | Thermo Fisher Scientific | 12587010 | |
| CHIR99021 | Stemgent | 04-0004 | |
| Collagenase II | Life Technologies | 17101-015 | |
| Collagenase XI | Sigma-Aldrich | C9407-100MG | |
| Collagenase D | Roche | 11088866001 | |
| Dispase II | Roche | 4942078001 | |
| Dnase I | Sigma-Aldrich | D5319 | |
| D-sorbitol | Roth | 6213.1 | |
| Dithiothreitol | Thermo Scientific | 1859330 | |
| EDTA | Roth | 8040 | |
| Forskolin | Tocris Bioscience | 1099 | |
| Glutamax | Life Technologies | 35050061 | |
| Hepes | Thermo Fisher Scientific | 15630106 | |
| hFGF-10 | Preprotech | 100-26 | |
| KCl | Sigma-Aldrich | P9541 | |
| KH2PO4 | Roth | 3904.2 | |
| Matrigel | Corning | 356231 | basement matrix |
| mEGF | Invitrogen | PMG8043 | |
| N2 | Invitrogen | 17502048 | |
| NaCl | Roth | 3957.1 | |
| Na2HPO4 | Roth | K300.2 | |
| N-Acetyl-L-Cystein | Sigma-Aldrich | A9165 | |
| Nicotinamid | Sigma-Aldrich | N0636 | |
| Noggin | n.a. | n.a. | Conditioned medium produced from HEK293 cells (Hek293-mNoggin-Fc) |
| PBS | Gibco | 14190169 | |
| Penicillin Streptomycin | Life Technologies | 15140122 | |
| Primocin | InvivoGen | ant-pm-1 | |
| Prostaglandin E2 | Tocris Bioscience | 2296 | |
| Recombinant Human HGF | Preprotech | 100-39H | |
| Rspondin | n.a. | n.a. | Conditioned medium produced from HEK293 cells (HA-Rspo1-Fc-293T) |
| SB202190 | Sigma-Aldrich | S7067 | |
| Sucrose | VWR | 27,480,294 | |
| TrypLE Express | Gibco | 12604021 | Dissociation reagent |
| Wnt3A | n.a. | n.a. | Conditioned medium produced from L-Wnt3a cells (from Sylvia Boj) |
| Y-27632 | Sigma-Aldrich | Y0503 | |
| Consumables | |||
| Cell Strainer 100 µm | Falcon | 352360 | |
| 48-well plate | Corning | 3548 | |
| Nepa Electroporation Cuvettes 2mm gap w/pipettes | Nepa Gene Co., Ltd. | EC-002S | |
| Tubes 15 ml | Greiner | 188271 | |
| Tubes 15 ml low binding | Eppendorf | 30122208 | Tubes for FACS preparing |
| Equipment | |||
| Electroporator Nepa21 | Nepa Gene Co., Ltd. | n.a. | |
| EVOS FL Auto | Invitrogen | AMAFD1000 | Fluorescence microscope |
| LSRFortessa | BD Bioscience | 647800E6 | FACS |
| Reagents and plasmids | |||
| Live/dead fixable blue dead cell stain kit | Invitrogen | L34962 | Includes antibody for live/dead staining for FACS analysis |
| EndoFree Plasmid Maxi Kit | Qiagen | 12362 | |
| Nutlin-3 | Selleckchem | S1061/07 | |
| Opti-MEM | Gibco | 31985047 | Electroporation buffer |
| 2 gRNA concatemer vector | AddGene | 84879 | |
| pCMV-EGFP | Nepa Gene Co., Ltd. | n.a. | |
| px458 plasmid | AddGene | 48138 | coding for sgRNA and Cas9 |
| px458_Conc2 plasmid | AddGene | 134449 | px458 plasmid containing 2x U6 promotors for two different sgRNAs |
| sgRNA_hTP53_1a | Eurofins Genomics | n.a. | 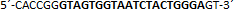 |
| sgRNA_hTP53_1b | Eurofins Genomics | n.a. | 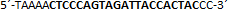 |
| sgRNA_hTP53_2a | Eurofins Genomics | n.a. | 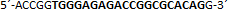 |
| sgRNA_hTP53_2b | Eurofins Genomics | n.a. | 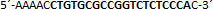 |
References
- Huch, M., et al. Long-term culture of genome-stable bipotent stem cells from adult human liver. Cell. 160 (1-2), 299-312 (2015).
- Werner, K., Weitz, J., Stange, D. E. Organoids as Model Systems for Gastrointestinal Diseases: Tissue Engineering Meets Genetic Engineering. Current Pathobiology Reports. 4 (1), 1-9 (2016).
- Olayanju, A., Jones, L., Greco, K., Goldring, C. E., Ansari, T. Application of porcine gastrointestinal organoid units as a potential in vitro tool for drug discovery and development. Journal of applied toxicology. 39 (1), 4-15 (2019).
- Drost, J., et al. Sequential cancer mutations in cultured human intestinal stem cells. Nature. 521 (7550), 43-47 (2015).
- Matano, M., et al. Modeling colorectal cancer using CRISPR-Cas9-mediated engineering of human intestinal organoids. Nature Medicine. 21 (3), 256-262 (2015).
- Schwank, G., et al. Functional repair of CFTR by CRISPR/Cas9 in intestinal stem cell organoids of cystic fibrosis patients. Cell Stem Cell. 13 (6), 653-658 (2013).
- Drost, J., et al. Use of CRISPR-modified human stem cell organoids to study the origin of mutational signatures in cancer. Science. 358 (6360), 234-238 (2017).
- Zhang, X. H., Tee, L. Y., Wang, X. G., Huang, Q. S., Yang, S. H. Off-target Effects in CRISPR/Cas9-mediated Genome Engineering. Molecular Therapy Nucleic Acids. 4, e264 (2015).
- Tsong, T. Y. Electroporation of cell membranes. Biophysical journal. 60 (2), 297-306 (1991).
- Fujii, M., Matano, M., Nanki, K., Sato, T. Efficient genetic engineering of human intestinal organoids using electroporation. Nature Protocols. 10 (10), 1474-1485 (2015).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Bartfeld, S., et al. In vitro expansion of human gastric epithelial stem cells and their responses to bacterial infection. Gastroenterology. 148 (1), 126-136 (2015).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Broutier, L., et al. Culture and establishment of self-renewing human and mouse adult liver and pancreas 3D organoids and their genetic manipulation. Nature Protocols. 11 (9), 1724-1743 (2016).
- Broutier, L., et al. Human primary liver cancer-derived organoid cultures for disease modeling and drug screening. Nature Medicine. 23 (12), 1424-1435 (2017).
- Hennig, A., et al. CFTR Expression Analysis for Subtyping of Human Pancreatic Cancer Organoids. Stem Cells Int. 2019, 1024614 (2019).
- Seidlitz, T., et al. Human gastric cancer modelling using organoids. Gut. 68 (2), 207-217 (2019).
- Stepanenko, O. V., Verkhusha, V. V., Kuznetsova, I. M., Uversky, V. N., Turoverov, K. K. Fluorescent proteins as biomarkers and biosensors: throwing color lights on molecular and cellular processes. Current protein & peptide science. 9 (4), 338-369 (2008).
- Andersson-Rolf, A., et al. Simultaneous paralogue knockout using a CRISPR-concatemer in mouse small intestinal organoids. Dev Biol. 420 (2), 271-277 (2016).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nature Protocols. 8, 2281 (2013).
- Merenda, A., et al. A Protocol for Multiple Gene Knockout in Mouse Small Intestinal Organoids Using a CRISPR-concatemer. Journal of Visualized Experiments. (125), (2017).
- Lesueur, L. L., Mir, L. M., Andre, F. M. Overcoming the Specific Toxicity of Large Plasmids Electrotransfer in Primary Cells In Vitro. Molecular Therapy Nucleic Acids. 5, e291 (2016).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
- Darquet, A. M., Cameron, B., Wils, P., Scherman, D., Crouzet, J. A new DNA vehicle for nonviral gene delivery: supercoiled minicircle. Gene Therapy. 4 (12), 1341-1349 (1997).
- Jacobi, A. M., et al. Simplified CRISPR tools for efficient genome editing and streamlined protocols for their delivery into mammalian cells and mouse zygotes. Methods. 121-122, 16-28 (2017).



