Summary
Eksisterende tilgange til konstruktion af kronisk implantable perifere nerve manchet elektroder til brug i små gnavere kræver ofte specialiseret udstyr og / eller højtuddannet personale. I denne protokol demonstrerer vi en enkel, billig tilgang til fremstilling af kronisk implantable manchetlektroder og demonstrerer deres effektivitet for vagus nervestimulation (VNS) hos rotter.
Abstract
Perifere nerve manchet elektroder har længe været brugt i neurovidenskab og relaterede områder til stimulering af, for eksempel, vagus eller iskiasnervenner. Flere nylige undersøgelser har vist effektiviteten af kronisk VNS i at forbedre centralnervesystemet plasticitet til at forbedre motorisk rehabilitering, udryddelse læring, og sensorisk diskrimination. Konstruktion af kronisk implantable enheder til brug i sådanne undersøgelser er udfordrende på grund af rotter 'lille størrelse, og typiske protokoller kræver omfattende uddannelse af personale og tidskrævende mikrofabrikation metoder. Alternativt kan kommercielt tilgængelige implantable manchetlektroder købes til en betydeligt højere pris. I denne protokol præsenterer vi en enkel, billig metode til konstruktion af små, kronisk implantable perifere nerve manchet elektroder til brug i rotter. Vi validerer den korte og langsigtede pålidelighed af vores manchetlektroder ved at påvise, at VNS i ketamin/xylazine bedøvede rotter producerer fald i vejrtrækningshastigheden i overensstemmelse med aktivering af Hering-Breuer-refleksen, både på implantationstidspunktet og op til 10 uger efter implantation af udstyret. Vi demonstrerer endvidere egnetheden af manchetlektroderne til brug i kroniske stimulationsundersøgelser ved at parre VNS med faglært løftestangs presseydelse for at fremkalde motorkortikale kortplastighed.
Introduction
For nylig er efterspørgslen efter kronisk implantable manchetlektroder til stimulering af perifere nerver vokset, da undersøgelser i stigende grad viser den prækliniske nytte af denne teknik til behandling af talrige inflammatoriskesygdomme 1,,2,,3 og neurologiske lidelser4,5,6,7,8,9,10,11,12,13,14,15. Kronisk VNS, for eksempel, har vist sig at forbedre neocortisk plasticitet i en række forskellige læringssammenhænge, forbedre motor rehabilitering4,,5,,6,7,,8, udryddelselæring 10,11,12,13,14, og sensorisk diskrimination15. Kommercielt tilgængelige perifere nerve manchet elektroder er ofte forbundet med længere tider for ordreopfyldelse og relativt høje omkostninger, som kan begrænse deres tilgængelighed. Alternativt, protokoller for "in-house" fremstilling af kronisk implantable manchetlektroder fortsat begrænset, og gnaver anatomi præsenterer særlige udfordringer på grund af deres lille størrelse. Nuværende protokoller til konstruktion af manchetlektroder til kroniske gnavere eksperimenter kræver ofte brug af komplekse udstyr og teknikker, samt ekstensivt uddannet personale. I denne protokol demonstrerer vi en forenklet tilgang til manchetelektrodefabrikation baseret på tidligere offentliggjorte og udbredte metoder16,17. Vi validerer funktionaliteten af vores kronisk implanterede elektroder hos rotter ved at påvise, at på tidspunktet for manchetimplantatation omkring venstre cervikale vagusnerven, stimulation anvendes på manchetlektroder med succes produceret et ophør af vejrtrækning og fald i SpO2. Stimulering af afferente lungereceptor vagusfibre er kendt for at engagere Hering-Breuer refleks, hvor hæmning af flere respiratoriske kerner i hjernestammen resulterer i undertrykkelse inspiration18. Således ophør af vejrtrækning i overensstemmelse med Hering-Breuer refleks, og den deraf følgende fald i SpO2, giver en enkel test for korrekt elektrode implantation og manchet funktion i bedøvet rotter. For at validere den langsigtede funktionalitet af kronisk implanterede manchetlektroder blev refleksresponser målt på implantationstidstidstidstidserne og sammenlignet med de responser, der blev opnået hos de samme dyr seks uger efter implantationen. En anden gruppe rotter blev implanteret med VNS manchetlektroder efter adfærdstræning på en løftestang presserende opgave. I disse rotter, VNS parret med korrekt opgave ydeevne produceret reorganisering af kortikale motor kort, i overensstemmelse med tidligere offentliggjorteundersøgelser 19,20,21,22. På tidspunktet for motorkortikisk kortlægning under anæstesi, som fandt sted 5-10 uger efter enhed implantation, vi yderligere valideret manchet funktion i VNS-behandlede dyr ved at bekræfte, at VNS held induceret et ophør af vejrtrækning og en større end 5% fald i SpO2.
De nyligt offentliggjorte protokoller fra Childs et al.17 og Rios et al.16 giver et velvalideret udgangspunkt for en forenklet manchetelektrodefabrikationsmetode, da denne populære metode er blevet udnyttet af flere laboratorier, der gennemfører kroniske VNS-studier hos gnavere1,2,3,4,,5, 6,7,,88,9,10,11. Den oprindelige metode indebærer flere højpræcisionstrin til at manipulere de fine mikrowirer, således at manchetlektrodefabrikation tager over en time at gennemføre, og omfattende træning til at udføre pålideligt. Den forenklede tilgang, der er beskrevet her, kræver betydeligt færre materialer og værktøjer og kan gennemføres på under en time af minimalt uddannet personale.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Alle procedurer, der er beskrevet i denne protokol udføres i overensstemmelse med NIH Guide for pleje og brug af laboratoriedyr og blev godkendt af den institutionelle Animal Care and Use Committee of The University of Texas i Dallas.
1. Stimulerende manchetlektrode fabrikation
- Gør manchetslangen klar.
- Brug et barberblad, skære et stykke polymer slange 2,5 mm i længden. Indsæt vicepperspidser eller en papirclips gennem slangen, og brug klingen til at lave en spalte på langs gennem slangens væg på den ene side af manchetten.
- Fjern snævlene fra slangen og indsæt en stor synsnål gennem manchettens midterlinje vinkelret på den lange akse. Sæt nålen gennem slidsen (øverst) og ind i midten af slangen modsatte (nederst). Sæt nålen i skumbrættet for at fastgøre manchetten på plads under de resterende monteringstrin.
- Placer sutur til sikring af manchetlukning under implantation.
- Sæt den lille synsnål gennem manchettens væg på midterlinjen ca. 0,5 mm fra den øverste slids på den ene side. Sæt nålen ind fra indvendigt til udvendigt for at undgå at beskadige manchetslangen. Sæt en 2 cm længde på 6/0 sutur gennem nålens øje og træk nålen gennem slangens væg for at trække suturen ind i manchetten.
- Lad tråden være på plads, fjern nålen og punkter et andet hul gennem slangevæggen ca. 0,5 mm under det første hul langs manchettens midterlinje. Sæt suturen gennem nåleøjet og træk nålen gennem slangevæggen for igen at trække suturen gennem manchetten.
- Begge ender af suturtråden skal nu være på den udvendige side af manchetten. Juster suturen, så ~1,5 cm strækker sig fra det øverste hul, og ~ 0,5 mm strækker sig fra det nederste hul.
- Påfør en lille mængde UV-hærdelim til den korte ende af suturen, der strækker sig fra det nederste hul, og træk den længere suturende, indtil den nederste hale næsten flugter med slangens ydervæg. Brug UV-tryllestaven til at hærde limen og holde suturen på plads.
- Trin 1.2.1 til 1.2.3 gentages på den modsatte side af manchetten.
- Placer Platinum:Iridium (Pt:Ir) wire ledninger.
- Brug den lille synsnål til at lave 4 huller i manchetvæggen. Hvert par huller skal placeres ca. 0,5-0,8 mm fra den vinkelrette midterlinje med et hul ca. 0,5-0,8 mm fra den øverste slids på hver side af manchetten.
FORSIGTIG: For at opnå den mest ensartede og nøjagtige placering af ledningerne skal du indsætte nålen fra indvendig til udvendig for at lave alle huller ved hjælp af suturplaceringen som vejledning. - Sæt synsnålen ind igen, denne gang arbejder fra udvendigt til indvendigt, gennem blyhul 1. Sæt ca. 0,5 cm af en 7,5 cm lang Pt:Ir-ledning gennem nålens øje og træk nålen gennem slangen for at føre ledningen gennem manchetvæggen. Ledningen justeres således, at ~4,5 cm strækker sig på den udvendige side af manchetten (Figur 1A).
- Sæt nålen gennem blyhul 1 igen, igen arbejder udvendigt-til-interiør, og desuden indsætte nålen gennem bly hul 2 direkte over fra bly hul 1. Sæt ~ 0,5 cm af den kortere (interiør) ende af Pt:Ir wire gennem øjet af nålen og træk nålen gennem slangen til at tråd ledningen gennem manchetvæggene.
BEMÆRK: Begge ender af Pt:Ir wiren skal nu være på den udvendige side af manchetten, og en wire loop dannes omkring spaltede kant og gennem bly hul 1 (Figur 1B). - Trin 1.3.1 til og med 1.3.3 gentages for at placere Pt:Ir-ledningen gennem blyhullerne 3 og 4.
- Ved hjælp af en butanlighter fjernes isoleringen forsigtigt fra en længde på 5-6 mm for enden af Pt:Ir-ledningerne, der strækker sig fra blyhul 2 og blyhul 4.
FORSIGTIG: Isoler enderne af ledningerne fra resten af manchetsamlingen omhyggeligt for at undgå at beskadige manchetten. Brug værktøj til at holde ledningerne for at undgå skader. - Juster den nøgne ledning inde i manchetten for at placere ledningerne på deres endelige placeringer. For at gøre dette skal du forsigtigt trække i enden af Pt:Ir-ledningen, der strækker sig fra hul 1, indtil den uisolerete del af ledningen flugter med hul 1. Gentag med den anden ledning for at justere den uisolerete ende af tråden gevind gennem blyhuller 3 og 4.
- Påfør en lille mængde UV-hærdelim på trådløkkerne på den udvendige side af manchetten ved blyhuller 1 og 3. Brug UV-tryllestaven til at hærde limen og sikre ledningerne på plads.
- Brug en lille pipettespids til at skubbe de uisolerete Pt:Ir wireledninger mod manchettens indvendige væg. Når ledningerne er på plads, skæres enderne af ledningerne, der strækker sig fra blyhuller 2 og 4, således at ca. 1 mm ledning strækker sig ud over manchetvæggens yderside.
- Fold 1 mm haler af wiren fladt mod den udvendige overflade af manchetten, passe på ikke at kort dem sammen. Påfør en lille mængde UV-hærdende lim til blot at dække de to haler og helbrede limen for at sikre blyplacering og give elektrisk isolering.
FORSIGTIG: Det er vigtigt at dække de eksternt eksponerede Pt:Ir overflader helt med lim for at isolere ledningerne og undgå off-target stimulation.
- Brug den lille synsnål til at lave 4 huller i manchetvæggen. Hvert par huller skal placeres ca. 0,5-0,8 mm fra den vinkelrette midterlinje med et hul ca. 0,5-0,8 mm fra den øverste slids på hver side af manchetten.
- Fastgør Pt:Ir wire ledninger på plads med sutur securement.
- Fjern den store nål med manchetsamlingen fra skumbrættet. Sæt en 3 cm længde på 6/0 sutur gennem nålens øje og træk nålen gennem slangen for at trække suturen gennem bunden af manchetten midt på midtpunktet.
- Skift til den lille synsnål for at fuldføre suturtrådningen til Pt:Ir bly securement. Sæt nålen gennem det samme midterhul og arbejd igen fra indvendigt til udvendigt for at undgå deformation af slangen og ledningerne. Sæt suturens udvendige hale gennem nålens øje og træk nålen gennem manchetvæggen for at skabe en sutursøjle rundt om kanten af manchetten (Figur 1C).
BEMÆRK: Brug snævn og arbejd under mikroskopet for at sikre, at suturen er orienteret langs manchettens lange akse og ligger fladt mod slangen. Dette trin sikrer, at ledningerne forbliver adskilt på den indvendige side af manchetten og holdes på plads lateral til manchetten midterlinjen. - Opret en anden sløjfe omkring den modsatte ende af manchetten ved at binde enderne af suturen i en halv knude, på den udvendige side af manchetten. Sørg for, at suturen løber langs manchettens lange akse og ligger fladt mod slangen. Mens du holder knuden stramt, så det lægger fladt mod slangen, anvende en lille mængde UV-kur lim til den halve knude og helbrede at holde på plads.
- Skær forsigtigt enderne af suturtråden så tæt på knuden som muligt. Hvis det er nødvendigt, skal du bruge en lille mængde ekstra UV-hærdelim til at lime de korte ender af sutur, så de lægger fladt mod slangen (Figur 1D).
- Loddestik stifter til Pt: Ir wire ledninger.
- Ved hjælp af en butan lighter, fjerne isoleringen fra ~ 3 mm i slutningen af hver af de Pt: Ir wire ledninger. Lod koppen side af en guld pin (se Tabel af materialer) til den uisoleret ende af hver bly.
- Test impedansen af den samlede enhed.
- Tilslut guldstifterne til indgangene til et LCR-modul eller et elektrode impedanskontrolmodul, og indstil testfrekvensen til 1 kHz. Nedsænk manchetslangen (og Pt:Ir stimulation kontakter interiør til manchetten) i et lille bæger fyldt med saltvand, idet man skal passe på at holde guld bly stifter og sonde stik tørre. Kontroller, at den samlede manchet har en impedans ved 1 kHz på mindre end 2 kΩ, før implantation fortsættes.
BEMÆRK: Høj impedans indikerer ofte utilstrækkeligt udsat Pt:Ir-overfladeareal, som kan opstå på grund af faktorer som utilstrækkelig fjernelse af isolering, utilsigtet påføring af klæbemiddel i manchettens indre, ødelagte trådtråde osv. Manchetter bør også inspiceres for brudte eller dårligt placerede trådtråde, der kan resultere i kortkontakter med langvarig brug.
- Tilslut guldstifterne til indgangene til et LCR-modul eller et elektrode impedanskontrolmodul, og indstil testfrekvensen til 1 kHz. Nedsænk manchetslangen (og Pt:Ir stimulation kontakter interiør til manchetten) i et lille bæger fyldt med saltvand, idet man skal passe på at holde guld bly stifter og sonde stik tørre. Kontroller, at den samlede manchet har en impedans ved 1 kHz på mindre end 2 kΩ, før implantation fortsættes.
2. Hoved-cap konstruktion
BEMÆRK: Headcap samling procedurer svarer til dem, der er offentliggjort tidligere (Childs et al.17), og er sammenfattet her for nemheds skyld.
-
Samlhovedbeklædningen 17
- Skær to små stykker af 30 AWG wire wrap, en ~ 13 mm i længden og en ~ 10 mm i længden. Strip ~ 1,5 mm isolering fra hver ende af begge ledninger. Lod pin side af en guld pin til den ene ende af hver ledning, så tæt på koppen som muligt. Brug wire cutters til at afskære overskydende længde af pin ud over loddeleddet.
- Lodde de andre ender af AWG ledninger til de to centrale loddekopper af en 4-pin microstrip stik.
- Bøj trådhovedkaplen op mod stikket og placer guldstifterne fladt mod stikket parallelt med hinanden, som vist i figur 2A. Stiften, der er tilsluttet den kortere ledning, skal placeres under den stift, der er tilsluttet den længere ledning. Brug søm akryl, dental cement, eller UV-hærde lim til at sikre headcap fører på plads.
3. Brug af enheden
- Implanter manchetlektroderne til kronisk vagus nervestimulation.
BEMÆRK: Alle kirurgiske procedurer bør udføres ved hjælp af steril eller aseptisk teknik under passende anæstesi i overensstemmelse med NIH's retningslinjer for pleje og brug af laboratoriedyr og med lokal IACUC-godkendelse. Følgende procedurer er beregnet til at illustrere en repræsentativ brug af enheden og er ikke beregnet til at være omfattende.- Placer rotten i en stereotaxic ramme og foretage en sagittal snit over parietal og occipital knogler til at afsløre kraniet overflade til implantation af headcap / stik. Bor omhyggeligt 4 huller i kraniet og læg guldsmedens skruer. Brug dental akryl til at sikre headcap til kraniet og skruer.
- Fjern rotten fra den stereotaxiske ramme og læg på højre side. Lav et lodret snit i huden på venstre side af halsen, og omhyggeligt dissekere venstre vagus nerve fra halspulsåren, placeret mellem sternomastoid og sternohyoid muskler og under omohyoid musklen.
- Tunnel manchetten fører subkutende mod kraniet. Tilslut ledningerne til hovedhætten ved hjælp af guldnåle.
- Placer vagus nerve inde i manchetten og fastgør enheden lukket ved at binde en dobbelt knude i manchetten suturer. Vær omhyggelig med at undgå at beskadige nerven under implantationen ved at manipulere nerven med stumpe, ikke-ledende kroge eller ved at gribe bindevæv omkring nerven.
- Test implantatet ved at anvende stimulering på enheden (10 s tog på 0,8 mA, 30 Hz, 100 μs bifasiske impulser). Korrekt implantation vil resultere i ophør af vejrtrækning og et fald i SpO2 på 5% eller mere.
- Dæk guld stifter og udsatte fører med dental akryl, tætte sår med suturer, og rense indsnit steder med saltvand, alkohol, og povidone jod opløsning.
- Giv erstatningsvæsker, analgetika og postoperativ pleje i overensstemmelse med NIH's retningslinjer og IACUC-godkendelse.
- Stimulere vagus nerve under vågen adfærd.
BEMÆRK: Levering af VNS som dyr udfører specifikke motoriske opgaver har tidligere vist sig at udvide motorkort repræsentation af opgave-relevante muskulatur. Vi bruger dette validerede paradigme til at give et repræsentativt eksempel på enhedsbrug, men mange andre adfærdsparadigme og/eller stimuleringsparametre kan være relevante for alternative applikationer. Rotter blev uddannet til at udføre løftestang presse opgave, der anvendes her før enheden implantation. Efter operationen blev gode præstationer igen verificeret før VNS-levering: Rotter udførte mindst 100 vellykkede forsøg i to 30 minutters træningssessioner om dagen. VNS blev parret med korrekte håndtag presser i løbet af 10 efterfølgende træningssessioner over 5 dage.- Tilslut rotten til en stimulusgenerator via implanteret hovedhætte, og juster den til passende stimuleringsindstillinger. For VNS-induceret reorganisering af det motorikale kort, parre hver korrekt løftestang tryk med et enkelt tog på 15 bifasiske impulser, hver med en bredde på 100 μs og amplitude på 800 μA, leveret med en frekvens på 30 Hz.
- Et stimuleringstog leveres umiddelbart efter påvisning af hver vellykket løftestangspresse under hele ti 30 minutters træningssessioner. Under VNS-levering skal du bruge et oscilloskop til at overvåge vellykket levering af strømstimulering.
- Valider kronisk implanteret manchetfunktion.
- Inden for 24 timer fra den sidste VNS-parrede træningssession skal du bruge intrakraniel mikrostimulation (ICMS) til at kvantificere det funktionelle somatotopiske kort i den motoriske cortex19,20,21,22.
- Efter induktion af anæstesi til ICMS kortlægning af den motoriske cortex, validere manchet funktion igen ved at anvende en 10 s tog på 30 Hz, 0,8 mA strøm stimulation (100 μs biphasic pulser), hvilket bør resultere i et ophør af vejrtrækning og reduktion i SpO2 niveauer på mindst 5%, i overensstemmelse med Hering-Breuer refleks.
BEMÆRK: Afhængigt af applikationen kan manchetfunktionen betragtes som acceptabel, hvis der observeres et pålideligt SpO2-fald på mindre end 5 %, eller hvis højere strømelynge (op til 1,6 mA) pålideligt producerer mindst en reduktion på mindst 5 % i SpO2. Manglende overholdelse af et ophør af vejrtrækning og/eller et pålideligt fald i SpO2 er tegn på implantatsvigt.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Vagus nerve manchet elektroder og hovedhætter blev kronisk implanteret i rotter i henhold til tidligere offentliggjorte kirurgiskeprocedurer 17,19,,20,21,22. Før implantationen blev impedans ved 1 kHz målt over manchetledningerne med manchetslangen nedsænket i saltvand (impedans = 1,2 ± 0,17 kΩ [gennemsnit ± std]; N = 9). Kun manchetter med impedanser mindre end 2 kΩ i saltvand blev implanteret; alle manchetter opfyldte dette kriterium (0/9-manchetter undtaget). Under implantation operationer, funktionel validering af alle manchetter blev udført ved test for en stimulation-induceret kort ophør af vejrtrækning og efterfølgende fald i blodet iltmætning tilskrives Hering-Breuer refleks. For at fremkalde denne reaktion blev der leveret et 10 s tog på 30 Hz, 0,8 mA strømstimulation (100 μs bifasiske impulser) hen over manchetledningerne. For 9/9 implanterede manchetter observerede vi et VNS-induceret vejrtrækningsstop under 10 sek.2 2 Under den indledende implantation fandt vi en signifikant sammenhæng mellem de indledende SpO2-aflæsninger og den procentvise ændring i SpO2 fremkaldt af VNS ( Figur2B; R2 = 0,60, p = 0,0083, Pearsons lineære korrelation), i overensstemmelse med offentliggjort litteratur, der viser, at anæstesidybde påvirker omfanget af Hering-Breuer-refleksen23,24. For at teste den langsigtede funktionalitet af de kronisk implanterede manchetter, rotter blev bedøvet igen 6 uger efter enheden implantation og VNS blev anvendt til at fremkalde Hering-Breuer refleks respons. For 7 af 9 enheder observerede vi et fald på mere end 5 % i SpO2 ved hjælp af 10 s tog på 0,8 mA, 30 Hz stimulation (Figur 2C). I disse anordninger adskiller omfanget af stimulationsformet ændring i SpO2 sig ikke fra den, der blev observeret ved den indledende implantation, hvilket tyder på fremragende fortsat ydeevne af de kronisk implanterede anordninger (indledende % ændring i SpO2 = -9,7 ± 3,4%, endelig % ændring i SpO2 = -15,8 ± 6,5%, gennemsnitlig ± std; p = 0,08, parret t-test). I de resterende 2 enheder var det tilstrækkeligt at øge stimuleringsjoliliten til 1,6 mA til at fremkalde en pålidelig reduktion i SpO2 på mindst 5 %, hvilket tyder på, at disse enheder fortsat fungerede, men at ændringer i impedans, nerveskader eller manchetorientering over tid kan have resulteret i nedsat ydeevne.
For yderligere at teste den langsigtede funktionalitet af vores kronisk implanterede stimulerende elektroder, en anden gruppe af rotter blev uddannet på en forenklet version af en dygtig nå løftestang-presse opgave udviklet af Hays et al. til kvantitativt at vurdere forelimb motor ydeevne25. Flere undersøgelser har vist, at parring af VNS med korrekt motorydelse på denne opgave resulterer i en udvidelse af den proksimale forelimb repræsentation i primær motor cortex19,20,21,22. I vores forenklede version af opgaven, rotter var forpligtet til at nå 2 cm uden for uddannelse kabine til fuldt ud at trykke en løftestang, og derefter at frigive det inden for 2 s for at modtage en fødevare belønning (Figur 2D). Dyrene fik to 30 minutters træningspas om dagen, indtil de opnåede stabile færdigheder på opgaven (>65% korrekt, > 100 forsøg/session, i mindst 8/10 på hinanden følgende sessioner). Rotter derefter gennemgik kirurgi for at implantere en stimulerende manchet elektrode omkring deres venstre vagus nerve. Efter helbredelse fra kirurgi, akklimatisering til stimulerende kabler, og vende tilbage til dygtige adfærdsmæssige ydeevne, rotter modtaget yderligere 10 træningssessioner, hvor VNS (0,5 s tog på 0,8 mA, 30 Hz impulser; 100 μs bifasic puls bredde), eller fingeret stimulation (ingen stimulation), blev leveret på tidspunktet for korrekt frigivelse løftestang. Inden for 24 timer efter den sidste VNS-parrede træningssession blev rotter bedøvet med ketamin/xylazin (80/10 mg/kg, i.p.), manchetelektrodefunktion blev testet, og kortikal motorkortlægning blev udført i henhold til offentliggjorte procedurer22. I overensstemmelse med tidligere undersøgelser, der viser, at VNS-drevudvidelse af opgaverelevante motorkortrepræsentationer udviste VNS-behandlede rotter (N = 3) signifikant større proksimale forelimb (PFL) repræsentationer end fingerede behandlede rotter (N = 4) i vores undersøgelse (Figur 2D; PFL % af det samlede kortareal, middelværdi + SEM: sham = 15,6 ± 6,7%, VNS = 38,3 ± 1,0% p = 0,035, 2-prøve t-test, testeffekt = 0,8). I alle VNS-behandlede dyr blev manchetfunktionen valideret efter induktion af anæstesi på tidspunktet for kortlægningen, 5-10 uger efter implantatet, ved at bekræfte en større end 5% ændring i SpO2 som reaktion på VNS (10 s tog på 0,8 mA, 30 Hz impulser; 100 μs bifasisk pulsbredde).
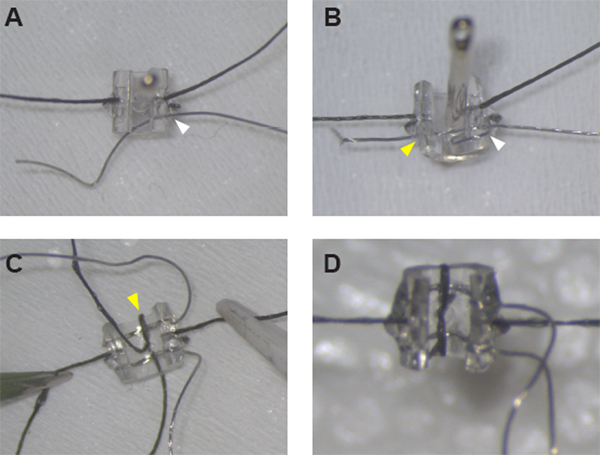
Figur 1: Samling af stimulerende manchetelektroder. (A) Efter fastgørelse af suturerne på hver side af manchetten kan Pt:Ir-tråden føres gennem manchetvæggen ved hul #1 (hvid pilespids) ved hjælp af en synsnål. (B) Pt:Ir wire er korrekt gevind og klar til de-isolering efter at have skabt en wire loop omkring manchetten kant og gevind wiren igen gennem hul #1 (hvid pilespids) og på tværs af manchetten gennem hul #2 (gul pilespids). (C)Når begge ledninger er på plads, skal du sikre den første føring ved at gevindsuge gennem midterhullet og rundt om manchetkanten (gul pilespids). (D) Luk løkken omkring den anden ledning med en halv knude og lim på plads for at fuldføre manchetsamlingen. Klik her for at se en større version af dette tal.

Figur 2: Brug af anordning til kronisk vagus nervestimulation i vågen opfører rotter. aA) Hovedbeklædning. (B) Under enhedsimplantatationen var VNS-fremkaldte reduktioner i SpO2 korreleret med de første SpO2-aflæsninger (R2 = 0,602, s = 0,008, Pearsons lineære korrelation). (C)Sammenligning af VNS-fremkaldte SpO2 dråber opnået ved enhedsimplantatation versus ved afslutningen af stimulationsforsøg 6 uger senere. Linjer angiver par målinger for de enkelte rotter. Stimulering i paneler B og C bestod af et enkelt 10 s tog med 100 μs bifasiske impulser leveret ved 0,8 mA og 30 Hz.(D) Rottemed kronisk implanteret VNS manchetlektroder, der udfører løftestangs-tryk-opgaven. (E) VNS (0,5 s tog på 0,8 mA, 30 Hz, 100 μs biphasic impulser) parret med korrekt løftestang-tryk ydeevne udvidet kortet repræsentation af opgave-relevante muskulatur i motor cortex. Rotter, der fik VNS parret med korrekt løftestang presse ydeevne (N = 3) udstillet en betydeligt større procentdel af motorkort område afsat til proksimale forelimb (PFL) repræsentation i forhold til rotter, der fik Sham stimulation (N = 4). Prikker viser PFL repræsentationer for de enkelte emner; fejlbjælker indikerer, at SEM. VNS-behandling efterfulgt af motorkortikisk kortlægning blev udført 5-10 uger efter implantation. Klik her for at se en større version af dette tal.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Her beskriver vi en enkel, billig tilgang til samling af kronisk implantable stimulerende manchetlektroder til brug i gnavere, lette prækliniske undersøgelser af denne nye behandling. Denne forenklede metode kræver ingen specialiseret uddannelse eller udstyr, og bruger et lille antal værktøjer og forsyninger, der er let tilgængelige for de fleste forskningslaboratorier, hvilket reducerer både de monetære og lønomkostninger enhed fremstilling i forhold til andretilgange 16,26,27,28. Der kræves forsigtighed under hele samlingen for at undgå overdreven anvendelse af UV-hærdeklæbemiddel, samtidig med at der sikres tilstrækkelig mekanisk stabilitet af suturerne og Pt:Ir-ledningerne til langsigtet manchetfunktion. Overdreven klæbemiddel komplicerer enhedens implantation og kan irritere omgivende væv efter operationen, mens utilstrækkelig klæbemiddel øger sandsynligheden for, at over tid fører ikke kan opretholde en god kontakt med nerven, hvilket resulterer i nedsat enhedens ydeevne eller fiasko. Konsekvent placering af de deolerede Pt:Ir ledninger inde i manchetten lumen er også afgørende for at opnå lave impedanser og god enhedsydeevne. Der skal være omhu for at justere den af isolerede ledning korrekt, således at den maksimalt mulige overflade af den eksponerede ledning sidder inde i manchetten, mens der ikke findes en eksponeret ledning eksternt.
Vi har valideret, at vores tilgang producerer manchetter af samme størrelse og pålidelighedsom dem,der i øjeblikket er i almindelig brug af flere laboratorier for kronisk VNS levering i rotter4,,5,,6,,7,,8,9,10,11,12,13,14,,15,,19,,20,21,22. Nylige undersøgelser tyder på, at perifere nervefibre er ligeledes rekrutteret ved hjælp af en bred vifte af elektrode kontakt størrelser og retninger16,29, tyderpå,at denne protokol kan tilpasses til mange eksperimenter, der kræver perifer nerve stimulation, og at små variationer i bly afstand eller overfladeareal, der opstår fra samling af manchetter i hånden vil ikke kritisk påvirke de fleste eksperimentelle resultater. Under hver stimulationssession overvågede vi spændingen over manchetledningerne ved hjælp af et oscilloskop for at sikre, at ledningerne ikke blev kortsluttede eller brudt, men vi sporede ikke ændringer i impedans for specifikke implanterede enheder i løbet af 5-10 uger efter implantatet. En undersøgelse af en lignende implanteret enhed rapporterede, at impedans ikke stiger betydeligt i løbet af de første 4 uger efter kirurgisk implantation, formentlig som den akutte skade stabiliserer30. I denne undersøgelse, dog, ændringer i enhedens impedans var ikke korreleret med enhedens ydeevne over 8 uger af kronisk implantation: forfatterne rapporterede ingen væsentlig ændring i forholdet mellem VNS intensitet og sammensatte virkning potentielle amplitude over flere uger efter implantatet. Her var vi ligeledes i stand til funktionelt at validere manchettens ydeevne efter 5-10 ugers implantation ved (i) at kontrollere, at VNS stadig kunne fremkalde et ophør af vejrtrækning og fald i SpO2 i overensstemmelse med Hering-Breuer refleks, og (ii) replikere tidligere arbejde viser VNS-induceret motor kort reorganisering. I vores eget arbejde, har vi fundet induktion af Hering-Breuer refleks at være den mest pålidelige måde at validere langsigtede funktionalitet af implanterede VNS manchetter, som kan udvise reduceret enhedens ydeevne eller fiasko på grund af en række faktorer, der ikke er relateret til manchet samling; disse omfatter kirurgiske komplikationer, nerveskader, og / eller mekanisk skade på manchetten eller hovedhætten. Fremragende kirurgisk teknik og applikationsspecifik validering af enhedens funktionalitet er afgørende for stabil og vellykket brug af kronisk implanteret stimulerende manchetlektroder.
Vi har beskrevet en enkel, billig tilgang til samling af perifere nerve manchet elektroder til kronisk implantation i små dyr og demonstreret sin nytte for VNS levering under rotte adfærdsmæssige eksperimenter. VNS er i stigende grad under efterforskning for en bred vifte af kliniske indikationer, herunder inflammatoriske sygdomme som reumatoid arthritis1,,2 og Crohns sygdom,31 samt neurologiske lidelser såsomslagtilfælde 5,,6,,7,8 og PTSD10,11. Denne tilgængelige metode til fremstilling af stimulerende manchetelektroder bør lette brugen af prækliniske gnaveremodeller i en række translationelle forskningsundersøgelser af VNS's mekanismer og virkning. Protokollen er let at tilpasse, hvilket yderligere øger alsidigheden i tilgangen. For eksempel kan polyurethanslangens diameter og/eller længde ændres for at imødekomme kroniske stimulationsforsøg hos andre arter eller på andre perifere nervesteder (f.eks. iskias, phrenic eller sakrale nerver). Alternativt kan konfigurationer med yderligere kundeemner muliggøre stimulering på flere steder langs nerven eller kunne rumme samtidig registrering af et stimulations-fremkaldt sammensat virkningspotentiale.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne har intet at afsløre.
Acknowledgments
Dette arbejde blev finansieret af University of Texas i Dallas og UT Board of Regents. Vi takker Solomon Golding, Bilaal Hassan, Marghi Jani og Ching-Tzu Tseng for teknisk assistance.
Materials
| Name | Company | Catalog Number | Comments |
| Biocompatible polyurethane-based polymer tubing, 0.080" OD x 0.040" ID | Braintree Scientific | MRE080 36 FT | |
| Dissecting microscope | AM Scopes | #SM-6T-FRL | |
| Fine Serrated Scissors, straight, 22mm cutting edge | Fine Science Tools | #14058-09 | for cutting Pt/Ir wire and suture thread |
| Forceps, #5 Dumont forceps, straight, 11 cm, 0.1 x 0.06 mm tip | Fine Science Tools | #11626-11 | |
| Forceps, ceramic tipped forceps, 0.3 mm x 30 mm tips | Electron Microscopy Sciences | #78127-71 | |
| Gold Pins, PCB Press Fit Socket | Mill-Max | #1001-0-15-15-30-27-04-0 | or similar small pins for connecting cuff leads to headcap |
| Isobutane lighter | BIC | #LCP21-AST | for de-insulating Pt/Ir wire |
| Micro strip connector with latch, 4-pin | Omnetics | A24002-004 / PS1-04-SS-LT | |
| Pipette tip, 10 uL | VWR | 89079-464 | |
| Platinum-Iridium (90/10%) Wire, 0.001" (diameter) x 9 strands, PTFE insulated | Sigmund Cohn | 10IR9/49T | |
| Razor Blade, Single Edge, Surgical Carbon Steel No.9 | VWR | #55411-050 | for cutting MicroRenathane tubing |
| Sewing needle, ca. 4.0 cm length x 0.7 mm diameter (size 6-7) | Singer | 00276 | Smaller needle for threading Pt/Ir wire |
| Sewing needle, ca. 4.5 cm length x 0.8 mm diameter (size 2-3) | Singer | 00276 | Larger needle for pinning cuff during assembly and for threading suture |
| Small foam board | Juvo+/Amazon | B07C9637SJ | for fabrication platform; our dimensions are ca. 2.5" x 3.5" x 1" (L x W x H) |
| Solder, multicore lead-free, 0.38mm diameter | Loctite/Multicore | #796037 | |
| Soldering station | Weller | WES51 | or similar soldering iron compatible with long conical tips (this part has been discontinued) |
| Soldering tip, long conical, 0.01" / 0.4 mm | Weller | 1UNF8 | |
| Suture, nonabsorbable braided silk ,size 6/0 | Fine Science tools | #18020-60 | |
| UV (405 nm) spot light | Henkel/Loctite | #2182207 | |
| UV Light Cure Adhesive 25 ml | Henkel/Loctite | AA 3106 | or similar biocompatible UV cure adhesive |
| Wire wrapping wire, 30 AWG | Digikey | K396-ND |
References
- Koopman, F. A., et al. Vagus nerve stimulation inhibits cytokine production and attenuates disease severity in rheumatoid arthritis. Proceedings of the National Academy of Sciences of the United States of America. , (2016).
- Levine, Y. A., et al. Neurostimulation of the cholinergic anti-inflammatory pathway ameliorates disease in rat collagen-induced arthritis. PLoS One. , (2014).
- Zhang, Y., et al. Chronic vagus nerve stimulation improves autonomic control and attenuates systemic inflammation and heart failure progression in a canine high-rate pacing model. Circulation: Heart Failure. , (2009).
- Ganzer, P. D., et al. Closed-loop neuromodulation restores network connectivity and motor control after spinal cord injury. Elife. , (2018).
- Hays, S. A., et al. Vagus nerve stimulation during rehabilitative training enhances recovery of forelimb function after ischemic stroke in aged rats. Neurobiology of Aging. , (2016).
- Khodaparast, N., et al. Vagus nerve stimulation delivered during motor rehabilitation improves recovery in a rat model of stroke. Neurorehabilitation and Neural Repair. , (2014).
- Meyers, E. C., et al. Vagus nerve stimulation enhances stable plasticity and generalization of stroke recovery. Stroke. , (2018).
- Hays, S. A., et al. Vagus nerve stimulation during rehabilitative training improves functional recovery after intracerebral hemorrhage. Stroke. , (2014).
- Farrand, A., et al. Vagus nerve stimulation improves locomotion and neuronal populations in a model of Parkinson's disease. Brain Stimulationation. , (2017).
- Souza, R. R., et al. Vagus nerve stimulation reverses the extinction impairments in a model of PTSD with prolonged and repeated trauma. Stress. , (2019).
- Noble, L. J., Souza, R. R., McIntyre, C. K. Vagus nerve stimulation as a tool for enhancing extinction in exposure-based therapies. Psychopharmacology. , (2019).
- Childs, J. E., Kim, S., Driskill, C. M., Hsiu, E., Kroener, S. Vagus nerve stimulation during extinction learning reduces conditioned place preference and context-induced reinstatement of cocaine seeking. Brain Stimulationation. , (2019).
- Peña, D. F., Engineer, N. D., McIntyre, C. K. Rapid remission of conditioned fear expression with extinction training paired with vagus nerve stimulation. Biological Psychiatry. , (2013).
- Childs, J. E., DeLeon, J., Nickel, E., Kroener, S. Vagus nerve stimulation reduces cocaine seeking and alters plasticity in the extinction network. Learning & Memory. , (2017).
- Engineer, C. T., et al. Temporal plasticity in auditory cortex improves neural discrimination of speech sounds. Brain Stimulationation. , (2017).
- Rios, M., et al. Protocol for Construction of Rat Nerve Stimulation Cuff Electrodes. Methods Protoc. , (2019).
- Childs, J. E., et al. Vagus nerve stimulation as a tool to induce plasticity in pathways relevant for extinction learning. Journal of Visualized Experiments. , (2015).
- Paintal, A. S. Vagal sensory receptors and their reflex effects. Physiological reviews. , (1973).
- Porter, B. A., et al. Repeatedly Pairing Vagus Nerve Stimulation with a Movement Reorganizes Primary Motor Cortex. Cerebral Cortex. 22, 2365-2374 (2011).
- Morrison, R. A., et al. Vagus nerve stimulation intensity influences motor cortex plasticity. Brain Stimulationation. , (2018).
- Hulsey, D. R., et al. Norepinephrine and serotonin are required for vagus nerve stimulation directed cortical plasticity. Exp. Neurol. , (2019).
- Hulsey, D. R., et al. Reorganization of Motor Cortex by Vagus Nerve Stimulation Requires Cholinergic Innervation. Brain Stimulation. 9, 174-181 (2016).
- Bouverot, P., Crance, J. P., Dejours, P. Factors influencing the intensity of the breuer-hering inspiration-inhibiting reflex. Respiration Physiology. , (1970).
- Fialova, E., Vizek, M., Palecek, F. Inflation reflex in the rat. Physiologia Bohemoslov. , (1975).
- Hays, S. A., et al. The bradykinesia assessment task: An automated method to measure forelimb speed in rodents. Journal of Neuroscience Methods. , (2013).
- Kim, H., et al. Cuff and sieve electrode (CASE): The combination of neural electrodes for bi-directional peripheral nerve interfacing. Journal of Neuroscience Methods. , (2020).
- González-González, M. A., et al. Thin Film Multi-Electrode Softening Cuffs for Selective Neuromodulation. Scientific Reports. , (2018).
- Thakur, R., Nair, A. R., Jin, A., Fridman, G. Y. Fabrication of a Self-Curling Cuff with a Soft, Ionically Conducting Neural Interface. Proceedings of the Annual International Conference of the IEEE Engineering in Medicine and Biology Society, EMBS. , (2019).
- Bucksot, J., et al. Flat electrode contacts for vagus nerve stimulation. PLoS One. 14, (2019).
- El Tahry, R., et al. Repeated assessment of larynx compound muscle action potentials using a self-sizing cuff electrode around the vagus nerve in experimental rats. Journal of Neuroscience Methods. , (2011).
- Bonaz, B., Sinniger, V., Pellissier, S. Anti-inflammatory properties of the vagus nerve: potential therapeutic implications of vagus nerve stimulation. Journal of Physiology. , (2016).



