Summary
现有的用于建造用于小型啮齿动物的可长期植入的外周神经袖口电极的方法通常需要专门的设备和/或训练有素的人员。在该协议中,我们演示了一种简单、低成本的制造慢性植入袖口电极的方法,并演示了它们对大鼠迷走神经刺激(VNS)的有效性。
Abstract
外周神经袖口电极早已用于神经科学和相关领域,以刺激,例如,迷走神经或坐骨神经。最近的几项研究表明,慢性VNS在提高中枢神经系统可塑性以改善运动康复、灭绝学习和感官歧视方面的有效性。由于大鼠体型小,长期植入装置的构建具有挑战性,典型的方案需要人员的广泛培训和耗时的微制造方法。或者,可以以更高的成本购买市售的植入式袖口电极。在该协议中,我们提出了一种简单、低成本的方法,用于构建用于大鼠的小型、慢性植入的外周神经袖口电极。我们验证了袖口电极的短期和长期可靠性,证明氯胺酮/xylazine麻醉大鼠的 VNS 在植入时和装置植入后 10 周内都会产生与激活 Hering-Breer 反射一致的呼吸速率降低。通过将 VNS 与熟练的杠杆压机性能配对以诱导电机皮质贴图可塑性,我们进一步演示了袖口电极在慢性刺激研究中的适用性。
Introduction
最近,对慢性植入袖口电极刺激周围神经的需求越来越大,因为研究越来越证明这种技术对治疗许多炎症,性疾病,,,,,,1、2、3,2和神经系统疾病44、5、6、7、8、9、10、11、12、13、14、15,14,,11,12的临床7,8105前有用。3 6913例如,慢性VNS已被证明可在各种学习环境中增强新皮质可塑性,改善运动康复,54,5,6,7,8,灭绝学习,6,7,810,11,12,13,14,,11,12,13,14和感官歧视15。10市售的外设神经袖口电极通常与订单履行时间延长和成本相对较高有关,从而限制其可访问性。另外,长期植入袖口电极的"内部"制造协议仍然有限,啮齿动物解剖由于其体积小而面临特殊挑战。目前为慢性啮齿动物实验构建袖口电极的协议通常需要使用复杂的设备和技术,以及经过广泛培训的人员。在该协议中,我们演示了一种基于以前发布和广泛使用的方法16、17,的袖口电极制造的简化方法。我们验证了我们长期植入大鼠电极的功能,证明在左颈椎迷走神经周围植入袖口时,对袖口电极的刺激成功地使SpO2的呼吸和下降停止。刺激的肺受体血管纤维是众所周知的从事赫林-布劳尔反射,其中抑制几个呼吸核在脑干的结果抑制灵感18。因此,停止呼吸与赫林-布劳尔反射一致,以及由此导致的 SpO2 下降,为麻醉大鼠正确植入电极和袖口功能提供了直接的测试。为了验证慢性植入袖口电极的长期功能,在植入时测量反射反应,并与植入后六周内在同一动物获得的反应进行比较。第二组大鼠在操纵杠杆任务的行为训练后植入了VNS袖口电极。在这些大鼠中,VNS与正确的任务性能配对,产生了皮质运动图的重组,与之前发表的,研究19、20、21、22,2021,一致。在麻醉下发生5~10周麻醉运动皮质映射时,通过确认VNS成功诱导呼吸停止和SpO2下降5%以上,进一步验证了VNS治疗动物的袖口功能。
最近出版的儿童类17和里奥斯等人的协议为简化袖口电极制造方法提供了一个经过验证的起点,因为这种流行的方法已被多个实验室使用,,在啮齿动物,,,,,,11、2、3、4、5、6、7、8、9、10、11中进行慢性,27,8610,VNS研究。349原始方法涉及几个高精度步骤来操纵细微线,使袖口电极制造需要一个多小时才能完成,并进行了广泛的培训才能可靠地执行。此处描述的简化方法所需的材料和工具要少得多,只需经过最少培训的人员,只需在一小时内完成。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
本议定书中描述的所有程序都按照《美国国家卫生和植物保护与使用指南》执行,并经达拉斯德克萨斯大学机构动物护理和使用委员会批准。
1. 刺激袖口电极制造
- 准备袖口管。
- 使用剃须刀刀片,切割一块 2.5 毫米长的聚合物管。插入钳子尖或回形针通过管子,并使用刀片使一个狭缝通过管壁的一侧袖口。
- 从管子上取下钳子,在袖口的中线插入一根大缝纫针,垂直于长轴。将针头穿过狭缝(顶部)插入对面管的中心(底部)。将针头放入泡沫板中,在其余装配步骤中将袖口固定到位。
- 放置缝合线,用于在植入过程中固定袖口闭合。
- 将小缝纫针插入袖口壁,在中线,大约0.5毫米从顶部缝线的一侧。将针头从内部插入外部,以避免损坏袖口管。通过针头的眼睛插入 2 厘米长 6/0 缝合线,并将针头拉过管子壁,将缝合线插入袖口。
- 将螺纹留在位,取出针头,沿着袖口的中线穿过管壁,穿过管壁约 0.5 mm。缝合线穿过针头的眼睛,将针穿过管壁,再次将缝合线穿过袖口。
- 缝合线两端现在应位于袖口的外侧。调整缝合线,使 ±1.5 厘米从顶部孔延伸,±0.5 mm 从底部孔延伸。
- 将少量紫外线固化胶粘剂涂抹到从下孔延伸的缝合线短端,并拉长缝合线端,直到下尾与管材的外墙几乎齐平。使用紫外线棒固化粘合剂,并牢固地固定缝合线。
- 在袖口的对面重复步骤 1.2.1 到 1.2.3。
- 放置铂金:虹膜(Pt:Ir)导线。
- 使用小缝纫针在袖口壁上打4个洞。每对孔应放置在距离垂直中线约 0.5~0.8 mm 的位置,而袖口两侧的顶部狭缝应放置约 0.5~0.8 mm 的孔。
注意:为了最一致和准确的引线放置,请将针从内部插入到外部,以使用缝合线放置作为参考。 - 再次插入缝纫针,这一次工作从外部到内部,通过铅孔1。将长约 0.5 厘米的 Pt:Ir 线插入针头眼,将针头拉过管子,将导线穿过袖口壁。调整导线,使 +4.5 厘米延伸到袖口的外表侧(图 1A)。
- 再次通过引线孔 1 插入针,再次从外部到内部工作,此外,将针插入铅孔 2,直接穿过引线孔 1。将 Pt:Ir 导线的短(内部)端插入 ±0.5 厘米,穿过针头的眼睛,将针头拉过管子,将导线穿过袖口壁。
注:Pt:Ir 导线的两端现在应位于袖口的外侧,并在狭缝边缘周围形成导线环路并通过引线孔 1(图 1B)。 - 重复步骤 1.3.1 到 1.3.3,将 Pt:Ir 导线穿过引线 3 和 4。
- 使用丁烷打火机,小心地从 Pt:Ir 导线从铅孔 2 和铅孔 4 延伸的 Pt:Ir 导线结束时的 5~6 mm 长度中去除绝缘层。
注意:小心地将引线与袖口组件的其余部分隔离,以避免损坏袖口。使用工具握住电线,避免受伤。 - 将袖口内的裸线对齐,将导线放在最终位置。为此,轻轻拉动 Pt:Ir 导线的端部,从孔 1 延伸,直到导线的未绝缘部分与孔 1 齐平。与其他引线重复,以对齐通过引线孔 3 和 4 的导线的未绝缘端。
- 在铅孔 1 和 3 的袖口外侧的导线环上涂抹少量紫外线固化粘合剂。使用紫外线棒固化粘合剂并固定引线。
- 使用小移液器尖端将未绝缘的 Pt:Ir 导线推到袖口的内壁上。一旦引线就位,切断从铅孔 2 和 4 延伸的导线的末端,使大约 1 mm 的导线延伸到袖口墙外部。
- 将电线的 1 mm 尾部平放在袖口的外表面上,注意不要将其短路在一起。涂抹少量紫外线固化粘合剂,只覆盖两条尾巴,并固化粘合剂,以确保铅放置并提供电气绝缘。
注意:用粘合剂完全覆盖外部暴露的 Pt:Ir 表面以隔离导线并避免目标外刺激非常重要。
- 使用小缝纫针在袖口壁上打4个洞。每对孔应放置在距离垂直中线约 0.5~0.8 mm 的位置,而袖口两侧的顶部狭缝应放置约 0.5~0.8 mm 的孔。
- 用缝合固定固定固定 Pt:Ir 导线。
- 从泡沫板上取下带袖口组件的大针。通过针头的眼睛插入 3 厘米长 6/0 缝合线,并将针头拉过管子,将缝合线穿过中点袖口底部。
- 切换到小缝纫针完成缝合线 Pt:Ir 铅固定。将针头插入同一中线孔,从内部到外部再次工作,以避免油管和导线的变形。将缝合线的外表尾穿过针头的眼睛,将针头拉过袖口壁,在袖口边缘形成缝合环(图1C)。
注:使用钳子,在显微镜下工作,以确保缝合线沿着袖口的长轴方向,平放在管子上。此步骤可确保引线在袖口的内侧保持分离,并放在一侧的袖口中线。 - 通过将缝合线末端绑在袖口的外侧,在袖口的外侧,在袖口的另一端周围创建第二个环。确保缝合线沿着袖口的长轴运行,并平放在管子上。在紧固结的同时,将其平放在管子上,将少量紫外线固化粘合剂涂抹在半结上,并固化到位。
- 小心地切割缝合线的末端,尽可能靠近结。如有必要,使用少量额外的紫外线固化粘合剂粘附缝合的短端,以便它们平放在管子上(图1D)。
- 将连接器引脚焊接到 Pt:Ir 导线。
- 使用丁烷打火机,从每个 Pt:Ir 导线的末尾的 ±3 mm 中去除绝缘层。将金针的杯面(参见 材料表)焊接到每个引线未内化的端。
- 测试组装设备的阻抗。
- 将金引脚连接到 LCR 仪表或电极阻抗检查模块的输入,将测试频率设置为 1 kHz。将袖口管(Pt:Ir 刺激接触到袖口内部)淹没在充满盐水的小烧杯中,注意保持金铅销和探头接头干燥。在继续植入之前,验证组装的袖口的阻抗是否低于 2 kΩ。
注:高阻抗通常表示暴露的 Pt:Ir 表面积不足,其原因可能是绝缘材料去除不足、袖口内部意外使用粘合剂、电线链断裂等。还应检查袖口是否有断裂或放置不当的电线链,这些电线链可能导致长期使用短路接触。
- 将金引脚连接到 LCR 仪表或电极阻抗检查模块的输入,将测试频率设置为 1 kHz。将袖口管(Pt:Ir 刺激接触到袖口内部)淹没在充满盐水的小烧杯中,注意保持金铅销和探头接头干燥。在继续植入之前,验证组装的袖口的阻抗是否低于 2 kΩ。
2. 头盖结构
注:Headcap 装配程序与之前发布的程序类似(Childs 等人17),并在此进行总结以方便起见。
-
组装头盖17
- 切割两小块 30 AWG 线包装,一个 13 毫米长,一个 +10 毫米长。剥去两根导线两端的 ±1.5 mm 绝缘层。将金针的销侧焊接到每根导线的一端,尽可能靠近杯。使用线切割机切断焊点以外的多长销。
- 将 AWG 导线的另一端焊接到 4 针微带连接器的两个中央焊杯上。
- 弯曲线头盖通向连接器,将金针平放在接头上,彼此平行,如图 2A 所示。连接到较短导线的销应放置在连接到较长导线的销下方。使用指甲丙烯酸、牙科水泥或紫外线固化粘合剂将头盖引线固定到位。
3. 设备使用情况
- 植入袖口电极,用于慢性迷走神经刺激。
注:所有外科手术应根据NIH实验室动物护理和使用指南,并经当地 IACUC 批准,在适当的麻醉下使用无菌或无菌技术进行。以下过程旨在说明设备的代表性用法,并不具有全面性。- 将大鼠放在立体轴框架中,在腹骨和腹骨上做一个下垂切口,以露出头骨表面,用于植入头盖/连接器。小心地在头骨上钻 4 个孔,并放置珠宝商的螺钉。使用牙科丙烯酸将头盖固定到头骨和螺钉上。
- 将老鼠从立体框架中取下,并躺在它的右侧。在颈部左侧的皮肤上做一个垂直切口,并仔细解剖左迷走神经从胡萝卜状动脉,位于胸肌和胸腺肌肉之间和软骨肌肉下面。
- 袖口的隧道引导皮下走向头骨。使用金针将引线连接到头盖。
- 将迷走神经放在袖口内,通过将双节绑在袖口缝合线中固定设备。在植入过程中,注意避免通过钝、非导电钩操纵神经或抓住神经周围的结缔组织来破坏神经。
- 通过对设备施加刺激来测试植入物(10 s 列车 0.8 mA,30 Hz,100 μs 双相脉冲)。适当的植入将导致呼吸停止和 SpO2 下降 5% 或更多。
- 用牙科丙烯酸覆盖金针和裸露的引线,用缝合线关闭伤口,用盐水、酒精和波维酮碘溶液清洁切口部位。
- 根据 NIH 指南和 IACUC 批准,提供替代液、镇痛药和术后护理。
- 在清醒过程中刺激迷走神经。
注:在动物执行特定运动任务时交付 VNS 之前已显示可扩展与任务相关的肌肉的电机映射表示。我们使用此经过验证的范例来提供设备使用情况的代表性示例,但许多其他行为范式和/或刺激参数可能与替代应用相关。老鼠在植入设备之前,接受过熟练掌握此处使用的杠杆压压任务的训练。手术后,在VNS分娩前再次验证了良好的表现:大鼠每天在两次30分钟的训练中至少进行了100次成功的试验。在 5 天的 10 次后续训练中,VNS 与正确的操纵杆机配对。- 通过植入的头盖将大鼠连接到刺激发生器,并调整到适当的刺激设置。对于 VNS 诱导的电机皮质贴图重组,将每个正确的操纵杆按压器与 15 个双相脉冲的单个列车配对,每个脉冲的宽度为 100 μs,振幅为 800 μA,以 30 Hz 的频率交付。
- 在10次30分钟的训练中,每次成功的杠杆压机被检测到后,将立即提供刺激列车。在 VNS 交付期间,使用示波器监控电流刺激的成功传递。
- 验证长期植入的袖口功能。
- 在上次 VNS 配对训练课的 24 小时内,使用颅内微刺激 (ICMS) 来量化运动皮层19、20、21、22,20,中的功能躯体图。21
- 在运动皮层ICMS图谱麻醉诱导后,通过应用10 s的30赫兹、0.8 mA电流刺激(100μs双相脉冲)再次验证袖口功能,这应该会导致停止呼吸,减少SpO2 水平至少5%,符合赫林-布劳尔反射。
注:根据应用的不同,如果观察到低于 5% 的可靠 SpO2 跌落,或者更高的电流振幅(高达 1.6 mA)可靠地在 SpO2中至少减少 5%,则袖口功能可能被认为是可接受的。未能观察到停止呼吸和/或 SpO2 的可靠减少表明植入物失败。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
根据先前公布的外科手术17、19、20、21、22,迷走神经,19袖口,电极和21头盖被长期植入大鼠体内。在植入之前,在袖口引线上测量 1 kHz 的阻抗,袖口管浸入盐水中(阻抗 = 1.2 = 0.17 kΩ [均值 = std];N = 9)。在盐水中只植入阻抗小于2 kΩ的袖口;所有袖口都符合此标准(不包括 0/9 袖口)。在植入手术期间,所有袖口的功能验证都通过测试刺激引起的短暂停止呼吸和随后血氧饱和度的下降归因于赫林-布劳尔反射。为了唤起这种反应,10 s的列车30赫兹,0.8 mA电流刺激(100μs双相脉冲)交付通过袖口引线。对于 9/9 植入袖口,我们观察到 VNS 诱导的呼吸停止在 10 秒刺激期间,并伴随着 SpO2的下降至少 5%(SpO 2 的百分比变化 = -10.3 = 3.2%, 均值 = std; 范围 = -5.7 至 -14.5%),确认袖口功能和正确植入。2在初始植入过程中,我们发现初始 SpO2读数与 VNS 唤起的 SpO2中百分比变化之间有显著相关性(图 2B;R2 = 0.60,p = 0.0083,Pearson 的线性相关性),与已发表的文献一致,证明麻醉深度影响赫林-布劳尔反射23,24的幅度。为了测试慢性植入袖口的长期功能,大鼠在设备植入6周后再次麻醉,并应用了VNS来唤起赫林-布劳尔反射反应。对于 9 台设备中的 7 台,我们观察到 SpO2的降幅大于 5%,使用 10 s 列车的 0.8 mA,30 Hz 刺激(图 2C)。在这些器件中,SpO2的刺激激发变化幅度与初始植入时观察到的幅度没有不同,这表明慢性植入装置的继续性能良好(SpO 2 的初始变化百分比 =-9.7 = 3.4%,SpO2的最终变化百分比 = -15.8 = 6.5%,均值 = std; p = 0.08,配对 t-test)。在其余 2 个器件中,将刺激振幅提高至 1.6 mA 足以使 SpO2的可靠减少至少 5%,这表明这些设备继续工作,但阻抗、神经损伤或袖口方向随时间的变化可能导致性能降低。
为了进一步测试我们长期植入的刺激电极的长期功能,第二组大鼠接受了由Hays等人开发的熟练伸手操纵杆任务的简化版本,以定量评估前肢电机性能25。多项研究已经证明,将VNS与正确的电机性能配对,可增加初级运动皮层19、20、21、2219,20,21中的近位前肢表示。在我们的简化版任务中,大鼠被要求在训练室外达到2厘米,以完全按下一个杠杆,然后在2s内释放它,才能获得食物奖励(图2D)。动物每天接受两次30分钟的训练,直到他们对任务达到稳定的熟练程度(>65%正确,>100试验/会话,至少连续8/10次)。然后,大鼠接受了手术,在左迷走神经周围植入刺激性袖口电极。手术后恢复,适应刺激电缆,并恢复熟练的行为表现,大鼠接受了额外的10个训练课程,其中VNS(0.5的列车0.8 mA,30 Hz脉冲;100μs双相脉冲宽度),或假刺激(无刺激),在正确的杠杆释放时交付。在上一次VNS配对训练后24小时内,大鼠被麻醉了氯胺酮/锡胺(80/10毫克/千克,即p.),测试了袖口电极功能,并按照公布的程序22进行皮质电机映射。与先前的研究表明 VNS 驱动任务相关运动图表示的扩展一致,VNS 治疗大鼠 (N = 3) 在我们的研究中表现出明显大于假处理大鼠 (N = 4) 的近位前肢 (PFL) 表示形式(图2D;PFL 占地图总面积的百分比,均值 = SEM:假 = 15.6 = 6.7%,VNS = 38.3 = 1.0%;p = 0.035,2 样本 t 测试,测试功率 = 0.8)。在所有经过 VNS 处理的动物中,通过确认 SpO2中高于 5% 的变化(10 s 0.8 mA,30 Hz 脉冲;100 μs 双相脉冲宽度)响应,在麻醉后进行了麻醉后验证袖口功能。
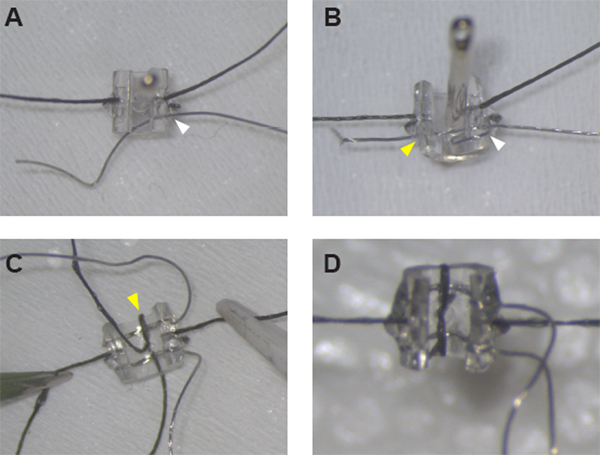
图1:刺激袖口电极的组装。(A) 固定袖口两侧的缝合线后,Pt:Ir 线线可以使用缝纫针穿过孔 #1(白色箭头)的袖口壁。(B) Pt:Ir 导线在袖口边缘周围创建导线环并再次穿过孔 #1(白色箭头)和袖口穿过孔 #2(黄色箭头)后,正确螺纹并做好脱保准备。(C) 一旦两条引线都到位,通过中线孔和袖口边缘(黄色箭头)螺纹缝合来固定第一条引线。(D) 用半结和胶水关闭第二条引线周围的循环,以完成袖口组装。 请单击此处查看此图的较大版本。

图2:清醒行为大鼠慢性迷走神经刺激的装置使用。 (A) 头盖组件。(B) 在设备植入过程中,SpO2 中的 VNS 唤起减少与初始 SpO2 读数相关(R2 = 0.602,p = 0.008,Pearson 的线性相关性)。(C) 6周后在设备植入时获得的VNS-唤起的SpO 2 滴与刺激实验终止时的比较。线指示单个大鼠的测量对。在面板B和C的刺激包括一个单10 s的10μs双相脉冲的列车交付在0.8 mA和30 Hz. (D) 鼠与慢性植入的VNS袖口电极执行杠杆压任务。(E) VNS (0.5 s 列车 0.8 mA, 30 Hz, 100 μs 双相脉冲) 与正确的杠杆压性能配对,扩展了运动皮层中与任务相关的肌肉的映射表示。与接受沙姆刺激(N = 4)的老鼠相比,接受 VNS 与正确杠杆压机性能 (N = 3) 配对的大鼠在运动图区域中所表现出的用于近位前肢 (PFL) 表示的较大百分比。点显示各个主题的 PFL 表示;误差条指示 SEM. VNS 治疗,随后进行运动皮质映射,在植入后 5~10 周进行。 请单击此处查看此图的较大版本。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
在这里,我们描述了一种简单、低成本的方法,用于组装用于啮齿动物的慢性植入刺激袖口电极,从而促进对这种新兴疗法的临床前研究。这种简化的方法不需要专门的培训或设备,并且使用少量的工具和用品,大多数研究实验室都,很容易获得,与其他方法16、26、27、28相比26,27,降低了设备制造的货币和人工成本。在整个装配过程中需要小心,以避免过度使用紫外线固化粘合剂,同时仍然确保缝合线和 Pt:Ir 引线具有足够的机械稳定性,从而实现长期袖口功能。过量的粘合剂会使设备植入复杂化,并可能在手术后刺激周围组织,而粘合剂不足会增加随着时间的推移,引线可能无法与神经保持良好的接触,导致设备性能下降或失效。在袖口流明内一致放置绝缘 Pt:Ir 导线对于实现低阻抗和良好器件性能也至关重要。应注意正确对齐去绝缘导线,使暴露的导线的最大可能表面位于袖口内,而外部不存在外露导线。
我们已证实,我们的方法所生产的袖口与目前几个实验室常用的袖口相似,用于,,,在大鼠4、5、6、7、8、9、10、11、12、13、14、15、19、20、21、22,5中长期进行VNS9,10,11,12,13,14,15,19,20,21,分娩。7,86最近的研究表明,外周神经纤维同样被采用各种各样的电极接触大小和方向16,29,29这表明这种协议可以适应许多需要周围神经刺激的实验,而且手工组装袖口产生的铅间距或表面积的小变化不会对大多数实验结果产生批判性影响。16在每个刺激会话期间,我们使用示波器监控袖口引线上的电压,以确保引线不会短路或断裂,但我们在植入后 5-10 周内没有跟踪特定植入设备的阻抗变化。一项对类似植入装置的研究表明,在手术植入后头4周内,阻抗确实显著增加,大概是因为急性损伤稳定了30。然而,在这项研究中,设备阻抗的变化与长期植入8周内的设备性能没有关联:作者报告,在植入后几周内,VNS强度与复合作用潜在振幅之间的关系没有显著变化。在这里,我们同样能够功能验证袖口性能后,5-10周的植入:(i) 验证VNS仍然可以唤起停止呼吸和下降的SpO2符合赫林-布劳尔反射,和(ii) 复制先前的工作,证明VNS诱导的电机图重组。在我们自己的工作中,我们发现诱导赫林-布劳尔反射是验证植入的 VNS 袖口长期功能的最可靠方法,由于与袖口组装无关的多种因素,可能会显示设备性能降低或故障;这些包括手术并发症、神经损伤和/或手铐或头盖的机械损伤。出色的手术技术和设备功能的应用特定验证对于稳定而成功地使用慢性植入刺激袖口电极至关重要。
我们描述了一种简单、廉价的组装外周神经袖口电极的方法,用于小动物的慢性植入,并证明了它在大鼠行为实验期间对VNS的传递有用性。VNS正在越来越多地调查广泛的临床适应症,包括炎症性疾病,如风湿性关节炎11,22和克罗恩病,31以及神经性疾病,如中风5,6,7,8,6,7,和PTSD10,11。,11这种可接近的制作刺激袖口电极的方法应有助于在各种对VNS机制和有效性的转化研究中使用临床前啮齿动物模型。该协议易于适应,进一步提高了该方法的多功能性。例如,聚氨酯管的直径和/或长度可以修改,以适应其他物种或其他周围神经位点(如坐骨神经、肾病或囊神经)的慢性刺激实验。或者,具有额外引线的配置可以在神经沿线的多个位点进行刺激,或者可以同时记录刺激唤起的复合动作电位。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
作者没有什么可透露的。
Acknowledgments
这项工作由德克萨斯大学达拉斯分校和UT摄政委员会资助。我们感谢所罗门·戈尔丁、比拉尔·哈桑、玛吉·贾尼和清慈宗的技术援助。
Materials
| Name | Company | Catalog Number | Comments |
| Biocompatible polyurethane-based polymer tubing, 0.080" OD x 0.040" ID | Braintree Scientific | MRE080 36 FT | |
| Dissecting microscope | AM Scopes | #SM-6T-FRL | |
| Fine Serrated Scissors, straight, 22mm cutting edge | Fine Science Tools | #14058-09 | for cutting Pt/Ir wire and suture thread |
| Forceps, #5 Dumont forceps, straight, 11 cm, 0.1 x 0.06 mm tip | Fine Science Tools | #11626-11 | |
| Forceps, ceramic tipped forceps, 0.3 mm x 30 mm tips | Electron Microscopy Sciences | #78127-71 | |
| Gold Pins, PCB Press Fit Socket | Mill-Max | #1001-0-15-15-30-27-04-0 | or similar small pins for connecting cuff leads to headcap |
| Isobutane lighter | BIC | #LCP21-AST | for de-insulating Pt/Ir wire |
| Micro strip connector with latch, 4-pin | Omnetics | A24002-004 / PS1-04-SS-LT | |
| Pipette tip, 10 uL | VWR | 89079-464 | |
| Platinum-Iridium (90/10%) Wire, 0.001" (diameter) x 9 strands, PTFE insulated | Sigmund Cohn | 10IR9/49T | |
| Razor Blade, Single Edge, Surgical Carbon Steel No.9 | VWR | #55411-050 | for cutting MicroRenathane tubing |
| Sewing needle, ca. 4.0 cm length x 0.7 mm diameter (size 6-7) | Singer | 00276 | Smaller needle for threading Pt/Ir wire |
| Sewing needle, ca. 4.5 cm length x 0.8 mm diameter (size 2-3) | Singer | 00276 | Larger needle for pinning cuff during assembly and for threading suture |
| Small foam board | Juvo+/Amazon | B07C9637SJ | for fabrication platform; our dimensions are ca. 2.5" x 3.5" x 1" (L x W x H) |
| Solder, multicore lead-free, 0.38mm diameter | Loctite/Multicore | #796037 | |
| Soldering station | Weller | WES51 | or similar soldering iron compatible with long conical tips (this part has been discontinued) |
| Soldering tip, long conical, 0.01" / 0.4 mm | Weller | 1UNF8 | |
| Suture, nonabsorbable braided silk ,size 6/0 | Fine Science tools | #18020-60 | |
| UV (405 nm) spot light | Henkel/Loctite | #2182207 | |
| UV Light Cure Adhesive 25 ml | Henkel/Loctite | AA 3106 | or similar biocompatible UV cure adhesive |
| Wire wrapping wire, 30 AWG | Digikey | K396-ND |
References
- Koopman, F. A., et al. Vagus nerve stimulation inhibits cytokine production and attenuates disease severity in rheumatoid arthritis. Proceedings of the National Academy of Sciences of the United States of America. , (2016).
- Levine, Y. A., et al. Neurostimulation of the cholinergic anti-inflammatory pathway ameliorates disease in rat collagen-induced arthritis. PLoS One. , (2014).
- Zhang, Y., et al. Chronic vagus nerve stimulation improves autonomic control and attenuates systemic inflammation and heart failure progression in a canine high-rate pacing model. Circulation: Heart Failure. , (2009).
- Ganzer, P. D., et al. Closed-loop neuromodulation restores network connectivity and motor control after spinal cord injury. Elife. , (2018).
- Hays, S. A., et al. Vagus nerve stimulation during rehabilitative training enhances recovery of forelimb function after ischemic stroke in aged rats. Neurobiology of Aging. , (2016).
- Khodaparast, N., et al. Vagus nerve stimulation delivered during motor rehabilitation improves recovery in a rat model of stroke. Neurorehabilitation and Neural Repair. , (2014).
- Meyers, E. C., et al. Vagus nerve stimulation enhances stable plasticity and generalization of stroke recovery. Stroke. , (2018).
- Hays, S. A., et al. Vagus nerve stimulation during rehabilitative training improves functional recovery after intracerebral hemorrhage. Stroke. , (2014).
- Farrand, A., et al. Vagus nerve stimulation improves locomotion and neuronal populations in a model of Parkinson's disease. Brain Stimulationation. , (2017).
- Souza, R. R., et al. Vagus nerve stimulation reverses the extinction impairments in a model of PTSD with prolonged and repeated trauma. Stress. , (2019).
- Noble, L. J., Souza, R. R., McIntyre, C. K. Vagus nerve stimulation as a tool for enhancing extinction in exposure-based therapies. Psychopharmacology. , (2019).
- Childs, J. E., Kim, S., Driskill, C. M., Hsiu, E., Kroener, S. Vagus nerve stimulation during extinction learning reduces conditioned place preference and context-induced reinstatement of cocaine seeking. Brain Stimulationation. , (2019).
- Peña, D. F., Engineer, N. D., McIntyre, C. K. Rapid remission of conditioned fear expression with extinction training paired with vagus nerve stimulation. Biological Psychiatry. , (2013).
- Childs, J. E., DeLeon, J., Nickel, E., Kroener, S. Vagus nerve stimulation reduces cocaine seeking and alters plasticity in the extinction network. Learning & Memory. , (2017).
- Engineer, C. T., et al. Temporal plasticity in auditory cortex improves neural discrimination of speech sounds. Brain Stimulationation. , (2017).
- Rios, M., et al. Protocol for Construction of Rat Nerve Stimulation Cuff Electrodes. Methods Protoc. , (2019).
- Childs, J. E., et al. Vagus nerve stimulation as a tool to induce plasticity in pathways relevant for extinction learning. Journal of Visualized Experiments. , (2015).
- Paintal, A. S. Vagal sensory receptors and their reflex effects. Physiological reviews. , (1973).
- Porter, B. A., et al. Repeatedly Pairing Vagus Nerve Stimulation with a Movement Reorganizes Primary Motor Cortex. Cerebral Cortex. 22, 2365-2374 (2011).
- Morrison, R. A., et al. Vagus nerve stimulation intensity influences motor cortex plasticity. Brain Stimulationation. , (2018).
- Hulsey, D. R., et al. Norepinephrine and serotonin are required for vagus nerve stimulation directed cortical plasticity. Exp. Neurol. , (2019).
- Hulsey, D. R., et al. Reorganization of Motor Cortex by Vagus Nerve Stimulation Requires Cholinergic Innervation. Brain Stimulation. 9, 174-181 (2016).
- Bouverot, P., Crance, J. P., Dejours, P. Factors influencing the intensity of the breuer-hering inspiration-inhibiting reflex. Respiration Physiology. , (1970).
- Fialova, E., Vizek, M., Palecek, F. Inflation reflex in the rat. Physiologia Bohemoslov. , (1975).
- Hays, S. A., et al. The bradykinesia assessment task: An automated method to measure forelimb speed in rodents. Journal of Neuroscience Methods. , (2013).
- Kim, H., et al. Cuff and sieve electrode (CASE): The combination of neural electrodes for bi-directional peripheral nerve interfacing. Journal of Neuroscience Methods. , (2020).
- González-González, M. A., et al. Thin Film Multi-Electrode Softening Cuffs for Selective Neuromodulation. Scientific Reports. , (2018).
- Thakur, R., Nair, A. R., Jin, A., Fridman, G. Y. Fabrication of a Self-Curling Cuff with a Soft, Ionically Conducting Neural Interface. Proceedings of the Annual International Conference of the IEEE Engineering in Medicine and Biology Society, EMBS. , (2019).
- Bucksot, J., et al. Flat electrode contacts for vagus nerve stimulation. PLoS One. 14, (2019).
- El Tahry, R., et al. Repeated assessment of larynx compound muscle action potentials using a self-sizing cuff electrode around the vagus nerve in experimental rats. Journal of Neuroscience Methods. , (2011).
- Bonaz, B., Sinniger, V., Pellissier, S. Anti-inflammatory properties of the vagus nerve: potential therapeutic implications of vagus nerve stimulation. Journal of Physiology. , (2016).



