Summary
小さなげっ歯類で使用するために慢性的に埋め込まれた末梢神経カフ電極を構築するための既存のアプローチは、多くの場合、特殊な機器および/または高度な訓練を受けた人員を必要とします。このプロトコルでは、慢性的に埋め込まれたカフ電極を作製するためのシンプルで低コストのアプローチを示し、ラットにおける迷走神経刺激(VNS)の有効性を実証する。
Abstract
末梢神経カフ電極は、神経科学および関連分野において、例えば迷走や坐骨神経の刺激に用いられてきた。最近のいくつかの研究では、運動リハビリテーション、絶滅学習、感覚的差別を改善するために中枢神経系の可塑性を高める上で慢性VNSの有効性が実証されています。このような研究で使用する慢性的に埋め込まれたデバイスの構築はラットの小さなサイズのために困難であり、典型的なプロトコルは、人員と時間のかかる微細加工方法の広範な訓練を必要とします。あるいは、市販の埋め込み型カフ電極は、大幅に高いコストで購入することができる。本プロトコルでは、ラットで使用するための小型で慢性的に埋め込まれた末梢神経カフ電極の構築のための、簡単で低コストの方法を提示する。ケタミン/キシラジン麻酔ラットのVNSが、移植時とデバイス移植後10週間の両方で、ヘリング・ブロイアー反射の活性化と一致する呼吸数の低下を生じることを実証することによって、カフ電極の短期および長期の信頼性を検証します。さらに、VNSと熟練したレバープレス性能を組み合わせて運動皮質マップの可塑性を誘導することにより、慢性刺激研究に使用するカフ電極の適合性を実証する。
Introduction
最近では、末梢神経の刺激のための慢性的に埋め込まれたカフ電極の需要が高まっており、研究が多数の炎症性疾患の治療のためにこの技術の前臨床有用性をますます実証するにつれて,2,3、1、5、6、7、8、9、10、11、12、13、14、15。,5,6,13,14,151,7,8,9,10,11,12慢性VNSは、例えば、様々な学習文脈において新皮質可塑性を増強することが,示されており、運動リハビリテーション4、5、6、7、8、5,6,7,8絶滅学習410、11、12、13、14、および感覚的識別15を改善する。10,1112,13,14市販の末梢神経カフ電極は、多くの場合、注文のフルフィルメントのための延長時間と比較的高いコストに関連付けられており、アクセシビリティを制限することができます。あるいは、慢性的に埋め込まれたカフ電極の「社内」製造のためのプロトコルは限られたままであり、げっ歯類解剖学は、その小さなサイズのために特定の課題を提示する。慢性げっ歯類実験のためのカフ電極を構築するための現在のプロトコルは、多くの場合、複雑な機器や技術だけでなく、広範な訓練を受けた人員の使用を必要とします。このプロトコルでは、以前に公開され、広く使用されている方法16、17,17に基づいてカフ電極製作への簡単なアプローチを示しています。左頸管迷走神経の周りのカフ移植時に、カフ電極に加えられる刺激がSpO2の呼吸と低下の停止に成功したことを実証することによって、ラットに慢性的に埋め込まれた電極の機能を検証します。心肺受容体バベイル繊維の刺激は、ヘリングブロイアー反射に関与することが知られており、脳幹におけるいくつかの呼吸核の阻害が抑制のインスピレーション18をもたらす。従って、ヘリングブロイアー反射と一致する呼吸の停止、および結果として得られるSpO2の低下は、麻酔下ラットにおける適切な電極注入およびカフ機能のための簡単なテストを提供する。慢性的に埋め込まれたカフ電極の長期機能性を検証するために、移植時に反射応答を測定し、移植後6週間後に同じ動物で得られた応答と比較した。ラットの第2のグループは、レバープレス作業の行動訓練の後、VNSカフ電極で移植された。これらのラットでは、VNSは正しいタスク性能と組み合わせることで、皮質運動マップの再編成を生じ、以前に発表された研究19、20、21、2220,21,22と一致する。19デバイス移植後5~10週で起こった麻酔下での運動皮質マッピングの時点で、VNSが呼吸停止を誘発し、SpO2の5%以上の低下を引き起こしたことを確認することで、VNS処理動物のカフ機能をさらに検証しました。
,Childs et al.8,17および Rios ら16の最近公開されたプロトコルは、この一般的な方法がげっ歯類,,,,1、2、3、4、5 、,6、8、9、10、511の慢性 VNS 研究を行う複数のラボで利用されてきたように、簡略化されたカフ電極の製造アプローチの適切な開始点を提供します。オリジナルの方法では、カフ電極の製造が完了するまでに1時間以上かかるような微細なマイクロワイヤを操作するためのいくつかの高精度のステップと、確実に実行するための広範なトレーニングが含まれます。ここで説明する簡略化されたアプローチは、材料とツールを大幅に削減し、最小限の訓練を受けた人員によって1時間以内に完了できます。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
このプロトコルに記載されているすべての手順は、実験動物のケアと使用のためのNIHガイドに従って行われ、ダラスのテキサス大学の施設動物のケアと使用委員会によって承認されました。
1. 刺激カフ電極の製造
- カフチューブを準備します。
- カミソリの刃を使用して、長さ2.5mmのポリマーチューブを切ります。チューブを通して鉗子の先端またはペーパークリップを挿入し、刃を使用して、袖口の片側の管の壁を通して縦にスリットを作ります。
- チューブから鉗子を取り外し、長軸に垂直なカフの正中線を通して大きな縫製針を挿入します。スリット(上)を通して、反対側のチューブの中央(下)に針を挿入します。残りの組み立てステップ中に袖口を固定するために、フォームボードに針を置きます。
- 注入の間に袖口閉鎖を固定するための縫合を置く。
- 袖口の壁を通して小さな縫製針を中線に、一方の端の上のスリットから約0.5 mm挿入します。袖口の損傷を避けるために、内部から外装に針を挿入します。針の目を通して6/0縫合糸の2cmの長さを挿入し、糸を袖口に通すために管の壁を通して針を引っ張ります。
- 糸を所定の位置に残し、針を取り外し、袖口の正中線に沿って、最初の穴の下約0.5mm下のチューブウォールに2番目の穴を穿刺します。針の目から縫合糸を挿入し、チューブウォールを通して針を引き、縫合糸を再び袖口に通します。
- 縫合糸の両端が袖口の外側にあるはずです。上の穴から約1.5cm伸び、下穴から約0.5mm伸びるように縫合を調整します。
- 下の穴から伸びる縫合糸の短い端に少量のUV硬化接着剤を塗布し、下尾がチューブの外壁とほぼ同じになるまで長い縫合端を引っ張ります。UV杖を使用して接着剤を硬化させ、縫合糸をしっかりと所定の位置に保持します。
- カフの反対側で、ステップ 1.2.1 ~ 1.2.3 を繰り返します。
- プラチナ:イリジウム(Pt:Ir)ワイヤーリードを配置します。
- カフの壁に4穴を作るために小さな縫製針を使用してください。各穴のペアは、垂直な正中線から約 0.5 ~0.8 mm、袖口の両側の上部スリットから約 0.5 ~ 0.8 mm の穴を配置する必要があります。
注意: リードの最も一貫した正確な配置のために、ガイドとして縫合線の配置を使用して、すべての穴を作るために内部から外装に針を挿入します。 - 縫製針を再び挿入し、今度は外装から内部まで、リードホール1を通して作業します。約0.5cmの長さ7.5cmのPt:Irワイヤーを針の目に通し、チューブを通して針を引き、ワイヤーリードをカフの壁に通します。袖口の外側に約4.5 cmが伸びるようにワイヤーを調整します(図1A)。
- リードホール1を通して針を再び挿入し、再び外装から内部に作業し、さらにリードホール1の真向かいにリードホール2を通して針を挿入する。Pt:Irワイヤーの短い(内部)端の0.5cmを針の目に差し込み、チューブを通して針を引き、ワイヤーリードをカフの壁に通します。
注: Pt:Ir ワイヤの両端がカフの外側側に、スリット エッジの周囲とリード ホール 1 (図 1B)を通るワイヤ ループが形成されます。 - ステップ 1.3.1 ~ 1.3.3 を繰り返して、Pt:Ir ワイヤをリード穴 3 と 4 に配置します。
- ブタンライターを使用して、リードホール2とリードホール4から延びるPt:Irワイヤの端部にある5~6mmの長さから断熱材を慎重に取り外します。
注意:袖口に損傷を与えないように注意深く袖口アセンブリの残りの部分からリードの端を分離します。工具を使用して、損傷を防ぐためにワイヤーを保持します。 - 袖口の内側に裸のワイヤーを合わせて、リードを最終的な位置に配置します。これを行うには、穴 1 から延びる Pt:Ir ワイヤの端を、ワイヤの絶縁されていない部分が穴 1 でフラッシュされるまで、そっと引っ張ります。他のリードで繰り返し、リードホール3と4を通して配線の絶縁されていない端を揃えます。
- リードホール1と3のカフの外側側のワイヤーループに少量のUV硬化接着剤を塗布します。紫外線杖を使用して接着剤を硬化させ、リードを所定の位置に固定します。
- カフの内壁に対して絶縁されていないPt:Irワイヤーリードを押すために小さなピペットの先端を使用してください。リードが所定の位置に配置されたら、リード穴 2 と 4 から延びるワイヤの端部を切断し、約 1 mm のワイヤがカフの外側を越えて伸びるようにします。
- ワイヤーの1mmの尾を袖口の外面に対して平らに折り返し、それらを一緒に短くしないように注意してください。2つの尾を覆うだけで、少量のUV硬化剤を塗布し、接着剤を硬化させ、鉛配置を確保し、電気絶縁を提供します。
注意:外部に露出したPt:Ir表面を接着剤で完全に覆い、ワイヤーを絶縁し、オフターゲット刺激を避けることは重要です。
- カフの壁に4穴を作るために小さな縫製針を使用してください。各穴のペアは、垂直な正中線から約 0.5 ~0.8 mm、袖口の両側の上部スリットから約 0.5 ~ 0.8 mm の穴を配置する必要があります。
- 縫合線を固定して、Pt:Irワイヤリードを所定の位置に固定します。
- 泡板から袖口アセンブリと大きい針を取り外します。針の目を通して6/0縫合糸の3cmの長さを挿入し、中点の袖口の底に縫合を通すためにチューブを通して針を引っ張ります。
- 小さな縫製針に切り替えて、Pt:Irリード固定のための縫合糸を完了します。チューブとワイヤリードの変形を避けるために、内部から外部に再び作業して、同じ正中の穴を通して針を挿入します。針の目を通して縫合の外側の尾を挿入し、袖口の壁を通して針を引いて、袖口の端の周りに縫合のループを作成する(図1C)。
注:鉗子を使用し、縫合が袖口の長い軸に沿って向き、管に対して平らに横たわっていることを確認するために顕微鏡の下で働きます。このステップは、リードが袖口の内側に分離されたままであることを保証し、袖口の正中線に横に保持されます。 - 袖口の外側の側面に、縫合糸の端を半分の結び目で結ぶことによって袖口の反対側の端のまわりの第2のループを作成する。縫合糸は袖口の長い軸に沿って動き、管に対して平らに横たわっていることを確認する。結び目をしっかりと保持しながらチューブに対して平らに横たわるように、少量のUV硬化接着剤をハーフノットに塗布し、所定の位置に保持するために硬化します。
- 縫合糸の端をできるだけ結び目の近くに慎重に切ります。必要に応じて、少量の追加のUV硬化剤を使用して縫合糸の短い端を接着し、チューブに対して平らに置きます(図1D)。
- Pt:Ir ワイヤリードへのはんだコネクタ ピン。
- ブタンライターを使用して、各Pt:Irワイヤーリード線の端にある〜3mmから断熱材を取り外します。各リードの断熱されていない端まで、金のピンのカップ側を( 材料表を参照)はんだ。
- 組み立てられたデバイスのインピーダンスをテストします。
- 金ピンをLCRメーターまたは電極インピーダンスチェックモジュールの入力に接続し、テスト周波数を1kHzに設定します。カフチューブ(およびPt:Ir刺激は、サリンで満たされた小さなビーカーに内部に接触します)を浸し、金のリードピンとプローブコネクタを乾燥させておきます。組み立てられた袖口が2 kΩ未満の1kHzでインピーダンスを持っていることを確認してから、移植を進めてください。
注:高インピーダンスは、多くの場合、絶縁の不十分な除去、カフ内部の接着剤の偶発的な適用、壊れたワイヤストランドなどの要因のために発生する可能性のある不適切なPt:Ir表面積が露出したことを示します。カフスはまた、長期的な使用との接触を短くする可能性があり、壊れたり、不十分に配置されたワイヤーストランドを検査する必要があります。
- 金ピンをLCRメーターまたは電極インピーダンスチェックモジュールの入力に接続し、テスト周波数を1kHzに設定します。カフチューブ(およびPt:Ir刺激は、サリンで満たされた小さなビーカーに内部に接触します)を浸し、金のリードピンとプローブコネクタを乾燥させておきます。組み立てられた袖口が2 kΩ未満の1kHzでインピーダンスを持っていることを確認してから、移植を進めてください。
2. ヘッドキャップ構造
注: ヘッドキャップアセンブリ手順は、以前に公開されたものと同様です (Childsら17)、便宜上ここに要約されています。
-
ヘッドキャップ17を組み立てる
- 30 AWGワイヤーラップの小片を2つ、長さ1〜13mm、長さ1〜10mmをカットします。両方のワイヤの両端から断熱材の〜1.5ミリメートルを取り除きます。金のピン側を各ワイヤーの一端にできるだけカップに近づけます。ワイヤーカッターを使用して、はんだジョイントを超えるピンの余分な長さを切り取ります。
- AWG ワイヤの他の端を 4 ピン マイクロストリップ コネクタの 2 つの中央のはんだカップにはんだ付けします。
- ワイヤヘッドキャップをコネクタに向かって上に曲げ、図 2A に示すように、コネクタに対して金ピンを平らに配置します( 図 2Aを参照)。短いワイヤに接続されたピンは、長いワイヤに接続されているピンの下に配置する必要があります。ヘッドキャップリードを固定するために、ネイルアクリル、歯科用セメント、UV硬化剤を使用してください。
3. デバイスの使用
- 慢性迷走神経刺激のためのカフ電極を埋め込む。
注:すべての外科的処置は、適切な麻酔下で無菌または無菌技術を使用して、実験動物のケアと使用のためのNIHガイドラインに従い、地元のIACUCの承認を得て行われるべきである。次の手順は、デバイスの代表的な使用方法を示すものであり、包括的なものではありません。- ラットを立体性フレームに入れ、頭頂部および後頭部骨の上に矢状切開を行い、ヘッドキャップ/コネクタの移植のための頭蓋骨表面を明らかにします。慎重に頭蓋骨に4穴を開け、宝石商のネジを配置します。頭蓋骨とネジにヘッドキャップを固定するために歯科アクリルを使用してください。
- 立体フレームからラットを取り出し、右側に置きます。首の左側の皮膚に垂直切開を行い、胸骨腫とステルノイドの筋肉の間とオモヨイド筋肉の下に位置する頸動脈から左迷走神経を慎重に解剖する。
- カフを頭蓋骨に向かって皮下に通う。ゴールドピンを使用してリードをヘッドキャップに接続します。
- カフの内側に迷走神経を置き、カフ縫合糸に二重結び目を結んでデバイスを固定します。鈍い、非導電性フックで神経を操作するか、または神経を取り囲む結合組織をつかむことで、移植中に神経を損傷しないように注意してください。
- 装置に刺激を加えることによってインプラントをテストする(0.8 mA、30 Hz、100 μsの二機的脈拍の10 s列車)。適切な移植は呼吸の停止と5%以上のSpO2 の低下をもたらす。
- 金ピンと露出したリードを歯科アクリルで覆い、縫合糸で傷を閉じ、生理食酒、アルコール、ポビドンヨウ素溶液で切開部位をきれいにします。
- NIHガイドラインとIACUCの承認に沿って、交換液、鎮痛薬、術後ケアを提供します。
- 目を覚ます行動の間に迷走神経を刺激する。
注:動物としてのVNSの送達は、以前にタスク関連の筋肉のモーターマップ表現を拡大するために示されています。この検証済みのパラダイムを使用してデバイスの使用の代表的な例を提供しますが、他の多くの行動パラダイムや刺激パラメータは代替アプリケーションに関連している可能性があります。ラットは、デバイスの移植前にここで使用されるレバープレスタスクの習熟度を訓練しました。手術後、VNS送達前に再び良好な性能が検証された:ラットは1日2回の30分トレーニングセッションで少なくとも100回の成功試験を行った。VNSは、5日間にわたる10回のトレーニングセッションで正しいレバープレスとペアになった。- 埋め込まれたヘッドキャップを介してラットを刺激発生器に接続し、適切な刺激設定に調整します。VNSによる運動皮質マップの再編成では、各正しいレバープレスを15個の二機体パルスの1本の列車とペアにし、それぞれ幅100μs、振幅800μAを30Hzの周波数で送ります。
- 刺激列車は10 30分のトレーニングセッションを通して成功したレバープレスの検出後すぐに配達される。VNS-配信中に、オシロスコープを使用して、電流刺激の正常な送達を監視します。
- 慢性的に埋め込まれたカフ機能を検証します。
- 最後のVNSペアトレーニングセッションの24時間以内に、頭蓋内微小刺激(ICMS)を使用して、運動皮質19、20、21、2220,21,の機能的な体性図を定量化する。1922
- 運動皮質のICMSマッピングのための麻酔の誘導後、30Hz、0.8 mA電流刺激(100 μsの二相パルス)の10 s列車を適用してカフ機能を再び検証し、呼吸停止とSpO2 レベルの低下を少なくとも5%の低下させ、ヘリング・ブロイアー反射と一致させる。
注意:用途によっては、5%未満の信頼性の高いSpO2 低下が観察された場合、またはより高い電流振幅(最大1.6mA)が確実にSpO2で少なくとも5%の減少を生じる場合、カフ機能は許容可能と考えられる。呼吸の停止および/またはSpO2 の信頼できる減少を観察する失敗は、インプラントの失敗を示す。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
迷走神経カフ電極およびヘッドキャップは、以前に公表された外科手術17、19、20、21、22に従ってラットに慢性的に移植された。17,19,20,21,22移植の前に、1 kHzでのインピーダンスは、カフリードを横切って測定され、カフ管は生理食い物に沈んだ(インピーダンス= 1.2 ± 0.17 kΩ[平均±std];N = 9)。生理食前のインピーダンスが2kΩ未満のカフスのみが埋め込まれました。すべての袖口はこの基準を満たしました(0/9カフは除きます)。移植手術中に、すべてのカフスの機能的検証は、刺激による呼吸の短い停止とその後のヘリングブロイアー反射に起因する血中酸素飽和度の低下のテストによって行われた。この応答を呼び起こすために、10 sの30 Hz、0.8 mA電流刺激(100 μsの二分の二着パルス)がカフリードを横切って送達されました。9/9移植されたカフスについて、少なくとも5%のSpO 2の低下(SpO2の%変化=-10.3±3.2%、2平均±std;範囲=-5.7〜-14.5%)、機能および適切な移植を行った10秒間の呼吸停止を観察した。最初の移植の間に、最初のSpO2測定値とVNSによって誘発されるSpO2のパーセント変化との間に有意な相関関係が見つかりました(図2B;R2=0.60、p=0.0083、ピアソンの線形相関)は、麻酔深さがヘリングブロイアー反射223、24,24の大きさに影響を与えるであることを示す出版文献と一致する。慢性的に埋め込まれたカフスの長期機能を試験するために、ラットは装置の移植後6週間後に再び麻酔をかけ、VNSを適用してヘリングブロイアー反射応答を呼び起こした。9台中7台のデバイスでは、0.8mA、30Hz刺激の10s列車を使用してSpO2が5%以上低下しました(図2C)。これらの装置では、SpO2の刺激誘発変化の大きさは2、最初の移植時に観察されたものと変わらず、慢性的に移植された装置の優れた継続的な性能を示唆した(SpO2の初期%変化=-9.7±3.4%、SpO2=-15.8 6.5%の最終的な%変化、平均±std;p = 0.08、対t-test)。2残りの2つの装置では、刺激振幅を1.6mAに増加させることで、少なくとも5%のSpO2の確実な減少を呼び起こすのに十分であり、これらのデバイスは機能し続けているが、時間の経過とともにインピーダンス、神経損傷、または袖口の向きの変化がパフォーマンスの低下をもたらした可能性があることを示唆した。
我々の慢性的に埋め込まれた刺激電極の長期機能をさらに試験するために、第2群のラットは、前肢運動性能25を定量的に評価するためにHaysらによって開発された熟練した到達レバープレスタスクの簡易版で訓練された。複数の研究は、このタスクに正しいモータ性能とVNSをペアリングすると、原発性運動皮質19、20、21、22,21,における近位前肢表現の拡大をもたらすことを実証している。19,22このタスクの簡略化版では、ラットはトレーニングブースの外で2cmに達してレバーを完全に押し下げ、食べ物の報酬を受け取るために2s以内にリリースする必要がありました(図2D)。動物は、タスクに対する安定した習熟度を達成するまで、1日に2回30分のトレーニングセッションを受けました(>65%正しい、>100回のトライアル/セッション、少なくとも8/10連続セッション)。ラットはその後、左迷走神経の周りに刺激カフ電極を移植する手術を受けた。手術から回復し、刺激ケーブルに順応し、熟練した行動性能に戻った後、ラットはVNS(0.5 sトレイン0.8mA、30Hzパルス、100μsの二ファシパルス幅)、またはシャム刺激(刺激なし)が正しいレバーリリース時に提供された追加の10のトレーニングセッションを受けました。最後のVNSペアトレーニングセッションの24時間以内に、ラットをケタミン/キシラジン(80/10 mg/kg、i.p.)で麻酔し、カフ電極機能を試験し、公開された手順22に従って皮質運動マッピングを行った。VNSがタスク関連の運動地図表現の拡大を促進することを実証する以前の研究と一致して、VNS処置ラット(N = 3)は、我々の研究でシャム処理ラット(N = 4)よりも有意に大きな前肢(PFL)表現を示した(図2D;総地図面積のPFL %、平均+SEM:シャム=15.6 ±6.7%、VNS = 38.3±1.0%;p = 0.035、2サンプルt検定、テストパワー = 0.8)。すべてのVNS処理動物において、カフ機能は、VNS(0.8 mA、30パルスHzの100秒の列車、100μsの二分脈拍幅)に応答してSpO2の5%以上の変化が起こったことを確認することによって、移植後5〜10週後のマッピング時の麻酔の誘導後にカフ機能を検証した。
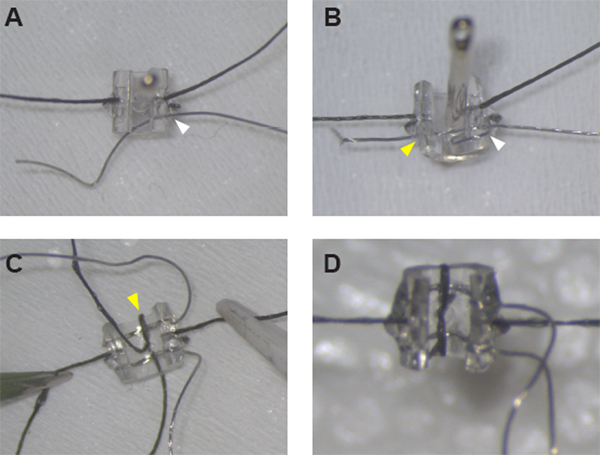
図1:刺激カフ電極の組み立て。(A)Aカフの両側の縫合線を固定した後、Pt:Irワイヤーは縫製針を使用して穴#1(白い矢印)でカフ壁を通すことができます。(B)Pt:Ir ワイヤーは、カフエッジの周りにワイヤーループを作成し、穴#1(白い矢印ヘッド)を通って、カフを通して穴#2(黄色の矢印頭)を通して再びワイヤーを通した後、適切に通し、絶縁解除の準備ができています。(C)両方のリードが所定の位置に入ったら、正中穴とカフエッジ(黄色の矢印)の周りに縫合を通して最初のリードを固定します。(D) 2 番目のリードの周りのループを半ノットで閉じ、所定の位置に接着剤を入れ、カフアセンブリを完成させます。この図の大きなバージョンを表示するには、ここをクリックしてください。

図2:目覚めのラットにおける慢性迷走神経刺激のための装置の使用法。 (A) ヘッドキャップアセンブリ。(B)デバイスの移植中に、SpO2のVNS誘発減少は2、初期SpO2測定値(R2 = 0.602、p = 0.008、ピアソンの線形相関)と相関していた。(C)6週間後の刺激実験終了時にデバイスの移植時に得られたVNS誘発SpO2滴の比較。線は、個々のラットの測定のペアを示します。パネルBとCの刺激は、レバープレス作業を行う慢性的に埋め込まれたVNSカフ電極を備えた0.8 mAおよび30Hz(D)ラットで、100μsの二ファシパルスの10秒の列車で構成されていました。(E) VNS(0.8 mA、30 Hz、100 μsの二方体パルス)と正しいレバープレス性能を組み合わせることで、運動皮質におけるタスク関連の筋肉の地図表現が拡大した。VNSを正しいレバープレス性能(N=3)と組み合わせたラットは、シャム刺激を受けたラット(N=4)と比較して、近位前肢(PFL)表現に専念する運動地図面積の割合が有意に大きい。ドットは、個々の被験者のPFL表現を示しています。誤差範囲は、SEM. VNS治療に続いて、続いて運動皮質マッピングが移植後5~10週行われたであることを示す。この図の大きなバージョンを表示するには、ここをクリックしてください。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
ここでは、げっ歯類で使用するための慢性的に埋め込まれた刺激カフ電極の組み立てのための簡単で低コストのアプローチを説明し、この新しい治療法の前臨床調査を促進する。この簡略化された方法は、特別な訓練や機器を必要としない、そしてほとんどの研究室で簡単にアクセスできるツールや物資の少数を使用し、他のアプローチ16、26、27、28,27と比較して、デバイス製造の金銭的および人件費の両方を削減する。16,,28縫合糸とPt:Irリードの適切な機械的安定性を確保しながら、UV硬化剤の過剰な適用を避けるために、組み立て全体にケアが必要です。過度の接着剤は、デバイスの移植を複雑にし、手術後の周囲の組織を刺激する可能性がありますが、不十分な接着剤は、時間の経過とともにリードが神経との良好な接触を維持しない可能性を高め、デバイスの性能または障害を低下させます。カフルーメン内の絶縁解除Pt:Irワイヤの一貫した配置は、低インピーダンスと優れたデバイス性能を達成するためにも重要です。露出したワイヤーの最大可能な表面が袖口の内側に座り、露出したワイヤーが外部に存在しないように、断熱されていないワイヤーを適切に整列させるために注意する必要があります。
我々のアプローチは,、ラット,,,,,,,,,,4、5、6、7、8、9、10、11、12、13、14、15、19、20、21、225,6で慢性VNSデリバリーのためにいくつかのラボで現在使用されているものと同様のサイズと信頼性のカフを生成することを検証しました。21,224,7891011121314151920最近の研究では、末梢神経線維が同様に多種多様な電極接触サイズと向きを使用して募集されていることが示されています16,29,このプロトコルは、末梢神経刺激を必要とする多くの実験に適応することができ、手でカフスの組み立てから生じる鉛間隔や表面積の小さな変動は、ほとんどの実験結果に重大な影響を与えないことを示唆しています。各刺激セッションでは、オシロスコープを使用してカフリード全体の電圧を監視し、リードがショートまたは破損していないことを確認しましたが、移植後5〜10週間の間、特定の埋め込みデバイスのインピーダンスの変化を追跡しませんでした。同様の移植された装置の1つの研究は、外科的移植後の最初の4週間の間にインピーダンスが有意に増加することを報告した、 おそらく急性傷害が30を安定させる。しかし、この研究では、デバイスインピーダンスの変化は、慢性移植の8週間にわたるデバイスの性能と相関していなかった:著者らは、移植後数週間にわたるVNS強度と化合物作用電位振幅との関係に有意な変化はないと報告した。ここでは、5~10週間の移植後も機能的にカフ性能を検証することができ、VNSはヘリング・ブロイアー反射と一致するSpO2の呼吸停止と降下を引き起こし、(ii)VNS誘導運動地図再編成を実証する前の作業を複製することができました。私たち自身の研究では、ヘリングブロイアー反射の誘導は、カフアセンブリとは無関係の多くの要因のためにデバイスのパフォーマンスや障害が低下する可能性がある埋め込まれたVNSカフの長期的な機能性を検証するための最も信頼性の高い方法であることがわかりました。これらには、外科的合併症、神経損傷、および/またはカフまたはヘッドキャップへの機械的損傷が含まれる。優れた外科技術および装置機能の適用特有の検証は慢性的に埋め込まれた刺激の袖口の電極の安定した、成功した使用のために重要である。
我々は、小型動物における慢性移植のための末梢神経カフ電極の組み立てのための簡単で安価なアプローチを説明し、ラット行動実験中のVNS送達に有用性を実証した。VNSは、関節リ,ウマチ,1、2、2クローン病などの炎症性疾患、31だけでなく、脳卒中155、6、7、8およびPTSD6,710、11などの神経疾患を含む幅広い臨床適応症についてますます調査中である。,8 11この刺激カフ電極を作るためのこのアクセス可能な方法は、VNSのメカニズムと有効性に関する様々な翻訳研究における前臨床げっ歯類モデルの使用を容易にするべきである。プロトコルは容易に適応可能であり、アプローチの多様性をさらに高める。例えば、ポリウレタンチューブの直径および/または長さは、他の種または他の末梢神経部位(例えば、坐骨神経、フレニック、または仙骨神経)における慢性刺激実験に対応するように変更することができる。あるいは、追加のリードを備えた構成は、神経に沿った複数の部位で刺激を可能にしたり、刺激誘発化合物作用電位の同時記録に対応したりすることができる。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
著者らは開示するものは何もない。
Acknowledgments
この作品は、テキサス大学ダラス校とUTリージェンツ理事会によって資金提供されました。ソロモン・ゴールディング、ビラル・ハッサン、マルギ・ジャニ、チン・ツ・ツェンの技術支援に感謝します。
Materials
| Name | Company | Catalog Number | Comments |
| Biocompatible polyurethane-based polymer tubing, 0.080" OD x 0.040" ID | Braintree Scientific | MRE080 36 FT | |
| Dissecting microscope | AM Scopes | #SM-6T-FRL | |
| Fine Serrated Scissors, straight, 22mm cutting edge | Fine Science Tools | #14058-09 | for cutting Pt/Ir wire and suture thread |
| Forceps, #5 Dumont forceps, straight, 11 cm, 0.1 x 0.06 mm tip | Fine Science Tools | #11626-11 | |
| Forceps, ceramic tipped forceps, 0.3 mm x 30 mm tips | Electron Microscopy Sciences | #78127-71 | |
| Gold Pins, PCB Press Fit Socket | Mill-Max | #1001-0-15-15-30-27-04-0 | or similar small pins for connecting cuff leads to headcap |
| Isobutane lighter | BIC | #LCP21-AST | for de-insulating Pt/Ir wire |
| Micro strip connector with latch, 4-pin | Omnetics | A24002-004 / PS1-04-SS-LT | |
| Pipette tip, 10 uL | VWR | 89079-464 | |
| Platinum-Iridium (90/10%) Wire, 0.001" (diameter) x 9 strands, PTFE insulated | Sigmund Cohn | 10IR9/49T | |
| Razor Blade, Single Edge, Surgical Carbon Steel No.9 | VWR | #55411-050 | for cutting MicroRenathane tubing |
| Sewing needle, ca. 4.0 cm length x 0.7 mm diameter (size 6-7) | Singer | 00276 | Smaller needle for threading Pt/Ir wire |
| Sewing needle, ca. 4.5 cm length x 0.8 mm diameter (size 2-3) | Singer | 00276 | Larger needle for pinning cuff during assembly and for threading suture |
| Small foam board | Juvo+/Amazon | B07C9637SJ | for fabrication platform; our dimensions are ca. 2.5" x 3.5" x 1" (L x W x H) |
| Solder, multicore lead-free, 0.38mm diameter | Loctite/Multicore | #796037 | |
| Soldering station | Weller | WES51 | or similar soldering iron compatible with long conical tips (this part has been discontinued) |
| Soldering tip, long conical, 0.01" / 0.4 mm | Weller | 1UNF8 | |
| Suture, nonabsorbable braided silk ,size 6/0 | Fine Science tools | #18020-60 | |
| UV (405 nm) spot light | Henkel/Loctite | #2182207 | |
| UV Light Cure Adhesive 25 ml | Henkel/Loctite | AA 3106 | or similar biocompatible UV cure adhesive |
| Wire wrapping wire, 30 AWG | Digikey | K396-ND |
References
- Koopman, F. A., et al. Vagus nerve stimulation inhibits cytokine production and attenuates disease severity in rheumatoid arthritis. Proceedings of the National Academy of Sciences of the United States of America. , (2016).
- Levine, Y. A., et al. Neurostimulation of the cholinergic anti-inflammatory pathway ameliorates disease in rat collagen-induced arthritis. PLoS One. , (2014).
- Zhang, Y., et al. Chronic vagus nerve stimulation improves autonomic control and attenuates systemic inflammation and heart failure progression in a canine high-rate pacing model. Circulation: Heart Failure. , (2009).
- Ganzer, P. D., et al. Closed-loop neuromodulation restores network connectivity and motor control after spinal cord injury. Elife. , (2018).
- Hays, S. A., et al. Vagus nerve stimulation during rehabilitative training enhances recovery of forelimb function after ischemic stroke in aged rats. Neurobiology of Aging. , (2016).
- Khodaparast, N., et al. Vagus nerve stimulation delivered during motor rehabilitation improves recovery in a rat model of stroke. Neurorehabilitation and Neural Repair. , (2014).
- Meyers, E. C., et al. Vagus nerve stimulation enhances stable plasticity and generalization of stroke recovery. Stroke. , (2018).
- Hays, S. A., et al. Vagus nerve stimulation during rehabilitative training improves functional recovery after intracerebral hemorrhage. Stroke. , (2014).
- Farrand, A., et al. Vagus nerve stimulation improves locomotion and neuronal populations in a model of Parkinson's disease. Brain Stimulationation. , (2017).
- Souza, R. R., et al. Vagus nerve stimulation reverses the extinction impairments in a model of PTSD with prolonged and repeated trauma. Stress. , (2019).
- Noble, L. J., Souza, R. R., McIntyre, C. K. Vagus nerve stimulation as a tool for enhancing extinction in exposure-based therapies. Psychopharmacology. , (2019).
- Childs, J. E., Kim, S., Driskill, C. M., Hsiu, E., Kroener, S. Vagus nerve stimulation during extinction learning reduces conditioned place preference and context-induced reinstatement of cocaine seeking. Brain Stimulationation. , (2019).
- Peña, D. F., Engineer, N. D., McIntyre, C. K. Rapid remission of conditioned fear expression with extinction training paired with vagus nerve stimulation. Biological Psychiatry. , (2013).
- Childs, J. E., DeLeon, J., Nickel, E., Kroener, S. Vagus nerve stimulation reduces cocaine seeking and alters plasticity in the extinction network. Learning & Memory. , (2017).
- Engineer, C. T., et al. Temporal plasticity in auditory cortex improves neural discrimination of speech sounds. Brain Stimulationation. , (2017).
- Rios, M., et al. Protocol for Construction of Rat Nerve Stimulation Cuff Electrodes. Methods Protoc. , (2019).
- Childs, J. E., et al. Vagus nerve stimulation as a tool to induce plasticity in pathways relevant for extinction learning. Journal of Visualized Experiments. , (2015).
- Paintal, A. S. Vagal sensory receptors and their reflex effects. Physiological reviews. , (1973).
- Porter, B. A., et al. Repeatedly Pairing Vagus Nerve Stimulation with a Movement Reorganizes Primary Motor Cortex. Cerebral Cortex. 22, 2365-2374 (2011).
- Morrison, R. A., et al. Vagus nerve stimulation intensity influences motor cortex plasticity. Brain Stimulationation. , (2018).
- Hulsey, D. R., et al. Norepinephrine and serotonin are required for vagus nerve stimulation directed cortical plasticity. Exp. Neurol. , (2019).
- Hulsey, D. R., et al. Reorganization of Motor Cortex by Vagus Nerve Stimulation Requires Cholinergic Innervation. Brain Stimulation. 9, 174-181 (2016).
- Bouverot, P., Crance, J. P., Dejours, P. Factors influencing the intensity of the breuer-hering inspiration-inhibiting reflex. Respiration Physiology. , (1970).
- Fialova, E., Vizek, M., Palecek, F. Inflation reflex in the rat. Physiologia Bohemoslov. , (1975).
- Hays, S. A., et al. The bradykinesia assessment task: An automated method to measure forelimb speed in rodents. Journal of Neuroscience Methods. , (2013).
- Kim, H., et al. Cuff and sieve electrode (CASE): The combination of neural electrodes for bi-directional peripheral nerve interfacing. Journal of Neuroscience Methods. , (2020).
- González-González, M. A., et al. Thin Film Multi-Electrode Softening Cuffs for Selective Neuromodulation. Scientific Reports. , (2018).
- Thakur, R., Nair, A. R., Jin, A., Fridman, G. Y. Fabrication of a Self-Curling Cuff with a Soft, Ionically Conducting Neural Interface. Proceedings of the Annual International Conference of the IEEE Engineering in Medicine and Biology Society, EMBS. , (2019).
- Bucksot, J., et al. Flat electrode contacts for vagus nerve stimulation. PLoS One. 14, (2019).
- El Tahry, R., et al. Repeated assessment of larynx compound muscle action potentials using a self-sizing cuff electrode around the vagus nerve in experimental rats. Journal of Neuroscience Methods. , (2011).
- Bonaz, B., Sinniger, V., Pellissier, S. Anti-inflammatory properties of the vagus nerve: potential therapeutic implications of vagus nerve stimulation. Journal of Physiology. , (2016).



