Summary
Les approches existantes pour la construction d’électrodes de manchette périphériques implantables chroniques pour une utilisation chez les petits rongeurs nécessitent souvent un équipement spécialisé et/ou un personnel hautement qualifié. Dans ce protocole, nous démontrons une approche simple et peu coûteuse pour fabriquer des électrodes de manchette chroniquement implantables, et démontrons leur efficacité pour la stimulation de nerf vague (VNS) chez les rats.
Abstract
Les électrodes périphériques de manchette de nerf ont longtemps été employées dans les neurosciences et les champs connexes pour la stimulation, par exemple, des nerfs vagues ou sciatiques. Plusieurs études récentes ont démontré l’efficacité de VNS chronique dans l’amélioration de la plasticité du système nerveux central pour améliorer la réadaptation motrice, l’apprentissage de l’extinction, et la discrimination sensorielle. La construction de dispositifs implantables chroniques pour une utilisation dans de telles études est difficile en raison de la petite taille des rats, et les protocoles typiques nécessitent une formation approfondie du personnel et des méthodes de microfabrication chronophages. Alternativement, les électrodes implantables de manchette disponibles dans le commerce peuvent être achetées à un coût sensiblement plus élevé. Dans ce protocole, nous présentons une méthode simple et peu coûteuse pour la construction de petites électrodes de manchette périphériques chroniquement implantables pour une utilisation chez les rats. Nous validons la fiabilité à court et à long terme de nos électrodes de manchette en démontrant que VNS dans la kétamine/xylazine anesthésié rats produit des diminutions du taux de respiration compatible avec l’activation du réflexe Hering-Breuer, à la fois au moment de l’implantation et jusqu’à 10 semaines après l’implantation de l’appareil. Nous démontrons en outre la pertinence des électrodes de manchette pour une utilisation dans les études de stimulation chronique en associant VNS avec la performance habile de presse de levier pour induire la plasticité corticale de carte de moteur.
Introduction
Récemment, la demande d’électrodes de manchettes chroniquement implantables pour la stimulation des nerfs périphériques a augmenté, car les études démontrent de plus en plus l’utilité préclinique de cette technique pour le traitement de nombreuses maladies inflammatoires1,2,3 et troubles neurologiques4,5,6,7,8,9,10,11,12,13,14,15. Chronique VNS, par exemple, a été montré pour améliorer la plasticité néocorticale dans une variété de contextes d’apprentissage, l’amélioration de la réadaptation motrice4,5,6 ,76,,8, l’apprentissage de l’extinction10,11,12,13,14, et la discrimination sensorielle15. Les électrodes périphériques de manchette périphériques disponibles dans le commerce sont souvent associées à des délais prolongés pour l’exécution des commandes et à des coûts relativement élevés, ce qui peut limiter leur accessibilité. Alternativement, les protocoles pour la fabrication « en interne » des électrodes de manchette chroniquement implantables restent limités, et l’anatomie de rongeur présente des défis particuliers en raison de leur petite taille. Les protocoles actuels pour la construction d’électrodes de manchette pour des expériences chroniques de rongeurs exigent souvent l’utilisation d’équipements et de techniques complexes, ainsi que du personnel hautement qualifié. Dans ce protocole, nous démontrons une approche simplifiée de la fabrication d’électrodes de manchette basée sur des méthodes précédemment publiées et largement utilisées16,17. Nous validons la fonctionnalité de nos électrodes chroniquement implantées chez les rats en démontrant qu’au moment de l’implantation de manchette autour du nerf vague cervical gauche, la stimulation appliquée aux électrodes de manchette a réussi à produire un arrêt de la respiration et de la baisse dans SpO2. La stimulation des fibres vagales de récepteur pulmonaire afférent est connue pour engager le réflexe d’Hering-Breuer, dans lequel l’inhibition de plusieurs noyaux respiratoires dans le tronc cérébral a comme conséquence l’inspiration de suppression18. Ainsi, l’arrêt de la respiration compatible avec le réflexe Hering-Breuer, et la baisse résultante dans SpO2, fournissent un test simple pour l’implantation d’électrode appropriée et la fonction de manchette dans les rats anesthésiés. Pour valider la fonctionnalité à long terme des électrodes de manchette chroniquement implantées, les réponses réflexes ont été mesurées au moment de l’implantation et comparées aux réponses obtenues chez les mêmes animaux six semaines après l’implantation. Un deuxième groupe de rats a été implanté avec des électrodes de manchette de VNS après l’entraînement comportemental sur une tâche pressante de levier. Chez ces rats, VNS jumelé à des performances de tâche correctes a produit la réorganisation de la carte motrice corticale, compatible avec les études précédemment publiées19,20,21,22. Au moment de la cartographie corticale motrice sous anesthésie, qui s’est produite 5 à 10 semaines après l’implantation de l’appareil, nous avons encore validé la fonction de manchette chez les animaux traités par VNS en confirmant que VNS a réussi à provoquer un arrêt de la respiration et une baisse de plus de 5% dans Spo2.
Les protocoles récemment publiés de Childs et al.17 et Rios et coll.16 fournissent un point de départ bien validé pour une approche simplifiée de fabrication d’électrodes de manchette, car cette méthode populaire a été utilisée par plusieurs laboratoires menant des études VNS chroniques chez les rongeurs1,2,3,4,5,6,7,8,9,10,11. La méthode originale implique plusieurs étapes de haute précision pour manipuler les microfils fins de telle sorte que la fabrication d’électrodes de manchette prend plus d’une heure à compléter, et une formation approfondie pour effectuer de manière fiable. L’approche simplifiée décrite ici nécessite beaucoup moins de matériaux et d’outils et peut être complétée en moins d’une heure par du personnel peu formé.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Toutes les procédures décrites dans ce protocole sont effectuées conformément au Guide des NIH pour le soin et l’utilisation des animaux de laboratoire et ont été approuvées par le Comité institutionnel de soins et d’utilisation des animaux de l’Université du Texas à Dallas.
1. Stimuler la fabrication d’électrodes de manchette
- Préparer le tube de manchette.
- À l’aide d’une lame de rasoir, couper un morceau de tube en polymère de 2,5 mm de longueur. Insérez des pointes de forceps ou un trombone à travers le tube et utilisez la lame pour faire une fente dans le sens de la longueur à travers le mur de la tuyauterie d’un côté le brassard.
- Retirer les forceps du tube et insérer une grande aiguille à coudre à travers la ligne médiane du brassard, perpendiculairement à l’axe long. Insérez l’aiguille à travers la fente (en haut) et dans le centre du tube en face (en bas). Placez l’aiguille dans la planche de mousse pour épingler le brassard en place pendant les étapes d’assemblage restantes.
- Placer la suture pour fixer la fermeture des poignets pendant l’implantation.
- Insérez la petite aiguille à coudre à travers le mur du brassard, sur la ligne médiane, à environ 0,5 mm de la fente supérieure d’un côté. Insérez l’aiguille de l’intérieur à l’extérieur pour éviter d’endommager le tube de manchette. Insérez une longueur de 2 cm de suture de 6/0 à travers l’œil de l’aiguille et tirez l’aiguille à travers le mur de la baignoire pour enfiler la suture dans le brassard.
- En laissant le fil en place, retirez l’aiguille et perforez un deuxième trou à travers le mur de tubes à environ 0,5 mm sous le premier trou, le long de la ligne médiane du brassard. Insérez la suture à travers l’œil de l’aiguille et tirez l’aiguille à travers le mur de tubes pour enfiler à nouveau la suture à travers le brassard.
- Les deux extrémités du fil de suture doivent maintenant être sur le côté extérieur de la manchette. Réglez la suture de sorte que ~1,5 cm s’étend du trou supérieur, et ~0,5 mm s’étend du trou inférieur.
- Appliquer une petite quantité d’adhésif UV cure à l’extrémité courte de la suture s’étendant du trou inférieur et tirer l’extrémité plus longue suture jusqu’à ce que la queue inférieure est presque flush avec le mur extérieur de la tuyauterie. Utilisez la baguette UV pour guérir l’adhésif et maintenir la suture fermement en place.
- Répétez les étapes 1.2.1 à 1.2.3 du côté opposé de la manchette.
- Placez les fils de fil Platinum:Iridium (Pt:Ir).
- Utilisez la petite aiguille à coudre pour faire 4 trous dans le mur de manchette. Chaque paire de trous doit être placée à environ 0,5 à 0,8 mm de la ligne médiane perpendiculaire, avec un trou d’environ 0,5 à 0,8 mm de la fente supérieure de chaque côté du brassard.
ATTENTION : Pour le placement le plus cohérent et le plus précis des fils, insérez l’aiguille de l’intérieur à l’extérieur pour faire tous les trous, en utilisant le placement de suture comme guide. - Insérez à nouveau l’aiguille à coudre, cette fois en travaillant de l’extérieur à l’intérieur, à travers le trou de plomb 1. Insérez environ 0,5 cm d’une longueur de 7,5 cm de Pt:Ir fil à travers l’œil de l’aiguille et tirez l’aiguille à travers le tube pour enfiler le fil de plomb à travers le mur de manchette. Réglez le fil de sorte que ~4,5 cm s’étend sur le côté extérieur de la manchette (Figure 1A).
- Insérez l’aiguille à travers le trou de plomb 1 à nouveau, de nouveau en travail extérieur à l’intérieur, et en outre insérer l’aiguille à travers le trou de plomb 2 directement en face du trou de plomb 1. Insérez ~0,5 cm de l’extrémité plus courte (intérieure) du fil Pt:Ir à travers l’œil de l’aiguille et tirez l’aiguille à travers le tube pour enfiler le fil de plomb à travers les parois du brassard.
REMARQUE : Les deux extrémités du fil Pt:Ir doivent maintenant être sur le côté extérieur de la manchette, et une boucle de fil est formée autour du bord de la fente et à travers le trou de plomb 1 (Figure 1B). - Répétez les étapes 1.3.1 à 1.3.3 pour placer Pt:Ir fil à travers les trous de plomb 3 et 4.
- À l’aide d’un briquet butane, retirez soigneusement l’isolant d’une longueur de 5 à 6 mm à l’extrémité des fils Pt:Ir qui s’étendent du trou de plomb 2 et du trou de plomb 4.
ATTENTION : Isolez soigneusement les extrémités des fils du reste de l’ensemble de manchettes afin d’éviter d’endommager la manchette. Utilisez des outils pour tenir les fils afin d’éviter les blessures. - Alignez le fil nu à l’intérieur du brassard pour placer les fils dans leurs emplacements finaux. Pour ce faire, tirez doucement sur l’extrémité du fil Pt:Ir s’étendant du trou 1 jusqu’à ce que la partie non isolée du fil est rince avec le trou 1. Répétez avec l’autre fil pour aligner l’extrémité non isolée du fil fileté à travers les trous de plomb 3 et 4.
- Appliquer une petite quantité d’adhésif UV cure sur les boucles de fil sur le côté extérieur de la manchette aux trous de plomb 1 et 3. Utilisez la baguette UV pour guérir l’adhésif et fixer les fils en place.
- Utilisez une petite pointe de pipette pour pousser les fils non isolés Pt:Ir contre le mur intérieur de la manchette. Une fois les fils en place, coupez les extrémités des fils s’étendant des trous de plomb 2 et 4 de sorte qu’environ 1 mm de fil s’étend au-delà de l’extérieur du mur de manchette.
- Pliez les queues de 1 mm du fil à plat contre la surface extérieure du brassard, en prenant soin de ne pas les court-circuiter ensemble. Appliquer une petite quantité d’adhésif UV cure pour couvrir les deux queues et guérir l’adhésif pour fixer le placement de plomb et de fournir une isolation électrique.
ATTENTION : Il est important de couvrir entièrement les surfaces Pt:Ir exposées à l’extérieur avec de l’adhésif pour isoler les fils et éviter la stimulation hors cible.
- Utilisez la petite aiguille à coudre pour faire 4 trous dans le mur de manchette. Chaque paire de trous doit être placée à environ 0,5 à 0,8 mm de la ligne médiane perpendiculaire, avec un trou d’environ 0,5 à 0,8 mm de la fente supérieure de chaque côté du brassard.
- Sécurisez les fils Pt:Ir en place avec la sécurité de suture.
- Retirez la grande aiguille avec l’ensemble de manchette de la planche en mousse. Insérez une longueur de 3 cm de 6/0 suture à travers l’œil de l’aiguille et tirez l’aiguille à travers le tube pour enfiler la suture à travers le bas de la manchette au milieu.
- Passez à la petite aiguille à coudre pour compléter le filetage de suture pour la sécurité de plomb Pt:Ir. Insérez l’aiguille dans le même trou de ligne médiane, en travaillant à nouveau de l’intérieur à l’extérieur pour éviter la déformation du tube et des fils de fil. Insérez la queue extérieure de la suture à travers l’œil de l’aiguille et tirez l’aiguille à travers le mur du brassard pour créer une boucle de suture autour du bord du brassard (figure 1C).
REMARQUE : Utilisez des forceps et travaillez au microscope pour s’assurer que la suture est orientée le long du long axe de la manchette et se trouve à plat contre le tube. Cette étape assure que les fils restent séparés sur le côté intérieur de la manchette et sont maintenus en place latérale à la ligne médiane du brassard. - Créez une deuxième boucle autour de l’extrémité opposée du brassard en attachant les extrémités de la suture en un demi-nœud, sur le côté extérieur de la manchette. Assurez-vous que la suture longe le long axe du brassard et se trouve à plat contre le tube. Tout en maintenant le noeud serré de sorte qu’il se couche à plat contre le tube, appliquer une petite quantité d’adhésif uv cure à la moitié-noeud et guérir pour tenir en place.
- Couper soigneusement les extrémités du fil de suture aussi près que possible du nœud. Si nécessaire, utilisez une petite quantité d’adhésif uv supplémentaire pour coller les extrémités courtes de la suture afin qu’elles soient à plat contre le tube (figure 1D).
- Les broches de connecteur de soudure aux fils de fil de Pt:Ir.
- À l’aide d’un briquet butane, retirez l’isolant d’environ 3 mm à la fin de chacun des fils de fil Pt:Ir. Souder le côté tasse d’une goupille d’or (voir Tableau des matériaux)à l’extrémité non isolée de chaque plomb.
- Testez l’impédance de l’appareil assemblé.
- Connectez les broches d’or aux entrées d’un compteur LCR ou d’un module de vérification de l’impédance électrode et réglez la fréquence d’essai à 1 kHz. Submergez les tubes de manchette (et Pt:Ir stimulation contacts intérieur à la manchette) dans un petit bécher rempli de solution saline, en prenant soin de garder les broches de plomb d’or et les connecteurs de sonde au sec. Vérifiez que le brassard assemblé a une impédance à 1 kHz de moins de 2 kΩ avant de procéder à l’implantation.
REMARQUE : L’impédance élevée indique souvent la surface inadéquate de Pt:Ir exposée, qui peut survenir en raison de facteurs tels que l’enlèvement insuffisant de l’isolation, l’application accidentelle de l’adhésif dans l’intérieur de manchette, les brins de fil cassés, etc. Les poignets doivent également être inspectés pour détecter les brins de fil cassés ou mal placés qui pourraient entraîner des contacts courts avec une utilisation à long terme.
- Connectez les broches d’or aux entrées d’un compteur LCR ou d’un module de vérification de l’impédance électrode et réglez la fréquence d’essai à 1 kHz. Submergez les tubes de manchette (et Pt:Ir stimulation contacts intérieur à la manchette) dans un petit bécher rempli de solution saline, en prenant soin de garder les broches de plomb d’or et les connecteurs de sonde au sec. Vérifiez que le brassard assemblé a une impédance à 1 kHz de moins de 2 kΩ avant de procéder à l’implantation.
2. Construction de bouchons
REMARQUE : Les procédures d’assemblage de headcap sont semblables à celles publiées précédemment (Childs et al.17),et sont résumées ici pour plus de commodité.
-
Assembler le headcap17
- Couper deux petits morceaux de 30 enveloppements de fil AWG, un ~13 mm de longueur et un ~10 mm de longueur. Retirez les ~1,5 mm d’isolant de chaque extrémité des deux fils. Souder le côté pin d’une épingle d’or à une extrémité de chaque fil, aussi près que possible de la tasse. Utilisez des coupe-fils pour couper l’excès de longueur de la goupille au-delà de l’articulation de soudure.
- Souder les autres extrémités des fils AWG aux deux tasses centrales de soudure d’un connecteur microstrip à 4 broches.
- Pliez le casque de fil conduit vers le connecteur et placez les broches d’or à plat contre le connecteur, parallèles les uns aux autres, comme le montre la figure 2A. La goupille reliée au fil plus court doit être placée sous la goupille reliée au fil plus long. Utilisez de l’acrylique à ongles, du ciment dentaire ou de l’adhésif UV pour fixer les fils de la tête en place.
3. Utilisation de l’appareil
- Implanter les électrodes de manchette pour la stimulation chronique du nerf vague.
REMARQUE : Toutes les interventions chirurgicales doivent être effectuées à l’aide d’une technique stérile ou aseptique sous anesthésie appropriée, conformément aux Lignes directrices des NIH pour le soin et l’utilisation des animaux de laboratoire et avec l’approbation locale de l’IACUC. Les procédures suivantes sont destinées à illustrer une utilisation représentative de l’appareil et ne sont pas destinées à être complètes.- Placez le rat dans un cadre stéréotaxique et faites une incision sagittale sur les os pariétals et occipitals pour révéler la surface du crâne pour l’implantation du casque/connecteur. Percer soigneusement 4 trous dans le crâne et placer les vis du bijoutier. Utilisez de l’acrylique dentaire pour fixer la tête au crâne et aux vis.
- Retirez le rat du cadre stéréotaxique et allongez-le sur le côté droit. Faire une incision verticale dans la peau sur le côté gauche du cou, et disséquer soigneusement le nerf vague gauche de l’artère carotide, situé entre les muscles sternomastoïdes et sternohyoïdes et sous le muscle omohyoïde.
- Tunnel le brassard conduit sous-cutanéement vers le crâne. Connectez les conduits au headcap à l’aide des broches d’or.
- Placez le nerf vague à l’intérieur du brassard et fixez l’appareil fermé en attachant un double nœud dans les sutures de manchette. Veillez à éviter d’endommager le nerf pendant l’implantation en manipulant le nerf avec des crochets émoussés et non conducteurs ou en saisissant le tissu conjonctif entourant le nerf.
- Testez l’implant en appliquant une stimulation sur l’appareil (10 s train de 0,8 mA, 30 Hz, 100 μs impulsions biphasiques). Une implantation adéquate entraînera un arrêt de la respiration et une baisse du SpO2 de 5 % ou plus.
- Couvrez les broches d’or et les fils exposés avec de l’acrylique dentaire, fermez les plaies avec des sutures, et nettoyez les sites d’incision avec la solution saline, d’alcool et d’iode povidone.
- Fournir des liquides de remplacement, des analgésiques et des soins postopératoires conformément aux lignes directrices des NIH et à l’approbation de l’IACUC.
- Stimuler le nerf vague pendant le comportement éveillé.
REMARQUE : Il a déjà été démontré que la livraison de VNS au fur et à mesure que les animaux effectuent des tâches motrices spécifiques élargit la représentation de la carte motrice de la musculature pertinente pour les tâches. Nous utilisons ce paradigme validé pour fournir un exemple représentatif de l’utilisation de l’appareil, mais de nombreux autres paradigmes comportementaux et /ou paramètres de stimulation peuvent être pertinents pour d’autres applications. Les rats ont été formés à la compétence sur la tâche de presse de levier utilisée ici avant l’implantation de dispositif. Après la chirurgie, de bonnes performances ont de nouveau été vérifiées avant l’accouchement par VNS : les rats ont effectué au moins 100 essais réussis en deux séances d’entraînement de 30 minutes par jour. VNS a été jumelé avec des presses à levier correctes au cours de 10 séances d’entraînement ultérieures sur 5 jours.- Connectez le rat à un générateur de stimulus par l’intermédiaire d’un bouchon de tête implanté et adaptez-le aux paramètres de stimulation appropriés. Pour la réorganisation induite par VNS de la carte corticale du moteur, jumeler chaque presse à levier correcte avec un seul train de 15 impulsions biphasiques, chacune d’une largeur de 100 μs et une amplitude de 800 μA, livrée à une fréquence de 30 Hz.
- Un train de stimulation est livré immédiatement après la détection de chaque presse à levier réussie tout au long de dix séances d’entraînement de 30 min. Pendant la livraison de VNS, utilisez un oscilloscope pour surveiller la livraison réussie de la stimulation actuelle.
- Valider la fonction de manchette implantée chroniquement.
- Dans les 24 h de la dernière séance d’entraînement jumelée vns, utilisez la microstimulation intracrânienne (ICMS) pour quantifier la carte somatotopique fonctionnelle dans le cortex moteur19,20,21,22.
- Après l’induction de l’anesthésie pour la cartographie ICMS du cortex moteur, valider la fonction de manchette à nouveau en appliquant un train de 10 s de 30 Hz, 0,8 mA stimulation du courant (100 μs impulsions biphasiques), ce qui devrait entraîner un arrêt de la respiration et une réduction des niveaux de SpO2 d’au moins 5%, compatible avec le réflexe Hering-Breuer.
REMARQUE : Selon l’application, la fonction de manchette peut être considérée comme acceptable si une baisse fiable de SpO2 inférieure à 5 % est observée, ou si des amplitudes de courant plus élevées (jusqu’à 1,6 mA) produisent de manière fiable une réduction fiable d’au moins 5 % de SpO2. Le défaut d’observer un arrêt de la respiration et/ou une diminution fiable du SpO2 est révélateur d’une défaillance de l’implant.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Les électrodes et les headcaps de manchette de nerf de Vagus ont été chroniquement implantés chez des rats selon des procédures chirurgicales précédemmentéditées 17,19,20,21,22. Avant l’implantation, l’impédance à 1 kHz a été mesurée à travers les fils de manchette avec le tube de manchette submergé en solution saline (impédance = 1,2 ± 0,17 kΩ [moyenne ± std]; N = 9). Seuls les poignets avec des impédances inférieures à 2 kΩ en solution saline ont été implantés; tous les poignets répondaient à ce critère (0/9 manchettes exclues). Pendant les chirurgies d’implantation, la validation fonctionnelle de tous les poignets a été exécutée par essai pour un arrêt bref de stimulation-induit de la respiration et la baisse suivante de la saturation d’oxygène de sang attribuée au réflexe d’Hering-Breuer. Pour évoquer cette réponse, un train de 10 s de 30 Hz, 0,8 mA de stimulation de courant (100 impulsions biphasiques de 10 μs) a été livré sur les fils de manchette. Pour les poignets implantés 9/9, nous avons observé un arrêt de la respiration induit par VNS pendant la durée de la stimulation de 10 secondes, qui s’est accompagnée d’une baisse de SpO2 d’au moins 5% (% de changement dans SpO2 = -10,3 ± 3,2%, moyenne ± std; gamme = -5,7 à -14,5%), confirmant la fonction de manchette et l’implantation appropriée. Au cours de l’implantation initiale, nous avons trouvé une corrélation significative entre les lectures initiales de SpO2 et le pourcentage de variation dans le SpO2 évoqué par VNS (Figure 2B; R2 = 0,60, p = 0,0083, corrélation linéaire de Pearson), compatible avec la littérature publiée démontrant que la profondeur de l’anesthésie a un impact sur l’ampleur du réflexe Hering-Breuer23,24. Pour tester la fonctionnalité à long terme des poignets chroniquement implantés, les rats ont été anesthésiés à nouveau 6 semaines après l’implantation de dispositif et VNS a été appliqué pour évoquer la réponse réflexe d’Hering-Breuer. Pour 7 appareils sur 9, nous avons observé une baisse de plus de 5 % du SpO2 à l’aide de trains de 10 s de 0,8 mA, de stimulation de 30 Hz (figure 2C). Dans ces dispositifs, l’ampleur du changement de stimulation-évoqué dans le SpO2 n’a pas différé de celle observée lors de l’implantation initiale, suggérant d’excellentes performances continues des dispositifs chroniquement implantés (variation initiale en % dans spo2 = -9,7 ± 3,4%, variation finale en % dans spo2 = -15,8 ± 6,5%, moyenne ± std; p = 0,08, t-test jumelé). Dans les 2 autres dispositifs, l’augmentation de l’amplitude de stimulation à 1,6 mA était suffisante pour évoquer une réduction fiable du SpO2 d’au moins 5%, ce qui suggère que ces dispositifs ont continué à fonctionner, mais que les changements dans l’impédance, les lésions nerveuses, ou l’orientation de la manchette au fil du temps peut avoir entraîné une réduction des performances.
Pour tester davantage la fonctionnalité à long terme de nos électrodes stimulantes chroniquement implantées, un deuxième groupe de rats a été formé sur une version simplifiée d’une tâche habile de levier-presse d’atteinte développée par Hays et al. pour évaluer quantitativement la performance du moteur de membre antérieur25. Plusieurs études ont démontré que l’appariement VNS avec des performances motrices correctes sur cette tâche entraîne l’expansion de la représentation du membre antérieur proximal dans le cortex moteur primaire19,20,21,22. Dans notre version simplifiée de la tâche, les rats devaient atteindre 2 cm à l’extérieur de la cabine d’entraînement pour déprimer complètement un levier, puis le relâcher dans les 2 s afin de recevoir une récompense alimentaire (Figure 2D). Les animaux ont reçu deux séances d’entraînement de 30 minutes par jour jusqu’à ce qu’ils aient atteint une compétence stable sur la tâche (>65% correct, >100 essais/session, pour au moins 8/10 sessions consécutives). Les rats ont ensuite subi une intervention chirurgicale pour implanter une électrode de manchette stimulante autour de leur nerf vague gauche. Après la récupération de la chirurgie, l’acclimatation aux câbles stimulants, et le retour à des performances comportementales compétentes, les rats ont reçu 10 séances d’entraînement supplémentaires dans lesquelles VNS (0,5 s train de 0,8 mA, 30 Hz impulsions; 100 μs largeur d’impulsion biphasique), ou stimulation simulée (pas de stimulation), a été livré au moment de la libération correcte du levier. Dans les 24 h suivant la dernière séance d’entraînement jumelée vns, les rats ont été anesthésiés avec de la kétamine/xylazine (80/10 mg/kg, i.p.), la fonction d’électrode de manchette a été testée, et la cartographie motrice corticale a été exécutée selon les procédures éditées22. Conformément aux études antérieures démontrant que le VNS entraîne l’expansion des représentations de cartes motrices pertinentes à la tâche, les rats traités VNS (N = 3) présentaient des représentations de membres antérieurs proximaux (PFL) significativement plus importantes que les rats traités par imposture (N = 4) dans notre étude (figure 2D; PFL % de la surface totale de la carte, moyenne + SEM: sham = 15,6 ± 6,7%, VNS = 38,3 ± 1,0%; p = 0,035, test t à 2 échantillons, puissance d’essai = 0,8). Chez tous les animaux traités par VNS, la fonction de manchette a été validée après l’induction de l’anesthésie au moment de la cartographie, 5 à 10 semaines après l’implant, en confirmant qu’un changement supérieur à 5 % de SpO2 s’est produit en réponse à la VNS (train de 10 s de 0,8 mA, impulsions de 30 Hz; 100 μs largeur d’impulsion biphasique).
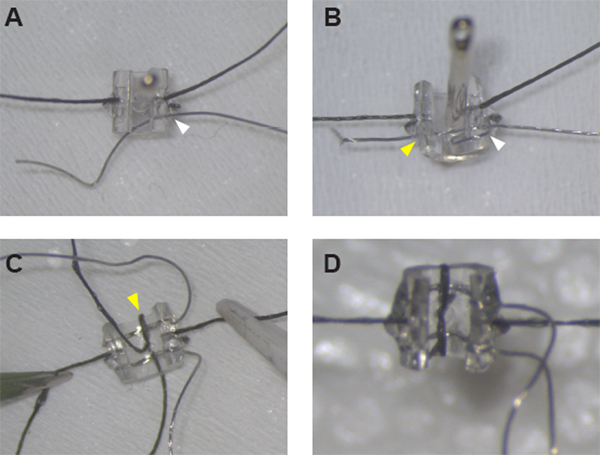
Figure 1 : Assemblage des électrodes de manchette stimulantes. (A) Après avoir sécurisé les sutures de chaque côté du brassard, Pt:Ir fil peut être enfilé à travers le mur de manchette au trou #1 (pointe de flèche blanche) à l’aide d’une aiguille à coudre. (B) Pt: Ir fil est correctement fileté et prêt pour la désisulation après la création d’une boucle de fil autour du bord de la manchette et le filetage du fil à nouveau à travers le trou #1 (pointe de flèche blanche) et à travers le brassard à travers le trou #2 (pointe de flèche jaune). (C) Une fois que les deux pistes sont en place, fixer la première avance en filetant la suture à travers le trou de ligne médiane et autour du bord de manchette (pointe de flèche jaune). (D) Fermez la boucle autour de la deuxième piste avec un demi-nœud et de la colle en place pour compléter l’assemblage de manchette. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 2 : Utilisation d’appareils pour la stimulation chronique du nerf vague chez les rats éveillés. (A) Assemblage de headcap. (B) Pendant l’implantation de l’appareil, les réductions évoquées par VNS dans le SpO2 ont été corrélées avec les lectures initiales du SpO2 (R2 = 0,602, p = 0,008, corrélation linéaire de Pearson). (C) Comparaison des gouttes spo2 évoquées par VNS obtenues à l’implantation de dispositif par rapport à la fin des expériences de stimulation 6 semaines plus tard. Les lignes indiquent des paires de mesures pour les rats individuels. La stimulation dans les panneaux B et C consistait en un seul train de 10 s de 100 impulsions biphasiques de 100 μs livrés à 0,8 mA et 30 Hz. (D) Rat avec des électrodes de manchette VNS implantées de façon chronique effectuant la tâche de presse à levier. (E) VNS (train de 0,5 mA, 30 Hz, 100 μs impulsions biphasiques) jumelé à des performances correctes de presse à levier a élargi la représentation cartographique de la musculature adaptée aux tâches dans le cortex moteur. Les rats qui ont reçu VNS jumelés avec la performance correcte de presse de levier (N = 3) ont montré un pourcentage significativement plus grand de la zone de carte moteur consacrée à la représentation proximale de membre antérieur (PFL) comparée aux rats qui ont reçu la stimulation de Sham (N = 4). Les points montrent des représentations de PFL pour des sujets individuels ; Les barres d’erreur indiquent que le traitement de SEM. VNS suivi de la cartographie corticale de moteur a été exécuté 5 à 10 semaines après l’implantation. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Ici, nous décrivons une approche simple et peu coûteuse pour l’assemblage des électrodes de manchette stimulante chroniquement implantables pour une utilisation chez les rongeurs, facilitant les investigations précliniques de cette thérapie émergente. Cette méthode simplifiée ne nécessite aucune formation ou équipement spécialisé, et utilise un petit nombre d’outils et de fournitures qui sont facilement accessibles à la plupart des laboratoires de recherche, réduisant à la fois les coûts monétaires et de main-d’œuvre de la fabrication d’appareils par rapport à d’autres approches16,26,27,28. Des soins sont nécessaires tout au long de l’assemblage pour éviter l’application excessive de l’adhésif de traitement UV tout en assurant la stabilité mécanique adéquate des sutures et des fils de Pt:Ir pour la fonction de manchette à long terme. L’adhésif excessif complique l’implantation de dispositif et peut irriter le tissu environnant après la chirurgie, tandis que l’adhésif insuffisant augmente la probabilité qu’avec le temps les fils puissent ne pas maintenir un bon contact avec le nerf, ayant pour résultat la performance ou l’échec de dispositif diminué. Le placement constant des fils Pt:Ir désis isolés à l’intérieur du lumen de manchette est également essentiel pour atteindre de faibles impédances et de bonnes performances de dispositif. Il faut faire attention à aligner correctement le fil désis isolé de telle sorte que la surface maximale possible du fil exposé se trouve à l’intérieur du brassard, alors qu’aucun fil exposé n’existe à l’extérieur.
Nous avons validé que notre approche produit des poignets de taille et de fiabilité similaires à ceux actuellement en usage commun par plusieurs laboratoires pour la livraison chronique VNS chez les rats4,5,6,7,8,9,10,11,12,13,14,15,19,20,21,22. Des études récentes indiquent que les fibres nerveuses périphériques sont également recrutées en utilisant une grande variété de tailles de contact électrode et les orientations16,29, ce qui suggère que ce protocole peut être adapté pour de nombreuses expériences nécessitant une stimulation nerveuse périphérique, et que de petites variations dans l’espacement de plomb ou la surface qui découlent de l’assemblage des poignets à la main n’aura pas d’impact critique sur la plupart des résultats expérimentaux. Au cours de chaque séance de stimulation, nous avons surveillé la tension à travers les conduits de manchette à l’aide d’un oscilloscope pour nous assurer que les fils n’étaient pas court ou cassés, mais nous n’avons pas suivi les changements dans l’impédance pour les dispositifs implantés spécifiques pour la durée des 5 à 10 semaines après l’implant. Une étude d’un dispositif implanté similaire a rapporté que l’impédance augmente considérablement au cours des 4 premières semaines après l’implantation chirurgicale, vraisemblablement que la blessure aiguë se stabilise30. Dans cette étude, cependant, les changements dans l’impédance de dispositif n’ont pas été corrélés avec la performance de dispositif au-dessus de 8 semaines d’implantation chronique : les auteurs n’ont rapporté aucun changement significatif dans la relation entre l’intensité de VNS et l’amplitude potentielle d’action composée sur plusieurs semaines après l’implant. Ici, nous avons été également en mesure de valider fonctionnellement la performance de manchette après 5–10 semaines d’implantation par (i) vérifier que VNS pourrait encore évoquer un arrêt de la respiration et une baisse dans spo2 compatible avec le réflexe Hering-Breuer, et (ii) la reproduction des travaux antérieurs démontrant VNS-induit la carte de réorganisation du moteur. Dans notre propre travail, nous avons trouvé l’induction du réflexe Hering-Breuer comme le moyen le plus fiable de valider la fonctionnalité à long terme des poignets VNS implantés, qui peuvent présenter des performances ou des défaillances réduites de l’appareil en raison d’un certain nombre de facteurs sans rapport avec l’assemblage de manchette; il s’agit notamment de complications chirurgicales, lésions nerveuses et/ou de dommages mécaniques au brassard ou à la tête. Une excellente technique chirurgicale et une validation spécifique à l’application de la fonctionnalité de l’appareil sont cruciales pour une utilisation stable et réussie des électrodes de manchette stimulantes implantées de façon chronique.
Nous avons décrit une approche simple et peu coûteuse pour l’assemblage des électrodes périphériques de manchette de nerf pour l’implantation chronique chez de petits animaux et avons démontré son utilité pour l’accouchement de VNS pendant des expériences comportementales de rat. VNS est de plus en plus à l’étude pour un large éventail d’indications cliniques, y compris les maladies inflammatoires telles que la polyarthrite rhumatoïde1,,2 et la maladie de Crohn,31 ainsi que les troubles neurologiques tels que l’AVC5,6,7,8 et ptsd10,11. Cette méthode accessible pour fabriquer des électrodes de manchette stimulantes devrait faciliter l’utilisation de modèles précliniques de rongeurs dans une variété d’études de recherche translationnelle sur les mécanismes et l’efficacité de VNS. Le protocole est facilement adaptable, augmentant encore la polyvalence de l’approche. Par exemple, le diamètre et/ou la longueur du tube en polyuréthane peuvent être modifiés pour tenir compte d’expériences de stimulation chronique chez d’autres espèces ou dans d’autres sites nerveux périphériques (p. ex., nerfs sciatiques, phréniques ou sacrés). Alternativement, les configurations avec des fils supplémentaires pourraient permettre la stimulation à plusieurs emplacements le long du nerf, ou pourraient accueillir l’enregistrement simultané d’un potentiel d’action composé de stimulation-évoqué.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Les auteurs n’ont rien à révéler.
Acknowledgments
Ces travaux ont été financés par l’Université du Texas à Dallas et le Conseil des régents de l’UT. Nous remercions Solomon Golding, Bilaal Hassan, Marghi Jani et Ching-Tzu Tseng pour leur assistance technique.
Materials
| Name | Company | Catalog Number | Comments |
| Biocompatible polyurethane-based polymer tubing, 0.080" OD x 0.040" ID | Braintree Scientific | MRE080 36 FT | |
| Dissecting microscope | AM Scopes | #SM-6T-FRL | |
| Fine Serrated Scissors, straight, 22mm cutting edge | Fine Science Tools | #14058-09 | for cutting Pt/Ir wire and suture thread |
| Forceps, #5 Dumont forceps, straight, 11 cm, 0.1 x 0.06 mm tip | Fine Science Tools | #11626-11 | |
| Forceps, ceramic tipped forceps, 0.3 mm x 30 mm tips | Electron Microscopy Sciences | #78127-71 | |
| Gold Pins, PCB Press Fit Socket | Mill-Max | #1001-0-15-15-30-27-04-0 | or similar small pins for connecting cuff leads to headcap |
| Isobutane lighter | BIC | #LCP21-AST | for de-insulating Pt/Ir wire |
| Micro strip connector with latch, 4-pin | Omnetics | A24002-004 / PS1-04-SS-LT | |
| Pipette tip, 10 uL | VWR | 89079-464 | |
| Platinum-Iridium (90/10%) Wire, 0.001" (diameter) x 9 strands, PTFE insulated | Sigmund Cohn | 10IR9/49T | |
| Razor Blade, Single Edge, Surgical Carbon Steel No.9 | VWR | #55411-050 | for cutting MicroRenathane tubing |
| Sewing needle, ca. 4.0 cm length x 0.7 mm diameter (size 6-7) | Singer | 00276 | Smaller needle for threading Pt/Ir wire |
| Sewing needle, ca. 4.5 cm length x 0.8 mm diameter (size 2-3) | Singer | 00276 | Larger needle for pinning cuff during assembly and for threading suture |
| Small foam board | Juvo+/Amazon | B07C9637SJ | for fabrication platform; our dimensions are ca. 2.5" x 3.5" x 1" (L x W x H) |
| Solder, multicore lead-free, 0.38mm diameter | Loctite/Multicore | #796037 | |
| Soldering station | Weller | WES51 | or similar soldering iron compatible with long conical tips (this part has been discontinued) |
| Soldering tip, long conical, 0.01" / 0.4 mm | Weller | 1UNF8 | |
| Suture, nonabsorbable braided silk ,size 6/0 | Fine Science tools | #18020-60 | |
| UV (405 nm) spot light | Henkel/Loctite | #2182207 | |
| UV Light Cure Adhesive 25 ml | Henkel/Loctite | AA 3106 | or similar biocompatible UV cure adhesive |
| Wire wrapping wire, 30 AWG | Digikey | K396-ND |
References
- Koopman, F. A., et al. Vagus nerve stimulation inhibits cytokine production and attenuates disease severity in rheumatoid arthritis. Proceedings of the National Academy of Sciences of the United States of America. , (2016).
- Levine, Y. A., et al. Neurostimulation of the cholinergic anti-inflammatory pathway ameliorates disease in rat collagen-induced arthritis. PLoS One. , (2014).
- Zhang, Y., et al. Chronic vagus nerve stimulation improves autonomic control and attenuates systemic inflammation and heart failure progression in a canine high-rate pacing model. Circulation: Heart Failure. , (2009).
- Ganzer, P. D., et al. Closed-loop neuromodulation restores network connectivity and motor control after spinal cord injury. Elife. , (2018).
- Hays, S. A., et al. Vagus nerve stimulation during rehabilitative training enhances recovery of forelimb function after ischemic stroke in aged rats. Neurobiology of Aging. , (2016).
- Khodaparast, N., et al. Vagus nerve stimulation delivered during motor rehabilitation improves recovery in a rat model of stroke. Neurorehabilitation and Neural Repair. , (2014).
- Meyers, E. C., et al. Vagus nerve stimulation enhances stable plasticity and generalization of stroke recovery. Stroke. , (2018).
- Hays, S. A., et al. Vagus nerve stimulation during rehabilitative training improves functional recovery after intracerebral hemorrhage. Stroke. , (2014).
- Farrand, A., et al. Vagus nerve stimulation improves locomotion and neuronal populations in a model of Parkinson's disease. Brain Stimulationation. , (2017).
- Souza, R. R., et al. Vagus nerve stimulation reverses the extinction impairments in a model of PTSD with prolonged and repeated trauma. Stress. , (2019).
- Noble, L. J., Souza, R. R., McIntyre, C. K. Vagus nerve stimulation as a tool for enhancing extinction in exposure-based therapies. Psychopharmacology. , (2019).
- Childs, J. E., Kim, S., Driskill, C. M., Hsiu, E., Kroener, S. Vagus nerve stimulation during extinction learning reduces conditioned place preference and context-induced reinstatement of cocaine seeking. Brain Stimulationation. , (2019).
- Peña, D. F., Engineer, N. D., McIntyre, C. K. Rapid remission of conditioned fear expression with extinction training paired with vagus nerve stimulation. Biological Psychiatry. , (2013).
- Childs, J. E., DeLeon, J., Nickel, E., Kroener, S. Vagus nerve stimulation reduces cocaine seeking and alters plasticity in the extinction network. Learning & Memory. , (2017).
- Engineer, C. T., et al. Temporal plasticity in auditory cortex improves neural discrimination of speech sounds. Brain Stimulationation. , (2017).
- Rios, M., et al. Protocol for Construction of Rat Nerve Stimulation Cuff Electrodes. Methods Protoc. , (2019).
- Childs, J. E., et al. Vagus nerve stimulation as a tool to induce plasticity in pathways relevant for extinction learning. Journal of Visualized Experiments. , (2015).
- Paintal, A. S. Vagal sensory receptors and their reflex effects. Physiological reviews. , (1973).
- Porter, B. A., et al. Repeatedly Pairing Vagus Nerve Stimulation with a Movement Reorganizes Primary Motor Cortex. Cerebral Cortex. 22, 2365-2374 (2011).
- Morrison, R. A., et al. Vagus nerve stimulation intensity influences motor cortex plasticity. Brain Stimulationation. , (2018).
- Hulsey, D. R., et al. Norepinephrine and serotonin are required for vagus nerve stimulation directed cortical plasticity. Exp. Neurol. , (2019).
- Hulsey, D. R., et al. Reorganization of Motor Cortex by Vagus Nerve Stimulation Requires Cholinergic Innervation. Brain Stimulation. 9, 174-181 (2016).
- Bouverot, P., Crance, J. P., Dejours, P. Factors influencing the intensity of the breuer-hering inspiration-inhibiting reflex. Respiration Physiology. , (1970).
- Fialova, E., Vizek, M., Palecek, F. Inflation reflex in the rat. Physiologia Bohemoslov. , (1975).
- Hays, S. A., et al. The bradykinesia assessment task: An automated method to measure forelimb speed in rodents. Journal of Neuroscience Methods. , (2013).
- Kim, H., et al. Cuff and sieve electrode (CASE): The combination of neural electrodes for bi-directional peripheral nerve interfacing. Journal of Neuroscience Methods. , (2020).
- González-González, M. A., et al. Thin Film Multi-Electrode Softening Cuffs for Selective Neuromodulation. Scientific Reports. , (2018).
- Thakur, R., Nair, A. R., Jin, A., Fridman, G. Y. Fabrication of a Self-Curling Cuff with a Soft, Ionically Conducting Neural Interface. Proceedings of the Annual International Conference of the IEEE Engineering in Medicine and Biology Society, EMBS. , (2019).
- Bucksot, J., et al. Flat electrode contacts for vagus nerve stimulation. PLoS One. 14, (2019).
- El Tahry, R., et al. Repeated assessment of larynx compound muscle action potentials using a self-sizing cuff electrode around the vagus nerve in experimental rats. Journal of Neuroscience Methods. , (2011).
- Bonaz, B., Sinniger, V., Pellissier, S. Anti-inflammatory properties of the vagus nerve: potential therapeutic implications of vagus nerve stimulation. Journal of Physiology. , (2016).



