ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
이 논문은 지질 막의 중성자 스핀 에코 (NSE) 연구에서 샘플 준비, 데이터 감소 및 데이터 분석을위한 프로토콜을 설명합니다. 지질의 현명한 중테리움 라벨링은 중요한 생물학적 과정이 발생하는 중전 길이와 시간 척도에 대한 다양한 막 역학에 접근할 수 있게 합니다.
Abstract
지질 이중층은 세포막의 주요 매트릭스를 형성하고 영양 교환, 단백질 막 상호 작용 및 바이러스 성 신진을위한 기본 플랫폼입니다, 다른 중요한 세포 과정 중. 효율적인 생물학적 활동을 위해 세포막은 세포와 구획의 무결성을 유지할 수 있을 만큼 단단해야 하지만 단백질 및 기능성 도메인과 같은 멤브레인 성분이 확산되고 상호 작용할 수 있을 만큼 충분히 유연해야 합니다. 탄성 및 유체 막 특성의 섬세한 균형, 생물학적 기능에 미치는 영향은 주요 생물학적 과정의 장편 길이 및 시간 척도,즉 막 변형 및 단백질 결합 이벤트의 집단 막 역학에 대한 더 나은 이해가 필요합니다. 이 동적 범위를 효과적으로 조사 할 수있는 기술 중 중 하나는 중성자 스핀 에코 (NSE) 분광법입니다. 중수소 라벨링과 결합된 NSE는 벤딩 및 두께 변동뿐만 아니라 선택 된 멤브레인 피처의 중전적 역학에 직접 액세스하는 데 사용할 수 있습니다. 이 백서는 NSE 기술에 대한 간략한 설명을 제공하고 샘플 준비 및 중음 체계의 세부 사항과 데이터 수집 및 감소에 대한 지침을 포함하여 리포소말 멤브레인에 대한 NSE 실험을 수행하는 절차를 간략하게 설명합니다. 또한 굴곡 강성 계수, 영역 압축성 계수 및 평면 점도와 같은 주요 멤브레인 파라미터를 추출하는 데 사용되는 데이터 분석 방법을 소개합니다. NSE 연구의 생물학적 중요성을 설명하기 위해 NSE가 조사한 멤브레인 현상의 예를 선택하여 멤브레인 굽힘 강성에 첨가제의 효과, 막 변동에 대한 도메인 형성의 영향 및 막 단백질 상호 작용의 동적 시그니처에 대해 논의됩니다.
Introduction
세포막과 그 기능에 대한 이해는 지난 수십 년 동안 현저하게 진화했습니다. 세포막의 이전 보기는 세포 경계와 집막단백질을 정의하는 수동 지질 양층으로 1은 점차 지질 이중층이 세포 신호, 분자 교환 및 단백질 기능을 포함한 중요한 생물학적 과정을 조절하는 데 중요한 역할을하는 동적 모델로 점차 변형되어 몇가지 2,3,4,5,6의이름을 지정합니다. 세포막이 매우 역동적이고 지속적으로 리모델링 및 분자 재분배를 겪고 있다는 이러한 실현은 멤브레인7,8,9의평형 구조를 넘어 과학 탐사를 촉구했습니다. 이에 따라 생물학적 및 생체 영감 지질 막에서 다양한 동적 모드를 연구하기 위해 여러 가지 접근법이 개발되었습니다. 현재까지, 이들 연구의 대부분은 주로 확산 분자 운동에 초점을 맞추고있다 10,11,12,13 및 거시적 모양 변동14,15,16,중간 막 역학이해에 상당한 격차를 떠나, 즉, 지질 분자의 몇 10-100s로 구성 지질 어셈블리의 집단 변동. 이러한 역학은 수십 ~소수의 100 Å의 길이 저울과 몇 백 ns (그림 1참조)에 하위 ns의 시간 동안 저울에 걸쳐 발생, 중시경 비늘로 여기에 언급. 그것은 실제로 주요 생물학적 활동이 막 수준17에서일어나는 이 비늘에 실제로 입니다. 여기에는 바이러스신진(18),채널 게이팅19,막 단백질 상호작용(20)이포함됩니다. 또한 멤브레인 단백질21,22의 에너지 경관은 단백질의 형성적 변화가 규제 역할에 필요한 것을 보여 주며, ns 시간척도23의 집단 막 변동에 걸쳐 발생하며, 세포막의 생물학적 기능과 생체 영감 에 대한 생물학적 기능에 있는 중각역학의 중요성을 더욱 강조하는 것이중요하다. 이 논문은 지질 막의 두 가지 주요 중전적 동적 모드, 즉 굽힘 변동 및 두께 변동에 중점을 둡니다.
이러한 변동 모드를 직접 조사하는 데 중요한 과제는 표준 분광법 방법을 사용하여 공간 및 측두형 스케일에 동시에 액세스하는 데 어려움이 있다는 것입니다. 다른 과제는 직접 접촉 기술이16을측정하기 위한 것과 동일한 변동에 영향을 줄 수 있다는 것입니다. 이는 생물학적 멤브레인(24)의 조성 및 구조적복잡성에의해 더욱 악화되어지질영역형성(26,27,28,29,30 및 막 비대칭31, 32,33)등 비균일한 멤브레인 특징을 초래하여 다른 멤브레인 특징의 역학을 이해하기 위해 선택적 프로브를 요구한다. 다행히도, 이러한 과제는 본질적으로 필요한 길이와 시간 척도에 액세스하는 중성자 스핀 에코(NSE)와 같은 비침습적 중성자 분광법 방법으로 극복될 수 있으며, 또한 그들의 물리화학적 환경을 변경하지 않고 선택적 멤브레인 특징의 연구를 가능하게 한다34. 실제로, 지난 몇 년 동안 NSE 분광기는 집단 막 역학의 독특하고 강력한 프로브로 진화했다35. 지질막에 대한 NSE 연구의 결과 기계적36,37 및 점성탄38,지질 막의39 속성에 대한 새로운 통찰력을 생산하고 생물학적 기능40,41에서자신의 잠재적 인 역할에 새로운 빛을 발산했다.
NSE 분광법은메제이(42)가처음 제안한 간섭계 설계를 기반으로 하며, 일련의 스핀 플리퍼와 자기 코일을 사용하여 중성자가 계측기를 통과할 때 중성자 스핀의 침체를 제어합니다. 설계는 시료위치(도 1A)에대하여 자기장 원소의 자기 미러링에 달려 있다. 이것은 중성자와 시료 사이의 에너지 교환이 없는 경우 중성자는 악기의 상반기와 후반에서 반대 방향으로 동일한 수의 스핀 프런치를 수행한다는 것을 의미합니다 (두 번의 패침체 코일 사이의 π 플립퍼를 알 수 있음). 그 결과, 중성자의 최종 스핀 상태는 초기 상태에 비해 변경되지 않은 상태로 유지- 스핀 에코라고 하는 현상(도 1A에서투명 중성자 참조). 그러나 중성자가 시료와 활발하게 상호 작용할 때 에너지 교환은 계측기의 후반부에서 스핀 프론치 수를 수정하여 다른 최종 스핀 상태로 이어집니다(그림 1A참조). 이것은 실험적으로 이 논문의 후반에 나타난 바와 같이 편광의 손실로 검출됩니다. NSE 기술에 대한 자세한 내용은 독자가 전용 기술논문(42,43,44,45)을참조합니다.
여기서, 단순화된 설명은 NSE로 액세스할 수 있는 길이 및 시간 척도에 대한 대략적인 추정치를 제공하기 위해 제시된다. 길이 스케일은 달성 가능한 파벡터 전달, Q = 4π 신 θ/λ의범위에 의해 결정되며, 여기서2θ는 산란 각및 λ는 중성자 파장이다. 하나는 Q가 파장 범위와 분광계의 두 번째 팔의 회전 정도에 의해 설정된 것을 볼 수 있습니다 (그림 1A참조). NSE 분광기의 전형적인 Q-범위는~0.02-2Å-146,47,및 0.01-4Å-1까지 최근 업그레이드48,49,~1-600 Å의 공간 척도에 해당한다. 한편, 접근 가능한 시간 척도는 자기 패침체 코일 내의 중성자에 의해 획득된 총 경기 침체 각도(또는 상)로부터계산되며, 50으로  나타났다. 이 표현식에서 t는
나타났다. 이 표현식에서 t는 
 중성자자성자성비의 위치가
중성자자성자성비의 위치가  코일 길이이며 코일 자기장의 강도로 정의된 포리에
코일 길이이며 코일 자기장의 강도로 정의된 포리에  시간이다. Fourier 시간은 계측기 기하학, 자기장 강도 및 중성자 파장에 엄격하게 의존하는 양이라는 점을 지적할 가치가 있습니다. 예를 들어, 파장의 중성자를 사용
시간이다. Fourier 시간은 계측기 기하학, 자기장 강도 및 중성자 파장에 엄격하게 의존하는 양이라는 점을 지적할 가치가 있습니다. 예를 들어, 파장의 중성자를 사용  = 8 Å 및 악기 설정 =
= 8 Å 및 악기 설정 =  1.2 m 및 =
1.2 m 및 =  0.4 T, Fourier 시간은 t ~ 50 ns로 계산됩니다. 실험적으로, 포리에 시간은 p침체 코일(즉, 자기장 강도)에서 전류를 변경하거나 다른 중성자 파장을 사용하여 조정되어~ 1 ps ~ 100ns의 전형적인 NSE 시간 척도를 초래한다. 그러나, NSE 분광기의 최근 업그레이드는 하이네즈 마이어-라이프니츠 젠트럼51의 J-NSE-피닉스 분광기에서 최대 ~400ns까지 더 긴 포리어 타임에 접근할 수 있게 해주었으며, 오크 리지 국립 연구소48의SNS-NSE 분광기, 그리고 IN15 NSE 분광기에서 최대 ~1,000ns까지인루트 랭에프(Ill-Inute)
0.4 T, Fourier 시간은 t ~ 50 ns로 계산됩니다. 실험적으로, 포리에 시간은 p침체 코일(즉, 자기장 강도)에서 전류를 변경하거나 다른 중성자 파장을 사용하여 조정되어~ 1 ps ~ 100ns의 전형적인 NSE 시간 척도를 초래한다. 그러나, NSE 분광기의 최근 업그레이드는 하이네즈 마이어-라이프니츠 젠트럼51의 J-NSE-피닉스 분광기에서 최대 ~400ns까지 더 긴 포리어 타임에 접근할 수 있게 해주었으며, 오크 리지 국립 연구소48의SNS-NSE 분광기, 그리고 IN15 NSE 분광기에서 최대 ~1,000ns까지인루트 랭에프(Ill-Inute)
멤브레인 역학의 길이 및 시간 척도에 직접 액세스 하는 것 외에도, NSE는 중성자 동위원소 감도 의 고유 기능을 가지고52. 구체적으로, 중성자의 능력은 생물학적 시스템에서 가장 풍부한 소원인 수소의 동위원소와 다르게 상호 작용하는 능력으로, 상이한 중성자 산란 길이 밀도,34 또는 NSLD(굴절의 광학 지수에 상응하는50)를초래하며, 프로티엄은 중투란에 의해 대체된다. 이를 통해 특정 멤브레인 피쳐를 강조하거나 다른 사람을 숨기는 데 일반적으로 사용되는 콘트라스트 변형이라고 하는 접근 방식을 사용하여 후자의 시나리오를 대비 일치라고 합니다. 대조적 변화/매칭의 빈번한 적용은 중수 또는 D 2O(NSLD = 6.4 ×10 -6 å-2)에 의해 물의 대체물(NSLD= -0.56 × 10-6Å-2)으로유량지질막(NSLD ~0~0× -6Å-2)으로부터 중성자 신호를 증폭시키는 것이다. 이러한 접근법은 멤브레인의 헤드그룹 영역으로D2O의침투가 멤브레인 두께(도 2A,왼쪽 패널 참조) 및 보다 정교한 모델이적용될때 다른 지질 하위 그룹의 위치의 정확한 측정을 허용하기 때문에 멤브레인 구조의 연구에서 매우 효과적이다. 이 논문은 생물 막의 집단 역학 및 선택 막 특징의 연구를 위한 대비 변이의 사용에 대한 몇 가지 예를 강조합니다.
여기서, 동역 및 기능성 멤브레인 특성에 대한 고유한 통찰력을 제공하는 NSE의 효과는 리포소말 현탁액의 형태로 독립형 멤브레인의 중전역학에 중점을 둔 모델 및 생물학적으로 관련된 지질 막 시스템에 대한 NSE 연구의 유형 사례를 통해 설명됩니다. 평면 막 역학의 NSE 측정을 위해, 독자는 방목 발생 중성자 스핀 에코 분광법 (GINSES)55,56 및 정렬 다중 다각막 스택의 다른 연구에 전담 간행물을참조57,58,59,60.
단순성, 이 논문은 잘 연구된 도메인 형성, 또는 위상 분리, 1,2-dimyristoyl-sn-glycero-3-인포콜린(DMPC)의 지질 이중층 시스템 및 1,2-distearoyl-sn-glycero-3-phosphocholine(DSPC) 혼합물(DSPC) 혼합물(DSPC)61개에 대해 세 가지 다른 계획을 강조합니다. 두 지질은 탄화수소 사슬 길이(DMPC의 14탄/꼬리 vs DSPC의 18탄소/꼬리)와 겔유체 전이 온도(Tm, DMPC = 23°C vsTm, DSPC = 55°C)의 불일치를 특징으로 합니다. 이는 DMPC:DSPC 멤브레인에서 혼합물63의상부 및 낮은 전이 온도 사이의 온도에서 측면 상 분리를 초래한다. 여기서 고려되는 증단 방식은 리포소말 멤브레인, 즉 굽힘 변동, 두께 변동 및 측면 도메인의 선택적 굽힘/두께 변동에 대한 NSE 측정에서 액세스할 수 있는 다양한 동적 모드를 시연하기 위해 선택됩니다. 모든 지질 조성물은 DMPC및 DSPC의 상용 및 정해 변형을 사용하여 70:30의 몰트 분수로 제조된 DMPC:DSPC 이중층에 대해 보고됩니다. 모든 시료 준비 단계는 D2O에서 지질 농도가 50 mg/mL인 4mL의 지질 현탁액을 기반으로 하며, 총 지질 질량인 Mtot = 샘플당 200 mg을 기준으로 합니다.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. 실험에 필요한 신분 제도
- 변동 측정을 구부리기 위해 D2O(D 99.9%) 또는 D2O 버퍼(예: H2O 대신D2O로 제조된 인산염 버퍼)로 완전히 프로페드된 리포솜을 만듭니다. 133.4 mg으로 완전히 protiated DMPC (C36H72NO8P) 및 DSPC (C44H88NO8P)를
 사용, 여기서 XDMPC와 XDSPC는 DMPC와 DSPC의 두더지 분수이며, 각각 0.7 및 0.3으로 설정하고 MwDMPC 및 MwDSPC는 각각 677.9 g/mol 및 790.1 g/mol이 제공하는 어금니 가중치입니다. 마찬가지로, mDSPC = 66.6 mg. 이러한 중음 방식은 멤브레인(NSLD ~ 0×10-6Å-2) 및 중음 버퍼(NSLD ~ 6.4 ×10-6 Å-2)사이의 산란 대비를 증가시키고 멤브레인 기복으로부터 신호를 증폭시킨다(그림 2A 왼쪽 패널 참조).
사용, 여기서 XDMPC와 XDSPC는 DMPC와 DSPC의 두더지 분수이며, 각각 0.7 및 0.3으로 설정하고 MwDMPC 및 MwDSPC는 각각 677.9 g/mol 및 790.1 g/mol이 제공하는 어금니 가중치입니다. 마찬가지로, mDSPC = 66.6 mg. 이러한 중음 방식은 멤브레인(NSLD ~ 0×10-6Å-2) 및 중음 버퍼(NSLD ~ 6.4 ×10-6 Å-2)사이의 산란 대비를 증가시키고 멤브레인 기복으로부터 신호를 증폭시킨다(그림 2A 왼쪽 패널 참조). - 선택 측면 멤브레인 피쳐의 굽힘 역학을 측정하려면 예를 들어, 위상 분리 DMPC:DSPC 멤브레인의 매트릭스 역학, 프로스테디드 DMPC(C36H72NO8P) 및 유족, DSPC-d83(C44H5NO8PD83,Mw 873.7 g/mol), 이러한 mDMPC = 128.8 mg 및DPC.78 m. 이 중음 체계는 원치 않는 DSPC가 풍부한 도메인의 산란을 최소화하여 DMPC가 풍부한 매트릭스에서 굽힘 변동을 선택적으로 측정할 수 있습니다(그림 2B 가운데 참조).
참고: 특정 대비 매칭 방식에 필요한 최적의 지질 증자를 찾으려면, 중성자연구(64)에대한 NIST 센터에서 개발한 것과 같은 사용 가능한 웹 기반 산란 길이 밀도(SLD) 계산기를 활용한다. 이 웹 기반 인터페이스에는 다양한 정도의 중음증과 지질 혼합물을 쉽게 계산할 수 있는 사용자 친화적인 도구가 장착되어 있습니다. - 평균 멤브레인 두께 변동(측면 대비 없음)의 NSE 측정의 경우 구성 지질의 꼬리 유족 변형을 사용하십시오. 즉, DMPC-d54 (C36H18NO8PD54,732.3 g/mol) 및 DSPC-d70 (C44H18NO 8PD70,860.1 g/mol)35,38,이러한 mDMPC-d54 = 133.0 mg 및 DPC-07 이러한 대비방식(도 2A,오른쪽 패널)은 지질 헤드그룹(NSLD ~ 4.5 ×10-6 Å-2)으로부터 산란 신호를 수직으로 증폭시켜 꼬리그룹(NSLD ~ 6.4×10-6Å-2)을 대조적으로 일치시켜 막 두께의 변동을 검출할 수 있도록 한다.
- 일부 멤브레인 구획의 두께 변동 연구를 위해, 예를 들어, DMPC가 풍부한 매트릭스는, DSPC가 풍부한 도메인이 탈결된 완충및 1차 산란 신호와 대조를 이루는 등, DMPC-d54와 함께 증식DMPC 지질을 대체하여 1.2단계에서 설명된 동일한 전략을 사용합니다.
2. 압출을 위한 지질 현탁액 준비
- 샘플 조성물에 따라 샘플의 각 성분의 질량을 계산합니다. 엄지 손가락의 규칙으로, 여러 분자 성분샘플의 경우, 성분의 질량은 어금니 질량에 의해 주어집니다, Mwi,그것의 두더지 분획에 의해 가중, Xi,그리고 모든 구성 요소에 걸쳐 정규화:
 M토트는 총 질량, 여기에 설정 200 mg. DMPC-DSPC 지질 이중레이어에 대한 위의 예제를 참조하십시오.
M토트는 총 질량, 여기에 설정 200 mg. DMPC-DSPC 지질 이중레이어에 대한 위의 예제를 참조하십시오. - 디지털 반 마이크로 밸런스를 사용하여, 지질 (및 기타 샘플 성분, 예를 들어, 단백질, 나노 입자 등)의 계산 된 질량을 무게와 유리병 또는 둥근 바닥 플라스크에 추가 – 사전에 유리 또는 플라스크를 무게 기억. 후드 내부를 수동으로 혼합하여 계량 된 구성 요소를 용해시키기 위해 용매 1 mL을 추가하십시오. 순수한 지질 샘플의 경우 클로로폼 또는 에탄올을 사용하십시오. 추가, 비 지질 성분 (예를 들어, 나노 입자)이있는 샘플의 경우 모든 구성 요소를 분산시키는 일반적인 용매를 선택하십시오.
- 작은 지질 량 (<10 mg)의 경우, 혼합물에 필요한 볼륨을 스톡 용액과 파이펫을 준비하십시오.
참고: 아래에 설명된 용매 건조 단계가 크게 느려지기 때문에 과도한 양의 용매를 첨가하지 마십시오.
- 작은 지질 량 (<10 mg)의 경우, 혼합물에 필요한 볼륨을 스톡 용액과 파이펫을 준비하십시오.
- 유리병을 비스듬히 회전시키면서 유리병에 불활성 가스(예를 들어 질소, 아르곤)를 부드럽게 스트리밍하여 후드 내부의 지질 용액을 건조시다. 유리병을 기울인 위치에 두어 유리병 벽에 말린 지질의 박막을 만들어 건조할 수 있습니다. 간헐적으로 용매 증발을 느리게하는 증발 매개 냉각을 우회하기 위해 35 °C의 수조에 유리병을 배치합니다.
- 바이알을 진공 오븐에 하룻밤 동안 놓아 -35°C의 진공 용매를 완전히 제거합니다. 불포화 지질의 경우, 산화를 최소화하기 위해 불활성 가스로 진공을 제거합니다.
- 전체 용매 제거를 보장하기 위해 지질 건조 후 유리병을 계량하고 측정된 양의 물질을 초과하여 과도한 질량이 없음을 확인합니다. 건조 후 측정된 질량에서 유리병의 질량을 빼서 이 작업을 수행하십시오. 질량이 초과된 경우, 또 다른 6 h에 대한 진공 하에서 샘플을 건조. 필요에 따라 이 프로세스를 반복합니다.
- 지질 필름을 D2O 또는 D2O 버퍼4mL로 수화하여 50 mg/mL의 지질 농도를 얻습니다. DMPC-DSPC 혼합물과 같이 전이 온도가 높은 지질의 경우 버퍼를 전이 온도(60°C) 이상으로 가열하여 혼합도 보장합니다.
참고: NSE 실험에는 상대적으로 큰 샘플 볼륨(~4mL)이 필요하기 때문에 필요한 버퍼의 절반( 즉 2mL)을 사용하여 샘플을 수분을 공급하여 샘플당 압출 수를 최소화하는 것이 좋습니다(섹션 3 참조). 이 경우 버퍼 포스트 압출의 나머지 절반을 추가합니다. 압출에 사용되는 주사기의 용량은 1mL로 제한됩니다. 따라서 4mL의 버퍼로 수분을 공급하려면 4세트의 압출이 필요합니다. - 지질 필름이 완전히 용해되고 더 이상 유리병 의 벽에 보이지 않게 될 때까지 소용돌이 - 수화 지질 용액을 혼합합니다. 이 단계에서, 수화 지질은 다각성 멜라 소포와 미크론 크기의 다중 멜라 스택을 형성하고 서스펜션은 유백색 나타납니다.
- 지질 스택의 파손을 용이하게 하고 다졸음절을 줄이기 위해, 수화 지질 용액의 유리병을 실험실 급냉동기(-80°C 냉동고)에 넣고 지질용액이 완전히 무너질 때까지 35°C 의 수조로 유리병을 이송하여 5개의 동결/해동 주기를 수행한다. 균일할 때까지 해동된 용액을 소용돌이시다. 네 번 더 반복합니다.
참고: 아세톤과 드라이 아이스를 결합하여 드라이 아이스 욕조를 빠르게 얼릴 수 있습니다.
3. 수화 지질 용액의 압출
- 두 멤브레인 지지대 사이에 폴리카보네이트 멤브레인을 사용하여 압출기 설정을 조립하고 각 측면에 두 개의 종이 필터를 추가하여 추가 지원을 제공합니다. 대상 리포솜 크기와 일치하는 모공 크기를 가진 폴리 카보네이트 멤브레인을 사용하십시오 (NSE 실험을위한 일반적인 모공 크기는 50 nm 및 100 nm입니다 - 일반적으로 100 nm 직경 리포솜은 덜 제한된 막 변동을 허용하지만, 작은 50 nm 리포솜은 곡률 연구에 사용될 수 있습니다). 조립을 완료하고 외부 압출기 케이스를 조이기 전에 폴리 카보네이트 멤브레인이 완전히 늘어나있는지 확인합니다.
- 폴리카보네이트 멤브레인을 D2O 또는 D2O 버퍼의 ~0.3mL을 밀폐 유리 주사기를 사용하여 멤브레인 어셈블리를 통해 몇 번 전달하여 수분화한다. 샘플 준비에 사용되는 동일한 버퍼를 활용합니다. 적어도 10 분 동안 방치 한 다음 샘플을 소개하기 전에 버퍼를 완전히 빨아.
- 준비된 지질 용액으로 1mL 가스 팽팽한 주사기를 채우고 압출기 장치의 한쪽 끝에 삽입하십시오. 그런 다음 빈 주사기를 반대쪽 끝에 삽입합니다. 주사기가 압출기 어셈블리에 연결되면 압출기 블록에 넣습니다.
- 압출에 온도가 높으면, 고전온도(예를 들어, DSPC,Tm = 55°C)를 가진 포화 지질의 경우와 같이, 지질 전이 온도(예를 들어, 60°C) 위에 압출기 가열 블록을 예열하여, 온수판에 가열 블록을 배치하거나 도 3A에도시된 바와 같이 순환 목욕을 이용하여.
참고: 이 단계는 지질의 균일한 혼합을 보장하고 다탄산 막을 파열할 수 있는 압출 도중 극단적인 압력을 가하지 않도록 하는 것이 중요합니다. 전이 온도가 낮은 지질 샘플(<25°C)의 경우 실온에서 압출을 수행합니다. - 지질 용액을 돌출하려면 도 3A에도시된 것처럼 알루미늄/강철 프레임이 있는 프로그래밍 가능한 주사기 펌프에 압출기를 부착한다. 온도 제어 압출의 경우 유체 채널이 있는 맞춤형 압출기 베이스를 추가하고 순환 하는 수조에 부착하십시오.
- 주사기 펌프를 프로그래밍하여 제조업체 매뉴얼에 따라 15-20 압출 주기를 수행합니다. 압출시, 지질 용액의 색상은 유백색에서 투명 오팔블루(도 3B,C)로바뀌며, 예상대로 가시광선의 파장보다 작은 최종 리포소말 크기를 나타낸다. 그림 3A에표시된 주사기 펌프의 종류에 대해 아래 단계를 따르십시오.
- 펌프 설정을 조정하여 시작합니다. 속도 버튼을 누르고 압출 속도(50.99mL/h)를 입력한 다음 직경 버튼을 누르고 주사기 직경(4.606 mm)을 입력합니다. 화면의 각 숫자 아래에 있는 최대 화살표를 사용하여 해당 숫자 값을 변경합니다.
- 샘플 주사기로 압출기를 오른쪽에 놓습니다(그림 3A참조). 인출 표시등이 켜지면 인출 버튼을 누릅니다. 시작을 누르고 샘플이 왼쪽(빈) 주사기에 분배될 때까지 기다립니다.
- 샘플(오른쪽) 주사기가 완전히 비어 있기 직전에 정지 버튼을 누르십시오. 분배된 볼륨을 기록하고 압출 주기를 프로그래밍하는 데 사용합니다. 1단계(PH:01)가 화면에 나타날 때까지 속도 버튼을 누를 수 있습니다. 볼륨 버튼을 눌러 이전에 기록된 분배된 볼륨을 입력합니다. 이 단계에서는 인출 표시등이 꺼져 있는지 확인하십시오 - 이것은 올바른 방향으로 샘플을 분배합니다.
- 속도 버튼을 다시 누르고 오른쪽 최대 화살표를 사용하여 2단계(PH:02)에 액세스합니다. 볼륨을 눌러 이전에 기록된 분배 된 볼륨의 동일한 값을 입력합니다. 이 단계에서는 인출 표시등이 켜져 날 때까지 인출 버튼을 누르면 샘플이 왼쪽으로 분배됩니다.
- 이 주기를 반복하려면 속도 버튼을 다시 누르고 오른쪽 최대 화살표를 사용하여 3단계(PH:03)에 액세스합니다. LP:SE가 화면에 나타날 때까지 볼륨 버튼을 누르고 20으로 설정합니다. 펌프가 수행하는 루프 또는 반복 수입니다. 마지막으로, 속도 버튼을 누르고, 4단계(PH:04)에 액세스하고 볼륨 버튼을 눌러 정지 기능을 가져옵니다. 이제 펌프가 자동 압출을 위해 설정됩니다.
- 압출 주기를 시작하려면 시작합니다.
- 압출된 지질 현탁액을 포함하는 주사기를 깨끗한 유리병에 비우고 보관 또는 측정을 준비합니다. 용융 온도가 높은 지질 샘플의 경우 측정될 때까지 유체 위상 전이 위에 샘플을 저장합니다. 그렇지 않으면 샘플을 실온에서 유지합니다.
- 압출 된 샘플을 동결로 동결하면 소포가 파열됩니다 (서스펜션은 다시 유백색으로 변합니다).
4. 샘플(들)에 대한 NSE 측정 및 수집된 데이터의 감소
- NSE 실험에 앞서, 적절한 시료 품질을 보장하기 위해 사용 가능한 방법을 사용하여 3.7 단계에서 압출된 리포소말 샘플을 특성화한다. NSE 실험에 대한 리포소말 현탁액의 품질을 평가하는 데 사용할 수 있는 잠재적 인 charcaterization 방법의 목록은 예를 들어 크기 분포, 다각형, 측면 막 구조, 토론 섹션에 포함되어 있습니다.
- 실험에 필요한 Q-범위 및 해당 계측기 설정을 결정합니다. 지질 이중층의 강성 측정을 구부리기 위해 ~(0.04 - 0.2)Å-1의Q 범위를 사용하십시오. 멤브레인 두께 변동의 연구를 위해, 막 두께35,66,67에대응하는 ~(0.04 - 0.2)Å-1의 Q 범위를 사용한다.
참고: 실험 시작 전에 계측기 과학자와 실험 설정에 대해 설명합니다. 앞서 언급했듯이, 시료의 SANS 특성화는 특히 선택적으로 중음이 높은 멤브레인에서와 같이 산란 신호의 이전 정보를 사용할 수 없는 경우 특히 필요하다. 또는 NSE 계측기의 제한된 Q-range에서 정적(회절이라고도 함) 측정을 실행하면 SANS에 비해 측정이 훨씬 더 오래 걸릴 수 있다는 주의할 수 있습니다. - 주사기 또는 이송 파이펫을 사용하여 NSE 빔라인에서 사용할 수 있는 지정된 샘플 셀에 압출된 리포소말 서스펜션을 로드합니다. 표준 NSE 샘플 셀은 1, 2, 3 및 4mm의 두께로 제공됩니다. 분산 신호를 최적화하는 방식으로 셀 두께를 선택하면서 일관된 배경 신호를 합리적인 강도로 유지합니다.
참고: 일반적으로 엄지 손가락의 규칙으로, 1 또는 2mm 경로 길이의 샘플 세포를 사용하여 유족 버퍼에서 프로티드 리포솜에 대해 - 두꺼운 세포는 해결하기 어려운 여러 산란 효과를 초래할 수 있습니다. 높은 수준의 신둥이(예: 꼬리 대비 일치리포솜 또는 단일 프로티아리플렛을 사용한 균등 측정 리포솜)를 가진 리포솜의 경우, 샘플이 더 많은 수량으로 제공되는 경우 계산 통계를 향상시키기 위해 두꺼운 샘플 셀(예: 3 또는 4mm 경로길이)을 사용하는 것이 좋습니다. - 버퍼에 대해 동일한 샘플 셀을 준비합니다. 리포소말 서스펜션과 동일한 버퍼를 사용합니다. 강도 정규화 및 배경(배경) 보정에 버퍼에 대한 측정이 필요합니다.
- 샘플 셀(들)을 NSE 분광계의 샘플 홀더에 배치하고, 측정 실행을 프로그래밍하고, 에코 데이터를 수집합니다. 처음 NSE 사용자가 있는 경우 계측기 과학자와 상의하여 측정 프로그래밍에 대해 문의하십시오.
- 데이터 감소에 필요한 두 가지 추가 측정 세트를 수행합니다:해상도(R)및전송(T)측정.
- 탄성 산란 참조(예: 탄소)에 대한분해능(R) 측정을 수행하여 동일한 설정에서 실행합니다. 즉, 샘플 및 버퍼 측정과 동일한 파벡터 및 푸리에 시간입니다.
- 시료 및 버퍼에 대한전송(T)측정을 수행하여 전송된 중성자 빔의 강도를 계산합니다(아래 단계 4.9 참조). 전송은 시료 또는 버퍼로부터 중성자 수의 비율로 계산되어 개방빔에 대한 중성자 수(즉, 빈 샘플 위치 포함).
- 수집된 데이터를 줄이기 위해 측정이 수행되는 NSE 분광계에 전용 데이터 감소 소프트웨어를 사용합니다.
참고: 다른 분광기는 다른 소프트웨어 또는 사용자 인터페이스를 활용할 수 있습니다. 다음은 데이터 분석 및 시각화 환경(DAVE)을 사용하여 NSE 데이터 감소의 예입니다.68 NIST 중성자 연구 센터의 NSE 분광기를 위해 특별히 작성된 소프트웨어.- DAVE 소프트웨어를 열고 데이터 감소 메뉴에서 NSE 데이터 감소를 선택합니다. 여러 팝업 창이 나타납니다.
- 파일 메뉴에서 열린 .echo 파일을 사용하여 다른 Q 값위에 데이터 파일을 업로드합니다. 이러한 파일은 스핀 에코 신호가 있는 원시 데이터 파일에 해당하며 파일 이름에 확장 .echo가 있습니다. 파일 업로드가 완료되면 파일이 사용 가능한 데이터 집합 아래에 표시됩니다.
- 선택한 파일을 마우스 오른쪽 단추로 클릭하고 해당값에 따라 라벨을 지정합니다. 즉, 샘플, 셀(빈 셀 또는 버퍼용) 또는 해상도입니다.
- 데이터 집합 탭을 사용하여 신호 대 잡음 비율을 개선하기 위해 검출기를 2 x 2로 그룹화합니다. 모든 파일에 동일한 비닝을 적용합니다. 즉, 해상도, 셀 및 샘플입니다.
- 키보드의 m 키를 눌러 모든 픽셀 그룹에 걸쳐 데이터를 검사하고 신호가 좋지 않은 데이터를 마스크합니다(그림 4B참조). Enter를 눌러 팝업 창에 액세스하여 모든 Fourier 시간 또는 이후 의 Fourier 시간에 동일한 마스크를 적용합니다. 이는 데이터 감소 시 임의의 지점에서 개별 픽셀에도 적용할 수 있습니다. 마스크된 픽셀은 녹색으로 바뀝니다.
- 수집된 데이터가 각 검출기 픽셀을 통해 위상 전류의 관점에서 에코 신호, 즉 코신 함수의 형태로 있는지 확인합니다(그림 4A참조).
참고: 위상 전류는 중성자 스핀의 경기 침체 각도에 비례한다. 따라서 그림 4A에도시된 것처럼 위상 전류를 위상 각도로 표현하는 것이 일반적입니다. 펄스 소스에 대한 측정을 위해, 중성자 펄스 내의 중성자 파장의 함수로서 에코 신호를 얻기 위해 추가 비행 시간 계산이 데이터에 적용됩니다. - 먼저 해결 방법 파일을 피팅합니다. 업로드된 파일 목록에서 해결 방법 파일을 선택하고 파일을 마우스 오른쪽 단추로 클릭합니다. 맞춤 작업 선택: 팝업 메뉴에서 에코(해상도)에 맞습니다.
- 에코 신호의 적합이 4.8 단계에서 필요한 매개 변수 A를포함한 여러 피팅 매개 변수를 생성하도록 합니다. 다음 식을 사용하여 피팅이 자동으로 수행됩니다.

여기서, ζ 에코 신호(즉, 도 4A의코신 기능)의 기간이며, σ 중성자 빔의 평균 파장 및 파장 확산에 의해 결정된 가우시안 봉투의 폭이며, Φc는 위상 전류이며, Φ0은 중성자50에의해 경험되는 필드 경로에 의존하는 에코 포인트이다. 샘플에 대한 물리적 정보는 진폭, A,수식(1)의 코신 함수에 인코딩된다.
참고: 가우시안 봉투의 너비는 계측기 과학자가 미리 정한 값을 기반으로 하며 변경해서는 안 됩니다. 다른 파라MT는 각 픽셀에 걸쳐 특정 에코 신호에 맞는 변수입니다. - 각 픽셀을 클릭하여 피팅 결과를 검사하여 결과 피팅 매개 변수, 맞춤 품질 및 적합성의 평균 정사각형 편차를 표시합니다. 전체 검출기에서 각 피팅 매개 변수와 관련된 오류를 검사하려면 이미지 옵션을 선택한 다음 관심 있는 피팅 매개 변수를 선택합니다. 이렇게 하면 각 픽셀에 피팅 패러머값이 있는 맵이 생성됩니다. 감지기 이미지를 마우스 오른쪽 단추로 클릭합니다. 선택한 피팅 매개 변수의 오류 막대 맵을 표시하는 팝업 창이 나타납니다.
- 특정 픽셀에 대한 적합성이 만족스럽지 않은 경우(예: 큰 오류 막대가 있는 파라미게이터에 적합) 해당 특정 픽셀에 신호를 다시 맞춥시게 합니다. 해당 픽셀을선택하고 피팅 탭을 누른 다음 픽셀 을 누릅니다. 피팅 탭에 위상(Φ0)및 기간(ζ)에 대한 새로운 시작 매개변수를 입력하여 보다 만족스러운 핏을 얻습니다.
참고: 포리에 시간의 함수로서 장착된 위상을 플롯하는 것이 유용합니다. 이렇게 하려면 기본 플롯 창으로 이동하여 맞춤 단계 대 푸리에 시간을선택합니다. 이 플롯은 부드럽고 연속적이어야 합니다. 이 플롯의 불연속성을 검사하고 해당 플롯에 해당하는 픽셀을 다시 맞춥시게 합니다.
- 업로드되고 레이블이 표시된 파일 목록에서 해당 파일을 선택하여 샘플 또는 셀 파일을 줄입니다.
- 4.7.5 단계에서 설명한 대로 모든 픽셀을 검사하고 통계가 좋지 않는 픽셀을 마스크합니다.
- 파일을 마우스 오른쪽 단추로 클릭하고 맞춤 작업 선택: 가져오기 단계(샘플, 셀). 이렇게 하면 해상도 파일에서 위상과 적용된 마스크를 가져옵니다.
- 해상도 파일에 대해 이전에 설명한 동일한 절차를 사용하여 에코 신호를 입력합니다(단계 4.7.8-4.7.10). 샘플 및 셀 파일을 피팅할 때 해상도에서 가져온 기간 및 에코 위상점의 값을 변경하지 마십시오. 이러한 매개 변수는 기악 설정에 따라 달라지며 샘플과 달라지지 않아야 합니다.
- 데이터 감소를 진행하기 전에 모든 데이터 파일에 대한 빔 센터를 입력합니다. 데이터 파일을 선택하고 일반 탭으로 이동하여 X 및 Y 빔 센터 값을 입력합니다. 이러한 값은 실험 중에 기록됩니다.
- 샘플, 셀 및 해상도 파일에 적합하면 나중에 데이터 분석 및 해석에서 사용할 정규화된 중간 산란 함수를 계산합니다. 이렇게 하려면 샘플 파일을 마우스 오른쪽 단추로 클릭하여 장착된 파일 목록에서 줄이며 팝업 메뉴에서 I(Q) 계산을 선택합니다. 해상도 및 셀(예: 버퍼) 파일및 Q-arc 수(단계 4.9 참조)에 대한 항목 선택 과 함께 창이 나타납니다. 필요한 모든 정보를 입력한 후 OK 버튼을 누릅니다. 결과는 새 창에 나타납니다.
참고: 데이터 감소는 정규화된 중간 산란함수(69)를얻기 위해 다음 방정식에 따라 수행됩니다.
여기서 t는 Fourier 시간, N위 및 N다운은 비 스핀 플립 및 스핀 플립 구성 (각각 π/2 플리퍼 끄 π기 및 온으로 측정됨)의 중성자 수이며, 슈퍼스크립트BKG 및 R은각각 4.4 단계와 4.6 단계에 정의된 대로 배경 및 해상도 측정에 해당합니다. 빔 편광은 중성자와 시료 사이의 에너지 교환으로 인해 스핀 상태의 변화가 편광(unity로부터)의 낙하로 검출된다.
중성자와 시료 사이의 에너지 교환으로 인해 스핀 상태의 변화가 편광(unity로부터)의 낙하로 검출된다.
- 마지막으로, 검출기 픽셀을 도 4B에 도시된 바와 같이 Q-아크로그룹화하여 정규화된 중간 산란 기능,S(Q,t)/ S(Q,0)의 Q-의존성을얻습니다. 이것은 기술적으로 데이터 binning이라고하며, 즉 샘플의 계산 통계와 그룹화 된 픽셀을 통해 데이터의 예상 표준 편차를 고려하여 신중하게 수행해야합니다.
- 시료를 강하게 산란하기 위해, 결과 중간 산란 함수, S(Q,t)/ S(Q,0)에합리적인 오차 막대를 유지하면서 검출기를 더 많은 Q-arcs로 나눕니다. 이렇게 하면 Q 데이터 요소가 더 많이 생성되며 아래에 설명된 데이터 분석 절차에 중요합니다. 약한 산란 시료의 경우, 과도한 비닝은 부패 신호가 불량하여 큰 붕괴 신호, 즉 S(Q,t)/ S(Q,0)에큰 오차 막대를 초래하여 큰 불확실성을 초래할 수 있음을 유의하십시오.
5. 데이터 분석 및 해석
- 정규화된 중간 산란 함수,S(Q,t)/ S(Q,0)를 맞추어, 위의 데이터 감소로부터 2/370의스트레치수로 확장지수 함수로 얻은 다이큐언 함수에 맞습니다.

참고: 이러한 적합의 예는 그림 5B에제공됩니다. S(Q,t)/ S(Q,0)를 방정식(3)에 맞게 하면 q 의존식 이완률 Γ(Q)을 산출합니다(Q). - 플롯Γ(Q)은Q의 함수로서 적절한 모델에 적합하여 관련 멤브레인 파라미터를 추출한다.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
굽힘 변동에 액세스하는 NSE 연구는 일반적으로 ~ (0.04 - 0.2) Å-1의Q 범위에서 수행됩니다. 이 Q-range는 구부리다믹이 지배하는 멤브레인 두께와 리포소말 반경 사이의 중간 길이 스케일에 해당합니다. 확장된 Q-range를 측정하면 리포소말 확산 및 막 내 역학을 포함한 추가 동적 모드에 액세스할 수 있습니다. NSE에서 액세스하는 멤브레인 역학의 크로스 오버에 대한 자세한 내용은 이러한 관련 간행물25,71을확인하십시오. NSE 신호가 비례한다는 것을 강조하는 것이  중요합니다:, 내가코와 나Inc.는 각각 샘플에서 일관되고 일관되지 않은 산란 강도입니다. 따라서, 주로 시료의 수소 함량에 의해 기여하는 일관된 산란 신호를 최소화하기 위해 중음 버퍼(즉, H2O 대신D2O로제조된 완충제)에서 NSE 리포소말 샘플을 준비하는 것이 바람직하다. 그러나, 어떤 경우에는 중간 중증 계획(즉, D2O 및 H2O의혼합물을 사용하여)이 최적의 대조 조건을 얻기 위해 필요할 수 있습니다. 전형적으로, 멤브레인 굽힘 변동의 NSE 측정은 도 5에서완전히 대조된 리포솜이라고 하는 유족 완충제에서 완전히 배분된 리포솜에 대해 수행됩니다. 이러한 중음 제표는 멤브레인 코어(~0×10-6Å-2)와 그 중증 유체 환경(~6.4 × 10-6Å-2)의큰 NSLD 차이를 초래하여 리포소말 막의 산란 신호를 크게 향상시키고 굽힘 역학의 측정 통계를 향상시킵니다. 이러한 대조식방식(도 2A 좌측 패널)은 단일38,72 및 다중39,66개의 지질 성분을 가진 지질 막의 강성을 구부리는 연구에서 자주 활용되며생물학적포함에 의한 막 연화/경화(예를 들어) 콜레스테롤, 약물 분자, 펩타이드/단백질)36,37,73,74,75,및 합성 첨가제(예를 들어, 나노입자)76,77.
중요합니다:, 내가코와 나Inc.는 각각 샘플에서 일관되고 일관되지 않은 산란 강도입니다. 따라서, 주로 시료의 수소 함량에 의해 기여하는 일관된 산란 신호를 최소화하기 위해 중음 버퍼(즉, H2O 대신D2O로제조된 완충제)에서 NSE 리포소말 샘플을 준비하는 것이 바람직하다. 그러나, 어떤 경우에는 중간 중증 계획(즉, D2O 및 H2O의혼합물을 사용하여)이 최적의 대조 조건을 얻기 위해 필요할 수 있습니다. 전형적으로, 멤브레인 굽힘 변동의 NSE 측정은 도 5에서완전히 대조된 리포솜이라고 하는 유족 완충제에서 완전히 배분된 리포솜에 대해 수행됩니다. 이러한 중음 제표는 멤브레인 코어(~0×10-6Å-2)와 그 중증 유체 환경(~6.4 × 10-6Å-2)의큰 NSLD 차이를 초래하여 리포소말 막의 산란 신호를 크게 향상시키고 굽힘 역학의 측정 통계를 향상시킵니다. 이러한 대조식방식(도 2A 좌측 패널)은 단일38,72 및 다중39,66개의 지질 성분을 가진 지질 막의 강성을 구부리는 연구에서 자주 활용되며생물학적포함에 의한 막 연화/경화(예를 들어) 콜레스테롤, 약물 분자, 펩타이드/단백질)36,37,73,74,75,및 합성 첨가제(예를 들어, 나노입자)76,77.
굽힘 변동을 측정하면 Zilman과 Granek이 예측한 대로 열기위기질탄 얇은시트(70)에대해 예측한 대로 Q3 의존도를 따르는 이완률을 초래합니다. 이 Q-의존의 정제 된 형태는 고려 Seifert와 랑거에 의해 제안 된 중간 층 마찰의 효과를 고려 왓슨과 브라운78에의해 이론적 교정에서 얻을 수있습니다 79. 또한 중성 평면을 증정의하여 친성 헤드그룹과 멤브레인의 소수성 꼬리 사이의 계면에 있을 때, 굽힘 이완 속도는 다음발현(38)에장착될 수 있다.

여기서 η버프는 완충점성, kBT는 열 에너지, θ이며 측정된 멤브레인(또는 선택적으로 유음된 시스템에서 멤브레인의 대조부분)의 굽힘 강성이다. 이러한 유형의 측정을 통해 구부러지는 강성 계수의 형태로 멤브레인 탄성 특성을 직접 계산할 수 있습니다. θ는 도 5C에도시된 바와 같이 Γ 대 Q3의선형 핏의 경사에서 추출된다.
한편, 막 두께 변동의 NSE 측정은 멤브레인 두께에 해당하는 Q값(참조)을 중심으로 Γ(Q)의 Q 3-의존성으로부터의편차를 나타낸다(참조 2 참조66). 두께 변동 신호를 격리하기 위해 도 5D와같이 Γ(Q)를 Q(Q)로나눌 수 있다. 결과 데이터는 두께 변동으로 인한 과도한 역학이 최근 거친 분자 역학(MD)시뮬레이션(MD) 시뮬레이션 67에서확증된 바와 같이 Q의Lorentzian 기능을 따른다는 것을 보여준다. 관찰된 과잉 역학에 맞추기 위해 나가오외(38)는 빙엄(80)에 의한 멤브레인 변동의 이론적 틀에 기초하여 다음과 같이 식을 개발하였다.

이 식에서, Q0은 멤브레인 두께(SANS 측정에서 독립적으로 얻을 수 있음)에 대응하는 피크 Q-값이며, μ 평면 멤브레인 점도, AL은 지질당 영역(SANS/SAXS로 측정됨) 및 KA는 영역 압축성 계수이다. KA가 폴리머 브러시 모델을 사용하여 θ로부터 계산될 수 있다고 가정하면, 이 표현은 하나의 맞는 파라미터, 즉 멤브레인 점도 μ감소시켜 형광 라벨링 또는 입자 테더링/추적(13)없이 멤브레인 점도를 측정하는 새로운 접근법을 제시한다. 전제는 탄성 얇은 시트(81)의변형 모델에 따라, θ 및 KA는 상호 의존적이라는 것입니다  :, tm이 기계적 (또는 변형 가능한) 멤브레인 두께및 β 인터리플렛 커플링을 설명하는 상수이다. 가정은 완전히 결합 된 전단지의 경우 β = 12, 완전히 결합되지 않은 전단지의 경우 β = 48, 중간 결합 된 전단지의 경우 β = 24가 가정합니다. 후자는 폴리머 브러쉬모델(81)이라고 하며 단일 성분 및 이진 유체 지질막(39)에적용하는 것으로 나타났다. 그러나, 이것은 주의해서 접근할 필요가 있습니다. 예를 들어, 독토로바 외의 최근시뮬레이션. 82는 중합체 브러시 모델이 콜레스테롤을 포함하는 불포화 지질 막에 보관하기 위해서는 기계적 멤브레인 두께의 변형된 발현을 사용해야 한다는 것을 보여주었다. 이상적으로, KA의 독립적인 측정이 가능하다면, 예를 들어, 마이크로파이펫 흡부제(83)를 사용하여, KA 결과를 NSE 굽힘 강성 측정과 결합하면 모델 및 생물학적 막에서 인터리플렛 커플링을 조사할 수 있는 독특한 기회가 주어질 것입니다 – 멤브레인 생물물리학 및 구조 생물학에 대한 오랜 질문. KA의 값이 검증되면, 그들은 중화막 점도를 얻기 위해 방정식 5에 사용할 수 있습니다.
:, tm이 기계적 (또는 변형 가능한) 멤브레인 두께및 β 인터리플렛 커플링을 설명하는 상수이다. 가정은 완전히 결합 된 전단지의 경우 β = 12, 완전히 결합되지 않은 전단지의 경우 β = 48, 중간 결합 된 전단지의 경우 β = 24가 가정합니다. 후자는 폴리머 브러쉬모델(81)이라고 하며 단일 성분 및 이진 유체 지질막(39)에적용하는 것으로 나타났다. 그러나, 이것은 주의해서 접근할 필요가 있습니다. 예를 들어, 독토로바 외의 최근시뮬레이션. 82는 중합체 브러시 모델이 콜레스테롤을 포함하는 불포화 지질 막에 보관하기 위해서는 기계적 멤브레인 두께의 변형된 발현을 사용해야 한다는 것을 보여주었다. 이상적으로, KA의 독립적인 측정이 가능하다면, 예를 들어, 마이크로파이펫 흡부제(83)를 사용하여, KA 결과를 NSE 굽힘 강성 측정과 결합하면 모델 및 생물학적 막에서 인터리플렛 커플링을 조사할 수 있는 독특한 기회가 주어질 것입니다 – 멤브레인 생물물리학 및 구조 생물학에 대한 오랜 질문. KA의 값이 검증되면, 그들은 중화막 점도를 얻기 위해 방정식 5에 사용할 수 있습니다.

도 1: NSE 계기 설계 및 시너지 효과는 중견 막 역학의 길이/시간 스케일과 겹칩니다. (A)NSE 기기의 다른 자기 요소의 회로도는, 왼쪽에서 오른쪽으로 악기를 통과하는 중성자의 스핀을 조작하는 데 사용된다. 강조된 중성자는 중성자와 시료 간의 에너지 교환으로 인한 스핀 방향(또는 편광 손실)의 변화를 나타내며, 투명한 중성자는 스핀 에코, 즉 에너지 교환제로 인해 중성자 스핀의 변화가 없음을 나타낸다. 회색 화살표는 분광계의 두 번째 팔을 회전하여 더 큰 산란 각도에 액세스 할 가능성을 나타냅니다. (B)지질 막에서 계층 역학의 회화 표현, 여러 길이와 시간 비늘에 걸쳐 다양한 동적 모드를 보여주는. 그늘진 영역은 NSE가 액세스하는 길이 및 시간 스케일을 나타내며, 이는 집단 멤브레인 변동, 즉 굽힘 및 두께 변동의 중형과 겹칩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 2: 지질 막에 대한 NSE 실험에서 가능한 중음 계획의 예. (A)왼쪽: 완전히 대조된 멤브레인, 예를 들어, 유정된 완충의 증식 막, 멤브레인 표면에 정상을 따라 NSLD 프로파일을 나타낸다. 멤브레인의 꼬리 영역(~0×10-2 Å-2)및 헤드그룹 영역(~4.5× 10-6 Å-2)의차이는 미결 버퍼를 가진 헤드그룹 수화에 기인한다. 오른쪽: 멤브레인의 탄화수소 꼬리 영역이 멤브레인 정상을 따라 해당 NSLD 프로파일에 도시된 것과 같이 멤브레인의 탄화수소 꼬리 영역이 완충과 동일한 NSLD를 가지는 것과 같은 꼬리 대비 일치 멤브레인. (B)도메인(가운데) 또는 매트릭스(왼쪽)가 버퍼와 대조를 이루는 두 개의 중성자 대비 방식을 가진 도메인 형성 멤브레인이 각각 행렬 또는 도메인 역학의 선택적 연구를 가능하게 한다. 이 수치는 니켈 등, JACS 201541에서수정되었습니다. (C)비대칭 멤브레인은 프로텍트 및 증식 지질 소포 사이의 사이클로덱스트린 교환에 의해 제조되어 다른 전단지를 유지하면서 하나의 멤브레인 전단지의 증식을 초래한다. 이를 통해 프로텍트 된 전단지의 굽힘 역학을 연구할 수 있으며 비대칭 멤브레인에서 반대 전단지 간의 기계적 커플링에 대한 통찰력을 제공합니다. 이 수치는 Rickeard 등, Nanoscale 202040에서수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 리포솜의 자동 압출을 위한 설정 의 예시. (A)주사기 펌프, 미니 압출기 세트 및 알루미늄/강철 프레임을 사용하여 맞춤형 자동 압출기가 순환 압출을 가능하게 합니다. (B)및(C)지질 현탁액의 시각적 외관의 차이를 나타내기 전(유백색) 및 후(투명 오팔 블루) 압출. 이것은 미크론 크기의 지질 스택 또는 가시광선의 파장의 순서보다 더 큰 거대한 소포의 초기 형성 때문입니다. 압출 후, 현탁액은 가시광선의 파장보다 작은 나노스코픽 소포(~100nm)로 구성되어 투명 현탁액을 산출합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 4: NSE 실험에서 대표적인 데이터 리포소말 서스펜션에 대한 대표적인 데이터. (A)단일 검출기 픽셀(패널 B의 표시 픽셀)에 대한 에코 신호의 예는 에코핏에 필요한 다양한 파라미터의 예와 함께 방정식(1)을 사용하여 에코 신호의 적합성을 보여준다. 에코 신호는 프로토콜의 4.7 단계에서 설명한 위상 전류 대신 위상 각의 함수로 플롯됩니다. (B)픽셀당 중성자 수의 변동을 나타내는 NSE 검출기 영상. 또한 이 이미지는 에코 신호가 좋지 않아 제거된 검출기 픽셀(녹색)을 보여줍니다. Q-arcs(Debye-Scherrer 링이라고도 함)에서 검출기 픽셀의 비닝은 NSE 데이터를 분석하고 해석하는 데 필요한 중간 산란 함수의 Q 의존성을 산출합니다. 이 수치는 애쉬카르, J. Appl. Phys. 202050에서수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 다른 중음 체계를 가진 리포소말 현탁액에 대한 NSE 실험의 대표적인 결과. (A)산란 각도, 2θ및 파벡터 전달을 나타내는 리포솜과 상호 작용하는 중성자의 산란 형상,  . (B)중간 산란 기능, S(Q,t)/ S(Q,0), 포리에 시간의 함수로서 부패를 나타낸다. 측정된 부패의 적합성은 방정식 3에 의해 주어진 확장된 지수 함수로 감소하여 이완률,Γ(Q)를산출한다. (C)유족 완충제에서 완전히 프로비티드된 리포솜의 경우,Γ(Q)는벤딩 역학의 전형적인 Q3 의존성을 따릅니다. 얻어진 데이터의 선형 피팅을 Zilman-Granek 모델에 맞추어 멤브레인의 굽힘 강성 계수를 산출합니다. (D)꼬리 중형 리포솜의 경우, 과도한 역학은 변동을 구부리는 것 외에도 관찰되며 멤브레인 두께에 해당하는 Q 값에서 가장 두드러집니다. Lorentzian 함수(방정식 5)에 과도한 역학을 장착하면 멤브레인 점도를 추출할 수 있습니다. 데이터 세트는 NIST의 NSE 분광계에서 수집되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
. (B)중간 산란 기능, S(Q,t)/ S(Q,0), 포리에 시간의 함수로서 부패를 나타낸다. 측정된 부패의 적합성은 방정식 3에 의해 주어진 확장된 지수 함수로 감소하여 이완률,Γ(Q)를산출한다. (C)유족 완충제에서 완전히 프로비티드된 리포솜의 경우,Γ(Q)는벤딩 역학의 전형적인 Q3 의존성을 따릅니다. 얻어진 데이터의 선형 피팅을 Zilman-Granek 모델에 맞추어 멤브레인의 굽힘 강성 계수를 산출합니다. (D)꼬리 중형 리포솜의 경우, 과도한 역학은 변동을 구부리는 것 외에도 관찰되며 멤브레인 두께에 해당하는 Q 값에서 가장 두드러집니다. Lorentzian 함수(방정식 5)에 과도한 역학을 장착하면 멤브레인 점도를 추출할 수 있습니다. 데이터 세트는 NIST의 NSE 분광계에서 수집되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
NSE는 다양한 조건에서 지질 막의 중각역학을 측정하는 강력하고 독특한 기술입니다. NSE의 효과적인 활용은 샘플 품질, 중성자 대비 및 지정된 샘플에 대해 조사할 수 있는 접근 가능한 역학의 범위에 따라 달라집니다. 따라서 성공적인 NSE 실험을 수행하고 고품질 데이터를 수집하려면 몇 가지 중요한 단계가 필요합니다. NSE 실험 중 중성자 빔 시간을 효과적으로 사용하는 데 있어 중요한 단계는 NSE 실험 전에 실험실 기반 방법으로 리포소말 현탁액을 특성화하는 것이다. 압출 리포솜의 크기 분포(또는 확산 상수)는 다이나믹 라이트 산란(DLS)에 의해 결정될 수 있으며, 개별 실험실이나 공유 시설에서 쉽게 사용할 수있다(84). 극저온 전자 현미경 검사는 최근 리포소말 샘플에서 검증된 또 다른 탄성술 법으로, 리포소말 현탁액의 극저온 미세화 섹션에 대한 고해상도 현미경 이미지가 효과적으로 리포소플루65, 도메인 형성85,86,또는 나노76입자 및87단백질과 같은 첨가제의 편조를 검사하는 데 사용될 수 있다. 대안적으로, 작은 각도 엑스레이 산란(SAXS)은 멤브레인구조(88)를특성화하거나, 리포소피 다암암(65)을 평가하거나, 멤브레인 구조 적특성에대한 첨가제의 효과를 평가하는 데 사용될 수 있다. 이러한 실험실 기반 기술 외에도 리포소말 샘플에 대한 NSE 측정이 작은 각도 중성자 산란(SANS)54,90을사용하여 구조 연구와 결합되는 것이 매우 바람직하다. SANS는 NSE에 우수한 보완을 제공하며, 구조 멤브레인 정보를 획득하는 것뿐만 아니라 시료로부터 중성자 산란 신호의 강도를 검사하고, 대비 체계를 확인하고, NSE 측정이 수행되어야 하는 Q-범위에 대한 정보에 입각한 선택을 하는 데 탁월한 보완이다. 따라서 NSE 사용자는 NSE 실험을 신청할 때 SANS 빔타임을 요청하는 것이 좋습니다.
그러나 NSE는 생물학적 막 연구에 대한 샘플 제한으로 고통받고 있습니다. 이러한 실험의 주요 제한 요인 중 하나는 NSE 측정(2-4 mL)과 고품질 의 데이터를 얻기 위해 100-200 mg의 멤브레인 재료 (지질 및 단백질)에 달하는 높은 샘플 농도에 필요한 표준 샘플 양입니다. 많은 경우에, 생물학적 물질의 이러한 양의 생산은 실현 가능하지 않거나 비용이 금지된다. 이러한 시나리오에서, 농도를 20-25 mg/mL로 줄일 수 있지만, 50 mg/mL 농도를 가진 샘플에 유사한 통계를 얻기 위해서는 획득 시간이 적어도 4배 증가해야 한다. 샘플 부피 및 농도에 대한 이러한 엄격한 요구 사항은 오크 리지 국립 연구소와 유럽 회전 소스의 두 번째 대상 스테이션과 같은 높은 플럭스 중성자 소스에 차세대 NSE 분광기로 완화 될 수 있습니다. 선택적 신기 계획을 요구하는 지질 막에 NSE 실험을 수행하는 또 다른 중요한 제한은 지질 분자또는 그들의 엄청난 가격의 일부 증단한 변이체의 상업적 인 availabilty의 부족입니다, 가능한 경우. 경우에 따라 이러한 제한은 오크 리지 국립 연구소의 바이오 신도 실험실, ANSTO의 국가 중성술 시설 또는 ISIS 중성자 및 무온 소스의 중음제 연구소와 같은 사용자 중음 시설을 통해 중성 지질 (또는 콜레스테롤, 단백질)의 합성을 요청함으로써 우회 될 수 있습니다. 이러한 시설과 합성 기능에 대한 액세스는 제안 된 재료 합성의 과학적 장점과 동위원소 에 민감한 연구에서 의도 된 사용에 따라 동료 검토 제출 된 사용자 제안을 통해 사용할 수 있습니다.
이러한 한계에도 불구하고, 멤브레인 역학의 연구에 NSE 분광기의 적용은 단일 성분지질 막35,38에서 다성분 생체 모방 막41,66,91에이르기까지 다양한 정도의 복잡성을 가진 멤브레인의 굽힘 강성 계측의 결정으로 이어졌으며, 모두 지질 막의 동적 특성에 대한 이해를 발전시켰습니다. 예를 들어, NSE 굴곡 강성 측정은 다른 분자 단위, 예를 들어, 다른 아실 사슬 길이및 사슬 채도38,72,92의지질을 갖는 지질 막의 강성 측정을 멤브레인 역학에서 분자 화학의 역할에 대한 필수적인 정보를 제공했습니다. 멤브레인 두께 또는 분자포장(93)과같은 구조적 정보와 결합할 때, 이러한 측정은 멤브레인 구조와 역학 간의 상호 의존성 및 멤브레인 기능에 미치는 영향에 대한 새로운 관점을 제공하기 시작합니다. NSE의 중견구는 분자 어셈블리의 길이 규모에 가장 관련이 있는 구조-특성 관계의 이러한 근본적인 조사를 위해 고유하게 배치합니다. 이 주제는 최근 콜레스테롤이 풍부한 지질 막에 대한 두 가지 NSE 연구에서 탐구되었다36 두 지질 성분 사이의 소수성 불일치와 이진 지질막에서 39. 두 연구 모두 멤브레인 역학이 지질 당 영역으로 확장한다는 강력한 증거를 발견, 독토로바 외에 의해 최근 모든 원자 MD 시뮬레이션에서 결론을 확증82. 이러한 사실 인정은 지질 막의 자기 조립된 특성을 강조하고 막 역학 및 기능적 특성을 정의하는 핵심 매개 변수로서 분자 포장의 통일된 그림을 제공합니다.
NSE의 다른 응용 분야는 콜레스테롤36,37,트레할로오스92,멜리틴 73,94,또는 약물 전달 응용 을 위한 나노 입자와 같은 무기 첨가제(76)와같은 생물학적 분자를 포함한 작은 첨가제에 대한 멤브레인 반응의 기계적 반응에 대한 연구를 포함한다. NSE는 또한 온도92,pH74,및 혼잡 거대분자96의존재를 포함하여 그들의 환경의 변화에 막 역학이 어떻게 반응하는지 이해하는 데 사용되었습니다. 이러한 연구는 지질 막의 연화 또는 경직에 영향을 미치는 요인의 더 나은 이해에 기여, 건강과 질병과 관련된 생물학적 조건하에서, 치료 응용 프로그램에 대한 제어 설정에서. 특히, NSE 측정은 또한 멤브레인 역학에 대한 항균 펩티드의 효과를 조사하는 데 사용되어 왔다73,94,95. 생물막에 대한 NSE 응용 프로그램의 추가 예로는 시아노균 세포97,98의광합성 기계가 있는 틸라코이드(thylakoids)라고 불리는 평평한 멤브레인 구조의 역학에 대한 연구가 포함됩니다.
하나는 또한 NSE 연구에서 선택적 지질 신증을 활용하여 생물학적 기능과 관련된 특정 멤브레인 기능의 역학을 조사할 수 있습니다. 예를 들어, 니켈 외.는 이전에 Heberle et al.28에의해 예시된 바와 같이, 멤브레인 내의 측면 대조를 생성하기 위해 도메인 형성 지질 막에서 선택적 지질 신증을 사용했다. 이 중음 제곱은 지질 도메인과 숙주 지질매트릭스(41)의 굽힘 강성의 독립적인 측정을 가능하게 했다(그림 2B참조). 연구 결과는 2개의 멤브레인 구획이 세포 막에 있는 도메인 대형을 위한 운전 기계장치가 될 수 있던 뚜렷한 굽힘 강성 moduli가 있다는 것을 확인했습니다. 최근 연구에서, Rickeard 외. 동위원소 표지 전단지와 비대칭 리포좀을 얻기 위해 protiated 및 증식 리포솜 사이 사이클로덱스트린 교환을 사용(도 2C). 그들의 끝 리포솜은 버퍼와 일치하는 프로텍트 된 전단지와 미결 된 전단지를 가지고 있어 개별 전단지 역학에 대한 연구를 가능하게하고 멤브레인 굽힘 변동에 대한 비대칭 및 전단지 커플링의 효과에 대한 첫 번째 직접 실험 계정을 제공합니다.
선택적 막 중음은 또한 막 두께 변동의 NSE 연구에서 사용되어 왔으며, 지질막(99)에서 긴 예측 된 동적 모드는 NSE 분광법35,100의출현으로 최근에 관찰되었다. 이러한 측정은 꼬리 유족 멤브레인을 활용하여 멤브레인 헤드그룹 영역으로부터 신호를 증폭시키고 두께 변동 신호를 해결합니다. 이러한 유형의 NSE 실험은 비교적 최근이지만, 효과적으로 멤브레인탄성 및 점성특성(38)의상호 의존성을 이해하고, 혼합 지질막(39)에서분자 포장을 이용한 굽힘 강성과 점도의 스케일링을 탐구하고, 멤브레인점도(36)에대한 콜레스테롤의 국소적 효과를 탐구하기 위해 효과적으로 사용되어 왔다. 이 동적 모드가 광범위한 의미를 가질 수있는 생물학적 중요성의 또 다른 영역은 중화 막 단백질 상호 작용95입니다. 막 단백질의 기능은 단백질과 숙주 막 사이의 소수성 매칭에 단단히 연결되어 있는 것으로 알려져 있다. 따라서, 막 두께의 변이는 두께 변동으로 인해 막 단백질의 기능에 대한 조절 메커니즘으로 작용할 수 있다. NSE는 단백질 결합및 막 두께 변동에 대한 삽입의 효과를 직접 조사 할 수 있기 때문에 이러한 연구에 매우 적합합니다. 우리의 단 (미공개)에서 최근 NSE 측정은 막 단백질 삽입이 막 두께 변동을 현저하게 억제하고 신호 이벤트를 조절하기위한 잠재적 인 메커니즘을 제시 할 수 있음을 시사한다. 이것은 NSE가 세포막과 단백질의 상호 작용에 의해 부여된 주요 생물학 기능의 길이 및 시간 규모에 단백질 결합 및 삽입에 막의 동적 반응을 이해하는 데 상당한 영향을 미칠 수있는 연구의 절박하면서도 저개발된 영역입니다.
요약하자면, NSE는 지난 몇 년 동안 중요한 생물학적 기능의 공간 및 현세적 비늘을 통해 막 역학을 심문하는 강력한 도구로 발전해 왔습니다. 이 기술은 빠르게 광범위한 관심을 얻고 있으며 멤브레인 기능의 주요 질문에 대답할 수있는 잠재력이 잘 인식되고 있습니다. NSE 내의 콘트라스트 변이 기능은 그렇지 않으면 얻기 어려울 수 있는 중각 막 특성을 측정하는 독특한 접근법으로 자리매김했습니다. 멤브레인 역학 의 연구에서 기존의 분광법 방법보다 NSE의 또 다른 중요한 장점은 MD 시뮬레이션에 액세스 할 수있는 길이와 시간 척도와 겹쳐져 시너지 실험 / 계산 연구를 통해 멤브레인을 구성하는 다양한 분자 구성 요소에 대한 분자 수준의 이해를 얻을 수 있다는 것입니다. 그 약속에도 불구하고, 생물학적 막 연구에서 NSE의 사용에 여전히 몇 가지 제한이 있다, 대량 샘플 볼륨에 대 한 요구 사항을 포함 하 여, 생물학적 시스템에 선택적 중성자 유동성의 어려움, 그리고 NSE 분광계에 상대적으로 낮은 중성자 플럭스, 더 긴 측정 시간과 제한된 빔 타임 가용성 결과. 그러나 이러한 단점은 중성자 소스및 계측의 지속적인 발전과 중성자 시설의 발전으로 가까운 장래에 극복 될 수 있습니다.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
저자는 이해 상충을 선언하지 않으며 공개 할 것이 없습니다.
Acknowledgments
R. 아쉬카르 감사 M. 나가오, L.-R. Stingaciu, 그리고 P. Zolnierczuk 많은 유용한 토론과 그들의 각각의 빔라인에 NSE 실험에 그들의 빈번한 지원에 대 한. 저자는 NIST와 ORNL에서 중성자 스핀 에코 분광기의 사용을 인정합니다. NIST의 NSE 분광기는 국가 표준 기술 연구소와 국가 과학 재단 간의 파트너십인 고해상도 중성자 산란 센터의 지원을 받고 있습니다. DMR-1508249. ORNL의 Spallation 중성자 소스의 NSE 분광기는 미국 에너지부 기초 에너지 과학 부서인 과학 사용자 시설 부서에서 지원됩니다. 오크 리지 국립 연구소는 UT-Battelle에 의해 관리됩니다, 미국 DOE 계약 번호에 따라 LLC. DE-AC05-00OR22725.
Materials
| Name | Company | Catalog Number | Comments |
| Chloroform (biotech grade) | Sigma Aldrich | 496189 | Biotech. grade, ≥99.8%, contains 0.5-1.0% ethanol as stabilizer |
| Circulating water bath | Julabo | SE-12 | Heating Circulator with smart pump, programmable temperature settings, and external sensor connection for measurement and control |
| Deuterium Oxide | Cambridge Isotopes Laboratories | DLM-4 | Deuterated water; Heavy water (D2O) (D, 99.9%) |
| Digital Semi-Microbalance | Mettler Toledo | MS105 | Semi-micro balance with 120 g capacity, 0.01 mg readability, high resolution weighing cell, ergonomic doors, and pipette-check application |
| Ethanol (molecular biology grade) | Sigma Aldrich | E7023 | 200 proof ethanol for molecular biology applications |
| Glass Pipets | VWR | 36360-536 | Disposable Soda Lime glass Pasteur pipets |
| Glass Vials | Thermo Scientific | B7990-1 | Borosilicate glass vials with PTFE/Silione septum caps |
| Lab grade freezer | Fisher Scientific | IU2886D | Ultra-low temprature freezer (-86 to -50 C) for long-term storage of lipids and proteins |
| Lipids (protaited or perdeuterated) | Avanti Polar Lipids | varies by lipid | Lipids can be purchased from Avanti in powder form or in a chloroform solution with the required amounts and deuteration schemes. |
| Millipore water purifier | Millipore Sigma | ZRQSVP3US | Direct-Q® 3 UV Water Purification System which deliver both pure and ultrapure water with a built-in UV lamp to reduce the levels of organics for biological applications |
| Mini Extruder Set | Avanti Polar Lipids | 610020 | Mini-extruder set includes mini-extruder, heating block, 2 GasTight Syringes, and 2 O-rings, Polycarbonate Membranes, and Filter Supports |
| Quick Connect Fittings | Grainger | 2YDA1 and 2YDA7 | Push-button tube fittings for QuickConnect water circulation applications, e.g. high temperature vesicle extrusion |
| Syringe Pump | SyringePump.com | New Era-1000 | Fully programmable syringe pump for infusion and withdrawal; programs up to 41 pumping phases with adjustable pumping rates, dispensed volumes, and extrusion cycles |
| Ultrasonic bath | Fisher Scientific | CPX2800 | Temperature controlled ultra sonic bath with programmable functionality for degassing and ultrasonic applications |
| Vacuum Oven | Thermo Scientific | 3608 | 0.7 cu ft vaccum oven with built-in-high-limit thermostat guards against overheating |
| Vortex Mixer | Fisher Scientific | 02-215-414 | Variable speed, analog control that allows low rpm start-up for gentle shaking or high-speed mixing for vigorous vortexing of samples |
References
- Singer, S. J., Nicolson, G. L. The fluid mosaic model of the structure of cell membranes. Science. 175 (4023), 720-731 (1972).
- Andersen, O. S., Koeppe, R. E. Bilayer thickness and membrane protein function: an energetic perspective. Annual Review of Biophysics and Biomolecular Structure. 36, 107-130 (2007).
- Lundbæk, J. A., Collingwood, S. A., Ingólfsson, H. I., Kapoor, R., Andersen, O. S. Lipid bilayer regulation of membrane protein function: gramicidin channels as molecular force probes. Journal of The Royal Society Interface. 7 (44), 373-395 (2010).
- Bradley, R. P., Radhakrishnan, R. Curvature-undulation coupling as a basis for curvature sensing and generation in bilayer membranes. Proceedings of the National Academy of Sciences of the United States of America. 113 (35), 117-124 (2016).
- Perozo, E., Cortes, D. M., Sompornpisut, P., Kloda, A., Martinac, B. Open channel structure of MscL and the gating mechanism of mechanosensitive channels. Nature. 418 (6901), 942-948 (2002).
- Jensen, M. Ø, Mouritsen, O. G. Lipids do influence protein function-the hydrophobic matching hypothesis revisited. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1666 (1-2), 205-226 (2004).
- Rajendran, L., Simons, K. Lipid rafts and membrane dynamics. Journal of Cell Science. 118 (6), 1099-1102 (2005).
- Katchalsky, A., Spangler, R. Dynamics of membrane processes. Quarterly Reviews of Biophysics. 1 (2), 127-175 (1968).
- Rheinstädter, M. C. Collective molecular dynamics in proteins and membranes (Review). Biointerphases. 3 (2), 83-90 (2008).
- Fujiwara, T., Ritchie, K., Murakoshi, H., Jacobson, K., Kusumi, A. Phospholipids undergo hop diffusion in compartmentalized cell membrane. The Journal of Cell Biology. 157 (6), 1071-1082 (2002).
- Hac, A. E., Seeger, H. M., Fidorra, M., Heimburg, T. Diffusion in two-component lipid membranes--a fluorescence correlation spectroscopy and monte carlo simulation study. Biophysical Journal. 88 (1), 317-333 (2005).
- Heinrich, M., Tian, A., Esposito, C., Baumgart, T. Dynamic sorting of lipids and proteins in membrane tubes with a moving phase boundary. Proceedings of the National Academy of Sciences of the United States of America. 107 (16), 7208-7213 (2010).
- Hormel, T. T., Kurihara, S. Q., Brennan, M. K., Wozniak, M. C., Parthasarathy, R. Measuring lipid membrane viscosity using rotational and translational probe diffusion. Physical Review Letters. 112 (18), 188101 (2014).
- Dimova, R. Recent developments in the field of bending rigidity measurements on membranes. Advances in Colloid and Interface Science. 208, 225-234 (2014).
- Bassereau, P., Sorre, B., Lévy, A. Bending lipid membranes: Experiments after W. Helfrich's model. Advances in Colloid and Interface Science. 208, 47-57 (2014).
- Monzel, C., Sengupta, K. Measuring shape fluctuations in biological membranes. Journal of Physics D: Applied Physics. 49 (24), 243002 (2016).
- Deserno, M. Mesoscopic membrane physics: concepts, simulations, and selected applications. Macromolecular Rapid Communications. 30 (9-10), 752-771 (2009).
- Reynwar, B. J., et al. Aggregation and vesiculation of membrane proteins by curvature-mediated interactions. Nature. 447 (7143), 461-464 (2007).
- Haswell, E. S., Phillips, R., Rees, D. C. Mechanosensitive channels: what can they do and how do they do it. Structure. 19 (10), 1356-1369 (2011).
- Phillips, R., Ursell, T., Wiggins, P., Sens, P. Emerging roles for lipids in shaping membrane-protein function. Nature. 459 (7245), 379-385 (2009).
- Dill, K. A., Chan, H. S. From Levinthal to pathways to funnels. Nature Structural Biology. 4 (1), 10-19 (1997).
- Henzler-Wildman, K., Kern, D. Dynamic personalities of proteins. Nature. 450 (7172), 964-972 (2007).
- Grimaldo, M., Roosen-Runge, F., Zhang, F., Schreiber, F., Seydel, T. Dynamics of proteins in solution. Quarterly Reviews of Biophysics. 52, 7 (2019).
- Lyman, E., Hsieh, C. -L., Eggeling, C. From dynamics to membrane organization: experimental breakthroughs occasion a "modeling manifesto". Biophysical Journal. 115 (4), 595-604 (2018).
- Arriaga, L. R., et al. Dissipative curvature fluctuations in bilayer vesicles: Coexistence of pure-bending and hybrid curvature-compression modes. The European Physical Journal. E, Soft Matter. 31 (1), 105-113 (2010).
- Honerkamp-Smith, A. R., Veatch, S. L., Keller, S. L. An introduction to critical points for biophysicists; observations of compositional heterogeneity in lipid membranes. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1788 (1), 53-63 (2009).
- Veatch, S. L., Keller, S. L. Organization in lipid membranes containing cholesterol. Physical Review Letters. 89 (26), 268101 (2002).
- Heberle, F. A., et al. Bilayer thickness mismatch controls domain size in model membranes. Journal of the American Chemical Society. 135 (18), 6853-6859 (2013).
- Nickels, J. D., et al. The in vivo structure of biological membranes and evidence for lipid domains. PLOS Biology. 15 (5), 2002214 (2017).
- Simons, K., Ikonen, E. Functional rafts in cell membranes. Nature. 387 (6633), 569-572 (1997).
- van Meer, G., Voelker, D. R., Feigenson, G. W. Membrane lipids: where they are and how they behave. Nature Reviews. Molecular Cell Biology. 9 (2), 112-124 (2008).
- Liu, S. -L., et al. Orthogonal lipid sensors identify transbilayer asymmetry of plasma membrane cholesterol. Nature Chemical Biology. 13, 268 (2016).
- Rothman, J., Lenard, J. Membrane asymmetry. Science. 195 (4280), 743-753 (1977).
- Ashkar, R., et al. Neutron scattering in the biological sciences: progress and prospects. Acta Crystallographica Section D. 74 (12), 1129-1168 (2018).
- Woodka, A. C., Butler, P. D., Porcar, L., Farago, B., Nagao, M. Lipid bilayers and membrane dynamics: insight into thickness fluctuations. Physical Review Letters. 109 (5), 058102 (2012).
- Chakraborty, S., et al. How cholesterol stiffens unsaturated lipid membranes. Proceedings of the National Academy of Sciences of the United States of America. 117 (36), 21896-21905 (2020).
- Arriaga, L. R., et al. Stiffening effect of cholesterol on disordered lipid phases: a combined neutron spin echo + dynamic light scattering analysis of the bending elasticity of large unilamellar vesicles. Biophysical Journal. 96 (9), 3629-3637 (2009).
- Nagao, M., Kelley, E. G., Ashkar, R., Bradbury, R., Butler, P. D. Probing elastic and viscous properties of phospholipid bilayers using neutron spin echo spectroscopy. The Journal of Physical Chemistry Letters. 8 (19), 4679-4684 (2017).
- Kelley, E. G., Butler, P. D., Ashkar, R., Bradbury, R., Nagao, M. Scaling relationships for the elastic moduli and viscosity of mixed lipid membranes. Proceedings of the National Academy of Sciences of the United States of America. 117 (38), 23365-23373 (2020).
- Rickeard, B. W., et al. Transverse lipid organization dictates bending fluctuations in model plasma membranes. Nanoscale. 12 (3), 1438-1447 (2020).
- Nickels, J. D., et al. Mechanical properties of nanoscopic lipid domains. Journal of the American Chemical Society. 137 (50), 15772-15780 (2015).
- Mezei, F. Neutron spin echo: A new concept in polarized thermal neutron techniques. Zeitschrift für Physik A Hadrons and Nuclei. 255 (2), 146-160 (1972).
- Hayter, J. B., Penfold, J. Neutron spin-echo integral transform spectroscopy. Zeitschrift für Physik B Condensed Matter. 35 (2), 199-205 (1979).
- Monkenbusch, M., Richter, D. Neutrons in Soft Matter. Imae, T., Kanaya, T., Furusaka, M., Torikai, N. , Wiley. ch6 147-182 (2011).
- Pynn, R. Neutron Spin Echo. Mezei, F., Pappas, C., Gutberlet, T. , Springer. Berlin Heidelberg. 159-177 (2003).
- Holderer, O., et al. The JCNS neutron spin-echo spectrometer J-NSE at the FRM II. Measurement Science and Technology. 19 (3), 034022 (2008).
- Schleger, P., et al. The long-wavelength neutron spin-echo spectrometer IN15 at the Institut Laue-Langevin. Physica B: Condensed Matter. 241-243, 164-165 (1997).
- Holderer, O., Zolnierczuk, P., Pasini, S., Stingaciu, L., Monkenbusch, M. A better view through new glasses: Developments at the Jülich neutron spin echo spectrometers. Physica B: Condensed Matter. 562, 9-12 (2019).
- Farago, B., et al. The IN15 upgrade. Neutron News. 26 (3), 15-17 (2015).
- Ashkar, R. Selective dynamics in polymeric materials: Insights from quasi-elastic neutron scattering spectroscopy. Journal of Applied Physics. 127 (15), 151101 (2020).
- Pasini, S., Holderer, O., Kozielewski, T., Richter, D., Phoenix Monkenbusch, M. J-NSE- Phoenix, a neutron spin-echo spectrometer with optimized superconducting precession coils at the MLZ in Garching. Review of Scientific Instruments. 90 (4), 043107 (2019).
- Svergun, D. I., Koch, M. H. J., Timmins, P. A., May, R. P. Small Angle X-Ray and Neutron Scattering from Solutions of Biological Macromolecules. , Oxford University Press. (2013).
- Eicher, B., et al. Joint small-angle X-ray and neutron scattering data analysis of asymmetric lipid vesicles. Journal of Applied Crystallography. 50 (2), 419-429 (2017).
- Heberle, F. A., et al. Model-based approaches for the determination of lipid bilayer structure from small-angle neutron and X-ray scattering data. European Biophysics Journal. 41 (10), 875-890 (2012).
- Jaksch, S., Koutsioubas, A., Mattauch, S., Holderer, O., Frielinghaus, H. Long-range excitations in phospholipid membranes. Chemistry and Physics of Lipids. 225, 104788 (2019).
- Jaksch, S., et al. Influence of ibuprofen on phospholipid membranes. Physical Review E. 91 (2), 022716 (2015).
- Armstrong, C. L., et al. Effect of cholesterol on the lateral nanoscale dynamics of fluid membranes. European Biophysics Journal. 41 (10), 901-913 (2012).
- Rheinstädter, M. C., Häußler, W., Salditt, T. Dispersion relation of lipid membrane shape fluctuations by neutron spin-echo spectrometry. Physical Review Letters. 97 (4), 048103 (2006).
- Armstrong, C. L., Häußler, W., Seydel, T., Katsaras, J., Rheinstädter, M. C. Nanosecond lipid dynamics in membranes containing cholesterol. Soft Matter. 10 (15), 2600-2611 (2014).
- Nickels, J. D., et al. Lipid rafts: buffers of cell membrane physical properties. The Journal of Physical Chemistry B. 123 (9), 2050-2056 (2019).
- Michonova-Alexova, E. I., Sugár, I. P. Component and state separation in DMPC/DSPC lipid bilayers: a Monte Carlo simulation study. Biophysical Journal. 83 (4), 1820-1833 (2002).
- Sugár, I. P., Thompson, T. E., Biltonen, R. L. Monte Carlo simulation of two-component bilayers: DMPC/DSPC mixtures. Biophysical Journal. 76 (4), 2099-2110 (1999).
- Mabrey, S., Sturtevant, J. M. Investigation of phase transitions of lipids and lipid mixtures by sensitivity differential scanning calorimetry. Proceedings of the National Academy of Sciences. 73 (11), 3862-3866 (1976).
- Neutron activation and scattering calculator. , Available from: https://www.ncnr.nist.gov/resources/activation/ (2021).
- Scott, H. L., et al. On the mechanism of bilayer separation by extrusion, or why your LUVs are not really unilamellar. Biophysical Journal. 117 (8), 1381-1386 (2019).
- Ashkar, R., et al. Tuning membrane thickness fluctuations in model lipid bilayers. Biophysical Journal. 109 (1), 106-112 (2015).
- Carrillo, J. -M. Y., Katsaras, J., Sumpter, B. G., Ashkar, R. A computational approach for modeling neutron scattering data from lipid bilayers. Journal of Chemical Theory and Computation. 13 (2), 916-925 (2017).
- Azuah, R. T. DAVE: a comprehensive software suite for the reduction, visualization, and analysis of low energy neutron spectroscopic data. Journal of Research of the National Institute of Standards and Technology. 114 (6), 341-358 (2009).
- Van Hove, L. Correlations in space and time and born approximation scattering in systems of interacting particles. Physical Review. 95 (1), 249-262 (1954).
- Zilman, A. G., Granek, R. Undulations and dynamic structure factor of membranes. Physical Review Letters. 77 (23), 4788-4791 (1996).
- Kelley, E. G., Butler, P. D., Nagao, M. Collective dynamics in model biological membranes measured by neutron spin echo spectroscopy. , Walter de Gruyter, Inc. 131-176 (2019).
- Zheng, Y., Michihiro, N., Dobrin, P. B. Bending elasticity of saturated and monounsaturated phospholipid membranes studied by the neutron spin echo technique. Journal of Physics: Condensed Matter. 21 (15), 155104 (2009).
- Sharma, V. K., Qian, S. Effect of an antimicrobial peptide on lateral segregation of lipids: a structure and dynamics study by neutron scattering. Langmuir. 35 (11), 4152-4160 (2019).
- Boggara, M. B., Faraone, A., Krishnamoorti, R. Effect of pH and Ibuprofen on the Phospholipid Bilayer Bending Modulus. The Journal of Physical Chemistry B. 114 (24), 8061-8066 (2010).
- Lee, J. -H., et al. Thermal fluctuation and elasticity of lipid vesicles interacting with pore-forming peptides. Physical Review Letters. 105 (3), 038101 (2010).
- Chakraborty, S., Abbasi, A., Bothun, G. D., Nagao, M., Kitchens, C. L. Phospholipid bilayer softening due to hydrophobic gold nanoparticle inclusions. Langmuir. 34 (44), 13416-13425 (2018).
- Hoffmann, I., et al. Softening of phospholipid membranes by the adhesion of silica nanoparticles - as seen by neutron spin-echo (NSE). Nanoscale. 6 (12), 6945-6952 (2014).
- Watson, M. C., Brown, F. L. H. Interpreting membrane scattering experiments at the mesoscale: the contribution of dissipation within the bilayer. Biophysical Journal. 98 (6), 9-11 (2010).
- Seifert, U., Langer, S. A. Viscous modes of fluid bilayer membranes. Europhysics Letters (EPL). 23 (1), 71-76 (1993).
- Bingham, R. J., Smye, S. W., Olmsted, P. D. Dynamics of an asymmetric bilayer lipid membrane in a viscous solvent. EPL (Europhysics Letters). 111 (1), 18004 (2015).
- Rawicz, W., Olbrich, K. C., McIntosh, T., Needham, D., Evans, E. Effect of chain length and unsaturation on elasticity of lipid bilayers. Biophysical Journal. 79 (1), 328-339 (2000).
- Doktorova, M., LeVine, M. V., Khelashvili, G., Weinstein, H. A new computational method for membrane compressibility: bilayer mechanical thickness revisited. Biophysical Journal. 116 (3), 487-502 (2019).
- Evans, E., Needham, D. Physical properties of surfactant bilayer membranes: thermal transitions, elasticity, rigidity, cohesion and colloidal interactions. The Journal of Physical Chemistry. 91 (16), 4219-4228 (1987).
- Lesieur, S., Grabielle-Madelmont, C., Paternostre, M. T., Ollivon, M. Size analysis and stability study of lipid vesicles by high-performance gel exclusion chromatography, turbidity, and dynamic light scattering. Analytical Biochemistry. 192 (2), 334-343 (1991).
- Heberle, F. A., et al. Direct label-free imaging of nanodomains in biomimetic and biological membranes by cryogenic electron microscopy. Proceedings of the National Academy of Sciences of the United States of America. 117 (33), 19943-19952 (2020).
- Cornell, C. E., Mileant, A., Thakkar, N., Lee, K. K., Keller, S. L. Direct imaging of liquid domains in membranes by cryo-electron tomography. Proceedings of the National Academy of Sciences of the United States of America. 117 (33), 19713-19719 (2020).
- Yao, X., Fan, X., Yan, N. Cryo-EM analysis of a membrane protein embedded in the liposome. Proceedings of the National Academy of Sciences of the United States of America. 117 (31), 18497-18503 (2020).
- Kučerka, N., Nieh, M. -P., Katsaras, J. Fluid phase lipid areas and bilayer thicknesses of commonly used phosphatidylcholines as a function of temperature. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1808 (11), 2761-2771 (2011).
- Nielsen, J. E., Bjørnestad, V. A., Lund, R. Resolving the structural interactions between antimicrobial peptides and lipid membranes using small-angle scattering methods: the case of indolicidin. Soft Matter. 14 (43), 8750-8763 (2018).
- Kučerka, N., et al. Lipid bilayer structure determined by the simultaneous analysis of neutron and X-ray scattering data. Biophysical Journal. 95 (5), 2356-2367 (2008).
- Kelley, E. G., Butler, P. D., Nagao, M. Scaling of lipid membrane rigidity with domain area fraction. Soft Matter. 15 (13), 2762-2767 (2019).
- Brüning, B. -A., et al. Bilayer undulation dynamics in unilamellar phospholipid vesicles: Effect of temperature, cholesterol and trehalose. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1838 (10), 2412-2419 (2014).
- Kučerka, N., et al. Areas of monounsaturated diacylphosphatidylcholines. Biophysical Journal. 97 (7), 1926-1932 (2009).
- Sharma, V. K., Mamontov, E., Anunciado, D. B., O'Neill, H., Urban, V. S. Effect of antimicrobial peptide on the dynamics of phosphocholine membrane: role of cholesterol and physical state of bilayer. Soft Matter. 11 (34), 6755-6767 (2015).
- Kelley, E. G., Butler, P. D., Nagao, M. Collective dynamics in lipid membranes containing transmembrane peptides. Soft Matter. , (2021).
- Yu, J., et al. Structure and dynamics of lipid membranes interacting with antivirulence end-phosphorylated polyethylene glycol block copolymers. Soft Matter. 16 (4), 983-989 (2020).
- Stingaciu, L. -R., et al. Revealing the dynamics of thylakoid membranes in living cyanobacterial cells. Scientific Reports. 6 (1), 19627 (2016).
- Stingaciu, L. -R., O'Neill, H. M., Liberton, M., Pakrasi, H. B., Urban, V. S. Influence of chemically disrupted photosynthesis on cyanobacterial thylakoid dynamics in synechocystis sp. PCC 6803. Scientific Reports. 9 (1), 5711 (2019).
- Miller, I. R. Energetics of fluctuation in lipid bilayer thickness. Biophysical Journal. 45 (3), 643-644 (1984).
- Nagao, M. Observation of local thickness fluctuations in surfactant membranes using neutron spin echo. Physical Review E. 80 (3), 031606 (2009).
Tags
생물학 문제 171 집단 지질 역학 굽힘 변성 영역 압축성 두께 변동 멤브레인 점도 선택적 신증 리포솜 제제Erratum
Formal Correction: Erratum: Neutron Spin Echo Spectroscopy as a Unique Probe for Lipid Membrane Dynamics and Membrane-Protein Interactions
Posted by JoVE Editors on 08/06/2021.
Citeable Link.
An erratum was issued for: Neutron Spin Echo Spectroscopy as a Unique Probe for Lipid Membrane Dynamics and Membrane-Protein Interactions. The Introduction, Protocol, and Representative Results sections have been updated.
In the Introduction, the fith pargraph was updated from:
Besides direct access to the length and time scale of membrane dynamics, NSE has the inherent capabilities of neutron isotope sensitivity52. Specifically, the ability of neutrons to interact differently with the isotopes of hydrogen, the most abundant element in biological systems, results in a different neutron scattering length density,34 or NSLD (the equivalent of the optical index of refraction50), when protium is substituted by deuterium. This enables an approach known as contrast variation, which is commonly used to highlight specific membrane features or conceal others — the latter scenario is referred to as contrast matching. A frequent application of contrast variation/matching is the substitution of water (NSLD = -0.56 × 10-6 Å-2) by heavy water or D2O (NSLD = 6.4 × 10-6 Å-2) to amplify the neutron signal from protiated lipid membranes (NSLD ~ 2 × 10-6 Å-2). This approach is highly effective in studies of membrane structure because the penetration of D2O into the headgroup region of the membrane allows accurate determination of the membrane thicknesses (see Figure 2A, left panel) and of the location of different lipid subgroups when more sophisticated models are applied53,54. This paper highlights some examples on the use of contrast variation for studies of collective dynamics in biomimetic membranes and select membrane features.
to:
Besides direct access to the length and time scale of membrane dynamics, NSE has the inherent capabilities of neutron isotope sensitivity52. Specifically, the ability of neutrons to interact differently with the isotopes of hydrogen, the most abundant element in biological systems, results in a different neutron scattering length density,34 or NSLD (the equivalent of the optical index of refraction50), when protium is substituted by deuterium. This enables an approach known as contrast variation, which is commonly used to highlight specific membrane features or conceal others — the latter scenario is referred to as contrast matching. A frequent application of contrast variation/matching is the substitution of water (NSLD = -0.56 × 10-6 Å-2) by heavy water or D2O (NSLD = 6.4 × 10-6 Å-2) to amplify the neutron signal from protiated lipid membranes (NSLD ~ 0 × 10-6 Å-2). This approach is highly effective in studies of membrane structure because the penetration of D2O into the headgroup region of the membrane allows accurate determination of the membrane thicknesses (see Figure 2A, left panel) and of the location of different lipid subgroups when more sophisticated models are applied53,54. This paper highlights some examples on the use of contrast variation for studies of collective dynamics in biomimetic membranes and select membrane features.
In the Protocol, step 1.1 was updated from:
For bending fluctuation measurements, make fully protiated liposomes in D2O (D 99.9%) or D2O-buffer (e.g., phosphate buffer prepared with D2O instead of H2O). Use fully protiated DMPC (C36H72NO8P) and DSPC (C44H88NO8P) with  133.4 mg, where XDMPC and XDSPC are the mole fractions of DMPC and DSPC, here set to 0.7 and 0.3, respectively, and MwDMPC and MwDSPC are the molar weights given by 677.9 g/mol and 790.1 g/mol, respectively. Similarly, mDSPC = 66.6 mg. This deuteration scheme increases the scattering contrast between the membrane (NSLD ~ 2 × 10-6 Å-2) and the deuterated buffer (NSLD ~ 6.4 × 10-6 Å-2) and amplifies the signal from membrane undulations (see Figure 2A left panel).
133.4 mg, where XDMPC and XDSPC are the mole fractions of DMPC and DSPC, here set to 0.7 and 0.3, respectively, and MwDMPC and MwDSPC are the molar weights given by 677.9 g/mol and 790.1 g/mol, respectively. Similarly, mDSPC = 66.6 mg. This deuteration scheme increases the scattering contrast between the membrane (NSLD ~ 2 × 10-6 Å-2) and the deuterated buffer (NSLD ~ 6.4 × 10-6 Å-2) and amplifies the signal from membrane undulations (see Figure 2A left panel).
to:
For bending fluctuation measurements, make fully protiated liposomes in D2O (D 99.9%) or D2O-buffer (e.g., phosphate buffer prepared with D2O instead of H2O). Use fully protiated DMPC (C36H72NO8P) and DSPC (C44H88NO8P) with  133.4 mg, where XDMPC and XDSPC are the mole fractions of DMPC and DSPC, here set to 0.7 and 0.3, respectively, and MwDMPC and MwDSPC are the molar weights given by 677.9 g/mol and 790.1 g/mol, respectively. Similarly, mDSPC = 66.6 mg. This deuteration scheme increases the scattering contrast between the membrane (NSLD ~ 0 × 10-6 Å-2) and the deuterated buffer (NSLD ~ 6.4 × 10-6 Å-2) and amplifies the signal from membrane undulations (see Figure 2A left panel).
133.4 mg, where XDMPC and XDSPC are the mole fractions of DMPC and DSPC, here set to 0.7 and 0.3, respectively, and MwDMPC and MwDSPC are the molar weights given by 677.9 g/mol and 790.1 g/mol, respectively. Similarly, mDSPC = 66.6 mg. This deuteration scheme increases the scattering contrast between the membrane (NSLD ~ 0 × 10-6 Å-2) and the deuterated buffer (NSLD ~ 6.4 × 10-6 Å-2) and amplifies the signal from membrane undulations (see Figure 2A left panel).
In the Representative Results, the fist pagargaph was updted from:
NSE studies accessing bending fluctuations are typically performed over a Q-range of ~ (0.04 - 0.2) Å-1. This Q-range corresponds to intermediate length scales between the membrane thickness and the liposomal radius, where bending dynamics dominate. Measurement over an extended Q-range can give access to additional dynamic modes, including liposomal diffusion and intramembrane dynamics. For more details on the cross-over in membrane dynamics accessed by NSE, check these relevant publications25,71. It is important to emphasize that NSE signals are proportional to:  , where Icoh and Iinc are, respectively, the coherent and incoherent scattering intensity from the sample. Therefore, it is advisable to prepare NSE liposomal samples in deuterated buffers (i.e., buffers prepared with D2O instead of H2O) to minimize the incoherent scattering signal, mainly contributed by the hydrogen content of the sample. However, in some cases intermediate deuteration schemes (i.e., using mixtures of D2O and H2O) might be necessary to obtain optimal contrast conditions. Typically, NSE measurements of membrane bending fluctuations are performed on fully protiated liposomes in deuterated buffer, referred to as fully contrasted liposomes in Figure 5. This deuteration scheme results in a large NSLD difference between the membrane core (~2 × 10-6 Å-2) and its deuterated fluid environment (~6.4 × 10-6 Å-2), which significantly enhances the scattering signal from the liposomal membranes and improves the measurement statistics of bending dynamics. This contrast scheme (Figure 2A left panel) is frequently utilized in studies of bending rigidity of lipid membranes with single38,72 and multiple39,66 lipid components and in studies of membrane softening/stiffening by biological inclusions (e.g., cholesterol, drug molecules, peptides/proteins)36,37,73,74,75, and synthetic additives (e.g., nanoparticles)76,77.
, where Icoh and Iinc are, respectively, the coherent and incoherent scattering intensity from the sample. Therefore, it is advisable to prepare NSE liposomal samples in deuterated buffers (i.e., buffers prepared with D2O instead of H2O) to minimize the incoherent scattering signal, mainly contributed by the hydrogen content of the sample. However, in some cases intermediate deuteration schemes (i.e., using mixtures of D2O and H2O) might be necessary to obtain optimal contrast conditions. Typically, NSE measurements of membrane bending fluctuations are performed on fully protiated liposomes in deuterated buffer, referred to as fully contrasted liposomes in Figure 5. This deuteration scheme results in a large NSLD difference between the membrane core (~2 × 10-6 Å-2) and its deuterated fluid environment (~6.4 × 10-6 Å-2), which significantly enhances the scattering signal from the liposomal membranes and improves the measurement statistics of bending dynamics. This contrast scheme (Figure 2A left panel) is frequently utilized in studies of bending rigidity of lipid membranes with single38,72 and multiple39,66 lipid components and in studies of membrane softening/stiffening by biological inclusions (e.g., cholesterol, drug molecules, peptides/proteins)36,37,73,74,75, and synthetic additives (e.g., nanoparticles)76,77.
to:
NSE studies accessing bending fluctuations are typically performed over a Q-range of ~ (0.04 - 0.2) Å-1. This Q-range corresponds to intermediate length scales between the membrane thickness and the liposomal radius, where bending dynamics dominate. Measurement over an extended Q-range can give access to additional dynamic modes, including liposomal diffusion and intramembrane dynamics. For more details on the cross-over in membrane dynamics accessed by NSE, check these relevant publications25,71. It is important to emphasize that NSE signals are proportional to:  , where Icoh and Iinc are, respectively, the coherent and incoherent scattering intensity from the sample. Therefore, it is advisable to prepare NSE liposomal samples in deuterated buffers (i.e., buffers prepared with D2O instead of H2O) to minimize the incoherent scattering signal, mainly contributed by the hydrogen content of the sample. However, in some cases intermediate deuteration schemes (i.e., using mixtures of D2O and H2O) might be necessary to obtain optimal contrast conditions. Typically, NSE measurements of membrane bending fluctuations are performed on fully protiated liposomes in deuterated buffer, referred to as fully contrasted liposomes in Figure 5. This deuteration scheme results in a large NSLD difference between the membrane core (~0 × 10-6 Å-2) and its deuterated fluid environment (~6.4 × 10-6 Å-2), which significantly enhances the scattering signal from the liposomal membranes and improves the measurement statistics of bending dynamics. This contrast scheme (Figure 2A left panel) is frequently utilized in studies of bending rigidity of lipid membranes with single38,72 and multiple39,66 lipid components and in studies of membrane softening/stiffening by biological inclusions (e.g., cholesterol, drug molecules, peptides/proteins)36,37,73,74,75, and synthetic additives (e.g., nanoparticles)76,77.
, where Icoh and Iinc are, respectively, the coherent and incoherent scattering intensity from the sample. Therefore, it is advisable to prepare NSE liposomal samples in deuterated buffers (i.e., buffers prepared with D2O instead of H2O) to minimize the incoherent scattering signal, mainly contributed by the hydrogen content of the sample. However, in some cases intermediate deuteration schemes (i.e., using mixtures of D2O and H2O) might be necessary to obtain optimal contrast conditions. Typically, NSE measurements of membrane bending fluctuations are performed on fully protiated liposomes in deuterated buffer, referred to as fully contrasted liposomes in Figure 5. This deuteration scheme results in a large NSLD difference between the membrane core (~0 × 10-6 Å-2) and its deuterated fluid environment (~6.4 × 10-6 Å-2), which significantly enhances the scattering signal from the liposomal membranes and improves the measurement statistics of bending dynamics. This contrast scheme (Figure 2A left panel) is frequently utilized in studies of bending rigidity of lipid membranes with single38,72 and multiple39,66 lipid components and in studies of membrane softening/stiffening by biological inclusions (e.g., cholesterol, drug molecules, peptides/proteins)36,37,73,74,75, and synthetic additives (e.g., nanoparticles)76,77.
In the Representative Reults, Figure 2 was updated from:
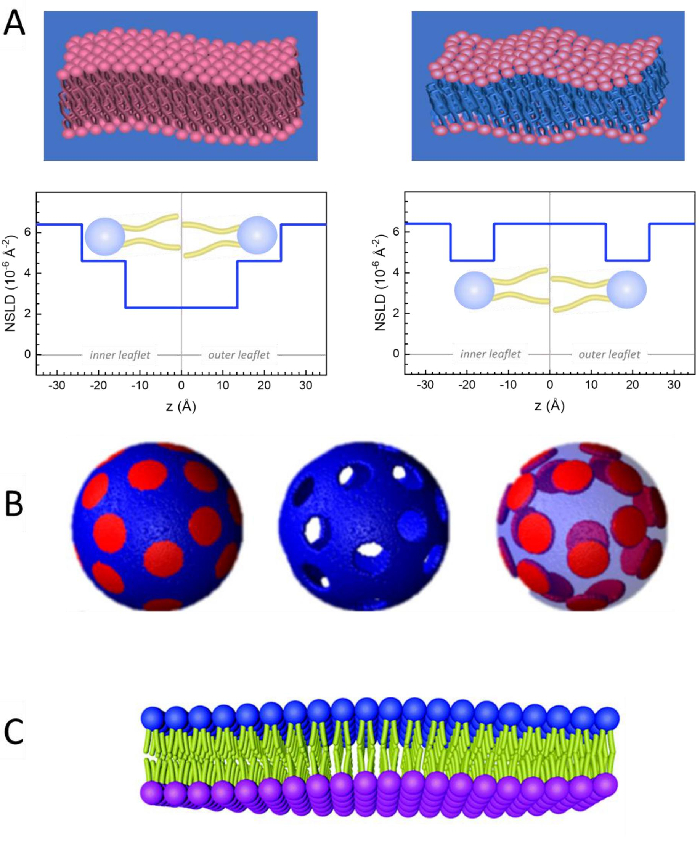
Figure 2: Examples of possible deuteration schemes in NSE experiments on lipid membranes. (A) Left: Fully contrasted membranes, e.g., protiated membranes in deuterated buffer, showing the NSLD profile along the normal to the membrane surface. The difference in the NSLD between the headgroup (~2 × 10-2 Å-2) and tail region (~4.5 × 10-6 Å-2) of the membrane is due to the headgroup hydration with deuterated buffer. Right: Tail-contrast matched membranes such that the hydrocarbon tail region of the membrane has the same NSLD as the buffer, as shown in the corresponding NSLD profile along the membrane normal. (B) Domain-forming membranes with two neutron contrast schemes where the domains (center) or the matrix (left) are contrast-matched to the buffer, enabling selective studies of matrix or domain dynamics, respectively. This figure has been modified from Nickels et al., JACS 201541. (C) Asymmetric membranes prepared by cyclodextrin exchange between protiated and deuterated lipid vesicles, resulting in the deuteration of one membrane leaflet while keeping the other leaflet protiated. This allows studies of the bending dynamics of the protiated leaflet and provides insights into the mechanical coupling between opposing leaflets in asymmetric membranes. This figure has been modified from Rickeard et al., Nanoscale 202040. Please click here to view a larger version of this figure.
to:
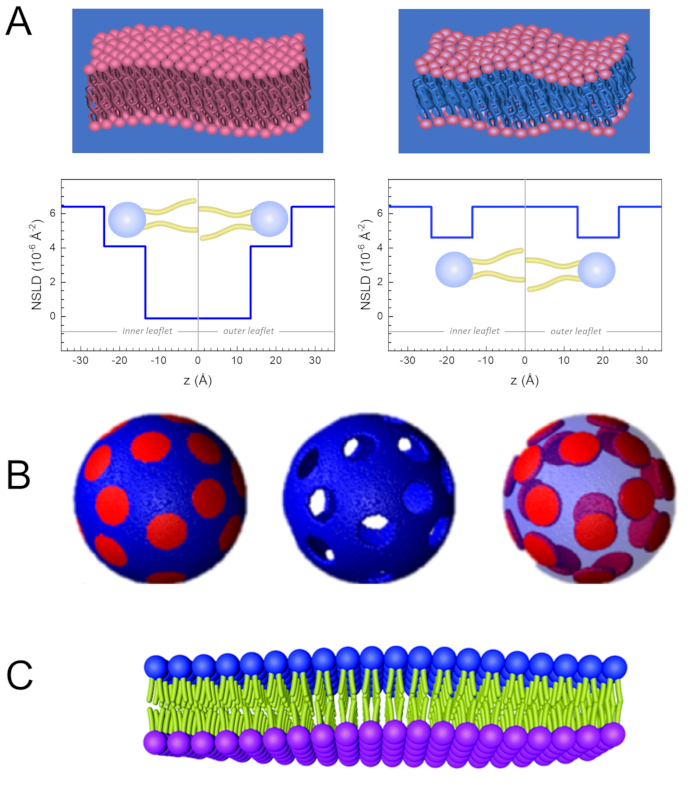
Figure 2: Examples of possible deuteration schemes in NSE experiments on lipid membranes. (A) Left: Fully contrasted membranes, e.g., protiated membranes in deuterated buffer, showing the NSLD profile along the normal to the membrane surface. The difference in the NSLD between the tail region (~0 × 10-2 Å-2) and headgroup region (~4.5 × 10-6 Å-2) of the membrane is due to the headgroup hydration with deuterated buffer. Right: Tail-contrast matched membranes such that the hydrocarbon tail region of the membrane has the same NSLD as the buffer, as shown in the corresponding NSLD profile along the membrane normal. (B) Domain-forming membranes with two neutron contrast schemes where the domains (center) or the matrix (left) are contrast-matched to the buffer, enabling selective studies of matrix or domain dynamics, respectively. This figure has been modified from Nickels et al., JACS 201541. (C) Asymmetric membranes prepared by cyclodextrin exchange between protiated and deuterated lipid vesicles, resulting in the deuteration of one membrane leaflet while keeping the other leaflet protiated. This allows studies of the bending dynamics of the protiated leaflet and provides insights into the mechanical coupling between opposing leaflets in asymmetric membranes. This figure has been modified from Rickeard et al., Nanoscale 202040. Please click here to view a larger version of this figure.



 사용, 여기서 XDMPC와 XDSPC는 DMPC와 DSPC의 두더지 분수이며, 각각 0.7 및 0.3으로 설정하고 MwDMPC 및 MwDSPC는 각각 677.9 g/mol 및 790.1 g/mol이 제공하는 어금니 가중치입니다. 마찬가지로, mDSPC = 66.6 mg. 이러한 중음 방식은 멤브레인(NSLD ~ 0×10-6Å-2) 및 중음 버퍼(NSLD ~ 6.4 ×10-6 Å-2)사이의 산란 대비를 증가시키고 멤브레인 기복으로부터 신호를 증폭시킨다(그림 2A 왼쪽 패널 참조).
사용, 여기서 XDMPC와 XDSPC는 DMPC와 DSPC의 두더지 분수이며, 각각 0.7 및 0.3으로 설정하고 MwDMPC 및 MwDSPC는 각각 677.9 g/mol 및 790.1 g/mol이 제공하는 어금니 가중치입니다. 마찬가지로, mDSPC = 66.6 mg. 이러한 중음 방식은 멤브레인(NSLD ~ 0×10-6Å-2) 및 중음 버퍼(NSLD ~ 6.4 ×10-6 Å-2)사이의 산란 대비를 증가시키고 멤브레인 기복으로부터 신호를 증폭시킨다(그림 2A 왼쪽 패널 참조). M토트는 총 질량, 여기에 설정 200 mg. DMPC-DSPC 지질 이중레이어에 대한 위의 예제를 참조하십시오.
M토트는 총 질량, 여기에 설정 200 mg. DMPC-DSPC 지질 이중레이어에 대한 위의 예제를 참조하십시오.

 중성자와 시료 사이의 에너지 교환으로 인해 스핀 상태의 변화가 편광(unity로부터)의 낙하로 검출된다.
중성자와 시료 사이의 에너지 교환으로 인해 스핀 상태의 변화가 편광(unity로부터)의 낙하로 검출된다.
