Abstract
زيادة الطلب على مصادر الطاقة المتجددة لديها الباحثين التحقيق في جدوى المواد الأولية البديلة، مثل الطحالب. وتشمل المزايا الكامنة ارتفاع العائد المحتمل، واستخدام الأراضي غير الصالحة للزراعة والتكامل مع مجاري النفايات. فإن الاحتياجات الغذائية للنظام إنتاج الطحالب على نطاق واسع يتطلب اقتران نظم زراعة بموارد النفايات الصناعية، مثل ثاني أكسيد الكربون من غاز المداخن والمغذيات من مياه الصرف الصحي. الملوثات غير العضوية الموجودة في هذه النفايات يمكن أن تؤدي إلى التراكم في الكتلة الحيوية الطحالب الدقيقة تؤثر سلبا على الإنتاجية والحد من الاستخدام النهائي. وتركز هذه الدراسة على تقييم تجريبي لأثر ومصير 14 الملوثات غير العضوية (باسم، الكادميوم، الكوبالت، النحاس والزئبق والمنجنيز والنيكل، والرصاص، بينالي الشارقة، سي، القصدير، V والزنك) على Nannochloropsis النمو سالينا . تم الانتهاء من زراعة الطحالب في photobioreactors مضيئة في 984 ميكرومول م -2 ثانية -1 والحفاظ على درجة الحموضة 7 في نمو مالقانونين الملوثة مع الملوثات غير العضوية في المستويات المتوقعة استنادا إلى تكوين وجدت في النظم التجارية غازات المداخن الفحم. الملوثات الموجودة في الكتلة الحيوية والمتوسطة في نهاية فترة النمو 7 أيام وتم قياس كمية تحليلي من خلال بخار بارد الامتصاص الذري الطيفي للزئبق وعن طريق إضافة بالحث البلازما الطيفي للو، الكادميوم، الكوبالت، النحاس، المنغنيز، ني، برميل، بينالي الشارقة، سي، القصدير، V والزنك. أظهرت النتائج N. سالينا هو سلالة حساسة للبيئة المتعددة المعادن مع انخفاض الإحصائي في الكتلة الحيوية yieldwith إدخال هذه الملوثات. التقنيات المعروضة هنا هي كافية لقياس نمو الطحالب وتحديد مصير الملوثات غير العضوية.
Introduction
مقارنة مع المحاصيل الأرضية التقليدية وقد ثبت الطحالب لتحقيق أعلى العوائد الكتلة الحيوية والدهن بسبب الكامنة أعلى كفاءة تحويل الطاقة الشمسية 1،2. زراعة الطحالب في معدلات إنتاجية عالية تتطلب المعروض من المواد الغذائية المختلفة بما في ذلك مصدر الكربون الخارجي. ومن المتوقع أن مرافق نمو واسع النطاق وستدمج مع مجاري النفايات الصناعية مثل غازات المداخن الصناعية من أجل تقليل تكاليف الإنتاج، وفي الوقت نفسه توفير المعالجة البيئية. الكربون النفايات الصناعية عادة في شكل ثاني أكسيد الكربون الغازي ويمكن أن تحتوي على الملوثات التي لها القدرة على التأثير سلبا على إنتاج الطحالب. على وجه التحديد، وغازات المداخن المستمدة من الفحم لديها مجموعة متنوعة من الملوثات بما في ذلك ولكن لا تقتصر على نواتج الاحتراق الماء وثاني أكسيد الكربون، فضلا عن أكاسيد الكبريت والنتروجين والغبار على ما يرام، والملوثات العضوية مثل الديوكسين والفوران، والمعارضة غير العضويةtaminants مثل المعادن الثقيلة. لم تستكشف أثر غالبية هذه الملوثات بما في ذلك غير العضوي مع بعضهم يعرف المعادن الثقيلة على الإنتاجية الطحالب. بعض هذه العناصر يمكن أن تكون المواد المغذية المفيدة على تركيزات مناسبة، ولكن بتركيزات أعلى أنها يمكن أن تنتج ضعف الخلية وحتى الموت 3.
دمج الطحالب مع غازات المداخن الصناعية لديه القدرة على إدخال مباشرة الملوثات غير العضوية إلى وسائط النمو. الفحم غاز المداخن استنادا لديها العديد من العناصر غير العضوية (على سبيل المثال، باسم، الكادميوم، الكوبالت، النحاس والزئبق والمنجنيز والنيكل، والرصاص، بينالي الشارقة، سي، القصدير، والزنك V) بتركيزات مختلفة بعضها، في البلدان المنخفضة الدخل التركيز، وتمثل المغذيات اللازمة للنمو الطحالب. الملوثات غير العضوية لديها قابلية عالية للربط الطحالب وكذلك يتم الممتص منها داخليا من خلال نقل المواد الغذائية. بعض الملوثات غير العضوية (أي شركة، النحاس، الزنك والمنجنيز) هي المواد الغذائية التي تشكل جزءا من الانزيمات إشراكد في عملية التمثيل الضوئي والتنفس وغيرها من المهام 3،4. ومع ذلك، في المعادن الزائدة والفلزات يمكن أن تكون سامة. العناصر الأخرى، مثل الرصاص والكادميوم والقصدير، بينالي الشارقة، سي، كما والزئبق، ليست معروفة لدعم وظيفة خلايا بأي تركيز وتمثل المعادن غير الغذائية التي يمكن أن تؤثر سلبا 3،5،6 نمو الثقافة. وجود أي من هذه الملوثات لديه القدرة على إحداث آثار سلبية على وظيفة خلايا الطحالب. وعلاوة على ذلك، تفاعل المعادن متعددة مع الطحالب تعقيد ديناميات النمو، ولها القدرة على التأثير النمو.
وقد الاقتصاد على نطاق واسع مرتبط مباشرة إلى إنتاجية النظام زراعة 19/07. وعلاوة على ذلك، وإعادة تدوير المتوسطة في نظام نمو الطحالب إما مفتوحة البرك القناة (ORP) أو photobioreactors (PBR) أمر بالغ الأهمية لأنها تمثل 99.9 و 99.4٪ من كتلة، على التوالي 20. وجود الملوثات غير العضوية في وسائل الإعلام يمكن أن تحد في نهاية المطاف مicroalgae الإنتاجية وإعادة التدوير وسائل الإعلام بسبب تراكم الملوثات. هذه الدراسة تجريبيا تأثير 14 الملوثات غير العضوية (باسم، الكادميوم، الكوبالت، النحاس والزئبق والمنجنيز والنيكل، والرصاص، بينالي الشارقة، سي، القصدير، V والزنك)، بتركيزات المتوقعة من تكامل نظم زراعة الطحالب مع الفحم تستمد غاز المداخن، على إنتاجية N. سالينا تزرع في PBRs النقل الجوي. وقد ثبت أن الملوثات المستخدمة في هذه الدراسة للا تكون موجودة في القائمة على الفحم غاز المداخن ولكن على أساس النفايات غاز المداخن البلدية، استنادا المخلفات الصلبة-غاز المداخن ومياه الصرف الصحي البلدية، المياه المنتجة، وضعف المياه الجوفية ومياه البحر 21-23 فقط. وتستند هذه التراكيز المستخدمة في هذه الدراسة على ما يمكن توقعه إذا تم دمج النظم نمو الطحالب مع الفحم يستند CO 2 مصدر مع كفاءة امتصاص موضح في أنظمة PBR التجارية 20. تعرض حسابات مفصلة دعم تركيزات المعادن الثقيلة والملوثات غير العضوية في نابانوآخرون. واستخدمت 24 التقنيات التحليلية لفهم توزيع غالبية المعادن في الكتلة الحيوية، وسائل الإعلام والبيئة. الأساليب المقدمة مكنت تقييم القدرة الإنتاجية من الطحالب الدقيقة تحت الضغط الملوثات غير العضوية وتقدير من مصير نهايتهم.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
نظام 1. النمو

الشكل 1. الطحالب النظام النمو. (A) rotometer الهواء، (B) CO 2 rotometer، (C) وحدة تحكم الحموضة مع الملف اللولبي، (D) مسجل بيانات، (E) في خط مرشحات الهواء، (F) رأس توزيع الهواء، (G) بنك ضوء الفلورسنت، (H) متر الرقم الهيدروجيني، ونظام (I) التبريد، (J) حمام الماء، (K) الأسلاك الحرارية، (L) رفع الهواء photobioreactor، (M) سخان، (N) سيرا على الأقدام في الدخان غطاء محرك السيارة، (O) تنفيس، (P) تسليم الهواء الأنابيب الشعرية، (Q) مرشحات الهواء، (R) أنبوب أخذ العينات، (S) PBR غطاء سيليكون، و (T)درجة الحموضة بشكل جيد في غطاء سيليكون. يرجى النقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
- بناء الطحالب النظام النمو التجريبية التالية (الشكل 1).
- الحصول على اثني عشر PBRs النقل الجوي يتكون من المفاعلات أنبوب زجاجي 4.5 سم وقطرها 80 سم في الطول بسعة زراعة 1.1 L مع أغطية السيليكون. اكتساب قبل قطع أنابيب زجاجية الشعرية (5 ملم القطر الخارجي و 1 مم القطر الداخلي) 10 سم (3 في PBR) و 85 سم (1 في PBR) في الطول.
- تجميد أغطية السيليكون في الفريزر -80 درجة مئوية. تليين مثقاب مع الجلسرين وبينما يتم تجميد أغطية حفر 3 ثقوب لاستضافة تنفيس، وأخذ العينات وتسليم الغاز الأنابيب الشعرية، و1 ثقب 17 مم لاستضافة مسبار درجة الحموضة.
- إدراج الأنابيب الشعرية 3 في مكان مع أطول أنبوب يمتد 2 سم من الجزء السفلي من PBR. في الأنابيب الشعرية الأخرى إضافة واي أنبوب السيليكونث أنبوب شعري تعلق على الطرف الآخر يمتد إلى نقطة أخذ العينات المطلوبة. تغطية فتحة للمتر الرقم الهيدروجيني مع حجم سيليكون سدادة 21D.
- ترطيب الهواء المحيط من خلال السطح من خلال الماء وتسليم الهواء مرطب لرأس توزيع الهواء. تمرير الغاز من خلال مرشح 0.2 ميكرون وتسليمها إلى تعليق الطحالب من خلال أطول تسليم الزجاج الأنابيب الشعرية.
- تقديم CO مضغوط 2 في مجرى الهواء مرطب من أجل الحفاظ على درجة الحموضة محايدة من 7.0 ± 0.1 في تعليق الثقافة. السيطرة على معدلات CO 2 تسليم مع الآلية CO 2 نظام مستوصف (وحدة تحكم درجة الحموضة) الذي يفتح الملف اللولبي المغناطيسي عندما تصل درجة الحموضة 7.1 ثقافة الطحالب ويغلق عند pH 6.9.
- توفير الضوء باستخدام 24 T5 مصابيح الفلورسنت التي تنتج عنها في المتوسط الإضاءة من 984 ميكرومول م -2 -1 ثانية مماثلة إلى الذروة الظروف في الهواء الطلق.
- تزج PBRs في حمام مائي من أجل مaintain على درجة حرارة ثابتة من حوالي 25 ° C. التحكم في درجة حرارة النظام باستخدام مبرد إعادة تدوير والتدفئة إعادة تدوير مياه الاستحمام وحدة التحكم الآلي.
- مراقبة درجة الحرارة ودرجة الحموضة في الوقت الحقيقي وتسجيل مع مسجل بيانات.
- التأكد من أن جميع مكونات النظام نمو الطحالب تعمل بشكل صحيح، لا سيما قبل حصاد الطحالب اللقاح أو إعداد الملوثات غير العضوية لأنها لا يمكن الحفاظ عليها.
2. مختبر وير التحضير
- غسل القوارير الحجمية، PBRs، قوارير وأي حاويات، مع الصابون وماء الصنبور. شطف مع الماء منزوع الأيونات (DW).
- حمض شطف وير مختبر من أجل القضاء على أي آثار الملوثات غير العضوية. ويمكن القيام بذلك عن طريق واحدة من طريقتين:
- نقع مختبر وير O / N في 10٪ حامض النيتريك الصف المعادن النزرة (تنبيه: لا أبخرة التنفس، ويتركز حامض النيتريك يمكن أن تنتج حرق شديد والأبخرة السامة، والعمل في هوو الدخاند باستخدام قفازات النتريل، نظارات واقية ومعطف المختبر).
- نقع مختبر وير لمدة 15 دقيقة في 50٪ المعادن النزرة حمض النيتريك الصف.
- شطف وير مختبر مع DW بدقة 3 مرات على الأقل التأكد من إزالة كافة حامض. فمن الأهمية بمكان أن PBRs وتشطف جيدا، وخاصة أنابيب أخذ العينات والأنابيب الشعرية. والفشل في القيام بذلك تنتج تحمض تثبيط المتوسط وإمكانية للنمو. اختبار الرقم الهيدروجيني للماء الشطف للتحقق من جميع الأحماض تم إزالتها.
- تعقيم PBRs والحاويات وقوارير من قبل التعقيم لهم في 120 ° C والضغط الجوي القياسي لمدة 30 دقيقة على الأقل.
3. N. سالينا إعداد المتوسطة
- تحضير محلول A: ملء جزئيا على الحجمي قارورة 1 لتر مع DW. إدراج شريط مغناطيسي وإضافة المواد الكيميائية هو مبين في الجدول رقم 1 واحدا تلو الآخر. تأكد من أن كل عنصر يذوب قبل إضافة التأسيسية المقبل. إزالة المغناطيس وملء عشرالبريد القارورة إلى علامة حجم 1 لتر.
| مكون | المبلغ إضافة (ز) | التركيز النهائي (ز / L) |
| H 3 BO 3 | 0.900 | 0.900 |
| غ 2 وزارة النفط 4 · 2H 2 O | 0.012 | 0.012 |
| MnCl 2 · 4H 2 O | 0.300 | 0.300 |
| ZnSO 4 · 7H 2 O | 0.060 | 0.060 |
| كبريتات النحاس 4 · 5H 2 O | 0.020 | 0.020 |
الجدول 1: الحل وصفة كميات المبالغ اللازمة في إعداد 1 لتر من محلول مركز.
- إعداد فيتامين الحل: في ثلاث المجلد منفصلقوارير umetric إضافة الفيتامينات كما هو مبين في الجدول رقم 2 النتائج كل حل من خلال فيتامين العقيمة 0.2 ميكرون فلتر حقنة لحاوية معقمة. الحفاظ على الفيتامينات في -4 درجة مئوية في الظلام.
| الفيتامينات | كمية (ملغ) | الحجم النهائي (مل) | تركيز فيتامين النهائي (ملغم / لتر) |
| البيوتين | 12.22 | 500 | 24.43 |
| فيتامين B12 | 13.50 | 100 | 135.00 |
| هيدروكلوريد الثيامين | 977.63 | 500 | 1،955.27 |
الجدول 2: فيتامين حل صفة كميات المبالغ اللازمة لإعداد المحاليل المركزةنشوئها.
- ملء جزئيا حاوية autoclavable 20 L مع DW وإدراج شريط مغناطيسي. وضع الحاوية على رأس لوحة النمام المغناطيسي وإضافة المواد الكيميائية هو مبين في الجدول رقم 3 (باستثناء الفيتامينات)، مضيفا منهم واحدا تلو الآخر، وبعد كل يذوب تماما. ملء الحاويات لتصل إلى 20 L.
| مكون | المبلغ إضافة إلى متوسطة | وحدة |
| كلوريد الصوديوم | 350.00 | ز |
| CaCl 2 · 2H 2 O | 3.00 | ز |
| بوكل | 9.60 | ز |
| نا 2 شافي 3 · 9H 2 O | 1.14 | ز |
| MgSO 4 · 7H 2 O | 29.60 | ز |
| 20.40 | ز | |
| KH 2 PO 4 | 1.36 | ز |
| سترات الأمونيوم الحديديك | 0.10 | ز |
| حل A | 20.00 | مل |
| البيوتين الحل * | 818.00 | ميكرولتر |
| فيتامين B12 الحل * | 296.20 | ميكرولتر |
| الحل هيدروكلوريد الثيامين * | 521.60 | ميكرولتر |
| * إضافة إلى تبريد سائل الإعلام تعقيمها |
الجدول 3: N. سالينا صفة المتوسطة. كميات المبالغ اللازمة في إعداد 20 L من المواد الغذائية الغنية المتوسطة.
- تعقيم متوسطة قبل التعقيم لمدة 30 دقيقة في 120 درجة مئوية وضغط جوي. السماح للسجع المتوسطلتر وصولا الى RT.
- وضع الحاوية على طبق من ذهب النمام المغناطيسي. إضافة الفيتامينات التي أعدت في الخطوة 3.2، والسماح للمزيج المتوسط بدقة.
4. الملوثات غير العضوية إعداد الأوراق المالية
- ملء جزئيا القوارير الحجمية مبين في الجدول رقم 4 مع DW وإضافة الملح الفردية المدرجة. ملء مع DW إلى الحجم النهائي المطلوب وتخلط جيدا. لا الحفاظ على هذه الأسهم كما كثف بعض العناصر إلى قارورة الجدران
تنبيه: العديد من الملوثات غير العضوية المستخدمة في هذا البروتوكول مسببة للسرطان، ماسخة والتشوهات الخلقية، وارتداء قناع الوجه، والقفازات ومعطف المختبر عند التعامل مع الأملاح.
| الحليلة | مصدر الملح | حجم المخزون لإعداد (L) | الملح إضافة إلى قارورة60؛ (الملح ملغ) | وأضاف تركيز تحليلها للثقافة (الحليلة ملغ / L) |
| مثل | NaAsO 2 | 0.1 | 14.8 | 7.74E-02 |
| القرص المضغوط | CdCl 2 | 0.5 | 13.5 | 1.50E-02 |
| شارك | كوكلي 2 .6H 2 O | 0.5 | 34.7 | 1.56E-02 |
| كر | نا 2 كر 2 O 7 · 2H 2 O | 0.1 | 40.6 | 1.29E-01 |
| النحاس | CuCl 2 .2H 2 O | 0.1 | 38.3 | 1.30E-01 |
| زئبق | HgCl 2 | 1.0 14.6 | 9.80E-03 | |
| مليون | MnCl 2 .4H 2 O | 0.1 | 58.8 | 1.49E-01 |
| ني | NiCl 2 .6H 2 O | 0.1 | 112.0 | 2.51E-01 |
| برميل | PbCl 2 | 0.5 | 39.9 | 5.41E-02 |
| بينالي الشارقة | بينالي الشارقة 2 O 3 | 0.5 | 26.7 | 4.06E-02 |
| SE | نا 2 سيو 3 | 0.5 | 11.8 | 9.80E-03 |
| SN | SnCl 2 .2H 2 O | 0.5 | 3.9 | 3.76E-03 |
| الخامس | V 2 O 5 | 0.1 | 22.2 | 1.13E-01 |
| الزنك | ZnCl 2 | 0.1 | 99.9 | 4.36E-01 |
تنتج المركزة غير العضوية إعداد الأسهم الملوثات إضافة 1 مل من هذا المخزون المركزة إلى 1.1 L PBR المتوسطة التركيز النهائي هو مبين في العمود الأخير: الجدول 4.
- تعقيم الأسهم الملوثات غير العضوية عن طريق تمرير الحل من خلال العقيمة 0.2 ميكرون تصفية المحاقن وجمع الرشاحة في أنبوب العقيمة.
5. N. سالينا اللقاح الإنتاج
- في قارورة 500 مل مخروطي إضافة 200 مل من المتوسط أعدت في الخطوة 3 ثم قم بإضافة 3 غرام من أجار. تغطية قارورة مع رقائق الألومنيوم والأوتوكلاف لمدة 20 دقيقة في 120 درجة مئوية. صب الحل في بتري أطباق معقمة وندعه يبرد حتى يتصلب. هذا ينبغي أن يستكمل يكون غطاء العقيمة أو على الأقل بالقرب من اللهب في بيئة نظيفة للحد من مخاطر التلوث.
- خط N. خلايا سالينا في العقيمة بتري ديس[هس أعدت في الخطوة 5.1 باستخدام بذر حلقة عقيمة. وضع الثقافات طبق بتري على طاولة مضاءة بأنوار T12 الحفاظ على RT. السماح الطحالب تنمو حتى المستعمرات مرئية.
- المستعمرات نقل إلى معقمة حير قوارير مخروطي يحتوي على 200 مل من المغذيات المتوسطة الغنية التي أعدت في الخطوة 3 والاحتفاظ بها على طاولة شاكر مضيئة (1000 RPM). السماح للثقافة تنمو حتى يصبح المتوسطة الأخضر.
- نقل الطحالب الدقيقة إلى PBR العقيمة 1.1 L. وضع PBR في حمام ماء اللقاح مضيئة في 200 ميكرومول م -2 ثانية -1 مع مصابيح الفلورسنت T8 والحفاظ على 23 ° C بواسطة مبرد إعادة تدوير وإعادة تدوير التدفئة السيطرة حمام ماء الآلي. ضبط الهواء وCO 2 rotometers إلى 2.5 L دقيقة -1 و 25 سم مكعب دقيقة -1، على التوالي.
- بعد أسبوع من الكتلة الحيوية تقسيم النمو إلى 1 الجديدة 0.1 L PBRs تحتوي على الوسيلة الجديدة وتركها تنمو حتى ما مجموعه لا يقل عن 28 غرام من الكتلة الحيوية الجافة والوزنحصلت بين المفاعلين الذي يمكن تحديده من خلال الكثافة الضوئية.
- حصاد الكتلة الحيوية اللقاح عن طريق الطرد المركزي في 2054 × ز لمدة 15 دقيقة في 10 ° C باستخدام زجاجات الطرد المركزي معقمة وتقنيات معقمة لتجنب التلوث. التخلص من طاف ومواصلة تركيز خلية حسب الحاجة.
- مرة واحدة يتم طرد كل الكتلة الحيوية، وإعادة تعليق الخلايا في 300 مل من المتوسط العقيمة الطازجة.
- تمييع 0.1 مل من ثقافة الطحالب الدقيقة في 3 مل من DW ثم تمييع 0.1 مل من هذا الحل الجديد في 3 مل من DW. ضمان العينة غير مختلطة تماما. قياس الكثافة الضوئية (OD) من تركيز الطحالب في 750 نانومتر () فورا باستخدام مقياس الطيف الضوئي.
- استخدام المعادلة (1) لتحديد كمية الكتلة الحيوية في التركيز.
ملاحظة: المعادلة (1) تم الحصول عليها من الانحدار الخطي بين مقابل إجمالي المواد الصلبة العالقة (في غرام / لتر -1) لN. سالينا (R 2 = 0.9995). وقد وضعت المعادلة (1) لspectrophotometer نموذج في جدول المواد، وتوليد معايرة جديدة في حالة استخدام نموذج معمل آخر.- باستخدام المعادلة (2) حساب حجم التركيز الطحالب (في L) اللازمة للحصول على كثافة 4 ز / L -1 الثقافة في PBR 1.1 L حجم (في L).
- باستخدام تقنيات معقمة، إضافة حجم الطحالب ركاز العثور عليها في الخطوة 5.9 إلى PBR تعقيمها من أجل التوصل إلى كثافة ثقافة الأولية من 4 جم / لتر -1. ملء PBR مع المتوسط إلى 1.1 L. كرر هذه الخطوة حتى يتم تلقيح 6 PBRs. وضع PBRs في حمام ماء اللقاح.
- السماح للالطحالب في PBRs تنمو لمدة 8 أيام ثم حصاد الكتلة الحيوية (بتكرار الخطوات 5،6-5،7). كرر الخطوة 5.8 لحساب الأوليحجم اللقاح لكثافة ثقافة الأولية من 1 جرام / لتر -1.
6. التجريبية المفاعلات
- باستخدام تقنيات معقمة تضيف ما يقرب من 1 L المتوسطة أعدت في الخطوة 3 لكل من 12-تشطف حمض PBRs معقمة. وضع PBRs في حمام مائي لنظام النمو التجريبية. تحويل الهواء sparge على 1.5 في L دقيقة -1.
- تعقيم درجة الحموضة متر معايرة من قبل تنظيفه مع 70٪ من الإيثانول. قياس درجة الحموضة من المتوسط في PBR وضمان درجة الحموضة ما يقرب من 7.0؛ إذا لم يكن كذلك، كرر الخطوة 2 لإزالة حمض تتسرب من الخطوة الشطف حامض.
- معايرة كل وحدة تحكم الرقم الهيدروجيني باستخدام العازلة درجة الحموضة 7، تطهير تحقيقات باستخدام الإيثانول (70٪) ومن ثم إدراجها في الأغطية PBRs.
- إلى كل PBR (باستثناء PBRs السيطرة) إضافة 1 مل من كل من معقمة الأسهم الملوثات غير العضوية أعدت في الخطوة 4. السماح للملوثات تخلط جيدا في PBR. التركيز النهائي من الملوثات غير العضوية في PBRs وعرضن في العمود الأخير في الجدول 4، وتركيزات القصوى المقدرة المتوقعة من التكامل محطة توليد الكهرباء التي تعمل بالفحم.
- إضافة 14 مل من DW المعقم في PBRs السيطرة.
- إضافة اللقاح الطحالب المركزة التي تم الحصول عليها في الخطوة 5.11 إلى PBRs التجريبية من أجل الحصول على كثافة ثقافة الأولية من 1 جرام / لتر -1. دعونا مزيج الكتلة الحيوية بدقة.
- بدوره أضواء شدة الضوء العالية (من 984 ميكرومول م -2 ثانية -1) وحدات التحكم ودرجة الحموضة في وضبط CO 2-30 سم مكعب دقيقة 1. زيادة تدفق CO 2 إلى 50 سم -1 دقيقة من يوم 3 بعد ذلك. الأولي انخفاض معدل تدفق CO 2 أمر بالغ الأهمية من أجل تجنب التغيرات الكبيرة في درجة الحموضة بسبب التأخير في الغاز / نقل السائل وقياس درجة الحموضة.
- قياس وأخذ عينات حسب الحاجة. تأكد بمناسبة منسوب المياه بعد أخذ العينات. (تنبيه: بعض الملوثات غير العضوية في PBR مسببة للسرطان، ماسخة والتشوهات الخلقية، قفازات استخدام وكابحاويات إد عند التعامل مع العينات).
- إضافة عقيمة DW يوميا إلى PBRs من أجل التعويض عن الخسائر الناجمة عن التبخر.
- بعد 7 أيام من النمو، حصاد الكتلة الحيوية بواسطة الطرد المركزي في 9936 × ز والمحافظة على حد سواء، والكتلة الحيوية وطاف المتوسطة، في -80 ° C.
- تجميد تجفيف الكتلة الحيوية عند 0.1 ملي بار و-50 ° CO / N. مسحوق الكتلة الحيوية (استخدام ملعقة لمسحوق الكتلة الحيوية داخل أنبوب الطرد المركزي). الحفاظ على تجميد الكتلة الحيوية المجففة في -80 ° C.
7. ميكروويف بمساعدة الهضم العينات
مطلوب هضم العينات الكتلة الحيوية كخطوة المعالجة المسبقة للتحليل ICP-MS.
ملاحظة: هذه الخطوات استخدام وعاء الميكروويف نظام الهضم مغلقة مع تخفيف الضغط التي تسيطر عليها. (تنبيه: ضغوط عالية تتطور أثناء عملية الهضم الحمضي والإطلاع على السلامة الجسدية للسفن الهضم والدروع، وإعادة تشكيل أغطية الأوعية الهضم الميكروويف قبل كل استخدام).
- غسل تفلون سفن الهضم الميكروويف بالماء والصابون، شطف مع DW، والسماح سفن الهواء الجاف. لإزالة تلوث المعادن النزرة في الأوعية هضم حامض كما هو موضح في الخطوات التالية.
- إعادة تشكيل أغطية الأوعية الهضم الميكروويف وإغلاق قارورة بإحكام.
- إضافة 10 مل من حمض النيتريك لكل منهما.
- إدخال السفينة في درع السلامة. ضمان عدم وجود الكتلة الحيوية، الماء أو أي الكواشف يتم ترك على جدران درع السلامة أو في الجدران الخارجية للسفن الهضم من أجل تجنب الأضرار التي لحقت درع السلامة. تتويج درع السلامة مع صمام الأمان التأكد من فصل الربيع في القارورة هو مطاردة. وضع الدرع الصاروخي على الدوار مع فتحات سقف مشيرا إلى الخارج في الصف الخارجي والداخل في الصف الداخلي.
- على السفينة رقم واحد، إدراج و thermowell السيراميك واستشعار درجة الحرارة. هذه الحرارة يراقب درجة الحرارة الداخلية الفعلية في القارورة، وتقوم بدور المعلمة مسيطرة لتنفيذ progr الهضمأنا. ضمان قارورة رقم واحد يحتوي على نفس العينة وكاشف كميات كما قارورة أخرى.
- إدخال المعلمات الهضم هو مبين في الجدول (5) وتبدأ عملية الهضم. عند الانتهاء من البرنامج، الهواء البارد قارورة حتى تصل RT.
| خطوة | قارورة الشطف | عينة الهضم | ||||
| درجة الحرارة (° C) | الوقت (دقيقة) | كحد أقصى. الطاقة (W) | درجة الحرارة (° C) | الوقت (دقيقة) | كحد أقصى. الطاقة (W) | |
| 1 | RT إلى 190 | 25 | 1000 | RT إلى 180 | 15 | 1000 |
| 2 | 190 | 10 | 1000 | 180 | 15 | 1000 |
| - | 20 | - | - | 20 | - |
الجدول 5: معلمات المستخدمة في البرنامج الهضم الميكروويف.
- داخل غطاء الدخان، إدراج أداة لتخفيف الضغط على الغطاء الدرع مع فتحات سقف تشير بعيدا عنك. مرة واحدة يتم تحرير الضغط فتح غطاء (تنبيه: قارورة هضم مفتوحة دائما داخل غطاء الدخان منذ الهضم الكتلة الحيوية باستخدام حمض تنتج أبخرة سامة).
- التخلص من الحمض. شطف الأوعية تفلون مع DW 3 مرات. السماح قارورة الهواء الجاف.
- لهضم الكتلة الحيوية، إضافة 50 ملغ من تجميد المجفف الكتلة الحيوية للسفن الهضم الميكروويف. لمراقبة الجودة (QC) تستعد قارورة التالية: في اثنين من قوارير مختلفة إما إضافة 5 مل من مستوى 7 ICPMS أو 5 مل من مستوى 7 زئبق CVAAS مستوى أعد في الخطوات 9.1 و 10.1 (الحل هضمها من هذه القارورة يسمى المختبر المحصنة فارغة (LFB))، وترك فارغا (حل آخر قارورة هضمهامن هذه القارورة يسمى مختبرية فارغة (LRB)).
- لهضم المتوسطة، إضافة 10 مل المتوسطة طاف لتجف حمض تشطف الأوعية الهضم الميكروويف. لمراقبة الجودة (QC) تستعد قارورة التالية: في اثنين من قوارير مختلفة إضافة 5 مل من مستوى 7 ICPMS أو CVAAS معيار المعادن أعدت في الخطوة 9.1 و 10.1 (الحل هضمها من هذه القارورة يسمى LFB)، إلى قارورة أخرى إضافة 10 (ويسمى الحل هضمها من هذه القارورة وLRB) مل من DW.
- إعادة تشكيل أغطية الأوعية الهضم الميكروويف وإغلاق قارورة بإحكام.
- إضافة 7 مل من أثر المركزة الصف المعادن حمض النتريك و 3 مل بيروكسيد الهيدروجين لكل قارورة. تجانس المحتويات عن طريق يحوم بلطف الحل. هضم محتويات قارورة بتكرار الخطوات 7،4-7،7 (استخدام المعلمات الهضم الميكروويف لعينة الهضم في الجدول 5).
- إضافة العينة هضمها إلى 25 مل الحجمي قارورة، الشطف السفن مع DW لزيادة الانتعاش. ملء قارورة حجمية مع DWإلى العلامة.
- نقل هضمها عينات إلى حاوية توج. الحفاظ على العينات عند 4 درجات مئوية حتى يمكن الانتهاء من التحليل. لهذا التحليل دراسة يتم في نفس اليوم للزئبق وخلال ثلاثة أيام للعناصر الأخرى.
8. مراقبة الجودة (QC) عينات
ملاحظة: تحليل عينات QC من أجل ضمان مصداقية النتائج من العينات التجريبية.
- ملء جزئيا حمض تشطف 1 L الحجمي قارورة مع DW. إضافة 280 مل من المركز التتبع الصف المعادن حمض النيتريك وتخلط جيدا (ويسمى هذا الحل أيضا الحل فارغ) (تنبيه: دائما إضافة حمض إلى الماء، وعدم إضافة الماء إلى حامض كما تفاعل طارد للحرارة يمكن أن تكون عنيفة). دعونا حل بارد لRT.
- بالإضافة إلى عينات QC أعد في الخطوات 7.9 و 7.10، وإعداد العينات QC التالية.
- لمواصلة عملية التحقق المعايرة (CCV): ملء أنبوب البوليسترين مع المعايرة القياسية (لإعداد رؤيةالخطوة 9.2 و 10.1). وضع حل زئبق القياسية على الرف CVAAS وICPMS حل القياسية في الاوتوماتيكى ICPMS.
- لمعايرة استمرار فارغة (بنك): ملء اثنين من أنابيب البوليسترين (16 مل) مع فارغة (حل أعدت في الخطوة 8.1). ضع عينة واحدة في رف CVAAS وعينة أخرى في الاوتوماتيكى ICPMS.
- لمصفوفة المدعمة مختبر (LFM): عشوائيا اختر 1 عينة من كل 12 عينة لكل نوع العينة (أي الكتلة الحيوية أو المتوسطة) واستخدامها لإعداد LFM. لICPMS، إضافة 0.5 مل من ICPMS مستوى قياسي 7 و 3 مل من هضم العينة التجريبية (سواء من الكتلة الحيوية أو المتوسطة) لأنبوب البوليسترين.
- خلط محتويات ووضع قنينة على الاوتوماتيكى ICPMS. لCVAAS، إضافة 2 مل زئبق مستوى قياسي 7 و 6 مل من هضم العينة التجريبية (سواء من الكتلة الحيوية أو المتوسطة) لأنبوب البوليسترين. خلط محتويات وقوارير مكان على الرف CVAAS.
- لعينات مزدوجة: عشوائيا اختر 1 عينة من أي وقت مضىص 12 عينة لكل نوع من مصفوفة (على سبيل المثال، والكتلة الحيوية والمتوسطة، LFM أو أي مصفوفة المخفف) وتكرار القارورة. ضع قارورة المتكررة في الاوتوماتيكى ICPMS أو رف CVAAS.
- لعينات مزدوجة: عشوائيا اختر 1 عينة من كل 12 عينة لكل نوع من مصفوفة (على سبيل المثال، والكتلة الحيوية والمتوسطة، LFM أو أي مصفوفة المخفف) وتكرار القارورة. ضع قارورة المتكررة في الاوتوماتيكى ICPMS أو رف CVAAS.
- تحديد معايير جودة البيانات للدراسة. لهذه الدراسة مكررة معايير الجودة التي وضعتها إيتون، Clesceri ورايس وغرينبرغ 25. المعلمات التي أنشئت لمراقبة الجودة هي: اختلاف النسبة المئوية (٪ D) لجنة تنسيق المفردات داخل ± 10٪ 25 (مع استثناء من الرصاص والأنتيمون، انظر المناقشة)، والانتعاش LFB النسبة المئوية (٪ R) ضمن ± 70-130٪ 25، LFM في المئة الانتعاش (٪ R) ضمن 75-125٪ 25، ونسبة النسبية الفرق (RPD) ضمن ± 20٪ 25، وكاليفورنيا المستمرالميسان فارغة (بنك) تحت الحد المسموح الإبلاغ طريقة (MRL) 25. رؤية المعادلات الحسابية في الخطوة 9.7.
9. الكمي من قبل بالحث إلى جانب البلازما الطيف الكتلي (ICPMS)
- في يوم من التحليل، ونقل ما يقرب من 5 مل من العينة هضمها لأنابيب البولي ستايرين ووضعها في الاوتوماتيكى ICPMS. إضافة حوالي 15 مل من عينات هضمها لأنابيب البولي ستايرين ووضعها في رف CVAAS.
- وفي اليوم نفسه التحليل إعداد معايير المعايرة. إضافة ICPMS شراؤها حل معيار وإعادة ملء مع فارغة (حل أعدت في الخطوة 8.1) كما هو موضح في الجدول رقم 6 (انظر وصف الحل القياسي في المواد الجدول) لقوارير حجمية حمض تشطف.
| معلمة | المرحلة 1 | مستوى 2 | مستوى 3 | مستوى 4 | مستوى 5 | مستوى 6 | مستوى 7 |
| مستوى شراؤها لتضاف (مل) | - | - | - | - | - | - | 10.0 |
| مستوى 7 التي يمكن ان تضاف (مل) | 0.0 | 1.0 | 2.5 | 5.0 | 20.0 | 25.0 | - |
| الحجم النهائي * (مل) | - | 50.0 | 50.0 | 50.0 | 100.0 | 50.0 | 100.0 |
| التركيز النهائي (ميكروغرام / لتر) | |||||||
| 75 وكما | 0.0 | 2.0 | 5.0 | 10.0 | 20.0 | 50.0 | 1000.0 |
| 111 الكادميوم | 0.0 | 1.0 | 2.5 | 5.0 | 10.0 | 25.0 | 50.0 |
| 59 شركة | 0.0 | 10.0 | 25.0 | 50.0 | 100.0 | 250.0 | 500.0 |
| 52 ساعة معتمدة | 0.0 | 2.0 | 5.0 | 10.0 | 20.0 | 50.0 | 100.0 |
| 63 النحاس | 0.0 | 5.0 | 12.5 | 25.0 | 50.0 | 125.0 | 250.0 |
| 55 المنغنيز | 0.0 | 3.0 | 7.5 | 15.0 | 30.0 | 75.0 | 150.0 |
| 60 ني | 0.0 | ثمانية | 20.0 | 40.0 | 80.0 | 200.0 | 400.0 |
| 208 الرصاص | 0.0 | 1.0 | 2.5 | 5.0 | 10.0 | 25.0 | 50.0 |
| 121 بينالي الشارقة | 0.0 | 12.0 | 30.0 | 60.0 | 120.0 | 300.0 | 600.0 |
| 51 V | 0.0 | 10.0 | 25.0 | 50.0 | 100.0 | 250.0 | 500.0 |
| 66 الزنك | 4.0 | 10.0 | 20.0 | 40.0 | 100.0 | 200.0 | |
| * تحقيق هذا الحجم بإضافة الحل أعد في الخطوة 8.1 | |||||||
الجدول 6: تركيز المعايير معايرة مستويات 1-7.
- إزالة المخاريط من ICPMS ويصوتن لهم لمدة 1 دقيقة في DW. تجفيف الأقماع ووضعها من جديد في الصك.
- بدوره على الماء المبرد، والغازات (AR، H 2، و)، وICPMS، وخطوط التوصيل للمعيار الداخلية، وملء الحاويات لصناعة السيارات في العينات شطف (DW، حمض النيتريك 10٪، 1٪ حامض النيتريك + حمض الهيدروكلوريك 0.5٪) .
- فتح برنامج محطة Masshunter وبدوره على البلازما، وضبط ICPMS وتحميل طريقة لتعيين المعلمات في الجدول 7.
| المعلمات القيم | |||||||||
| المعايير الداخلية | 72 قه، 115 في | ||||||||
| قوة الترددات اللاسلكية | 1500 W | ||||||||
| البلازما معدل تدفق الغاز | 14.98 | ||||||||
| معدل تدفق الغاز البخاخات | 1.1 لتر / دقيقة (الناقل والتخفيف الغاز مجتمعة - 0.6 + 0.5 لتر / دقيقة) | ||||||||
| أخذ العينات مخروط | النيكل ل x عدسة | ||||||||
| مخروط المصفاة | النيكل | ||||||||
| معدل امتصاص عينة | 0.3 RPS | ||||||||
| البخاخات مضخة | 0.1 RPS | ||||||||
| S / C درجة الحرارة | 2 ° C | ||||||||
| حالة المسح الضوئي | يسكن الوقت 1 ثانية، وعدد من تكرار 3 | ||||||||
| H تدفق غاز 2 | N / A | ||||||||
| كان تدفق الغاز | 4.3 مل / دقيقة | ||||||||
| معلمة | المرحلة 1 | مستوى 2 | مستوى 3 | مستوى 4 | مستوى 5 | مستوى 6 |
| L7 زئبق القياسية التي يمكن ان تضاف (مل) | 0 | 1 | 2.5 | 5 | 20 | 25 |
| الحجم النهائي * (مل) | - | 50 | 50 | 50 | 100 | 50 |
| التركيز النهائي (ميكروغرام / لتر) | 0 | 0.5 | 1.25 | 2.5 | 5 | 12.5 |
| * تحقيق هذا الحجم بإضافة الحل أعد في الخطوة 8.1 | ||||||
الجدول 8: تركيز الزئبق المعايرة القياسية مستويات 1-6.
- فتح الغاز هارون وصمام الهواء، بدوره على الامتصاص الذرينشوئها مقياس الطيف الضوئي وحقن تدفق الطيفي الذرية (FIAS). فتح البرنامج CVAAS Winlab، تشغيل مصباح الزئبق والسماح لها الاحماء حتى تصل المعلمة الطاقة البرمجيات 79. تحميل برنامج لتحليل الزئبق مع المعلمات في الجدول 9. ضبط مسار الضوء في الصك لإعطاء أقصى قدر من النفاذية.
| المعلمات | القيم |
| الغاز الناقل | الأرجون، 100 مل / دقيقة |
| مصباح | الزئبق مصباح التفريغ ELECTRODELESS، والإعداد في 185 مللي أمبير |
| الطول الموجي | 253.7 نانومتر |
| شق | 0.7 نانومتر |
| درجة الحرارة خلية | 100 ° C |
| حجم العينة | 500 ميكرولتر |
| الناقل | 3٪ حمض الهيدروكلوريك، 9.23 مل / دقيقة |
| اختزال | 10٪ SnCl 2، 5.31 مل / دقيقة |
| قياس | ارتفاع الذروة |
| قراءة مكررات | 3 |
الجدول 9: ظروف التشغيل CVAAS.
- توصيل خط إلى حل الناقل مصنوع من 3٪ الصف المعادن النزرة حمض الهيدروكلوريك.
- توصيل خط إلى حل عامل مختزل مصنوعة من كلوريد قصديري 10٪ (مناسبة لتحليل زئبق) في 3٪ المعادن النزرة الصف حمض الهيدروكلوريك. يعد هذا الحل في نفس اليوم من التحليل لأنها عرضة للأكسدة في الغلاف الجوي (تنبيه: كلوريد قصديري خطرة جدا، واستخدام ملابس واقية عند التعامل معها جمع النفايات CVAAS في احتواء الخطرة والتخلص منها بشكل صحيح).
- وضع معايير زئبق، وعينات QC والعينات التجريبية في رف CVAAS وإدخال تسلسل في البرنامج CVAAS Winlab. تشغيل المعايير وتوليد معادلة المعايرة.
- تشغيل QC سامPLES والعينات التجريبية. وCVAAS توجه حوالي 5 مل من العينة في الصك، ويقلل من الزئبق الموجودة في العينة إلى عنصر الزئبق (زئبق 0) الغاز وعمليات التطهير الغاز من حل مع الغاز الناقل (ع) في نظام مغلق. بخار الزئبق يمر من خلال خلية في مسار الزئبق ضوء المصباح. وكشف يحدد ضوء استيعابها في 253.7 نانومتر، ويرتبط ذلك إلى تركيز. (تنبيه: زئبق بخار سام، وضمان الصك العادم هود في مكان).
- حساب٪ R،٪ D وRPD في الخطوة 9.7 خلال تحليل ومقارنة النتائج لمشروع معايير جودة البيانات.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
غلة الكتلة الحيوية
إنتاج N. سالينا في النظام PBR المستخدمة في هذه الدراسة نمت من 1 جرام / لتر -1 إلى 8.5 ± 0.19 جرام / لتر -1 (N = 12) للمفاعلات السيطرة و 4.0 ± 0.3 جم / لتر -1 (N = 12) ل المتعددة المعادن الملوثة في 7 أيام. التجارب أنتجت بيانات قابلة للتكرار في جميع أنحاء المفاعلات ثلاث نسخ ودفعات متعددة. ويبين الشكل 2A متوسط كثافة الثقافة مع الخطأ المعياري صغير جدا مستندة على عينة من ثلاثة PBRs مستقلة. لضمان أن هذه النتيجة لم تكن نتيجة معزولة، وقد نمت ثلاث دفعات مع نتائج مماثلة. وأظهرت النتائج المجمعة لجميع دفعات أربعة في الشكل 2B. على الرغم من التباين البيولوجي موجود، وتظهر هذه الدراسة أن هناك تأثير سلبي ثابت من الملوثات غير العضوية إلى N. إنتاج سالينا. وكانت غلة الكتلة الحيوية في الملوث يتعرض PBRs مختلفة إحصائيا لPBRs التحكم منيوم 2 فصاعدا (أنوفا، ف <0.05).
تقييم مراقبة نوعية الملوثات غير العضوية الكمي
اثني عشر من أربعة عشر عناصر تحليلها كانت تماما للاسترداد بعد الهضم كما هو موضح التي كتبها٪ لR LFB مع٪ R قرب 100٪، مما يدل على عدم الخسائر، لا المكاسب وعدم وجود تلوث عبر من التحاليل أثناء عملية الهضم (الجدول 10). تم رصدها خلال التحليل الكمي للعينات٪ D وRPD من خلال كل تحليل ومتوسط نتائج وترد في الجدول 10. و، الكادميوم، الكوبالت، النحاس والزئبق والمنجنيز والنيكل، والرصاص، بينالي الشارقة، V والزنك مرت ٪ D و RPD، ولكن٪ D للرصاص وبينالي الشارقة انخفض تدريجيا خلال التحليل. و٪ D لهذه العناصر تتحسن بعد التنظيف مخروط، ومع ذلك، تنظيف مخروط ثابتة غير عملي، وبالتالي خفضت أهداف جودة البيانات للرصاص وبينالي الشارقة. وكان بنك التعمير الصينى لجميع التحاليل أيضا تحت MRL. تم تقييم الآثار مصفوفة من خلال تحليل عينات LFM والحصول على٪ على R. While المشارك، مرت زئبق، V وبينالي الشارقة معايير البيانات QC، لم مرت عليه من قبل و، الكادميوم، الكروم، النحاس، المنغنيز والنيكل والرصاص والزنك عندما تم تحليل عينات الكتلة الحيوية هضمها، مما أدى إلى٪ R أدناه الأهداف QC. أسفرت٪ R التي مرت معايير جودة البيانات تخفيف مصفوفة في DW إلى نسبة 1: 3 (المذيبات المذاب). وقد لوحظت آثار مصفوفة أيضا خلال تحليل طاف هضمها وعولجت من قبل نسبة التخفيف نفسها (الجدول 10) التأكد من لم التخفيف ألا تمس حد الكشف عن الصك. القضايا مع الكشف عن سي والقصدير لوحظت استنادا إلى تفسيرات غير مستقرة وقضية التلوث، على التوالي. وتعزى قراءات غير مستقرة لسي للأملاح في المصفوفة 27. وقد تتبعت تلوث القصدير مرة أخرى إلى حمض المستخدمة في خطوة عملية الهضم.
| الحليلة | R | CCV | LFB | LFM للعينات الكتلة الحيوية | LFM للعينات طاف | ||||
| ٪ د | ٪ R | نسبة التخفيف | ٪ R | RPD | نسبة التخفيف | ٪ R | RPD | ||
| QC يحد من 25 | 0.9950 | ± 10 | 70-130 | - | 75-125 | ± 20 | - | 75-125 | ± 20 |
| مثل | 0.9998 | 1.8 | 101.0 | 1: 3 | 100.4 | 5.2 | 1: 3 | 92.5 | -0.5 |
| القرص المضغوط | 1.0000 | 1.4 | 102.6 | 1: 3 | 103.5 | 4.6 | لا شيء | 92.3 | 0.6 |
| شارك | 0.9997 | 1.7 | 98.8 | لا شيء | 95.2 | -1.4 | لا شيء | 96.5 | -1.5 |
| كر | 0.9999 | 1.5 | 99.8 | 1: 3 | 96.5 | 1.8 | 1: 3 | 90.1 | -0.8 |
| النحاس | 0.9999 | 2.9 | 98.2 | 1: 3 | 101.4 | 4.8 | 1: 3 | 94.4 | -0.5 |
| زئبق | 0.9983 | -1.7 | 103.0 | لا شيء | 98.7 | 1.5 | لا شيء | 98.0 | 0.3 |
| مليون | 0.9998 | 2.9 | 97.6 | 1: 3 | 83.2 | 1.8 | 1: 3 | 95.4 | -1.7 |
| ني | 0.9999 | 103.5 | 1: 3 | 98.5 | 2.1 | لا شيء | 93.3 | -0.9 | |
| الخامس | 0.9998 | 2.5 | 97.2 | لا شيء | 95.5 | -1.5 | لا شيء | 101.2 | -1.9 |
| برميل | 0.9998 | 12.6 | 105.2 | 1: 3 | 88.9 | 0.0 | لا شيء | 93.5 | -0.5 |
| بينالي الشارقة | 0.9998 | 1.1 | 105.7 | لا شيء | 101.8 | -9.6 | لا شيء | 90.8 | -1.2 |
| الزنك | 0.9997 | 5.2 | 120.8 | 1: 3 | 90.7 | 1.4 | لا شيء | 89.2 | -1.9 |
الجدول 10: ملخص نتائج عينات مراقبة الجودة. R = المشتركمعامل rrelation،٪ D: الفرق في المئة،٪ R: الانتعاش في المئة، RPD = الفرق النسبي في المئة، ونسبة التخفيف يشير إلى المذاب: نسبة المذيبات.
تركيزات الملوثات غير العضوية
تم العثور على المعادن الثقيلة والملوثات غير العضوية في كل من الكتلة الحيوية وطاف المتوسطة. وأظهرت التركيزات التي وجدت في الكتلة الحيوية لل12 عناصر تم تحليلها في الشكل (3). التركيزات في الكتلة الحيوية التي تحصد من PBRs ثلاث نسخ (N = 3) دفعة واحدة # 1 يظهر الخطأ المعياري صغير جدا (الشكل 3A). الجمع بين البيانات من PBRs ثلاث نسخ من 4 دفعات يظهر باستمرار أن الملوثات غير العضوية الموجودة في الكتلة الحيوية (N = 12). وأظهرت التركيزات التي وجدت في المتوسطة طاف في الشكل (4). وتظهر النتائج PBRs ثلاث نسخ (N = 3) للدفعة رقم 1 أيضا الخطأ المعياري الصغيرة (الشكل 4A) وتبين أن معظم الملوثات وتقع تفضيلي في الكتلة الحيوية لeading لتركيزات منخفضة جدا في طاف مع عدة تجمعات عينة قريبة من الحدود القصوى للأداة. يتم عرض النتائج من جميع دفعات أربعة في الشكل 4B.
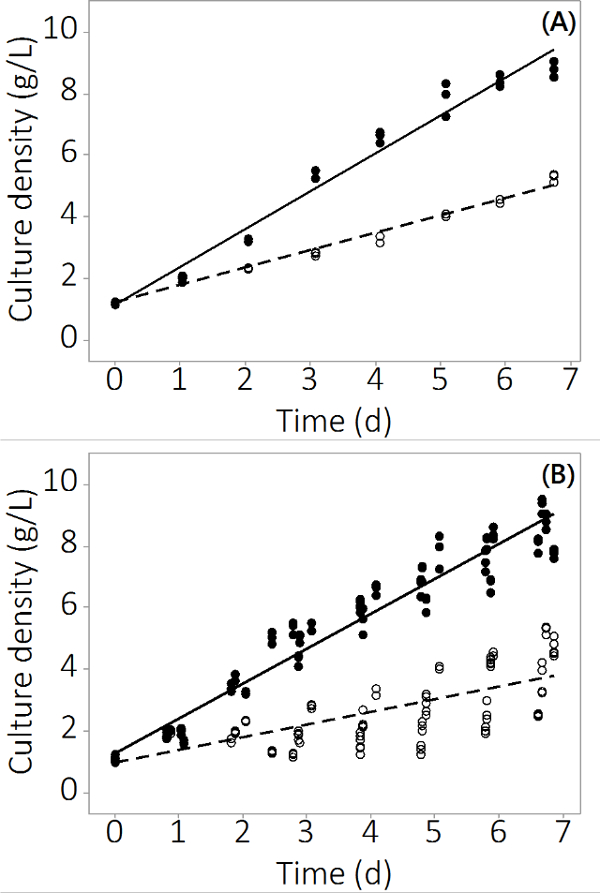
الرقم 2. ulture ج التركيز خلال الفترة زراعة لPBRs الملوثة والسيطرة عليها. (A) الكثافة الثقافة في الدفعة رقم 1، والنتائج من N = 3 PBRs. (B) كثافة الثقافة في 4 دفعات، والنتائج من N = 12 PBRs. دوائر فارغة تمثل ملوثة الكتلة الحيوية، والدوائر مليئة تمثل عنصر التحكم.
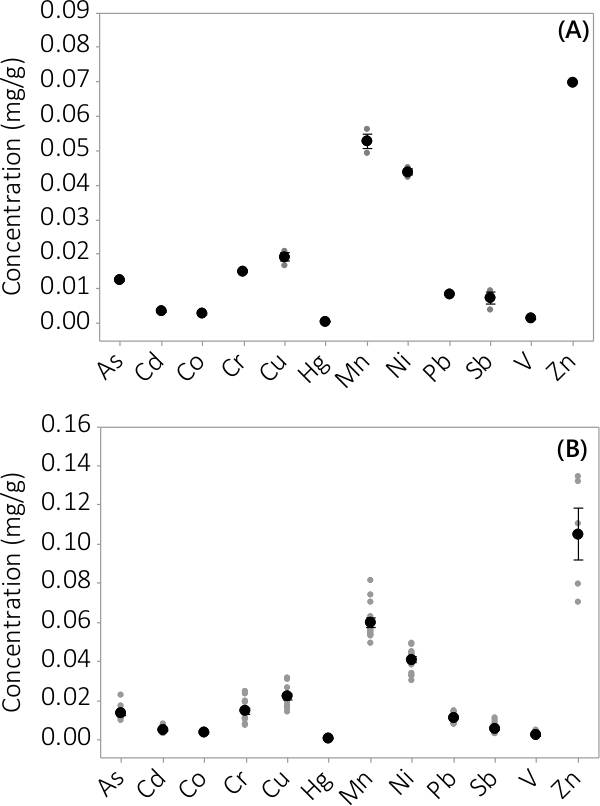
الشكل 3. تركيز الملوثات غير العضوية في الكتلة الحيوية. (A) تركيز دفعة واحدة # 1، والنتائج من N = 1 PBR للزنك وN = 3 PBRs لجميع التحاليل الأخرى، (B) تركيز من 4 دفعات، والنتائج من N = 4 PBRs للزنك وN = 12 PBRs لجميع التحاليل الأخرى. ويمثل متوسط التركيزات التي كتبها black شغل الدوائر، وتتمثل نقاط البيانات الفردية من قبل الدوائر شغل في الرمادي. أشرطة الخطأ تمثل واحدة ± الخطأ المعياري عن المتوسط.
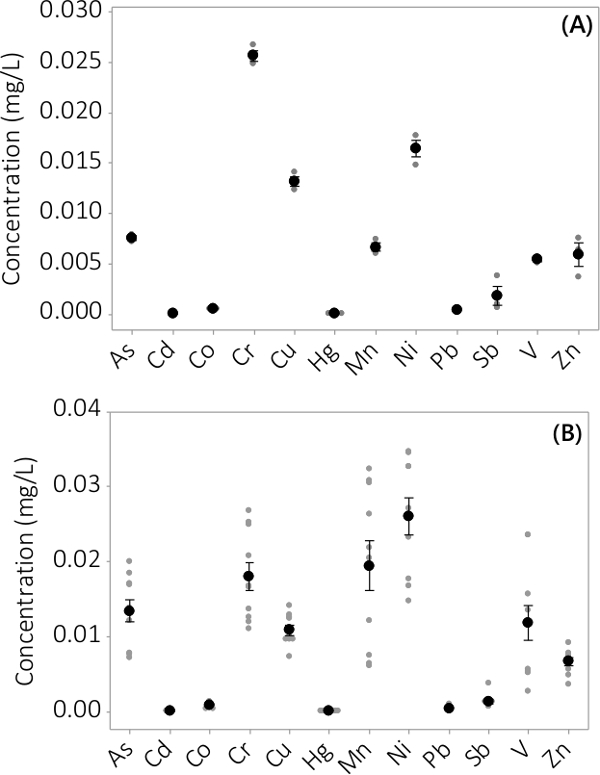
الرقم 4. تركيز الملوثات غير العضوية في طاف. (A) التركيز في الدفعة رقم 1، والنتائج من N = 3 PBRs، (B) تركيز من 4 دفعات، والنتائج من N = 12 PBRs. ويمثل متوسط التركيزات التي كتبها black شغل الدوائر، وتتمثل نقاط البيانات الفردية من قبل الدوائر شغل في الرمادي. أشرطة الخطأ تمثل واحدة ± الخطأ المعياري عن المتوسط.
>
Subscription Required. Please recommend JoVE to your librarian.
Discussion
المالحة الطحالب N. سالينا يمكن زراعتها بنجاح في النظام النمو مصممة مع نتائج قابلة للتكرار وغلة الكتلة الحيوية العالية. النقل الجوي الاختلاط المسموح به للثقافة مع وقف التنفيذ مختلطة بشكل جيد مع الحد الأدنى من تسوية أو biofouling خلال فترات النمو 7 أيام. يظهر التباين ضوء الحد الأدنى في الضفة ضوء الفلورسنت أيضا لا ينتج اختلافات ملحوظة في النمو.
الدراسة معارض المعادن الثقيلة الملوثة وسائل الإعلام في ممثل تركيزات التكامل مع غازات المداخن الفحم يؤثر سلبا نمو الكتلة الحيوية. التكرار في الدراسة الضوء على تأثير النظام المتعددة المعادن لديها على الإنتاجية. الخطوات المختلفة في عملية لديها القدرة على التأثير سلبا على النمو وتلوث نظام يتطلب إعداد التجريبية الدؤوب. تحديد الرقم الهيدروجيني للمتوسطة قبل البدء في التجربة هو خطوة QC التي تسمح للتحقق من أن المتوسط لا يحمض (على سبيل المثال، دورة الفتشوبlting من PBR غير لائق الشطف بعد تمرغ حامض). سوف المتوسطة المحمضة يؤثر على نمو الطحالب وتغيير التوافر الحيوي المغذي (مثل التغيرات في غير العضوية أنواع جديدة الكربون والمعادن أنواع جديدة) وبالتالي تؤثر على التفاعلات بين الطحالب ملزمة المواقع والمغذيات والمعادن. كان مطلوبا من إعداد دقيق للمعدات مختبر لهذه الدراسات من هذا القبيل أن التوازن الشامل الدقيق للمعادن قدم لا يمكن أن يؤديها. خطوات أخرى في عملية لديها القدرة على تقديم مجهولي المصير للمعادن تسليط الضوء على الحاجة إلى استخدام المذيبات الصف المناسبة والمواد الكيميائية. QC المناسبة من خلال عملية يمكن أن تحدد بشكل فعال إدخال ملوثات المعادن الثقيلة.
أظهرت النتائج وتوزع الملوثات قدم بين الكتلة الحيوية (الشكل 3)، وسائل الإعلام (الشكل 4) والبيئة. الملوثات غير العضوية وجدت في N. تحصد يقترح سالينا أن هذا الطحالب سوف incorporatه العديد من الملوثات غير العضوية الموجودة في غازات المداخن. هذا الاستيعاب يمكن أن يكون نتيجة لامتزاز على جدران الخلايا نظرا لمواقع مشحونة ملزمة، وامتصاص داخل الخلية بسبب النشاط الأيضي، وهطول الأمطار من المجمعات شكلت مع العناصر الموجودة في المتوسطة 28. ظهرت بصريا مفاعلات مع الملوثات غير العضوية بعد بضعة أيام صفراء اللون بالمقارنة مع الأخضر الداكن من المفاعلات السيطرة. وكانت الكتلة الحيوية الملوثة تحصد لا تختلف بصريا من الكتلة الحيوية خالية من الملوثات بعد تشكيل بيليه بعد الحصاد بواسطة الطرد المركزي. ويعزى الفرق اللون البصرية قبل الحصاد إلى انخفاض الكتلة الحيوية الكثافة وأكد الطحالب. الملوثات لم تتم إزالة في الكتلة الحيوية لديها القدرة على التراكم في وسائل الإعلام كما هو موضح في الشكل (4). تراكم في وسائل الإعلام يمثل إمكانات للحد من النطاق الذي يمثل إعادة التدوير وسائل الإعلام ضرورة لالجدوى الاقتصادية. سوف تملي الحدمن التسامح لملوثات المعادن الثقيلة التي ستكون أنواع محددة. نتائج هذه الدراسة تسلط الضوء على الحاجة إلى فهم أفضل للتأثيرات السلبية المحتملة على دمج أنظمة نمو الطحالب مع مصادر الكربون النفايات، وتحديدا الفحم غاز المداخن القائمة. نتائج هذه الدراسة تسلط الضوء على احتياجات لفهم الآثار المترتبة الإنتاجية من الملوثات الأخرى المتوقع أن تكون موجودة في غازات المداخن مثل أكاسيد الكبريت والنيتروجين، والغبار الناعم، والملوثات العضوية مثل الديوكسين ثنائي البنزين متعدد الكلور وثنائي بنزو الفوران. لقد افترض تقييم TEA وLCA السابقة التكامل السلس دون النظر في آثار الملوثات مثل المعادن الثقيلة والملوثات غير العضوية على الإنتاجية. بشكل عام النتائج من هذا العمل تسليط الضوء على تأثير نظام متعدد المعادن على الإنتاجية، ويمكن استخدامها لفهم إمكانات الطحالب الدقيقة إلى bioremediate الملوثات.
والمنهجية المقدمة سمح لعشردراسة (ه) من الملوثات غير العضوية مع نتائج قابلة للتكرار لالطحالب. تم العثور على بعض الملوثات غير العضوية المستخدمة في هذه التجربة تقليديا في أنظمة النمو بتركيزات منخفضة، ولكن الآخرين لم يكن لديك وظيفة معروفة في الخلية. ونتيجة لذلك الخليط متعددة العناصر من و، الكادميوم، الكوبالت، النحاس والزئبق والمنجنيز والنيكل، والرصاص، بينالي الشارقة، سي، القصدير، V والزنك عند التركيز هو مبين في الجدول رقم 4 النمو الكبت. ويمكن قياس كمية الملوثات في الكتلة الحيوية إثبات التحدي في النظم المتعددة المعادن. في كثير من الأحيان، يمكن أن العينات مع محتويات عالية من المواد العضوية والأملاح تنتج التدخلات المصفوفة، التدخلات متعدد الذرات، التدخلات البدنية والملح تتراكم في المخاريط الذي يؤدي في نهاية المطاف إلى قراءات غير دقيقة وفقدان الدقة التحليلية 29،30. عينات مراقبة الجودة تعمل جنبا إلى جنب مع العينات التجريبية ساعدت على تحديد دقة ودقة من القراءات. وقد أظهرت قياس التحاليل باستخدام البروتوكولات وضعت لهذه الدراسة أن تكونccurate ودقيقة انتاج المستردة مقبولة التى تقع فى أداء مقبول لهذا النوع من الدراسة 25،29. وقد أظهر هضم العينات عن طريق المايكرويف أن تكون فعالة لN. سالينا كما كانت عينات هضمها واضحة بدون وجود حطام خلية أو أجزاء قابلة للامتزاج. مصفوفة المستخدمة في هذا تجارب (الكتلة الحيوية للطحالب ومياه البحر الاصطناعي) أنتجت التدخلات المصفوفة التي تم التغلب عليها عن طريق مصفوفة التخفيف. ومع ذلك، يمكن أن حجم العينة الكتلة الحيوية أعلى من تلك التي استخدمت في هذه التجربة أن يؤدي إلى تدخلات مصفوفة، وبالتالي QC ينبغي تحليلها لكل سيناريو محدد.
Subscription Required. Please recommend JoVE to your librarian.
Materials
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Sodium chloride | Fisher Scientific | S271-3 | |
| Calcium chloride dihydrate | Fisher Scientific | C79-500 | |
| Potassium chloride | Fisher Scientific | P217-500 | |
| Sodium meta silicate nonahydrate | Fisher Scientific | S408-500 | |
| Magnesium sulfate heptahydrate | Fisher Scientific | M63-500 | |
| Potassium nitrate | EMD Chemical | PX1520-5 | |
| Potassium phosphate monobasic | Fisher Scientific | P285-500 | |
| Ammonium ferric citrate | Fisher Scientific | I72-500 | |
| Boric acid | Fisher Scientific | A73-500 | |
| Sodium molybdate, dihydrate | EMD Chemical | SX0650-2 | |
| Manganese chloride tetrahydrate | Fisher Scientific | M87-500 | |
| Zinc sulfate heptahydrate | Fisher Scientific | Z68-500 | |
| Cupric sulfate pentahydrate | Fisher Scientific | C489-500 | |
| Biotin | Acros Organics | 230090010 | |
| Thiamine | Acros Organics | 148990100 | |
| Vitamin B12 | Acros Organics | 405920010 | |
| Copper (II) chloride dihydrate | Sigma-Aldrich | 221783-100G | Irritant, Dangerous to the Environment |
| Lead (II) chloride | Sigma-Aldrich | 268690-250G | Toxic, Dangerous to the Environment |
| Sodium dichromate dihydrate | Sigma-Aldrich | 398063-100G | Oxidizing, Highly Toxic, Dangerous to the Environment |
| Cobalt (II) chloride hexahydrate | Sigma-Aldrich | 255599-100G | Toxic, Dangerous to the Environment |
| Nickel (II) chloride hexahydrate | Sigma-Aldrich | 223387-500G | Toxic, Dangerous to the Environment |
| Sodium (meta) arsenite | Sigma-Aldrich | 71287 | Toxic, Dangerous to the Environment |
| Cadmium chloride | Sigma-Aldrich | 202908-10G | Highly Toxic, Dangerous to the Environment |
| Mercury (II) chloride | Sigma-Aldrich | 215465-100G | Toxic, Dangerous to the Environment |
| Tin (II) chloride dihydrate | Fisher Scientific | T142-500 | Corrosive. Suitable for Hg analysis. Very hazardous. |
| Manganese chloride tetrahydrate | Fisher Scientific | M87-500 | |
| Vanadium (V) oxide | Acros Organics | 206422500 | Dangerous to the Environment |
| Carbon dioxide | Air Liquide | I2301S-1 | Compressed |
| Hydrogen peroxide | H325-500 | Fisher Scientific | 30% in water |
| ICP-MS standard | ICP-MS-6020 | High Purity Standards | |
| Mercury standard | CGHG1-1 | Inorganic Ventures | 1000±6 µg/mL in 5% nitric acid |
| Argon | Air Liquide | Compressed | |
| Helium | Air Liquide | Compressed, ultra high purity | |
| Hydrogen | Air Liquide | Compressed, ultra high purity | |
| Nitric acid | Fisher Scientific | A509-P212 | 67-70% nitric acid, trace metal grade. Caution: manipulate under fume hood. |
| Hydrochloric acid | Fisher Scientific | A508-P212 | 35% hydrochloric acid, trace metal grade. Caution: manipulate under fume hood. |
| Equipment | |||
| Scientific prevacuum sterilizer | Steris | 31626A | SV-120 |
| Centrifuge | Thermo Fisher | 46910 | RC-6 Plus |
| Spectrophotometer | Shimadzu | 1867 | UV-1800 |
| pH controller | Hanna | BL981411 | X4 |
| Rotometer, X5 | Dwyer | RMA-151-SSV | T31Y |
| Rotometer, X5 | Dwyer | RMA-26-SSV | T35Y |
| Water bath circulator | Fisher Scientific | 13-873-45A | |
| Compact chiller | VWR | 13270-120 | |
| Freeze dryer | Labconco | 7752020 | |
| Stir plate | Fisher Scientific | 11-100-49S | |
| pH lab electrode | Phidgets Inc | 3550 | |
| Inductively coupled plasma mass spectrometer | Agilent Technologies | 7700 Series ICP-MS | Attached to autosampler CETAC ASX-520 |
| FIAS 100 | Perkin Elmer Instruments | B0506520 | |
| Atomic absorption spectrometer | Perkin Elmer Instruments | AAnalyst 800 | |
| Cell heater (quartz) | Perkin Elmer Instruments | B3120397 | |
| Microwave | Milestone | Programmable, maximum power 1,200 W | |
| Microwave rotor | Milestone | Rotor with 24-75 ml Teflon vessels for closed-vessel microwave assisted digestion. | |
| Materials | |||
| 0.2 μm syringe filter | Whatman | 6713-0425 | |
| 0.2 μm syringe filter | Whatman | 6713-1650 | |
| 0.45 μm syringe filter | Thermo Fisher | F2500-3 | |
| Polystyrene tubes | Evergreen | 222-2094-050 | 17 x 100 mm w/cap, 16 ml, polysteryne |
| Octogonal magnetic stir bars | Fisher scientific | 14-513-60 | Magnets encased in PTFE fluoropolymer |
References
- Dismukes, G. C., Carrieri, D., Bennette, N., Ananyev, G. M., Posewitz, M. C. Aquatic phototrophs: efficient alternatives to land-based crops for biofuels. Curr Opin Biotechnol. 19 (3), 235-240 (2008).
- Moody, J. W., McGinty, C. M., Quinn, J. C. Global evaluation of biofuel potential from microalgae. Proceedings of the National Academy of Sciences. 111 (23), 8691-8696 (2014).
- Pinto, E., et al. Heavy metal-induced oxidative stress in algae. J Phycol. 39 (6), 1008-1018 (2003).
- Gupta, A., Lutsenko, S. Evolution of copper transporting ATPases in eukaryotic organisms. Curr Genomics. 13 (2), 124-133 (2012).
- Perales-Vela, H. V., Peña-Castro, J. M., Cañizares-Villanueva, R. O. Heavy metal detoxification in eukaryotic microalgae. Chemosphere. 64 (1), 1-10 (2006).
- Sandau, E., Sandau, P., Pulz, O. Heavy metal sorption by microalgae. Acta Biotechnol. 16 (4), 227-235 (1996).
- Amer, L., Adhikari, B., Pellegrino, J. Technoeconomic analysis of five microalgae-to-biofuels processes of varying complexity. Bioresour Technol. 102 (20), 9350-9359 (2011).
- Benemann, J. R., Goebel, R. P., Weissman, J. C., Augenstein, D. C. Microalgae as a source of liquid fuels. Final Technical Report, US Department of Energy, Office of Research. , (1982).
- Benemann, J. R., Oswald, W. J. Report No. DOE/PC/93204--T5 Other: ON: DE97052880; TRN: TRN. Systems and economic analysis of microalgae ponds for conversion of CO2 to biomass. , (1996).
- Chisti, Y. Biodiesel from microalgae. Biotechnol Adv. 25 (3), 294-306 (2007).
- Davis, R., Aden, A., Pienkos, P. T. Techno-economic analysis of autotrophic microalgae for fuel production. Applied Energy. 88 (10), 3524-3531 (2011).
- Jones, S., et al. Process design and economics for the conversion of algal biomass to hydrocarbons: whole algae hydrothermal liquefaction and upgrading. U.S. Department of Energy Bioenergy Technologies Office. , (2014).
- Lundquist, T. J., Woertz, I. C., Quinn, N. W. T., Benemann, J. R. A realistic technology and engineering assessment of algae biofuel production. Energy Biosciences Institute. , Berkeley, CA. (2010).
- Nagarajan, S., Chou, S. K., Cao, S., Wu, C., Zhou, Z. An updated comprehensive techno-economic analysis of algae biodiesel. Bioresour Technol. 145, 150-156 (2011).
- Pienkos, P. T., Darzins, A. The promise and challenges of microalgal-derived biofuels. Biofuels Bioproducts & Biorefining-Biofpr. 3, 431-440 (2009).
- Richardson, J. W., Johnson, M. D., Outlaw, J. L. Economic comparison of open pond raceways to photo bio-reactors for profitable production of algae for transportation fuels in the Southwest. Algal Research. 1 (1), 93-100 (2012).
- Rogers, J. N., et al. A critical analysis of paddlewheel-driven raceway ponds for algal biofuel production at commercial scales. Algal Research. 4, 76-88 (1016).
- Sun, A., et al. Comparative cost analysis of algal oil production for biofuels. Energy. 36 (8), 5169-5179 (2011).
- Thilakaratne, R., Wright, M. M., Brown, R. C. A techno-economic analysis of microalgae remnant catalytic pyrolysis and upgrading to fuels. Fuel. 128, 104-112 (2014).
- Quinn, J. C., et al. Nannochloropsis production metrics in a scalable outdoor photobioreactor for commercial applications. Bioresour Technol. 117, 164-171 (2012).
- Borkenstein, C., Knoblechner, J., Frühwirth, H., Schagerl, M. Cultivation of Chlorella emersonii with flue gas derived from a cement plant. J Appl Phycol. 23 (1), 131-135 (2010).
- Douskova, I., et al. Simultaneous flue gas bioremediation and reduction of microalgal biomass production costs. Appl Microbiol Biotechnol. 82 (1), 179-185 (2009).
- Israel, A., Gavrieli, J., Glazer, A., Friedlander, M. Utilization of flue gas from a power plant for tank cultivation of the red seaweed Gracilaria cornea. Aquaculture. 249 (1-4), 311-316 (2012).
- Napan, K., Teng, L., Quinn, J. C., Wood, B. Impact of Heavy Metals from Flue Gas Integration with Microalgae Production. , Algal Research. (2015).
- Eaton, A. D., Clesceri, L. S., Rice, E. W., Greenberg, A. E. 3125B. Inductively coupled plasma/mass spectrometry (ICP/MS) method. Standard methods for the examination of water and wastewater. , (2005).
- Eaton, A. D., Clesceri, L. S., Rice, E. W., Greenberg, A. E. Standard methods for the examination of water and wastewater. , APHA-AWWA-WEF. (2005).
- Matrix effects in the ICP-MS analysis of selenium in saline water samples. Smith, M., Compton, J. S. Proceedings of the 2004 Water Institute of Southern Africa Biennial Conference, Cape Town, South Africa, , (2004).
- Mehta, S. K., Gaur, J. P. Use of algae for removing heavy metal ions from wastewater: progress and prospects. Crit Rev Biotechnol. 25 (3), 113-152 (2005).
- EPA, U. Method: 200.8: Determination of trace elements in waters and wastes by inductively coupled plasma - mass spectrometry. , (1994).
- Eaton, A. D., Clesceri, L. S., Rice, E. W., Greenberg, A. E. 3120B. Inductively coupled plasma (ICP) method. Standard methods for the examination of water and wastewater. , (2005).
Tags
العلوم البيئية، العدد 101، والطحالب، والمعادن الثقيلة،Get cutting-edge science videos from JoVE sent straight to your inbox every month.









