Abstract
Повышение спроса на возобновляемые виды топлива имеет исследователей, изучающих возможность альтернативных сырья, таких, как микроводорослей. Присущие преимущества включают высокую потенциальную урожайность, использование не пахотных земель и интеграции с потоками отходов. Потребности в питательных веществах масштабной производственной системы микроводорослей потребует сцепление возделывания систем с ресурсами промышленных отходов, таких как двуокись углерода из дымовых газов и питательных веществ из сточных вод. Неорганические примеси, присутствующие в этих отходов может потенциально привести к биоаккумуляции в микроводорослей биомассы негативно повлиять производительность и предельный конечного использования. Это исследование фокусируется на экспериментальной оценки воздействия и о судьбе 14 неорганических загрязнителей (As, Cd, Co, Cr, Cu, Hg, Mn, Ni, Pb, Sb, Se, Sn, V и Zn) на Nannochloropsis роста Салина , Микроводорослей культивируется в фотобиореакторах освещаются в 984 мкмоль м -2 с -1 и выдерживают при рН 7 в рост мEdia загрязнены неорганических загрязнений на уровне ожидалось на основании композиции, найденного в коммерческих системах угля дымовых газов. Загрязняющих веществ, присутствующих в биомассе и среде в конце периода роста 7 дней были количественно анализировали с помощью холодного пара атомно-абсорбционной спектрометрии для Hg и через индуктивно-связанной плазмы масс-спектрометрии для As, Cd, Co, Cr, Cu, Mn, Ni, Pb, Sb, Se, Sn, V и Zn. Результаты показывают, N. Салина чувствительны к деформации различных металлов окружающей среды с уменьшением статистической биомассы yieldwith введения этих примесей. Методы, представленные здесь, являются достаточными для количественной оценки роста водорослей и определения судьбы неорганических загрязнений.
Introduction
По сравнению с традиционными наземными культур микроводорослей были показаны для достижения более высоких биомассы и липидов урожаи из-за присущих более высокой эффективности преобразования солнечной 1,2. Выращивание микроводорослей при высоких скоростях производительности требует питания различных питательных веществ, включая внешнего источника углерода. Ожидается, что крупные объекты роста будут интегрированы с потоками промышленных отходов, таких как промышленных дымовых газов с целью минимизации издержек производства и в то же время обеспечивает восстановление окружающей среды. Промышленные отходы углерода, как правило, в виде газообразного диоксида углерода и может содержать примеси, которые потенциально могут отрицательно повлиять производства микроводорослей. В частности, дымовой газ получают из угля будет иметь различные загрязнений, включая, но не ограничиваясь ими продуктов сгорания воды и углекислого газа, а также оксиды серы и азота, мелкой пыли, органических примесей, таких как диоксины и фураны, и неорганического Contaminants, такие как тяжелые металлы. Влияние большинства этих загрязнителей, включая неорганических с некоторыми из них известен как тяжелых металлов на продуктивность микроводорослей не были изучены. Некоторые из этих элементов могут быть питательные вещества в соответствующих концентрациях, однако при более высоких концентрациях они могут производить дисфункцию клеток и даже смерть 3.
Интеграция микроводорослей с промышленной дымовых газов имеет потенциал непосредственно вводить неорганические загрязнения в ростовой среде. Уголь на основе дымовых газов имеет целый ряд неорганических элементов (например, As, Cd, Co, Cr, Cu, Hg, Mn, Ni, Pb, Sb, Se, Sn, V и Zn) в различных концентрациях, некоторые из которых, в странах с низким концентрация, представляют питательные вещества для роста микроводорослей. Неорганические загрязняющие вещества с высоким сродством связывается с микроводорослей и дополнительно сорбируются внутри через питательных перевозчиков. Некоторые неорганические загрязнители (т.е., Co, Cu, Zn и Mn) питательные вещества, которые являются частью ферментов включаютd в процессе фотосинтеза, дыхания и других функций 3,4. Тем не менее, в избыточных металлов и металлоидов может быть токсичным. Другие элементы, такие как Pb, Cd, Sn, Sb, Se, As и Hg, не известны для поддержки функции клеток в любой концентрации и представляют собой средства питательных веществ металлов, которые могут негативно повлиять на 3,5,6 роста культуры. Наличие любого из этих загрязняющих веществ имеет потенциал для производства негативное воздействие на функции клеток микроводоросли. Кроме того, взаимодействие нескольких металлов с микроводорослей усложняет динамику роста и имеет потенциал, чтобы влиять рост.
Крупномасштабные экономика были непосредственно связаны с производительностью системы культивирования 7-19. Кроме того, средний утилизация в системе роста микроводорослей для открытых водоемах либо направляющими (ОВП) или фотобиореакторах (PBR) является критическим, поскольку он представляет 99,9 и 99,4% от массы, соответственно 20. Наличие неорганических загрязнений в средствах массовой информации в конечном счете может ограничить мПроизводительность icroalgae и переработка СМИ в связи с загрязняющей накопления. Это исследование экспериментально определили влияние 14 неорганические загрязнители (As, Cd, Co, Cr, Cu, Hg, Mn, Ni, Pb, Sb, Se, Sn, V и Zn), в концентрациях, ожидаемых от интеграции систем выращивания микроводорослей с угля происходит дымового газа, на продуктивность N. Салина вырос в НРБ воздушных перевозок. Загрязняющие вещества, используемые в данном исследовании было показано, что не только присутствовать в угольной дымовых газов, но твердых бытовых отходов на основе дымовых газов, на основе биогенного топочного газа, городских сточных вод, добываемой воды, нарушение грунтовых вод и морской воды 21-23. Концентрации, используемые в данном исследовании, основаны на том, что можно было бы ожидать, если бы системы роста микроводорослей были интегрированы с угольной основе СО 2 источника с захвата эффективности продемонстрировано в коммерческих системах PBR 20. Подробные расчеты, поддерживающие концентрации тяжелых металлов и неорганических загрязнений представлены в Napanи др. 24 Аналитические методы были использованы, чтобы понять распределение большинства металлов в биомассе, средства массовой информации и среды. Методы, представленные включен оценку производительности потенциала микроводорослей в неорганической загрязнений стресса и количественного их конечного судьбы.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Система Рост

Рисунок 1. Система микроводорослей роста. () Воздуха rotometer, (Б) СО 2 rotometer, (С) контроллер рН с соленоида (D) регистратор данных (E) в линию воздушных фильтров (F), заголовок распределения воздуха, (G), флуоресцентный свет банк, (Н) рН-метры, система (I), охлаждения (J), водяная баня (К) провод термопары (L), эрлифта фотобиореактор, (М) автономный обогреватель (N), ходить в парах капот, (О) вентиляционные (Р) подачи воздуха капиллярная трубка, (Q) воздушные фильтры (R) трубки для отбора пробы (S) PBR силиконовые крышки, и (Т)рН также в силиконовой крышкой. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
- Постройте следующую микроводорослей экспериментальную систему роста (рис 1).
- Приобретать двенадцать воздушных перевозок НРБ, состоящие из стеклянных трубчатых реакторах 4,5 см в диаметре и 80 см в высоту с выращивания мощностью 1,1 л с силиконовыми крышками. Приобретать нарезанные стекла капилляров (5 мм внешний диаметр 1 мм внутренний диаметр) 10 см (3 в PBR) и 85 см (по 1 на PBR) в длину.
- Замораживание силиконовые крышки в -80 ° C морозильнике. Смажьте сверло с глицерином и в то время крышки заморожены дрель 3 отверстия для размещения вентиляционные, отбора проб и доставки газа капиллярных трубок и 1 отверстие диаметром 17 мм для размещения рН зонда.
- Вставьте 3 капилляров в месте с самой длинной трубы, проходящей на 2 см от дна PBR. В другом капиллярной трубки добавить силиконовой трубки Wiго капиллярной трубки, прикрепленный к другому концу, проходящей в нужную точку дискретизации. Закройте отверстие для рН-метра с размером силикона пробки 21D.
- Увлажняйте окружающий воздух путем пропускания его через воду и доставить увлажненный воздух в заголовке распределения воздуха. Пропустите газ через 0,2 мкм фильтр и поставить его в суспензии водорослей через длинный доставки стеклянной капиллярной трубки.
- Доставка сжатого CO 2 в увлажненной воздушного потока с целью поддержания нейтрального рН 7,0 ± 0,1 в культуральной суспензии. Управление скоростью доставки СО 2 с автоматизированной СО 2 диспансер системы (контроллер рН), что открывает магнитный соленоид, когда культуры водорослей достигает рН 7.1 и закрывает при рН 6,9.
- Обеспечить свет, используя 24 T5 люминесцентных ламп, которые приводят в среднем освещения 984 мкмоль м -2 с -1, аналогичной пика внешним условиям.
- Погружают НРБ на водяной бане, чтобы мAINTAIN постоянную температуру около 25 ° С. Контролировать температуру системы с помощью рециркуляции охладитель и автоматизированную нагрева циркулирующей воды ванны блока управления.
- Монитор температуры и рН в режиме реального времени и запись с регистратором данных.
- Убедитесь, что все компоненты системы роста микроводорослей правильно работать, особенно до уборки микроводорослей прививочный или подготовки неорганические загрязнения, поскольку они не могут быть сохранены.
2. Лаборатория Посуда Подготовка
- Вымойте мерных колб, НРБ, бутыли и любые контейнеры, с мылом и водопроводной воды. Промыть деионизированной водой (ДВ).
- Кислота промыть лабораторное оборудование для того, чтобы устранить любые следы неорганических загрязнений. Это может быть сделано с помощью одного из двух способов:
- Замочите лабораторное оборудование O / N в 10% микроэлемент сорта азотной кислоты (Внимание: не дыхание пары, концентрированная азотная кислота может привести к серьезным горения и токсичных паров, работа в вытяжном огоD Использование нитриловые перчатки, защитные очки и халат).
- Замочите посуду лаборатории в течение 15 мин в 50% следов металлов сорта азотной кислоты.
- Промойте лабораторное оборудование с DW тщательно, по крайней мере в 3 раза, делая, что все кислоту удаляют. Очень важно, что НРБ тщательно промыть, особенно трубы отбора проб и капиллярных трубок. Неспособность сделать это будет производить подкисления среды и возможного ингибирования роста. Испытание рН промывной воды, чтобы проверить все кислоты был удален.
- Стерилизовать НРБ, контейнеров и колб в автоклаве их при температуре 120 ° С и стандартном атмосферном давлении в течение по крайней мере 30 мин.
3. Н. Салина Средний Подготовка
- Получение раствора А: Частично заполнить 1 л мерную колбу с DW. Вставка магнитной мешалкой и добавить химические вещества, приведенные в таблице 1, один за другим. Убедитесь, что каждый ингредиент растворяется перед добавлением следующего компонента. Удалить магнит и заполнить тысе колбу на 1 л объема отметки.
| Компонент | Сумма добавить (г) | Конечная концентрация (г / л) |
| Н 3 ВО 3 | 0.900 | 0.900 |
| На 2 МоО 4 · 2H 2 O | 0,012 | 0,012 |
| MnCl 2 · 4H 2 O | 0.300 | 0.300 |
| ZnSO 4 · 7H 2 O | 0,060 | 0,060 |
| CuSO 4 · 5H 2 O | 0,020 | 0,020 |
Таблица 1:. Решение рецепт Количества количества, необходимые для приготовления 1 л концентрированного раствора.
- Подготовка витамина решения: в трех отдельных обumetric колбы добавляют витамины, как показано в таблице 2. Фильтр каждого витамина раствора через стерильный шприцевой фильтр 0,2 мкм в стерильный контейнер. Сохранить витамины при -4 ° С в темноте.
| Витамины | Сумма (мг) | Конечный объем (мл) | Конечная концентрация витамина (мг / л) |
| Биотин | 12.22 | 500 | 24.43 |
| Витамин В12 | 13.50 | 100 | 135.00 |
| Тиамин гидрохлорид | 977,63 | 500 | 1,955.27 |
Таблица 2:. Витамин решение Рецепт Количества количества, необходимые для приготовления концентрированной Солуния.
- Частично заполнить 20 л автоклавируемый контейнер с DW и вставьте магнитной мешалкой. Поместите контейнер на верхней части магнитной мешалкой пластины и добавить химические вещества, приведенные в таблице 3 (за исключением витаминов), добавив их один за другим, и после каждого полного растворения. Заполните контейнер для достижения 20 L.
| Компонент | Сумма добавить в среде | Блок |
| NaCl | 350.00 | г |
| CaCl 2 · 2H 2 O | 3.00 | г |
| KCl | 9.60 | г |
| На 2 SiO 3 · 9Н 2 O | 1.14 | г |
| MgSO 4 · 7H 2 O | 29.60 | г |
| 20.40 | г | |
| KH 2 PO 4 | 1.36 | г |
| Аммония железа цитрат | 0.10 | г |
| Решение | 20.00 | мл |
| Биотин решение * | 818.00 | мкл |
| Витамин В12 решение * | 296,20 | мкл |
| Тиамин гидрохлорид решение * | 521,60 | мкл |
| * Добавить в охлажденном автоклавного СМИ |
Таблица 3: Н. Салина среднего рецепт. Количества суммы, необходимые в подготовке 20 л питательной среде.
- Стерилизацию среды в автоклаве в течение 30 мин при 120 ° С и атмосферном давлении. Пусть средний воркуютл до комнатной температуры.
- Поместите контейнер на магнитной мешалки пластины. Добавить витамины, полученного на стадии 3.2, и пусть средний тщательно перемешать.
4. Неорганические примеси массоподготовки
- Частично заполнить мерных колб, указанные в таблице 4, DW и добавить отдельные соли в списке. Залейте DW до требуемой конечного объема и тщательно перемешать. Не сохранять эти запасы, как некоторые элементы адсорбируются на стенках колбы
ВНИМАНИЕ: Некоторые неорганические загрязнители, используемые в настоящем протоколе являются канцерогенными, тератогенными и мутагенными свойствами, носить маску, перчатки и халат при обращении соли.
| Аналит | Соль источник | Объем наличии подготовить (L) | Соль добавить в колбу60; (Мг соли) | Концентрации анализируемого вещества в культуру добавляли (мг анализируемого вещества / л) |
| В качестве | NAASO 2 | 0,1 | 14,8 | 7.74E-02 |
| CD | CdCl 2 | 0,5 | 13,5 | 1.50E-02 |
| Компания | CoCl 2 · 6H 2 O | 0,5 | 34,7 | 1.56E-02 |
| Cr | На 2 Cr 2 O 7 · 2H 2 O | 0,1 | 40,6 | 1.29E-01 |
| Cu | CuCl 2 · 2H 2 O | 0,1 | 38,3 | 1.30E-01 |
| Ртуть | HgCl 2 | 1.0 14.6 | 9.80E-03 | |
| Миннесота | MnCl 2 · 4H 2 O | 0,1 | 58,8 | 1.49E-01 |
| Ni | NiCl 2 · 6H 2 O | 0,1 | 112,0 | 2.51E-01 |
| Pb | PbCl 2 | 0,5 | 39,9 | 5.41E-02 |
| Sb | Sb 2 O 3 | 0,5 | 26,7 | 4.06E-02 |
| Се | На 2 SEO 3 | 0,5 | 11,8 | 9.80E-03 |
| Sn | SnCl 2 · 2H 2 O | 0,5 | 3.9 | 3.76E-03 |
| В | V 2 O 5 | 0,1 | 22,2 | 1.13E-01 |
| Zn | ZnCl 2 | 0,1 | 99,9 | 4.36E-01 |
Таблица 4:. Концентрированный препарат неорганического загрязнения сток добавлением 1 мл этого концентрированного наличии в 1,1 л PBR среды производит конечной концентрации, показанной в последнем столбце.
- Стерилизация неорганические запасы загрязняющих пропусканием раствора через стерильный шприцевой фильтр 0,2 мкм и собирают фильтрат в стерильную пробирку.
5. Н. Салина Инокулят Производство
- В колбу Эрленмейера на 500 мл добавляют 200 мл среды, полученный на стадии 3, и затем добавляют 3 г агар. Накройте колбу алюминиевой фольги и автоклаве в течение 20 мин при 120 ° С. Залейте раствор в стерильных чашках Петри и дайте ему остыть до тех пор, пока застывает. Это должно быть завершено быть стерильным капотом или по крайней мере рядом с пламенем в чистой окружающей среде, чтобы уменьшить риск заражения.
- Серия Н. Салина клетки в стерильные чашки-DISHES, полученного на стадии 5.1, используя стерильный посева петлю. Поместите чашку Петри культур на столе, освещенной с огнями T12 поддерживается при комнатной температуре. Пусть микроводорослей расти, пока колонии не видно.
- Колонии передачи в стерильные толку колб Эрленмейера, содержащих 200 мл питательной богатой среде, подготовленные в шаге 3, и держать их на освещенной шейкер таблице (1000 оборотов в минуту). Давайте культуры растут до тех пор, пока среда становится зеленым.
- Передача микроводорослей в 1,1 л стерильной PBR. Поместите PBR в посевной водяной бане освещается 200 мкмоль м-2 с-1 с люминесцентными лампами T8 и поддерживается на уровне 23 ° С с помощью рециркуляционного охладителя и автоматизированной нагрева рециркуляционного контроля водяной бане. Отрегулируйте воздух и CO 2 rotometers 2,5 л мин -1 и 25 см мин -1, соответственно.
- После недели сплит рост биомассы в новых 1 .1 L НРБ, содержащих новую среду, и пусть он не расти, пока в общей сложности не менее 28 г сухого веса биомассыполученные между двумя реакторами, которые могут быть определены посредством оптической плотности.
- Урожай посевной биомассы центрифугированием при 2054 х г в течение 15 мин при 10 ° С с использованием стерильных бутылки центрифуги и стерильные методы, чтобы избежать загрязнения. Утилизацию супернатанта и продолжают концентрации клеток по мере необходимости.
- После того как все биомассу центрифугируют, повторно приостанавливать клеток в 300 мл свежего стерильной среде.
- Развести 0,1 мл культуры микроводорослей в 3 мл DW, а затем разбавленную 0,1 мл этом новом растворе в 3 мл DW. Убедитесь, что образец тщательно перемешивают. Измерьте оптическую плотность (ОП) в микроводорослей концентрата на 750 нм () немедленно с помощью спектрофотометра.
- Используйте уравнение (1) для определения количества биомассы в концентрате.
Примечание: Уравнение (1) была получена из линейной регрессии между отношению к общей взвешенных твердых частиц (в г / л -1) для N. Салина (R 2 = 0,9995). Уравнение 1 был разработан для СПЕКТРophotometer модели в таблице материалов, генерировать новую калибровку при использовании другой спектрофотометра модели.- Используя уравнение (2) вычислить объем микроводорослей концентрата (по L), необходимых для получения плотности 4 г / л -1 культуры в PBR 1,1 л объема (л).
- Использование стерильных методов, добавьте объем микроводорослей концентрата нашли на этапе 5.9 на автоклавного PBR достичь начальной плотности культуры 4 г / л -1. Заполните PBR со средой до 1,1 L. Повторите этот шаг, пока не 6 НРБ заражают. Поместите НРБ в посевной водяной бане.
- Пусть микроводорослей в НРБ расти в течение 8 дней, а затем собирать биомассу (по повторяющимся шагом 5,6 до 5,7). Повторите шаг 5,8 для расчета начальнойОбъем инокулята для начальной плотности культуры 1 г / л -1.
6. Экспериментальные реакторы
- С использованием стерильной методики добавить приблизительно 1 л среды, полученного на стадии 3 к каждой из 12-кислотных промывали стерильным НРБ. Поместите НРБ в водяной бане экспериментальной системы роста. Включите Промойте воздух на 1,5 л мин -1.
- Стерилизация калиброванный рН-метр путем очистки его 70% -ным этанолом. Измерить рН среды в PBR и обеспечить рН примерно 7,0; если нет, повторите шаг 2, чтобы удалить кислоту выщелоченного от полоскания кислоты.
- Калибровка каждого контроллера, используя рН буфера рН 7, дезинфекции зондов с использованием этанола (70%), а затем вставить их в крышках НРБ.
- Для каждого PBR (за исключением контрольных НРБ) добавить 1 мл каждого из стерильных неорганические загрязнители запасов, подготовленных на шаге 4. Пусть загрязнения тщательно перемешать в PBR. Конечная концентрация неорганических загрязнений в НРБ являются шоуп в последней колонке таблицы 4, и расчетные максимальные концентрации ожидать от угольной электростанции интеграции.
- Добавить 14 мл стерильного DW с контрольными НРБ.
- Добавить концентрированного микроводорослей инокулята, полученного на стадии 5.11 экспериментальным НРБ, чтобы получить начальную плотность культуры 1 г / л -1. Пусть смесь биомассы тщательно.
- Включите фары высокие интенсивности света (из 984 мкмоль м -2 с -1) и контроллеров рН и отрегулируйте CO 2 до 30 см мин 1. Увеличьте поток СО 2 до 50 см мин -1 от 3 день после. Начальная скорость потока с низким CO 2 является критическим для того, чтобы избежать больших изменений в рН-за задержек в газ / жидкость передачи и измерения рН.
- Измерьте и взять образцы по мере необходимости. Убедитесь, чтобы отметить уровень воды после отбора проб. (ВНИМАНИЕ: некоторые неорганические загрязнители в PBR являются канцерогенными, мутагенными и тератогенными; используйте перчатки и CAPPред контейнеры при работе с образцами).
- Добавить стерильной DW ежедневно в НРБ с целью компенсации потерь из-за испарения.
- После 7 дней роста, урожай биомассы путем центрифугирования при 9936 × г и сохранить как, биомассы и надосадочную среду, при -80 ° С.
- Замораживание сухой биомассы на 0,1 мбар и -50 ° CO / N. Порошок биомассы (используйте шпатель для порошка биомассы внутри центрифуги трубы). Сохранение лиофилизированного биомассы при -80 ° С.
7. Микроволновая печь Assisted Переваривание образцов
Переваривание образцов биомассы требуется в качестве стадии предварительной обработки для анализа ICP-MS.
Примечание: Эти шаги применять закрытую микроволновой судно системы пищеварения с облегчением регулируемым давлением. (ВНИМАНИЕ: Высокое давление во время разработки кислотного разложения, проверьте физическую целостность сосудов и пищеварения щитов, и изменить крышки микроволновая пищеварения сосудов перед каждым использованием).
- Вымойте тефлоновые микроволновая пищеварения сосуды с водой и мылом, промыть и пусть ДГ воздушные суда сухой. Для удаления загрязнений следов металлов в сосудах переварить кислоту, как описано в следующих шагах.
- Реформирование микроволновой пищеварение крышки сосудов и закрыть флаконы плотно.
- Добавьте 10 мл азотной кислоты на каждый.
- Представьте судно в безопасности щит. Убедитесь, что не биомасса, вода или любые реагенты остаются на стенках защитного кожуха или в наружных стенах пищеварения сосудов во избежание повреждения защитного кожуха. Закрывают безопасности щит с предохранительным клапаном убедившись весна во флаконе находится на одном уровне. Найдите щит на роторе с крышкой отверстия направлены наружу в наружном ряду, а внутрь во внутренней подряд.
- На судно номер один, вставьте керамической гильзы и датчика температуры. Этот термометр контролирует фактическую температуру во флаконе и служит в качестве контрольного параметра, чтобы выполнить пищеварения PROGRесть. Убедитесь, что номер один флакон содержит те же реагента и образца суммы, как и другие флаконах.
- Входные параметры пищеварения показано в таблице 5 и начать пищеварение. Когда программа закончилась, воздух прохладный флаконы, пока они не достигнут RT.
| Шаг | Флаконы для ополаскивания | Образец пищеварения | ||||
| Температура (° С) | Время (мин) | Максимум мощность (Вт) | Температура (° С) | Время (мин) | Максимум мощность (Вт) | |
| 1 | RT 190 | 25 | 1000 | RT 180 | 15 | 1000 |
| 2 | 190 | 10 | 1000 | 180 | 15 | 1000 |
| - | 20 | - | - | 20 | - |
Таблица 5: Параметры, используемые в программе микроволновая пищеварения.
- Внутри вытяжкой, вставьте инструмент сброса давления на крышке экрана с крышкой отверстия направлены от вас. После сброса давления открыть крышку (ВНИМАНИЕ: Всегда открытые флаконы переваривается внутри вытяжного шкафа, поскольку биомасса пищеварения с использованием кислоты образуются токсичные газы).
- Утилизировать кислоты. Промыть суда тефлоновые с DW 3 раза. Пусть флаконы высохнуть.
- Для переваривания биомассы, добавить 50 мг сублимированного биомассы СВЧ пищеварения судов. Для контроля качества (КК) подготовить следующие флаконов: в двух разных флаконах добавить либо 5 мл Уровень 7 МСПМС или 5 мл Уровень 7 рт CVAAS стандарта подготовлен в шагах 9.1 и 10.1 (переваренной решения от этого флакона называется лабораторию укрепленный пустым (LFB)), оставьте еще флакон пустой (переваренной решениеиз этого флакона называется лаборатория реагента бланка (ЛРБ)).
- Для переваривания среду, добавить 10 мл надосадочной среды для сухой кислоты промыть микроволновая пищеварения сосуды. Для контроля качества (КК) подготовить следующие флаконов: В двух разных флаконах добавить 5 мл Уровень 7 МСПМС или CVAAS стандарта металла, полученного на стадии 9.1 и 10.1 (переваренной решения от этого флакона называется LFB), в другой флакон добавить 10 мл DW (переваренный раствор, из этого флакона, называется LRB).
- Реформирование микроволновой пищеварение крышки сосудов и закрыть флаконы плотно.
- Добавить 7 мл концентрированной следов металлов класса азотной кислоты и 3 мл перекиси водорода в каждую пробирку. Перемешать содержимое, осторожно вращая решение. Дайджест содержимое флаконов, повторяя шаги 7,4 до 7,7 (использовать параметры СВЧ пищеварения для образца пищеварения в таблице 5).
- Добавить переваривается образца в 25 мл мерную колбу, полоскание сосуды с DW для повышения восстановления. Заполните мерную колбу с DWдо отметки.
- Передача переваривается образцы с колпачком контейнера. Сохранение образцов при 4 ° С до анализа не может быть завершена. Для этого анализа исследования делается тот же день на рт.ст. и в течение трех дней для других элементов.
8. Контроль качества (QC) Образцы
Примечание: Анализ образцов КК, чтобы обеспечить надежность результатов экспериментальных образцов.
- Частично заполнить кислоты промыть 1 л мерную колбу с DW. Добавить 280 мл концентрированной трассировки металла марки азотной кислоты и тщательно перемешать (это решение также называется пустым раствор) (ВНИМАНИЕ: всегда добавлять кислоту в воду, не добавляйте воду в кислоту, как экзотермическая реакция может быть жестоким). Пусть решение остыть до комнатной температуры.
- В дополнение к образцам КК, подготовленных в шагах 7,9 и 7,10, подготовить следующие образцы КК.
- Для продолжения проверки калибровки (CCV): Заполните полистирола трубки с калибровочной (для подготовки смшаг 9.2 и 10.1). Поставьте стандартное решение Hg на стойке CVAAS и МСПМС стандартного раствора в пробоотборник МСПМС.
- Для продолжения калибровки заготовки (БУВ): Заполните два полистирольные пробирки (16 мл) с пустой (раствора, полученного на стадии 8.1). Поместите один образец в CVAAS стойки и другой образец в пробоотборник МСПМС.
- Для лабораторного укрепленный матрицы (ЛЧМ): Случайный выбор 1 образец каждые 12 образцов для каждого типа образца (то есть, биомассы или средней) и использовать его для подготовки LFM. Для МСПМС, добавить 0,5 мл МСПМС стандартном уровне 7 и 3 мл переваренной экспериментального образца (либо из биомассы или среды) с полистирольной трубки.
- Смешайте содержимое и поместите флаконы на МСПМС пробоотборник. Для CVAAS, добавляют 2 мл Hg стандартный уровень 7 и 6 мл переваренной экспериментального образца (либо из биомассы или среды) с полистирольной трубки. Смешайте содержимое флакона и место на CVAAS стойки.
- Для дубликатов проб: Случайный выбор 1 образец когда-либоу 12 образцов для каждого типа матрицы (например, биомасса, средний, ЛЧМ или любой разбавляют матрица) и дублировать флакон. Поместите повторные флаконов в пробоотборник МСПМС или стойки CVAAS.
- Для дубликатов проб: Случайный выбор 1 образец каждые 12 образцов для каждого типа матрицы (например, биомассы, среде, МЛС или любой разбавленной матрицы) и дублировать флакон. Поместите повторные флаконов в пробоотборник МСПМС или стойки CVAAS.
- Определить критерии качества данных для исследования. Для настоящего исследования дублировать критериям качества, установленным Eaton, Clesceri, Райс и Гринберг 25. Параметры, установленные для контроля качества являются: процент разница (% D) для ККТ в пределах ± 10% 25 (за исключением свинца и сурьмы, увидеть дискуссию), LFB восстановления процента (% R) в ± 70-130% 25, ЛСМ процентов Восстановление (% R) в течение 75-125% 25, и относительная разность процентов (РПД) в пределах ± 20% 25, и продолжает CAлибрации пустым (БКК) ниже предела метод отчетности (МПО), 25. См расчета уравнения в шаге 9.7.
9. Количественная индуктивно связанной плазмой Масс-спектрометрия (ICPMS)
- В день анализа, передачи приблизительно 5 мл переваренной образца полистирола труб и поместите их в автоматический пробоотборник МСПМС. Добавить примерно 15 мл переваренной образцов полистирола труб и поместите их в CVAAS стойки.
- В тот же день из анализа подготовить калибровочных стандартов. Добавить приобрели МСПМС стандартный раствор и залейте пустой (раствор, приготовленный на шаге 8.1), как описано в таблице 6 (см стандартное описание решения в таблице материалов) к кислотно-мерных колб ополаскивают.
| Параметр | 1-Й Уровень | Уровень 2 | Уровень 3 | Уровень 4 | Уровень 5 | Уровень 6 | Уровень 7 |
| Приобретенные стандарт будет добавлен (мл) | - | - | - | - | - | - | 10.0 |
| Уровень 7, которые будут добавлены (мл) | 0.0 | 1.0 | 2.5 | 5.0 | 20,0 | 25,0 | - |
| Конечный объем * (мл) | - | 50,0 | 50,0 | 50,0 | 100,0 | 50,0 | 100,0 |
| Конечная концентрация (мкг / л) | |||||||
| 75 Как | 0.0 | 2.0 | 5.0 | 10.0 | 20,0 | 50,0 | 1000,0 |
| 111 Cd | 0.0 | 1.0 | 2.5 | 5.0 | 10.0 | 25,0 | 50,0 |
| 59 Со | 0.0 | 10.0 | 25,0 | 50,0 | 100,0 | 250,0 | 500,0 |
| 52 Кр | 0.0 | 2.0 | 5.0 | 10.0 | 20,0 | 50,0 | 100,0 |
| 63 Cu | 0.0 | 5.0 | 12,5 | 25,0 | 50,0 | 125,0 | 250,0 |
| 55 Мп | 0.0 | 3.0 | 7.5 | 15,0 | 30,0 | 75,0 | 150,0 |
| 60 Ni | 0.0 | 8.0 | 20,0 | 40,0 | 80,0 | 200,0 | 400,0 |
| 208 Pb | 0.0 | 1.0 | 2.5 | 5.0 | 10.0 | 25,0 | 50,0 |
| 121 Sb | 0.0 | 12,0 | 30,0 | 60,0 | 120,0 | 300,0 | 600,0 |
| 51 V | 0.0 | 10.0 | 25,0 | 50,0 | 100,0 | 250,0 | 500,0 |
| 66 Zn | 4.0 | 10.0 | 20,0 | 40,0 | 100,0 | 200,0 | |
| * Достичь этого объема путем добавления раствора, полученного на стадии 8.1 | |||||||
Таблица 6: Концентрация калибровочных Уровни 1 до 7..
- Удалить конусы из МСПМС и разрушать ультразвуком их в течение 1 мин в DW. Высушите конусов и положил их обратно в прибор.
- Включите чиллера, газы (Ar, H 2, He), МСПМС, подключаемые к линии внутреннего стандарта, и заполнить автоматического пробоотборника полоскания контейнеров (DW, 10% азотной кислоты, 1% азотной кислоты + 0,5% соляной кислоты) ,
- Откройте программное обеспечение MassHunter Workstation и включите плазмы, мелодии МСПМС и загрузить метод установки с параметрами в таблице 7.
| Параметры Ценности | |||||||||
| Внутренние стандарты | 72 Се, 115 В | ||||||||
| ВЧ-мощность | 1500 Вт | ||||||||
| Расход газа с плазменным | 14.98 | ||||||||
| Расход газа-распылителя | 1,1 л / мин (носитель и разбавление газа в сочетании - 0,6 + 0,5 л / мин) | ||||||||
| Отбор конусная | Никель на х линзы | ||||||||
| Скиммер конус | Никель | ||||||||
| Образец скорость поглощения | 0.3 RPS | ||||||||
| Ингалятор насос | 0.1 RPS | ||||||||
| S / С Температура | 2 ° С | ||||||||
| Сканирование состояние | Выдержка времени 1 сек, количество повторных 3 | ||||||||
| Поток 2 газа Н | N / A | ||||||||
| Он расхода газа | 4,3 мл / мин | ||||||||
| Параметр | 1-Й Уровень | Уровень 2 | Уровень 3 | Уровень 4 | Уровень 5 | Уровень 6 |
| L7 рт стандарт будет добавлен (мл) | 0 | 1 | 2.5 | 5 | 20 | 25 |
| Конечный объем * (мл) | - | 50 | 50 | 50 | 100 | 50 |
| Конечная концентрация (мкг / л) | 0 | 0,5 | 1.25 | 2.5 | 5 | 12,5 |
| * Достичь этого объема путем добавления раствора, полученного на стадии 8.1 | ||||||
Таблица 8: Концентрация ртути калибровочного стандарта Уровни 1 до 6..
- Открыть газовый Ar и воздушный клапан, включите атомной Absorpния спектрофотометр и впрыска потока по атомной спектроскопии (ФИАС). Откройте программное обеспечение CVAAS WINLAB, включите рт лампы и дайте ему прогреться до тех пор, энергетический параметр программного обеспечения не достигнет 79. Нагрузка по программам рт анализа с параметрами в таблице 9. Отрегулируйте светлый путь в приборе, чтобы дать максимальное пропускание.
| Параметры | Ценности |
| Газ-носитель | Аргон, 100 мл / мин |
| Лампа | Рт безэлектродную газоразрядных ламп, установка на 185 мА |
| Длина волны | 253,7 нм |
| Щель | 0,7 нм |
| Температура сотовый | 100 ° С |
| Объем пробы | 500 мкл |
| Носитель | 3% HCl, 9,23 мл / мин |
| Восстановитель | 10% SnCl 2, 5,31 мл / мин |
| Измерение | Пик высота |
| Читайте повторов | 3 |
Таблица 9: CVAAS условия эксплуатации.
- Подключите линию к решению носителя из 3% следов металла марки соляной кислоты.
- Подключите линии к восстановителя раствора, приготовленного из 10% хлорида олова (подходит для анализа ртути) в 3% класса микроэлемент соляной кислоты. Подготовьте это решение в тот же день анализа, он склонен к атмосферному окислению (ВНИМАНИЕ: хлорид олова очень опасно, используйте защитную одежду при работе с ним собирать CVAAS отходов в опасных сдерживания и правильно распоряжаться.).
- Поместите стандарты ртути, образцы КК и экспериментальные образцы в стойке CVAAS и ввода последовательности в программном обеспечении CVAAS WINLAB. Запустите стандарты и генерировать уравнение калибровки.
- Выполнить КК СэмПлес и экспериментальные образцы. CVAAS потребляет приблизительно 5 мл образца в прибор, уменьшает Hg присутствует в образце до элементарной ртути (Hg 0) газа и продувает газ из раствора с газом-носителем (Ar) в замкнутой системе. Рт пар проходит через ячейку в пути лампа накаливания в рт. Детектор определяет свет, поглощенный в 253,7 нм и соотносит его концентрации. (ВНИМАНИЕ: паров ртути является токсичным, обеспечить инструмент вытяжка на месте).
- Рассчитать% R,% D и RPD в шаге 9.7 во время анализа и сравнения результатов к критериям качества данных проекта.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Доходность биомассы
Производство N. заИпа в системе PBR, используемого в этом исследовании выросли с 1 г / л -1 до 8,5 ± 0,19 г / л-1 (N = 12) для управления реакторами и 4,0 ± 0,3 г / л -1 (N = 12) мульти-металл загрязнены в течение 7 дней. Эксперименты производятся повторяющиеся данные по тройных реакторов и нескольких партий. 2А показывает среднюю плотность культуры с очень небольшой стандартной ошибки на основе выборки из трех независимых НРБ. Чтобы обеспечить этот результат был не единичный результат, еще три партии были выращены с аналогичными результатами. Объединенные результаты для всех четырех партий показаны на фиг.2В. Хотя биологическая изменчивость существует, это исследование показывает, что существует последовательное негативное влияние неорганических загрязнителей в N. Салина производство. Доходность биомассы в загрязняющих подвергается НРБ были статистически отличается от управления НРБ отдень 2 года (ANOVA, р <0,05).
Оценка контроля качества неорганической загрязнений количественного
Двенадцать из четырнадцати анализируемых элементов были полностью восстановлены после переваривания, как показано на LFB% R% R с близкой к 100%, указывает на отсутствие потерь, ни выгод и не перекрестного загрязнения анализируемых в процессе пищеварения (Таблица 10). Во количественный анализ образцов% D и РПД контролировали через все анализа и среднее значение результатов показаны в Таблице 10. As, Cd, Co, Cr, Cu, Hg, Mn, Ni, Pb, Sb, V и Zn прошло % D и РПД, однако% D для Pb и Sb постепенно снизился во время анализа. % D для этих элементов улучшаются после очистки конуса, однако, постоянной очистки конуса непрактично, и, следовательно, к качеству данных для Pb и Sb были снижены. БКК для всех анализируемых также ниже ПДК. Матричные эффекты были оценены путем анализа образцов ЛЧМ и получения% R. Втотя Co, Hg, Sb и V прошли критерии данных КК, он не был принят As, Cd, Cr, Cu, Mn, Ni, Pb и Zn, когда были проанализированы образцы перевариваются биомассы, в результате% R ниже целей КК. Матрица разбавления в DW в соотношении 1: 3 (растворенного вещества: растворитель) привело% R, который прошел критерии качества данных. Наблюдались также эффекты Матричные ходе анализа переваренной супернатанта и были адресованы той же степени разбавления (Таблица 10), убедившись, что разведение не нарушить предела обнаружения прибора. Проблемы с обнаружением Se и Sn наблюдались на основе показаний нестабильных и вопроса загрязнения, соответственно. Нестабильные показания для Se относятся к солям, в матрице 27. Загрязнение Sn был проследить, чтобы кислоты, используемой на стадии пищеварения.
| Аналит | R | ККТ | LFB | ЛЧМ для образцов биомассы | ЛЧМ для образцов надосадочной | ||||
| % D | % R | Коэффициент разбавления | % R | РПД | Коэффициент разбавления | % R | РПД | ||
| КК ограничивает 25 | 0.9950 | ± 10 | 70-130 | - | 75-125 | ± 20 | - | 75-125 | ± 20 |
| В качестве | 0,9998 | 1.8 | 101,0 | 1: 3 | 100,4 | 5.2 | 1: 3 | 92,5 | -0.5 |
| CD | 1.0000 | 1.4 | 102,6 | 1: 3 | 103,5 | 4.6 | Ни | 92,3 | 0,6 |
| Компания | 0,9997 | 1.7 | 98,8 | Ни | 95,2 | -1.4 | Ни | 96,5 | -1.5 |
| Cr | 0,9999 | 1.5 | 99,8 | 1: 3 | 96,5 | 1.8 | 1: 3 | 90,1 | -0.8 |
| Cu | 0,9999 | 2.9 | 98,2 | 1: 3 | 101,4 | 4.8 | 1: 3 | 94,4 | -0.5 |
| Ртуть | 0,9983 | -1.7 | 103,0 | Ни | 98,7 | 1.5 | Ни | 98,0 | 0,3 |
| Миннесота | 0,9998 | 2.9 | 97,6 | 1: 3 | 83,2 | 1.8 | 1: 3 | 95,4 | -1.7 |
| Ni | 0,9999 | 103,5 | 1: 3 | 98,5 | 2.1 | Ни | 93,3 | -0.9 | |
| В | 0,9998 | 2.5 | 97,2 | Ни | 95,5 | -1.5 | Ни | 101,2 | -1.9 |
| Pb | 0,9998 | 12.6 | 105,2 | 1: 3 | 88,9 | 0.0 | Ни | 93,5 | -0.5 |
| Sb | 0,9998 | 1.1 | 105,7 | Ни | 101,8 | -9.6 | Ни | 90,8 | -1.2 |
| Zn | 0,9997 | 5.2 | 120,8 | 1: 3 | 90,7 | 1.4 | Ни | 89,2 | -1.9 |
Таблица 10: Сводка результатов контрольных образцов качества. R = соКоэффициент rrelation,% D: Разница процентов,% R: восстановление процентов, РПД = относительная разница процентов, коэффициент разбавления относится к растворенному веществу: соотношение растворителя.
Неорганические концентрации загрязняющих
Тяжелый металл и неорганические загрязнители были найдены в биомассе и надосадочной среды. Концентрации, обнаруженные в биомассе за 12 анализируемых элементов показаны на рисунке 3. Концентрации в биомассе, полученные из трех повторностей НРБ (N = 3) в пакете # 1 показывает очень небольшое стандартную ошибку (фиг.3А). Объединение данных из трех повторностей НРБ от 4 партий последовательно показывает, что неорганические примеси присутствуют в биомассе (N = 12). Концентрации, обнаруженные в надосадочной среде показано на рисунке 4. Результаты показывают, трех экземплярах НРБ (N = 3) для пакетной # 1 также имеют небольшой стандартную ошибку (рис 4а) и показывают, что большинство загрязнений преимущественно были расположены в биомассы лeading до очень низких концентраций в надосадочной жидкости с нескольких концентраций образцов, близких к MRL прибора. Результаты всех четырех партий представлены на фиг.4В.
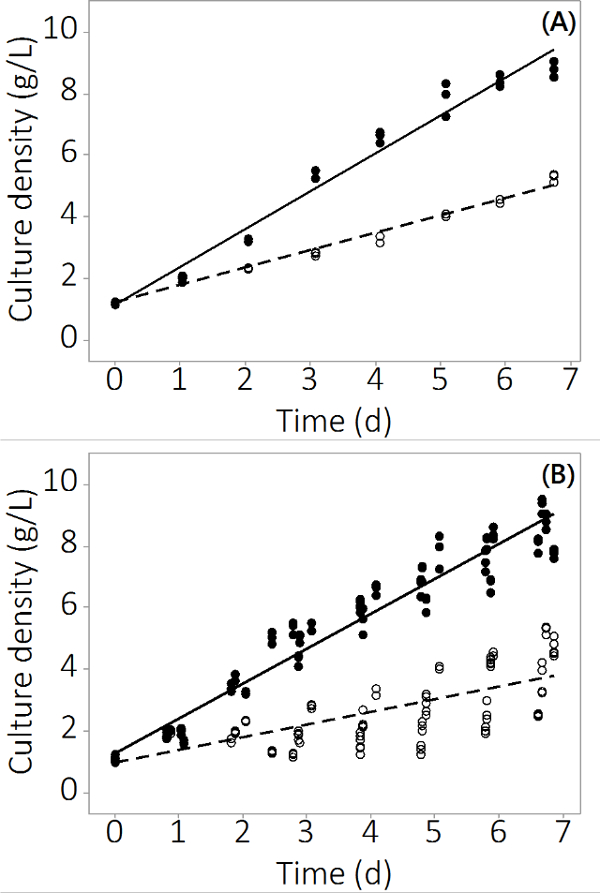
Рисунок 2. С ulture концентрация за период выращивания для загрязненных и контрольных НРБ. () Плотность Культура в пакетном # 1, результаты N = 3 НРБ. (B), плотность культура в 4 партиях, результаты N = 12 НРБ. Пусто круги представляют загрязненные биомассы, заполненные кружки обозначают контроль.
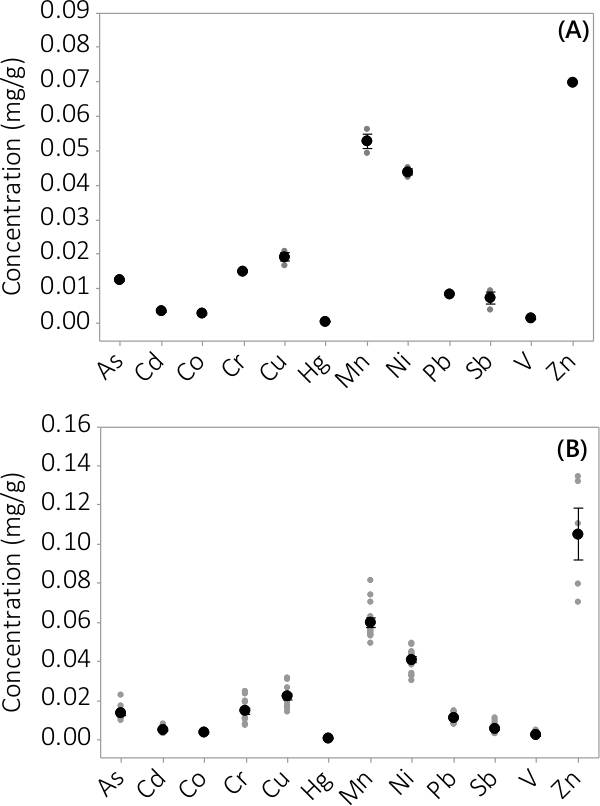
Рисунок 3. Концентрация неорганических загрязнений в биомассе. () Концентрация в пакетном #1, результаты от N = 1 PBR для Zn и N = 3 НРБ для всех других аналитов, (Б) Концентрация от 4 партий, результаты N = 4 НРБ для Zn и N = 12 НРБ для всех других веществ. Средние концентрации представлены черных закрашенных кружков, отдельные точки данных представлены серыми закрашенных кружков. Усы представляют ± стандартная ошибка одна от среднего значения.
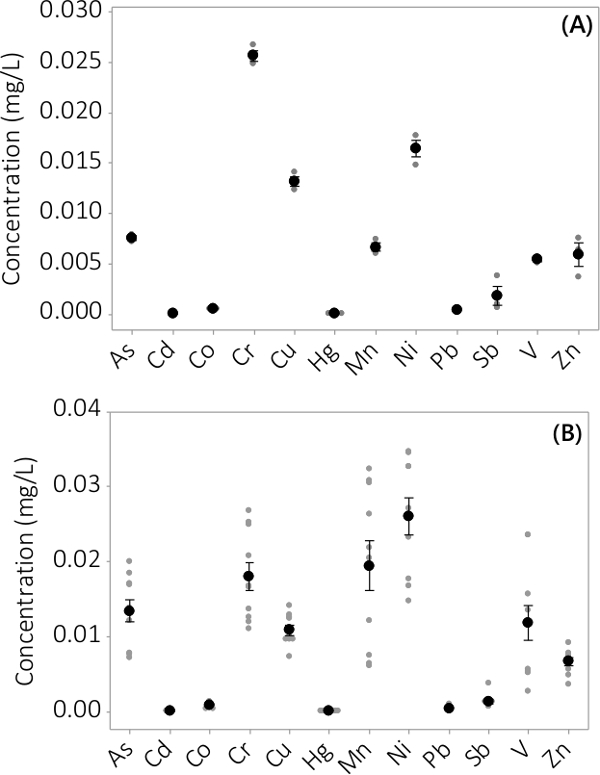
Рисунок 4. Концентрация неорганических примесей в надосадочной жидкости. (А) Концентрация в партии # 1, результаты N = 3 НРБ, (б) концентрации от 4 партий, результаты N = 12 НРБ. Средние концентрации представлены черных закрашенных кружков, отдельные точки данных представлены серыми закрашенных кружков. Усы представляют ± стандартная ошибка одна от среднего значения.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Соленая микроводорослей Н. Салина можно с успехом выращивать в проектируемой системе роста с повторяемых результатов и высоких урожаев биомассы. Воздушные перевозки перемешивание допускается для хорошо смешанной приостановлено культуры с минимальной оседания или обрастания в течение периодов роста 7 день. Минимальный изменчивость света через флуоресцентного света банка также показано, не производят заметные различия в темпах роста.
Исследование показывает, тяжелых металлов загрязненных средах при концентрациях представителя интеграции с угля дымовых газов негативно влияет рост биомассы. Повторяемость в исследовании подчеркивается влияние многопартийная система металл на производительность. Различные этапы процесса есть потенциал, чтобы отрицательно повлиять рост и загрязнять систему требующий прилежного экспериментальный препарат. Определение рН среды перед началом эксперимента шаг КК, который позволяет для проверки, что среда не подкисленной (например, RESUlting неправильного PBR промывки после кислотной замачивания). Подкисленный среда влияет рост водорослей и изменить питательный биодоступность (например, изменения в неорганического углерода видообразования и металлов видообразования), таким образом, влияя на взаимодействие между водорослей сайтов связывания питательных веществ и металлов. Тщательная подготовка лабораторного оборудования для этих исследований требуется, так что точное баланса массы введенных металлов может быть выполнена. Другие шаги в процессе, имеют потенциал, чтобы представить без вести металлов говорит о необходимости использования собственных растворителей класса и химических веществ. Правильное КК в процессе может эффективно выявлять введение примесей тяжелых металлов.
Результаты показывают, введенные примеси распределены между биомассой (рис 3), средства массовой информации (Рисунок 4) и окружающей среды. Неорганические примеси найдены в заготовленных N. Салина предполагает, что это будет микроводорослей состав вошлое несколько неорганических загрязняющих веществ, присутствующих в дымовом газе. Это усвоение может быть результатом адсорбции на клеточных стенок за счет заряженных участков связывания, поглощения внутри клетки вследствие метаболической активности и осаждения комплексов, образованных с элементами, присутствующими в среде 28. Визуально реакторы с неорганическими загрязняющих веществ через пару дней появились желтого цвета по сравнению с темно-зелеными контрольных реакторов. Загрязненная биомасса собирают не визуально отличается от загрязнений свободной биомассы после образования гранул после уборки урожая путем центрифугирования. Визуальная разница в цвета до сбора урожая объясняется более низкой плотности биомассы микроводорослей и подчеркнул. Загрязняющие вещества не удаляются в биомассе есть потенциал, чтобы накапливаться в средствах массовой информации, как показано на рисунке 4. Накопление в средствах массовой информации представляет собой потенциал для ограничения масштабов, как переработка информации представляет собой необходимость экономической жизнеспособности. Ограничение будет продиктованодопуском к тяжелых металлов загрязняющих веществ, которые будут определенные разновидности. Результаты этого исследования подчеркивают необходимость лучше понять потенциальные негативные воздействия на интеграции систем роста микроводорослей с источниками углерода отходов, в частности угля, основанную дымового газа. Результаты этого исследования выявления потребностей, чтобы понять последствия производительности других загрязняющих веществ, как ожидается, будет присутствовать в дымовых газах, таких как оксиды серы и азота, мелкой пыли, и органических загрязняющих веществ, таких как полихлорированных дибензо диоксинов и фуранов дибензо. Предыдущие чай и LCA оценки предполагали полную интеграцию без учета воздействия загрязняющих веществ, таких как тяжелые металлы и неорганические загрязнители на производительность. В целом результаты этой работы выделить воздействие системы с несколькими металла на производительность и может быть использован, чтобы понять потенциалы микроводорослей, чтобы bioremediate загрязнений.
Методология, представленная позволило гое исследование неорганических загрязнений с повторяемых результатов для микроводорослей. Некоторые неорганические загрязнители, используемые в данном эксперименте, традиционно нашли в системах роста при низких концентрациях, а другие не имеют известной функции в клетке. В результате многоэлементный смесь As, Cd, Co, Cr, Cu, Hg, Mn, Ni, Pb, Sb, Se, Sn, V и Zn в концентрации показано в таблице 4 ингибирует рост. Количественная количество загрязняющих веществ в биомассе может оказаться сложной задачей в нескольких металлических систем. Часто образцы с высоким содержанием органики и солей может производить матричные помехи, помехи многоатомных, физические помехи и соль построить в конусах что в конечном итоге приводит к неточным показаниям и потери точности аналитического 29,30. Образцы для контроля качества выполнения вместе с экспериментальными образцами помогли определить точность и точность показаний. Измерение анализируемых с использованием протоколов, разработанных для данного исследования показали, чтобы бытьccurate и точное производство приемлемые извлечения, которые в приемлемой производительности для данного типа исследования 25,29. Переваривание образцов по микроволновой печи проявилось, чтобы быть эффективным для N. Салина, как переваривается образцы ясно, без наличия мусора клеток или несмешивающихся порциями. Матрица используется в этом эксперименте (биомассы водорослей и искусственной морской воде) производится матричных помех, которые были преодолены матрицы разбавления. Тем не менее, выше биомассы размеры выборки, чем те, которые используются в этом эксперименте может привести к помехам матричных, и, следовательно, КК должны быть проанализированы для каждого конкретного сценария.
Subscription Required. Please recommend JoVE to your librarian.
Materials
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Sodium chloride | Fisher Scientific | S271-3 | |
| Calcium chloride dihydrate | Fisher Scientific | C79-500 | |
| Potassium chloride | Fisher Scientific | P217-500 | |
| Sodium meta silicate nonahydrate | Fisher Scientific | S408-500 | |
| Magnesium sulfate heptahydrate | Fisher Scientific | M63-500 | |
| Potassium nitrate | EMD Chemical | PX1520-5 | |
| Potassium phosphate monobasic | Fisher Scientific | P285-500 | |
| Ammonium ferric citrate | Fisher Scientific | I72-500 | |
| Boric acid | Fisher Scientific | A73-500 | |
| Sodium molybdate, dihydrate | EMD Chemical | SX0650-2 | |
| Manganese chloride tetrahydrate | Fisher Scientific | M87-500 | |
| Zinc sulfate heptahydrate | Fisher Scientific | Z68-500 | |
| Cupric sulfate pentahydrate | Fisher Scientific | C489-500 | |
| Biotin | Acros Organics | 230090010 | |
| Thiamine | Acros Organics | 148990100 | |
| Vitamin B12 | Acros Organics | 405920010 | |
| Copper (II) chloride dihydrate | Sigma-Aldrich | 221783-100G | Irritant, Dangerous to the Environment |
| Lead (II) chloride | Sigma-Aldrich | 268690-250G | Toxic, Dangerous to the Environment |
| Sodium dichromate dihydrate | Sigma-Aldrich | 398063-100G | Oxidizing, Highly Toxic, Dangerous to the Environment |
| Cobalt (II) chloride hexahydrate | Sigma-Aldrich | 255599-100G | Toxic, Dangerous to the Environment |
| Nickel (II) chloride hexahydrate | Sigma-Aldrich | 223387-500G | Toxic, Dangerous to the Environment |
| Sodium (meta) arsenite | Sigma-Aldrich | 71287 | Toxic, Dangerous to the Environment |
| Cadmium chloride | Sigma-Aldrich | 202908-10G | Highly Toxic, Dangerous to the Environment |
| Mercury (II) chloride | Sigma-Aldrich | 215465-100G | Toxic, Dangerous to the Environment |
| Tin (II) chloride dihydrate | Fisher Scientific | T142-500 | Corrosive. Suitable for Hg analysis. Very hazardous. |
| Manganese chloride tetrahydrate | Fisher Scientific | M87-500 | |
| Vanadium (V) oxide | Acros Organics | 206422500 | Dangerous to the Environment |
| Carbon dioxide | Air Liquide | I2301S-1 | Compressed |
| Hydrogen peroxide | H325-500 | Fisher Scientific | 30% in water |
| ICP-MS standard | ICP-MS-6020 | High Purity Standards | |
| Mercury standard | CGHG1-1 | Inorganic Ventures | 1000±6 µg/mL in 5% nitric acid |
| Argon | Air Liquide | Compressed | |
| Helium | Air Liquide | Compressed, ultra high purity | |
| Hydrogen | Air Liquide | Compressed, ultra high purity | |
| Nitric acid | Fisher Scientific | A509-P212 | 67-70% nitric acid, trace metal grade. Caution: manipulate under fume hood. |
| Hydrochloric acid | Fisher Scientific | A508-P212 | 35% hydrochloric acid, trace metal grade. Caution: manipulate under fume hood. |
| Equipment | |||
| Scientific prevacuum sterilizer | Steris | 31626A | SV-120 |
| Centrifuge | Thermo Fisher | 46910 | RC-6 Plus |
| Spectrophotometer | Shimadzu | 1867 | UV-1800 |
| pH controller | Hanna | BL981411 | X4 |
| Rotometer, X5 | Dwyer | RMA-151-SSV | T31Y |
| Rotometer, X5 | Dwyer | RMA-26-SSV | T35Y |
| Water bath circulator | Fisher Scientific | 13-873-45A | |
| Compact chiller | VWR | 13270-120 | |
| Freeze dryer | Labconco | 7752020 | |
| Stir plate | Fisher Scientific | 11-100-49S | |
| pH lab electrode | Phidgets Inc | 3550 | |
| Inductively coupled plasma mass spectrometer | Agilent Technologies | 7700 Series ICP-MS | Attached to autosampler CETAC ASX-520 |
| FIAS 100 | Perkin Elmer Instruments | B0506520 | |
| Atomic absorption spectrometer | Perkin Elmer Instruments | AAnalyst 800 | |
| Cell heater (quartz) | Perkin Elmer Instruments | B3120397 | |
| Microwave | Milestone | Programmable, maximum power 1,200 W | |
| Microwave rotor | Milestone | Rotor with 24-75 ml Teflon vessels for closed-vessel microwave assisted digestion. | |
| Materials | |||
| 0.2 μm syringe filter | Whatman | 6713-0425 | |
| 0.2 μm syringe filter | Whatman | 6713-1650 | |
| 0.45 μm syringe filter | Thermo Fisher | F2500-3 | |
| Polystyrene tubes | Evergreen | 222-2094-050 | 17 x 100 mm w/cap, 16 ml, polysteryne |
| Octogonal magnetic stir bars | Fisher scientific | 14-513-60 | Magnets encased in PTFE fluoropolymer |
References
- Dismukes, G. C., Carrieri, D., Bennette, N., Ananyev, G. M., Posewitz, M. C. Aquatic phototrophs: efficient alternatives to land-based crops for biofuels. Curr Opin Biotechnol. 19 (3), 235-240 (2008).
- Moody, J. W., McGinty, C. M., Quinn, J. C. Global evaluation of biofuel potential from microalgae. Proceedings of the National Academy of Sciences. 111 (23), 8691-8696 (2014).
- Pinto, E., et al. Heavy metal-induced oxidative stress in algae. J Phycol. 39 (6), 1008-1018 (2003).
- Gupta, A., Lutsenko, S. Evolution of copper transporting ATPases in eukaryotic organisms. Curr Genomics. 13 (2), 124-133 (2012).
- Perales-Vela, H. V., Peña-Castro, J. M., Cañizares-Villanueva, R. O. Heavy metal detoxification in eukaryotic microalgae. Chemosphere. 64 (1), 1-10 (2006).
- Sandau, E., Sandau, P., Pulz, O. Heavy metal sorption by microalgae. Acta Biotechnol. 16 (4), 227-235 (1996).
- Amer, L., Adhikari, B., Pellegrino, J. Technoeconomic analysis of five microalgae-to-biofuels processes of varying complexity. Bioresour Technol. 102 (20), 9350-9359 (2011).
- Benemann, J. R., Goebel, R. P., Weissman, J. C., Augenstein, D. C. Microalgae as a source of liquid fuels. Final Technical Report, US Department of Energy, Office of Research. , (1982).
- Benemann, J. R., Oswald, W. J. Report No. DOE/PC/93204--T5 Other: ON: DE97052880; TRN: TRN. Systems and economic analysis of microalgae ponds for conversion of CO2 to biomass. , (1996).
- Chisti, Y. Biodiesel from microalgae. Biotechnol Adv. 25 (3), 294-306 (2007).
- Davis, R., Aden, A., Pienkos, P. T. Techno-economic analysis of autotrophic microalgae for fuel production. Applied Energy. 88 (10), 3524-3531 (2011).
- Jones, S., et al. Process design and economics for the conversion of algal biomass to hydrocarbons: whole algae hydrothermal liquefaction and upgrading. U.S. Department of Energy Bioenergy Technologies Office. , (2014).
- Lundquist, T. J., Woertz, I. C., Quinn, N. W. T., Benemann, J. R. A realistic technology and engineering assessment of algae biofuel production. Energy Biosciences Institute. , Berkeley, CA. (2010).
- Nagarajan, S., Chou, S. K., Cao, S., Wu, C., Zhou, Z. An updated comprehensive techno-economic analysis of algae biodiesel. Bioresour Technol. 145, 150-156 (2011).
- Pienkos, P. T., Darzins, A. The promise and challenges of microalgal-derived biofuels. Biofuels Bioproducts & Biorefining-Biofpr. 3, 431-440 (2009).
- Richardson, J. W., Johnson, M. D., Outlaw, J. L. Economic comparison of open pond raceways to photo bio-reactors for profitable production of algae for transportation fuels in the Southwest. Algal Research. 1 (1), 93-100 (2012).
- Rogers, J. N., et al. A critical analysis of paddlewheel-driven raceway ponds for algal biofuel production at commercial scales. Algal Research. 4, 76-88 (1016).
- Sun, A., et al. Comparative cost analysis of algal oil production for biofuels. Energy. 36 (8), 5169-5179 (2011).
- Thilakaratne, R., Wright, M. M., Brown, R. C. A techno-economic analysis of microalgae remnant catalytic pyrolysis and upgrading to fuels. Fuel. 128, 104-112 (2014).
- Quinn, J. C., et al. Nannochloropsis production metrics in a scalable outdoor photobioreactor for commercial applications. Bioresour Technol. 117, 164-171 (2012).
- Borkenstein, C., Knoblechner, J., Frühwirth, H., Schagerl, M. Cultivation of Chlorella emersonii with flue gas derived from a cement plant. J Appl Phycol. 23 (1), 131-135 (2010).
- Douskova, I., et al. Simultaneous flue gas bioremediation and reduction of microalgal biomass production costs. Appl Microbiol Biotechnol. 82 (1), 179-185 (2009).
- Israel, A., Gavrieli, J., Glazer, A., Friedlander, M. Utilization of flue gas from a power plant for tank cultivation of the red seaweed Gracilaria cornea. Aquaculture. 249 (1-4), 311-316 (2012).
- Napan, K., Teng, L., Quinn, J. C., Wood, B. Impact of Heavy Metals from Flue Gas Integration with Microalgae Production. , Algal Research. (2015).
- Eaton, A. D., Clesceri, L. S., Rice, E. W., Greenberg, A. E. 3125B. Inductively coupled plasma/mass spectrometry (ICP/MS) method. Standard methods for the examination of water and wastewater. , (2005).
- Eaton, A. D., Clesceri, L. S., Rice, E. W., Greenberg, A. E. Standard methods for the examination of water and wastewater. , APHA-AWWA-WEF. (2005).
- Matrix effects in the ICP-MS analysis of selenium in saline water samples. Smith, M., Compton, J. S. Proceedings of the 2004 Water Institute of Southern Africa Biennial Conference, Cape Town, South Africa, , (2004).
- Mehta, S. K., Gaur, J. P. Use of algae for removing heavy metal ions from wastewater: progress and prospects. Crit Rev Biotechnol. 25 (3), 113-152 (2005).
- EPA, U. Method: 200.8: Determination of trace elements in waters and wastes by inductively coupled plasma - mass spectrometry. , (1994).
- Eaton, A. D., Clesceri, L. S., Rice, E. W., Greenberg, A. E. 3120B. Inductively coupled plasma (ICP) method. Standard methods for the examination of water and wastewater. , (2005).
Tags
Науки об окружающей среде выпуск 101 водоросли тяжелые металлы,Get cutting-edge science videos from JoVE sent straight to your inbox every month.









