Abstract
Toenemende vraag naar hernieuwbare brandstoffen heeft onderzoekers het onderzoek naar de haalbaarheid van alternatieve grondstoffen, zoals microalgen. Inherente voordelen omvatten hoge potentiële opbrengst, het gebruik van niet-landbouwgrond en de integratie met afvalstromen. De voedingsbehoefte van een grootschalig productiestelsel microalgen de koppeling van kweeksystemen met industrieel afval middelen, zoals kooldioxide uit rookgas en voedingsstoffen uit het afvalwater vereist. Anorganische verontreinigingen aanwezig in deze afvalstoffen kan mogelijk leiden tot bioaccumulatie in microalgen biomassa productiviteit en het beperken van eindgebruik negatieve invloed. Dit onderzoek richt zich op de experimentele evaluatie van de impact en het lot van de 14 anorganische verontreinigingen (As, Cd, Co, Cr, Cu, Hg, Mn, Ni, Pb, Sb, Se, Sn, V en Zn) op Nannochloropsis Salina groei . Microalgen werden fotobioreactoren verlicht 984 umol m -2 s -1 gekweekt en gehouden op pH 7 in een groei media vervuild met anorganische verontreinigingen op niveaus verwacht op basis van de samenstelling bij commerciële steenkool rookgasinstallaties. Verontreinigingen in de biomassa en het medium aan het einde van een 7 dagen groeiperiode werden analytisch gekwantificeerd door koude damp-atomaire absorptiespectrometrie voor Hg en door inductief gekoppeld plasma massa spectrometrie voor As, Cd, Co, Cr, Cu, Mn, Ni, Pb, Sb, Se, Sn, V en Zn. Resultaten tonen N. salina is een gevoelige stam multi-metal omgeving met een statistische vermindering van biomassa yieldwith de invoering van deze verontreinigingen. De hier gepresenteerde technieken zijn geschikt voor het kwantificeren algengroei en het bepalen van het lot van anorganische verontreinigingen.
Introduction
Vergeleken met traditionele vaste gewassen microalgen bleken sterke groei en lipide-opbrengst als gevolg van inherente hogere solar rendementen 1,2 bereiken. Teelt van microalgen bij hoge productiviteit vereist de levering van verschillende voedingsstoffen, waaronder een externe koolstofbron. Verwacht wordt dat grootschalige groei installaties worden geïntegreerd industriële afvalstromen zoals industriële rookgas teneinde productiekosten te minimaliseren en tegelijkertijd verschaffen herstel van het milieu. Bedrijfsafval koolstof typisch in de vorm van gasvormig koolstofdioxide en kunnen verontreinigingen die het potentieel negatieve effect microalgen produktie hebben bevatten. Concreet zal rookgas afkomstig uit steenkool verschillende contaminanten zoals maar niet beperkt tot verbrandingsproducten water en kooldioxide, evenals zwavel- en stikstof, fijn stof, organische verontreinigingen zoals dioxinen en furanen en anorganische converontreinigingen zoals zware metalen. De gevolgen van de meeste van deze verontreinigingen waaronder anorganische waarbij sommige zogenaamde zware metalen op de productiviteit microalgen niet zijn onderzocht. Enkele van deze elementen kunnen nutriënten in geschikte concentraties, maar bij hogere concentraties ze celdisfunctie en zelfs de dood 3 kan produceren.
De integratie van microalgen industriële rookgas heeft het potentieel om anorganische verontreinigingen direct introduceren in groeimedia. Kolengestookte rookgassen verschillende anorganische elementen (bijvoorbeeld As, Cd, Co, Cr, Cu, Hg, Mn, Ni, Pb, Sb, Se, Sn, V en Zn) bij verschillende concentraties waarvan sommige, in low concentratie, vertegenwoordigen voedingsstoffen voor microalgen groei. Anorganische verontreinigingen hebben een hoge affiniteit te binden aan algen en verder inwendig gesorbeerd door de nutriënt transporters. Sommige anorganische verontreinigingen (dwz, Co, Cu, Zn en Mn) zijn voedingsstoffen die onderdeel vormen van de enzymen te betrekkend in de fotosynthese, ademhaling en andere functies 3,4. Echter, dan metalen en metalloïden kunnen giftig zijn. Andere elementen, zoals Pb, Cd, Sn, Sb, Se, As en Hg, zijn niet bekend om celfunctie te ondersteunen in elke concentratie en vertegenwoordigen niet-voedingsstof metalen, die een negatieve invloed zouden kunnen hebben groei cultuur 3,5,6. De aanwezigheid van deze stoffen heeft het potentieel om negatieve effecten op celfunctie microalgen produceren. Verder is de interactie van meerdere metalen met microalgen bemoeilijkt groeidynamiek en heeft het potentieel om de groei beïnvloeden.
Grootschalige economie zijn rechtstreeks gekoppeld aan de productiviteit van het teeltsysteem 7-19. Bovendien medium recyclen in de microalgen groei voor of open loopvlak vijvers (ORP) of fotobioreactoren (PBR) is kritisch als het vertegenwoordigt 99,9 en 99,4% van de massa, respectievelijk 20. De aanwezigheid van anorganische verontreinigingen in de media kan uiteindelijk m beperkenicroalgae productiviteit en de recycling van de media te wijten aan verontreiniging opbouw. Deze studie experimenteel bepaalde het effect van 14 anorganische verontreinigingen (As, Cd, Co, Cr, Cu, Hg, Mn, Ni, Pb, Sb, Se, Sn, V en Zn) in concentraties verwacht van de integratie van microalgen kweeksystemen kolen afgeleide rookgas, de productiviteit van N. Salina geteeld in airlift PBRS. De verontreinigingen die in deze studie is aangetoond dat niet alleen aanwezig in steenkool gebaseerde rookgas maar gemeentelijk afval op basis van rookgas, biosolids gebaseerde rookgas, gemeentelijk afvalwater, geproduceerd water, verminderde grondwater en zeewater 21-23 zijn. De concentraties die in deze studie zijn gebaseerd op wat zou worden verwacht wanneer microalgen groeisystemen geïntegreerd met een kolengestookte CO 2 bron met een opname-efficiëntie aangetoond in commerciële systemen PBR 20. Gedetailleerde berekeningen ondersteunen van de concentraties van de zware metalen en anorganische verontreinigingen worden in Napanet al. 24 analytische technieken gebruikt om de verdeling van de meerderheid van de metalen in de biomassa, media en omgeving te begrijpen. De gepresenteerde methoden kon de evaluatie van de productiviteit potentieel van microalgen onder anorganische verontreinigende stress en kwantificering van hun einde lot.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Groei systeem

Figuur 1. Microalgen groei systeem. (A) lucht rotometer, (B) CO 2 rotometer, (C) pH controller met elektromagnetische, (D) datalogger, (E) in-line luchtfilters, (F) luchtverdeling header, (G) TL-licht bank, (H) pH meter, (I) koelsysteem, (J) waterbad, (K) thermokoppeldraad, (L) lucht lift fotobioreactor, (M) verwarming, (N) walk-in fume afzuigkap, (O) vent, (P) lucht levering capillair, (Q) luchtfilters, (R) bemonstering buis, (S) PBR siliconen deksel, en (T)pH goed in siliconen deksel. Klik hier om een grotere versie van deze figuur te bekijken.
- Bouw de volgende microalg experimentele groei (zie figuur 1).
- Verwerven twaalf luchtbrug PBRS uit glas buisreactoren 4,5 cm in diameter en 80 cm hoog met een kweek capaciteit van 1,1 l met silicone deksels. Acquire pre-cut glazen capillaire buizen (5 mm uitwendige diameter en 1 mm inwendige diameter) van 10 cm (3 per PBR) en 85 cm (1 per PBR) in lengte.
- Freeze silicone deksels in een -80 ° C vriezer. Smeer een boor met glycerol en terwijl deksels zijn bevroren boor 3 gaten om de vent, bemonstering en levering van gas capillaire buizen hosten en 1 gat van 17 mm diameter tot een pH-sonde hosten.
- Plaats de 3 capillaire buisjes vast met de langste zich uitstrekt 2 cm vanaf de bodem van de PBR. In de andere capillair voeg een siliconenslang with een capillaire buis verbonden met het andere einde zich uitstrekt tot een gewenst bemonsteringspunt. Bedek het gat voor de pH-meter met een silicone stopper grootte 21D.
- Bevochtigen omgevingslucht door borrelen het door het water en het leveren van de bevochtigde lucht op de luchtverdeling header. Ga het gas door een 0,2 um filter en leveren het aan de algen suspensie door de langste glazen levering capillair.
- Lever samengeperst CO 2 in de bevochtigde luchtstroom teneinde een neutrale pH van 7,0 ± 0,1 in de kweek suspensie te houden. Controle van de snelheid van de CO 2 levering met een geautomatiseerde CO 2 apotheek systeem (pH-controller), dat een magnetische solenoïde opent wanneer de algen cultuur bereikt pH 7,1 en sluit bij pH 6,9.
- Zorg voor licht met behulp van 24 T5 tl-lampen die resulteren in een gemiddelde verlichting van 984 umol m -2 sec -1 vergelijkbaar buitenomstandigheden piek.
- Dompel de PBRS in een waterbad om maintain een constante temperatuur van ongeveer 25 ° C. Controle van de temperatuur van het systeem met behulp van een recirculatie koelmachine en een automatische verwarming recirculerend waterbad unit controle.
- Monitor temperatuur en de pH in real-time en op te nemen met een datalogger.
- Zorg ervoor dat alle onderdelen van de microalgen groei systeem goed werkt, vooral voor de oogst microalgen entstof of het voorbereiden van anorganische verontreinigingen omdat ze niet kunnen worden bewaard.
2. Lab Ware Voorbereiding
- Was maatkolven, PBRS, mandeflessen en alle containers, met kraanwater en zeep. Spoelen met gedemineraliseerd water (DW).
- Acid spoel het lab ware teneinde sporen van anorganische verontreinigingen te verwijderen. Dit kan door een van twee manieren:
- Geniet lab ware O / N in 10% trace metalen graad salpeterzuur (LET OP: niet inademen rook, geconcentreerd salpeterzuur kan ernstige branden en giftige dampen, werk produceren in een damp hood gebruiken nitril handschoenen, veiligheidsbril en laboratoriumjas).
- Geniet lab ware gedurende 15 minuten in 50% trace metalen graad salpeterzuur.
- Spoel het lab ware met DW grondig minstens 3 keer om ervoor te zorgen alle zuur wordt verwijderd. Het is essentieel dat PBRS grondig gespoeld met name de monsterbuizen en de capillaire buisjes. Doet u dit niet zal verzuring van het medium en de mogelijke remming van de groei te produceren. Test de pH van het spoelwater om alle zure verifiëren is verwijderd.
- Steriliseer PBRS, containers en flessen door ze te autoclaveren bij 120 ° C en bij normale atmosferische druk gedurende ten minste 30 min.
3. N. salina Medium Voorbereiding
- Voorbereiding van de oplossing A: Gedeeltelijk Vul een 1 liter maatkolf met DW. Plaats een magnetische roerstaaf en voeg de in tabel 1 na elkaar chemicaliën. Zorg ervoor dat elk ingrediënt oplost vóór de toevoeging van de volgende bestanddelen. Verwijder de magneet en vul the kolf met het 1 L volume merk.
| Bestanddeel | Bedrag toe te voegen (g) | Uiteindelijke concentratie (g / l) |
| H 3 BO 3 | 0.900 | 0.900 |
| Na 2 MoO 4 · 2H 2 O | 0,012 | 0,012 |
| MnCl2 · 4H 2 O | 0.300 | 0.300 |
| ZnSO 4 · 7H 2 O | 0,060 | 0,060 |
| CuSO4 · 5H 2 O | 0,020 | 0,020 |
Tabel 1:. Oplossing Een recept Hoeveelheden bedragen nodig bij de bereiding van 1 liter geconcentreerde oplossing.
- Voorbereiding van de vitamine oplossing: In drie afzonderlijke volumetric kolven voeg vitaminen zoals weergegeven in tabel 2. Filtreer elke vitamine oplossing door een steriel 0,2 urn spuitfilter een steriele houder. Behoud vitaminen bij -4 ° C in het donker.
| Vitaminen | Bedrag (mg) | Final volume (ml) | Uiteindelijke vitamine-concentratie (mg / l) |
| Biotine | 12.22 | 500 | 24.43 |
| Vitamine B12 | 13.50 | 100 | 135.00 |
| Thiaminechloorhydraat | 977,63 | 500 | 1,955.27 |
Tabel 2:. Vitamine oplossing recept De hoeveelheden zijn hoeveelheden die nodig zijn voor de bereiding van geconcentreerde oplos-tie.
- 20 L autoclaveerbare container met DW gedeeltelijk te vullen en plaats een magnetische roerstaaf. Plaats de container op een magnetische roerder plaat en voeg de in tabel 3 (behalve de vitamines) chemie, toevoegen ze achter elkaar en na elke volledig oplost. Vul de container tot 20 L. bereiken
| Bestanddeel | Bedrag toe te voegen aan medium | Eenheid |
| NaCl | 350.00 | g |
| CaCl 2 · 2H 2 O | 3.00 | g |
| KCl | 9.60 | g |
| Na 2 SiO 3 · 9H 2 O | 1.14 | g |
| MgSO4 · 7H 2 O | 29.60 | g |
| 20.40 | g | |
| KH 2 PO 4 | 1.36 | g |
| Ammonium ferricitraat | 0.10 | g |
| Oplossing A | 20.00 | ml |
| Biotine-oplossing * | 818,00 | pi |
| Vitamine B12 oplossing * | 296,20 | pi |
| Thiaminechloorhydraat oplossing * | 521,60 | pi |
| * Toevoegen aan gekoelde autoclaaf media |
Tabel 3: N. salina medium recept. De hoeveelheden zijn bedragen die nodig zijn in de voorbereiding van de 20 L van voedselrijke medium.
- Steriliseer het medium autoclaaf gedurende 30 minuten bij 120 ° C en atmosferische druk. Laat het medium cool naar RT.
- Zet het vaatje op een magnetische roerder plaat. Voeg het bereid in stap 3.2 vitaminen en laat het medium mix grondig.
4. Anorganische verontreinigingen voorraad voorbereiding
- Gedeeltelijk vul de maatkolven aangegeven in tabel 4 met DW en voeg de individuele zout vermeld. Vul met DW om het gewenste uiteindelijke volume en meng. Niet bewaren deze bestanden zoals sommige elementen adsorberen aan wanden kolf
LET OP: Verschillende anorganische verontreinigende stoffen die in dit protocol zijn kankerverwekkend, teratogeen en mutageen, draag een gezichtsmasker, handschoenen en een laboratoriumjas bij het hanteren van zouten.
| Analyte | Zoutbron | Volume van de voorraad te bereiden (L) | Zout toe te voegen aan de kolf60; (Mg zout) | Analytconcentratie toegevoegd aan de kweek (mg analyt / l) |
| Als | NAASO 2 | 0.1 | 14.8 | 7.74E-02 |
| CD | CdCl2 | 0.5 | 13.5 | 1.50E-02 |
| Co | CoCl 2 .6H O 2 | 0.5 | 34.7 | 1.56E-02 |
| Cr | Na 2 Cr 2 O 7 · 2 H 2 O | 0.1 | 40.6 | 1.29E-01 |
| Cu | CuCl .2H 2 2 O | 0.1 | 38.3 | 1.30E-01 |
| Hg | HgCl2 | 1.0 14.6 | 9.80E-03 | |
| Mn | MnCl2 .4H O 2 | 0.1 | 58.8 | 1.49E-01 |
| Ni | 2 NiCl .6H O 2 | 0.1 | 112,0 | 2.51E-01 |
| Pb | PbCl2 | 0.5 | 39.9 | 5.41E-02 |
| Sb | Sb 2 O 3 | 0.5 | 26.7 | 4.06E-02 |
| Se | Na 2 SeO 3 | 0.5 | 11.8 | 9.80E-03 |
| Sn | SnCl 2 .2H O 2 | 0.5 | 3.9 | 3.76E-03 |
| V | V 2 O 5 | 0.1 | 22.2 | 1.13E-01 |
| Zn | ZnCl2 | 0.1 | 99.9 | 4.36E-01 |
Tabel 4:. Geconcentreerde anorganische verontreinigingen stampreparaat toevoeging van 1 ml van deze geconcentreerde bouillon aan de PBR 1,1 L medium produceert de eindconcentratie in de laatste kolom.
- Steriliseer de anorganische verontreiniging bestanden door de oplossing door een steriel 0,2 urn spuitfilter en verzamel het filtraat in een steriele buis.
5. N. salina Inoculum Production
- In een 500 ml Erlenmeyer kolf van 200 ml medium bereid in stap 3 en voeg 3 gram agar. Bedek de kolf met aluminiumfolie en autoclaaf gedurende 20 minuten bij 120 ° C. Giet de oplossing in een steriele petri-gerechten en laat het afkoelen tot het stolt. Dit moet worden voltooid een steriele kap of op zijn minst in de buurt van een vlam in een schone omgeving om de kans op besmetting te verminderen.
- Streak N. Salina cellen in een steriele petri-dishes bereid in stap 5.1 onder toepassing van een steriele lus seeding. Plaats de petrischaal kweken op een tafel verlicht met T12 lampen gehandhaafd op kamertemperatuur. Laat microalgen groeien tot kolonies zichtbaar zijn.
- Overdracht kolonies om steriele verbijsterd erlenmeyers met 200 ml van voedselrijk medium bereid in stap 3 en houd ze op een verlichte schudtafel (1000 RPM). Laat de cultuur groeien tot medium wordt groen.
- Breng de microalgen een 1.1 L steriele PBR. Plaats de PBR per inoculum waterbad verlicht 200 umol m -2 s -1 bij T8 fluorescentielampen en gehouden op 23 ° C door een recirculerende koeler en een automatische verwarmen recirculerend waterbad controle. Pas de lucht en de CO 2 rotometers tot 2,5 L min -1 en 25 cc min -1, respectievelijk.
- Na een week van groei split biomassa in nieuwe 1 0,1 L PBRS met nieuw medium en laat het groeien tot een totaal van ten minste 28 g droog gewicht biomassaverkregen tussen de twee reactoren die kan worden bepaald door middel van optische dichtheid.
- Oogst de inoculum biomassa door centrifugatie bij 2054 x g gedurende 15 minuten bij 10 ° C met steriele centrifugeflessen en steriele technieken te voorkomen. Gooi het supernatant en blijven cel concentratie als nodig is.
- Zodra alle biomassa wordt gecentrifugeerd, resuspendeer de cellen in 300 ml vers steriel medium.
- Verdun 0,1 ml van microalgen kweek in 3 ml van DW en verdun vervolgens 0,1 ml van deze nieuwe oplossing in 3 ml van DW. Zorg ervoor dat het monster grondig gemengd. Meet de optische dichtheid (OD) van de microalg concentraat bij 750 nm () onmiddellijk met een spectrofotometer.
- Met vergelijking (1) om de hoeveelheid biomassa te bepalen in het concentraat.
Opmerking: Vergelijking (1) werd verkregen uit de lineaire regressie tussen versus totale hoeveelheid zwevende deeltjes (in g / l -1) voor N. Salina (R2 = 0,9995). Vergelijking 1 is ontwikkeld voor het spectrophotometer model in de Materials tabel, het genereren van een nieuwe kalibratie bij gebruik van een andere spectrofotometer model.- Met vergelijking (2) bepaal het volume van microalgen concentraat (in L) nodig om een 4 g / l -1 kweekdichtheid in een PBR van 1,1 L volume (in L) te verkrijgen.
- Met steriele techniek, voeg de hoeveelheid microalgen concentraat in de stap 5.9 een geautoclaveerde PBR een eerste kweek dichtheid van 4 g / l -1 bereikt. Vul PBR met medium tot 1,1 L. Herhaal deze stap tot 6 PBRS worden geënt. Plaats de PBRS in het inoculum waterbad.
- Laat de microalgen in de PBRS kweken voor 8 dagen en dan oogsten de biomassa (door het herhalen van stappen 5,6-5,7). Herhaal stap 5.8 de oorspronkelijke berekeninginoculum volume voor een eerste kweek dichtheid van 1 g / l -1.
6. Experimentele Reactoren
- Met behulp van steriele technieken voeg ongeveer 1 liter medium bereid in stap 3 aan elk van de 12-zuur gespoeld steriele PBRS. Plaats de PBRS in het waterbad van het experimentele groeisysteem. Schakel sparge lucht op 1,5 L min -1.
- Steriliseren een geijkte pH-meter met het schoonmaken van het met 70% ethanol. Meet de pH van het medium in de PBR en controleer pH ongeveer 7,0; zo niet, herhaal dan stap 2 tot zuur uitgeloogd uit het zuur spoelen stap te verwijderen.
- Kalibreren elke pH-controller met behulp van pH 7, desinfecteren de sondes met ethanol (70%) en plaats ze in de PBRS deksels.
- Aan elke PBR (behalve control PBRS) voeg 1 ml van elk van de anorganische verontreinigingen steriele voorraden bereid in stap 4. Laat de verontreinigingen grondig in de PBR mengen. De uiteindelijke concentratie van de anorganische verontreinigingen in de PBRS zijn voorstellingn in de laatste kolom in tabel 4, en worden de geschatte maximale concentraties verwacht van een kolengestookte elektriciteitscentrale integratie.
- Voeg 14 ml steriel DW met de controle PBRS.
- Voeg de geconcentreerde microalg inoculum verkregen in stap 5.11 van de experimentele PBRS teneinde een initiële kweek dichtheid van 1 g / l -1 verkrijgen. Laat biomassa mix grondig.
- Draai hoge lichtintensiteit lichten (van 984 umol m -2 sec -1) en pH-controllers op en CO 2 aan te passen aan 30 cc min 1. Verhoog de CO 2 stroom naar 50 cc min -1 vanaf dag 3 na afloop. Initial lage CO 2 debiet is cruciaal om grote veranderingen in de pH te voorkomen als gevolg van vertragingen in de gas / vloeistof overdracht en pH-meting.
- Meet en monsters te nemen als dat nodig is. Zorg ervoor dat het waterpeil na de bemonstering te markeren. (LET OP: sommige anorganische verontreinigingen in de PBR zijn kankerverwekkend, teratogeen en mutageen, gebruik handschoenen en capped containers bij de omgang met monsters).
- Voeg steriele DW dagelijks naar de PBRS in om te compenseren voor verliezen als gevolg van verdamping.
- Na 7 dagen kweken, oogsten de biomassa door centrifugatie bij 9936 x g en bewaart zowel biomassa en supernatant medium bij -80 ° C.
- Freeze drogen de biomassa bij 0,1 mbar en -50 ° CO / N. Poeder van de biomassa (gebruik een spatel om poeder biomassa in de centrifugebuis). Behoud gevriesdroogd biomassa bij -80 ° C.
7. Microwave Assisted Spijsvertering van Monsters
De digestie van de biomassa monsters is vereist als een pre-verwerkingsstap voor ICP-MS analyse.
Opmerking: deze stappen een gesloten vat microgolfontsluiting systeem met gecontroleerde druk opluchting. (LET OP: Hoge druk ontwikkelen tijdens zuur spijsvertering, inspecteren van de fysieke integriteit van de vertering schepen en schilden, en hervormen de deksels microgolfontsluiting vaartuig voor elk gebruik).
- Wash Teflon microgolfontsluiting vaten met water en zeep, afspoelen met DW en de lucht laten drogen schepen. Trace metaalverontreiniging in de vaten te verwijderen verteren bereid zoals beschreven in de volgende stappen.
- Vernieuwing van het microgolfontsluiting deksels vat en sluit de flesjes stevig vast.
- Voeg 10 ml salpeterzuur elk.
- Invoering van het schip in de veiligheid schild. Zorg ervoor dat er geen biomassa, water of andere reagentia worden achtergelaten op de wanden van de beschermkap of de buitenwanden van de reactievaten om schade aan het veiligheidsscherm voorkomen. Cap de veiligheid schild met de veiligheidsklep zorg ervoor dat de lente in de flacon is flush. Zoek het schild op de rotor met de dop ventilatieopeningen naar buiten in de buitenste rij en naar binnen in de binnenste rij.
- Op vaartuig nummer één, plaatst u de keramische thermowell en de temperatuur sensor. Deze thermometer controleert de werkelijke temperatuur in de flacon en dient als de controlerende parameter om de spijsvertering te progr voereneen M. Zorg ervoor dat de flacon nummer één bevat hetzelfde monster en reagens hoeveelheden als de andere flesjes.
- Voer de verteringsparameters getoond in Tabel 5 en begint spijsvertering. Wanneer het programma is afgelopen, koele lucht de flesjes tot ze RT bereiken.
| Stap | Flesjes spoelen | Monsterontsluiting | ||||
| Temperatuur (° C) | Tijd (min) | Max. vermogen (W) | Temperatuur (° C) | Tijd (min) | Max. vermogen (W) | |
| 1 | RT tot 190 | 25 | 1000 | RT 180 | 15 | 1000 |
| 2 | 190 | 10 | 1000 | 180 | 15 | 1000 |
| - | 20 | - | - | 20 | - |
Tabel 5: Parameters gebruikt in het microgolfontsluiting programma.
- Binnen een zuurkast, plaatst het overdrukventiel tool op het schild dop met de dop ventilatieopeningen wijzen van u af. Zodra de druk is vrijgegeven openen de dop (LET OP: Altijd geopend verteerd flesjes in zuurkast sinds biomassavergisting met een zuur produceert giftige dampen).
- Gooi het zuur. De Teflon schepen met DW 3 keer spoelen. Laat flacons aan de lucht drogen.
- Biomassa verteren, voeg 50 mg gevriesdroogd biomassa magnetron reactievaten. Voor kwaliteitscontrole (QC) voor te bereiden de volgende flesjes: in twee verschillende flesjes toe ofwel 5 ml Level 7 ICPMS of 5 ml Level 7 Hg CVAAS standaard voorbereid in de stappen 9.1 en 10.1 (de verteerde oplossing van deze flacon wordt het laboratorium versterkte genoemd blanco (LFB)), laat een ander flesje leeg (de verteerde oplossingvan deze flacon wordt de laboratoriumreagens blanco (LRB)).
- Om medium verteren, voeg 10 ml supernatant medium zuur gespoeld microgolfontsluiting schepen drogen. Voor kwaliteitscontrole (QC) stelt de volgende injectieflacons: In twee flesjes voeg 5 ml van niveau 7 ICPMS of CVAAS metalen standaard bereid in stap 9,1 en 10,1 (de verteerde oplossing van dit buisje wordt de LFB), een nieuw buisje toevoegen 10 ml van DW (de verteerde oplossing van deze flacon wordt de LRB).
- Vernieuwing van het microgolfontsluiting deksels vat en sluit de flesjes stevig vast.
- Voeg 7 ml geconcentreerd sporenmetalen rang salpeterzuur en 3 ml waterstofperoxide aan elk flesje. Meng de inhoud door voorzichtig schudden van de oplossing. Digest de inhoud van de ampullen door stap 7,4-7,7 (gebruik microgolfontsluiting parameters voor steekproefspijsvertering in Tabel 5).
- Toevoegen verteerd monster een 25 ml maatkolf de vaten met DW spoelen voor verbeterd herstel. Vul de maatkolf met DWhet merk.
- Transfer gedigereerd monsters naar een afgedekte container. Bewaar monsters bij 4 ° C tot analyse kan worden voltooid. Voor dit onderzoek analyse op dezelfde dag gedaan Hg binnen drie dagen voor de andere elementen.
8. Quality Control (QC) monsters
Opmerking: Analyse QC samples om de betrouwbaarheid van de resultaten van experimentele monsters te verzekeren.
- Gedeeltelijk vullen een zuur gespoeld 1 L maatkolf met DW. Voeg 280 ml geconcentreerd trace metalen leerjaar salpeterzuur en meng (deze oplossing wordt ook wel de blanco-oplossing) (LET OP: Steeds zuur toevoegen aan water, nooit water toe te voegen aan zuur als de exotherme reactie gewelddadig kan zijn). Laat oplossing afkoelen tot kamertemperatuur.
- Naast QC monsters bereid in stappen 7.9 en 7.10, de voorbereiding van de volgende QC monsters.
- Voor de voortdurende kalibratie verificatie (CCV): Vul een polystyreen buis met kalibratiestandaard (voor de bereiding ziestap 9.2 en 10.1). Zet de Hg standaard oplossing op de CVAAS rek en de ICPMS standaardoplossing in de ICPMS autosampler.
- Voor de voortdurende kalibratie blanco (CCB): Vul twee polystyreen buizen (16 ml) met de blanco (bereid in stap 8.1). Plaats een monster in de CVAAS rek en het andere monster in de ICPMS autosampler.
- Voor het laboratorium versterkte matrix (LFM): Willekeurig kiezen 1 monster van elk 12 monsters voor elk type monster (bijv biomassa of medium) en gebruik het om een LFM bereiden. Voor ICPMS, voeg 0,5 ml ICPMS standaard niveau 7 en 3 ml geknipt experimentele monster (van ofwel biomassa of medium) in een polystyreen buis.
- Meng de inhoud en plaats de flacons op de ICPMS autosampler. Voor CVAAS, voeg 2 ml Hg standaard Level 7 en 6 ml verteerd experimentele monster (van ofwel biomassa of medium) om een polystyreen buis. Meng de inhoud en plaats flacons op de CVAAS rek.
- Voor de duplicaten van de monsters: Willekeurig kiezen 1 steekproef van steedsy 12 monsters voor elk type matrix (bijvoorbeeld biomassa, medium, LFM of verdund matrix) en dupliceren de flacon. Plaats de herhaalde flacons in de ICPMS autosampler of CVAAS rek.
- Voor extra monsters: Willekeurig kiezen 1 monster van elk 12 monsters voor elk type matrix (bijvoorbeeld biomassa, medium, LFM of verdund matrix) en dupliceren de flacon. Plaats de herhaalde flacons in de ICPMS autosampler of CVAAS rek.
- Definieer de kwaliteit van de gegevens criteria voor de studie. Voor de huidige studie te dupliceren de door Eaton, Clesceri, Rijst en Greenberg 25 kwaliteitscriteria. De voor de QC parameters zijn: procent verschil (% D) voor CCV binnen ± 10% 25 (met uitzondering van Pb en Sb, zie bespreking), LFB procent recovery (% R) binnen ± 70-130% 25, LFM procent recovery (% R) binnen 75-125% 25, en de relatieve procent verschil (RPD) binnen ± 20% 25, en een voortdurende calibratie blanco (CCB) hieronder methode rapportage limiet (MRL) 25. Zie berekeningsvergelijkingen in stap 9.7.
9. Kwantificering door inductief gekoppeld plasma massaspectrometrie (ICPMS)
- Op de dag van volledige analyse ongeveer 5 ml van uitgegist monster polystyreenbuizen en plaats ze in de ICPMS autosampler. Voeg ongeveer 15 ml gedigereerde monsters polystyreenbuizen en plaats ze in de CVAAS rack.
- Op dezelfde dag van analyse te maken van de kalibratie standaarden. Voeg gekocht ICPMS standaardoplossing en vul met lege (bereid in stap 8.1) zoals beschreven in tabel 6 (zie standaardoplossing beschrijving in het Material tabel) zuur-gespoeld maatkolven.
| Parameter | Level 1 | Niveau 2 | Niveau 3 | Niveau 4 | Niveau 5 | Niveau 6 | Niveau 7 |
| Heb norm worden toegevoegd (ml) | - | - | - | - | - | - | 10.0 |
| Niveau 7 worden toegevoegd (ml) | 0.0 | 1.0 | 2.5 | 5.0 | 20.0 | 25,0 | - |
| Eindvolume * (ml) | - | 50.0 | 50.0 | 50.0 | 100.0 | 50.0 | 100.0 |
| Uiteindelijke concentratie (ug / l) | |||||||
| 75 Aangezien | 0.0 | 2.0 | 5.0 | 10.0 | 20.0 | 50.0 | 100.0 |
| 111 Cd | 0.0 | 1.0 | 2.5 | 5.0 | 10.0 | 25,0 | 50.0 |
| 59 Co | 0.0 | 10.0 | 25,0 | 50.0 | 100.0 | 250,0 | 500.0 |
| 52 Cr | 0.0 | 2.0 | 5.0 | 10.0 | 20.0 | 50.0 | 100.0 |
| 63 Cu | 0.0 | 5.0 | 12.5 | 25,0 | 50.0 | 125,0 | 250,0 |
| 55 Mn | 0.0 | 3.0 | 7.5 | 15.0 | 30,0 | 75,0 | 150,0 |
| 60 Ni | 0.0 | 8.0 | 20.0 | 40.0 | 80.0 | 200,0 | 400,0 |
| 208 Pb | 0.0 | 1.0 | 2.5 | 5.0 | 10.0 | 25,0 | 50.0 |
| 121 Sb | 0.0 | 12.0 | 30,0 | 60,0 | 120,0 | 300,0 | 600.0 |
| 51 V | 0.0 | 10.0 | 25,0 | 50.0 | 100.0 | 250,0 | 500.0 |
| 66 Zn | 4.0 | 10.0 | 20.0 | 40.0 | 100.0 | 200,0 | |
| * Bereiken van dit volume door toevoeging van het bereid in stap 8.1-oplossing | |||||||
Tabel 6: Concentratie van kalibratiestandaarden Levels 1-7..
- Verwijder de kegels van de ICPMS en ultrasone trillingen hen 1 min in DW. Droog de kegels en zet ze terug in het instrument.
- Zet het water chiller, gassen (Ar, H 2, He), de ICPMS, plug lijnen naar interne standaard, en vul auto-sampler spoelen containers (DW, 10% salpeterzuur, 1% salpeterzuur + 0,5% zoutzuur) .
- Open de Masshunter Workstation software en zet de plasma, tune de ICPMS en laadt de ingestelde parameters in tabel 7 methode.
| Parameters Waarden | |||||||||
| Interne standaarden | 72 Ge, 115 | ||||||||
| RF Power | 1.500 W | ||||||||
| Plasma gasstromingssnelheid | 14.98 | ||||||||
| Vernevelaar gasstromingssnelheid | 1.1 L / min (carrier en verdunning gas gecombineerd - 0,6 + 0,5 L / min) | ||||||||
| Sampling kegel | Nickel voor x lens | ||||||||
| Skimmer kegel | Nikkel | ||||||||
| Sample opnamesnelheid | 0.3 rps | ||||||||
| Vernevelaar pomp | 0.1 rps | ||||||||
| S / C temperatuur | 2 ° C | ||||||||
| Aftasttoestand | Dwell tijd 1 sec, het aantal herhaalde 3 | ||||||||
| H2 gasstroom | N / A | ||||||||
| Hij gasstroom | 4,3 ml / min | ||||||||
| Parameter | Level 1 | Niveau 2 | Niveau 3 | Niveau 4 | Niveau 5 | Niveau 6 |
| L7 Hg formaat wordt toegevoegd (ml) | 0 | 1 | 2.5 | 5 | 20 | 25 |
| Eindvolume * (ml) | - | 50 | 50 | 50 | 100 | 50 |
| Uiteindelijke concentratie (ug / l) | 0 | 0.5 | 1.25 | 2.5 | 5 | 12.5 |
| * Bereiken van dit volume door toevoeging van het bereid in stap 8.1-oplossing | ||||||
Tabel 8: Concentratie van Hg calibratiestandaard Levels 1-6..
- Open de Ar gas en lucht ventiel, zet de Atomic absorptie spectrofotometer en de Flow Injection Atomic Spectroscopy (FIAS). Open de CVAAS Winlab software, zet de Hg-lamp en laat het opwarmen tot parameter van de software energie 79. Laad het programma voor de Hg-analyse met de parameters in Tabel 9 bereikt. Stel de lichtbaan in het instrument om de maximale transmissie geven.
| Parameters | Waarden |
| Dragergas | Argon, 100 ml / min |
| Lamp | Hg elektrodeloze ontladingslamp, setup bij 185 mA |
| Golflengte | 253,7 nm |
| Spleet | 0,7 nm |
| Celtemperatuur | 100 ° C |
| Monstervolume | 500 gl |
| Carrier | 3% HCl, 9,23 ml / min |
| Reductant | 10% SnCl 2, 5,31 ml / min |
| Maat | Piekhoogte |
| Lees repliceert | 3 |
Tabel 9: CVAAS bedrijfsomstandigheden.
- Steek de lijn naar de carrier oplossing van 3% trace metalen graad zoutzuur.
- Steek de lijn naar het reductiemiddel oplossing van 10% stannochloride (geschikt voor analyse Hg) bij 3% sporenmetalen rang zoutzuur. Bereid deze oplossing dezelfde dag van de analyse als het is gevoelig voor atmosferische oxidatie (LET OP: Tinchloride is erg gevaarlijk, gebruik beschermende kleding bij het werken ermee Verzamel CVAAS afval in gevaarlijke insluiting en goed afvoeren.).
- Plaats de Hg normen, QC monsters en experimentele monsters in de CVAAS rek en input van de volgorde in de CVAAS Winlab software. Run normen en het genereren van de kalibratievergelijking.
- Run QC samples en experimentele monsters. De CVAAS trekt ongeveer 5 ml van het monster in het instrument reduceert de onderhavige Hg in het monster tot elementair Hg (Hg 0) gas en zuivert het gas uit de oplossing met een drager gas (Ar) in een gesloten systeem. De Hg damp gaat door een cel in het Hg lamp licht pad. Een detector bepaalt het licht geabsorbeerd bij 253,7 nm en koppelt deze aan concentratie. (LET OP: Hg damp is toxisch, zorgen instrument afzuigkap is op zijn plaats).
- Bereken% R,% D en RPD in stap 9.7 tijdens de analyse en de resultaten van het project datakwaliteit criteria te vergelijken.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Biomassa opbrengsten
Productie van N. salina in de PBR wordt gebruikt in deze studie steeg van 1 g / l -1 tot 8,5 ± 0,19 g / L -1 (N = 12) ter controle reactoren en 4,0 ± 0,3 g / L -1 (N = 12) voor het multi-metalen verontreinigde in 7 dagen. De experimenten geproduceerd herhaalbare data over drievoud reactoren en meerdere batches. Figuur 2A toont de gemiddelde dichtheid van de cultuur met zeer kleine standaard fout op basis van steekproeven uit drie onafhankelijke PBRS. Om dit resultaat te garanderen een alleenstaand was, werden drie batches gekweekt met gelijke resultaten. De gecombineerde resultaten van alle vier groepen worden getoond in figuur 2B. Hoewel biologische variabiliteit bestaat, deze studie toont aan dat er een consistent negatieve impact van anorganische verontreinigingen N. salina productie. De biomassa opbrengst van de verontreiniging blootgestelde PBRS statistisch verschillend van de controle van PBRSdag 2 verder (ANOVA, p <0,05).
Kwaliteitscontrole beoordeling van anorganische verontreinigende kwantificering
Twaalf van de veertien elementen geanalyseerd waren volledig realiseerbaar na vertering, zoals aangegeven door de LFB% R% met R in de buurt van 100%, aangeeft dat er geen verlies, geen winst en geen kruisbesmetting van analyten tijdens de spijsvertering (tabel 10). Bij kwantitatieve analyse van monsters% D en RPD werden gevolgd door alle analyses en het gemiddelde van de resultaten worden getoond in Tabel 10. As, Cd, Co, Cr, Cu, Hg, Mn, Ni, Pb, Sb, V en Zn geslaagd het% O en RPD evenwel% D Pb en Sb geleidelijk daalde tijdens de analyse. De% D voor deze elementen zijn verbeterd na reiniging kegel echter constant kegel reiniging onpraktisch en daarom gegevenskwaliteitsdoelstellingen van Pb en Sb werden verlaagd. CCB voor alle analyten waren ook onder de MRL. Matrix effecten werden bepaald door het analyseren LFM monsters en het verkrijgen van de% R. While Co, Hg, V en Sb gaf de QC data criteria, werd niet voorbij As, Cd, Cr, Cu, Mn, Ni, Pb en Zn als gedigereerd biomassa monsters geanalyseerd, resulterend in% R onder de QC-doeleinden. Matrix DW verdunning in een verhouding van 1: 3 (opgeloste stof: oplosmiddel) resulteerde in% R die gegevens kwaliteitscriteria doorstaan. Matrix effecten werden ook waargenomen in de analyse van de gedigereerde supernatant en werden behandeld door dezelfde verdunningsverhouding (Tabel 10) ervoor zorgen de verdunningsfactor leverde de detectielimiet van het instrument niet in gevaar brengen. Problemen met de detectie van Se en Sn werden waargenomen op basis van onstabiele metingen en een contaminatie probleem resp. De onstabiele metingen van Se worden toegeschreven aan zouten in de matrix 27. De Sn verontreiniging werd teruggevoerd naar een zuur toegepast bij de digestiestap.
| Analyte | R | CCV | LFB | LFM voor biomassa monsters | LFM voor supernatant monsters | ||||
| % D | % R | Verdunningsverhouding | % R | RPD | Verdunningsverhouding | % R | RPD | ||
| QC beperkt 25 | 0,9950 | ± 10 | 70-130 | - | 75-125 | ± 20 | - | 75-125 | ± 20 |
| Als | 0,9998 | 1.8 | 101.0 | 1: 3 | 100,4 | 5.2 | 1: 3 | 92.5 | -0.5 |
| CD | 1.0000 | 1.4 | 102.6 | 1: 3 | 103.5 | 4.6 | Geen | 92.3 | 0.6 |
| Co | 0,9997 | 1.7 | 98.8 | Geen | 95.2 | -1.4 | Geen | 96.5 | -1.5 |
| Cr | 0,9999 | 1.5 | 99.8 | 1: 3 | 96.5 | 1.8 | 1: 3 | 90.1 | -0.8 |
| Cu | 0,9999 | 2.9 | 98.2 | 1: 3 | 101.4 | 4.8 | 1: 3 | 94.4 | -0.5 |
| Hg | 0,9983 | -1,7 | 103,0 | Geen | 98.7 | 1.5 | Geen | 98.0 | 0.3 |
| Mn | 0,9998 | 2.9 | 97.6 | 1: 3 | 83.2 | 1.8 | 1: 3 | 95.4 | -1,7 |
| Ni | 0,9999 | 103.5 | 1: 3 | 98.5 | 2.1 | Geen | 93.3 | -0.9 | |
| V | 0,9998 | 2.5 | 97.2 | Geen | 95.5 | -1.5 | Geen | 101,2 | -1.9 |
| Pb | 0,9998 | 12.6 | 105.2 | 1: 3 | 88.9 | 0.0 | Geen | 93.5 | -0.5 |
| Sb | 0,9998 | 1.1 | 105,7 | Geen | 101.8 | -9,6 | Geen | 90.8 | -1.2 |
| Zn | 0,9997 | 5.2 | 120,8 | 1: 3 | 90.7 | 1.4 | Geen | 89.2 | -1.9 |
Tabel 10: Samenvatting van de resultaten van de kwaliteitscontrole monsters. R = correlation coëfficiënt,% D: procent verschil% R: procent herstel, RPD = relatieve procent verschil, verdunningsverhouding verwijst naar opgeloste: oplosmiddel-verhouding.
Anorganische verontreinigingen concentraties
Heavy metal en anorganische verontreinigingen werden gevonden in zowel biomassa en supernatant medium. De concentraties in de biomassa voor de 12 geanalyseerde elementen zijn weergegeven in figuur 3. Concentraties in de biomassa geoogst drievoud PBRS (N = 3) in batch # 1 toont een zeer kleine standaardfout (figuur 3A). Het combineren van gegevens uit drievoud PBRS van 4 batches vaste blijkt dat anorganische verontreinigingen aanwezig in de biomassa (N = 12) zijn. De concentraties in het supernatant medium worden getoond in figuur 4. Resultaten tonen drievoud PBRS (N = 3) voor batch # 1 ook kleine standaardfout (Figuur 4A) en laten zien dat de meeste verontreinigingen voorkeur gelegen zijn in de biomassa leading zeer lage concentraties in het supernatant met verschillende monsterconcentraties nabij de MRL van het instrument. De resultaten van alle vier groepen zijn weergegeven in Figuur 4B.
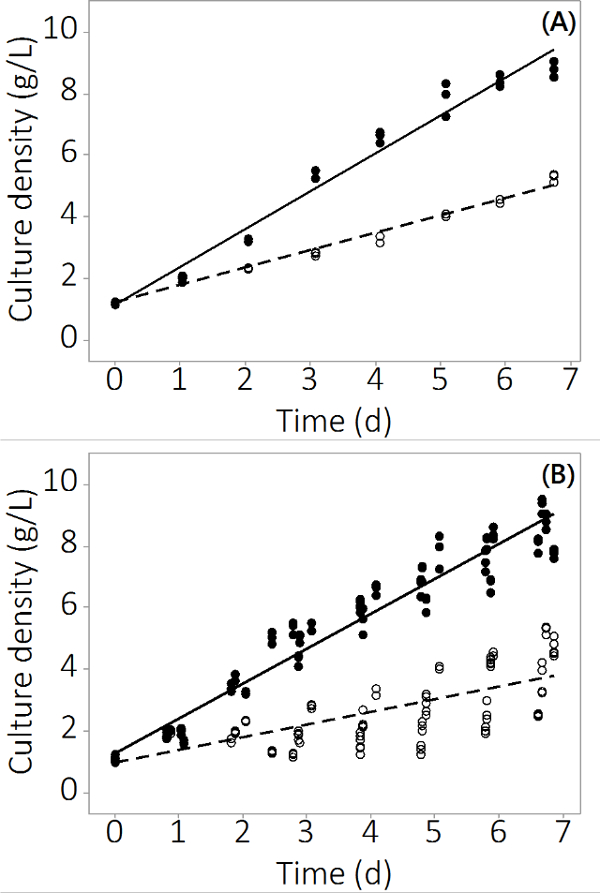
Figuur 2. C ULTUUR concentratie in de teeltperiode voor verontreinigde en controle PBRS. (A) Cultuur dichtheid in batch # 1, de resultaten van N = 3 PBRS. (B) Cultuur dichtheid in 4 partijen, de resultaten van N = 12 PBRS. Lege cirkels vertegenwoordigen verontreinigde biomassa, gesloten cirkels vertegenwoordigen de controle.
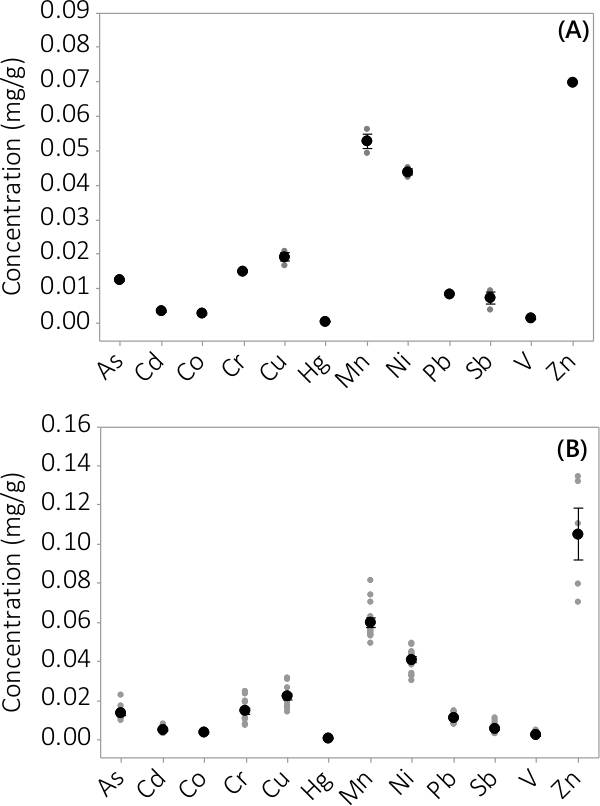
Figuur 3. Concentratie van anorganische verontreinigingen in biomassa. (A) concentratie in batch #1, resultaten van N = 1 PBR voor Zn en N = 3 PBRS alle andere analyten, (B) concentratie van 4 batches, afkomstig N = 4 PBRS voor Zn en N = 12 PBRS alle andere analyten. Gemiddelde concentraties zijn weergegeven door zwarte dichte rondjes, zijn afzonderlijke gegevenspunten voorgesteld door grijze dichte cirkels. Foutbalken vertegenwoordigen ± één standaardafwijking van het gemiddelde.
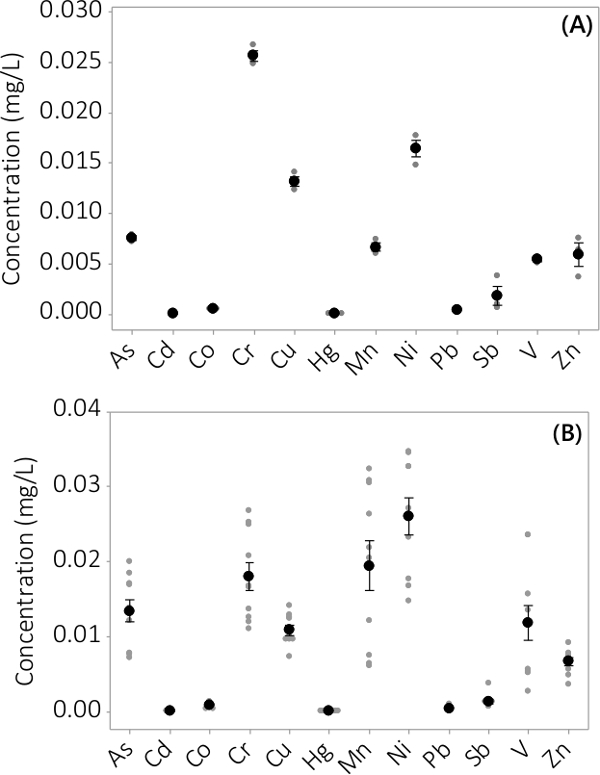
Figuur 4. Concentratie van anorganische verontreinigingen in supernatant. (A) concentratie in batch # 1, afkomstig N = 3 PBRS, (B) concentratie van 4 batches, afkomstig N = 12 PBRS. Gemiddelde concentraties zijn weergegeven door zwarte dichte rondjes, zijn afzonderlijke gegevenspunten voorgesteld door grijze dichte cirkels. Foutbalken vertegenwoordigen ± één standaardafwijking van het gemiddelde.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Saline microalgen N. salina succes kunnen worden geteeld in de ontworpen groeisysteem met herhaalbare resultaten en hoge opbrengsten biomassa. Airlift mengen toegestaan voor een goed gemengde opgeschort cultuur met minimale bezinken of biofouling over de perioden van 7 dagen groei. De minimale licht variabiliteit over de tl-licht bank is ook aangetoond dat niet tot merkbare verschillen in groei.
De studie toont met zware metalen verontreinigde media bij concentraties representatief zijn voor de integratie met kolen rookgas negatieve invloed groei van biomassa. Herhaalbaarheid in de studie wijst op de invloed van de multi-metal systeem heeft op de productiviteit. Verscheidene stappen in de werkwijze hebben het potentieel een negatieve invloed groei en verontreinigen het systeem waarbij zorgvuldige experimentele opstelling. Bepaling van de pH van het medium voordat het experiment een QC stap waarmee wordt gecontroleerd of het medium niet wordt aangezuurd (bijvoorbeeld resulting van onjuist PBR spoelen na zure weken). Aangezuurde medium zal algengroei beïnvloeden en veranderen voedingsstoffen biologische beschikbaarheid (bv veranderingen in de anorganische koolstof speciatie en metalen soortvorming) dus invloed heeft op de interacties tussen algen bindingsplaatsen, nutriënten en metalen. De zorgvuldige bereiding van laboratoriumapparatuur voor deze studies werd zodanig vereist een nauwkeurige massabalans van de ingevoerde metalen kan worden uitgevoerd. Andere stappen in het proces hebben het potentieel introduceren vermist metalen benadrukken de noodzaak van het gebruik van de juiste klasse oplosmiddelen en chemicaliën. Juiste QC door het proces effectief kan identificeren van de introductie van zware metalen verontreinigingen.
De resultaten tonen ingebracht verontreinigingen worden verdeeld tussen de biomassa (figuur 3), media (figuur 4) en milieu. Anorganische verontreinigingen gevonden in geoogste N. salina suggereert dat dit microalgen zal incorporate een aantal van de anorganische verontreinigingen aanwezig in rookgassen. Dit assimilatie kan gevolge van adsorptie op celwanden als gevolg van geladen bindingsplaatsen, absorptie in de cel als gevolg van metabole activiteit en precipitatie van complexen gevormd met elementen in het medium 28. Visueel de reactoren met anorganische verontreinigingen na enkele dagen verschenen gele kleur in vergelijking met de donkergroene van de controle reactoren. Verontreinigde geoogst biomassa was niet visueel verschillend van de verontreiniging-vrije biomassa na pellet vorming na de oogst door centrifugeren. Het visuele kleurverschil voor de oogst wordt toegeschreven aan een lagere dichtheid biomassa en benadrukte microalgen. Verontreinigingen die niet in de biomassa verwijderd hebben accumulatievermogen in de media zie figuur 4. Accumulatie in de media duidt op potentiële omvang beperken als media recycling vertegenwoordigt een noodzaak voor economische levensvatbaarheid. De beperking zou gedicteerddoor de tolerantie voor zware metalen verontreinigingen die soortspecifiek zal zijn. De resultaten van dit onderzoek onderstrepen de noodzaak om beter inzicht in de mogelijke negatieve gevolgen voor de integratie van microalgen groei systemen met afval koolstof bronnen, in het bijzonder op basis van steenkool rookgas. De resultaten van deze studie benadrukken de behoefte om de gevolgen van de productiviteit van de andere verontreinigingen verwacht aanwezig in rookgassen te begrijpen, zoals oxiden van zwavel en stikstof, fijn stof en organische verontreinigingen zoals polychloordibenzo dioxinen en furanen dibenzo. Vorige TEA en LCA assessments hebben een naadloze integratie aangenomen zonder de effecten van verontreinigingen, zoals zware metalen en anorganische verontreinigingen op de productiviteit. In het algemeen de resultaten daarvan benadrukken het effect van een multi-metal systeem op de productiviteit en kan worden gebruikt om het potentieel van microalgen begrijpen verontreinigingen bioremediate.
De methodologie gepresenteerd toegestaan voor the studie van anorganische verontreinigingen met herhaalbare resultaten voor microalgen. Sommige anorganische verontreinigingen die in dit experiment worden traditioneel in groeisystemen bij lage concentraties, maar anderen niet een bekende functie in de cel. Hierdoor multi-element mengsel van As, Cd, Co, Cr, Cu, Hg, Mn, Ni, Pb, Sb, Se, Sn, V en Zn in een concentratie in tabel 4 geremde groei. Kwantificeren van de hoeveelheid verontreinigingen in de biomassa kan moeilijkheden opleveren in multi-metal systemen. Vaak kunnen monsters met een hoog gehalte aan organische stoffen en zouten matrix storingen, polyatomische storingen, fysieke storingen en zout te produceren bouwen in kegels die uiteindelijk leidt tot onnauwkeurige metingen en het verlies van analytische nauwkeurigheid 29,30. Kwaliteitscontrolemonsters werking samen met de experimentele monsters geholpen om de nauwkeurigheid en precisie van de metingen te bepalen. Meting van de analyten met behulp van protocollen ontwikkeld voor deze studie heeft aangetoond dat een teccurate en nauwkeurig produceren aanvaardbare terugvorderingen die binnen de aanvaardbare prestaties voor dit type onderzoek 25,29. Vertering van stalen door microgolf oven werd bleek effectief voor N. te zijn zoutmeer zo verteerd monsters waren duidelijk zonder aanwezigheid van celresten of niet mengbaar porties. De matrix die in deze experimenten (algenbiomassa en kunstmatig zeewater) die matrix storingen die werden overwonnen door matrix verdunning. Echter, kan sterke groei steekproeven dan die in dit experiment tot matrix storingen en derhalve QC worden geanalyseerd voor elk specifiek scenario.
Subscription Required. Please recommend JoVE to your librarian.
Materials
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Sodium chloride | Fisher Scientific | S271-3 | |
| Calcium chloride dihydrate | Fisher Scientific | C79-500 | |
| Potassium chloride | Fisher Scientific | P217-500 | |
| Sodium meta silicate nonahydrate | Fisher Scientific | S408-500 | |
| Magnesium sulfate heptahydrate | Fisher Scientific | M63-500 | |
| Potassium nitrate | EMD Chemical | PX1520-5 | |
| Potassium phosphate monobasic | Fisher Scientific | P285-500 | |
| Ammonium ferric citrate | Fisher Scientific | I72-500 | |
| Boric acid | Fisher Scientific | A73-500 | |
| Sodium molybdate, dihydrate | EMD Chemical | SX0650-2 | |
| Manganese chloride tetrahydrate | Fisher Scientific | M87-500 | |
| Zinc sulfate heptahydrate | Fisher Scientific | Z68-500 | |
| Cupric sulfate pentahydrate | Fisher Scientific | C489-500 | |
| Biotin | Acros Organics | 230090010 | |
| Thiamine | Acros Organics | 148990100 | |
| Vitamin B12 | Acros Organics | 405920010 | |
| Copper (II) chloride dihydrate | Sigma-Aldrich | 221783-100G | Irritant, Dangerous to the Environment |
| Lead (II) chloride | Sigma-Aldrich | 268690-250G | Toxic, Dangerous to the Environment |
| Sodium dichromate dihydrate | Sigma-Aldrich | 398063-100G | Oxidizing, Highly Toxic, Dangerous to the Environment |
| Cobalt (II) chloride hexahydrate | Sigma-Aldrich | 255599-100G | Toxic, Dangerous to the Environment |
| Nickel (II) chloride hexahydrate | Sigma-Aldrich | 223387-500G | Toxic, Dangerous to the Environment |
| Sodium (meta) arsenite | Sigma-Aldrich | 71287 | Toxic, Dangerous to the Environment |
| Cadmium chloride | Sigma-Aldrich | 202908-10G | Highly Toxic, Dangerous to the Environment |
| Mercury (II) chloride | Sigma-Aldrich | 215465-100G | Toxic, Dangerous to the Environment |
| Tin (II) chloride dihydrate | Fisher Scientific | T142-500 | Corrosive. Suitable for Hg analysis. Very hazardous. |
| Manganese chloride tetrahydrate | Fisher Scientific | M87-500 | |
| Vanadium (V) oxide | Acros Organics | 206422500 | Dangerous to the Environment |
| Carbon dioxide | Air Liquide | I2301S-1 | Compressed |
| Hydrogen peroxide | H325-500 | Fisher Scientific | 30% in water |
| ICP-MS standard | ICP-MS-6020 | High Purity Standards | |
| Mercury standard | CGHG1-1 | Inorganic Ventures | 1000±6 µg/mL in 5% nitric acid |
| Argon | Air Liquide | Compressed | |
| Helium | Air Liquide | Compressed, ultra high purity | |
| Hydrogen | Air Liquide | Compressed, ultra high purity | |
| Nitric acid | Fisher Scientific | A509-P212 | 67-70% nitric acid, trace metal grade. Caution: manipulate under fume hood. |
| Hydrochloric acid | Fisher Scientific | A508-P212 | 35% hydrochloric acid, trace metal grade. Caution: manipulate under fume hood. |
| Equipment | |||
| Scientific prevacuum sterilizer | Steris | 31626A | SV-120 |
| Centrifuge | Thermo Fisher | 46910 | RC-6 Plus |
| Spectrophotometer | Shimadzu | 1867 | UV-1800 |
| pH controller | Hanna | BL981411 | X4 |
| Rotometer, X5 | Dwyer | RMA-151-SSV | T31Y |
| Rotometer, X5 | Dwyer | RMA-26-SSV | T35Y |
| Water bath circulator | Fisher Scientific | 13-873-45A | |
| Compact chiller | VWR | 13270-120 | |
| Freeze dryer | Labconco | 7752020 | |
| Stir plate | Fisher Scientific | 11-100-49S | |
| pH lab electrode | Phidgets Inc | 3550 | |
| Inductively coupled plasma mass spectrometer | Agilent Technologies | 7700 Series ICP-MS | Attached to autosampler CETAC ASX-520 |
| FIAS 100 | Perkin Elmer Instruments | B0506520 | |
| Atomic absorption spectrometer | Perkin Elmer Instruments | AAnalyst 800 | |
| Cell heater (quartz) | Perkin Elmer Instruments | B3120397 | |
| Microwave | Milestone | Programmable, maximum power 1,200 W | |
| Microwave rotor | Milestone | Rotor with 24-75 ml Teflon vessels for closed-vessel microwave assisted digestion. | |
| Materials | |||
| 0.2 μm syringe filter | Whatman | 6713-0425 | |
| 0.2 μm syringe filter | Whatman | 6713-1650 | |
| 0.45 μm syringe filter | Thermo Fisher | F2500-3 | |
| Polystyrene tubes | Evergreen | 222-2094-050 | 17 x 100 mm w/cap, 16 ml, polysteryne |
| Octogonal magnetic stir bars | Fisher scientific | 14-513-60 | Magnets encased in PTFE fluoropolymer |
References
- Dismukes, G. C., Carrieri, D., Bennette, N., Ananyev, G. M., Posewitz, M. C. Aquatic phototrophs: efficient alternatives to land-based crops for biofuels. Curr Opin Biotechnol. 19 (3), 235-240 (2008).
- Moody, J. W., McGinty, C. M., Quinn, J. C. Global evaluation of biofuel potential from microalgae. Proceedings of the National Academy of Sciences. 111 (23), 8691-8696 (2014).
- Pinto, E., et al. Heavy metal-induced oxidative stress in algae. J Phycol. 39 (6), 1008-1018 (2003).
- Gupta, A., Lutsenko, S. Evolution of copper transporting ATPases in eukaryotic organisms. Curr Genomics. 13 (2), 124-133 (2012).
- Perales-Vela, H. V., Peña-Castro, J. M., Cañizares-Villanueva, R. O. Heavy metal detoxification in eukaryotic microalgae. Chemosphere. 64 (1), 1-10 (2006).
- Sandau, E., Sandau, P., Pulz, O. Heavy metal sorption by microalgae. Acta Biotechnol. 16 (4), 227-235 (1996).
- Amer, L., Adhikari, B., Pellegrino, J. Technoeconomic analysis of five microalgae-to-biofuels processes of varying complexity. Bioresour Technol. 102 (20), 9350-9359 (2011).
- Benemann, J. R., Goebel, R. P., Weissman, J. C., Augenstein, D. C. Microalgae as a source of liquid fuels. Final Technical Report, US Department of Energy, Office of Research. , (1982).
- Benemann, J. R., Oswald, W. J. Report No. DOE/PC/93204--T5 Other: ON: DE97052880; TRN: TRN. Systems and economic analysis of microalgae ponds for conversion of CO2 to biomass. , (1996).
- Chisti, Y. Biodiesel from microalgae. Biotechnol Adv. 25 (3), 294-306 (2007).
- Davis, R., Aden, A., Pienkos, P. T. Techno-economic analysis of autotrophic microalgae for fuel production. Applied Energy. 88 (10), 3524-3531 (2011).
- Jones, S., et al. Process design and economics for the conversion of algal biomass to hydrocarbons: whole algae hydrothermal liquefaction and upgrading. U.S. Department of Energy Bioenergy Technologies Office. , (2014).
- Lundquist, T. J., Woertz, I. C., Quinn, N. W. T., Benemann, J. R. A realistic technology and engineering assessment of algae biofuel production. Energy Biosciences Institute. , Berkeley, CA. (2010).
- Nagarajan, S., Chou, S. K., Cao, S., Wu, C., Zhou, Z. An updated comprehensive techno-economic analysis of algae biodiesel. Bioresour Technol. 145, 150-156 (2011).
- Pienkos, P. T., Darzins, A. The promise and challenges of microalgal-derived biofuels. Biofuels Bioproducts & Biorefining-Biofpr. 3, 431-440 (2009).
- Richardson, J. W., Johnson, M. D., Outlaw, J. L. Economic comparison of open pond raceways to photo bio-reactors for profitable production of algae for transportation fuels in the Southwest. Algal Research. 1 (1), 93-100 (2012).
- Rogers, J. N., et al. A critical analysis of paddlewheel-driven raceway ponds for algal biofuel production at commercial scales. Algal Research. 4, 76-88 (1016).
- Sun, A., et al. Comparative cost analysis of algal oil production for biofuels. Energy. 36 (8), 5169-5179 (2011).
- Thilakaratne, R., Wright, M. M., Brown, R. C. A techno-economic analysis of microalgae remnant catalytic pyrolysis and upgrading to fuels. Fuel. 128, 104-112 (2014).
- Quinn, J. C., et al. Nannochloropsis production metrics in a scalable outdoor photobioreactor for commercial applications. Bioresour Technol. 117, 164-171 (2012).
- Borkenstein, C., Knoblechner, J., Frühwirth, H., Schagerl, M. Cultivation of Chlorella emersonii with flue gas derived from a cement plant. J Appl Phycol. 23 (1), 131-135 (2010).
- Douskova, I., et al. Simultaneous flue gas bioremediation and reduction of microalgal biomass production costs. Appl Microbiol Biotechnol. 82 (1), 179-185 (2009).
- Israel, A., Gavrieli, J., Glazer, A., Friedlander, M. Utilization of flue gas from a power plant for tank cultivation of the red seaweed Gracilaria cornea. Aquaculture. 249 (1-4), 311-316 (2012).
- Napan, K., Teng, L., Quinn, J. C., Wood, B. Impact of Heavy Metals from Flue Gas Integration with Microalgae Production. , Algal Research. (2015).
- Eaton, A. D., Clesceri, L. S., Rice, E. W., Greenberg, A. E. 3125B. Inductively coupled plasma/mass spectrometry (ICP/MS) method. Standard methods for the examination of water and wastewater. , (2005).
- Eaton, A. D., Clesceri, L. S., Rice, E. W., Greenberg, A. E. Standard methods for the examination of water and wastewater. , APHA-AWWA-WEF. (2005).
- Matrix effects in the ICP-MS analysis of selenium in saline water samples. Smith, M., Compton, J. S. Proceedings of the 2004 Water Institute of Southern Africa Biennial Conference, Cape Town, South Africa, , (2004).
- Mehta, S. K., Gaur, J. P. Use of algae for removing heavy metal ions from wastewater: progress and prospects. Crit Rev Biotechnol. 25 (3), 113-152 (2005).
- EPA, U. Method: 200.8: Determination of trace elements in waters and wastes by inductively coupled plasma - mass spectrometry. , (1994).
- Eaton, A. D., Clesceri, L. S., Rice, E. W., Greenberg, A. E. 3120B. Inductively coupled plasma (ICP) method. Standard methods for the examination of water and wastewater. , (2005).
Tags
Environmental Sciences algen zware metalen,Get cutting-edge science videos from JoVE sent straight to your inbox every month.









