Abstract
再生可能燃料の需要の増加は、微細藻類などの代替原料の実現可能性を調査する研究者を持っています。固有の利点は、高電位収量、廃棄物の流れと非耕地と統合の使用を含みます。大規模な微細藻類の生産システムの栄養要件は、排煙や排水からの栄養分からの二酸化炭素などの産業廃棄物の資源、と栽培システムの結合が必要になります。これらの廃棄物中に存在する無機汚染物質は潜在的にマイナスの生産性に影響を与え、最終用途を制限する微細藻類バイオマスに生物蓄積につながることができます。この研究は、影響の実験的評価とNannochloropsis·サリナの成長の14無機汚染物質(として、カドミウム、コバルト、クロム、銅、水銀、マンガン、ニッケル、Pb、SbおよびSeの、Snを、VおよびZn)の運命に焦点を当てて。微細藻類は、成長mはpH7で984マイクロモルメートル-2秒で照明光バイオリアクターで栽培-1維持しましたEDIA商業石炭排煙システムに見られる組成に基づいて予想されるレベルで無機汚染物質で汚染。バイオマスおよび7日間の成長期間の終了時に培地中に存在する汚染物質は分析的に、水銀のためと同様に、カドミウム、コバルト、クロム、銅、マンガン、ニッケルのための誘導結合プラズマ質量分析法を通して冷蒸気原子吸光分析法を介して定量化しましたPb、SbおよびSeの、錫、VおよびZn。結果はNを示しますサリナは、これらの汚染物質の導入yieldwithバイオマスにおける統計減少した多金属環境に敏感株です。ここで紹介する技術は、藻類の成長を定量化し、無機汚染物質の運命を決定するための適切です。
Introduction
伝統的な地上の作物に比べて微細藻類は、固有の高い太陽光変換効率1,2に起因する高いバイオマスおよび脂質収率を達成することが示されています。高い生産速度での微細藻類の培養は、外部の炭素源を含む様々な栄養素の供給を必要とします。これは、大規模な成長設備は、生産コストを最小限に抑えると同時に、環境の改善を提供するために、このような産業煙道ガスなどの産業廃棄物の流れと統合されることが期待されます。産業廃棄物の炭素は、気体の二酸化炭素の形で、典型的には負微細藻類の生産に影響を与える可能性があり、汚染物質を含有することができます。具体的には、石炭から誘導された煙道ガスは、以下を含む様々な汚染物質を持っているが、燃焼生成物の水と二酸化炭素、ならびに硫黄および窒素、細塵、ダイオキシン類およびフランなどの有機汚染物質の酸化物、及び無機詐欺に限定されるものではありません重金属など汚染物。微細藻類の生産性の重金属として知られているそれらのいくつかと無機物を含むこれらの汚染物質の大部分の影響が検討されていません。これらの要素のいくつかは、しかし、より高い濃度で、それらは細胞機能不全および死3を生成することができ、適切な濃度での栄養素であることができます。
産業煙道ガスと微細藻類の統合直接増殖培地中に無機汚染物質を導入する可能性を有します。石炭ベースの煙道ガスは低に、種々の濃度の無機元素( 例えば、として、カドミウム、コバルト、クロム、銅、水銀、マンガン、ニッケル、Pb、SbおよびSeの、Snを、VおよびZn)の様々なそのうちのいくつかを持っています濃度は、微細藻類の成長のための栄養素を表します。無機汚染物質は、微細藻類に特異的に結合すると、さらに栄養輸送体を介して内部的に吸着され、高い親和性を有します。一部の無機汚染物質( すなわち、コバルト、銅、亜鉛およびMn)が関与する酵素の一部を形成する栄養素であります光合成、呼吸およびその他の機能3,4中のd。しかし、過剰の金属及びメタロイドに毒性であり得ます。このような鉛、カドミウム、錫、Sbを、セレン、As及び水銀のような他の要素は、任意の濃度で細胞機能をサポートし、負培養増殖3,5,6に影響を与える可能性があり、非栄養素の金属を表すことが知られていません。これらの汚染物質のいずれかの存在は、微細藻類の細胞機能に対する負の効果をもたらす可能性を有します。さらに、微細藻類で複数の金属の相互作用は、成長動力学を複雑にし、成長に影響を与える可能性を有します。
大規模な経済学は、直接栽培システム7-19の生産にリンクされています。それは質量の99.9と99.4%で、それぞれ20を表すようにまた、オープン軌道池(ORP)またはフォトバイオリアクターのいずれかのための微細藻類の成長システム(PBR)中の培地のリサイクルは重要です。メディア中の無機汚染物質の存在は、最終的にMが制限される可能性がicroalgaeの生産性とによる汚染物質の蓄積へのメディアの再利用。この研究は、実験的に微細藻類培養システムの統合から期待される濃度で、14無機汚染物質(AS、カドミウム、コバルト、クロム、銅、水銀、マンガン、ニッケル、Pb、SbおよびSeの、錫、VおよびZn)の影響を決定しました石炭は、Nの生産性に、煙道ガスを導出してサリナは空輸PBRSで増殖させました。本研究で用いた汚染物質は、石炭ベースの煙道ガスが、一般廃棄物系の煙道ガス、バイオソリッドベースの煙道ガス、都市下水、生成水、減損地下水や海水21-23に存在しないことが示されています。この研究で使用した濃度は、微細藻類の成長システムは、商用PBRシステム20において実証取り込み効率で石炭ベースのCO 2源と統合された場合に予想されるものに基づいています。重金属や無機汚染物質の濃度を支援する詳細な計算はNapanに提示されていますら 24の分析技術は、バイオマス、メディア環境における金属の大部分の分布を把握するために使用されました。提示される方法は、無機汚染物質のストレスとそのエンド運命の定量化の下で微細藻類の生産能力の評価を可能にしました。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1.成長システム

図1.微細藻類の成長システム。(A)空気ロートメーター、(B)CO 2ロートメーター、ソレノイドと(C)pHコントローラー、(D)データロガー、(E)、インラインエアフィルタ、(F)の空気分配ヘッダ、 (G)蛍光灯バンク、(H)は、pHメーター、(I)は、冷却システム、(J)水浴、(K)熱電対線、(L)エアリフトフォトバイオリアクター、(M)ヒーター、(N)ウォークインヒュームフード(O)ベント、(P)空気送達毛細管、(Q)、エアフィルタ(R)サンプリングチューブ、(S)PBRシリコーン蓋、及び(T)シリコーン蓋のpHウェル。 この図の拡大版を表示するには、こちらをクリックしてください。
- 以下の微細藻類の実験成長システム( 図1)を構築。
- ガラス管反応器の直径4.5センチ、シリコーン蓋と1.1 Lの培養容量の高さ80センチからなる12空輸PBRSを取得します。長さ10cm(PBRあたり3)及び85センチメートル(PBRあたり1)のプレカットガラスキャピラリーチューブ(5ミリメートル、外径1mmの内径)を取得します。
- -80℃の冷凍庫にシリコーン蓋をフリーズします。グリセロールでドリルビットを潤滑し、蓋はpHプローブをホストするためにベント、サンプリングおよびガス配送毛細管、および17ミリメートルの直径の1穴をホストするための3つの穴凍結ドリルされています。
- PBRの底から2センチメートルを延長最長チューブを所定の位置に3キャピラリー管を挿入します。他のキャピラリーチューブにシリコンチューブのwiを追加毛細管番目の所望のサンプリング点まで延びるもう一方の端に取り付けられました。シリコン栓サイズ21DとpHメーター用の穴をカバーしています。
- 水を介してバブリングすることにより、周囲の空気を加湿し、空気分配ヘッダに加湿空気をお届けします。 0.2μmのフィルターを通してガスを通過し、最長のガラス配信毛細管を通じて藻類懸濁液にそれを提供します。
- 培養懸濁液中で7.0±0.1の中性pHを維持するために加湿空気流内に圧縮されたCO 2を配信します。藻類培養物はpHが7.1に到達し、pHは6.9で閉じたときに、磁気ソレノイドを開き、自動化されたCO 2調剤システム(pHコントローラー)とCO 2送達の速度を制御します。
- 984マイクロモルのM -2秒-1屋外条件をピークに類似の平均照度をもたらす24 T5蛍光灯を使用して光を提供します。
- mのために、水浴中でPBRSを浸し約25℃の一定温度にaintain。再循環冷却器および自動加熱循環水浴ユニット制御を使用してシステムの温度を制御します。
- リアルタイムで温度およびpHを監視し、データロガーで記録します。
- 微細藻類の成長システムのすべてのコンポーネントが正しく、特に微細藻類の接種材料を採取するか、それらを保存することができないなどの無機汚染物質を準備する前に、作業していることを確認してください。
2.ラボウェアの準備
- 石鹸で、メスフラスコ、PBRS、カーボイ、任意の容器を洗い、水をタップします。脱イオン水(DW)で洗い流してください。
- 酸は、無機汚染物質の痕跡を除去するために実験器具をすすぎます。これは、2つの方法のいずれかによって行うことができます。
- 息ヒュームは、濃硝酸はヒュームホーに厳しい燃焼や有毒ガス、作品を制作することができません。実験器具のO / N 10%の微量金属グレードの硝酸(注意ソークニトリル手袋、ゴーグルと白衣を使用してD)。
- 50%の微量金属グレードの硝酸で15分間、実験器具を浸します。
- DWで全ての酸が除去されていることを確認すること徹底的に少なくとも3回の実験器具をすすぎます。それは、PBRSが十分に洗浄されていること、特に、サンプリングチューブと毛細管重要です。これを行うに失敗すると、成長の中、可能な阻害の酸性化が生成されます。全ての酸を確認するためにすすぎ水のpHをテストが除去されています。
- 120℃、少なくとも30分間、標準大気圧でそれらをオートクレーブでPBRS、容器やフラスコを滅菌します。
3. N.サリナミディアム準備
- 溶液Aの調製:一部DWで1 Lのメスフラスコを埋めます。磁気攪拌棒を挿入し、他の後に表1 1に示す化学物質を追加します。各成分は、次の成分を添加する前に溶解していることを確認してください。磁石を外し、目を埋めます1 Lの体積マークに電子フラスコ。
| コンポーネント | 追加する量(g) | 最終濃度(G / L) |
| H 3 BO 3 | 0.900 | 0.900 |
| のNa 2のMoO 4·2H 2 O | 0.012 | 0.012 |
| のMnCl 2·4H 2 O | 0.300 | 0.300 |
| のZnSO 4·7H 2 O | 0.060 | 0.060 |
| のCuSO 4·5H 2 O | 0.020 | 0.020 |
表1:ソリューションのレシピ数量は、濃縮液の1リットルの製造に必要な量です。
- ビタミン溶液の調製:3つの別々の体積はumetricフラスコを滅菌容器に無菌0.2μmのシリンジフィルターを通して、表2に示すようにビタミンを追加し、各ビタミン溶液をフィルタリングします。暗闇の中で-4°Cのビタミンを保持します。
| ビタミン | 量(mg)を | 最終体積(mL)を | 最終ビタミン濃度(mg / Lで) |
| ビオチン | 12.22 | 500 | 24.43 |
| ビタミンB12 | 13.50 | 100 | 135.00 |
| チアミン塩酸塩 | 977.63 | 500 | 1,955.27 |
表2:ビタミン溶液レシピ数量が濃縮されたソルの調製に必要な量です。る。
- 部分的にDWで20 Lオートクレーブ容器を満たし、磁気攪拌棒を挿入します。磁気撹拌プレートの上にコンテナを置き、(ビタミン除く)を表3に示す化学物質を追加し、他の後、それぞれが完全に溶解した後、それらを1つずつ追加します。 20 L.に到達するための容器を満たします
| コンポーネント | 量を培地に追加します | ユニット |
| 塩化ナトリウム | 350.00 | G |
| のCaCl 2·2H 2 O | 3.00 | G |
| 塩化カリウム | 9.60 | G |
| のNa 2のSiO 3·9H 2 O | 1.14 | G |
| 硫酸マグネシウム·7H 2 O | 29.60 | G |
| 20.40 | G | |
| KH 2 PO 4 | 1.36 | G |
| 第二鉄アンモニウム、クエン酸 | 0.10 | G |
| 溶液A | 20.00 | ミリリットル |
| ビオチン溶液* | 818.00 | μL |
| ビタミンB12·ソリューション* | 296.20 | μL |
| チアミン塩酸塩溶液* | 521.60 | μL |
| *冷却オートクレーブしたメディアに追加 |
表3:N.サリナ媒体レシピ。数量は、栄養豊富な培地を20 Lの製造に必要な量です。
- 120℃、大気圧下で30分間オートクレーブ処理することにより培地を滅菌します。メディアクーしましょうRTまでL。
- 磁気撹拌プレート上に容器を置きます。ステップ3.2で調製したビタミンを追加して、徹底的にメディアミックスをしましょう。
4.無機汚染物質原料調製
- 部分的にDWと表4に示したメスフラスコを記入し、記載された個々の塩を加えます。必要な最終容量をDWで満たし、十分に混合します。いくつかの要素が壁をフラスコに吸着、これらの株式を保存しません
注意:塩を処理するときに、このプロトコルで使用されるいくつかの無機汚染物質は、発がん性、催奇形性および変異原性、フェイスマスク、手袋、白衣を着用してください。
| 検体 | 塩源 | (L)を調製するための株式の巻 | 塩をフラスコに追加します60; (MG塩) | 検体濃度が培養物に添加濃度(mg検体/ L) |
| として | NaAsO 2 | 0.1 | 14.8 | 7.74E-02 |
| CD | のCdCl 2 | 0.5 | 13.5 | 1.50E-02 |
| 共同 | のCoCl 2·6H 2 O | 0.5 | 34.7 | 1.56E-02 |
| クロム | のNa 2の Cr 2 O 7·2H 2 O | 0.1 | 40.6 | 1.29E-01 |
| 銅 | のCuCl 2·2H 2 O | 0.1 | 38.3 | 1.30E-01 |
| HG | のHgCl 2 | 1.0 14.6 | 9.80E-03 | |
| マンガン | のMnCl 2·4H 2 O | 0.1 | 58.8 | 1.49E-01 |
| ニッケル | のNiCl 2·6H 2 O | 0.1 | 112.0 | 2.51E-01 |
| 鉛 | にPbCl 2 | 0.5 | 39.9 | 5.41E-02 |
| SB | のSb 2 O 3 | 0.5 | 26.7 | 4.06E-02 |
| SE | のNa 2のSeO 3 | 0.5 | 11.8 | 9.80E-03 |
| のSn | のSnCl 2·2H 2 O | 0.5 | 3.9 | 3.76E-03 |
| V | V 2 O 5 | 0.1 | 22.2 | 1.13E-01 |
| 亜鉛 | のZnCl 2 | 0.1 | 99.9 | 4.36E-01 |
表4:1.1 LのPBR媒体にこの濃縮ストックの1ミリリットルの濃縮無機汚染物質の原料調製添加は、最後の列に示した最終濃度を生成します。
- 滅菌0.2μmのシリンジフィルターを通して溶液を通過させることにより、無機汚染物質の在庫を殺菌し、滅菌チューブにろ液を集めます。
5. N.サリナ接種生産
- 500ミリリットルの三角フラスコに、ステップ3で調製した培地200mlを追加し、寒天の3グラムを追加します。 120℃で20分間、アルミホイル、オートクレーブでフラスコをカバー。滅菌ペトリ皿に溶液を注ぎ、それが固化するまでそれが冷まします。これは、無菌フードであるか、または少なくとも汚染の危険性を低減するためのクリーンな環境での火気の近くで完了する必要があります。
- ストリークN.滅菌ペトリDISでサリナ細胞HESは、無菌播種ループを使用して、ステップ5.1で調製しました。 RTで維持T12ライトで照らされ、テーブルの上にペトリ皿の文化を置きます。コロニーが表示されるまで微細藻類が成長しましょう。
- ステップ3で調製した栄養豊富な培地200mlを含むバッフル付三角フラスコを無菌で照らさシェーカーテーブル(千RPM)でそれらを保つために転送コロニー。媒体が緑色になるまで培養は成長しましょう。
- 1.1 L無菌PBRに微細藻類を転送します。 200マイクロモルのM -2秒-1 T8蛍光灯とで照明され、再循環冷却器および自動加熱循環水浴制御により23℃に維持接種水浴中でPBRを配置します。 2.5 Lの分-1とそれぞれ-1、分25 ccの空気とCO 2 rotometersを調整します。
- 新しい培地を含む新しい1.1 LのPBRSに成長スプリットバイオマスの一週間後とバイオマス乾燥重量の少なくとも28グラムの合計があるまで、成長させ光学密度により決定することができる2つの反応器の間に得られます。
- 汚染を避けるために、滅菌遠心ボトル無菌技術を使用して10℃で15分間2054×gで遠心分離することにより接種バイオマスを収穫。上清を処分し、必要に応じて細胞濃度を続けます。
- 一旦全てのバイオマスを遠心分離し、新鮮な滅菌培地300ml中に細胞を再懸濁します。
- DW 3mlに微細藻類の培養0.1ミリリットルを希釈した後、DW 3mlに、この新しい溶液0.1mlを希釈。サンプルは完全に混合であることを確認してください。 750 nmの微細藻類の濃縮物の光学密度(OD)を測定()直ちに分光光度計を使用して。
- 濃縮液にバイオマスの量を決定するために、式(1)を使用します。
注:式(1)から(g / L -1)総懸濁固形物N.ための対の間の線形回帰から得ました。 サリナ (R 2 = 0.9995)。式1は、SPECTRのために開発されました材料表中のモデルophotometer、他の分光光度計モデルを使用する場合は、新しいキャリブレーションを生成します。- 式を使用して、(2)(L)に微細藻類の濃縮物の体積を計算する(L)にPBR 1.1 Lの体積の4 G / L -1培養密度を得るために必要。
- 無菌技術を用いて、微細藻類の量を追加する4グラム/ L -1の初期の培養密度に到達するためにオートクレーブPBRにステップ5.9で見つけ集中します。 1.1 Lに培地でPBRを埋める6 PBRSが接種されるまで、この手順を繰り返します。接種水浴中PBRSを配置します。
- PBRSにおける微細藻類は、8日間成長させ、その後、(繰り返しのステップ5.6から5.7による)バイオマスを収穫。初期を計算するための手順を繰り返し5.81グラム/ L -1の初期培養密度のための接種量。
6.実験炉
- 無菌技術を使用すると、12酸リンス滅菌PBRSのそれぞれに対して、ステップ3で調製した培地を約1 Lを追加します。実験的成長システムの水浴中でPBRSを配置します。 1.5 Lの分での散布空気を回し-1。
- 70%エタノールでそれを洗浄することによって、較正されたpHメーターを滅菌します。 PBRでの培地のpHを測定し、pHは約7.0であることを確認してください。ない場合は、リンス工程酸から浸出酸を除去するために、ステップ2を繰り返します。
- エタノール(70%)を使用して、プローブを消毒した後、PBRSの蓋にそれらを挿入、緩衝液pH 7を使用して、各pHコントローラを調整。
- (制御PBRSを除く)各PBRに汚染物質が完全にPBRに混ぜてみましょう手順4で製造した無菌の無機汚染物質の株式の各1ミリリットルを追加します。 PBRS中の無機汚染物質の最終濃度は、ショーですnは表4の最後の列に、石炭火力発電所の統合から推定最大濃度を期待されています。
- 制御PBRSに滅菌DWの14ミリリットルを追加します。
- を1g / L -1の初期培養密度を得るために、実験的にPBRSステップ5.11で得られた濃縮された微細藻類の接種材料を追加します。バイオマス混合物を徹底的にしてみましょう。
- 高い光強度の光(984マイクロモルM -2秒-1)とのpH調整剤を回して、30のcc分1にCO 2を調整します。 50のcc分のCO 2の流れ-1、その後3日目からを増やします。初期の低CO 2流量が原因で気体/液体転送およびpH測定の遅れにpHの大きな変化を避けるために重要です。
- 測定し、必要に応じてサンプルを取ります。サンプリング後の水位をマークすることを確認します。 (注意:PBRの一部の無機汚染物質は、発がん性、催奇形性および変異原性であり、手袋、CAPPを使用サンプルを取り扱う際に)容器を編。
- 蒸発による損失を補償するためにPBRSに毎日滅菌DWを追加します。
- 成長の7日後、9936×gの遠心分離によりバイオマスを収穫し、-80℃で、両方、バイオマス、上清培地を維持します。
- CO / N°0.1ミリバールでバイオマスを乾燥凍結し、-50。粉末バイオマス(遠心管の内部に粉末バイオマスにヘラを使用します)。 -80℃で凍結乾燥したバイオマスを保持します。
サンプルの消化支援7.電子レンジ
バイオマス試料の消化は、ICP-MS分析のための前処理工程として必要とされます。
注:これらの手順は、制御された圧力リリーフで密閉容器のマイクロ波分解システムを使用しています。 (注意:高圧力は、酸消化中に開発消化容器と盾の物理的な整合性を検査し、すべての使用前にマイクロ波分解容器の蓋の形を変えます)。
- 石鹸と水で洗浄テフロンマイクロ波分解容器、DWでリンスし、船の空気乾燥をしましょう。次の手順で説明するように、血管中の微量金属汚染を除去するには、酸を消化します。
- マイクロ波消化槽の蓋を再形成し、しっかりバイアルを閉じます。
- それぞれに硝酸10mlのを追加します。
- 安全シールドで容器をご紹介します。何バイオマス、水や試薬が安全シールドへのダメージを避けるために、安全シールドの壁に、または消化管の外壁に残っていないことを確認してください。安全弁は、バイアル中のスプリングが同一平面であることを確認することで、安全シールドキャップ。キャップ通気口が外側の列にし、内側に内側の列に外向きでロータにシールドを探します。
- 容器番号1に、セラミックサーモウェルおよび温度センサを挿入します。この温度計は、バイアル内の実際の内部温度を監視し、消化PROGRを実行するための制御パラメータとなります午前。バイアル数、一方が他方のバイアルと同様のサンプルおよび試薬の量が含まれていることを確認してください。
- 入力消化パラメータを表5に示し、消化を開始します。プログラムが終了したとき、彼らはRTに到達するまで、空気がバイアルを冷却します。
| ステップ | すすぎバイアル | サンプル消化 | ||||
| 温度(°C) | 時間(分) | マックス。電力(W) | 温度(°C) | 時間(分) | マックス。電力(W) | |
| 1 | 190 RT | 25 | 千 | 180 RT | 15 | 千 |
| 2 | 190 | 10 | 千 | 180 | 15 | 千 |
| - | 20 | - | - | 20 | - |
表5:マイクロ波分解プログラムで使用されるパラメータ。
- ヒュームフードの内側には、通気孔があなたから離れてポイントキャップをシールドキャップの圧力逃がしツールを挿入します。 (:酸を用いたバイオマス消化が有毒ガスを発生するので、ヒュームフードの内側は、必ずオープンに消化バイアル注意)圧力が解放されると、キャップを開きます。
- 酸の処分。 DWとテフロン容器を3回すすいでください。空気乾燥バイアルましょう。
- バイオマスを消化するために、マイクロ波分解容器に凍結乾燥したバイオマス50mgを追加します。品質管理(QC)は、次のバイアルの準備のために:追加する二つの異なるバイアル中のいずれかのレベル7 ICPMSの5ミリリットルまたはステップ9.1と、このバイアルから10.1(消化液中で調製したレベル7のHg CVAAS標準の5mlを強化した実験室と呼ばれ、 )(LFB)ブランク、空の別のバイアル(消化ソリューションを残しますこのバイアルから実験用試薬と呼ばれるブランク(LRB))。
- 培地を消化するために、酸リンスマイクロ波消化槽を乾燥させるために10ミリリットルに上清培地を追加します。品質管理(QC)は、次のバイアルを準備するための2つの異なるバイアルに10を追加し、別のバイアルにステップ9.1および10.1(LFBと呼ばれるこのバイアルから消化液)で調製したレベル7 ICPMSまたはCVAAS金属標準、5mlのを追加DWのミリリットル(このバイアルから消化液をLRBと呼ばれています)。
- マイクロ波消化槽の蓋を再形成し、しっかりバイアルを閉じます。
- 各バイアルに濃縮された微量金属グレードの硝酸と3ミリリットル過酸化水素の7ミリリットルを追加します。溶液を穏やかに旋回してコンテンツを均一化。 (表5のサンプル消化のためにマイクロ波分解パラメータを使用)7.7へのステップ7.4を繰り返して、バイアルの内容物を消化。
- 増加した回復のためDWで血管をすすぎ、25ミリリットルのメスフラスコに消化されたサンプルを追加します。 DWでメスフラスコを埋めますマークに。
- 転送は、蓋付容器にサンプルを消化しました。分析が完了することができるまで4℃でサンプルを保持します。本研究の分析のために水銀のために、その他の要素のための3日以内に、同じ日に行われます。
8.品質管理(QC)サンプル
注:実験試料から得られた結果の信頼性を確保するために、QCサンプルを分析します。
- 部分的にDWで1 Lのメスフラスコリンス酸を埋めます。濃縮された微量金属グレードの硝酸の280ミリリットルを加え、十分に混合する(このソリューションはまた、ブランク溶液と呼ばれている)(注意:常に発熱反応が暴力的であることができるような酸に水を加え、水に酸を決して追加しません)。室温に冷却ソリューションをしてみましょう。
- ステップ7.9および7.10で製造したQCサンプルに加えて、以下のQCサンプルを準備します。
- 継続的なキャリブレーションの確認(CCV)の場合:を参照してください。準備のためのキャリブレーション標準とポリスチレンチューブを(記入ステップ9.2及び10.1)。 CVAASラックとICPMSオートサンプラーでICPMS標準溶液に水銀標準溶液を入れてください。
- 継続的なキャリブレーションブランク(CCB)の場合:空白(ステップ8.1で調製した溶液)を持つ2つのポリスチレンチューブ(16ミリリットル)を入力します。 CVAASラックとICPMSオートサンプラー内の他の試料中の1サンプルを置きます。
- ランダムサンプルの各タイプごとに12個のサンプルの1サンプル( すなわち、バイオマスまたは媒体)を選択し、LFMを準備するためにそれを使用する:実験室を強化したマトリックス(LFM)のため。 ICPMSは、ポリスチレンチューブに(バイオマスまたはメディアのいずれかから)消化実験サンプルのICPMS標準レベル7と3ミリリットルの0.5ミリリットルを追加します。
- 内容物を混合し、ICPMSオートサンプラーにバイアルを置きます。 CVAASについては、ポリスチレンチューブに(バイオマスまたはメディアのいずれかから)消化実験サンプル2mlの水銀標準レベル7と6ミリリットルを追加します。 CVAASラック上のコンテンツと場所バイアルを混ぜます。
- 重複したサンプルの場合:ランダム、これまでの1サンプルを選択Yマトリックスの種類ごとに12サンプル( 例えば、バイオマス、培地、LFMまたは任意の希釈マトリックス)、バイアルを複製します。 ICPMSオートサンプラまたはCVAASラックに繰り返さバイアルを置きます。
- 重複したサンプルの場合:ランダム行列( 例えば、バイオマス、培地、LFMまたは任意の希釈マトリックス)の各タイプごとに12個のサンプルの1サンプルを選択し、バイアルを複製します。 ICPMSオートサンプラまたはCVAASラックに繰り返さバイアルを置きます。
- 研究のためのデータ品質基準を定義します。本研究のためにイートン、Clesceri、ライスとグリーンバーグ25によって確立された品質基準を複製します。 QCのために確立されたパラメータは次のとおりです:±10%、25±70から130パーセント25内に、LFBの回収率(%のR)(鉛及びSb、説明を参照してくださいを除く)、LFMパーセント以内のCCVのパーセント差(%のD)百分の75から125まで25内の回収率(%R)、および相対的なパーセント差(RPD)±20%25内、および継続的なCAメソッドの報告限界(MRL)25以下(CCB)空白秤動。ステップ9.7で計算式を参照してください。
誘導結合プラズマ質量分析法による定量9.(ICPMS)
- 分析の日に、ポリスチレンチューブに消化されたサンプルの約5ミリリットルを転送し、ICPMSオートサンプラーに配置します。ポリスチレンチューブに消化された試料の約15ミリリットルを追加し、CVAASラックに配置します。
- 分析の同じ日には、キャリブレーション標準を準備します。購入ICPMSに標準液を追加し、 表6に記載したように、ブランク(ステップ8.1で調製した溶液)で補充酸リンスメスフラスコに( 材料表中の標準溶液の説明を参照してください)。
| パラメーター | レベル1 | レベル2 | レベル3 | レベル4 | レベル5 | レベル6 | レベル7 |
| 購入標準を添加する(ミリリットル) | - | - | - | - | - | - | 10.0 |
| 追加されるレベル7(ミリリットル) | 0.0 | 1.0 | 2.5 | 5.0 | 20.0 | 25.0 | - |
| 最終容量*(ミリリットル) | - | 50.0 | 50.0 | 50.0 | 100.0 | 50.0 | 100.0 |
| 最終濃度(μg/ Lが) | |||||||
| 75として、 | 0.0 | 2.0 | 5.0 | 10.0 | 20.0 | 50.0 | 100.0 |
| 111カドミウム | 0.0 | 1.0 | 2.5 | 5.0 | 10.0 | 25.0 | 50.0 |
| 59共同 | 0.0 | 10.0 | 25.0 | 50.0 | 100.0 | 250.0 | 500.0 |
| 52のCr | 0.0 | 2.0 | 5.0 | 10.0 | 20.0 | 50.0 | 100.0 |
| 63銅 | 0.0 | 5.0 | 12.5 | 25.0 | 50.0 | 125.0 | 250.0 |
| 55のMn | 0.0 | 3.0 | 7.5 | 15.0 | 30.0 | 75.0 | 150.0 |
| 60ニッケル | 0.0 | 8.0 | 20.0 | 40.0 | 80.0 | 200.0 | 400.0 |
| 208鉛 | 0.0 | 1.0 | 2.5 | 5.0 | 10.0 | 25.0 | 50.0 |
| 121のSb | 0.0 | 12.0 | 30.0 | 60.0 | 120.0 | 300.0 | 600.0 |
| 51 V | 0.0 | 10.0 | 25.0 | 50.0 | 100.0 | 250.0 | 500.0 |
| 66のZn | 4.0 | 10.0 | 20.0 | 40.0 | 100.0 | 200.0 | |
| *ステップ8.1で調製した溶液を添加することによって、このボリュームを実現 | |||||||
表6:キャリブレーション標準の濃度レベル1〜7。
- ICPMSからコーンを取り外し、DWで1分のためにそれらを超音波処理します。コーンを乾燥させ、機器にそれらを戻します。
- 水チラーの電源をオンにし、ガス(アルゴン、H 2、He)の、ICPMS、内部標準プラグライン、およびオートサンプラーリンスの容器を埋める(DW、10%硝酸を、1%の硝酸+ 0.5%塩酸) 。
- MassHunterワークステーションソフトウェアを開き、プラズマをオンにし、曲ICPMSを、表7のパラメータに設定する方法をロードします。
| パラメータ 価値観 | |||||||||
| 内部標準 | 72のGe、115で | ||||||||
| RF電力 | 1,500 W | ||||||||
| プラズマガス流量 | 14.98 | ||||||||
| ネブライザーガス流量 | 1.1リットル/分(キャリアおよび希釈ガスを組み合わせ - 0.6 + 0.5 L /分) | ||||||||
| サンプリングコーン | Xレンズ用のニッケル | ||||||||
| スキマーコーン | ニッケル | ||||||||
| サンプル取り込み速度 | 0.3 RPS | ||||||||
| 噴霧器ポンプ | 0.1 RPS | ||||||||
| S / Cの温度 | 2°C | ||||||||
| スキャン条件 | 時間を1秒、複製3の数をドウェル | ||||||||
| H 2ガス流量 | N / A | ||||||||
| Heガス流 | 4.3ミリリットル/分 | ||||||||
| パラメーター | レベル1 | レベル2 | レベル3 | レベル4 | レベル5 | レベル6 |
| 追加するL7水銀標準(ミリリットル) | 0 | 1 | 2.5 | 5 | 20 | 25 |
| 最終容量*(ミリリットル) | - | 50 | 50 | 50 | 100 | 50 |
| 最終濃度(μg/ Lが) | 0 | 0.5 | 1.25 | 2.5 | 5 | 12.5 |
| *ステップ8.1で調製した溶液を添加することによって、このボリュームを実現 | ||||||
表8:水銀校正標準の濃度 6をレベル1。
- Arガスと空気バルブを開け、原子Absorpをオンン分光光度計およびフローインジェクション原子吸光分析(FIAS)。 、CVAAS Winlabソフトウェアを開き、Hgランプをオンにしてソフトウェアのエネルギーパラメータは、 表9のパラメータを使用して79ロード水銀分析のためのプログラムに到達するまで、それがウォームアップしてみましょう。最大透過率を与えるために、機器内の光路を調整します。
| パラメータ | 価値観 |
| キャリアガス | アルゴンを、100ml /分 |
| ランプ | 水銀無電極放電ランプ、185ミリアンペア時のセットアップ |
| 波長 | 253.7 nmの |
| スリット | 0.7ナノメートル |
| 電池温度 | 100°C |
| 試料容量 | 500μlの |
| キャリア | 3%のHCl、9.23ミリリットル/分 |
| 還元剤 | 10%のSnCl 2、5.31ミリリットル/分 |
| 測定 | ピーク高さ |
| 複製を読みます | 3 |
表9:CVAAS運転条件。
- 3%の微量金属グレードの塩酸からなるキャリア液にラインを接続します。
- 3%の微量金属グレードの塩酸中(水銀分析に適した)10%塩化第一スズで作られた還元剤溶液に線を接続します。それは大気酸化する傾向があるように、このソリューションを分析の同じ日を準備し(注意:塩化第一スズは非常に危険で、それを操作するときの保護服を使用し、危険な封じ込めにCVAAS廃棄物を収集し、適切に廃棄してください。)。
- CVAAS WinlabソフトウェアのCVAASラックおよび入力シーケンス内の水銀標準、QC試料と実験試料を配置します。基準を実行し、校正式を生成します。
- ファイル名を指定して実行QC SAMplesと実験サンプル。 CVAASは、機器に試料約5ミリリットルを描画要素のHg(水銀0)ガスに、試料中のHgの存在を減少させ、閉鎖系におけるキャリアガス(Ar)を含む溶液からガスをパージします。水銀蒸気が水銀ランプの光路内のセルを通過します。検出器は253.7 nmで吸収した光を決定し、濃度に相関します。 (注意:水銀蒸気は有毒である、機器の排気フードが所定の位置にあることを確認してください)。
- 分析中のステップ9.7の%R、%DとRPDを計算し、プロジェクトデータの品質基準に結果を比較します。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
バイオマス収量
Nの生産この研究のために使用されるPBR方式でサリナ 8.5±0.19グラム/ Lには1g / L -1の成長-1(N = 12)対照反応器および4.0±0.3グラム/ L -1(N = 12)多金属7日間で汚染。実験は三連の反応器及び複数のバッチ全体で再現可能データを生成した。 図2(a)は、3つの独立したPBRSからのサンプリングに基づいて、非常に小さな標準誤差の平均培養密度を示しています。この結果は、単離された結果ではなかった確実にするために、3つのバッチを同様の結果で成長させました。すべての4つのバッチのために組み合わせた結果を図2Bに示されています。生物学的変動が存在するが、本研究ではNに無機汚染物質の一貫性のマイナスの影響があることを示していますサリナ生産 。汚染物質曝露さPBRSにおけるバイオマス収量はからの制御PBRSと統計的に差がありました2日目以降(ANOVA、P <0.05)。
無機汚染物質の定量化の品質管理アセスメント
何の損失、無利益および消化( 表10)中の分析物のない交差汚染がないことを示し、100%近く%RのLFBの%Rで示すように分析14要素の十二は、完全消化後に回収可能でした。サンプル%のD及びRPDの定量分析の間、すべての分析によってモニターし、その結果の平均値を表10に示す。ように、カドミウム、コバルト、クロム、銅、水銀、マンガン、ニッケル、鉛、Sbを、VおよびZn合格Pb及びSbのためしかし、%Dの%DとRPDは、次第に解析中に低下しました。これらの要素の%Dは、コーン洗浄後に改善されているが、一定のコーン洗浄は非現実的であるため、Pb及びSbのためのデータの品質目標が低下しました。すべての検体に対するCCBはMRLの下にもありました。マトリクス効果は、LFMのサンプルを分析し、%Rを求めることにより評価しました。 While株式会社、水銀、VおよびSbはQCデータ基準に合格した消化バイオマス試料を分析したときには、QCの目的%以下のRの結果として、カドミウム、クロム、銅、マンガン、ニッケル、鉛と亜鉛によって渡されませんでした。 3(溶質:溶媒)1の比DWにおけるマトリックスの希釈は、データの品質基準に合格%のRが得られました。マトリクス効果は消化上清の分析中に観察され、希釈器の検出限界を損なわなかった確認して、同じ希釈率( 表10)によって対処しました。 Se及びSnを検出の問題は、それぞれ不安定な測定値および汚染の問題に基づいて、観察されました。 SEの不安定な測定値は、マトリックス27中の塩に起因します。のSn汚染を消化ステップで使用される酸に遡るました。
| 検体 | R | CCV | LFB | バイオマスサンプルのLFM | 上清サンプルのLFM | ||||
| %D | %のR | 希釈率 | %のR | RPD | 希釈率 | %のR | RPD | ||
| QCは、25を制限します | 0.9950 | ±10 | 70〜130 | - | 75〜125 | ±20 | - | 75〜125 | ±20 |
| として | 0.9998 | 1.8 | 101.0 | 1:3 | 100.4 | 5.2 | 1:3 | 92.5 | -0.5 |
| CD | 10000 | 1.4 | 102.6 | 1:3 | 103.5 | 4.6 | なし | 92.3 | 0.6 |
| 共同 | 0.9997 | 1.7 | 98.8 | なし | 95.2 | -1.4 | なし | 96.5 | -1.5 |
| クロム | 0.9999 | 1.5 | 99.8 | 1:3 | 96.5 | 1.8 | 1:3 | 90.1 | -0.8 |
| 銅 | 0.9999 | 2.9 | 98.2 | 1:3 | 101.4 | 4.8 | 1:3 | 94.4 | -0.5 |
| HG | 0.9983 | -1.7 | 103.0 | なし | 98.7 | 1.5 | なし | 98.0 | 0.3 |
| マンガン | 0.9998 | 2.9 | 97.6 | 1:3 | 83.2 | 1.8 | 1:3 | 95.4 | -1.7 |
| ニッケル | 0.9999 | 103.5 | 1:3 | 98.5 | 2.1 | なし | 93.3 | -0.9 | |
| V | 0.9998 | 2.5 | 97.2 | なし | 95.5 | -1.5 | なし | 101.2 | -1.9 |
| 鉛 | 0.9998 | 12.6 | 105.2 | 1:3 | 88.9 | 0.0 | なし | 93.5 | -0.5 |
| SB | 0.9998 | 1.1 | 105.7 | なし | 101.8 | -9.6 | なし | 90.8 | -1.2 |
| 亜鉛 | 0.9997 | 5.2 | 120.8 | 1:3 | 90.7 | 1.4 | なし | 89.2 | -1.9 |
表10:品質管理サンプルの結果のまとめ 。 R =共同rrelation係数は、%D:パーセント差は、%R:回収率、RPD =相対パーセント差は、希釈率は、溶質を指す:溶媒の比率を。
無機汚染物質濃度
重金属及び無機汚染物質は、バイオマス、上清培地の両方で発見されました。分析12の要素にバイオマスに見られる濃度は、 図3に示されている。三重PBRSから採取したバイオマス中の濃度(N = 3)、バッチ#1に非常に小さな標準誤差( 図3A)を示します。 4バッチから三重PBRSからのデータを組み合わせることにより、一貫して、無機汚染物質は、バイオマス(N = 12)の中に存在することを示しています。上清培地中に見出さ濃度は、図4に示す。結果は、三重PBRS(N = 3)、バッチ#1も小さい標準誤差( 図4A)を有し、ほとんどの汚染物質を優先バイオマスLに位置していたことを示す表示します楽器のMRLに近いいくつかのサンプル濃度で上清中に非常に低い濃度をeading。すべての4つのバッチの結果は、図4Bに示されています。
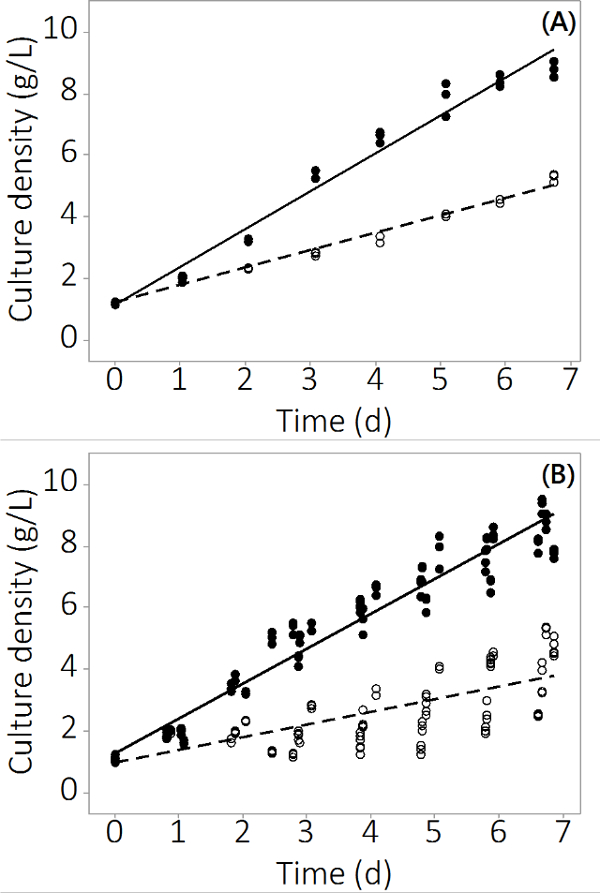
図2。汚染されたと制御PBRSのための培養期間にわたってC ulture濃度。バッチ#1(A)培養密度、N = 3 PBRSからの結果。 4バッチで(B)培養密度は、Nからの結果は、12 PBRSを=。白丸は、バイオマスを汚染し、黒丸はコントロールを表す表現します。
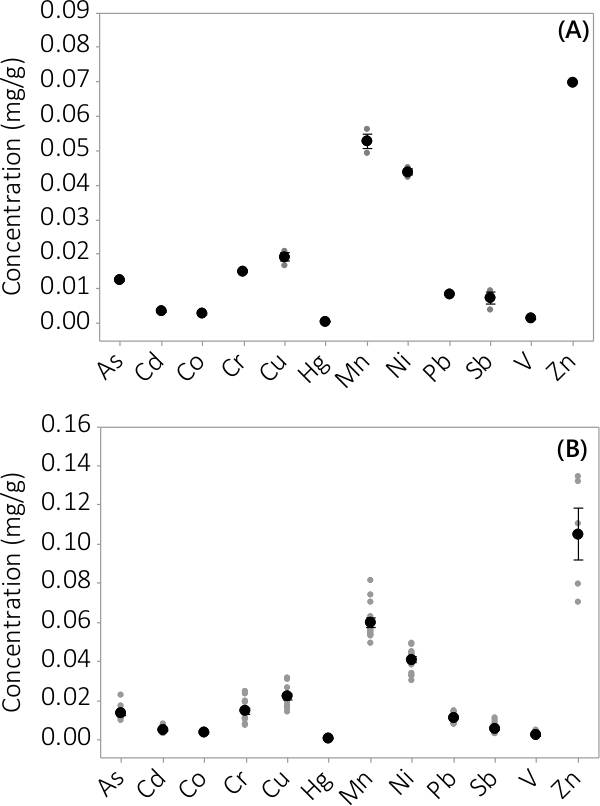
バイオマス中の無機汚染物質の濃度を図3(A)バッチ#での濃縮1、N = 1からPBR ZnおよびN =他のすべての検体のための3 PBRSの結果、4バッチから(B)濃度、N = 4のZn用PBRS及びN =他のすべての検体のための12 PBRSの結果。平均濃度は黒黒丸で表され、個々のデータポイントは灰色の黒丸で表されています。エラーバーは平均値から±1標準誤差を表します。
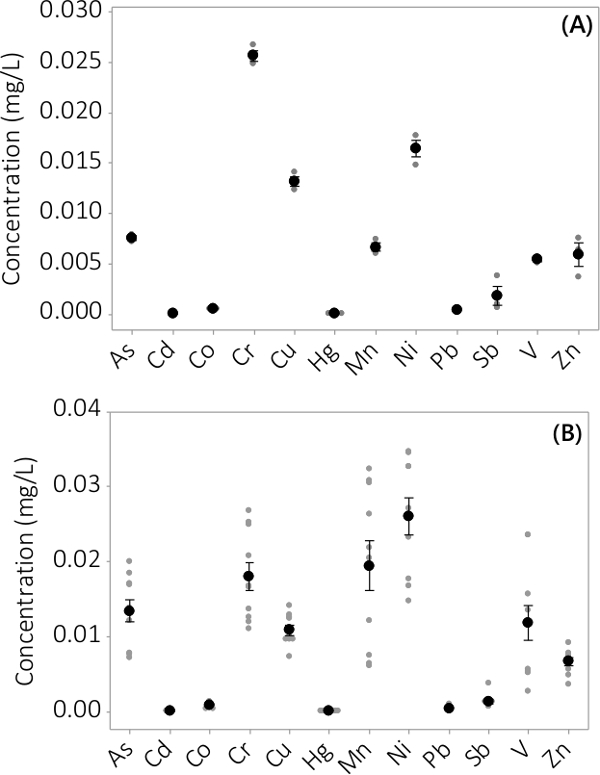
上清中の無機汚染物質の濃度を図4。バッチ#1(A)の濃度、N = 3 PBRS、4バッチから(B)の濃度、N = 12 PBRSの結果から生じます。平均濃度は黒黒丸で表され、個々のデータポイントは灰色の黒丸で表されています。エラーバーは平均値から±1標準誤差を表します。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
生理食塩水の微細藻類のN.サリナが正常に再現性のある結果と高いバイオマス収率で設計された成長システムに成長させることができます。空輸は、7日間の成長期間にわたって最小の沈降または生物付着とよく混合懸濁培養のために許可された混合します。蛍光灯バンク全体で最小の光の変動も成長に顕著な差が生じていないことが示されています。
研究では、石炭の煙道ガス悪影響を与えるバイオマス成長との統合の濃度の代表で重金属汚染のメディアを示しています。研究における再現性は多金属システムは生産性に与える影響を強調しています。プロセスの様々な段階にマイナス成長に影響を与え、勤勉な実験の準備を必要とするシステムを汚染する可能性があります。実験を開始する前に、培地のpHの決意は、媒体が酸性化されていないことを確認( 例えば、RESUを可能にQC工程であります酸浸漬後のリンス不適切PBR)からlting。酸性化した培地は、栄養生物学的利用能を藻類の成長に影響を及ぼし、変更されます( 例えば、無機炭素の分化や金属分化の変化)、従って藻類結合部位、栄養素と金属の間の相互作用に影響を与えます。これらの研究のための実験装置の細心の準備が導入された金属の正確な質量バランスを行うことができるように必要とされました。プロセスの他のステップは、適切なグレードの溶媒および化学物質の使用の必要性を強調金属行方不明導入する可能性を秘めています。プロセスを通じて適切なQCを効果的に重金属汚染物質の導入を識別することができます。
結果は、導入された汚染物質は、バイオマス( 図3)、メディア( 図4)と環境との間に分布している示しています。収穫N.で見つかった無機汚染物質サリナは、この微細藻類がincorporatますことを示唆しています煙道ガス中に存在する無機汚染物質の複数の電子。この同化が原因の荷電結合部位、吸収セル内による代謝活性にし、媒体28中に存在する元素で形成された複合体の沈殿に細胞壁への吸着の結果であり得ます。数日後、無機汚染物質と視覚的に反応器は、制御原子炉の濃い緑色に比べて色が黄色に見えました。汚染された収穫したバイオマスは、遠心分離により収穫した後、ペレットを形成した後、汚染物質を含まないバイオマスから視覚的に異なっていませんでした。収穫前の視覚的な色の違いは、より低密度のバイオマスに起因し、微細藻類を強調されています。 図4に示すように、バイオマス中に除去されない汚染物質が培地中に蓄積する可能性があります。メディアでの蓄積は、メディアのリサイクルは経済性のために必要であることを示すように規模を制限する可能性を表しています。制限が指示されることになります特定の種になる重金属汚染物質への耐性による。この研究の結果は、より良い廃棄物の炭素源と微細藻類の成長システムを統合する上での潜在的な負の影響を理解する必要があり、具体的には、石炭ベースの煙道ガスをハイライトします。この研究の結果は、硫黄や窒素の酸化物、細塵、及びそのようなポリ塩化ジベンゾダイオキシン類およびジベンゾフランなどの有機汚染物質として、煙道ガス中に存在することが予想される他の汚染物質の生産性への影響を理解することの必要性を強調表示します。前TEAとLCA評価では、このような生産性の重金属や無機汚染物質などの汚染物質の影響を考慮することなく、シームレスな統合を前提としています。一般に、この研究の結果は、生産上の多金属系の影響を強調し、汚染物質を生物学的に改善するために微細藻類の電位を理解するために使用することができます。
方法論は目に許さ提示さ微細藻類のための再現性のある結果と無機汚染物質の電子研究。この実験で使用されるいくつかの無機汚染物質は、伝統的に低濃度で成長システムに見ているが、他は、細胞内の既知の機能を持っていません。その結果、 表4に抑制成長に示す濃度のように、カドミウム、コバルト、クロム、銅、水銀、マンガン、ニッケル、Pb、SbおよびSeの、Snを、VおよびZnの多元素混合物。バイオマス中の汚染物質の量を定量すると、多金属系における困難な証明することができます。多くの場合、有機物と塩の高い内容のサンプルは、最終的に不正確な読み取りと分析精度29,30の損失につながるコーンに構築マトリックス干渉、多原子イオン干渉、物理的な干渉と塩を生成することができます。品質管理サンプルは、測定値の正確さと精度を決定するために助けた実験サンプルと一緒に実行します。この研究のために開発されたプロトコルを使用して、分析物の測定であることが示されています研究25,29のこのタイプのための許容できる性能の範囲内にある許容可能な回収率を生産ccurateかつ正確。電子レンジによる試料の消化は、Nのために有効であることが示されました消化し た試料としてサリナは、細胞破片または非混和性部分のない存在に透明でした。この実験で使用したマトリックス(藻類バイオマスおよび人工海水)は、行列の希釈によって克服されたマトリックス干渉を生じました。しかし、この実験で使用したものよりも高いバイオマスサンプルサイズは、マトリックス干渉につながるので、QCは、それぞれの特定のシナリオのために分析されるべきです。
Subscription Required. Please recommend JoVE to your librarian.
Materials
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Sodium chloride | Fisher Scientific | S271-3 | |
| Calcium chloride dihydrate | Fisher Scientific | C79-500 | |
| Potassium chloride | Fisher Scientific | P217-500 | |
| Sodium meta silicate nonahydrate | Fisher Scientific | S408-500 | |
| Magnesium sulfate heptahydrate | Fisher Scientific | M63-500 | |
| Potassium nitrate | EMD Chemical | PX1520-5 | |
| Potassium phosphate monobasic | Fisher Scientific | P285-500 | |
| Ammonium ferric citrate | Fisher Scientific | I72-500 | |
| Boric acid | Fisher Scientific | A73-500 | |
| Sodium molybdate, dihydrate | EMD Chemical | SX0650-2 | |
| Manganese chloride tetrahydrate | Fisher Scientific | M87-500 | |
| Zinc sulfate heptahydrate | Fisher Scientific | Z68-500 | |
| Cupric sulfate pentahydrate | Fisher Scientific | C489-500 | |
| Biotin | Acros Organics | 230090010 | |
| Thiamine | Acros Organics | 148990100 | |
| Vitamin B12 | Acros Organics | 405920010 | |
| Copper (II) chloride dihydrate | Sigma-Aldrich | 221783-100G | Irritant, Dangerous to the Environment |
| Lead (II) chloride | Sigma-Aldrich | 268690-250G | Toxic, Dangerous to the Environment |
| Sodium dichromate dihydrate | Sigma-Aldrich | 398063-100G | Oxidizing, Highly Toxic, Dangerous to the Environment |
| Cobalt (II) chloride hexahydrate | Sigma-Aldrich | 255599-100G | Toxic, Dangerous to the Environment |
| Nickel (II) chloride hexahydrate | Sigma-Aldrich | 223387-500G | Toxic, Dangerous to the Environment |
| Sodium (meta) arsenite | Sigma-Aldrich | 71287 | Toxic, Dangerous to the Environment |
| Cadmium chloride | Sigma-Aldrich | 202908-10G | Highly Toxic, Dangerous to the Environment |
| Mercury (II) chloride | Sigma-Aldrich | 215465-100G | Toxic, Dangerous to the Environment |
| Tin (II) chloride dihydrate | Fisher Scientific | T142-500 | Corrosive. Suitable for Hg analysis. Very hazardous. |
| Manganese chloride tetrahydrate | Fisher Scientific | M87-500 | |
| Vanadium (V) oxide | Acros Organics | 206422500 | Dangerous to the Environment |
| Carbon dioxide | Air Liquide | I2301S-1 | Compressed |
| Hydrogen peroxide | H325-500 | Fisher Scientific | 30% in water |
| ICP-MS standard | ICP-MS-6020 | High Purity Standards | |
| Mercury standard | CGHG1-1 | Inorganic Ventures | 1000±6 µg/mL in 5% nitric acid |
| Argon | Air Liquide | Compressed | |
| Helium | Air Liquide | Compressed, ultra high purity | |
| Hydrogen | Air Liquide | Compressed, ultra high purity | |
| Nitric acid | Fisher Scientific | A509-P212 | 67-70% nitric acid, trace metal grade. Caution: manipulate under fume hood. |
| Hydrochloric acid | Fisher Scientific | A508-P212 | 35% hydrochloric acid, trace metal grade. Caution: manipulate under fume hood. |
| Equipment | |||
| Scientific prevacuum sterilizer | Steris | 31626A | SV-120 |
| Centrifuge | Thermo Fisher | 46910 | RC-6 Plus |
| Spectrophotometer | Shimadzu | 1867 | UV-1800 |
| pH controller | Hanna | BL981411 | X4 |
| Rotometer, X5 | Dwyer | RMA-151-SSV | T31Y |
| Rotometer, X5 | Dwyer | RMA-26-SSV | T35Y |
| Water bath circulator | Fisher Scientific | 13-873-45A | |
| Compact chiller | VWR | 13270-120 | |
| Freeze dryer | Labconco | 7752020 | |
| Stir plate | Fisher Scientific | 11-100-49S | |
| pH lab electrode | Phidgets Inc | 3550 | |
| Inductively coupled plasma mass spectrometer | Agilent Technologies | 7700 Series ICP-MS | Attached to autosampler CETAC ASX-520 |
| FIAS 100 | Perkin Elmer Instruments | B0506520 | |
| Atomic absorption spectrometer | Perkin Elmer Instruments | AAnalyst 800 | |
| Cell heater (quartz) | Perkin Elmer Instruments | B3120397 | |
| Microwave | Milestone | Programmable, maximum power 1,200 W | |
| Microwave rotor | Milestone | Rotor with 24-75 ml Teflon vessels for closed-vessel microwave assisted digestion. | |
| Materials | |||
| 0.2 μm syringe filter | Whatman | 6713-0425 | |
| 0.2 μm syringe filter | Whatman | 6713-1650 | |
| 0.45 μm syringe filter | Thermo Fisher | F2500-3 | |
| Polystyrene tubes | Evergreen | 222-2094-050 | 17 x 100 mm w/cap, 16 ml, polysteryne |
| Octogonal magnetic stir bars | Fisher scientific | 14-513-60 | Magnets encased in PTFE fluoropolymer |
References
- Dismukes, G. C., Carrieri, D., Bennette, N., Ananyev, G. M., Posewitz, M. C. Aquatic phototrophs: efficient alternatives to land-based crops for biofuels. Curr Opin Biotechnol. 19 (3), 235-240 (2008).
- Moody, J. W., McGinty, C. M., Quinn, J. C. Global evaluation of biofuel potential from microalgae. Proceedings of the National Academy of Sciences. 111 (23), 8691-8696 (2014).
- Pinto, E., et al. Heavy metal-induced oxidative stress in algae. J Phycol. 39 (6), 1008-1018 (2003).
- Gupta, A., Lutsenko, S. Evolution of copper transporting ATPases in eukaryotic organisms. Curr Genomics. 13 (2), 124-133 (2012).
- Perales-Vela, H. V., Peña-Castro, J. M., Cañizares-Villanueva, R. O. Heavy metal detoxification in eukaryotic microalgae. Chemosphere. 64 (1), 1-10 (2006).
- Sandau, E., Sandau, P., Pulz, O. Heavy metal sorption by microalgae. Acta Biotechnol. 16 (4), 227-235 (1996).
- Amer, L., Adhikari, B., Pellegrino, J. Technoeconomic analysis of five microalgae-to-biofuels processes of varying complexity. Bioresour Technol. 102 (20), 9350-9359 (2011).
- Benemann, J. R., Goebel, R. P., Weissman, J. C., Augenstein, D. C. Microalgae as a source of liquid fuels. Final Technical Report, US Department of Energy, Office of Research. , (1982).
- Benemann, J. R., Oswald, W. J. Report No. DOE/PC/93204--T5 Other: ON: DE97052880; TRN: TRN. Systems and economic analysis of microalgae ponds for conversion of CO2 to biomass. , (1996).
- Chisti, Y. Biodiesel from microalgae. Biotechnol Adv. 25 (3), 294-306 (2007).
- Davis, R., Aden, A., Pienkos, P. T. Techno-economic analysis of autotrophic microalgae for fuel production. Applied Energy. 88 (10), 3524-3531 (2011).
- Jones, S., et al. Process design and economics for the conversion of algal biomass to hydrocarbons: whole algae hydrothermal liquefaction and upgrading. U.S. Department of Energy Bioenergy Technologies Office. , (2014).
- Lundquist, T. J., Woertz, I. C., Quinn, N. W. T., Benemann, J. R. A realistic technology and engineering assessment of algae biofuel production. Energy Biosciences Institute. , Berkeley, CA. (2010).
- Nagarajan, S., Chou, S. K., Cao, S., Wu, C., Zhou, Z. An updated comprehensive techno-economic analysis of algae biodiesel. Bioresour Technol. 145, 150-156 (2011).
- Pienkos, P. T., Darzins, A. The promise and challenges of microalgal-derived biofuels. Biofuels Bioproducts & Biorefining-Biofpr. 3, 431-440 (2009).
- Richardson, J. W., Johnson, M. D., Outlaw, J. L. Economic comparison of open pond raceways to photo bio-reactors for profitable production of algae for transportation fuels in the Southwest. Algal Research. 1 (1), 93-100 (2012).
- Rogers, J. N., et al. A critical analysis of paddlewheel-driven raceway ponds for algal biofuel production at commercial scales. Algal Research. 4, 76-88 (1016).
- Sun, A., et al. Comparative cost analysis of algal oil production for biofuels. Energy. 36 (8), 5169-5179 (2011).
- Thilakaratne, R., Wright, M. M., Brown, R. C. A techno-economic analysis of microalgae remnant catalytic pyrolysis and upgrading to fuels. Fuel. 128, 104-112 (2014).
- Quinn, J. C., et al. Nannochloropsis production metrics in a scalable outdoor photobioreactor for commercial applications. Bioresour Technol. 117, 164-171 (2012).
- Borkenstein, C., Knoblechner, J., Frühwirth, H., Schagerl, M. Cultivation of Chlorella emersonii with flue gas derived from a cement plant. J Appl Phycol. 23 (1), 131-135 (2010).
- Douskova, I., et al. Simultaneous flue gas bioremediation and reduction of microalgal biomass production costs. Appl Microbiol Biotechnol. 82 (1), 179-185 (2009).
- Israel, A., Gavrieli, J., Glazer, A., Friedlander, M. Utilization of flue gas from a power plant for tank cultivation of the red seaweed Gracilaria cornea. Aquaculture. 249 (1-4), 311-316 (2012).
- Napan, K., Teng, L., Quinn, J. C., Wood, B. Impact of Heavy Metals from Flue Gas Integration with Microalgae Production. , Algal Research. (2015).
- Eaton, A. D., Clesceri, L. S., Rice, E. W., Greenberg, A. E. 3125B. Inductively coupled plasma/mass spectrometry (ICP/MS) method. Standard methods for the examination of water and wastewater. , (2005).
- Eaton, A. D., Clesceri, L. S., Rice, E. W., Greenberg, A. E. Standard methods for the examination of water and wastewater. , APHA-AWWA-WEF. (2005).
- Matrix effects in the ICP-MS analysis of selenium in saline water samples. Smith, M., Compton, J. S. Proceedings of the 2004 Water Institute of Southern Africa Biennial Conference, Cape Town, South Africa, , (2004).
- Mehta, S. K., Gaur, J. P. Use of algae for removing heavy metal ions from wastewater: progress and prospects. Crit Rev Biotechnol. 25 (3), 113-152 (2005).
- EPA, U. Method: 200.8: Determination of trace elements in waters and wastes by inductively coupled plasma - mass spectrometry. , (1994).
- Eaton, A. D., Clesceri, L. S., Rice, E. W., Greenberg, A. E. 3120B. Inductively coupled plasma (ICP) method. Standard methods for the examination of water and wastewater. , (2005).
Tags
環境科学、問題101、藻類、重金属、Get cutting-edge science videos from JoVE sent straight to your inbox every month.









