Abstract
재생 연료에 대한 수요의 증가와 같은 미세 조류 등의 대체 원료의 가능성을 조사하는 연구가있다. 고유의 장점은 폐기물 높은 잠재적 인 수율, 비 경작지의 사용 및 통합을 포함한다. 미세 조류 대량 생산 시스템의 영양 요구는 배기 가스와 폐수로부터 영양분 이산화탄소 등의 산업 폐기물 자원으로 재배 시스템의 결합을 필요로 할 것이다. 이 폐기물에 존재하는 무기 오염 물질은 잠재적으로 부정적인 생산성과 제한 최종 사용에 영향을 미칠 미세 조류 바이오 매스의 생물 축적으로 이어질 수 있습니다. 이 연구는 충격의 실험 평가 및 Nannochloropsis의 살리나 성장에 14 무기 오염 물질 (AS, CD, 공동, CR, 구리, 수은, 망간, 니켈, 납 (SB), 셀레늄, 주석, V 및 아연)의 운명에 초점을 맞추고 . 미세 조류는 성장 M에서의 pH 7에서 984 μmol m -2 초에 조명 광 바이오 반응기에서 재배 -1 유지되었다수준의 무기 오염 물질로 오염 edia 상업적 석탄 연소 가스 시스템으로 볼 조성물을 기준으로 예상했다. 바이오 매스와 7 일간 성장 기간 말 매질에 존재 오염 분석적, 수은과 같이, CD 공동 CR, 구리, 망간, 니켈을위한 유도 결합 플라즈마 질량 분석을 통해 차가운 증기를 원자 흡광 법으로 정량 하였다 납 (SB), 셀레늄, 주석, V 및 아연. 결과는 N.을 보여 살리나 이러한 오염물 도입 yieldwith 생물량 통계적 감소에 다중 금속 환경에 민감한 균주이다. 여기에 제시된 기술은 조류 성장을 정량화 및 무기 오염 물질의 운명을 결정하기에 적합.
Introduction
기존의 지상파 작물에 비해 더 높은 고유의 미세 조류는 태양 광 변환 효율 1,2- 인한 높은 생물량, 지질 및 수율을 달성하는 것으로 나타났다. 높은 생산성 속도에서 미세 조류의 배양은 외부 탄소원 등 다양한 영양소의 공급을 필요로한다. 이는 대규모 성장 설비 생산 비용을 최소화하기 위해 이러한 산업 연도 가스와 같은 산업 폐기물과 통합하고 동시에 환경 개선을 제공 할 것으로 기대된다. 산업 폐기물 탄소 기체 이산화탄소의 형태로 일반적으로 부정적인 미세 조류의 생산에 영향을 미칠 가능성이있는 오염 물질을 함유 할 수있다. 특히, 석탄 유래의 배기 가스를 포함한 다양한 오염 물질이 있지만 연소 생성물을 물과 이산화탄소뿐만 아니라 황 및 질소, 미세 먼지, 다이옥신과 퓨란 등의 유기 오염 물질의 산화물 및 무기 콘에 한정되지중금속 등 오염 물질도. 미세 조류의 생산성에 중금속으로 알려져 그들 중 일부와 무기물을 포함하여 이러한 오염 물질의 대부분의 영향은 탐구되지 않았다. 이러한 요소 중 일부는 적절한 농도의 영양분이 될 수 있지만 더 높은 농도에서 그들은 세포 기능 장애 및 사망 3를 생성 할 수 있습니다.
산업 연도 가스와 미세 조류의 통합은 직접 성장 배지 내로의 무기 오염 물질을 도입 할 가능성이있다. 석탄 기반의 배기 가스는 무기 요소 (예를 들면, CD, 공동, CR, 구리, 수은, 망간, 니켈, 납 (SB), 셀레늄, 주석, V 및 아연,로) 일부, 그 중 낮은에 다양한 농도에서의 숙박을 제공합니다 농도, 미세 조류의 성장을위한 영양분을 나타냅니다. 무기 오염 물질은 높은 친화력이 미세 조류에 결합하고 더 영양 운송을 통해 내부적으로 흡착 할 수있다. 일부 무기 오염물 (즉, CO, 구리, 아연 및 Mn)을 포함하는 효소의 일부를 형성 영양소광합성, 호흡 및 기타 기능 3,4에서 D. 그러나, 초과 금속 및 준 금속에 독성이 될 수 있습니다. 이러한 납, 카드뮴, 주석 (SB), 셀레늄로서 수은과 같은 다른 요소는 임의의 농도에서 세포의 기능을 지원하고 부정적인 배양 -3,5,6- 성장에 영향을 미칠 수있는 비 - 금속 영양소를 나타내는 알려져 있지 않다. 이러한 오염 물질의 임의의 존재는 미세 조류 세포 기능에 부정적인 영향을 생산할 수있는 잠재력을 가지고있다. 또한, 미세 조류 여러 금속의 상호 작용 성장 역학을 복잡하게하고 성장에 영향을 미칠 가능성이있다.
대규모 경제 직접 재배 시스템 7-19의 생산성에 연결되어있다. 이 질량의 99.9 및 99.4 %, 각각 20를 나타냅니다 더욱이, 개방 궤도 연못 (ORP) 또는 광 바이오 반응기 중의 미세 조류의 성장 시스템 (PBR) 중간 재활용이 중요하다. 미디어 무기 오염 물질의 존재는 궁극적으로 m을 제한 할icroalgae 생산성 인해 오염 물질 축적에 미디어의 재활용. 이 연구는 실험적으로, (CD, 공동, CR, 구리, 수은, 망간, 니켈, 납 (SB), 셀레늄, 주석, V 및 아연,로) 미세 조류 재배 시스템의 통합을 예상 농도에서 14 무기 오염 물질의 영향을 결정 석탄은 N의 생산성, 배기 가스를 유도로 살리나는 공수의 PBRS에서 성장. 이 연구에 사용 된 오염 물질은 석탄 기반의 연도 가스 그러나 생활 폐기물 기반 연도 가스, 바이오 솔리드 기반의 연도 가스, 하수, 생성 된 물, 장애인 지하수 및 해수 21-23에 존재하지 않을 것으로 나타났다. 본 연구에 사용 된 농도는 미세 조류 성장 시스템은 상업용 PBR 시스템 (20)에서 입증 흡수 효율 석탄계 CO 2 소스와 통합 된 경우 예상되는 것에 기초한다. 중금속 및 무기 오염 물질의 농도를지지 상세한 계산 Napan에 제시등. 24 분석 기술은 바이오 매스 미디어 환경에서 금속의 대부분의 분포를 이해하기 위해 사용되었다. 제시된 방법은 무기 오염 물질 스트레스와 최종 운명의 정량에서 미세 조류의 생산성 잠재력의 평가를 활성화.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. 성장 시스템

그림 1. 미세 조류 성장 시스템. (A) 공기 rotometer, (B) CO 2 rotometer, 솔레노이드 (C)의 pH 컨트롤러 (D) 데이터 로거, (E) - 라인 공기 필터 (F) 공기 분배 헤더, (사) 형광등 은행, (H)의 pH 미터, (I) 냉각 시스템, (J) 수조, (K) 열전대 와이어 (L) 에어 리프트 광 생물 반응기, (M) 히터 (N) 워크 인 연기 후드 (O) 벤트 (P) 공기 공급 모세관 (Q) 공기 필터 (R), 샘플링 관 (S) PBR 실리콘 덮개, 및 (T)실리콘 뚜껑 산도 잘. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 다음과 같은 미세 조류 실험 성장 시스템 (그림 1)을 구축 할 수 있습니다.
- 유리관 반응기 직경 4.5 cm 및 실리콘 뚜껑 1.1 L의 배양 용량 높이 80cm 이루어진 열두 공수 PBRS 획득. 10cm (PBR 당 3), 길이 85cm (PBR 당 1)의 프리 컷 유리 모세관 (5mm 외경 및 내경 1mm)을 취득.
- -80 ° C 냉장고에 실리콘 뚜껑을 동결. 글리세롤과 드릴 비트를 윤활하고 뚜껑 드릴에게 환기, 샘플링 및 가스 공급 모세관 튜브를 호스팅 할 3 홀, 17 mm 직경의 1 구멍을 동결하는 동안의 pH 프로브를 호스팅 할 수 있습니다.
- PBR의 바닥에서 2cm 연장이 가장 긴 튜브와 장소에 3 모세관 튜브를 삽입합니다. 다른 모세관 튜브에 실리콘 튜브를 추가 WI원하는 샘플링 지점까지 연장하는 타단에 연결된 모세관 토륨. 실리콘 스토퍼 크기 21D와 pH 미터 용 구멍을 커버.
- 물을 통해 버블 링에 의해 대기를 가습 및 공기 분배 헤더에 가습 된 공기를 제공한다. 0.2 ㎛의 필터를 통해 가스를 전달하고 전달 긴 유리 모세관 튜브를 통해 조류 현탁액에 배달.
- 배양 현탁액에서 7.0 ± 0.1의 pH를 중성으로 유지하기 위해 습한 공기 스트림으로 압축 CO 2을 전달한다. 조류 문화의 pH 7.1에 도달하여 pH 6.9에서 닫을 때 자기 솔레노이드를 엽니 자동 이산화탄소 약국 시스템 (PH 컨트롤러)와 이산화탄소 전달의 속도를 제어 할 수 있습니다.
- 984 μmol 분 -2 초 -1 야외 조건 피크와 유사한 평균 조명 결과 24 T5 형광 램프를 사용하여 빛을 제공합니다.
- M하기 위해 물을 욕조에 PBRS을 담가약 25 ° C의 일정 온도를 aintain. 재순환 냉각 및 가열 자동화 재순환 수조 유닛 제어를 사용하여 시스템의 온도를 제어.
- 실시간으로 온도와 산도를 모니터링하고 데이터 로거에 기록한다.
- 미세 조류의 성장 시스템의 모든 구성 요소가 올바르게 특히 미세 조류 접종을 수확하거나 보존 할 수없는 등의 무기 오염 물질을 준비하기 전에, 작동하는지 확인합니다.
2. 실험실 도자기 준비
- 비누와 수돗물로 부피 플라스크, PBRS, carboys하고 용기를 세척 할 것. 탈 이온수 (DW)와 린스.
- 산 무기 오염물의 흔적을 제거하기 위해 랩웨어를 헹군다. 이 두 가지 방법 중 하나를 사용하여 수행 할 수 있습니다 :
- 호흡의 연기는, 농축 질산는 연기 ~이 심한 연소 및 유독 가스, 작업을 생성 할 수 있습니다하지 마십시오 실험실 도자기 O / N 10 %의 미량 금속 등급 질산 (주의 만끽니트릴 장갑, 고글 및 실험실 코트)를 사용하여 거라고.
- 50 %의 미량 금속 등급 질산에 15 분 동안 실험실 도자기를 만끽.
- DW 모든 산 제거했는지 확인하고 철저하게 3 회 이상 실험실 도자기를 씻어. 그것은 PBRS 철저, 특히 샘플링 튜브 및 모세관을 린스하는 것이 중요하다. 이렇게하지 않으면 성장의 매체 가능한 억제의 산성화를 생성합니다. 모든 산을 검증하는 세정 수의 pH를 테스트가 제거되었다.
- 적어도 30 분 동안 120 ° C의 표준 대기압에서이를 오토 클레이브에 의해 PBRS, 용기 플라스크를 멸균.
3. N. 살리나 중간 준비
- 솔루션의 준비 : 부분적으로 DW와 1 L 부피 플라스크를 입력합니다. 자기 교반 막대를 삽입하고 다른 한 후 표 1 일에 표시된 화학 물질을 추가 할 수 있습니다. 각각의 성분은 다음 성분을 첨가하기 전에 용해 있는지 확인합니다. 자석을 제거하고 일을 채우기1 리터 볼륨 마크에 전자 플라스크.
| 구성 요소 | 추가 금액 (G) | 최종 농도 (G / L) |
| H 3 BO 3 | 0.900 | 0.900 |
| 나 2을 MoO 4 · 2H 2 O | 0.012 | 0.012 |
| MnCl 2 · 4H 2 O | 0.300 | 0.300 |
| ZnSO 4 · 7H 2 O | 0.060 | 0.060 |
| CuSO 4 · 5H 2 O | 0.020 | 0.020 |
표 1. 해결책 레시피 수량 농축액 1 L의 제조에 필요한 양이다.
- 비타민 용액의 조제 : 별도의 세 권에서umetric 플라스크 멸균 용기에 무균 0.2 μm의 주사기 필터를 통해 표 2에 나타낸 바와 같이. 비타민을 추가 각 비타민 용액 필터. 어둠 속에서 ° C ~ -4 비타민을 보존합니다.
| 비타민 | 양 (mg)을 | 최종 부피 (㎖) | 최종 비타민 농도 (㎎ / ℓ) |
| 비오틴 | 12.22 | (500) | 24.43 |
| 비타민 B12 | 13.50 | (100) | 135.00 |
| 티아민 염산염 | 977.63 | (500) | 1,955.27 |
표 2. 비타민 용액 레시피 수량 농축 SOLU의 제조에 필요한 양이다기.
- 부분적으로 DW와 20 L 오토 클레이브 컨테이너를 작성하고 자기 교반 막대를 삽입합니다. 자기 교반 플레이트 위에 놓고, 용기 (비타민 제외) 표 3에 나타내는 화학 물질을 추가 한 후, 다른 각각 완전 용해 후 하나씩 추가. L. (20)에 도달하는 용기를 채우기
| 구성 요소 | 금액은 중간에 추가 | 단위 |
| 염화나트륨 | 350.00 | G |
| 염화칼슘 2 · 2H 2 O | 3.00 | G |
| KCl을 | 9.60 | G |
| 나 2 그런가 3 · 9H 2 O | 1.14 | G |
| 황산 4 · 7H 2 O | 29.60 | G |
| 20.40 | G | |
| KH 2 PO 4 | 1.36 | G |
| 암모늄 철 구연산 | 0.10 | G |
| 솔루션 | 20.00 | ml의 |
| 비오틴 솔루션 * | 818.00 | μL |
| 비타민 B12 용액 * | 296.20 | μL |
| 티아민 염산염 용액 * | 521.60 | μL |
| * 냉각 멸균 미디어에 추가 |
표 3 : N. 살리나 매체 조리법. 수량은 영양이 풍부한 매체의 20 (L)의 제조에 필요한 양이다.
- 30 ° C에서 120 분, 대기압에 대해 오토 클레이브에 의해 멸균 매체. 매체 쿠하자RT 아래로 L.
- 자석 교반기 판에 용기를 놓습니다. 단계 3.2에서 제조 된 비타민을 추가하고 철저하게 매체 믹스를 할 수 있습니다.
4. 무기 오염 물질 재고 준비
- 부분적으로 DW와 표 4에 표시된 용량 플라스크를 작성하고 나열된 개별 소금을 추가합니다. 필요한 최종 부피에 DW로 작성하고 철저하게 섞는다. 일부 요소가 벽을 플라스크에 흡착 이러한 주식을 보존하지 않음
주의 : 염을 처리 할 때이 프로토콜에서 사용되는 여러 가지 무기 오염 물질, 발암 성 기형 및 돌연변이이며, 얼굴 마스크, 장갑 및 실험실 코트를 착용하십시오.
| 분석 | 소금 소스 | 주식의 볼륨을 준비하는 (L) | 소금 플라스크에 추가(60); (mg의 소금) | 분석 물질 농도가 추가로 배양 (mg의 분석 물 / L) |
| 으로 | NaAsO 2 | 0.1 | 14.8 | 7.74E-02 |
| CD | 을 CDCl3 2 | 0.5 | 13.5 | 1.50E-02 |
| 공동 | 의 CoCl2 · 6H 2 O | 0.5 | 34.7 | 1.56E-02 |
| CR | 나 2 CR 2 O 7 · 2H 2 O | 0.1 | 40.6 | 1.29E-01 |
| 구리 | 의 CuCl 2 · 2H 2 O | 0.1 | 38.3 | 1.30E-01 |
| 수은 | HgCl 2 | 1.0 14.6 | 9.80E-03 | |
| 망간 | MnCl 2 · 4H 2 O | 0.1 | 58.8 | 1.49E-01 |
| 니켈 | NiCl 2 · 6H 2 O | 0.1 | 112.0 | 2.51E-01 |
| 납 | PbCl 2 | 0.5 | 39.9 | 5.41E-02 |
| SB | SB 2 O 3 | 0.5 | 26.7 | 4.06E-02 |
| 괜찮다 | 나 2 서 3 | 0.5 | 11.8 | 9.80E-03 |
| 주석 | SnCl 2 · 2H 2 O | 0.5 | 3.9 | 3.76E-03 |
| V | V 2 O 5 | 0.1 | 22.2 | 1.13E-01 |
| 아연 | ZnCl 2 | 0.1 | 99.9 | 4.36E-01 |
표 4 :. 1.1 L의 PBR 매체에이 집중 재고 1 ㎖의 고농도 무기 오염 물질의 재고 준비 추가는 마지막 열에 표시된 최종 농도를 생성합니다.
- 멸균 0.2 μm의 주사기 필터를 통해 용액을 통과시켜 무기 오염물 축적량을 소독 멸균 튜브 여액을 모은다.
5. N. 살리나 접종 생산
- 500㎖의 삼각 플라스크에 단계 3에서 제조 한 배지 200㎖를 추가 한 다음 한천 3g을 추가한다. 120 ℃에서 20 분 동안 알루미늄 포일과 함께 오토 클레이브 플라스크 커버. 멸균 페트리 접시에 솔루션을 붓고 굳은 때까지 냉각을 할 수 있습니다. 이는 무균 후드이거나 적어도 오염의 위험을 최소화하기 위해 깨끗한 환경에서 불꽃 근처 완료되어야한다.
- 킬 N. 무균 배양-DIS에서 살리나 세포HES는 무균 접종 루프를 사용하여 단계 5.1에서 제조. 실온에서 유지 T12의 빛으로 조명 테이블에 페트리 접시 문화를 놓습니다. 식민지가 표시 될 때까지 미세 조류의 성장 보자.
- 전송 식민지는 영양이 풍부한 배지 200㎖ 3 단계에서 준비하고 조명 흔드는 테이블 (1000 RPM)에 그들을 유지를 포함하는 삼각 플라스크를 당황 멸균한다. 매체가 녹색이 될 때까지 문화가 성장하자.
- 1.1 L 멸균 PBR로 미세 조류를 전송합니다. 순환 냉각 장치 및 자동 난방 순환 수조 제어에 의해 23 ° C에서 200 μmol 분 -2 초 -1 T8 형광 조명 조명 유지 접종 물을 욕조에 PBR를 놓습니다. 각각 -1 인 min 분 -1 2.5 L 및 25 CC에 공기와 이산화탄소 rotometers를 조정합니다.
- 새로운 매체를 포함하는 새로운 1 0.1 L의 PBRS로 성장 분할 바이오 매스의 주 후에는 건조 중량 바이오 매스되어 적어도 28g의 총까지 성장하자광학 밀도를 측정 할 수있는 두 반응기 사이를 얻을.
- 오염을 방지하기 위해 멸균 원심 병 및 무균 기술을 사용하여 10 ° C에서 15 분 동안 2054 × g에서 원심 분리하여 접종 매스 수확. 뜨는 폐기하고 필요에 따라 세포 농도를 계속합니다.
- 일단 모든 미생물을 원심 분리하여 신선한 멸균 배지 300 ㎖에 세포를 다시 일시.
- DW 3ml를 미세 조류 배양에 0.1 mL로 희석하고 3 ml의 DW이 새로운 용액 0.1 mL로 희석한다. 샘플을 확인하는 것은 완전히 혼합이다. 750 nm에서의 미세 조류 농축 물의 광학 농도 (OD)를 측정한다 () 바로 분광 광도계.
- (1) 정광에서의 바이오 매스의 양을 결정하는 방정식을 사용한다.
식 (1) (N)에 대한 (G / L-1에) 총 부유 물질 대 사이의 선형 회귀로부터 얻은 : 참고 살리나 (R = 0.9995 2). 수학 식 1은 spectr 위해 개발 된다른 분광 광도계 모델을 사용하는 경우 자재 표 모델 ophotometer, 새로운 교정을 생성한다.- 식을 이용하여 (2) (L)에 미세 조류 농축 물의 체적을 계산 (L)에 PBR 1.1 L의 부피 4g / L -1 배양 밀도를 얻기 위해 필요한.
- 멸균 기법을 이용하여, 미세 조류의 부피가 4g / L-1의 초기 배양 밀도에 도달하기까지 멸균 된 PBR 단계 5.9에서 발견 농축액 추가. 6 PBRS이 접종 될 때까지 1.1 L. 중간과 PBR을 입력하면이 단계를 반복합니다. 접종 물을 욕조에 PBRS를 놓습니다.
- PBRS에서 미세 조류 8 일 동안 성장하자 다음 (반복 단계 5.6-5.7로) 바이오 매스를 수확. 단계를 반복 5.8은 초기을 계산1g /의 L-1의 초기 문화 밀도 접종 볼륨.
6. 실험 원자로
- 사용 멸균 기술은 12 산 세척 멸균 PBRS의 각 단계 3에서 제조 된 매체의 약 1 패를 추가합니다. 실험 성장 시스템의 수조에 PBRS를 놓습니다. -1 인 min 1.5 L에에 살포 공기를 돌립니다.
- 70 % 에탄올로 세정하여 보정 된 pH 측정기를 소독. PBR 매질의 pH를 측정하여 pH가 약 7.0 인 보장; 하지 않을 경우, 2 단계를 반복은 산 세척 단계에서 걸러 산을 제거합니다.
- 에탄올 (70 %)를 사용하여 프로브를 소독 한 다음 PBRS 뚜껑에 삽입, 완충액 pH 7을 이용하여 각각의 pH를 보정 컨트롤러.
- (제어 PBRS 제외) 각 PBR에 오염 물질이 완전히 PBR에 혼합하자 4 단계에서 제조 된 멸균 무기 오염 물질의 주식 각 1 ㎖를 추가합니다. PBRS의 무기 오염 물질의 최종 농도는 쇼 아르N 표 4의 마지막 열에서와 석탄 화력 발전소 통합에서 추정 된 최대 농도를 것으로 예상된다.
- 제어 PBRS에 멸균 DW의 14 ML을 추가합니다.
- 1g / L의 -1의 초기 배양 밀도를 획득하기 위해 PBRS 실험을 5.11 단계에서 얻은 농축 된 미세 조류를 접종 추가. 철저 바이오 매스 믹스를 보자.
- 높은 광 강도 등 (984 μmol m -2 초 -1)과의 산도 컨트롤러의 전원을 켜고 30 CC 최소 1 CO 2를 조정합니다. 50 공통 분에 이산화탄소 흐름 -1 후 3 일에서을 높입니다. 초기 낮은 CO 2 유량으로 인해 가스 / 액체 전달 및 pH를 측정하여 pH 지연의 큰 변화를 피하기 위해 중요하다.
- 측정하고 필요에 따라 샘플을 채취. 샘플링 후 수위를 표시해야합니다. (주의 : PBR의 일부 무기 오염 물질, 발암 성 기형 및 돌연변이이다; 사용 장갑과 CAPPED 용기) 샘플을 처리 할 때.
- 증발로 인한 손실을 보상하기 위해 PBRS 매일 멸균 DW를 추가합니다.
- 성장 7 일 후, 9,936 × g에서 원심 분리하여 바이오 매스 수확 및 -80 ° C에서, 둘, 바이오 매스 및 상층 액 매체를 보존 할 수 있습니다.
- 0.1 밀리바 및 -50 ° 주식 / N에서 바이오 매스 건조 동결. 분말 바이오 매스 (원심 관 내부 분말 바이오 매스에 주걱을 사용). -80 ℃에서 동결 건조 바이오 매스를 보존합니다.
샘플의 소화 보조 7. 마이크로 웨이브
바이오 시료의 소화는 ICP-MS 분석을위한 전처리 단계로서 필요하다.
참고 :이 단계는 제어 압력 완화와 밀폐 용기 전자 레인지의 소화 시스템을 사용합니다. (주의 : 높은 압력, 산 소화 동안 개발 소화 용기 및 방패의 물리적 무결성을 검사하고 모든 사용하기 전에 마이크로파 분해 용기의 뚜껑을 바꿀).
- 비누와 물로 씻을 것 테프론 전자 소화 선박, DW 씻어 선박을 건조 공기를 보자. 다음 단계에서 설명하는 바와 같이 용기에 미량의 금속 오염을 제거하기 위해서는 산 다이제스트.
- 마이크로파 분해 용기의 뚜껑을 바꿀 단단히 병을 닫습니다.
- 각각에 질산 10 ㎖를 추가합니다.
- 안전 실드에서 선박을 소개합니다. 어떠한 미생물, 물이나 시약 안전 실드의 손상을 방지하기 위해 안전 실드의 벽에 또는 소화 용기 외벽에 남아 있지 않는지 확인. 안전 밸브는 유리 병에 봄이 높이가 확인한와 안전 실드를 모자. 캡 통풍구가 외부 행과 안쪽 내부 행에 바깥쪽으로 가리키는 회 전자의 방패를 찾습니다.
- 선박 번호 하나에, 세라믹 보호관 및 온도 센서를 삽입합니다. 이 온도계 바이알에서 실내 온도를 모니터링하고 소화 PROGR을 실행 제어 매개 역할입니다. 유리 병 숫자 하나가 다른 유리 병 같은 시료와 시약 양이 포함되어 있는지 확인합니다.
- 입력 소화 파라미터를 표 5에 도시되고 소화를 시작한다. 프로그램이 완료되면 그들은 실온에 도달 할 때까지, 공기는 튜브를 냉각.
| 단계 | 세척 유리 병 | 샘플 소화 | ||||
| 온도 (℃) | 시간 (분) | 최대. 전력 (W) | 온도 (℃) | 시간 (분) | 최대. 전력 (W) | |
| 1 | RT 190 | (25) | 1,000 | RT 180 | (15) | 1,000 |
| (2) | (190) | (10) | 1,000 | (180) | (15) | 1,000 |
| - | (20) | - | - | (20) | - |
표 5 : 마이크로파 분해 과정에서 사용되는 변수.
- 흄 후드 내부 캡 통풍구와 실드 캡의 압력 릴리프 도구를 사용하면 멀리 가리 삽입합니다. (: 바이오 매스 소화가 산을 사용 이후 흄 후드 내부에 항상 열려 소화 병이 유독 가스를 발생주의) 압력이 뚜껑을 열기 출시되면.
- 산 폐기하십시오. DW는 3 회와 테프론 용기를 씻어. 건조 공기 튜브 보자.
- 바이오 매스를 소화 전자 소화 용기에 동결 건조 바이오 매스의 50 mg의 추가합니다. 품질 관리 (QC)는 다음 유리 병을 준비 내용 : 추가 두 개의 서로 다른 유리 병에를 어느 레벨 7 ICPMS 5 ml의 또는 단계 9.1이 유리 병에서 10.1 (소화 솔루션에서 제조 레벨 7 수은 CVAAS 표준의 5 ml를 강화 실험실라고 빈 (LFB))는, 다른 유리 병 빈 (소화 솔루션을 떠나이 유리 병에서 실험실 시약라고 빈 (LRB)).
- 중간 다이제스트 10 ml의에게 산 세척 전자 소화 선박을 건조 뜨는 매체를 추가합니다. 품질 관리 (QC)는 다음 바이알을 준비 두 가지 바이알 (10)을 추가 다른 바이알에 단계 9.1 및 10.1 (LFB이라고이 바이알로부터 분해 용액)에서 제조 된 레벨 7 ICPMS 또는 CVAAS 금속 표준 5 mL를 추가 DW의 ㎖ (이 바이알로부터 분해 된 용액 LRB라고 함)를.
- 마이크로파 분해 용기의 뚜껑을 바꿀 단단히 병을 닫습니다.
- 농축 트레이스 금속 등급 질산 7 mL를 각 바이알에 3 ㎖ 과산화수소를 추가한다. 부드럽게 용액 소용돌이에 의해 내용 균질화. (표 5에서 시료 소화 마이크로파 분해 파라미터를 사용) 7.7 단계 7.4를 반복함으로써, 바이알의 내용물 다이제스트.
- 증가 복구를 위해 DW와 혈관을 세척, 25 mL의 용량 플라스크에 소화 샘플을 추가합니다. DW와 부피 플라스크를 채우마크.
- 전송 덮인 용기에 샘플을 소화. 분석이 완료 될 때까지 4 ° C에서 샘플을 보존합니다. 이 연구 분석을 위해 수은과 다른 요소에 대한 3 일 이내에 같은 날에 이루어집니다.
8. 품질 관리 (QC) 샘플
참고 : 실험 샘플의 결과의 신뢰성을 보장하기 위해 품질 관리 샘플을 분석 할 수 있습니다.
- 부분적으로 DW와 1 L 부피 플라스크 세척 산을 입력합니다. (이 솔루션은 또한 빈 솔루션이라고합니다) 집중 추적 금속 학년 질산의 280 ML을 추가하고 철저하게 혼합 (주의 : 항상 발열 반응이 폭력이 될 수있는 산에 물을 넣어 물에 산을 결코 추가하지 않음). 실온으로 냉각 솔루션을 보자.
- 단계 7.9 및 7.10에서 제조 QC 샘플 외에 다음 QC 샘플을 준비한다.
- 계속 교정 확인 (CCV)은 다음을 참조 준비를위한 교정 표준 폴리스티렌 튜브 (채우기단계 9.2 및 10.1). CVAAS 랙 및 ICPMS ICPMS의 자동 시료 주입기의 표준 용액에 수은 표준 용액을 넣어.
- 계속 교정 빈 (CCB)의 경우 : 빈 (8.1 단계에서 제조 된 용액)와 두 폴리스티렌 튜브 (16 ml)에 입력합니다. 하나 CVAAS 랙에 샘플과 ICPMS의 자동 시료 주입기의 다른 샘플을 놓습니다.
- 실험실 강화 매트릭스 (LFM)의 경우 : 무작위로 샘플의 각 유형 (즉, 바이오 매스 또는 매체)에 대한 매 12 샘플 1 샘플을 선택하고 LFM을 준비하는 데 사용합니다. ICPMS 들어 폴리스티렌 튜브에 ICPMS 기준치 (7) 및 (또는 바이오 매스 매체 중 하나에서) 분해 시험 물질 3ml를 0.5ml를 추가.
- 내용을 혼합하고 ICPMS의 자동 시료 주입기에 튜브를 배치합니다. CVAAS 들어 폴리스티렌 튜브에 2 ㎖의 수은 기준치 (7) 및 (또는 바이오 매스 매체 중 하나에서) 분해 실험 예 6를 가하여. CVAAS 랙에 내용과 장소 튜브를 섞는다.
- 중복 된 샘플의 경우 : 무작위 적 1 샘플을 선택행렬의 각각의 유형에 대한 샘플 (12), Y (예를 들면, 바이오 매스, 중간 LFM 또는 희석 매트릭스)와 바이알 중복. ICPMS 오토 샘플러 또는 CVAAS 랙에 반복 튜브를 놓습니다.
- 중복 된 샘플의 경우 : 무작위로 매트릭스 (예를 들면, 바이오 매스, 중간, LFM 또는 희석 매트릭스)의 각 유형에 대해 매 12 샘플 1 샘플을 선택하고 병을 복제. ICPMS 오토 샘플러 또는 CVAAS 랙에 반복 튜브를 놓습니다.
- 연구를위한 데이터 품질 기준을 정의합니다. 본 연구를 위해 이튼, Clesceri, 쌀과 그린버그 (25)에 의해 설립 된 품질 기준을 중복. 품질 관리를 위해 설립 매개 변수는 다음과 같습니다 ± 10 % 25 ± 70-130% (25) 내에서, LFB의 회수율 (%의 R) (납 및 Sb로, 설명을 참조하십시오의 제외), LFM 퍼센트 내에서 CCV에 대한 퍼센트의 차이 (% d 개) 회수 (%의 R) 75~125% 25 이내, 및 상대 퍼센트 차이 (RPD) 25 ± 20 % 이내, 그리고 계속 CA방법보고 제한 (MRL) 25 이하 libration의 빈 (CCB). 단계 9.7에서 계산 방정식을 참조하십시오.
플라즈마 질량 분석 유도 결합 9. 정량화 (ICPMS)
- 분석의 날, 폴리스티렌 튜브에 약 5 ml의 소화 샘플을 전송하고 ICPMS의 자동 시료 주입기에 배치합니다. 폴리스티렌 튜브에 소화 샘플의 약 15 ML을 추가하고 CVAAS 랙에 배치합니다.
- 분석의 같은 날 교정 표준을 준비합니다. 구입 ICPMS에게 표준 용액을 추가하고 표 6에 설명 된대로 빈 (8.1 단계에서 제조 된 용액)와 리필 산 세척 용량 플라스크에 (재료 표에 표준 용액 설명을 참조).
| 매개 변수 | 레벨 1 | 레벨 2 | 레벨 3 | 레벨 4 | 레벨 5 | 레벨 6 | 레벨 7 |
| 구매 표준을 추가 할 (ML) | - | - | - | - | - | - | 10.0 |
| 레벨 7을 추가 할 (ML) | 0.0 | 1.0 | 2.5 | 5.0 | 20.0 | 25.0 | - |
| 최종 볼륨 * (㎖) | - | 50.0 | 50.0 | 50.0 | 100.0 | 50.0 | 100.0 |
| 최종 농도 (μg의 / L) | |||||||
| 75 | 0.0 | 2.0 | 5.0 | 10.0 | 20.0 | 50.0 | (100)0.0 |
| (111) 카드뮴 | 0.0 | 1.0 | 2.5 | 5.0 | 10.0 | 25.0 | 50.0 |
| 59 공동 | 0.0 | 10.0 | 25.0 | 50.0 | 100.0 | 250.0 | 500.0 |
| 52 CR | 0.0 | 2.0 | 5.0 | 10.0 | 20.0 | 50.0 | 100.0 |
| (63) 구리 | 0.0 | 5.0 | 12.5 | 25.0 | 50.0 | 125.0 | 250.0 |
| 55 망간 | 0.0 | 3.0 | 7.5 | 15.0 | 30.0 | 75.0 | 150.0 |
| 60 니켈 | 0.0 | 8.0 | 20.0 | 40.0 | 80.0 | 200.0 | 400.0 |
| 208 납 | 0.0 | 1.0 | 2.5 | 5.0 | 10.0 | 25.0 | 50.0 |
| (121)의 Sb | 0.0 | 12.0 | 30.0 | 60.0 | 120.0 | 300.0 | 600.0 |
| 51 V | 0.0 | 10.0 | 25.0 | 50.0 | 100.0 | 250.0 | 500.0 |
| (66) 아연 | 4.0 | 10.0 | 20.0 | 40.0 | 100.0 | 200.0 | |
| * 단계 8.1에서 제조 한 용액을 첨가하여 볼륨을 달성 | |||||||
표 6 : 교정 표준의 농도 7 레벨 1..
- ICPMS에서 콘을 제거하고 DW 1 분을 초음파 처리. 콘을 건조하고 악기를 다시 넣습니다.
- 물 냉각 장치를 켜고, 가스 (AR, H 2, 그는), ICPMS, 내부 표준 플러그 라인 및 자동 샘플러 린스 용기 작성 (DW, 10 % 질산을 1 % 질산 + 0.5 % 염산) .
- 표 7에 매개 변수를 설정하는 방법을 서비스 MassHunter 워크 스테이션 소프트웨어를 열고 플라즈마, 조정 ICPMS 켜고로드합니다.
| 매개 변수 값 | |||||||||
| 내부 표준 | 72 창, 115 | ||||||||
| RF 전력 | 1,500 W | ||||||||
| 플라즈마 가스 유량 | 14.98 | ||||||||
| 분무기 가스 유량 | 1.1 L / 분 (캐리어와 희석 가스는 결합 - 0.6 + 0.5 L / 분) | ||||||||
| 샘플링 콘 | X 렌즈 니켈 | ||||||||
| 스키머 콘 | 니켈 | ||||||||
| 샘플 흡수율 | 0.3 RPS | ||||||||
| 분무기 펌프 | 0.1 RPS | ||||||||
| S / C의 온도 | 2 ° C | ||||||||
| 검색 조건 | 시간 1 초, 복제 3의 수를 드웰 | ||||||||
| H 2 가스 유동 | N / A | ||||||||
| 그는 가스 유동 | 4.3 ㎖ / 분 | ||||||||
| 매개 변수 | 레벨 1 | 레벨 2 | 레벨 3 | 레벨 4 | 레벨 5 | 레벨 6 |
| L7 수은 표준 추가 할 (ML) | 0 | 1 | 2.5 | (5) | (20) | (25) |
| 최종 볼륨 * (㎖) | - | (50) | (50) | (50) | (100) | (50) |
| 최종 농도 (μg의 / L) | 0 | 0.5 | 1.25 | 2.5 | (5) | 12.5 |
| * 단계 8.1에서 제조 한 용액을 첨가하여 볼륨을 달성 | ||||||
도표 8 : 수은 표준 용액의 농도 6 레벨 1..
- Ar 가스와 공기 밸브를 열고, 원자 Absorp를 켭니다기 분광 광도계와 흐름 주입 원자 분광학 (FIAS). , CVAAS Winlab 소프트웨어를 열고 수은 램프를 켜고 소프트웨어의 에너지 매개 변수가 79로드 표 9의 매개 변수와 수은 분석을위한 프로그램에 도달 할 때까지 따뜻하게 할 수 있습니다. 최대 투과율을 제공하는 기기에서 빛의 경로를 조정합니다.
| 매개 변수 | 값 |
| 캐리어 가스 | 아르곤, 100 ㎖ / 분 |
| 램프 | 수은 무 전극 방전 램프, 185mA에서 설치 |
| 파장 | 253.7 nm의 |
| 슬릿 | 0.7 nm의 |
| 셀 온도 | 100 ° C |
| 샘플 볼륨 | 500 μL |
| 반송파 | 3 % 염산, 9.23 ㎖ / 분 |
| 환원제 | 10 % SnCl 2, 5.31 ㎖ / 분 |
| 측정 | 피크 높이 |
| 복제 읽기 | 3 |
도표 9 : CVAAS 작동 조건.
- 3 %의 미량 금속 등급 염산으로 만든 캐리어 솔루션 라인을 연결합니다.
- 3 %의 미량 금속 등급 염산 (수은 분석에 적합) 10 % 염화 주석 이루어지는 환원제 용액에 선을 연결. 이 대기 중 산화하는 경향으로이 솔루션을 분석 같은 날을 준비 (주의 : 주석 염화물은 매우 위험합니다, 그것은 작업을 할 때 보호 마모를 사용 위험 봉쇄에 CVAAS 폐기물을 수집하고 적절하게 폐기하십시오.).
- CVAAS Winlab 소프트웨어의 CVAAS 랙 및 입력 순서에 따라 수은 표준, 품질 관리 샘플 및 실험 샘플을 놓습니다. 표준 실행하고 교정 방정식을 생성합니다.
- 실행 품질 관리 샘PLES 실험 샘플. CVAAS 악기로 샘플의 약 5 mL를 그립니다, 원소 수은 (수은 0) 가스 시료의 수은 선물을 줄이고 폐쇄 시스템의 캐리어 가스 (AR)과 솔루션에서 가스를 제거합니다. 수은 증기 램프는 수은 광로의 셀을 통과한다. 검출기는 253.7 nm에서 흡수되는 빛의 농도를 결정하고 그것을 연관. (주의 : 수은 증기는 독성, 악기 배기 후드가 제자리에 있는지 확인).
- 분석 기간 동안 단계 9.7 %의 R % D와 RPD를 계산하고, 프로젝트 데이터 품질 기준과 결과를 비교.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
바이오 매스 수율
N의 생산 살리나 본 연구에 사용한 PBR 시스템에서 8.5까지 1g / L -1에서 ± 0.19 g / L-1 (N = 12) 대조군 반응기 및 4.0 ± 0.3 g / ℓ -1 (N = 12)을 성장 다중 금속은 7 일 오염. 실험은 세중 원자로 및 여러 배치에 걸쳐 반복 데이터를 생산. 그림 2A는 3 개의 독립적 인 PBRS에서 샘플링을 기반으로 매우 작은 표준 오차와 평균 문화 밀도를 보여줍니다. 이 결과는 고립 된 결과 아니었다 보장하기 위해 세 이상 배치 비슷한 결과로 성장했다. 네 배치에 대한 결합 된 결과는 그림 2B에 표시됩니다. 생물 다양성이 존재하지만,이 연구는 N.에 무기 오염 물질의 일관된 부정적인 영향이 있음을 보여줍니다 살리나 생산. 오염 물질에 노출 PBRS의 바이오 매스 생산량은에서 제어 PBRS에 통계적으로 차이를 보였다2 일 이후 (ANOVA, P <0.05).
무기 오염 물질 정량화의 품질 관리 평가
아무 손실없이 이익과 소화 (표 10) 동안 분석없이 교차 오염을 나타내는없는, 100 %에 가까운 %의 R과 LFB %의 연구와 같이 분석 십사 요소 중 12 완전히 소화 후 복구했다. 샘플 % D와 RPD의 정량 분석은 모든 분석 및 결과의 평균을 통해 관찰 하였다 동안 표 10에 나타내었다. 같이, CD, 공동, CR, 구리, 수은, 망간, 니켈, 납, Sb를, V, Zn으로 통과 납 및 Sb를위한 그러나 %의 D % D와 RPD는 점차적으로 분석 중에 떨어졌다. 이러한 요소 %의 D는 콘 세척 후 개선하지만 상수 콘 세정 비실용적이므로, 납 및 Sb를위한 데이터 품질 목표가 저하되었다. 모든 분석에 대한 CCB는 MRL 이하도했다. 매트릭스 효과 LFM 샘플을 분석 % 연구를 획득하여 평가 하였다. While 공동, 수은, V 및 Sb를 그것에는 QC 목적 % 미만 R 결과 소화 바이오 시료를 분석 한 결과로서, CD, CR, 구리, 망간, 니켈, 납 및 아연을 통과하지 않은, QC 데이터 기준을 통과시켰다. 3 (용질 : 용매) 1 비율의 매트릭스 DW 희석 데이터 품질 기준을 통과 %의 R 결과. 매트릭스의 효과는 또한 소화 상등액 분석 동안 관찰하고, 희석 기기의 검출 한계를 손상하지 않았다 확인한 동일한 희석 비율 (표 10)에 의해 해결되었다. SE 및 주석의 검출과 관련된 문제는 각각 불안정 판독 및 오염 문제에 기초하여 관찰 하였다. 셀레늄의 불안정한 측정 값은 매트릭스 (27)에 염에 기인한다. 의 Sn 오염 소화 공정에서 사용하는 산에 거슬러 하였다.
| 분석 | R | CCV | LFB | 바이오 매스 샘플 LFM | 상층 액 샘플에 대한 LFM | ||||
| % D | % 연구 | 희석 비율 | % 연구 | RPD | 희석 비율 | % 연구 | RPD | ||
| 품질 관리 (25)을 제한 | 0.9950 | ± 10 | 70-130 | - | 75-125 | ± 20 | - | 75-125 | ± 20 |
| 으로 | 0.9998 | 1.8 | 101.0 | 1 : 3 | 100.4 | 5.2 | 1 : 3 | 92.5 | -0.5 |
| CD | 1.0000 | 1.4 | 102.6 | 1 : 3 | 103.5 | 4.6 | 없음 | 92.3 | 0.6 |
| 공동 | 0.9997 | 1.7 | 98.8 | 없음 | 95.2 | -1.4 | 없음 | 96.5 | -1.5 |
| CR | 0.9999 | 1.5 | 99.8 | 1 : 3 | 96.5 | 1.8 | 1 : 3 | 90.1 | -0.8 |
| 구리 | 0.9999 | 2.9 | 98.2 | 1 : 3 | 101.4 | 4.8 | 1 : 3 | 94.4 | -0.5 |
| 수은 | 0.9983 | -1.7 | 103.0 | 없음 | 98.7 | 1.5 | 없음 | 98.0 | 0.3 |
| 망간 | 0.9998 | 2.9 | 97.6 | 1 : 3 | 83.2 | 1.8 | 1 : 3 | 95.4 | -1.7 |
| 니켈 | 0.9999 | 103.5 | 1 : 3 | 98.5 | 2.1 | 없음 | 93.3 | -0.9 | |
| V | 0.9998 | 2.5 | 97.2 | 없음 | 95.5 | -1.5 | 없음 | 101.2 | -1.9 |
| 납 | 0.9998 | 12.6 | 105.2 | 1 : 3 | 88.9 | 0.0 | 없음 | 93.5 | -0.5 |
| SB | 0.9998 | 1.1 | 105.7 | 없음 | 101.8 | -9.6 | 없음 | 90.8 | -1.2 |
| 아연 | 0.9997 | 5.2 | 120.8 | 1 : 3 | 90.7 | 1.4 | 없음 | 89.2 | -1.9 |
표 10 : 품질 관리 샘플의 결과의 요약. R = 공동rrelation 계수 %의 D : 퍼센트 차이의 % R : 용매 비율 : 회수율, RPD = 상대 퍼센트 차이 희석율 용질 지칭한다.
무기 오염 물질 농도
중금속 및 무기 오염 물질은 모두 바이오 매스와 뜨는 매체에서 발견되었다. 분석 요소 (12)에서 발견되는 미생물 농도는도 3에 도시된다. PBRS 중으로부터 수확 된 바이오 매스 농도 (N = 3) # 1은 매우 작은 표준 오차 (도 3A)을 일괄 적으로 나타낸다. 배치에서 4 중으로 PBRS로부터 데이터를 결합하는 것은 지속적 무기 오염 물질이 바이오 매스 (N = 12) 내에 존재 함을 나타낸다. 상청액 배지에서 발견 농도는도 4에 나타내었다. 결과는 삼중 PBRS 표시 (N = 3) (1)는 또한 작은 표준 오차 (도 4a)를 가지고, 가장 오염이 우선적으로 바이오 매스 (L)에 위치 된 것을 보여 일괄 번호eading 악기의 MRL에 가까운 몇 가지 샘플 농도 뜨는 매우 낮은 농도. 네 배치의 결과는 그림 (b)에 제시되어있다.
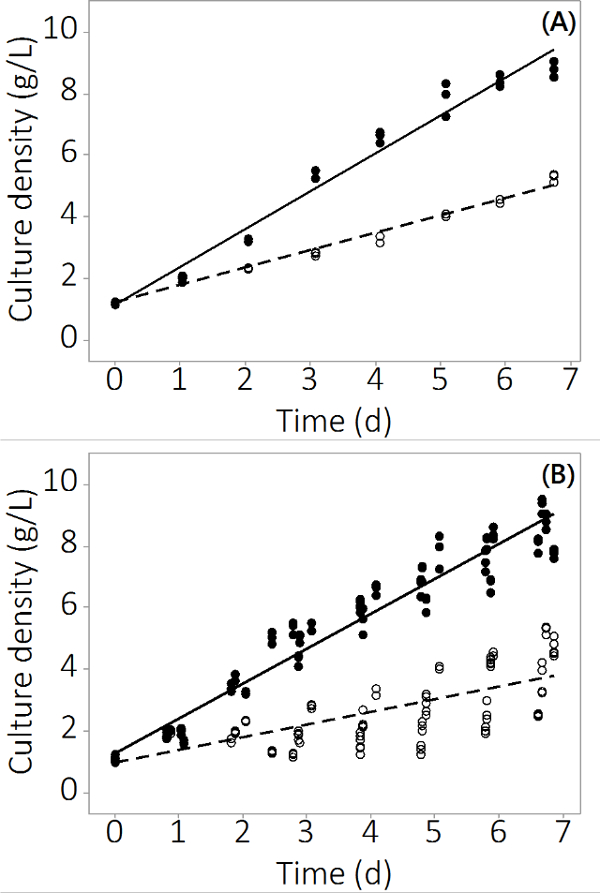
그림 2. 오염 및 제어 PBRS의 재배 기간 동안 C ulture 농도. 배치 # 1 (A) 문화 밀도, N = 3 PBRS 결과. 일괄 4 (B) 배양 밀도, N은 12의 결과를 PBRS =. 빈 원은 바이오 매스를 오염 나타내고, 채워진 원은 컨트롤을 나타냅니다.
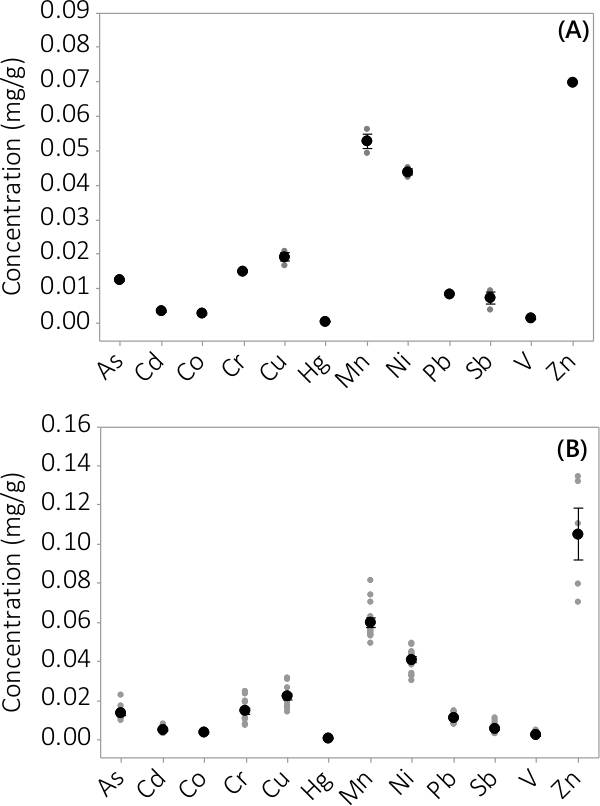
바이오 매스 무기 오염 물질의 그림 3. 농도. (A)에 배치 #에 집중1, N = 1 PBR 아연 및 N = 다른 모든 분석을위한 3 PBRS에 대한 결과, 4 배치에서 (B)의 농도, N = 4 아연에 대한 PBRS 및 N = 다른 모든 분석 12 PBRS 결과. 평균 농도는 검은 채워진 원으로 표시됩니다, 개별 데이터 포인트는 회색 채워진 원으로 표시됩니다. 오차 막대는 평균에서 ± 하나의 표준 오류를 나타냅니다.
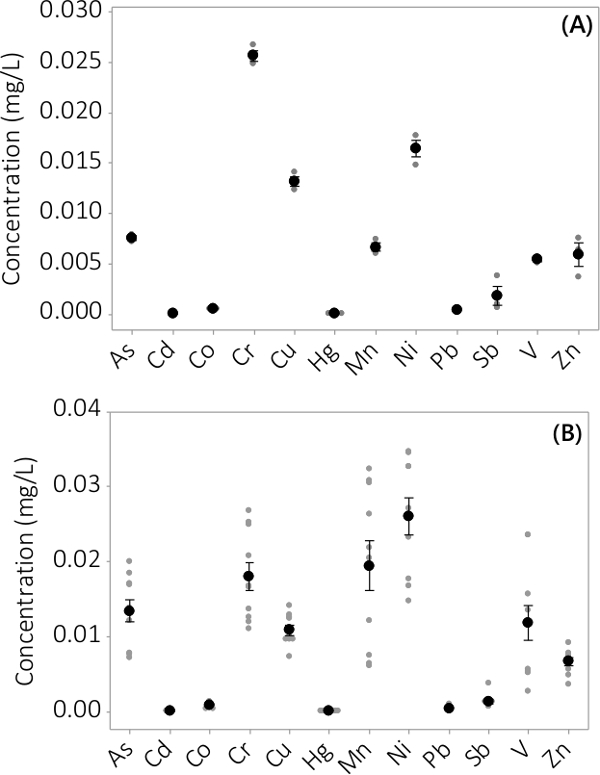
상등액 무기 오염 물질도 4 농도. 일괄 # 1 (A) 농도 PBRS N = 3, 4에서 배치 (B) 농도, N = 12의 결과 PBRS 결과. 평균 농도는 검은 채워진 원으로 표시됩니다, 개별 데이터 포인트는 회색 채워진 원으로 표시됩니다. 오차 막대는 평균에서 ± 하나의 표준 오류를 나타냅니다.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
식염수 미세 조류의 N. 살리나 성공적으로 반복 가능한 결과와 높은 바이오 매스 수율 설계 성장 시스템에서 재배 할 수있다. 공수는 7 일 성장 기간 동안 최소한의 정착 또는의 생물 연료와 잘 혼합 중지 문화 허용 혼합. 형광등 은행에서 최소한의 빛의 변화는 성장에 눈에 띄는 차이를 생산하지 표시됩니다.
이 연구는 중금속 석탄 연소 가스에 부정적인 영향을 바이오 매스 성장과 통합의 농도 대리점에서 미디어를 오염 보여줍니다. 연구에서 반복성 다중 금속 시스템의 생산성에 미치는 영향을 강조한다. 프로세스의 다양한 단계에 부정적인 영향을 성장 부지런히 실험 준비를 필요로 시스템을 오염시킬 가능성이있다. 실험을 시작하기 전에 배지의 pH의 측정은 매체가 산성화되지 않는 것을 확인 (예, resu 허용 QC 공정 인) 산 침지 한 후 세척 부적절한 PBR에서 lting. 산성화 매체는 영양 생체 이용률을 조류의 성장에 영향을 미치는 변경됩니다 (예를 들면, 무기 탄소 종 분화 및 금속 종 분화의 변화), 따라서 조류의 결합 부위, 영양분과 금속 사이의 상호 작용에 영향을주지. 이러한 연구를위한 실험 장비의 세심한 제조는 금속의 도입 정확한 질량 밸런스를 수행 할 수 있도록 요구 하였다. 공정에서 다른 단계는 적절한 수준의 용매 및 화학 물질의 사용에 대한 필요성을 강조하는 금속 불명 도입 할 가능성이있다. 적절한 QC 과정을 통해 효과적으로 중금속 오염 물질의 도입을 확인할 수있다.
결과는 도입 오염 물질이 바이오 매스 (그림 3), 미디어 (그림 4)와 환경 사이에 분포되어 보여줍니다. 수확 N.에서 발견 된 무기 오염 물질 살리나이 미세 조류가 incorporat 것을 제안즉, 연도 가스에 존재하는 여러 가지의 무기 오염 물질. 이것은 동화 인해 부과 결합 부위, 흡수 세포 내부 대사 활동에 기인 한 매질 (28)에 존재하는 원소로 형성된 복합체의 침전 세포벽 상에 흡착의 결과 일 수있다. 며칠 후 무기 오염 물질과 시각적으로 원자로 제어 원자로의 짙은 녹색에 비해 색상이 노란색 나타났다. 오염 된 수확 바이오 매스는 원심 분리하여 수확 후 펠렛을 형성 한 후 오염 물질이없는 바이오 매스 시각적으로 차이가 없었다. 수확 전에 시각적 색상 차이는 낮은 밀도 바이오 매스에 기인하고 미세 조류를 강조한다. 도 4에 도시 된 바와 같이 바이오 매스에서 제거되지 오염물 매체에 축적 할 가능성이있다. 미디어 축적 미디어 재활용 경제성에 대한 필요성을 대표로 규모를 제한 할 가능성을 나타낸다. 제한은 좌우 될 것이다종 특정 될 것 중금속 오염 물질에 대한 허용 오차에 의해. 본 연구의 결과는보다 나은 폐기물 탄소원으로 미세 조류 성장 시스템을 통합에 부정적 영향을 이해하기 위해 필요한, 즉 석탄계 연도 가스를 강조. 본 연구의 결과는 폴리 염화 디 벤조 다이옥신 등의 황 및 질소, 미세 먼지, 유기 오염 물질의 산화물 등의 배기 가스에 존재할 것으로 예상 기타 오염 물질의 생산성에 미치는 영향을 이해하기 위해 필요를 강조 퓨란을 벤조. 이전 차와 LCA 평가는 중금속과 생산성에 무기 오염 물질로 오염 물질의 영향을 고려하지 않고 원활한 통합을 가정 하였다. 일반적으로 이러한 작업의 결과가 생산성에 다중 금속 시스템의 영향을 강조하는 오염물을 bioremediate 미세 조류의 전위를 이해하기 위해 사용될 수있다.
방법론 번째 허용 선물했다미세 조류에 대한 반복 가능한 결과와 무기 오염 물질의 전자 연구. 이 실험에서 사용되는 일부 무기 오염물 전통적 낮은 농도에서 성장 시스템에서 발견되지만, 다른 셀에 공지 기능을 갖지 않는다. 그 결과 농도로서는, CD, 공동, CR, 구리, 수은, 망간, 니켈, 납, Sb으로 셀레늄, 주석, V 및 Zn 다원 계 혼합물을 표 4에 도시 성장 억제. 미생물 오염 물질의 양을 정량화하는 것은 멀티 메탈 시스템에 도전 증명할 수있다. 종종, 유기물과 소금의 높은 내용으로 샘플은 결국 부정확 한 측정 및 분석 정확도 29, 30의 손실로 연결 콘에 구축 매트릭스 간섭, 다 원자 간섭, 물리적 간섭과 소금을 생성 할 수 있습니다. 품질 관리 샘플 측정의 정확도와 정밀도를 결정하는데 도움이 실험 샘플과 함께 실행. 본 연구를 위해 개발 된 프로토콜을 사용하여 분석 물질의 측정을 것으로 나타났다연구 25,29의이 유형에 대한 적절한 성능 내에 허용 복구를 생산 ccurate 정확한. 전자 레인지에 의한 샘플의 소화 N.에 대한 효과적인 것으로 보였다 살리나는 소화 샘플 세포 파편 또는 혼합되지 않는 부분없이 존재 명확했다. 이 실험 (조류 바이오 매스와 인공 해수)에 사용되는 행렬은 행렬의 희석에 의해 극복 된 매트릭스 간섭을 생산했다. 그러나,이 실험에 사용 된 것보다 더 높은 바이오 매스 샘플 크기는 매트릭스 간섭을 초래할 수 있고, 따라서 QC는 각각의 특정 시나리오에 대해 분석한다.
Subscription Required. Please recommend JoVE to your librarian.
Materials
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Sodium chloride | Fisher Scientific | S271-3 | |
| Calcium chloride dihydrate | Fisher Scientific | C79-500 | |
| Potassium chloride | Fisher Scientific | P217-500 | |
| Sodium meta silicate nonahydrate | Fisher Scientific | S408-500 | |
| Magnesium sulfate heptahydrate | Fisher Scientific | M63-500 | |
| Potassium nitrate | EMD Chemical | PX1520-5 | |
| Potassium phosphate monobasic | Fisher Scientific | P285-500 | |
| Ammonium ferric citrate | Fisher Scientific | I72-500 | |
| Boric acid | Fisher Scientific | A73-500 | |
| Sodium molybdate, dihydrate | EMD Chemical | SX0650-2 | |
| Manganese chloride tetrahydrate | Fisher Scientific | M87-500 | |
| Zinc sulfate heptahydrate | Fisher Scientific | Z68-500 | |
| Cupric sulfate pentahydrate | Fisher Scientific | C489-500 | |
| Biotin | Acros Organics | 230090010 | |
| Thiamine | Acros Organics | 148990100 | |
| Vitamin B12 | Acros Organics | 405920010 | |
| Copper (II) chloride dihydrate | Sigma-Aldrich | 221783-100G | Irritant, Dangerous to the Environment |
| Lead (II) chloride | Sigma-Aldrich | 268690-250G | Toxic, Dangerous to the Environment |
| Sodium dichromate dihydrate | Sigma-Aldrich | 398063-100G | Oxidizing, Highly Toxic, Dangerous to the Environment |
| Cobalt (II) chloride hexahydrate | Sigma-Aldrich | 255599-100G | Toxic, Dangerous to the Environment |
| Nickel (II) chloride hexahydrate | Sigma-Aldrich | 223387-500G | Toxic, Dangerous to the Environment |
| Sodium (meta) arsenite | Sigma-Aldrich | 71287 | Toxic, Dangerous to the Environment |
| Cadmium chloride | Sigma-Aldrich | 202908-10G | Highly Toxic, Dangerous to the Environment |
| Mercury (II) chloride | Sigma-Aldrich | 215465-100G | Toxic, Dangerous to the Environment |
| Tin (II) chloride dihydrate | Fisher Scientific | T142-500 | Corrosive. Suitable for Hg analysis. Very hazardous. |
| Manganese chloride tetrahydrate | Fisher Scientific | M87-500 | |
| Vanadium (V) oxide | Acros Organics | 206422500 | Dangerous to the Environment |
| Carbon dioxide | Air Liquide | I2301S-1 | Compressed |
| Hydrogen peroxide | H325-500 | Fisher Scientific | 30% in water |
| ICP-MS standard | ICP-MS-6020 | High Purity Standards | |
| Mercury standard | CGHG1-1 | Inorganic Ventures | 1000±6 µg/mL in 5% nitric acid |
| Argon | Air Liquide | Compressed | |
| Helium | Air Liquide | Compressed, ultra high purity | |
| Hydrogen | Air Liquide | Compressed, ultra high purity | |
| Nitric acid | Fisher Scientific | A509-P212 | 67-70% nitric acid, trace metal grade. Caution: manipulate under fume hood. |
| Hydrochloric acid | Fisher Scientific | A508-P212 | 35% hydrochloric acid, trace metal grade. Caution: manipulate under fume hood. |
| Equipment | |||
| Scientific prevacuum sterilizer | Steris | 31626A | SV-120 |
| Centrifuge | Thermo Fisher | 46910 | RC-6 Plus |
| Spectrophotometer | Shimadzu | 1867 | UV-1800 |
| pH controller | Hanna | BL981411 | X4 |
| Rotometer, X5 | Dwyer | RMA-151-SSV | T31Y |
| Rotometer, X5 | Dwyer | RMA-26-SSV | T35Y |
| Water bath circulator | Fisher Scientific | 13-873-45A | |
| Compact chiller | VWR | 13270-120 | |
| Freeze dryer | Labconco | 7752020 | |
| Stir plate | Fisher Scientific | 11-100-49S | |
| pH lab electrode | Phidgets Inc | 3550 | |
| Inductively coupled plasma mass spectrometer | Agilent Technologies | 7700 Series ICP-MS | Attached to autosampler CETAC ASX-520 |
| FIAS 100 | Perkin Elmer Instruments | B0506520 | |
| Atomic absorption spectrometer | Perkin Elmer Instruments | AAnalyst 800 | |
| Cell heater (quartz) | Perkin Elmer Instruments | B3120397 | |
| Microwave | Milestone | Programmable, maximum power 1,200 W | |
| Microwave rotor | Milestone | Rotor with 24-75 ml Teflon vessels for closed-vessel microwave assisted digestion. | |
| Materials | |||
| 0.2 μm syringe filter | Whatman | 6713-0425 | |
| 0.2 μm syringe filter | Whatman | 6713-1650 | |
| 0.45 μm syringe filter | Thermo Fisher | F2500-3 | |
| Polystyrene tubes | Evergreen | 222-2094-050 | 17 x 100 mm w/cap, 16 ml, polysteryne |
| Octogonal magnetic stir bars | Fisher scientific | 14-513-60 | Magnets encased in PTFE fluoropolymer |
References
- Dismukes, G. C., Carrieri, D., Bennette, N., Ananyev, G. M., Posewitz, M. C. Aquatic phototrophs: efficient alternatives to land-based crops for biofuels. Curr Opin Biotechnol. 19 (3), 235-240 (2008).
- Moody, J. W., McGinty, C. M., Quinn, J. C. Global evaluation of biofuel potential from microalgae. Proceedings of the National Academy of Sciences. 111 (23), 8691-8696 (2014).
- Pinto, E., et al. Heavy metal-induced oxidative stress in algae. J Phycol. 39 (6), 1008-1018 (2003).
- Gupta, A., Lutsenko, S. Evolution of copper transporting ATPases in eukaryotic organisms. Curr Genomics. 13 (2), 124-133 (2012).
- Perales-Vela, H. V., Peña-Castro, J. M., Cañizares-Villanueva, R. O. Heavy metal detoxification in eukaryotic microalgae. Chemosphere. 64 (1), 1-10 (2006).
- Sandau, E., Sandau, P., Pulz, O. Heavy metal sorption by microalgae. Acta Biotechnol. 16 (4), 227-235 (1996).
- Amer, L., Adhikari, B., Pellegrino, J. Technoeconomic analysis of five microalgae-to-biofuels processes of varying complexity. Bioresour Technol. 102 (20), 9350-9359 (2011).
- Benemann, J. R., Goebel, R. P., Weissman, J. C., Augenstein, D. C. Microalgae as a source of liquid fuels. Final Technical Report, US Department of Energy, Office of Research. , (1982).
- Benemann, J. R., Oswald, W. J. Report No. DOE/PC/93204--T5 Other: ON: DE97052880; TRN: TRN. Systems and economic analysis of microalgae ponds for conversion of CO2 to biomass. , (1996).
- Chisti, Y. Biodiesel from microalgae. Biotechnol Adv. 25 (3), 294-306 (2007).
- Davis, R., Aden, A., Pienkos, P. T. Techno-economic analysis of autotrophic microalgae for fuel production. Applied Energy. 88 (10), 3524-3531 (2011).
- Jones, S., et al. Process design and economics for the conversion of algal biomass to hydrocarbons: whole algae hydrothermal liquefaction and upgrading. U.S. Department of Energy Bioenergy Technologies Office. , (2014).
- Lundquist, T. J., Woertz, I. C., Quinn, N. W. T., Benemann, J. R. A realistic technology and engineering assessment of algae biofuel production. Energy Biosciences Institute. , Berkeley, CA. (2010).
- Nagarajan, S., Chou, S. K., Cao, S., Wu, C., Zhou, Z. An updated comprehensive techno-economic analysis of algae biodiesel. Bioresour Technol. 145, 150-156 (2011).
- Pienkos, P. T., Darzins, A. The promise and challenges of microalgal-derived biofuels. Biofuels Bioproducts & Biorefining-Biofpr. 3, 431-440 (2009).
- Richardson, J. W., Johnson, M. D., Outlaw, J. L. Economic comparison of open pond raceways to photo bio-reactors for profitable production of algae for transportation fuels in the Southwest. Algal Research. 1 (1), 93-100 (2012).
- Rogers, J. N., et al. A critical analysis of paddlewheel-driven raceway ponds for algal biofuel production at commercial scales. Algal Research. 4, 76-88 (1016).
- Sun, A., et al. Comparative cost analysis of algal oil production for biofuels. Energy. 36 (8), 5169-5179 (2011).
- Thilakaratne, R., Wright, M. M., Brown, R. C. A techno-economic analysis of microalgae remnant catalytic pyrolysis and upgrading to fuels. Fuel. 128, 104-112 (2014).
- Quinn, J. C., et al. Nannochloropsis production metrics in a scalable outdoor photobioreactor for commercial applications. Bioresour Technol. 117, 164-171 (2012).
- Borkenstein, C., Knoblechner, J., Frühwirth, H., Schagerl, M. Cultivation of Chlorella emersonii with flue gas derived from a cement plant. J Appl Phycol. 23 (1), 131-135 (2010).
- Douskova, I., et al. Simultaneous flue gas bioremediation and reduction of microalgal biomass production costs. Appl Microbiol Biotechnol. 82 (1), 179-185 (2009).
- Israel, A., Gavrieli, J., Glazer, A., Friedlander, M. Utilization of flue gas from a power plant for tank cultivation of the red seaweed Gracilaria cornea. Aquaculture. 249 (1-4), 311-316 (2012).
- Napan, K., Teng, L., Quinn, J. C., Wood, B. Impact of Heavy Metals from Flue Gas Integration with Microalgae Production. , Algal Research. (2015).
- Eaton, A. D., Clesceri, L. S., Rice, E. W., Greenberg, A. E. 3125B. Inductively coupled plasma/mass spectrometry (ICP/MS) method. Standard methods for the examination of water and wastewater. , (2005).
- Eaton, A. D., Clesceri, L. S., Rice, E. W., Greenberg, A. E. Standard methods for the examination of water and wastewater. , APHA-AWWA-WEF. (2005).
- Matrix effects in the ICP-MS analysis of selenium in saline water samples. Smith, M., Compton, J. S. Proceedings of the 2004 Water Institute of Southern Africa Biennial Conference, Cape Town, South Africa, , (2004).
- Mehta, S. K., Gaur, J. P. Use of algae for removing heavy metal ions from wastewater: progress and prospects. Crit Rev Biotechnol. 25 (3), 113-152 (2005).
- EPA, U. Method: 200.8: Determination of trace elements in waters and wastes by inductively coupled plasma - mass spectrometry. , (1994).
- Eaton, A. D., Clesceri, L. S., Rice, E. W., Greenberg, A. E. 3120B. Inductively coupled plasma (ICP) method. Standard methods for the examination of water and wastewater. , (2005).
Tags
환경 과학 문제 (101) 조류 중금속,Get cutting-edge science videos from JoVE sent straight to your inbox every month.









