Abstract
Økende etterspørsel etter fornybare drivstoff har forskere undersøker muligheten for alternative råstoffer, for eksempel mikroalger. Iboende fordeler inkluderer høy potensiell avkastning, bruk av ikke-dyrkbar jord og integrasjon med avfallsstrømmer. Nærings kravene til en storskala mikroalger produksjonssystem vil kreve kobling av dyrkingssystemer med industrielt avfall ressurser, for eksempel karbondioksid fra røykgass og næringsstoffer fra avløpsvann. Uorganiske miljøgifter som finnes i disse avfall kan potensielt føre til bioakkumulering i mikroalge biomasse negativt påvirke produktiviteten og begrense sluttbruk. Denne studien fokuserer på eksperimentell evaluering av virkningen og skjebnen til 14 uorganiske forurensninger (As, Cd, Co, Cr, Cu, Hg, Mn, Ni, Pb, Sb, SE, Sn, V og Zn) på Nannochloropsis salina vekst . Mikroalger ble dyrket i fotobioreaktorer belyst ved 984 umol m sek -2 -1 og holdt ved pH 7 i en vekst media forurenset med uorganiske forurensninger på nivåer forventet basert på sammensetningen funnet i kommersielle kull røykgass systemer. Forurensninger som er tilstede i biomassen og mediet ved slutten av en 7 dagers vekstperiode ble analytisk kvantifisert gjennom kalde dampen atomabsorpsjonsspektrometri for Hg og ved induktivt koblet plasma massespektrometri for As, Cd, Co, Cr, Cu, Mn, Ni, Pb, Sb, Se, Sn, V og Zn. Resultatene viser N. salina er en følsom stamme til multi-metall-miljø med en statistisk reduksjon i biomassen yieldwith innføring av slike forurensninger. Teknikkene er presentert her er tilstrekkelig for å kvantifisere algevekst og å bestemme skjebnen av uorganiske forurensninger.
Introduction
Sammenlignet med tradisjonelle landbaserte avlinger mikroalger har vist seg å oppnå høyere biomasse og lipid utbytter på grunn av iboende høyere solar konvertering effektivitet 1,2. Dyrking av mikroalger ved høye produktivitetspriser krever tilførsel av ulike næringsstoffer, inkludert en ekstern karbonkilde. Det forventes at store vekst anlegg vil bli integrert med industrielle avfallsstrømmer som industriell avgass for å minimalisere driftskostnadene, og på samme tid gi miljømessige utbedring. Industrielt avfall karbon er vanligvis i form av gass karbondioksid og kan inneholde forurensninger som har potensial til å negativt påvirke mikroalger produksjon. Spesifikt vil røkgass avledet fra kull har en rekke forurensninger, inkludert men ikke begrenset til, forbrenningsprodukter vann og karbondioksyd, såvel som oksyder av svovel og nitrogen, fint støv, organiske miljøgifter som dioksiner og furaner, og uorganiske conforurensninger slik som tungmetaller. Virkningen av de fleste av disse forurensninger inkludert uorganiske partikler med noen av dem kjent som tungmetaller på mikroalger produktivitet har ikke blitt utforsket. Noen av disse elementene kan være næringsstoffer i passende konsentrasjoner, men ved høyere konsentrasjoner kan de produsere celle dysfunksjon og død 3.
Integreringen av mikroalger med industriell avgass har potensial til direkte å innføre uorganiske forurensninger inn i vekstmediet. Kullbasert røkgass har en rekke uorganiske elementer (for eksempel As, Cd, Co, Cr, Cu, Hg, Mn, Ni, Pb, Sb, Se, Sn, V og Zn) ved forskjellige konsentrasjoner og noen av disse, i lave konsentrasjon, representerer næringsstoffer for mikroalger vekst. Uorganiske forurensninger har en høy affinitet til å binde til mikroalgene og videre bli sorbert internt gjennom nærings transportører. Enkelte uorganiske forurensninger (dvs., Co, Cu, Zn og Mn) er næringsstoffer som utgjør en del av enzymer involvererd i fotosyntese, respirasjon og andre funksjoner 3,4. Imidlertid, i overkant metaller og metalloider kan være giftig. Andre elementer, som for eksempel Pb, Cd, Sn, Sb, Se, As og Hg, er ikke kjent for å støtte cellefunksjon på en hvilken som helst konsentrasjon og representerer ikke-næringsmetaller som kan ha negativ innvirkning på vekstkultur 3,5,6. Tilstedeværelsen av noen av disse forurensninger har potensial til å gi negative effekter på mikroalger cellefunksjon. Videre interaksjonen av flere metaller med mikroalger kompliserer vekst dynamikk, og har potensiale til å påvirke veksten.
Storskala økonomi har vært direkte knyttet til produktivitet dyrking system 7-19. Videre er resirkulering medium i mikroalger vekst system for enten åpne kanal dammer (ORP) eller fotobioreaktorer (PBR) kritisk som den representerer 99,9 og 99,4% av massen, henholdsvis 20. Tilstedeværelsen av uorganiske forurensninger i media kan begrense m instansicroalgae produktivitet og resirkulering av media på grunn av forurensning bygge opp. Denne studien eksperimentelt bestemte virkningen av 14 uorganiske forurensninger (As, Cd, Co, Cr, Cu, Hg, Mn, Ni, Pb, Sb, Se, Sn, V og Zn), ved konsentrasjoner som forventes fra integreringen av mikroalgedyrkingssystemer med kull avledet røkgass, på produktiviteten av N. salina vokst i lufttransport PBRs. Forurensningene som brukes i denne undersøkelsen har vist seg å ikke bare være til stede i kullbasert avgass men kommunalt avfallsbasert røkgass, biosolids basert røkgass, kommunalt avløpsvann, produsert vann, svekket grunnvann og sjøvann 21-23. Konsentrasjonene brukt i denne studien er basert på hva som forventes hvis mikroalger vekst systemer ble integrert med en kullbasert CO 2 kilde med en opptakseffektivitet demonstrert i kommersielle PBR systemer 20. Detaljerte beregninger som støtter konsentrasjonene av tungmetaller og uorganiske forurensninger er presentert i Napanet al. 24 analyseteknikker ble brukt for å forstå fordelingen av de fleste av metallene i biomassen, media og miljø. Metodene som presenteres aktivert vurdering av produktivitet potensial for mikroalger i henhold uorganisk forurensning stress og kvantifisering av sin ende skjebne.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Vekst system

Figur 1. Mikroalger vekst system. (A) luft rotometer, (B) CO 2 rotometer, (C) pH-kontroller med solenoid, (D) datalogger, (E) in-line luftfiltre, (F) luftfordeling i mål (G) fluorescerende lys bank, (H) pH-meter, (I) kjølesystem, (J) vannbad, (K) termoelementledning, (L) air lift fotobioreaktoren, (M) varmeapparat, (N) walk-in ryke hette, (O) lufte, (P) luft levering kapillarrør, (Q) luftfiltre, (R) prøvetakingsrøret, (S) PBR silikon lokk, og (T)pH godt i silikon lokk. Klikk her for å se en større versjon av dette tallet.
- Bygg følgende mikroalger eksperimentelle vekst system (figur 1).
- Tilegne tolv lufttransport PBRs består av glass rørreaktorer 4,5 cm i diameter og 80 cm i høyde med dyrking kapasitet på 1,1 liter med silikon lokk. Erverve pre-cut glass kapillærrør (5 mm ytre diameter og 1 mm innvendig diameter) med 10 cm (3 per PBR) og 85 cm (1 per PBR) i lengde.
- Fryse silikon lokk i en -80 ° C fryser. Smør en borekrone med glyserol og mens lokkene er frosset drill 3 hull som vert ventilasjons, prøvetaking og gassleveranser kapillærrør, og 1 hull mm diameter 17 å arrangere en pH probe.
- Sett i 3 kapillarrør på plass med den lengste rør som strekker seg 2 cm fra bunnen av PBR. I det andre kapillærrøret legge en silikonrøret with et kapillarrør forbundet med den andre enden strekker seg til en ønsket prøvetakingspunkt. Dekke hullet for pH-meter med en silikonpropp størrelse 21D.
- Fukte omgivende luft ved å boble det gjennom vann og levere fuktet luft til luftfordelings spissen. Passerer gassen gjennom et 0,2 um filter, og levere den til algesuspensjonen gjennom den lengste glassleverings kapillarrør.
- Levere komprimert CO 2 i den fuktede luftstrømmen for å opprettholde en nøytral pH-verdi på 7,0 ± 0,1 i suspensjonskultur. Kontrollere hastigheten av CO 2 levering med en automatisert CO 2 dispensary system (pH controller) som åpner en magnetisk solenoid når alge kulturen når pH 7,1 og lukker ved pH 6,9.
- Gi lys bruker 24 T5 lysrør som resulterer i en gjennomsnittlig belysning av 984 mikromol m -2 sek -1 lik topp forhold utendørs.
- Senk PBRs i et vannbad for å maintain en konstant temperatur på ca 25 ° C. Styre temperaturen til systemet ved hjelp av en resirkulerende kjøle og en automatisk resirkulerende varme vannbad enhet kontroll.
- Overvåke temperatur og pH i sanntid og ta opp med en datalogger.
- Pass på at alle komponenter i mikroalger vekst systemet er riktig å jobbe, spesielt før høsting mikroalger inoculum eller forbereder uorganiske miljøgifter som de ikke kan bevares.
2. Lab Ware Forberedelse
- Vask volumetriske kolber, PBRs, ballonger og beholdere, med såpe og vann fra springen. Skyll med deionisert vann (DW).
- Acid skylle laboratoriet ware for å eliminere eventuelle spor av uorganiske forurensninger. Dette kan gjøres ved en av to måter:
- Sug lab ware O / N i 10% spormetallkvalitet salpetersyre (OBS: Ikke pust røyk, kan konsentrert salpetersyre gi alvorlig brenning og giftig røyk, arbeid i en avtrekks hood Bruk nitrilhansker, vernebriller og frakk).
- Sug lab ware for 15 min i 50% spormetallkvalitet salpetersyre.
- Skyll lab ware med DW grundig minst tre ganger og pass på at all syre er fjernet. Det er viktig at PBRs er grundig skylt, spesielt Prøverør og kapillarrørene. Unnlatelse av å gjøre dette vil produsere forsuring av mediet og mulig hemming av vekst. Test pH i skyllevannet for å kontrollere all syre er fjernet.
- Steriliser PBRs, containere og kolber ved autoklavering av dem ved 120 ° C og standard atmosfærisk trykk i minst 30 min.
3. N. salina Medium Forberedelse
- Fremstilling av oppløsning A delvis fyller en 1-liters målekolbe med DW. Sett inn en magnetisk rørestav og tilsett kjemikalier vist i tabell 1 etter hverandre. Sørge for at hver ingrediens oppløses før tilsetning av neste bestanddel. Fjern magneten og fyll the kolbe til en L volum mark.
| Component | Beløp legge til (g) | Sluttkonsentrasjon (g / L) |
| H 3 BO 3 | 0.900 | 0.900 |
| Na 2 Moo 4 · 2H 2 O | 0,012 | 0,012 |
| MnCI2 · 4H 2 O | 0,300 | 0,300 |
| ZnSO4 · 7H 2 O | 0,060 | 0,060 |
| CuSO4 · 5H 2 O | 0,020 | 0,020 |
Tabell 1:. Oppløsning A oppskrift Mengdene er mengder som trengs for fremstilling av 1 liter konsentrert løsning.
- Fremstilling av vitamin løsning: I tre separate volumetric kolber legg vitaminer som vist i tabell 2. Filtrer hver vitamin løsningen gjennom et sterilt 0,2 pm filter for å sprøyte en steril beholder. Bevare vitaminer på -4 ° C i mørket.
| Vitaminer | Beløp (mg) | Sluttvolum (ml) | Slutt vitamin konsentrasjon (mg / L) |
| Biotin | 12.22 | 500 | 24.43 |
| Vitamin B12 | 13.50 | 100 | 135.00 |
| Tiaminhydroklorid | 977,63 | 500 | 1,955.27 |
Tabell 2:. Vitamin løsning oppskrift Mengdene er mengder som er nødvendig for fremstilling av konsentrerte oppløsesjon.
- Delvis fylle en 20 L autoklaverbar container med DW og sette inn en magnetisk rørepinne. Plasser beholderen på toppen av en magnetrører plate og legg til kjemikalier som er vist i tabell 3 (bortsett fra vitaminer), og legger dem etter hverandre, og etter hvert fullt oppløses. Fyll beholderen til å nå 20 L.
| Component | Beløp for å legge til middels | Enhet |
| NaCl | 350.00 | g |
| CaCl 2 · 2H 2 O | 3,00 | g |
| KCl | 9,60 | g |
| Na 2 SiO 3 · 9H 2 O | 1.14 | g |
| MgSO4 · 7H 2 O | 29.60 | g |
| 20.40 | g | |
| KH 2 PO 4 | 1,36 | g |
| Ammonium ferricitrat | 0,10 | g |
| Løsning A | 20.00 | ml |
| Biotin løsning * | 818,00 | ul |
| Vitamin B12 løsning * | 296,20 | ul |
| Tiaminhydroklorid løsning * | 521,60 | ul |
| * Legg til avkjølt autoklaveres media |
Tabell 3: N. salina medium oppskrift. Mengder er mengder som trengs i utarbeidelsen av 20 L av næringsrikt medium.
- Steriliser ved autoklavering av mediet i 30 minutter ved 120 ° C og atmosfærisk trykk. La medium COOl ned til RT.
- Plasser beholderen på en magnetrører plate. Legg vitaminer utarbeidet i trinn 3.2 og la mellom bland godt.
4. uorganiske miljøgifter lager forberedelse
- Delvis fylle volumetriske kolber angitt i tabell 4 med DW og legge den enkelte salt oppført. Fyll med DW til ønsket sluttvolum og bland godt. Ikke bevare disse bestandene som noen elementer adsorberes til kolbe vegger
FORSIKTIG: Flere uorganiske miljøgifter som brukes i denne protokollen er kreftfremkallende, teratogene og mutagene, bruke munnbind, hansker og frakk ved håndtering av salter.
| Analytt | Salt kilde | Volumet på lager for å forberede (L) | Salt for å legge til kolben60; (Mg salt) | Analyttkonsentrasjon tilsatt til kulturen (analytt mg / L) |
| Som | NaAsO 2 | 0.1 | 14.8 | 7.74E-02 |
| Cd | CdCl 2 | 0.5 | 13.5 | 1.50E-02 |
| Co | CoCl to .6H 2 O | 0.5 | 34.7 | 1.56E-02 |
| Cr | Na 2 Cr 2 O 7 · 2H 2 O | 0.1 | 40.6 | 1.29E-01 |
| Cu | CuCl2 .2H 2 O | 0.1 | 38.3 | 1.30E-01 |
| Hg | HgCl 2 | 1.0 14.6 | 9.80E-03 | |
| Mn | MnCI2 .4H 2 O | 0.1 | 58.8 | 1.49E-01 |
| Ni | NiCl2 .6H 2 O | 0.1 | 112,0 | 2.51E-01 |
| Pb | PbCI2 | 0.5 | 39.9 | 5.41E-02 |
| Sb | Sb 2 O 3 | 0.5 | 26.7 | 4.06E-02 |
| Se | Na 2 SEO 3 | 0.5 | 11.8 | 9.80E-03 |
| Sn | SnCl2 .2H 2 O | 0.5 | 3.9 | 3.76E-03 |
| V | V 2 O 5 | 0.1 | 22.2 | 1.13E-01 |
| Zn | ZnCI2 | 0.1 | 99.9 | 4.36E-01 |
Tabell 4:. Konsentrert uorganiske forurensninger massetilberedning tilsetning av 1 ml av denne konsentrerte lager til 1,1 L PBR medium frembringer den endelige konsentrasjon som er vist i den siste kolonnen.
- Steril de uorganiske forurensnings aksjer ved å føre oppløsningen gjennom et sterilt 0,2 um sprøytefilter og samle opp filtratet i et sterilt rør.
5. N. salina Inokulum Produksjon
- I en 500 ml Erlenmeyer-kolbe tilsettes 200 ml medium fremstilt i trinn 3, og deretter tilsettes 3 g agar. Dekk med folie kolbe autoklav og aluminium i 20 minutter ved 120 ° C. Hell blandingen i sterile petriskåler og la den avkjøles før den stivner. Dette skal være ferdig være en steril hette eller i det minste i nærheten av en flamme i et rent miljø for å redusere risikoen for smitte.
- Streak N. Salina celler i sterile petri-dishes fremstilt i trinn 5.1 ved bruk av en steril sløyfe såing. Plasser petriskål kulturer på et bord belyst med lys T12 holdt ved romtemperatur. La mikroalger vokse til koloniene er synlige.
- Overfør kolonier til sterilt forbløffet Erlenmeyerkolber inneholder 200 ml næringsrikt medium utarbeidet i trinn 3 og holde dem på et opplyst shaker bord (1000 RPM). La kulturen vokse inntil medium blir grønn.
- Overføre mikroalger til en 1,1 L steril PBR. Plasser PBR i et inokulum vannbad belyst ved 200 umol m sek -2 -1 T8 med fluorescerende lys og opprettholdt ved 23 ° C ved en resirkulerende kjøle og en automatisk resirkulerende varme vannbad kontroll. Juster luft og CO 2 rotometers til 2,5 L min -1 og 25 cc min -1, henholdsvis.
- Etter en uke med vekst delt biomasse til nye 1 0,1 L PBRs inneholdende nytt medium, og la det vokse inntil en total på minst 28 g tørrvekt biomasseoppnås mellom de to reaktorene som kan bestemmes gjennom optisk tetthet.
- Høste inokulum biomassen ved sentrifugering ved 2054 x g i 15 minutter ved 10 ° C ved hjelp av sterile sentrifugerør og sterile teknikker for å unngå forurensning. Kast supernatanten og fortsette cellekonsentrasjonen etter behov.
- Når all biomasse blir sentrifugert, re-suspendere cellene i 300 ml av friskt sterilt medium.
- Fortynn 0,1 ml av mikroalge kultur i 3 ml DW og deretter fortynne 0,1 ml av denne nye løsning i 3 ml DW. Sørg for at prøven er grundig blandet. Måle den optiske tetthet (OD) av mikroalger konsentratet ved 750 nm () umiddelbart ved hjelp av et spektrofotometer.
- Bruke ligning (1) for å bestemme mengden av biomasse i konsentratet.
MERK: Ligning (1) ble oppnådd fra den lineære regresjon mellom versus totale suspenderte faste stoffer (i g / l -1) for N. Salina (R2 = 0,9995). Ligning 1 ble utviklet for spectrophotometer modellen i Materials Table, generere en ny kalibrering hvis du bruker en annen spektrofotometer modell.- Ved hjelp av ligning (2) beregne volumet av mikroalger konsentrat (i L) som er nødvendig for å oppnå en 4 g / l -1 kultur tetthet i en PBR av 1,1 liter volum (i liter).
- Ved hjelp av sterile teknikker, tilsett volumet av mikroalger konsentrat funnet i trinn 5.9 til en Autoclaved PBR for å oppnå en innledende kulturen tetthet på 4 g / l -1. Fyll PBR med medium til 1,1 L. Gjenta dette trinnet til 6 PBRs er vaksinert. Plasser PBRs i pode vannbad.
- La mikroalger i PBRs vokse i 8 dager og deretter høste biomassen (ved å gjenta trinn 5.6 til 5.7). Gjenta trinn 5.8 for å beregne den innledendevolum inokulum for en kultur initial densitet på 1 g / l -1.
6. Eksperimentelle Reaktorer
- Ved hjelp av sterile teknikker tilsettes ca. 1 liter medium fremstilt i trinn 3 til hver av de 12 syre skyllet sterile PBRs. Plasser PBRs i vannbadet av den eksperimentelle vekstsystemet. Slå sparge luft på 1.5 L min -1.
- Sterilisere en kalibrert pH-meter ved å rense den med 70% etanol. Måling av pH i mediet i PBR og sikre at pH-verdien er ca. 7,0; hvis ikke, å gjenta trinn 2 fjernes syreutlutet fra syrerensetrinnet.
- Kalibrere hver pH kontrolleren bruker buffer pH 7, desinfisere sondene bruker etanol (70%) og deretter sette dem i PBRs lokkene.
- Til hver PBR (med unntak av kontroll PBRs) tilsett 1 ml av hver av de sterile uorganiske forurensninger stocks fremstilt i trinn 4. La forurensningene grundig blandes i PBR. Den endelige konsentrasjonen av uorganiske miljøgifter i PBRs er showetn i siste kolonne i tabell 4, og er estimert maksimalkonsentrasjonene forventes fra et kullfyrt kraftverk integrering.
- Legg 14 ml sterilt DW til kontroll PBRs.
- Tilsett konsentrert mikroalger inokulum ble oppnådd i trinn 5,11 til forsøks PBRs for å oppnå en initial kultur tetthet på 1 g / l -1. La biomasse bland godt.
- Slå høy lysintensitet lys (av 984 mikromol m -2 sek -1) og pH-kontrollere på og justere CO 2 til 30 cc min 1. Øke CO 2 strømmen til 50 cc min -1 fra dag 3 etterpå. Initial lavt CO to strømningshastighet er kritisk for å unngå store endringer i pH på grunn av forsinkelser i gass / væske-overføring, og pH-måling.
- Mål og ta prøver etter behov. Sørg for å markere vannstanden etter prøvetaking. (OBS: noen uorganiske miljøgifter i PBR er kreftfremkallende, teratogene og mutagene, bruk hansker og capped beholdere ved håndtering av prøver).
- Legg sterile DW daglig til PBRs for å kompensere for tap på grunn av fordampning.
- Etter 7 dagers vekst, høsting biomassen ved sentrifugering ved 9936 x g og bevare både, biomasse og supernatant medium, ved -80 ° C.
- Frysetørr biomassen ved 0,1 mbar og -50 ° CO / N. Powder biomasse (bruk en slikkepott til pulver biomasse inne sentrifugerøret). Bevar frysetørket biomasse ved -80 ° C.
7. Mikrobølgeovn pasning Fordøyelse av prøver
Fordøyelsen av biomassen prøvene er nødvendig som et pre-prosesstrinn for ICP-MS-analyse.
Merk: Disse trinnene bruker en lukket beholder mikrobølgeovn fordøyelse system med kontrollert trykkavlastning. (OBS: Høyt trykk utvikle seg under syre fordøyelsen, inspisere den fysiske integriteten til fordøyelsen fartøy og skjold, og omskape mikrobølgeovn fordøyelsen fartøyet lokkene før hver bruk).
- Vask Teflon mikrobølgeovn fordøyelsen fartøy med såpe og vann, skyll med DW og la skipene lufttørke. For å fjerne spor metallforurensning i skipene fordøye syre som beskrevet i følgende trinn.
- Omskape mikrobølgeovn fordøyelsen fartøyet lokk og lukk ampullene tett.
- Tilsett 10 ml salpetersyre til hver.
- Introduser fartøyet i sikkerhetsskjoldet. Sikre at ingen biomasse, vann eller andre reagenser er igjen på veggene av beskyttelsesskjoldet eller i de ytre veggene av fordøyelses fartøyer for å unngå skade på beskyttelsesskjoldet. Cap beskyttelsesskjoldet med sikkerhetsventilen gjør at fjæren i hetteglasset er flush. Finn skjoldet på rotoren med hetten vents peker utover i den ytre raden og innover i indre rad.
- På fartøy nummer én, må du sette den keramiske termolommen og temperatursensoren. Dette termometeret overvåker den faktiske interne temperaturen i hetteglass og fungerer som den kontrollerende parameter for å utføre fordøyelsen progrer. Sørg for at hette nummer én inneholder de samme prøvemateriale og reagensvolumer beløp som de andre ampuller.
- Input fordøyelsen parametere vist i tabell 5 og starte fordøyelsen. Når programmet er ferdig, luft kjøle ned flaskene før de når RT.
| Trinn | Ampuller skylle | Prøve fordøyelsen | ||||
| Temperatur (° C) | (Min) | Maks. Effekt (W) | Temperatur (° C) | (Min) | Maks. Effekt (W) | |
| 1 | RT 190 | 25 | 1000 | RT 180 | 15 | 1000 |
| 2 | 190 | 10 | 1000 | 180 | 15 | 1000 |
| - | 20 | - | - | 20 | - |
Tabell 5: Parametere brukt i mikrobølgeovn fordøyelsen program.
- Inne i en avtrekkshette, setter trykkavlastning verktøyet på skjoldet cap med cap vents peker bort fra deg. Når trykket slippes åpne lokket (OBS: Alltid åpne fordøyd ampuller inne avtrekk siden biomasse fordøyelsen bruker syre produserer giftige gasser).
- Kast den syre. Skyll Teflon fartøy med DW 3 ganger. La hetteglass lufttørke.
- Å fordøye biomasse, legge til 50 mg frysetørket biomasse til mikrobølge fordøyelsen fartøy. For kvalitetskontroll (QC) utarbeide følgende hetteglass: i to forskjellige ampuller legge til enten 5 ml Nivå 7 ICPMS eller 5 ml Nivå 7 Hg CVAAS standard utarbeidet i trinn 9.1 og 10.1 (fordøyd løsning fra denne flasken kalles laboratoriet befestet blank (LFB)), la en annen beholder tom (den fordøyd løsningfra denne ampulle kalles laboratoriet reagensblindprøve (LRB)).
- Å fordøye medium, tilsett 10 ml supernatant medium tørke syre skylles mikrobølgeovn fordøyelsen fartøy. For kvalitetskontroll (QC) utarbeide følgende hetteglass: I to forskjellige ampuller tilsett 5 ml Nivå 7 ICPMS eller CVAAS metall standard utarbeidet i trinn 9.1 og 10.1 (fordøyd løsning fra denne flasken kalles LFB), til et annet hetteglass legge 10 ml DW (fordøyd oppløsningen fra denne ampulle kalles LRB).
- Omskape mikrobølgeovn fordøyelsen fartøyet lokk og lukk ampullene tett.
- Legg 7 ml konsentrert spormetallkvalitet salpetersyre og 3 ml hydrogenperoksid til hver ampulle. Homogen innholdet ved forsiktig virvlende løsningen. Fordøye innholdet i hetteglassene ved å gjenta trinn 7.4 til 7.7 (bruke mikrobølgeråtne parametrene for prøve fordøyelse i tabell 5).
- Legg fordøyd prøven til en 25 ml målekolbe, skylling fartøyene med DW for økt utvinning. Fyll målekolbe med DWtil merket.
- Transfer fordøyd prøver til en avkortet container. Preserve prøver ved 4 ° C inntil analyse kan fullføres. For denne studien analysen er gjort samme dag for Hg og innen tre dager for de andre elementene.
8. kvalitetskontroll (QC) Samples
Merk: Analyser QC prøver for å sikre påliteligheten av resultatene fra eksperimentelle prøver.
- Delvis fylle en syre skylles en L målekolbe med DW. Legg 280 ml konsentrert spormetallkvalitet salpetersyre og bland (denne oppløsning er også kalt blindoppløsning) (FORSIKTIG: alltid legge syre til vann, aldri tilsett vann til syre som den eksoterme reaksjon kan være voldsomme). La løsningen kult å RT.
- I tillegg til QC prøver fremstilt i trinn 7,9 og 7,10, forberede følgende QC prøvene.
- For den videre kalibrering godkjenning (CCV): Fyll en polystyren rør med kalibrering standard (for fremstilling setrinn 9.2 og 10.1). Sett Hg standard løsning på CVAAS rack og de ICPMS standard løsning i ICPMS autosampler.
- For den videre kalibrering blank (CCB): Fyll to polystyrenrør (16 ml) med blank (løsning utarbeidet i trinn 8.1). Plasser den ene prøven i CVAAS rack og den andre prøven i ICPMS autosampler.
- For laboratoriet-befestet matrise (LFM): tilfeldig velge en prøve av hver 12 prøver for hver type prøve (dvs. biomasse eller medium) og bruke den til å forberede en LFM. For ICPMS, tilsett 0,5 ml av ICPMS standard nivå 7 og 3 ml spaltet eksperimentell prøve (fra enten biomasse eller medium) til en polystyren-rør.
- Bland innholdet og plassere flaskene på ICPMS autosampler. For CVAAS, tilsett 2 ml Hg standard Nivå 7 og 6 ml spaltet eksperimentell prøve (fra enten biomasse eller medium) til en polystyren-rør. Bland innholdet og plassere ampuller på CVAAS rack.
- For duplikatprøvene: tilfeldig velge en prøve av noensinney 12 prøver av hver type matrise (for eksempel biomasse, medium, LFM eller en hvilken som helst fortynnet matrix) og duplisere hetteglasset. Plasser gjentatte hetteglassene i ICPMS automatiske prøvetakeren eller CVAAS rack.
- For duplikatprøvene: tilfeldig velge en prøve av hver 12 sampler for hver type matrise (for eksempel biomasse, medium, LFM eller en hvilken som helst fortynnet matrix) og duplisere hetteglasset. Plasser gjentatte hetteglassene i ICPMS automatiske prøvetakeren eller CVAAS rack.
- Definer data kvalitetskriterier for studien. For denne studien duplisere kvalitetskriteriene fastsatt av Eaton, Clesceri, Rice og Greenberg 25. Parametrene som er fastsatt for QC er: prosent forskjell (% D) for CCV innenfor ± 10% 25 (med unntak av Pb og Sb, se omtale), LFB prosent recovery (% R) innenfor ± 70-130% 25 LFM prosent utvinning (% R) innenfor 75-125% 25, og relativ prosent forskjell (RPD) innenfor ± 20% 25, og et kontinuerlig CAlibration blank (CCB) under metode rapportering grense (MRL) 25. Se beregnings ligninger i trinn 9.7.
9. Kvantifisering av induktivt koblet plasma massespektrometri (ICPMS)
- På dagen for analyse overfører omtrent 5 ml fordøyd prøve å polystyrenrør og plassere dem i ICPMS autosampler. Tilsett ca 15 ml fordøyd prøver å polystyrenrør og plassere dem i CVAAS rack.
- Samme dag analyse klarkalibreringsstandardene. Legg kjøpt ICPMS standardløsning og fyll med blank (oppløsningen fremstilt i trinn 8.1) som beskrevet i tabell 6 (se standardoppløsning beskrivelse i Material tabell) til syre-vasket volumetriske kolber.
| Parameter | Nivå 1 | Nivå 2 | Nivå 3 | Nivå 4 | Nivå 5 | Nivå 6 | Nivå 7 |
| Innkjøpt standard for å bli tilsatt (ml) | - | - | - | - | - | - | 10,0 |
| Nivå 7 som skal tilsettes (ml) | 0.0 | 1.0 | 2.5 | 5.0 | 20.0 | 25,0 | - |
| Sluttvolum (ml) | - | 50.0 | 50.0 | 50.0 | 100,0 | 50.0 | 100,0 |
| Sluttkonsentrasjon (ug / l) | |||||||
| 75 As | 0.0 | 2.0 | 5.0 | 10,0 | 20.0 | 50.0 | 1000,0 |
| 111 Cd | 0.0 | 1.0 | 2.5 | 5.0 | 10,0 | 25,0 | 50.0 |
| 59 Co | 0.0 | 10,0 | 25,0 | 50.0 | 100,0 | 250,0 | 500,0 |
| 52 Cr | 0.0 | 2.0 | 5.0 | 10,0 | 20.0 | 50.0 | 100,0 |
| 63 Cu | 0.0 | 5.0 | 12.5 | 25,0 | 50.0 | 125,0 | 250,0 |
| 55 Mn | 0.0 | 3.0 | 7.5 | 15.0 | 30.0 | 75.0 | 150,0 |
| 60 Ni | 0.0 | 8.0 | 20.0 | 40.0 | 80.0 | 200,0 | 400,0 |
| 208 Pb | 0.0 | 1.0 | 2.5 | 5.0 | 10,0 | 25,0 | 50.0 |
| 121 Sb | 0.0 | 12.0 | 30.0 | 60.0 | 120.0 | 300,0 | 600,0 |
| 51 V | 0.0 | 10,0 | 25,0 | 50.0 | 100,0 | 250,0 | 500,0 |
| 66 Zn | 4.0 | 10,0 | 20.0 | 40.0 | 100,0 | 200,0 | |
| * Oppnå dette volum ved å tilsette oppløsningen fremstilt i trinn 8.1 | |||||||
Tabell 6: Konsentrasjon av kalibreringsstandarder Levels 1-7..
- Fjern kjeglene fra ICPMS og sonicate dem i 1 minutt i DW. Tørk kjegler og sette dem tilbake i instrumentet.
- Slå på vannkjøleren, gasser (Ar, H 2, He), den ICPMS, plug linjer til intern standard, og fylle auto-sampler skylle beholdere (DW, 10% salpetersyre, 1% salpetersyre + 0,5% saltsyre) .
- Åpne Masshunter Workstation-programvaren og slå på plasma, tune den ICPMS og laste metoden satt til parametere i tabell 7.
| Parametere Verdier | |||||||||
| Interne standarder | 72 Ge, 115 I | ||||||||
| Rf makt | 1500 W | ||||||||
| Plasma gasstrømningshastigheten | 14.98 | ||||||||
| Forstøveren gasstrømningshastigheten | 1,1 liter / min (bæregass kombinert og fortynning - 0,6 + 0,5 L / min) | ||||||||
| Sampling kjegle | Nikkel for x linse | ||||||||
| Skimmer kjegle | Nikkel | ||||||||
| Sample opptaksraten | 0,3 rps | ||||||||
| Nebulizer pumpe | 0,1 rps | ||||||||
| S / C temperatur | 2 ° C | ||||||||
| Skanning tilstand | Holdetid 1 sek, antall replikere 3 | ||||||||
| H 2 gasstrømmen | N / A | ||||||||
| Han gasstrømmen | 4,3 ml / min | ||||||||
| Parameter | Nivå 1 | Nivå 2 | Nivå 3 | Nivå 4 | Nivå 5 | Nivå 6 |
| L7 Hg standard for å bli tilsatt (ml) | 0 | 1 | 2.5 | 5 | 20 | 25 |
| Sluttvolum (ml) | - | 50 | 50 | 50 | 100 | 50 |
| Sluttkonsentrasjon (ug / l) | 0 | 0.5 | 1,25 | 2.5 | 5 | 12.5 |
| * Oppnå dette volum ved å tilsette oppløsningen fremstilt i trinn 8.1 | ||||||
Tabell 8: Konsentrasjon av Hg kalibrering standard Levels 1-6..
- Åpne Ar gass og luftventil, slå på Atomic Absorpsjon spektrofotometer og Flow Injection Atomic spektroskopi (FIAS). Åpne CVAAS Winlab programvare, slå på Hg lampe og la den varmes opp før programvaren energi parameter når 79. Load programmet for Hg analyse med parametrene i tabell 9. Juster lysbanen i instrumentet for å gi maksimal transmisjon.
| Parametere | Verdier |
| Bæregass | Argon, 100 ml / min |
| Lampe | Hg electrodeless utladningslampe, oppsettet på 185 mA |
| Bølgelengde | 253,7 nm |
| Slit | 0.7 nm |
| Cell temperatur | 100 ° C |
| Prøvevolum | 500 mL |
| Carrier | 3% HCl, 9,23 ml / min |
| Reduksjons | 10% SnCl2, 5,31 ml / min |
| Måling | Topphøyde |
| Les gjentak | 3 |
Tabell 9: CVAAS driftsforhold.
- Plugg linjen til bæreroppløsningen fremstilt av 3% spormetallkvalitet saltsyre.
- Plugg linjen til reduksjonsmiddeloppløsningen er laget av 10% tinnklorid (egnet for analyse Hg) i 3% spormetallkvalitet saltsyre. Forberede denne løsningen samme dag av analysen som det er utsatt for atmosfærisk oksidasjon (OBS: Stannoklorid er svært farlig, bruke verneklær når du arbeider med det Samle CVAAS avfall i farlig forurensning og skikkelig kast.).
- Plasser Hg standarder, QC prøver og eksperimentelle prøver i CVAAS rack og innspill sekvensen i CVAAS Winlab programvare. Kjør standarder og generere kalibreringsligningen.
- Kjør QC samsipper og eksperimentelle prøver. Den CVAAS trekker omtrent 5 ml av prøven inn i instrumentet, reduserer Hg til stede i prøven til elementært Hg (Hg 0) gass og renser gassen fra oppløsningen med en bæregass (Ar) i et lukket system. Den Hg damp passerer gjennom en celle i Hg lampe lysbanen. En detektor bestemmer lys som absorberes ved 253,7 nm og relaterer den til konsentrasjon. (OBS: Hg damp er giftig, sikre instrument avtrekksvifte er på plass).
- Beregn% R,% D og RPD i trinn 9.7 under analyse og sammenligne resultatene til prosjekt data kvalitetskriterier.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Biomasse utbytter
Produksjon av N. salina i PBR-systemet brukt i denne studien økte fra 1 g / l -1-8,5 ± 0,19 g / l -1 (N = 12) for kontroll reaktorer og 4,0 ± 0,3 g / l 1 (N = 12) for multi-metal forurenset i syv dager. Forsøkene produsert repeterbare data på tvers tredoble reaktorer og flere partier. Figur 2A viser gjennomsnittlig kultur tetthet med svært liten standard feil basert på prøvetaking fra tre uavhengige PBRs. For å sikre dette resultatet var ikke en isolert resultat ble tre mer batcher vokst med lignende resultater. De kombinerte resultater for alle fire grupper er vist i figur 2B. Selv om biologiske variasjoner eksisterer, viser denne undersøkelsen at det er en jevn negativ innvirkning av uorganiske forurensninger til N. salina produksjon. Biomassen rentene i forurensnings utsatt PBRs var statistisk forskjellig kontroll PBRs fradag 2 og utover (ANOVA, p <0,05).
Kvalitetskontroll vurdering av uorganisk forurensning kvantifisering
Tolv av de fjorten elementer analysert var fullstendig gjenvinnbar etter oppslutning som vist med LFB% R% R med nær 100%, noe som indikerer ingen tap, ingen effekt og ingen kryss-kontaminering av analytter under fordøyelsen (tabell 10). Ved kvantitativ analyse av prøver% D og RPD ble overvåket gjennom hele analysen, og gjennomsnittet av resultatene er vist i tabell 10. As, Cd, Co, Cr, Cu, Hg, Mn, Ni, Pb, Sb, V og Zn passert den% D og RPD, men% D for Pb og Sb gradvis falt under analysen. Den% D for disse elementene er forbedret etter kjegle rengjøring, men er konstant kjegle rengjøring upraktisk, og derfor dataene kvalitetsmål for Pb og Sb ble senket. CCB for alle analyttene var også under MRL. Matrix effekter ble vurdert ved å analysere LFM prøver og skaffe% R. While Co, Hg, V og Sb bestått QC data kriteriene, var det ikke bestått av As, Cd, Cr, Cu, Mn, Ni, Pb og Zn når fordøyde biomassen Prøvene ble analysert, noe som resulterer i% under R QC mål. Matrix fortynning i DW til et forhold på 1: 3 (oppløst stoff: løsningsmiddel) resulterte i R% som passerte data kvalitetskriterier. Matrix effekter ble også observert i løpet av analysen av fordøyd og supernatanten ble adressert av den samme fortynningsforholdet (tabell 10) slik at fortynningen ikke kompromitterer deteksjonsgrensen til instrumentet. Problemer med påvisning av Se og Sn ble observert basert på ustabile opplesninger og en forurensning problem, henholdsvis. Den ustabile avlesninger for Se er knyttet til salter i matrisen 27. Den Sn kontaminering ble sporet tilbake til en syre anvendes i digereringstrinnet.
| Analytt | R | CCV | LFB | LFM for biomasseprøver | LFM for supernatantprøver | ||||
| % D | % R | Fortynningsforhold | % R | RPD | Fortynningsforhold | % R | RPD | ||
| QC begrenser 25 | 0,9950 | ± 10 | 70-130 | - | 75-125 | ± 20 | - | 75-125 | ± 20 |
| Som | 0,9998 | 1.8 | 101,0 | 1. 3 | 100,4 | 5.2 | 1. 3 | 92.5 | -0.5 |
| Cd | 1,0000 | 1.4 | 102,6 | 1. 3 | 103,5 | 4.6 | None | 92.3 | 0.6 |
| Co | 0,9997 | 1.7 | 98,8 | None | 95.2 | -1,4 | None | 96.5 | -1,5 |
| Cr | 0,9999 | 1.5 | 99,8 | 1. 3 | 96.5 | 1.8 | 1. 3 | 90.1 | -0.8 |
| Cu | 0,9999 | 2.9 | 98.2 | 1. 3 | 101,4 | 4.8 | 1. 3 | 94,4 | -0.5 |
| Hg | 0,9983 | -1,7 | 103,0 | None | 98.7 | 1.5 | None | 98.0 | 0.3 |
| Mn | 0,9998 | 2.9 | 97,6 | 1. 3 | 83.2 | 1.8 | 1. 3 | 95,4 | -1,7 |
| Ni | 0,9999 | 103,5 | 1. 3 | 98.5 | 2.1 | None | 93,3 | -0.9 | |
| V | 0,9998 | 2.5 | 97.2 | None | 95.5 | -1,5 | None | 101,2 | -1,9 |
| Pb | 0,9998 | 12.6 | 105,2 | 1. 3 | 88.9 | 0.0 | None | 93,5 | -0.5 |
| Sb | 0,9998 | 1.1 | 105,7 | None | 101,8 | -9,6 | None | 90.8 | -1,2 |
| Zn | 0,9997 | 5.2 | 120,8 | 1. 3 | 90,7 | 1.4 | None | 89.2 | -1,9 |
Tabell 10: Sammendrag av resultatene av kvalitetskontrollprøver. R = correlation koeffisient,% D: prosent forskjell,% R: prosent oppgang, RPD = relativ prosent forskjell, fortynningsforhold refererer til oppløst stoff: løsemiddel forholdet.
Uorganiske miljøgifter konsentrasjoner
Heavy metal og uorganiske forurensninger ble funnet i både biomasse og supernatant medium. Konsentrasjonene funnet i biomassen for de 12 elementene er analysert, er vist i figur 3. Konsentrasjonene i biomassen høstet fra triplikate PBRs (N = 3) i batch # 1 viser et meget lite standardfeil (figur 3A). Ved å kombinere data fra triplikate PBRs fra fire grupper konsekvent viser at uorganiske forurensninger er tilstede i biomassen (N = 12). Konsentrasjonene ble funnet i supernatanten medium er vist i figur 4. Resultatene viser triplikate PBRs (N = 3) for batch # 1 har også liten standardfeil (figur 4A), og viser at de fleste forurensninger fortrinnsvis ble plassert i biomassen leading til meget lave konsentrasjoner i supernatanten med flere prøvekonsentrasjoner nær MRL av instrumentet. Resultater fra alle fire satser er vist i figur 4B.
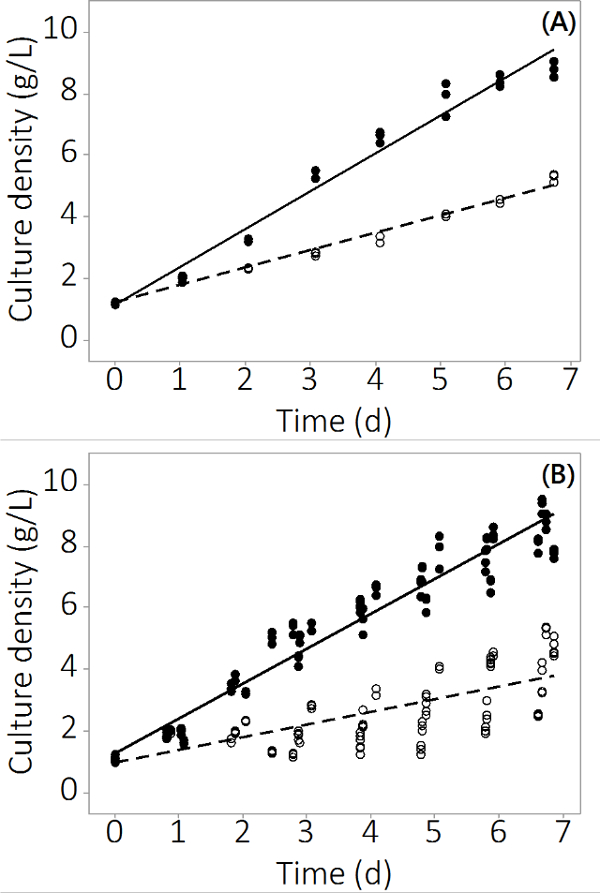
Figur 2. C ruk konsentrasjon over dyrking perioden for forurensede og kontroll PBRs. (A) Kultur tettheten i batch # 1, resultater fra n = 3 PBRs. (B) Kultur tetthet i fire grupper, resultater fra N = 12 PBRs. Tomme sirkler representerer forurenset biomasse, fylte sirkler representerer kontrollen.
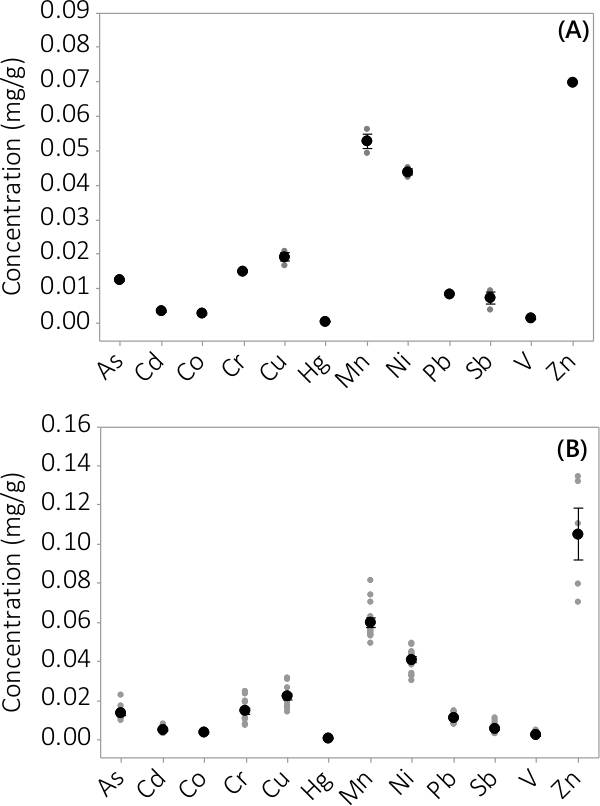
Figur 3. Konsentrasjon av uorganiske forurensninger i biomassen. (A) Konsentrasjon i batch #1 resultater fra N = 1 PBR for Zn og N = 3 PBRs for alle de andre analytter, (B) Konsentrasjon fra fire partier, resultater fra N = 4 PBRs for Zn og N = 12 PBRs for alle de andre analytter. Gjennomsnittlig konsentrasjon er representert ved sorte fylte sirkler, er individuelle datapunkter representert av grå fylte sirkler. Feilstolpene representerer en ± standardfeil av middelverdien.
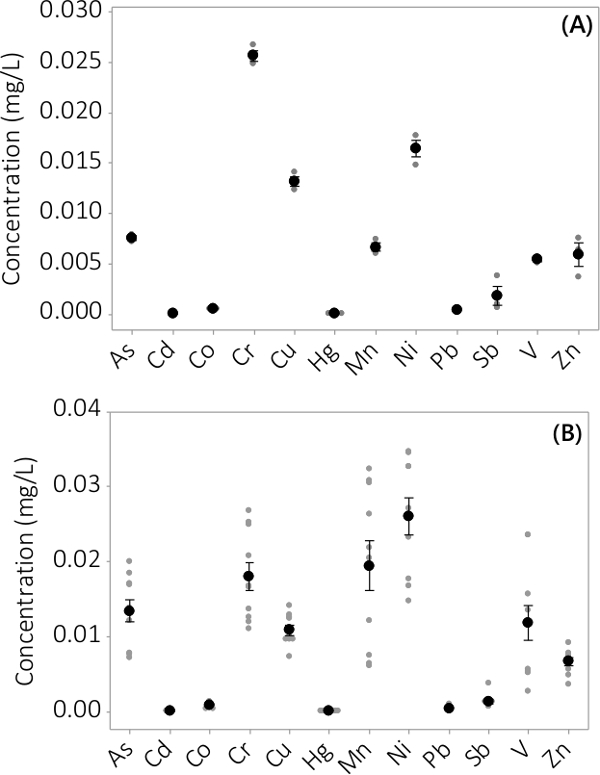
Figur 4. Konsentrasjon av uorganiske forurensninger i supernatanten. (A) Konsentrasjon i batch # 1, resultatene fra n = 3 PBRs, (B) Konsentrasjon av 4 grupper, resultater fra n = 12 PBRs. Gjennomsnittlig konsentrasjon er representert ved sorte fylte sirkler, er individuelle datapunkter representert av grå fylte sirkler. Feilstolpene representerer en ± standardfeil av middelverdien.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Saline mikroalger N. salina kan være vellykket dyrkes i designet vekst system med repeterbare resultater og høye biomasse avkastning. Airlift blandingen tillatt for en godt blandet suspendert kultur med minimal bosetting eller begroing i løpet av de syv dagers vekstperioder. Den minimale lys variasjon over fluorescerende lys banken er også vist å ikke gi merkbare forskjeller i vekst.
Studien viser heavy metal forurenset media ved konsentrasjoner representant for integrasjon med kull røykgass negativt påvirker biomassevekst. Repeterbarhet i studien fremhever virkningen multi-metal-systemet har på produktiviteten. Ulike trinn i prosessen har potensial til å negativt påvirke vekst og forurense system som krever flittig eksperimentell forberedelse. Bestemmelse av pH i mediet før eksperimentet er en QC trinn som gir mulighet for kontroll av at mediet ikke blir surgjort (f.eks resulting av feil PBR skylling etter syre soaking). Syrnet medium vil påvirke algevekst og endre nærings biotilgjengelighet (f.eks endringer i uorganisk karbon arts og metaller arts) og dermed påvirker samspillet mellom algebindingsseter, næringsstoffer og metaller. Den omhyggelig forberedelse av laboratorieutstyr for disse studiene var nødvendig slik at en nøyaktig massebalansen av de innførte metaller kan utføres. Andre trinn i prosessen har potensial til å innføre rede for metaller fremhever behovet for bruk av riktig klasse løsemidler og kjemikalier. Riktig QC gjennom prosessen effektivt kan identifisere innføring av tungmetallforurensninger.
Resultatene viser innført forurensninger fordeles mellom biomasse (figur 3), medium (figur 4) og miljø. Uorganiske miljøgifter som finnes i slakte N. salina tyder på at dette mikroalger vil incorporate flere av de uorganiske forurensninger som er tilstede i avgassene. Dette assimilering kan være et resultat av adsorpsjon på cellevegger på grunn av ladede bindingsseter, absorpsjon inne i cellen på grunn av metabolsk aktivitet, og utfelling av kompleksene dannet med elementer til stede i mediet 28. Visuelt reaktorene med uorganiske miljøgifter etter et par dager dukket gul i fargen i forhold til mørk grønn av kontroll reaktorer. Forurenset slaktet biomasse var ikke visuelt forskjellig fra forurensningen frie biomasse etter pellet dannelse etter høsting ved sentrifugering. Den visuelle fargeforskjell før høsting er knyttet til en lavere tetthet av biomasse og stresset mikroalger. Forurensninger som ikke er fjernet i biomassen har potensial til å akkumulere i media som illustrert i figur 4. Akkumulering i media representerer et potensial for å begrense omfanget som resirkulering media representerer en nødvendighet for økonomisk levedyktighet. Begrensningen ville bli diktertav toleranse for tungmetallforurensninger som vil være artsspesifikk. Resultatene av denne studien fremheve behovet for å bedre forstå de potensielle negative virkninger på å integrere mikroalger vekst systemer med avfall karbonkilder, spesielt kull basert røykgass. Resultatene fra denne studien fremheve behovet for å forstå produktivitets implikasjonene av andre forurensninger som forventes å være til stede i røykgass som oksider av svovel og nitrogen, fint støv, og organiske miljøgifter som polyklorerte dibenzo dioksiner og dibenzo furaner. Tidligere te og LCA vurderinger har antatt en sømløs integrering uten å vurdere konsekvensene av forurensninger som tungmetaller og uorganiske miljøgifter på produktivitet. Generelt er resultatene fra dette arbeidet fremheve virkningen av en multi-metall-systemet på produktivitet og kan brukes til å forstå potensialene for mikroalger til bioremediate forurensninger.
Metodikken present tillatt for the studie av uorganiske miljøgifter med repeterbare resultater for mikroalger. Noen uorganiske forurensninger som anvendes i dette forsøk er som tradisjonelt finnes i vekst systemer ved lave konsentrasjoner, men de andre ikke har en kjent funksjon i cellen. Som et resultat av den multi-element blanding av As, Cd, Co, Cr, Cu, Hg, Mn, Ni, Pb, Sb, Se, Sn, V og Zn på den konsentrasjon som er vist i tabell 4, inhiberte vekst. Kvantifisering av mengden av forurensninger i biomassen kan vise seg å være vanskelig i multi-metall-systemer. Ofte kan prøver med høyt innhold av organiske stoffer og salter produsere matrix forstyrrelser, polyatomic forstyrrelser, fysiske forstyrrelser og salt bygge opp kjegler som til slutt fører til unøyaktige målinger og tap av analytisk nøyaktighet 29,30. Kvalitetskontroll prøvene kjøres sammen med de eksperimentelle prøver bidratt til å bestemme nøyaktighet og presisjon av målingene. Måling av analytter ved bruk av protokollene som er utviklet for denne undersøkelsen har vist seg å være enccurate og presis produsere akseptable inngang som er innenfor akseptabel ytelse for denne typen studier 25,29. Fordøyelse av prøver av mikrobølgeovnen ble vist å være effektive for N. salina som fordøyd prøvene var klare uten tilstedeværelse av celleavfall eller blandbare deler. Matrisen brukes i denne eksperimenter (alger biomasse og kunstig sjøvann) produsert matrise forstyrrelser som ble overvunnet av matrix fortynning. Imidlertid kan høyere biomasse utvalgsstørrelser enn de som brukes i dette eksperimentet føre til matrise forstyrrelser, og derfor QC bør analyseres for hvert enkelt scenario.
Subscription Required. Please recommend JoVE to your librarian.
Materials
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Sodium chloride | Fisher Scientific | S271-3 | |
| Calcium chloride dihydrate | Fisher Scientific | C79-500 | |
| Potassium chloride | Fisher Scientific | P217-500 | |
| Sodium meta silicate nonahydrate | Fisher Scientific | S408-500 | |
| Magnesium sulfate heptahydrate | Fisher Scientific | M63-500 | |
| Potassium nitrate | EMD Chemical | PX1520-5 | |
| Potassium phosphate monobasic | Fisher Scientific | P285-500 | |
| Ammonium ferric citrate | Fisher Scientific | I72-500 | |
| Boric acid | Fisher Scientific | A73-500 | |
| Sodium molybdate, dihydrate | EMD Chemical | SX0650-2 | |
| Manganese chloride tetrahydrate | Fisher Scientific | M87-500 | |
| Zinc sulfate heptahydrate | Fisher Scientific | Z68-500 | |
| Cupric sulfate pentahydrate | Fisher Scientific | C489-500 | |
| Biotin | Acros Organics | 230090010 | |
| Thiamine | Acros Organics | 148990100 | |
| Vitamin B12 | Acros Organics | 405920010 | |
| Copper (II) chloride dihydrate | Sigma-Aldrich | 221783-100G | Irritant, Dangerous to the Environment |
| Lead (II) chloride | Sigma-Aldrich | 268690-250G | Toxic, Dangerous to the Environment |
| Sodium dichromate dihydrate | Sigma-Aldrich | 398063-100G | Oxidizing, Highly Toxic, Dangerous to the Environment |
| Cobalt (II) chloride hexahydrate | Sigma-Aldrich | 255599-100G | Toxic, Dangerous to the Environment |
| Nickel (II) chloride hexahydrate | Sigma-Aldrich | 223387-500G | Toxic, Dangerous to the Environment |
| Sodium (meta) arsenite | Sigma-Aldrich | 71287 | Toxic, Dangerous to the Environment |
| Cadmium chloride | Sigma-Aldrich | 202908-10G | Highly Toxic, Dangerous to the Environment |
| Mercury (II) chloride | Sigma-Aldrich | 215465-100G | Toxic, Dangerous to the Environment |
| Tin (II) chloride dihydrate | Fisher Scientific | T142-500 | Corrosive. Suitable for Hg analysis. Very hazardous. |
| Manganese chloride tetrahydrate | Fisher Scientific | M87-500 | |
| Vanadium (V) oxide | Acros Organics | 206422500 | Dangerous to the Environment |
| Carbon dioxide | Air Liquide | I2301S-1 | Compressed |
| Hydrogen peroxide | H325-500 | Fisher Scientific | 30% in water |
| ICP-MS standard | ICP-MS-6020 | High Purity Standards | |
| Mercury standard | CGHG1-1 | Inorganic Ventures | 1000±6 µg/mL in 5% nitric acid |
| Argon | Air Liquide | Compressed | |
| Helium | Air Liquide | Compressed, ultra high purity | |
| Hydrogen | Air Liquide | Compressed, ultra high purity | |
| Nitric acid | Fisher Scientific | A509-P212 | 67-70% nitric acid, trace metal grade. Caution: manipulate under fume hood. |
| Hydrochloric acid | Fisher Scientific | A508-P212 | 35% hydrochloric acid, trace metal grade. Caution: manipulate under fume hood. |
| Equipment | |||
| Scientific prevacuum sterilizer | Steris | 31626A | SV-120 |
| Centrifuge | Thermo Fisher | 46910 | RC-6 Plus |
| Spectrophotometer | Shimadzu | 1867 | UV-1800 |
| pH controller | Hanna | BL981411 | X4 |
| Rotometer, X5 | Dwyer | RMA-151-SSV | T31Y |
| Rotometer, X5 | Dwyer | RMA-26-SSV | T35Y |
| Water bath circulator | Fisher Scientific | 13-873-45A | |
| Compact chiller | VWR | 13270-120 | |
| Freeze dryer | Labconco | 7752020 | |
| Stir plate | Fisher Scientific | 11-100-49S | |
| pH lab electrode | Phidgets Inc | 3550 | |
| Inductively coupled plasma mass spectrometer | Agilent Technologies | 7700 Series ICP-MS | Attached to autosampler CETAC ASX-520 |
| FIAS 100 | Perkin Elmer Instruments | B0506520 | |
| Atomic absorption spectrometer | Perkin Elmer Instruments | AAnalyst 800 | |
| Cell heater (quartz) | Perkin Elmer Instruments | B3120397 | |
| Microwave | Milestone | Programmable, maximum power 1,200 W | |
| Microwave rotor | Milestone | Rotor with 24-75 ml Teflon vessels for closed-vessel microwave assisted digestion. | |
| Materials | |||
| 0.2 μm syringe filter | Whatman | 6713-0425 | |
| 0.2 μm syringe filter | Whatman | 6713-1650 | |
| 0.45 μm syringe filter | Thermo Fisher | F2500-3 | |
| Polystyrene tubes | Evergreen | 222-2094-050 | 17 x 100 mm w/cap, 16 ml, polysteryne |
| Octogonal magnetic stir bars | Fisher scientific | 14-513-60 | Magnets encased in PTFE fluoropolymer |
References
- Dismukes, G. C., Carrieri, D., Bennette, N., Ananyev, G. M., Posewitz, M. C. Aquatic phototrophs: efficient alternatives to land-based crops for biofuels. Curr Opin Biotechnol. 19 (3), 235-240 (2008).
- Moody, J. W., McGinty, C. M., Quinn, J. C. Global evaluation of biofuel potential from microalgae. Proceedings of the National Academy of Sciences. 111 (23), 8691-8696 (2014).
- Pinto, E., et al. Heavy metal-induced oxidative stress in algae. J Phycol. 39 (6), 1008-1018 (2003).
- Gupta, A., Lutsenko, S. Evolution of copper transporting ATPases in eukaryotic organisms. Curr Genomics. 13 (2), 124-133 (2012).
- Perales-Vela, H. V., Peña-Castro, J. M., Cañizares-Villanueva, R. O. Heavy metal detoxification in eukaryotic microalgae. Chemosphere. 64 (1), 1-10 (2006).
- Sandau, E., Sandau, P., Pulz, O. Heavy metal sorption by microalgae. Acta Biotechnol. 16 (4), 227-235 (1996).
- Amer, L., Adhikari, B., Pellegrino, J. Technoeconomic analysis of five microalgae-to-biofuels processes of varying complexity. Bioresour Technol. 102 (20), 9350-9359 (2011).
- Benemann, J. R., Goebel, R. P., Weissman, J. C., Augenstein, D. C. Microalgae as a source of liquid fuels. Final Technical Report, US Department of Energy, Office of Research. , (1982).
- Benemann, J. R., Oswald, W. J. Report No. DOE/PC/93204--T5 Other: ON: DE97052880; TRN: TRN. Systems and economic analysis of microalgae ponds for conversion of CO2 to biomass. , (1996).
- Chisti, Y. Biodiesel from microalgae. Biotechnol Adv. 25 (3), 294-306 (2007).
- Davis, R., Aden, A., Pienkos, P. T. Techno-economic analysis of autotrophic microalgae for fuel production. Applied Energy. 88 (10), 3524-3531 (2011).
- Jones, S., et al. Process design and economics for the conversion of algal biomass to hydrocarbons: whole algae hydrothermal liquefaction and upgrading. U.S. Department of Energy Bioenergy Technologies Office. , (2014).
- Lundquist, T. J., Woertz, I. C., Quinn, N. W. T., Benemann, J. R. A realistic technology and engineering assessment of algae biofuel production. Energy Biosciences Institute. , Berkeley, CA. (2010).
- Nagarajan, S., Chou, S. K., Cao, S., Wu, C., Zhou, Z. An updated comprehensive techno-economic analysis of algae biodiesel. Bioresour Technol. 145, 150-156 (2011).
- Pienkos, P. T., Darzins, A. The promise and challenges of microalgal-derived biofuels. Biofuels Bioproducts & Biorefining-Biofpr. 3, 431-440 (2009).
- Richardson, J. W., Johnson, M. D., Outlaw, J. L. Economic comparison of open pond raceways to photo bio-reactors for profitable production of algae for transportation fuels in the Southwest. Algal Research. 1 (1), 93-100 (2012).
- Rogers, J. N., et al. A critical analysis of paddlewheel-driven raceway ponds for algal biofuel production at commercial scales. Algal Research. 4, 76-88 (1016).
- Sun, A., et al. Comparative cost analysis of algal oil production for biofuels. Energy. 36 (8), 5169-5179 (2011).
- Thilakaratne, R., Wright, M. M., Brown, R. C. A techno-economic analysis of microalgae remnant catalytic pyrolysis and upgrading to fuels. Fuel. 128, 104-112 (2014).
- Quinn, J. C., et al. Nannochloropsis production metrics in a scalable outdoor photobioreactor for commercial applications. Bioresour Technol. 117, 164-171 (2012).
- Borkenstein, C., Knoblechner, J., Frühwirth, H., Schagerl, M. Cultivation of Chlorella emersonii with flue gas derived from a cement plant. J Appl Phycol. 23 (1), 131-135 (2010).
- Douskova, I., et al. Simultaneous flue gas bioremediation and reduction of microalgal biomass production costs. Appl Microbiol Biotechnol. 82 (1), 179-185 (2009).
- Israel, A., Gavrieli, J., Glazer, A., Friedlander, M. Utilization of flue gas from a power plant for tank cultivation of the red seaweed Gracilaria cornea. Aquaculture. 249 (1-4), 311-316 (2012).
- Napan, K., Teng, L., Quinn, J. C., Wood, B. Impact of Heavy Metals from Flue Gas Integration with Microalgae Production. , Algal Research. (2015).
- Eaton, A. D., Clesceri, L. S., Rice, E. W., Greenberg, A. E. 3125B. Inductively coupled plasma/mass spectrometry (ICP/MS) method. Standard methods for the examination of water and wastewater. , (2005).
- Eaton, A. D., Clesceri, L. S., Rice, E. W., Greenberg, A. E. Standard methods for the examination of water and wastewater. , APHA-AWWA-WEF. (2005).
- Matrix effects in the ICP-MS analysis of selenium in saline water samples. Smith, M., Compton, J. S. Proceedings of the 2004 Water Institute of Southern Africa Biennial Conference, Cape Town, South Africa, , (2004).
- Mehta, S. K., Gaur, J. P. Use of algae for removing heavy metal ions from wastewater: progress and prospects. Crit Rev Biotechnol. 25 (3), 113-152 (2005).
- EPA, U. Method: 200.8: Determination of trace elements in waters and wastes by inductively coupled plasma - mass spectrometry. , (1994).
- Eaton, A. D., Clesceri, L. S., Rice, E. W., Greenberg, A. E. 3120B. Inductively coupled plasma (ICP) method. Standard methods for the examination of water and wastewater. , (2005).
Tags
Environmental Sciences alger tungmetaller,Get cutting-edge science videos from JoVE sent straight to your inbox every month.









