Abstract
Ökad efterfrågan på förnybara bränslen har forskare undersöker möjligheten av alternativa råvaror, såsom mikroalger. Inneboende fördelar är hög potentiell avkastning, användning av icke-åkermark och integration med avfallsflöden. Närings kraven på en storskalig mikroalger produktionssystem kommer att kräva kopplingen av odlingssystem med industriella resurser avfall, såsom koldioxid från rökgaser och näringsämnen från avloppsvatten. Oorganiska föroreningar som förekommer i dessa avfall kan potentiellt leda till bioackumulering i alger biomassa påverkar produktiviteten och begränsa slutanvändning negativt. Denna studie fokuserar på experimentell utvärdering av effekterna och öde 14 oorganiska föroreningar (As, Cd, Co, Cr, Cu, Hg, Mn, Ni, Pb, Sb, Se, Sn, V och Zn) på Nannochloropsis salina tillväxt . Mikroalger odlades i photobioreactors upplyst på 984 fimol m -2 s -1 och hölls vid pH 7 i en tillväxt media förorenat med oorganiska föroreningar på nivåer förväntade baserat på sammansättningen i kommersiella gassystem kol förbrännings. Föroreningar som finns i biomassan och mediet i slutet av en 7-dagars tillväxtperiod var analytiskt kvantifieras genom kall ånga atomabsorptionsspektrometri för Hg och genom induktivt kopplad plasma masspektrometri för As, Cd, Co, Cr, Cu, Mn, Ni, Pb, Sb, Se, Sn, V och Zn. Resultat visar N. salina är en känslig stam till den multimetallmiljö med en statistisk minskning i biomassa yieldwith införandet av dessa kontaminanter. De tekniker som presenteras här är tillräckliga för att kvantifiera algtillväxt och bestämma ödet av oorganiska föroreningar.
Introduction
Jämfört med traditionella markgrödor mikroalger har visat att uppnå högre biomassa och lipid avkastning på grund av inneboende högre effektivitet solenergi konvertering 1,2. Odling av mikroalger vid höga produktivitet kräver leverans av olika näringsämnen, inklusive en extern kolkälla. Det förväntas att storskaliga tillväxtmöjligheter kommer att integreras med industriella avfallsströmmar såsom industri rökgas för att minimera produktionskostnaderna och samtidigt ge miljöåterställning. Industriavfall kol är typiskt i form av gasformig koldioxid och kan innehålla föroreningar som har potential att negativt påverka mikroalger produktion. Specifikt kommer rökgas härrörande från kol har en mängd olika föroreningar, inklusive men inte begränsat till förbränningsprodukter vatten och koldioxid, samt oxider av svavel och kväve, fint damm, organiska föroreningar, såsom dioxiner och furaner, och oorganisk conreningar såsom tungmetaller. Effekterna av de flesta av dessa föroreningar inklusive oorganiska med några av dem som kallas tungmetaller på mikroalger produktiviteten har inte undersökts. Några av dessa faktorer kan vara näringsämnen vid lämpliga koncentrationer, men vid högre koncentrationer de kan producera cell dysfunktion och även död 3.
Integrationen av mikroalger med industriell rökgas har potential att direkt införa oorganiska föroreningar i tillväxtmedier. Kol baserad rökgas har en mängd olika oorganiska element (t.ex. As, Cd, Co, Cr, Cu, Hg, Mn, Ni, Pb, Sb, Se, Sn, V och Zn) vid olika koncentrationer av vilka några, i låg koncentration, representerar näringsämnen för mikroalger tillväxt. Oorganiska föroreningar har en hög affinitet för att binda till mikroalger och ytterligare sorberas internt genom närings transportörer. Vissa oorganiska föroreningar (dvs., Co, Cu, Zn och Mn) är näringsämnen som ingår i enzymer involverard fotosyntes, respiration och andra funktioner 3,4. Men i överskott metaller och metalloider kan vara giftiga. Andra faktorer, såsom Pb, Cd, Sn, Sb, Se, As och Hg, inte är kända för att stödja cellfunktionen i vilken koncentration och representerar icke-näringsämnen metaller som negativt kan påverka kulturtillväxt 3,5,6. Förekomsten av någon av dessa föroreningar har potential att producera negativa effekter på mikroalger cellfunktion. Vidare samspelet mellan flera metaller med mikroalger komplicerar tillväxtdynamik och har potential att påverka tillväxten.
Storskaliga ekonomi har varit direkt kopplat till produktivitet odlingssystemet 7-19. Dessutom är medel recirkulering i mikroalger tillväxtsystem för antingen öppna löpbanornas dammar (ORP) eller photobioreactors (PBR) kritisk eftersom det utgör 99,9 och 99,4% av massan, respektive 20. Förekomsten av oorganiska föroreningar i media kunde slutligen begränsa microalgae produktivitet och återvinning av media på grund av förorenings uppbyggnad. Denna studie experimentellt bestämd effekterna av 14 oorganiska föroreningar (As, Cd, Co, Cr, Cu, Hg, Mn, Ni, Pb, Sb, Se, Sn, V och Zn), vid koncentrationer som förväntas från integrationen av mikroalger odlingssystem med kol härledd rökgas, på produktiviteten hos N. salina odlas i flygtransport PBRs. Föroreningarna som används i denna studie har visat sig inte bara vara närvarande i kolbaserad rökgas men kommunalt avfall baserade rökgas, biosolids baserade rökgas, kommunalt avloppsvatten, producerat vatten, försämrad grundvatten och havsvatten 21-23. De koncentrationer som användes i denna studie bygger på vad som skulle kunna förvänta sig om mikroalger tillväxt system integrerades med en kolbaserad CO2 källa med en upptagning effektivitet visats i kommersiella PBR system 20. Detaljerade beräkningar som stöder av koncentrationerna av tungmetaller och oorganiska föroreningar presenteras i Napanet al., 24 Analytiska tekniker användes för att förstå fördelningen av huvuddelen av metallerna i biomassa, media och miljö. De metoder som presenteras möjliggjorde bedömning av produktivitetspotentialen hos mikroalger i oorganisk förorening stress och kvantifiering av deras öde.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Tillväxt systemet

Figur 1. Mikroalger tillväxtsystem. (A) luft rotometer, (B) CO 2 rotometer, (C) pH-kontroller med magnet, (D) datalogger, (E) in-line luftfilter (F) luftfördelningsröret, (G) fluorescerande ljus bank, (H) pH-mätare, (I) kylsystem (J) vattenbad (K) termotråd, (L) luftlyft fotobioreaktor, (M) värmare, (N) walk-in rök huva, (O) utlopp, (P) lufttillförsel kapillärrör, (Q) luftfilter, (R) provtagningsrör, (S) lock PBR silikon, och (T)pH väl silikonlock. Klicka här för att se en större version av denna siffra.
- Bygg följande mikroalger experimentella tillväxten systemet (figur 1).
- Förvärva tolv flygtransport PBRs bestående av glas rörreaktorer 4.5 cm i diameter och 80 cm i höjd med en odling kapacitet på 1,1 liter med silikonlock. Förvärva förskurna glaskapillärrör (5 mm yttre diameter och 1 mm inre diameter) på 10 cm (3 per PBR) och 85 cm (1 per PBR) i längd.
- Frys silikon lock i en -80 ° C frys. Smörj en borrkrona med glycerol och medan lock fryses borra 3 hål att vara värd för ventilations, provtagning och gas leverans kapillärrör och 1 hål av 17 mm diameter för att vara värd för en pH-sond.
- Sätt i 3 kapillärrör på plats med den längsta röret som sträcker sig 2 cm från botten av PBR. I den andra kapillärröret lägga en kisel rör with ett kapillärrör fäst vid den andra änden sträcker sig till en önskad samplingspunkt. Täck hålet för pH-mätare med en silikonpropp storlek 21D.
- Fukta omgivande luft genom att bubbla den genom vatten och leverera fuktad luft till luftfördelningsröret. Passera gas genom ett 0,2 pm filter och leverera den till den Algsuspensionen genom den längsta glasleverans kapillärrör.
- Leverera komprimerad CO 2 in i fuktad luft strömmen för att bibehålla ett neutralt pH-värde av 7,0 ± 0,1 i odlingssuspension. Kontrollera hastigheten för CO 2 leverans med en automatiserad CO 2 apotek systemet (pH-kontroller) som öppnar en magnetisk solenoid när algkulturen når pH 7,1 och stänger vid pH 6,9.
- Ge ljus med hjälp av 24 T5-lysrör som resulterar i en genomsnittlig belysning av 984 fimol m -2 s -1 liknande topp utomhus.
- Doppa PBRs i ett vattenbad för att maintain en konstant temperatur av ca 25 ° C. Reglera temperaturen hos systemet genom att använda en återcirkulerande kylmaskin och ett automatiserat upphettnings recirkulerande vattenbad apparatstyrning.
- Övervaka temperatur och pH i realtid och spela med en datalogger.
- Se till att alla delar av mikroalger tillväxt systemet fungerande, särskilt före skörd mikroalger inokulat eller förbereder oorganiska föroreningar eftersom de inte kan bevaras.
2. Lab Ware Framställning
- Tvätta mätkolvar, PBRs, damejeanne och behållare, med tvål och kranvatten. Skölj med avjoniserat vatten (DW).
- Syra skölj labbet ware för att eliminera alla spår av oorganiska föroreningar. Detta kan göras genom ett av två sätt:
- Blöt lab ware O / N på 10% spårmetallkvalitet salpetersyra (VARNING: Undvik inandning rök, kan koncentrerad salpetersyra producera svår brännande och giftiga ångor, arbete i en drag hood använder nitril handskar, skyddsglasögon och labbrock).
- Blöt lab ware under 15 minuter i 50% spårmetallkvalitet salpetersyra.
- Skölj labbet ware med DW ordentligt åtminstone 3 gånger att se till alla syra avlägsnas. Det är kritiskt att PBRs sköljs noggrant, speciellt provtagningsrör och kapillärrören. Underlåtenhet att göra detta kommer att ge försurning av mediet och möjlig hämning av tillväxt. Testa pH för sköljvattnet för att kontrollera alla syra har avlägsnats.
- Sterilisera PBRs, behållare och flaskor genom autoklavering dem vid 120 ° C och standard atmosfärstryck under minst 30 minuter.
3. N. salina Medium Framställning
- Beredning av lösning A: Delvis fylla en 1 L mätkolv med DW. Sätt i en magnetisk omrörarstav och lägga de kemikalier som anges i tabell 1 efter varandra. Säkerställ att varje ingrediens upplöses före tillsats av nästa beståndsdel. Ta magneten och fylla the kolven till 1 L volymmärke.
| Komponent | Belopp att lägga (g) | Slutlig koncentration (g / I) |
| H 3 BO 3 | 0,900 | 0,900 |
| Na 2 Moo 4 · 2H 2 O | 0,012 | 0,012 |
| MnCl2 · 4H 2 O | 0,300 | 0,300 |
| ZnSO 4 · 7 H2O | 0,060 | 0,060 |
| CUSO4 · 5H 2 O | 0,020 | 0,020 |
Tabell 1:. Lösning Ett recept Mängderna är mängder som behövs vid framställning av 1 liter koncentrerad lösning.
- Beredning av vitaminlösning: I tre separata volumetric kolvar lägga vitaminer såsom visas i tabell 2. Filtrera varje vitaminlösning genom ett sterilt 0,2 fim sprutfilter till en steril behållare. Bevara vitaminer vid -4 ° C i mörker.
| Vitaminer | Mängd (mg) | Slutlig volym (ml) | Slutlig koncentration vitamin (mg / L) |
| Biotin | 12,22 | 500 | 24.43 |
| Vitamin B12 | 13,50 | 100 | 135,00 |
| Tiaminhydroklorid | 977,63 | 500 | 1,955.27 |
Tabell 2:. Vitamin lösning recept Mängderna är mängder som behövs för framställning av koncentrerad lösningarning.
- Delvis fylla en 20 L autoklaverbar behållare med DW och infoga en magnetisk omrörarstav. Placera behållaren på en magnetomrörare platta och lägg de kemikalier som anges i tabell 3 (utom vitaminer), lägga dem efter varandra och efter varje helt upplöses. Fyll behållaren för att nå 20 L.
| Komponent | Belopp att lägga till medel | Enhet |
| NaCI | 350,00 | g |
| CaCl2 • 2 H2O | 3,00 | g |
| KCl | 9,60 | g |
| Na 2 SiO 3 · 9H 2 O | 1,14 | g |
| MgSO 4 · 7 H2O | 29,60 | g |
| 20,40 | g | |
| KH 2 PO 4 | 1,36 | g |
| Ammonium järncitrat | 0,10 | g |
| Lösning A | 20,00 | ml |
| Biotin lösning * | 818,00 | il |
| Vitamin B12-lösning * | 296,20 | il |
| Tiaminhydroklorid lösning * | 521,60 | il |
| * Lägg till kyld autoklave media |
Tabell 3: N. Salina medel recept. Mängderna är mängder som behövs vid framställning av 20 liter näringsrikt medium.
- Sterilisera mediet genom autoklavering under 30 min vid 120 ° C och atmosfärstryck. Låt mediet cool ned till RT.
- Placera behållaren på en magnetomrörare platta. Tillsätt vitaminer som framställts i steg 3,2 och låt mediet blanda väl.
4. Oorganiska föroreningar mäldberedningen
- Delvis fylla de mätkolvar som anges i tabell 4 med DW och tillsätt den individuella saltet listat. Fyll med DW till önskad slutliga volymen och blanda väl. Inte bevara dessa bestånd som vissa delar bindas till kolv väggar
VARNING: Flera oorganiska föroreningar som används i detta protokoll är cancerframkallande, fosterskadande och mutagena, bär ansiktsmask, handskar och laboratorierock vid hantering av salter.
| Analyt | Salt källa | Volym lager för att förbereda (L) | Salt för att lägga till kolven60; (Mg-salt) | Analytkoncentrationen sattes till kulturen (mg analyt / L) |
| Som | NaAsO 2 | 0,1 | 14,8 | 7.74E-02 |
| CD | CdCl2 | 0,5 | 13,5 | 1.50E-02 |
| Co | CoCl2 .6H 2 O | 0,5 | 34,7 | 1.56E-02 |
| Cr | Na 2 Cr 2 O 7 • 2 H2O | 0,1 | 40,6 | 1.29E-01 |
| Cu | CuCl 2 .2H 2 O | 0,1 | 38,3 | 1.30E-01 |
| Hg | HgCl2 | 1,0 14,6 | 9.80E-03 | |
| Mn | MnCl2 .4H 2 O | 0,1 | 58,8 | 1.49E-01 |
| Ni | NiCl2 .6H 2 O | 0,1 | 112,0 | 2.51E-01 |
| Pb | PbCl2 | 0,5 | 39,9 | 5.41E-02 |
| Sb | Sb 2 O 3 | 0,5 | 26,7 | 4.06E-02 |
| Se | Na 2 SeO 3 | 0,5 | 11,8 | 9.80E-03 |
| Sn | SnCl2 .2H 2 O | 0,5 | 3,9 | 3.76E-03 |
| V | V 2 O 5 | 0,1 | 22,2 | 1.13E-01 |
| Zn | ZnCl2 | 0,1 | 99,9 | 4.36E-01 |
Tabell 4:. Koncentrerad oorganiska föroreningar mäldberedningen Tillsats av 1 ml av denna koncentrerade lager till 1,1 L PBR mediet alstrar den slutkoncentration som visas i den sista kolumnen.
- Sterilisera oorganiska föroreningslagren genom att lösningen genom ett sterilt 0,2 pm sprutfilter och samla filtratet i ett sterilt rör.
5. N. salina Vaccin Produktion
- I en 500 ml Erlenmeyer-kolv till 200 ml medium som framställts i steg 3 och tillsätt sedan 3 g agar. Täck kolven i aluminiumfolie och autoklav under 20 minuter vid 120 ° C. Häll lösningen i sterila petriskålar och låt den svalna tills den stelnar. Detta bör kompletteras vara en steril huva eller åtminstone nära en eld i en ren miljö för att minska risken för kontaminering.
- Serie N. salina celler i sterila petri-dishes framställts i steg 5,1 med en steril sådd slinga. Placera petriskål kulturer på ett bord upplyst med T12 lampor som hölls vid RT. Låt mikroalger växa tills kolonier syns.
- Överför kolonier att steril förbryllad Erlenmeyerkolvar innehållande 200 ml näringsrikt medium som framställts i steg 3 och hålla dem på en upplyst skakbord (1000 rpm). Låt kulturen växa tills mediet blir grön.
- Överför mikroalger till en 1,1 L sterilt PBR. Placera PBR i en ymp vattenbad upplyst på 200 | j, mol m -2 s -1 med T8 lysrör och hölls vid 23 ° C med en återcirkulerande kylmaskin och ett automatiserat upphettnings recirkulerande vattenbad kontroll. Justera luft och CO 2 rotometers till 2,5 L min -1 och 25 cc min -1, respektive.
- Efter en vecka av tillväxt split biomassa till nya 1 .1 L PBRs innehåller nytt medium och låt det växa tills totalt minst 28 g torrvikt biomassaerhålls mellan de två reaktorer som kan bestämmas genom optisk densitet.
- Skörda inokulatet biomassan genom centrifugering vid 2054 x g under 15 min vid 10 ° C med användning av sterila centrifugflaskor och sterila tekniker för att undvika kontaminering. Kassera supernatanten och fortsätt cellkoncentrationen som behövs.
- När all biomassa centrifugeras, återsuspendera cellerna i 300 ml färskt sterilt medium.
- Späd 0,1 ml av alger kultur i 3 ml DV och sedan späda 0,1 ml av denna nya lösning i 3 ml DV. Se till att provet är ordentligt blandat. Mät den optiska densiteten (OD) hos mikroalger koncentratet vid 750 nm () omedelbart med användning av en spektrofotometer.
- Använd ekvation (1) för att bestämma mängden biomassa i koncentratet.
Obs: Ekvation (1) erhölls från den linjära regressionen mellan kontra totalt suspenderat material (ig / L -1) för N. Salina (R 2 = 0,9995). Ekvation 1 utvecklades för Spectrophotometer modell i material tabellen, skapa en ny kalibrering om du använder en annan spektrofotometer modell.- Med hjälp av formel (2) beräkna volymen av mikroalger koncentrat (i L) som krävs för erhållande av en 4 g / I -1 odlingsdensitet i en PBR av 1,1 L volym (i liter).
- Med användning av sterila tekniker, till volymen av mikroalger koncentrat finns i steg 5,9 till en autoklaverad PBR att nå ett initialt odlingsdensitet av 4 g / I -1. Fyll PBR med medium till 1,1 L. Upprepa detta steg tills 6 PBRs ympas. Placera PBRs i inokulum vattenbad.
- Låt mikroalger i PBRs växa i 8 dagar och sedan skörda biomassa (genom att upprepa steg från 5,6 till 5,7). Upprepa steg 5,8 för att beräkna den initialaymp volym för en inledande odlingsdensitet av 1 g / I -1.
6. Experimentella Reaktorer
- Använda sterila tekniker lägga ca 1 liter medium framställt i steg 3 till vart och ett av de 12 syra sköljas sterila PBRs. Placera PBRs i vattenbadet av den experimentella tillväxtsystemet. Slå sparge luft på 1,5 L min -1.
- Sterilisera en kalibrerad pH-mätare genom att rengöra den med 70% etanol. Mät pH hos mediet i PBR och säkerställa pH är ca 7,0; Om inte, att upprepa steg 2 ta bort syra lakas ur syran sköljningssteget.
- Kalibrera varje pH-kontroller med hjälp av pH 7, desinficera sonderna med användning av etanol (70%) och sedan infoga dem i PBRs lock.
- Till varje PBR (utom kontroll PBRs) tillsätt 1 ml av var och en av de sterila oorganiska föroreningar lager som framställts i steg 4. Låt föroreningarna blanda noga i PBR. Den slutliga koncentrationen av de oorganiska föroreningarna i PBRs är shown i den sista kolumnen i tabell 4, och de uppskattade maximala koncentrationer förväntas av ett kraftverk integrations koleldade.
- Lägg 14 ml steril DW till styr PBRs.
- Lägg den koncentrerade mikroalger inokulum som erhållits i steg 5,11 till de experimentella PBRs för att erhålla en initial kultur densitet av 1 g / I -1. Låt blandningen biomassa ordentligt.
- Vänd hög ljusintensitet lampor (av 984 fimol m -2 s -1) och pH-regulatorer på och justera CO 2 till 30 cc min 1. Öka CO2 flöde till 50 cc min -1 från dag 3 efteråt. Initial låga CO 2 flöde är avgörande för att undvika stora förändringar i pH på grund av förseningar i gas- vätskeöverföring och pH-mätning /.
- Mät och ta prover vid behov. Var noga med att markera vattennivån efter provtagningen. (OBS: vissa oorganiska föroreningar i PBR är cancerframkallande, fosterskadande och mutagena, använda handskar och capped behållare vid hantering av prover).
- Tillsätt steril DW dagligen till PBRs för att kompensera för förluster på grund av avdunstning.
- Efter 7 dagars tillväxt, skörda biomassan genom centrifugering vid 9936 x g och bevara både, biomassa och supematant-medium, vid -80 ° C.
- Frystorkades biomassan vid 0,1 mbar och -50 ° CO / N. Pulver biomassan (använd en spatel till pulver biomassa inuti centrifugröret). Bevara frystorkad biomassa vid -80 ° C.
7. Mikrovågsugn Assisted Digerering av prover
Uppslutningen av proverna biomassa krävs som en pre-behandlingssteg för ICP-MS-analys.
Obs! Dessa åtgärder använder ett slutet kärl mikrovågsugn matsmältning med kontrollerad tryckavlastning. (OBS: Högt tryck utvecklas under syraupplösning, inspektera fysiska integritet matsmältningen fartyg och sköldar, och omforma mikrovågsnedbrytning fartygs lock innan varje användning).
- Tvätta teflon mikrovågsugn matsmältningen fartyg med tvål och vatten, skölj med DW och låta fartyg lufttorka. För att avlägsna spårmetallförorening i kärlen smälta syra, såsom beskrivs i de följande stegen.
- Omforma mikrovågsugn digestionskärl lock och stäng flaskorna tätt.
- Tillsätt 10 ml salpetersyra till varje.
- Inför fartyget i säkerhetsskyddet. Se till att inga biomassa, vatten eller reagens kvar på väggarna i säkerhetsskärmen eller i de yttre väggarna av de digererings fartyg för att undvika skada på säkerhetsskölden. Cap säkerhets sköld med säkerhetsventilen och se till att fjädern i flaskan är i jämnhöjd. Leta upp skölden på rotorn med locket ventiler pekar utåt i den yttre raden och inåt i den inre raden.
- På kärl nummer ett, sätter den keramiska termometer och temperatursensorn. Denna termometer övervakar faktiska innertemperaturen i flaskan och fungerar som den styrande parametern för att utföra matsmältningen program. Se till att flaskan nummer ett innehåller samma prov och reagensmängder som de andra flaskor.
- Mata in matsmältningen parametrar visas i tabell 5 och börja matsmältning. När programmet är klart, luft kyla flaskorna tills de når RT.
| Steg | Flaskor sköljning | Prov digere | ||||
| Temperatur (° C) | Tid (min) | Max. effekt (W) | Temperatur (° C) | Tid (min) | Max. effekt (W) | |
| 1 | RT till 190 | 25 | 1000 | RT till 180 | 15 | 1000 |
| 2 | 190 | 10 | 1000 | 180 | 15 | 1000 |
| - | 20 | - | - | 20 | - |
Tabell 5: Parametrar som används i mikrovågsugnen matsmältningen programmet.
- Inuti ett dragskåp, sätter övertrycks verktyget på skärmlocket med den gemensamma jordbrukspolitiken ventiler pekar bort från dig. När trycket släpps öppna locket (OBS: Alltid öppet spjälkade flaskor inuti dragskåp eftersom matsmältningen biomassa användning av syra producerar giftiga gaser).
- Gör dig av syran. Skölj teflon fartyg med DW 3 gånger. Låt flaskorna lufttorka.
- För att smälta biomassa, tillsätt 50 mg frystorkad biomassa till mikrovågsnedbrytning fartyg. För kvalitetskontroll (QC) förbereda följande injektionsflaskor: i två olika flaskor lägga antingen 5 ml Level 7 ICPMS eller 5 ml Level 7 Hg CVAAS standard som utarbetats i steg 9.1 och 10.1 (den nedbrutna lösningen från flaskan kallas laboratoriet befästa blank (LFB)), lämna en annan flaska tomt (den uppslutna lösningenfrån flaskan kallas laboratoriereagens tomt (LRB)).
- För att smälta mediet, tillsätt 10 ml flytande medium för att torka syra sköljas mikrovågsugn matsmältningen fartyg. För kvalitetskontroll (QC) förbereda följande injektionsflaskor: I två olika flaskor tillsätt 5 ml Level 7 ICPMS eller CVAAS metall standard som framställts i steg 9,1 och 10,1 (den nedbrutna lösningen från flaskan kallas LFB), till en annan flaska tillsätt 10 ml DV (den uppslutna lösningen från flaskan kallas LRB).
- Omforma mikrovågsugn digestionskärl lock och stäng flaskorna tätt.
- Lägg 7 ml koncentrerad spårmetallkvalitet salpetersyra och 3 ml väteperoxid till varje flaska. Homogeni innehållet genom att försiktigt snurra lösningen. Smälta innehållet i flaskorna genom att upprepa steg från 7,4 till 7,7 (använd mikrovågsugn matsmältningen parametrarna för prov uppslutning i tabell 5).
- Lägg smält prov till en 25 ml mätkolv, sköljning av fartyg med DW för ökad återvinning. Fyll mätkolven med DWtill märket.
- Transfer diger prover till ett tak behållare. Bevara prover vid 4 ° C tills analys kan fullföljas. För denna studie analys görs samma dag för Hg och inom tre dagar för de andra elementen.
8. kvalitetskontroll (QC) Prover
Obs: Analysera QC prover för att säkerställa tillförlitligheten av resultaten från experimentprover.
- Delvis fylla en syra sköljdes 1 L mätkolv med DW. Lägg 280 ml koncentrerad spårmetallkvalitet salpetersyra och blanda väl (denna lösning även kallad blindlösning) (OBS: alltid syra i vatten, aldrig tillsätt vatten till syra som den exoterma reaktionen kan vara våldsam). Låt lösningen svalna till RT.
- Förutom QC prover framställda i steg 7.9 och 7.10, förbereda följande QC prover.
- För den fortsatta kalibreringsverifiering (CCV): Fyll en polystyrenrör med kalibreringsstandard (för framställning sesteg 9.2 och 10.1). Sätt Hg standardlösning på CVAAS rack och ICPMS standardlösning i ICPMS autosamplern.
- För den fortsatta kalibrering tomt (CCB): Fyll två polystyrenrör (16 ml) med blind (lösning som framställts i steg 8,1). Placera ett prov i CVAAS rack och andra provet i ICPMS autosamplern.
- För laboratorie berikade matris (LFM): slumpmässigt välja 1 prov av varje 12 prover för varje typ av prov (dvs. biomassa eller medium) och använda den för att förbereda en LFM. För ICPMS, tillsätt 0,5 ml ICPMS standardnivå 7 och 3 ml av diger experimentella prov (från antingen biomassa eller medium) till ett polystyrenrör.
- Blanda innehållet och placera flaskorna på ICPMS autosamplern. För CVAAS, tillsätt 2 ml Hg standard Level 7 och 6 ml diger experimentella prov (från antingen biomassa eller medium) till ett polystyrenrör. Blanda innehållet och placera flaskor på CVAAS rack.
- För duplikatprover: slumpmässigt välja 1 prov av någonsiny 12 prover för varje typ av matris (t.ex. biomassa, medium, LFM eller utspädda matris) och duplicera flaskan. Placera upprepade flaskorna i ICPMS autosamplern eller CVAAS rack.
- För duplikatprover: slumpmässigt välja 1 prov av varje 12 prover för varje typ av matris (t.ex. biomassa, medium, LFM eller utspädda matris) och duplicera flaskan. Placera upprepade flaskorna i ICPMS autosamplern eller CVAAS rack.
- Definiera datakvalitetskriterierna för studien. För denna studie duplicera de kvalitetskriterier som fastställts av Eaton, Clesceri, ris och Greenberg 25. Parametrarna som fastställts för QC är: procents skillnad (% D) för CCV inom ± 10% 25 (med undantag för Pb och Sb, se diskussion), LFB procent återhämtning (% R) inom ± 70-130% 25, LFM procent återhämtning (% R) inom 75-125% 25 och relativ procents skillnad (RPD) inom ± 20% 25 och en fortsatt calibration blank (CCB) under metod rapporteringsgränsen (MRL) 25. Se beräkningsformlerna i steg 9.7.
9. Kvantifiering av induktivt kopplad plasma-masspektrometri (ICPMS)
- På dagen för analysen, överföra cirka 5 ml smält prov till polystyrenrör och placera dem i ICPMS autosamplern. Tillsätt ca 15 ml smält prover som polystyrenrör och placera dem i CVAAS rack.
- Samma dag som analysen framställa kalibreringsstandarder. Lägg köpta ICPMS standardlösning och fyll på med tom (lösning som framställts i steg 8,1) som beskrivs i tabell 6 (se standardlösning beskrivning i Material tabell) till syra sköljs mätkolvar.
| Parameter | Nivå 1 | Nivå 2 | Nivå 3 | Nivå 4 | Level 5 | Nivå 6 | Nivå 7 |
| Inköpt standarden som skall tillsättas (ml) | - | - | - | - | - | - | 10,0 |
| Nivå 7 som skall tillsättas (ml) | 0,0 | 1,0 | 2,5 | 5,0 | 20,0 | 25,0 | - |
| Slutlig volym * (ml) | - | 50,0 | 50,0 | 50,0 | 100,0 | 50,0 | 100,0 |
| Slutlig koncentration (^ g / l) | |||||||
| 75 Såsom | 0,0 | 2,0 | 5,0 | 10,0 | 20,0 | 50,0 | 1000,0 |
| 111 Cd | 0,0 | 1,0 | 2,5 | 5,0 | 10,0 | 25,0 | 50,0 |
| 59 Co | 0,0 | 10,0 | 25,0 | 50,0 | 100,0 | 250,0 | 500,0 |
| 52 Cr | 0,0 | 2,0 | 5,0 | 10,0 | 20,0 | 50,0 | 100,0 |
| 63 Cu | 0,0 | 5,0 | 12,5 | 25,0 | 50,0 | 125,0 | 250,0 |
| 55 Mn | 0,0 | 3,0 | 7,5 | 15,0 | 30,0 | 75,0 | 150,0 |
| 60 L | 0,0 | 8,0 | 20,0 | 40,0 | 80,0 | 200,0 | 400,0 |
| 208 Pb | 0,0 | 1,0 | 2,5 | 5,0 | 10,0 | 25,0 | 50,0 |
| 121 Sb | 0,0 | 12,0 | 30,0 | 60,0 | 120,0 | 300,0 | 600,0 |
| 51 V | 0,0 | 10,0 | 25,0 | 50,0 | 100,0 | 250,0 | 500,0 |
| 66 Zn | 4,0 | 10,0 | 20,0 | 40,0 | 100,0 | 200,0 | |
| * Uppnå denna volym genom tillsats av lösningen som framställts i steg 8,1 | |||||||
Tabell 6: Koncentration av kalibreringsstandarder Nivå 1 till 7..
- Ta bort konerna från ICPMS och Sonikera dem under 1 minut i DW. Torka konerna och sätta tillbaka dem i instrumentet.
- Slå på vattenkylare, gaser (Ar, H 2, He), den ICPMS, plug linjer till intern standard, och fyll auto-sampler sköljbehållare (DW, 10% salpetersyra, 1% salpetersyra + 0,5% saltsyra) .
- Öppna Masshunter Workstation och slå på plasma, stämma ICPMS och ladda den metod som parametrar i tabell 7.
| Parametrar Värden | |||||||||
| Interna standarder | 72 Ge, 115 | ||||||||
| Rf-effekt | 1500 W | ||||||||
| Plasma gasflödeshastighet | 14,98 | ||||||||
| Flödeshastighet Nebulizer gas | 1,1 L / min (bärare och utspädningsgasen kombineras - 0,6 + 0,5 l / min) | ||||||||
| Provtagning kon | Nickel för x lins | ||||||||
| Skumma kon | Nickel | ||||||||
| Provupptagningshastighet | 0,3 rps | ||||||||
| Nebulisatorn pumpen | 0,1 rps | ||||||||
| S / C temperatur | 2 ° C | ||||||||
| Skanning Förhållande | Väntetid 1 sekund, antalet replikat 3 | ||||||||
| H 2 gasflöde | N / A | ||||||||
| Han gasflöde | 4,3 ml / min | ||||||||
| Parameter | Nivå 1 | Nivå 2 | Nivå 3 | Nivå 4 | Level 5 | Nivå 6 |
| L7 Hg standard tillsättas (ml) | 0 | 1 | 2,5 | 5 | 20 | 25 |
| Slutlig volym * (ml) | - | 50 | 50 | 50 | 100 | 50 |
| Slutlig koncentration (^ g / l) | 0 | 0,5 | 1,25 | 2,5 | 5 | 12,5 |
| * Uppnå denna volym genom tillsats av lösningen som framställts i steg 8,1 | ||||||
Tabell 8: Koncentration Hg kalibreringsstandard Nivåerna 1 till 6..
- Öppna Ar-gas och luftventil, slå på Atomic Absorption spektrofotometer och Flow Injection atomspektroskopi (FIAS). Öppna CVAAS Winlab programvara, slå på Hg-lampa och låt den värmas upp tills programvarans energi parameter når 79. Fyll på programmet för Hg analys med parametrarna i Tabell 9. Justera ljusvägen i instrumentet för att ge maximal transmittans.
| Parametrar | Värden |
| Bärargas | Argon, 100 ml / minut |
| Lampa | Hg elektrodfri urladdningslampa, setup på 185 mA |
| Våglängd | 253,7 nm |
| Slit | 0,7 nm |
| Celltemperatur | 100 ° C |
| Provvolym | 500 | il |
| Bärare | 3% HCl, 9,23 ml / min |
| Reduktant | 10% SnCl2, 5,31 ml / min |
| Mätning | Topphöjd |
| Läs replikat | 3 |
Tabell 9: CVAAS driftsförhållanden.
- Anslut ledningen till bärarlösningen gjord av 3% spårmetallkvalitet saltsyra.
- Anslut ledningen till reduktionsmedel lösning gjord av 10% tennklorid (lämplig för Hg analys) i 3% spårmetallkvalitet saltsyra. Bered denna lösning samma dag av analys som det är utsatt för atmosfärisk oxidation (OBS: Tennklorid är mycket farligt, använd skyddskläder när du arbetar med det Samla CVAAS avfall farligt inneslutning och kasta.).
- Placera Hg standarder, QC prover och experimentprover i CVAAS rack och inmatning sekvensen i CVAAS Winlab programvaran. Kör standarder och få fram kalibreringsekvationen.
- Kör QC samperna och experimentprover. Den CVAAS drar cirka 5 ml av prov i instrumentet, reducerar Hg närvarande i provet till elementärt Hg (Hg 0) gas och renar gasen från lösningen med en bärargas (Ar) i ett slutet system. Den Hg-ånga passerar genom en cell i Hg-lampa strålgången. En detektor bestämmer ljuset absorberas vid 253,7 nm och korrelerar till koncentration. (OBS: Hg ånga är giftig, säkerställa instrument avluftshuv är på plats).
- Beräkna% R,% D och RPD i steg 9.7 under analys och jämföra resultaten till projektdatakvalitetskriterier.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Biomassa utbyten
Framställning av N. salina i PBR systemet som används i denna studie ökade från 1 g / I -1 till 8,5 ± 0,19 g / I -1 (N = 12) för kontrollreaktorer och 4,0 ± 0,3 g / I -1 (N = 12) för multi-metall förorenat i 7 dagar. Experimenten producerade repeterbara data över trippel reaktorer och flera omgångar. Figur 2A visar den genomsnittliga odlingstätheten med mycket små standardfel bygger på provtagning från tre oberoende PBRs. För att säkerställa detta resultat inte var en isolerad Resultatet blev ytterligare tre satser vuxit med liknande resultat. De kombinerade resultat för alla fyra satser är visade i figur 2B. Även om biologisk variabilitet existerar, visar denna studie att det finns en konsekvent negativ inverkan av oorganiska föroreningar till N. salina produktion. De biomassa ger i förorenings utsätts PBRs var statistiskt skiljer sig kontroll PBRs fråndag 2 och framåt (ANOVA, p <0,05).
Kvalitetskontroll bedömning av oorganiska förorenings kvantifiering
Tolv av de fjorton element analyserade var fullt återvinningsbart efter matsmältningen vilket framgår av LFB% R med% R nära 100%, vilket indikerar inga förluster, inga vinster och ingen korskontaminering av analyter under matsmältningen (tabell 10). Under kvantitativ analys av prover% D och RPD övervakades genom alla analyser och medelvärdet av resultaten visas i tabell 10. As, Cd, Co, Cr, Cu, Hg, Mn, Ni, Pb, Sb, V och Zn passerade % D och RPD, men% D för Pb och Sb successivt sjunkit under analysen. Den% D för dessa element förbättras efter kon städning, dock är konstant kon rengöring opraktiskt, och därmed datakvalitetsmålen för Pb och Sb sänktes. CCB för alla analyter var också under gränsvärdet. Matrix effekter bedömdes genom att analysera LFM prover och erhållit% R. While Co, Hg, V och Sb passerade kvalitetskontrolldata kriterier, det var inte klarat av As, Cd, Cr, Cu, Mn, Ni, Pb och Zn när spjälkade prover biomassa analyserades, vilket resulterade i% R under QC målen. Matrix utspädning i DW till ett förhållande av 1: 3 (löst ämne: lösningsmedel) resulterade i% R som passerade datakvalitetskriterier. Matrix effekter observerades också vid analysen av den spjälkade vätskan och behandlades med samma utspädningsfaktorn (tabell 10) och se till att utspädning inte äventyra detektionsgränsen för instrumentet. Problem med att upptäcka Se och Sn observerades baserat på instabila avläsningar och en förorening problem, respektive. De instabila avläsningar för Se tillskrivs salter i matrisen 27. Sn smittan spåras tillbaka till en syra som används i uppslutningssteget.
| Analyt | R | CCV | LFB | LFM för prover biomassa | LFM för supernatant-prover | ||||
| % D | % R | Spädningsförhållande | % R | RPD | Spädningsförhållande | % R | RPD | ||
| QC begränsar 25 | 0,9950 | ± 10 | 70-130 | - | 75-125 | ± 20 | - | 75-125 | ± 20 |
| Som | 0,9998 | 1,8 | 101,0 | 1: 3 | 100,4 | 5,2 | 1: 3 | 92,5 | -0,5 |
| CD | 1,0000 | 1,4 | 102,6 | 1: 3 | 103,5 | 4,6 | Inget | 92,3 | 0,6 |
| Co | 0,9997 | 1,7 | 98,8 | Inget | 95,2 | -1,4 | Inget | 96,5 | -1,5 |
| Cr | 0,9999 | 1,5 | 99,8 | 1: 3 | 96,5 | 1,8 | 1: 3 | 90,1 | -0,8 |
| Cu | 0,9999 | 2,9 | 98,2 | 1: 3 | 101,4 | 4,8 | 1: 3 | 94,4 | -0,5 |
| Hg | 0,9983 | -1,7 | 103,0 | Inget | 98,7 | 1,5 | Inget | 98,0 | 0,3 |
| Mn | 0,9998 | 2,9 | 97,6 | 1: 3 | 83,2 | 1,8 | 1: 3 | 95,4 | -1,7 |
| Ni | 0,9999 | 103,5 | 1: 3 | 98,5 | 2,1 | Inget | 93,3 | -0,9 | |
| V | 0,9998 | 2,5 | 97,2 | Inget | 95,5 | -1,5 | Inget | 101,2 | -1,9 |
| Pb | 0,9998 | 12,6 | 105,2 | 1: 3 | 88,9 | 0,0 | Inget | 93,5 | -0,5 |
| Sb | 0,9998 | 1,1 | 105,7 | Inget | 101,8 | -9,6 | Inget | 90,8 | -1,2 |
| Zn | 0,9997 | 5,2 | 120,8 | 1: 3 | 90,7 | 1,4 | Inget | 89,2 | -1,9 |
Tabell 10: Sammanfattning av resultaten av kvalitetskontrollprover. R = correlation koefficient,% D: procents skillnad,% R: procent återhämtning, RPD = relativ procent skillnad, utspädningsfaktorn avser lösta ämnen: lösningsmedelsförhållandet.
Oorganiska föroreningskoncentrationer
Tungmetall och oorganiska föroreningar hittades i både biomassa och supematant-medium. De koncentrationer som påträffas i biomassan för de 12 element som analyseras är visade i fig 3. Koncentrationer i biomassan som skördats från trippel PBRs (N = 3) i batch # 1 visar en mycket liten medelfel (figur 3A). Kombinera data från trippel PBRs från fyra satser visar genomgående att oorganiska föroreningar är närvarande i biomassa (N = 12). De koncentrationer som påträffas i supernatanten mediet visas i figur 4. Resultaten visar trippel PBRs (N = 3) för kull # 1 har också liten medelfel (Figur 4A) och visar att de flesta föroreningar preferentiellt var belägna i biomassan leading att mycket låga koncentrationer i supernatanten med flera provkoncentrationer nära gränsvärdet av instrumentet. Resultat från alla fyra satser presenteras i figur 4B.
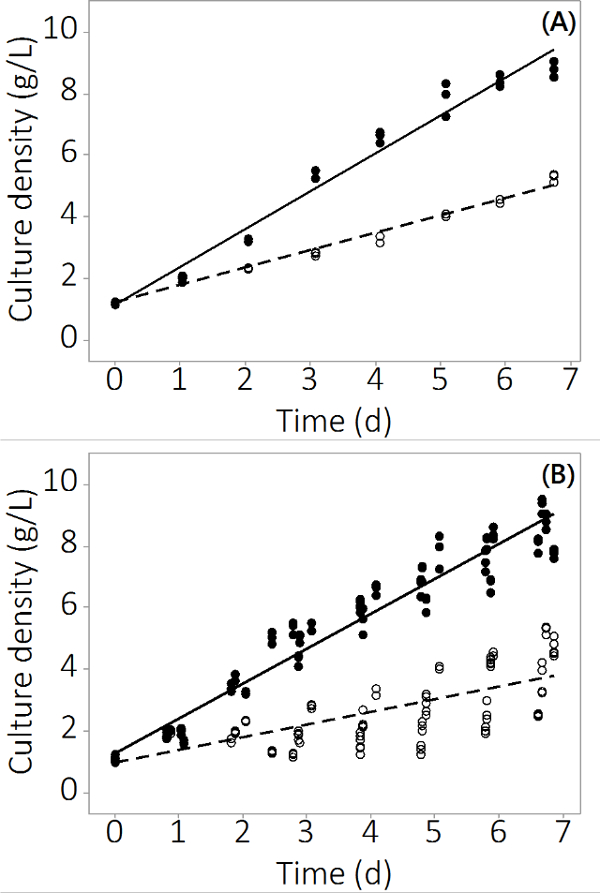
Figur 2. C ulture koncentration under odlingsperioden för förorenade och kontroll PBRs. (A) Kultur täthet i batch # 1, resultat från N = 3 PBRs. (B) Kultur tätheten i 4 omgångar, resultat från N = 12 PBRs. Tomma cirklar representerar förorenad biomassa, fyllda cirklarna representerar kontrollen.
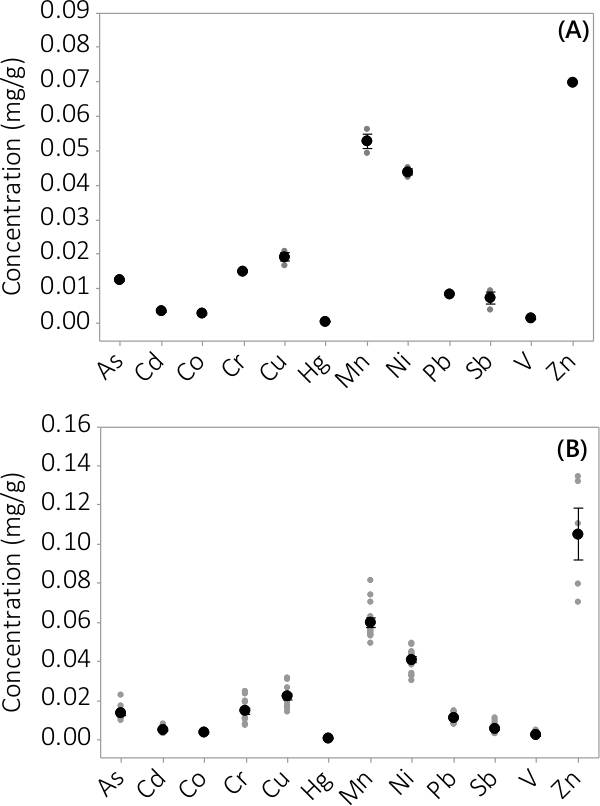
Figur 3. Koncentration av oorganiska föroreningar i biomassa. (A) Koncentration i batch #1 resultat från N = 1 PBR för Zn och N = 3 PBRs för alla andra analyter, (B) Koncentration från 4 partier, resultat från N = 4 PBRs för Zn och N = 12 PBRs för alla andra analyter. Medel koncentrationer representeras av svarta fyllda cirklar, individuella datapunkter representeras av grå fyllda cirklar. Felstaplar representerar ± ett standardfel från medelvärdet.
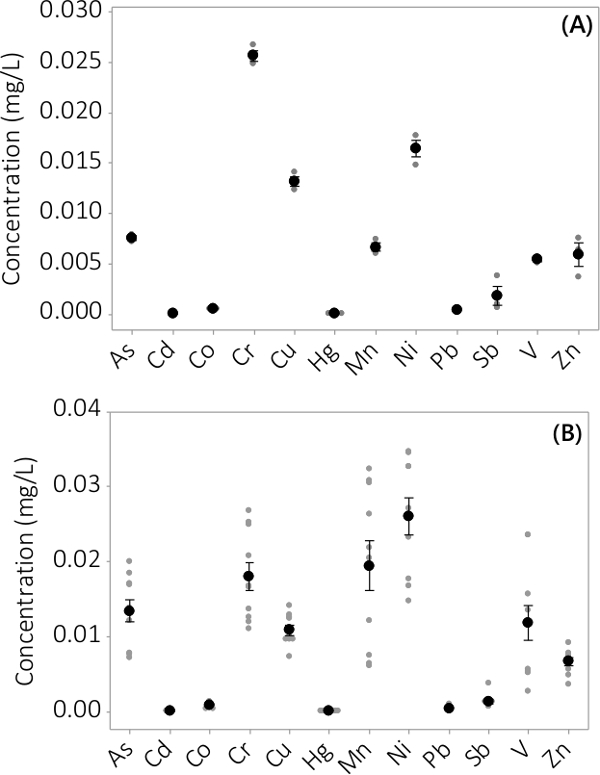
Figur 4. Koncentration av oorganiska föroreningar i supernatanten. (A) Koncentration i batch # 1, resultat från N = 3 PBRs, (B) Koncentration från fyra satser, resultat från N = 12 PBRs. Medel koncentrationer representeras av svarta fyllda cirklar, individuella datapunkter representeras av grå fyllda cirklar. Felstaplar representerar ± ett standardfel från medelvärdet.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Saltlösning mikroalger N. Salina kan framgångsrikt odlas i utformade tillväxt systemet med repeterbara resultat och hög avkastning biomassa. Airlift blandning tillåtet för en välblandad suspenderad kultur med minimal sedimentering eller biofouling över 7 dag tillväxtperioder. Den minimala ljus variation över fluorescerande ljus banken också visat sig inte ge märkbara skillnader i tillväxt.
Studien visar heavy metal förorenat media vid koncentrationer representativa för integration med kol rökgas negativt effekter tillväxt biomassa. Repeterbarhet i studien belyser effekterna multimetallsystemet har på produktiviteten. Olika steg i processen har potential att negativt påverka tillväxten och förorena systemet kräver flitig experimentella preparat. Bestämning av pH i mediet före start av experimentet är ett QC steg som möjliggör kontroll att mediet inte surgöres (t.ex. Resulting av felaktig PBR sköljning efter syrablötläggning). Försurat mediet kommer att påverka algernas tillväxt och ändra närings biotillgänglighet (t.ex. förändringar i oorganiskt kol artbildning och metaller artbildning) vilket påverkar samspelet mellan alger bindningsställen, näringsämnen och metaller. Den noggranna förberedelser av laboratorieutrustning för dessa studier krävdes en sådan som kan utföras en noggrann massbalans av de införda metallerna. Andra steg i processen har potential att införa vunna metaller som belyser behovet av att använda rätt kvalitet lösningsmedel och kemikalier. Korrekt QC genom processen på ett effektivt sätt kan identifiera införandet av tungmetallföroreningar.
Resultaten visar införda föroreningar fördelas mellan biomassan (Figur 3), media (Figur 4) och miljö. Oorganiska föroreningar som finns i skördade N. Salina tyder på att denna mikroalger kommer incorporate flera av de oorganiska föroreningar som förekommer i rökgasen. Denna assimilering kan vara ett resultat av adsorption på cellväggarna på grund av laddade bindningsställen, absorption inuti cellen på grund av metabolisk aktivitet, och utfällning av komplex bildade med ämnen som förekommer i mediet 28. Visuellt reaktorerna med oorganiska föroreningar efter ett par dagar verkade gul färg jämfört med mörkgröna av kontrollreaktorer. Förorenad skördade biomassan var inte skiljer sig visuellt från föroreningsfria biomassa efter pelletbildning efter skörd genom centrifugering. Den visuella färg skillnaden före skörd tillskrivs en lägre densitet biomassa och betonade mikroalger. Föroreningar som inte avlägsnats i biomassan har potential att ackumuleras i media som visas i Figur 4. Ansamling i medierna utgör en potential för att begränsa omfattningen som återvinning media utgör en nödvändighet för ekonomisk bärkraft. Begränsningen skulle diktav tolerans mot tungmetallföroreningar som kommer att vara artspecifika. Resultaten från denna studie belyser behovet av att bättre förstå de potentiella negativa effekter på integrering av mikroalger tillväxt system med avfalls kolkällor, särskilt kol baserad rökgas. Resultaten från denna studie belyser det behov att förstå produktivitets konsekvenserna av andra föroreningar som förväntas vara närvarande i rökgas såsom oxider av svavel och kväve, fint damm och organiska föroreningar såsom polyklorerade dibenso dioxiner och dibensofuraner furaner. Tidigare TEA och LCA bedömningar har antagit en sömlös integration utan hänsyn till effekterna av föroreningar såsom tungmetaller och oorganiska föroreningar på produktiviteten. I allmänhet resultaten från detta arbete belysa effekterna av en flermetallsystemet på produktivitet och kan användas för att förstå möjligheterna med mikroalger att bioremediate föroreningar.
Metodiken presenterade tillåtet för thE: s undersökning av oorganiska föroreningar med repeterbara resultat för mikroalger. Vissa oorganiska föroreningar som används i detta experiment är traditionellt finns i tillväxtsystem vid låga koncentrationer, men de andra har inte en känd funktion i cellen. Som ett resultat av flera element blandning av As, Cd, Co, Cr, Cu, Hg, Mn, Ni, Pb, Sb, Se, Sn, V och Zn vid den koncentration som visas i tabell 4 hämmade tillväxt. Kvantifiering av mängden föroreningar i biomassan kan bevisa utmanande i flera metallsystem. Ofta kan prover med höga halter av organiska ämnen och salter producera matris störningar, mångatomiga störningar, fysiska störningar och salt bygga upp koner som så småningom leder till felaktiga avläsningar och förlust av analytisk noggrannhet 29,30. Kvalitetskontroll prover körs tillsammans med de experimentella proverna bidragit till att bestämma noggrannhet och precision av mätningarna. Mätning av analyterna med användning av de protokoll som utvecklats för denna studie har visat sig vara enccurate och exakt producera acceptabla återkrav som ligger inom acceptabla prestanda för denna typ av studie 25,29. Uppslutning av prover från mikrovågsugnen var visade sig vara effektiv för N. Salina som spjälkade prover var klart utan närvaro av cellrester eller oblandbara delar. Matrisen som används i detta experiment (alger biomassa och artificiell havsvatten) producerade matris störningar som övervanns av matris utspädning. Emellertid kan högre biomassa urvalsstorlekar än de som används i detta experiment leda till matris störningar, och därför bör QC analyseras för varje specifikt sjukdomsscenario.
Subscription Required. Please recommend JoVE to your librarian.
Materials
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Sodium chloride | Fisher Scientific | S271-3 | |
| Calcium chloride dihydrate | Fisher Scientific | C79-500 | |
| Potassium chloride | Fisher Scientific | P217-500 | |
| Sodium meta silicate nonahydrate | Fisher Scientific | S408-500 | |
| Magnesium sulfate heptahydrate | Fisher Scientific | M63-500 | |
| Potassium nitrate | EMD Chemical | PX1520-5 | |
| Potassium phosphate monobasic | Fisher Scientific | P285-500 | |
| Ammonium ferric citrate | Fisher Scientific | I72-500 | |
| Boric acid | Fisher Scientific | A73-500 | |
| Sodium molybdate, dihydrate | EMD Chemical | SX0650-2 | |
| Manganese chloride tetrahydrate | Fisher Scientific | M87-500 | |
| Zinc sulfate heptahydrate | Fisher Scientific | Z68-500 | |
| Cupric sulfate pentahydrate | Fisher Scientific | C489-500 | |
| Biotin | Acros Organics | 230090010 | |
| Thiamine | Acros Organics | 148990100 | |
| Vitamin B12 | Acros Organics | 405920010 | |
| Copper (II) chloride dihydrate | Sigma-Aldrich | 221783-100G | Irritant, Dangerous to the Environment |
| Lead (II) chloride | Sigma-Aldrich | 268690-250G | Toxic, Dangerous to the Environment |
| Sodium dichromate dihydrate | Sigma-Aldrich | 398063-100G | Oxidizing, Highly Toxic, Dangerous to the Environment |
| Cobalt (II) chloride hexahydrate | Sigma-Aldrich | 255599-100G | Toxic, Dangerous to the Environment |
| Nickel (II) chloride hexahydrate | Sigma-Aldrich | 223387-500G | Toxic, Dangerous to the Environment |
| Sodium (meta) arsenite | Sigma-Aldrich | 71287 | Toxic, Dangerous to the Environment |
| Cadmium chloride | Sigma-Aldrich | 202908-10G | Highly Toxic, Dangerous to the Environment |
| Mercury (II) chloride | Sigma-Aldrich | 215465-100G | Toxic, Dangerous to the Environment |
| Tin (II) chloride dihydrate | Fisher Scientific | T142-500 | Corrosive. Suitable for Hg analysis. Very hazardous. |
| Manganese chloride tetrahydrate | Fisher Scientific | M87-500 | |
| Vanadium (V) oxide | Acros Organics | 206422500 | Dangerous to the Environment |
| Carbon dioxide | Air Liquide | I2301S-1 | Compressed |
| Hydrogen peroxide | H325-500 | Fisher Scientific | 30% in water |
| ICP-MS standard | ICP-MS-6020 | High Purity Standards | |
| Mercury standard | CGHG1-1 | Inorganic Ventures | 1000±6 µg/mL in 5% nitric acid |
| Argon | Air Liquide | Compressed | |
| Helium | Air Liquide | Compressed, ultra high purity | |
| Hydrogen | Air Liquide | Compressed, ultra high purity | |
| Nitric acid | Fisher Scientific | A509-P212 | 67-70% nitric acid, trace metal grade. Caution: manipulate under fume hood. |
| Hydrochloric acid | Fisher Scientific | A508-P212 | 35% hydrochloric acid, trace metal grade. Caution: manipulate under fume hood. |
| Equipment | |||
| Scientific prevacuum sterilizer | Steris | 31626A | SV-120 |
| Centrifuge | Thermo Fisher | 46910 | RC-6 Plus |
| Spectrophotometer | Shimadzu | 1867 | UV-1800 |
| pH controller | Hanna | BL981411 | X4 |
| Rotometer, X5 | Dwyer | RMA-151-SSV | T31Y |
| Rotometer, X5 | Dwyer | RMA-26-SSV | T35Y |
| Water bath circulator | Fisher Scientific | 13-873-45A | |
| Compact chiller | VWR | 13270-120 | |
| Freeze dryer | Labconco | 7752020 | |
| Stir plate | Fisher Scientific | 11-100-49S | |
| pH lab electrode | Phidgets Inc | 3550 | |
| Inductively coupled plasma mass spectrometer | Agilent Technologies | 7700 Series ICP-MS | Attached to autosampler CETAC ASX-520 |
| FIAS 100 | Perkin Elmer Instruments | B0506520 | |
| Atomic absorption spectrometer | Perkin Elmer Instruments | AAnalyst 800 | |
| Cell heater (quartz) | Perkin Elmer Instruments | B3120397 | |
| Microwave | Milestone | Programmable, maximum power 1,200 W | |
| Microwave rotor | Milestone | Rotor with 24-75 ml Teflon vessels for closed-vessel microwave assisted digestion. | |
| Materials | |||
| 0.2 μm syringe filter | Whatman | 6713-0425 | |
| 0.2 μm syringe filter | Whatman | 6713-1650 | |
| 0.45 μm syringe filter | Thermo Fisher | F2500-3 | |
| Polystyrene tubes | Evergreen | 222-2094-050 | 17 x 100 mm w/cap, 16 ml, polysteryne |
| Octogonal magnetic stir bars | Fisher scientific | 14-513-60 | Magnets encased in PTFE fluoropolymer |
References
- Dismukes, G. C., Carrieri, D., Bennette, N., Ananyev, G. M., Posewitz, M. C. Aquatic phototrophs: efficient alternatives to land-based crops for biofuels. Curr Opin Biotechnol. 19 (3), 235-240 (2008).
- Moody, J. W., McGinty, C. M., Quinn, J. C. Global evaluation of biofuel potential from microalgae. Proceedings of the National Academy of Sciences. 111 (23), 8691-8696 (2014).
- Pinto, E., et al. Heavy metal-induced oxidative stress in algae. J Phycol. 39 (6), 1008-1018 (2003).
- Gupta, A., Lutsenko, S. Evolution of copper transporting ATPases in eukaryotic organisms. Curr Genomics. 13 (2), 124-133 (2012).
- Perales-Vela, H. V., Peña-Castro, J. M., Cañizares-Villanueva, R. O. Heavy metal detoxification in eukaryotic microalgae. Chemosphere. 64 (1), 1-10 (2006).
- Sandau, E., Sandau, P., Pulz, O. Heavy metal sorption by microalgae. Acta Biotechnol. 16 (4), 227-235 (1996).
- Amer, L., Adhikari, B., Pellegrino, J. Technoeconomic analysis of five microalgae-to-biofuels processes of varying complexity. Bioresour Technol. 102 (20), 9350-9359 (2011).
- Benemann, J. R., Goebel, R. P., Weissman, J. C., Augenstein, D. C. Microalgae as a source of liquid fuels. Final Technical Report, US Department of Energy, Office of Research. , (1982).
- Benemann, J. R., Oswald, W. J. Report No. DOE/PC/93204--T5 Other: ON: DE97052880; TRN: TRN. Systems and economic analysis of microalgae ponds for conversion of CO2 to biomass. , (1996).
- Chisti, Y. Biodiesel from microalgae. Biotechnol Adv. 25 (3), 294-306 (2007).
- Davis, R., Aden, A., Pienkos, P. T. Techno-economic analysis of autotrophic microalgae for fuel production. Applied Energy. 88 (10), 3524-3531 (2011).
- Jones, S., et al. Process design and economics for the conversion of algal biomass to hydrocarbons: whole algae hydrothermal liquefaction and upgrading. U.S. Department of Energy Bioenergy Technologies Office. , (2014).
- Lundquist, T. J., Woertz, I. C., Quinn, N. W. T., Benemann, J. R. A realistic technology and engineering assessment of algae biofuel production. Energy Biosciences Institute. , Berkeley, CA. (2010).
- Nagarajan, S., Chou, S. K., Cao, S., Wu, C., Zhou, Z. An updated comprehensive techno-economic analysis of algae biodiesel. Bioresour Technol. 145, 150-156 (2011).
- Pienkos, P. T., Darzins, A. The promise and challenges of microalgal-derived biofuels. Biofuels Bioproducts & Biorefining-Biofpr. 3, 431-440 (2009).
- Richardson, J. W., Johnson, M. D., Outlaw, J. L. Economic comparison of open pond raceways to photo bio-reactors for profitable production of algae for transportation fuels in the Southwest. Algal Research. 1 (1), 93-100 (2012).
- Rogers, J. N., et al. A critical analysis of paddlewheel-driven raceway ponds for algal biofuel production at commercial scales. Algal Research. 4, 76-88 (1016).
- Sun, A., et al. Comparative cost analysis of algal oil production for biofuels. Energy. 36 (8), 5169-5179 (2011).
- Thilakaratne, R., Wright, M. M., Brown, R. C. A techno-economic analysis of microalgae remnant catalytic pyrolysis and upgrading to fuels. Fuel. 128, 104-112 (2014).
- Quinn, J. C., et al. Nannochloropsis production metrics in a scalable outdoor photobioreactor for commercial applications. Bioresour Technol. 117, 164-171 (2012).
- Borkenstein, C., Knoblechner, J., Frühwirth, H., Schagerl, M. Cultivation of Chlorella emersonii with flue gas derived from a cement plant. J Appl Phycol. 23 (1), 131-135 (2010).
- Douskova, I., et al. Simultaneous flue gas bioremediation and reduction of microalgal biomass production costs. Appl Microbiol Biotechnol. 82 (1), 179-185 (2009).
- Israel, A., Gavrieli, J., Glazer, A., Friedlander, M. Utilization of flue gas from a power plant for tank cultivation of the red seaweed Gracilaria cornea. Aquaculture. 249 (1-4), 311-316 (2012).
- Napan, K., Teng, L., Quinn, J. C., Wood, B. Impact of Heavy Metals from Flue Gas Integration with Microalgae Production. , Algal Research. (2015).
- Eaton, A. D., Clesceri, L. S., Rice, E. W., Greenberg, A. E. 3125B. Inductively coupled plasma/mass spectrometry (ICP/MS) method. Standard methods for the examination of water and wastewater. , (2005).
- Eaton, A. D., Clesceri, L. S., Rice, E. W., Greenberg, A. E. Standard methods for the examination of water and wastewater. , APHA-AWWA-WEF. (2005).
- Matrix effects in the ICP-MS analysis of selenium in saline water samples. Smith, M., Compton, J. S. Proceedings of the 2004 Water Institute of Southern Africa Biennial Conference, Cape Town, South Africa, , (2004).
- Mehta, S. K., Gaur, J. P. Use of algae for removing heavy metal ions from wastewater: progress and prospects. Crit Rev Biotechnol. 25 (3), 113-152 (2005).
- EPA, U. Method: 200.8: Determination of trace elements in waters and wastes by inductively coupled plasma - mass spectrometry. , (1994).
- Eaton, A. D., Clesceri, L. S., Rice, E. W., Greenberg, A. E. 3120B. Inductively coupled plasma (ICP) method. Standard methods for the examination of water and wastewater. , (2005).
Tags
Miljövetenskap alger tungmetaller,Get cutting-edge science videos from JoVE sent straight to your inbox every month.









