Abstract
Die zunehmende Nachfrage nach erneuerbaren Kraftstoffen hat Forscher die Machbarkeit alternativer Einsatzmaterialien, wie beispielsweise Mikroalgen. Inhärenten Vorteile sind die hohe Ertragspotenzial, Verwendung von Nicht-Ackerland und die Integration mit Abfallströmen. Die Nährstoffbedarf eines großen Mikroalgen-Produktionssystem wird die Kopplung von Anbausystemen mit Industrieabfällen Ressourcen wie Kohlendioxid aus Rauchgas und Nährstoffe aus dem Abwasser erforderlich. In diesen Abfällen vorhanden anorganischen Verunreinigungen kann potenziell zu Bioakkumulation in Mikroalgen-Biomasse führen, sich negativ auf die Produktivität und die Begrenzung der Endanwendung. Diese Studie konzentriert sich auf die experimentelle Evaluierung der Auswirkungen und das Schicksal von 14 anorganischen Verunreinigungen (As, Cd, Co, Cr, Cu, Hg, Mn, Ni, Pb, Sb, Se, Sn, V und Zn) auf Nannochloropsis salina Wachstum . Mikroalgen in Photobioreaktoren bei 984 & mgr; mol m -2 s belichtet bei pH 7 in einem Wachstums m -1 kultiviert und gepflegtEdia verschmutzt mit anorganischer Verunreinigungen in Konzentrationen erwartet, basierend auf der Zusammensetzung in kommerziellen Kohlenabgasanlagen gefunden. In der Biomasse und dem Medium am Ende einer 7-tägigen Wachstumsperiode vorhandenen Verunreinigungen wurden analytisch durch Kaltdampf-Atomabsorptionsspektrometrie für Hg und durch induktiv gekoppelte Plasma-Massenspektrometrie für As, Cd, Co, Cr, Cu, Mn, Ni quantifiziert, Pb, Sb, Se, Sn, V und Zn. Die Ergebnisse zeigen, N. salina ist ein empfindlicher Stamm, der zur Mehrmetall-Umgebung mit einer statistischen Abnahme der Biomasse yieldwith der Einführung dieser Verunreinigungen. Die hier vorgestellten Techniken sind ausreichend für die Quantifizierung von Algenwachstum und Bestimmung des Schicksals von anorganischen Verunreinigungen.
Introduction
Im Vergleich zu herkömmlichen terrestrischen Kulturpflanzen Mikroalgen sind gezeigt worden, um höhere Biomasse und Lipid Ausbeuten aufgrund inhärenter höherer Solarumwandlungseffizienzen 1,2 erzielen. Kultivierung von Mikroalgen bei hohen Produktivitätsraten erfordert die Versorgung mit verschiedenen Nährstoffen, einschließlich einer externen Kohlenstoffquelle. Es wird erwartet, dass großflächige Wachstum Einrichtungen werden mit industriellen Abfallströme wie industriellen Abgas um die Produktionskosten zu minimieren integrieren und gleichzeitig bieten Umweltsanierung. Industrieabfälle Kohlenstoff ist in der Regel in Form von gasförmigem Kohlendioxid und Schadstoffe, die das Potenzial, sich negativ auf die Produktion von Mikroalgen haben, enthalten. Konkret wird Rauchgas aus Kohle eine Vielzahl von Verunreinigungen aufweisen, einschließlich aber nicht beschränkt auf Verbrennungsprodukte Wasser und Kohlendioxid, sowie Oxide von Schwefel und Stickstoff, Feinstaub, organische Verunreinigungen, wie Dioxine und Furane sowie anorganische con begrenztSchadstoffe wie Schwermetalle. Die Auswirkungen der meisten dieser Verunreinigungen, einschließlich anorganische Stoffe mit einigen von ihnen, wie Schwermetalle auf Mikroalgen Produktivität bekannt wurden nicht untersucht worden. Einige dieser Elemente können Nährstoffe in geeigneten Konzentrationen sein, aber bei höheren Konzentrationen sie Zelldysfunktion und sogar Tod 3 produzieren kann.
Die Integration von Mikroalgen mit industriellen Abgas hat das Potential, anorganischen Verunreinigungen in das Wachstumsmedium direkt einzuführen. Kohlebasis Abgas hat eine Vielzahl von anorganischen Elementen (beispielsweise As, Cd, Co, Cr, Cu, Hg, Mn, Ni, Pb, Sb, Se, Sn, V und Zn) in verschiedenen Konzentrationen von denen einige, in niedrigen Konzentration, stellen Nährstoffe für Mikroalgenwachstum. Anorganischen Verunreinigungen haben eine hohe Affinität zu den Mikroalgen zu binden und weiter intern durch Nährstofftransport sorbiert werden. Einige anorganische Verunreinigungen (dh, Co, Cu, Zn und Mn) sind Nährstoffe, die Bestandteil von Enzymen bilden beinhaltend in der Photosynthese, Atmung und andere Funktionen 3,4. Jedoch im Überschuß von Metallen und Metalloiden können toxisch sein. Andere Elemente, wie Pb, Cd, Sn, Sb, Se, As und Hg, sind nicht bekannt, die Zellfunktion in jeder Konzentration unterstützt und stellen nicht-Nährstoff Metalle, die sich negativ auswirken könnte Kulturwachstum 3,5,6. Das Vorhandensein von jeder dieser Verunreinigungen hat das Potenzial, negative Auswirkungen auf die Mikroalgenzellfunktion zu erzeugen. Weiterhin ist die Wechselwirkung von mehreren Metallen mit Mikroalgen verkompliziert Wachstumsdynamik und das Potential hat, das Wachstum auswirken.
Großökonomie wurden direkt auf die Produktivität des Kultivierungssystem 7-19 verbunden. Außerdem ist Medium Rückführung in der Mikroalge Wachstumssystem für entweder offen Laufbahn Teichen (ORP) oder Photobioreaktoren (PBR) kritisch, da sie repräsentiert 99,9 und 99,4% der Masse, bzw. 20. Die Anwesenheit von anorganischen Verunreinigungen in den Medien könnte letztlich begrenzen microalgae Produktivität und das Recycling von Medien durch Verunreinigung Aufbau. Diese Studie experimentell bestimmt die Auswirkungen 14 anorganischen Verunreinigungen (As, Cd, Co, Cr, Cu, Hg, Mn, Ni, Pb, Sb, Se, Sn, V und Zn) in Konzentrationen von der Integration von Mikroalgen Kultivierungssysteme erwartet Kohle abgeleiteten Rauchgas, auf die Produktivität der N. salina in Luftbrücke PBRs gewachsen. Die in dieser Studie verwendeten Verunreinigungen haben gezeigt, dass nicht nur in Steinkohle gewonnene Rauchgas aber Siedlungsabfall-basierte Abgas, biosolids-basierte Abgas, kommunales Abwasser, erzeugt Wasser, beeinträchtigt das Grundwasser und Meerwasser 21-23 vorliegen. Die in dieser Studie verwendeten Konzentrationen sind auf erwarten wäre, wenn Mikroalgenwachstumssysteme wurden mit einem Kohlebasis CO 2 -Quelle mit einer Aufnahmeeffizienz in kommerziellen PBR Systeme 20 gezeigt, integriert werden kann. Detaillierte Berechnungen unterstützen die Konzentration der Schwermetalle und anorganische Verunreinigungen werden in Napan vorgestelltet al. 24 Analytische Techniken wurden verwendet, um die Verteilung der meisten Metalle in den Biomasse, Medien und Umwelt zu verstehen. Die vorgestellten Methoden ermöglichte die Beurteilung der Produktivitätspotenzial von Mikroalgen unter anorganische Kontaminanten Stress und Quantifizierung ihrer Ende Schicksal.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Wachstum System

Abbildung 1. Mikroalgen Wachstum-System. (A) Luft Rotometer, (B) CO 2 Rotometer, (C) pH-Regler mit Magnet, (D) Datenlogger (E) in-line Luftfilter (F) Luftverteilerkopf, (G) Fluoreszenzlicht Bank, (H) pH-Meter, (I) Kühlsystem, (J) Wasserbad, (K) Thermoelementdraht, (L) Airlift-Photobioreaktor, (M) Heizung, (N) begehbarer fume Abzugshaube, (O) zu entlüften, (P) Liefermenge Kapillare, (Q) Luftfilter, (R) Probenrohr, (S) PBR Silikondeckel, und (T)pH auch in Silikondeckel. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
- Erstellen Sie das folgende Mikroalgen experimentellen Wachstumssystem (Abbildung 1).
- Erwerben zwölf Airlift PBRs bestehend aus Glas Rohrreaktoren 4,5 cm Durchmesser und 80 cm in der Höhe mit einem Kultivierungs Kapazität von 1,1 l mit Silikon Deckel. Erwerben vorgeschnittenen Glaskapillaren (5 mm Außendurchmesser und 1 mm Innendurchmesser) von 10 cm (3 pro PBR) und 85 cm (1 pro PBR) in der Länge.
- Einfrieren Silikondeckel in einem -80 ° C Tiefkühltruhe. Schmieren Sie einen Bohrer mit Glycerin und während Deckel eingefroren Bohrer 3 Löcher, um die Entlüftung, Probenahme und Gasförder Kapillaren Gastgeber und 1 Loch von 17 mm Durchmesser, um eine pH-Sonde zu hosten.
- Setzen Sie die 3 Kapillaren in Stadt mit der längsten Röhre, die sich 2 cm vom Boden des PBR. In der anderen Kapillarröhrchen fügen Sie einen Silikonschlauch with ein Kapillarrohr an das andere Ende sich zu einem gewünschten Abtastpunkt befestigt. Decken Sie das Loch für die pH-Meter mit einem Silikonstopper Größe 21D.
- Befeuchtung der Luft durch Sprudeln es durch Wasser und liefern die befeuchtete Luft zum Luftverteilerkopf. Führen Sie das Gas durch ein 0,2 um Filter und liefern sie an die Algensuspension durch die längste Glas Lieferung Kapillare.
- Liefern komprimierte CO 2 in den befeuchteten Luftstrom, um einen neutralen pH-Wert von 7,0 ± 0,1 in der Kultursuspension zu erhalten. Steuern Sie die Geschwindigkeit der CO 2 Lieferung mit einem automatisierten CO2-Apotheke System (pH-Controller), die ein magnetisches Solenoid öffnet, wenn die Algenkultur erreicht pH 7,1 und schließt bei pH 6,9.
- Sorgen für Licht mit 24 T5-Leuchtstofflampen, die in einer durchschnittlichen Ausleuchtung von 984 & mgr; mol m -2 s -1 ähnlich wie die Außentemperaturen Spitzenergebnis.
- Tauchen Sie die PBRs in ein Wasserbad, um maintain eine konstante Temperatur von etwa 25 ° C. Kontrollieren Sie die Temperatur des Systems mit Hilfe eines Umlaufkühler und eine automatische Heizungswasserkreislauf Bad Einheit Kontrolle.
- Überwachen Temperatur und pH-Wert in Echtzeit aufzeichnen und mit einem Datenlogger.
- Sicherzustellen, dass alle Komponenten der Mikroalge Wachstumssystem richtig funktionieren, insbesondere vor der Ernte Mikroalge Inokulum oder Herstellung von anorganischen Verunreinigungen, wie sie nicht erhalten werden kann.
2. Lab Ware Vorbereitung
- Messkolben, PBRs, Ballons und keine Behälter mit Seife und Leitungswasser zu waschen. Spülen mit VE-Wasser (DW).
- Säure spülen Sie die Labormaterialien verwenden, um alle Spuren von anorganischen Verunreinigungen zu beseitigen. Dies kann durch eine von zwei Arten durchgeführt werden:
- Soak Labormaterialien O / N in 10% Spurenmetall Salpetersäure (ACHTUNG: Rauch nicht einatmen, konzentrierte Salpetersäure kann schwere Verbrennungen und giftigen Rauch, unter dem Abzug hoo produzierend mit Nitril-Handschuhe, Schutzbrille und Labormantel).
- Soak Labormaterialien für 15 min in 50% Spurenmetall Salpetersäure.
- Mit DW Spülen Sie die Labormaterialien gründlich mindestens 3 mal dafür, dass alle Säure entfernt wird. Es ist kritisch, daß PBRs gut gespült werden, insbesondere die Probenahmeröhrchen und die Kapillarrohre. Gelingt dies nicht, wird Ansäuerung des Mediums und mögliche Wachstumshemmung zu erzeugen. Testen Sie den pH-Wert des Spülwassers, um alle Säure überprüfen, wurde entfernt.
- Sterilisieren PBRs, Behälter und Flaschen durch Autoklavieren sie bei 120 ° C und Standardatmosphärendruck von mindestens 30 min.
3. N. salina Medium Vorbereitung
- Herstellung der Lösung A: Teilweise einen 1 L-Messkolben mit DW zu füllen. Setzen Sie einen Magnetrührstab und fügen Sie die in der Tabelle 1 nacheinander gezeigt Chemikalien. Stellen Sie sicher, dass jede Zutat löst vor der Zugabe des nächsten Bestandteil. Entfernen Sie den Magneten und füllen the-Kolben auf die 1 L Volumen-Marke.
| Komponente | Menge hinzufügen (g) | Endkonzentration (g / L) |
| H 3 BO 3 | 0,900 | 0,900 |
| Na 2 MoO 4 · 2H 2 O | 0,012 | 0,012 |
| MnCl 2 · 4H 2 O | 0,300 | 0,300 |
| ZnSO 4 · 7H 2 O | 0,060 | 0,060 |
| CuSO 4 · 5H 2 O | 0,020 | 0,020 |
. Tabelle 1: Lösung A Rezeptur Mengen sind Mengen, die bei der Herstellung von 1 l konzentrierte Lösung benötigt.
- Herstellung von Vitamin-Lösung: In drei separaten volumetric Kolben hinzuzufügen, die Vitamine, wie in Tabelle 2 gezeigt. Filter Jeder Vitaminlösung durch ein steriles 0,2 um-Spritzenfilter in einen sterilen Behälter. Preserve Vitamine bei -4 ° C im Dunkeln.
| Vitamine | Menge (mg) | Endvolumen (ml) | Schluss Vitamin-Konzentration (mg / L) |
| Biotin | 12.22 | 500 | 24,43 |
| Vitamin B12 | 13.50 | 100 | 135.00 |
| Thiamin-Hydrochlorid | 977,63 | 500 | 1,955.27 |
Tabelle 2:. Vitaminlösung Rezeptur Mengen sind Mengen, die für die Herstellung von konzentrierten Lösungen benötigttion.
- Teilweise zu füllen einen 20 l autoklavierbare Behälter mit DW und setzen Sie einen Magnetrührer. Stellen Sie den Behälter auf einem Magnetrührer Platte und fügen Sie die in Tabelle 3 (mit Ausnahme der Vitamine) gezeigt, Chemikalien, indem Sie sie eine nach der anderen und nach jedem vollständig auflöst. Füllen Sie den Behälter bis 20 L. erreichen
| Komponente | Belaufen sich auf bis mittel hinzufügen | Einheit |
| NaCl | 350.00 | g |
| CaCl 2 · 2H 2 O | 3.00 | g |
| KCl | 9.60 | g |
| Na 2 SiO 3 · 9H 2 O | 1.14 | g |
| MgSO 4 · 7H 2 O | 29.60 | g |
| 20.40 | g | |
| KH 2 PO 4 | 1.36 | g |
| Ammonium Eisencitrat | 0.10 | g |
| Lösung A | 20,00 | ml |
| Biotin-Lösung * | 818,00 | ul |
| Vitamin B12-Lösung * | 296,20 | ul |
| Thiamin-Hydrochlorid-Lösung * | 521,60 | ul |
| * In den gekühlten Autoklaven Medien |
Tabelle 3: N. salina Medium Rezept. Die Mengen sind Mengen, die bei der Herstellung von 20 l nährstoffreichen Medium benötigt.
- Sterilisieren des Mediums durch Autoklavieren für 30 Minuten bei 120 ° C und Atmosphärendruck. Lassen Sie das Medium cool bis auf RT.
- Stellen Sie den Behälter auf einem Magnetrührer Platte. Fügen Sie die in Schritt 3.2 vorbereitet Vitamine und lassen Sie die mittlere Mischung gründlich.
4. anorganischen Verunreinigungen Stoffaufbereitung
- Teilweise zu füllen den Messkolben in Tabelle 4 angegeben mit DW und fügen Sie die einzelnen Salz aufgeführt. Füllen Sie mit DW auf die gewünschte endgültige Volumen und gründlich mischen. Diese Aktien erhalten Sie nicht als einzelne Elemente zu adsorbieren an Wänden Flasche
ACHTUNG: Mehrere anorganischen Verunreinigungen in diesem Protokoll verwendet werden, sind krebserregend, teratogen und mutagen, ein Mundschutz getragen, Handschuhe und Laborkittel beim Umgang mit Salzen.
| Analyten | Salzquelle | Volumen der Stamm vorzubereiten (L) | Salz nach in den Kolben hinzufügen60; (Mg Salz) | Analytkonzentration zu der Kultur zugegeben (mg Analyt / l) |
| Als | NaAsO 2 | 0.1 | 14,8 | 7.74E-02 |
| CD | CdCl 2 | 0,5 | 13,5 | 1.50E-02 |
| Co | CoCl 2 · 6H 2 O | 0,5 | 34,7 | 1.56E-02 |
| Cr | Na 2 Cr 2 O 7 · 2H 2 O | 0.1 | 40,6 | 1.29E-01 |
| Cu | CuCl 2 · 2H 2 O | 0.1 | 38,3 | 1.30E-01 |
| Hg | HgCl 2 | 1.0 14,6 | 9.80E-03 | |
| Mn | MnCl 2 · 4H 2 O | 0.1 | 58,8 | 1.49E-01 |
| Ni | NiCl 2 · 6H 2 O | 0.1 | 112,0 | 2.51E-01 |
| Pb | PbCl 2 | 0,5 | 39.9 | 5.41E-02 |
| Sb | Sb 2 O 3 | 0,5 | 26,7 | 4.06-02 |
| Se | Na 2 SeO 3 | 0,5 | 11,8 | 9.80E-03 |
| Sn | SnCl 2 · 2H 2 O | 0,5 | 3.9 | 3.76E-03 |
| V | V 2 O 5 | 0.1 | 22.2 | 1,13e-01 |
| Zn | ZnCl 2 | 0.1 | 99,9 | 4.36E-01 |
Tabelle 4:. Konzentrierte anorganische Verunreinigungen Stoffaufbereitung Die Zugabe von 1 ml dieser konzentrierten Stamm auf den 1.1 L PBR Medium erzeugt den in der letzten Spalte angezeigt Endkonzentration.
- Sterilisieren der anorganischen Verunreinigung Bestände, indem die Lösung durch ein steriles 0,2 um-Spritzenfilter filtriert und das Filtrat in ein steriles Röhrchen.
5. N. salina Inokulum Produktion
- In einem 500 ml Erlenmeyer-Kolben mit 200 ml Medium in Schritt 3 hergestellt und dann werden 3 g Agar. Bedecken Sie den Kolben, der mit Aluminiumfolie und Autoklaven für 20 min bei 120 ° C. Füllen Sie die Lösung in sterile Petrischalen und abkühlen lassen, bis es sich verfestigt. Dies sollte eine sterile Haube oder zumindest in der Nähe einer Flamme in einer sauberen Umgebung zu Kontaminationsrisiko zu verringern abgeschlossen sein.
- Streak N. salina Zellen in sterile Petri-dishes bereit in Schritt 5.1 mit einer sterilen Seeding loop. Legen Sie die Petrischale Kulturen auf einem Tisch mit T12-Leuchten bei RT gehalten beleuchtet. Mikroalgen wachsen lassen, bis Kolonien sichtbar sind.
- Transfer Kolonien Erlenmeyer-Kolben, die 200 ml von nährstoffreichen Medium in Schritt 3 hergestellt und halten sie auf einer beleuchteten Rütteltisch (1.000 RPM) steril. Lassen Sie die Kultur wachsen, bis Medium wird grün.
- Übertragen Sie die Mikroalgen zu einem 1,1 l sterile PBR. Setzen Sie den PBR in einem Inokulum Wasserbad bei 200 & mgr; mol m -2 s -1 mit T8 Leuchtstoffröhren durch eine Umlaufkühler und einem automatisierten Heizung Umlaufwasserbad Steuer beleuchtet und bei 23 ° C gehalten. Einstellen der Luft und CO 2 Rotometern bis 2,5 L min -1 und 25 cm min -1.
- Nach einer Woche Wachstum Split Biomasse in neuen 1 .1 L PBRs enthält neue Medium und lassen Sie es, bis insgesamt mindestens 28 g Trockengewicht Biomasse wachsenzwischen den beiden Reaktoren, die optische Dichte bestimmt werden kann, erhalten.
- Ernte des Inokulums Biomasse durch Zentrifugation bei 2.054 × g für 15 min bei 10 ° C unter Verwendung von sterilen Zentrifugenflaschen und sterile Techniken, um eine Kontamination zu vermeiden. Entsorgen Sie den Überstand und weiterhin Zellkonzentration nach Bedarf.
- Sobald alle Biomasse zentrifugiert Wieder die Zellen in 300 ml frischem sterilem Medium.
- Verdünnte 0,1 ml Mikroalgenkultur in 3 ml DW auffüllen und 0,1 ml dieser neuen Lösung in 3 ml DW. Achten Sie darauf, die Probe wird gründlich gemischt. Anschließend wird die optische Dichte (OD) der Mikroalgen-Konzentrat bei 750 nm () sofort unter Verwendung eines Spektrophotometers.
- Verwenden der Gleichung (1), um die Menge an Biomasse in dem Konzentrat zu bestimmen.
Hinweis: Die Gleichung (1) wurde aus der linearen Regression zwischen gegen Schwebstoffen von N. erhalten (in g / L -1) Salina (R 2 = 0,9995). Gleichung 1 wurde für die spectr entwickeltenophotometer Modell in der Werkstoff-Tabelle, erzeugen eine neue Kalibrierung, wenn mit einem anderen Spektralphotometer Modell.- Unter Verwendung der Gleichung (2) berechnet das Volumen der Mikroalgen-Konzentrat (in L) benötigt, um eine 4 g / L -1 Kulturdichte in einem pBr-Wert von 1,1 l Volumen (in L) zu erhalten.
- Verwendung steriler Techniken fügen das Volumen der Mikroalgen konzentrieren sich in dem Schritt 5.9 mit einem autoklavierten PBR gefunden, um eine anfängliche Kulturdichte von 4 g / L -1 zu erreichen. Füllen PBR mit mittleren bis 1,1 L. Wiederholen Sie diesen Schritt, bis 6 PBRs geimpft werden. Legen Sie die PBRs in dem Inokulum Wasserbad.
- Lassen Sie die Mikroalgen in den PBRs wachsen für 8 Tage und dann ernten die Biomasse (durch Wiederholen der Schritte von 5,6 bis 5,7). Wiederholen Sie Schritt 5.8 zur Berechnung der AnfangsInokulum Volumen für einen anfänglichen Kulturdichte von 1 g / L -1.
6. Versuchsreaktoren
- Mit sterilen Techniken hinzuzufügen ca. 1 l Medium in Schritt 3, um jedem der 12 säure gespült sterile PBRs vorbereitet. Platzieren Sie die PBRs im Wasserbad der experimentellen Wachstumssystem. Schalten Spülung Luft auf bei 1,5 L min -1.
- Sterilisieren eines kalibrierten pH-Meters durch Reinigung mit 70% Ethanol. Messung des pH-Werts des Mediums, in dem PBR und sorgen pH ca. 7,0; Wenn nicht, wiederholen Sie Schritt 2, um Säure aus dem Säurewaschschritt ausgelaugt zu entfernen.
- Kalibrieren Sie jeden pH-Controller unter Verwendung von Puffer pH 7, Desinfizieren Sie die Sonden mit Ethanol (70%) und dann legen Sie sie in den PBRs Deckel.
- Zu jeder PBR (mit Ausnahme der Steuer PBRs) 1 ml jeder der sterile anorganischen Verunreinigungen Aktien in Schritt 4 bereit Lassen Sie die Verunreinigungen gründlich im PBR mischen. Die endgültige Konzentration der anorganischen Verunreinigungen in den PBRs sind Shown in der letzten Spalte der Tabelle 4 und werden die geschätzten maximalen Konzentrationen von einem Kohlekraftwerk Integration erwartet.
- Hinzuzufügen 14 ml sterilem DW den Steuer PBRs.
- Fügen der konzentrierten Mikroalgen Inokulums in Schritt 5.11 an die experimentellen PBRs erhalten, um einen anfänglichen Kulturdichte von 1 g / L -1 erhalten. Lassen Biomasse Mischung gründlich.
- Schalten hoher Lichtintensität Leuchten (von 984 & mgr; mol m -2 s -1) und pH-Controller auf und passen CO 2 bis 30 cc min 1. Erhöhen Sie die CO 2 Fluss in 50 ccm min -1 von Tag 3 danach. Initial niedrigen CO 2 Flussrate ist entscheidend, um große Veränderungen im pH-Wert zu vermeiden, aufgrund von Verzögerungen bei Gas / Flüssig-Transfer und die pH-Messung.
- Messen und Proben nach Bedarf. Achten Sie darauf, um den Wasserstand nach der Probennahme zu markieren. (ACHTUNG: einige anorganische Schadstoffe in der PBR sind krebserregend, teratogen und mutagen, Handschuhe und CAPPed Behälter beim Umgang mit Proben).
- In sterile DW täglich zu den PBRs um für Verdunstungsverluste auszugleichen.
- Nach 7 Tagen Wachstum geerntet, die Biomasse durch Zentrifugation bei 9.936 × g und bewahren sowohl Biomasse und Überstandsmedium, bei -80 ° C.
- Gefriertrockne die Biomasse bei 0,1 mbar und -50 ° CO / N. Powder die Biomasse (verwenden Sie einen Spachtel, um Pulver Biomasse innerhalb der Zentrifugenröhrchen). Bewahren gefriergetrocknet Biomasse bei -80 ° C.
7. mikrowellenunterstützten Aufschluss der Proben
Die Verdauung der Biomasse Proben als Vorverarbeitungsschritt für ICP-MS-Analyse erforderlich.
Hinweis: Diese Schritte geschlossenes Gefäß Mikrowellenaufschluss-System mit kontrollierten Druckentlastung. (ACHTUNG: Hohe Drücke entwickeln während der Säureaufschluss, überprüfen Sie die körperliche Unversehrtheit der Aufschlussgefäße und Schilde, und Neugestaltung des Mikrowellenaufschlussgefäßdeckel vor jedem Einsatz).
- Wash Teflon Mikrowellenaufschlussgefäße mit Wasser und Seife gründlich mit DW und lassen Gefäße der Luft trocknen. Um Spurenmetallverunreinigungen in den Gefäßen zu entfernen verdauen Säure, wie in den folgenden Schritten beschrieben.
- Umgestaltung der Mikrowellenaufschlussgefäß Deckel und schließen Sie die Fläschchen fest.
- 10 ml Salpetersäure zu jedem.
- Führen Sie das Gefäß in der Sicherheitsschild. Sicherzustellen, dass keine Biomasse, Wasser oder jegliche Reagenzien werden auf die Wände des Schutzschildes oder in den Außenwänden der Aufschlussgefäße, um eine Beschädigung der Schutzschild vermeiden gelassen. Verschließen Sie die Sicherheitsabdeckung mit Sicherheitsventil dafür, dass die Feder in der Ampulle bündig. Suchen Sie das Schild auf dem Rotor mit der Kappe Öffnungen nach außen zeigen in der äußeren Reihe und nach innen in der inneren Reihe.
- Am Schiff Nummer eins, legen Sie die Keramikschutzrohr und den Temperatursensor. Dieses Thermometer überwacht die tatsächliche Innentemperatur in dem Fläschchen und dient als Steuerungsgröße, um die Verdauung progr ausführenbin. Stellen Sie sicher, dass Fläschchen Nummer eins enthält die gleichen Proben- und Reagenzienmengen wie die anderen Durchstechflaschen.
- Geben Sie die Verdauung Parameter in Tabelle 5 gezeigt und starten Sie die Verdauung. Wenn das Programm beendet ist, kühle Luft die Fläschchen, bis sie RT erreichen.
| Schritt | Vials Spülen | Probenaufschluss | ||||
| Temperatur (° C) | (Min) | Max. Leistung (W) | Temperatur (° C) | (Min) | Max. Leistung (W) | |
| 1 | RT bis 190 | 25 | 1000 | RT 180 | 15 | 1000 |
| 2 | 190 | 10 | 1000 | 180 | 15 | 1000 |
| - | 20 | - | - | 20 | - |
Tabelle 5: Parameter in der Mikrowellen-Aufschlussprogramm verwendet.
- Innerhalb einer Abzugshaube, legen Sie die Druckentlastungswerkzeug auf der Schutzkappe mit den Kappenöffnungen darauf von Ihnen entfernt. Sobald Druck Öffnen Sie den Deckel freigegeben wird (ACHTUNG: Always open verdauten Fläschchen innerhalb Abzug, da Biomasse Verdauung unter Verwendung von Säure produziert giftige Dämpfe).
- Entsorgen Sie die Säure. Spülen Sie die Teflongefäßen mit DW 3 mal. Lassen Vials der Luft trocknen.
- Biomasse verdauen, fügen Sie 50 mg gefriergetrockneter Biomasse Mikrowellenaufschlussgefäße. Für die Qualitätskontrolle (QC) bereiten die folgenden Durchstechflaschen: Durchstechflaschen in zwei verschiedenen fügen entweder 5 ml Stufe 7 ICPMS oder 5 ml der Stufe 7 Hg CVAAS Standard in den Schritten 9.1 und 10.1 (der verdauten Lösung dieses Fläschchen vorbereitet wird als Labor Festungs blank (LFB)), lassen eine weitere Ampulle leer ist (die verdauten Lösungvon diesem Fläschchen wird als Laborreagenz blank (LRB)).
- Bis mittel verdauen, 10 ml überstehende Medium zu Säure gespült Mikrowellenaufschlussgefäße trocknen. Für die Qualitätskontrolle (QC) bereiten die folgenden Durchstechflaschen: In zwei verschiedenen Durchstechflaschen mit 5 ml Stufe 7 oder ICPMS CVAAS Metall Standard in Schritt 9.1 und 10.1 (der verdauten Lösung dieses Fläschchen wird als LFB) bereit, in ein anderes Fläschchen hinzufügen 10 ml DW (Die verdaute Lösung dieses Fläschchen heißt der LRB).
- Umgestaltung der Mikrowellenaufschlussgefäß Deckel und schließen Sie die Fläschchen fest.
- In 7 ml konzentrierte Spurenmetall Salpetersäure und 3 ml Wasserstoffperoxid zu jedem Fläschchen. Den Inhalt durch leichtes Schwenken Sie die Lösung. Verdauen, den Inhalt der Durchstechflaschen durch Wiederholung der Schritte 7.4 bis 7.7 (verwenden Sie die Mikrowellenaufschluss Parameter für Probenaufschluss in Tabelle 5).
- Hinzuzufügen verdaute Probe in einen 25 ml Meßkolben, das Spülen der Behälter mit DW für eine erhöhte Rückgewinnung. Messkolben mit DW füllenzur Marke.
- Übertragungs verdauten Proben zu einem verschlossenen Behälter. Bewahren Proben bei 4 ° C bis zur Analyse abgeschlossen werden kann. Für diese Studie Analyse wird noch am selben Tag für Hg und innerhalb von drei Tagen für die anderen Elemente durchgeführt.
8. Qualitätskontrolle (QC) Proben
Hinweis: Analysieren Sie QC-Proben, um die Zuverlässigkeit der Ergebnisse von experimentellen Proben zu gewährleisten.
- Teilweise zu füllen eine Säure gespült 1 L Messkolben mit DW. In 280 ml konzentrierte Spurenmetall Salpetersäure und gründlich mischen (diese Lösung wird auch als Blindlösung) (ACHTUNG: Stets Säure in Wasser, niemals Wasser hinzufügen, um Säure als die exotherme Reaktion kann heftig sein). Lassen Lösung auf RT abkühlen.
- Neben der QC-Proben in den Schritten 7.9 und 7.10 bereit, bereiten Sie die folgenden QC-Proben.
- Für die weitere Überprüfung der Kalibrierung (CCV): Füllen Sie ein Polystyrolröhrchen mit Kalibrierungsstandard (Herstellung sieheSchritt 9.2 und 10.1). Legen Sie die Hg-Standardlösung auf der CVAAS Rack und den ICPMS Standardlösung in der ICPMS Autosampler.
- Für die weitere Kalibrierung blank (CCB): Füllen Sie zwei Polystyrolröhrchen (16 ml) mit dem Rohling (in Schritt 8.1) hergestellte Lösung. Legen Sie eine Probe in der CVAAS Rack und die andere Probe in der ICPMS Autosampler.
- Für Labor-angereicherte Matrix (LFM): Nach dem Zufall wählen 1 Probe von jeweils 12 Proben für jeden Typ der Probe (dh Biomasse oder mittel) und verwenden Sie es, um eine LFM vorzubereiten. Für ICPMS, fügen Sie 0,5 ml ICPMS Standard Stufe 7 und 3 ml verdaut Versuchsprobe (entweder aus Biomasse oder mittel) zu einem Polystyrolröhrchen.
- Mischen Sie Inhalte und legen Sie die Durchstechflaschen auf der ICPMS Autosampler. Für CVAAS, 2 ml Hg Standard Stufe 7 und 6 ml verdaut Versuchsprobe (entweder aus Biomasse oder mittel) zu einem Polystyrolröhrchen. Mischen Sie Inhalte und Platz auf dem Fläschchen CVAAS Rack.
- Für die Doppelproben: Nach dem Zufall wählen 1 Probe jey 12 Proben für jede Art der Matrix (beispielsweise Biomasse, mittel, LFM oder jeder verdünnten Matrix) und Duplizieren der Fläschchen. Legen Sie die wiederholte Phiolen ICPMS in der Autosampler oder CVAAS Rack.
- Für die Doppelproben: Nach dem Zufall wählen 1 Probe von je 12 Proben für jeden Typ der Matrix (zB Biomasse, mittel, LFM oder einer verdünnten Matrix) und duplizieren das Fläschchen. Legen Sie die wiederholte Phiolen ICPMS in der Autosampler oder CVAAS Rack.
- Definieren Sie die Datenqualitätskriterien für die Studie. Für die vorliegende Studie zu duplizieren die Qualitätskriterien von Eaton, Clesceri, Reis und Greenberg 25 etabliert. Die für die Qualitätskontrolle festgelegten Parameter sind: prozentuale Differenz (% D) für CCV innerhalb ± 10% 25 (mit Ausnahme von Pb und Sb, siehe Diskussion), LFB Prozent Rückgewinnung (% R) im Bereich von ± 70 bis 130% 25. LFM Prozent Erholung (% R) von 75-125% 25, und die relative Differenz in Prozent (RPD) innerhalb von ± 20% 25, und ein fort caLibration blank (CCB) unter Methode Meldegrenze (MRL) 25. Siehe Berechnungsgleichungen in Schritt 9.7.
9. Quantifizierung durch induktiv gekoppelte Plasma-Massenspektrometrie (ICP-MS)
- Am Tag der Analyse, Transfer ca. 5 ml aufgeschlossene Probe auf Polystyrolröhrchen und legen Sie sie in der ICPMS Autosampler. In etwa 15 ml verdauten Proben auf Polystyrolröhrchen und legen Sie sie in der CVAAS Rack.
- Am selben Tag der Analyse bereiten die Kalibrierungsstandards. Fügen gekauft ICPMS Standardlösung und füllen mit leeren (in Schritt 8.1 hergestellten Lösung), wie in Tabelle 6 beschrieben (siehe Standardlösung Beschreibung in Material Table) zu Säure-Messkolben gespült.
| Parameter | Stufe 1 | Stufe 2 | Stufe 3 | Stufe 4 | Stufe 5 | Stufe 6 | Stufe 7 |
| Gekauft Standard hinzugefügt werden (ml) | - | - | - | - | - | - | 100 |
| Stufe 7 hinzugefügt werden (ml) | 0.0 | 1.0 | 2.5 | 5.0 | 20,0 | 25,0 | - |
| Endvolumen * (ml) | - | 50,0 | 50,0 | 50,0 | 100,0 | 50,0 | 100,0 |
| Endkonzentration (ug / l) | |||||||
| 75 Als | 0.0 | 2.0 | 5.0 | 100 | 20,0 | 50,0 | 1000,0 |
| 111 Cd | 0.0 | 1.0 | 2.5 | 5.0 | 100 | 25,0 | 50,0 |
| 59 Co | 0.0 | 100 | 25,0 | 50,0 | 100,0 | 250,0 | 500,0 |
| 52 Cr | 0.0 | 2.0 | 5.0 | 100 | 20,0 | 50,0 | 100,0 |
| 63 Cu | 0.0 | 5.0 | 12,5 | 25,0 | 50,0 | 125,0 | 250,0 |
| 55 Mn | 0.0 | 3.0 | 7.5 | 15,0 | 30,0 | 75,0 | 150,0 |
| 60 Ni | 0.0 | 8.0 | 20,0 | 40,0 | 80.0 | 200,0 | 400,0 |
| 208 Pb | 0.0 | 1.0 | 2.5 | 5.0 | 100 | 25,0 | 50,0 |
| 121 Sb | 0.0 | 12.0 | 30,0 | 60.0 | 120,0 | 300,0 | 600,0 |
| 51 V | 0.0 | 100 | 25,0 | 50,0 | 100,0 | 250,0 | 500,0 |
| 66 Zn | 4.0 | 100 | 20,0 | 40,0 | 100,0 | 200,0 | |
| * Erreichen dieses Volumen durch Hinzufügen der in Schritt 8.1 hergestellten Lösung | |||||||
Tabelle 6: Konzentration von Kalibrierstandards Ebenen 1 bis 7..
- Entfernen Sie die Zapfen aus den ICPMS und beschallen sie für 1 min in DW. Trocknen Sie die Kegel und setzte sie wieder in das Instrument.
- Schalten Sie den Wasserkühler, Gase (Ar, H 2, He), der ICPMS, Steckleitungen zu internen Standards, und füllen Autosampler Spülung Behälter (DW, 10% Salpetersäure, 1% Salpetersäure + 0,5% Chlorwasserstoffsäure) .
- Öffnen Sie die Masshunter Workstation Software und schalten Sie das Plasma, Abstimmung der ICPMS und laden Sie die Parameter in Tabelle 7 beschriebenen Methode.
| Parameter Werte | |||||||||
| Interne Standards | 72 Ge, 115 In | ||||||||
| HF-Leistung | 1.500 W | ||||||||
| Plasmagasströmungsgeschwindigkeit | 14,98 | ||||||||
| Vernebler Gasdurchsatz | 1,1 l / min (Träger und Verdünnungsgas kombiniert - 0,6 + 0,5 L / min) | ||||||||
| Probennahmekonus | Nickel für x-Objektiv | ||||||||
| Skimmer Kegel | Nickel | ||||||||
| Probenaufnahmerate | 0,3 rps | ||||||||
| Vernebler Pumpe | 0,1 rps | ||||||||
| S / C Temperatur | 2 ° C | ||||||||
| Scanning Zustand | Verweilzeit 1 s Anzahl an Wiederholungs 3 | ||||||||
| H 2 Gasstrom | N / A | ||||||||
| Er Gasstrom | 4,3 ml / min | ||||||||
| Parameter | Stufe 1 | Stufe 2 | Stufe 3 | Stufe 4 | Stufe 5 | Stufe 6 |
| L7 Hg Standard hinzugefügt werden (ml) | 0 | 1 | 2.5 | 5 | 20 | 25 |
| Endvolumen * (ml) | - | 50 | 50 | 50 | 100 | 50 |
| Endkonzentration (ug / l) | 0 | 0,5 | 1.25 | 2.5 | 5 | 12,5 |
| * Erreichen dieses Volumen durch Hinzufügen der in Schritt 8.1 hergestellten Lösung | ||||||
Tabelle 8: Die Konzentration von Hg Kalibrierstandard Levels 1 bis 6..
- Öffnen Sie das Ar-Gas und Luftventil, schalten Sie den Atomic Absorptiontion Spektralphotometer und die Fließinjektionsatomspektroskopie (FIAS). Öffnen Sie die CVAAS Winlab Software, schalten Sie den Hg-Lampe und warmlaufen lassen, bis Energieparameter der Software erreicht 79. Legen Sie das Programm für die Hg-Analyse mit den Parametern in der Tabelle 9. Stellen Sie den Lichtweg im Gerät, um die maximale Durchlässigkeit geben.
| Parameter | Werte |
| Trägergas | Argon, 100 ml / min |
| Lampe | Hg elektrodenlose Entladungslampe, Setup bei 185 mA |
| Wellenlänge | 253,7 nm |
| Schlitz | 0,7 nm |
| Zelltemperatur | 100 ° C |
| Probenvolumen | 500 & mgr; |
| Träger | 3% HCl, 9,23 ml / min |
| Reduktions | 10% SnCl 2, 5,31 ml / min |
| Messung | Spitzenhöhe |
| Lesen Sie Replikate | 3 |
Tabelle 9: CVAAS Betriebsbedingungen.
- Stecken Sie die Leitung in die Trägerlösung von 3% Spurenmetall Grad Chlorwasserstoffsäure hergestellt.
- Stecken Sie die Leitung in die Reduktionsmittellösung von 10% Zinnchlorid (geeignet für Hg-Analyse) in 3% Spurenmetall Grad Chlorwasserstoffsäure hergestellt. Bereiten Sie diese Lösung den gleichen Tag der Analyse, wie sie ist anfällig für Luftoxidation (ACHTUNG: Zinnchlorid ist sehr gefährlich, verwenden Sie Schutzkleidung bei der Arbeit mit ihm sammeln CVAAS Abfälle in gefährlichen Rückhaltung und ordnungsgemäß zu entsorgen.).
- Legen Sie die Hg-Standards, QC Proben und Versuchsproben in der CVAAS Zahn Eingang der Reihenfolge in der CVAAS Winlab Software. Führen Standards und erzeugen die Kalibrierungsgleichung.
- Run QC samples und experimentellen Proben. Die CVAAS zieht ungefähr 5 ml der Probe in das Instrument reduziert die vorliegende Hg in der Probe zu elementarem Hg (Hg 0) Gas und reinigt das Gas aus der Lösung mit einem Trägergas (Ar) in einem geschlossenen System. Die Hg-Dampf gelangt durch eine Zelle in der Hg-Lampe Lichtpfad. Ein Detektor bestimmt die bei 253,7 nm absorbiert Licht und setzt sie in die Konzentrations. (ACHTUNG: Hg-Dampf giftig ist, sicherzustellen, Instrument Dunstabzugshaube ist vorhanden).
- Berechnen Sie% R,% D und RPD im Schritt 9.7 bei der Analyse und vergleichen Sie die Ergebnisse auf die Projektdaten Qualitätskriterien.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Biomasseerträge
Herstellung von N. salina in der in dieser Studie verwendeten PBR Systems stieg von 1 g / l -1 auf 8,5 ± 0,19 g / L -1 (N = 12) für die Steuerung Reaktoren und 4,0 ± 0,3 g / L -1 (N = 12) für den in 7 Tagen Multimetall kontaminiert. Die Experimente erzeugt wiederholbare Daten in dreifacher Ausfertigung Reaktoren und mehrere Stapel auf. 2A zeigt die durchschnittlichen Kulturdichte mit sehr geringen Standardfehler basierend auf Probenahme aus drei unabhängigen PBRs. Um zu gewährleisten, diese Resultat war kein Einzel Ergebnis wurden drei Chargen mit ähnlichen Ergebnissen gewachsen. Die kombinierten Ergebnisse für alle vier Chargen werden in 2B gezeigt. Obwohl biologische Variabilität existiert, zeigt diese Studie, dass es eine konsistente negative Auswirkung von anorganischen Verunreinigungen N. salina Produktion. Die Biomasseerträge in der Verunreinigung ausgesetzt PBRs waren statistisch nicht unterschiedlich zu den Steuer PBRs ausTag 2 an (ANOVA, p <0,05).
Qualitätskontrolle Bewertung der anorganischen Verunreinigung Quantifizierung
Zwölf der vierzehn Elemente analysiert wurden vollständig einbringlich nach der Verdauung durch den LFB% R mit% R in der Nähe von 100% gezeigt, was anzeigt, keine Verluste, keine Gewinne und keine Kreuzkontamination von Analyten während der Verdauung (Tabelle 10). Während die quantitative Analyse von Proben% D und RPD wurden durch das Analyse- und dem Durchschnitt der Ergebnisse überprüft werden in Tabelle 10 gezeigt. As, Cd, Co, Cr, Cu, Hg, Mn, Ni, Pb, Sb, V und Zn bestanden die% D und RPD jedoch% D für Pb und Sb allmählich gesunken während der Analyse. Die% D für diese Elemente sind nach dem Kegelreinigung verbessert, ist aber konstant Kegelreinigungs unpraktisch, und damit die Datenqualitätsziele für Pb und Sb gesenkt wurden. CCB für alle Analyten lagen unter dem MRL. Matrixeffekte wurden durch die Analyse von Proben LFM und Erhalten der% R beurteilt. Während Co, Hg, V und Sb bestanden die QC Datenkriterien, es nicht von As, Cd, Cr, Cu, Mn, Ni, Pb und Zn bestanden, wenn verdauten Biomasse Proben wurden analysiert, was zu% R unterhalb der QC Ziele. Matrix Verdünnung in DW auf ein Verhältnis von 1: 3 (gelöster Stoff: Lösungsmittel) resultierte in% R, die Datenqualitätskriterien übergeben. Matrixeffekte wurden ebenfalls bei der Analyse des verdauten Überstand und wurden mit dem gleichen Verdünnungsverhältnis (Tabelle 10) dafür, dass die Verdünnung nicht die Nachweisgrenze des Geräts beeinträchtigen gerichtet. Probleme mit der Erkennung von Se und Sn beobachtet wurden basierend auf instabiler Anzeige und einer Kontamination Problem auf. Die instabile Messwerte für Se sind an Salzen in der Matrix 27 zugeschrieben. Die Sn-Verunreinigung zurück zu einer Säure im Aufschlußschritt verwendet zurückzuführen.
| Analyten | R | CCV | LFB | LFM für Biomasseproben | LFM für Überstandsproben | ||||
| % D | % R | Verdünnungsverhältnis | % R | RPD | Verdünnungsverhältnis | % R | RPD | ||
| QC 25 begrenzt | 0,9950 | ± 10 | 70-130 | - | 75-125 | ± 20 | - | 75-125 | ± 20 |
| Als | 0,9998 | 1.8 | 101,0 | 1: 3 | 100,4 | 5.2 | 1: 3 | 92,5 | -0.5 |
| CD | 1,0000 | 1.4 | 102,6 | 1: 3 | 103,5 | 4.6 | Keine | 92,3 | 0.6 |
| Co | 0,9997 | 1.7 | 98,8 | Keine | 95,2 | -1,4 | Keine | 96,5 | -15 |
| Cr | 0,9999 | 15 | 99,8 | 1: 3 | 96,5 | 1.8 | 1: 3 | 90,1 | -0.8 |
| Cu | 0,9999 | 2.9 | 98,2 | 1: 3 | 101,4 | 4.8 | 1: 3 | 94,4 | -0.5 |
| Hg | 0,9983 | -1.7 | 103,0 | Keine | 98,7 | 15 | Keine | 98,0 | 0.3 |
| Mn | 0,9998 | 2.9 | 97,6 | 1: 3 | 83,2 | 1.8 | 1: 3 | 95,4 | -1.7 |
| Ni | 0,9999 | 103,5 | 1: 3 | 98,5 | 2.1 | Keine | 93,3 | -0.9 | |
| V | 0,9998 | 2.5 | 97,2 | Keine | 95,5 | -15 | Keine | 101,2 | -1.9 |
| Pb | 0,9998 | 12,6 | 105,2 | 1: 3 | 88,9 | 0.0 | Keine | 93,5 | -0.5 |
| Sb | 0,9998 | 1.1 | 105,7 | Keine | 101,8 | -9,6 | Keine | 90,8 | -1.2 |
| Zn | 0,9997 | 5.2 | 120,8 | 1: 3 | 90,7 | 1.4 | Keine | 89,2 | -1.9 |
Tabelle 10: Zusammenfassung der Ergebnisse von Qualitätskontrollproben. R = correlation Koeffizient,% D: Prozent Differenz,% R: prozentuale Ausbeute, RPD = relative prozentuale Unterschied, Verdünnungsverhältnis bezieht sich auf solute: Lösungsmittel-Verhältnis.
Anorganische Schadstoffkonzentrationen
Heavy Metal und anorganischen Verunreinigungen wurden sowohl Biomasse und überstehende Medium gefunden. Die in der Biomasse in den 12 analysierten Elemente gefunden Konzentrationen sind in Abbildung 3 dargestellt. Die Konzentrationen in der Biomasse aus Dreifach PBRs geerntet (N = 3) im Batch # 1 zeigt eine sehr geringe Standardabweichung (3A). Kombinieren von Daten aus dreifachen PBRs 4 Chargen konsistent zeigt, dass anorganische Verunreinigungen in der Biomasse (N = 12) vorhanden sind. Die in der Überstandsmedium gefunden Konzentrationen sind in Abbildung 4 dargestellt. Die Ergebnisse zeigen, dreifach PBRs (N = 3) für den Batch # 1 haben auch kleine Standardfehler (4A) und zeigen, dass die meisten Verunreinigungen bevorzugt in der Biomasse l liegteading bis sehr niedrigen Konzentrationen in dem Überstand mit mehreren Probenkonzentrationen nahe der MRL des Instruments. Ergebnisse aus allen vier Chargen in 4B dargestellt.
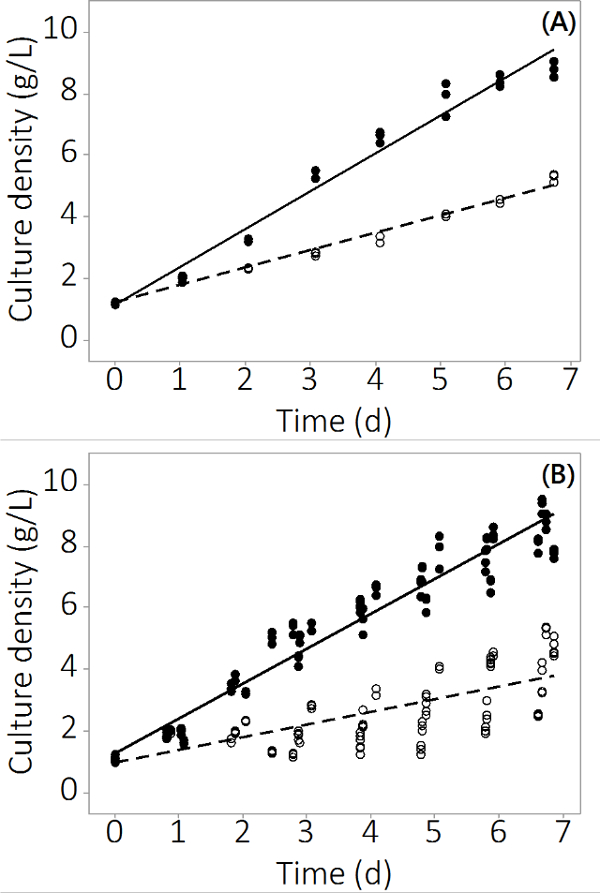
Abbildung 2. K ultur Konzentration über die Anbauperiode für kontaminierte und Kontrolle PBRs. (A) Kultur Dichte im Batch # 1, ergibt sich aus N = 3 PBRs. (B) Kultur Dichte in 4 Chargen, ergibt sich aus n = 12 PBRs. Leere Kreise stellen kontaminierte Biomasse gefüllten Kreise stellen die Kontrolle.
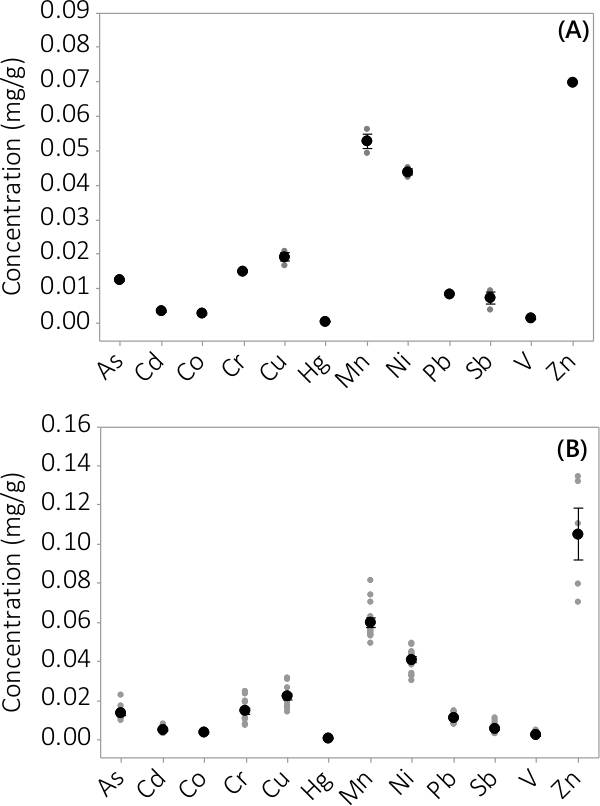
Abbildung 3. Die Konzentration der anorganischen Verunreinigungen in Biomasse. (A) Konzentration im Batch #1 ist, sich auf N = 1 PBR für Zn und n = 3 PBRs für alle anderen Analyten, (B) Konzentration von 4 Chargen, ergibt sich aus N = 4 PBRs für Zn und N = 12 PBRs für alle andere Analyte. Mittelwerte sind durch schwarze Kreise dargestellt gefüllt werden einzelne Datenpunkte von Grau gefüllte Kreise dargestellt. Fehlerbalken stellen ± eine Standardabweichung vom Mittelwert.
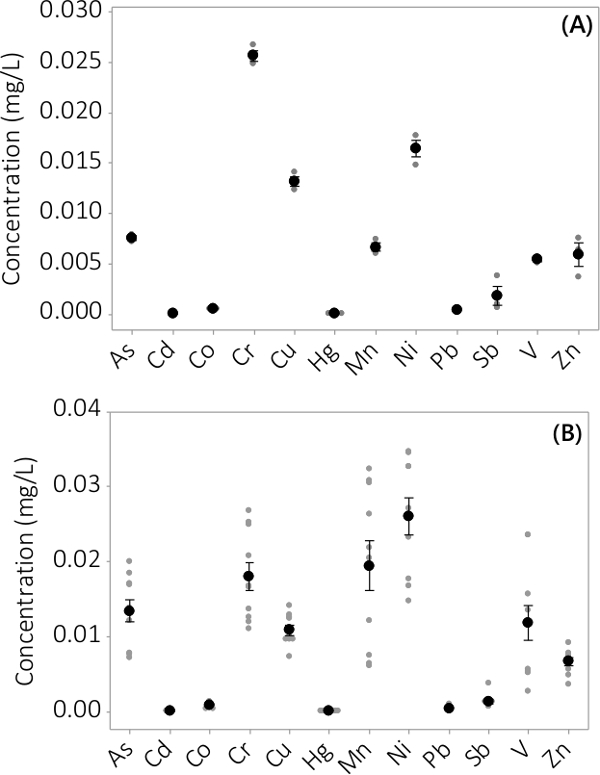
Abbildung 4. Die Konzentration der anorganischen Verunreinigungen im Überstand. (A) Konzentration im Ansatz # 1, resultiert aus N = 3 PBRs, (B) Konzentration von 4 Chargen, ergibt sich aus N = 12 PBRs. Mittelwerte sind durch schwarze Kreise dargestellt gefüllt werden einzelne Datenpunkte von Grau gefüllte Kreise dargestellt. Fehlerbalken stellen ± eine Standardabweichung vom Mittelwert.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Saline Mikroalgen N. salina erfolgreich im Wachstums gestaltet System reproduzierbare Ergebnisse und hohe Biomasseerträge angebaut werden. Airlift Mischen für einen gut gemischten suspendierten Kultur mit minimaler Absetzen oder Biofouling auf der 7-tägigen Wachstumsperioden erlaubt. Die minimale Licht Variabilität über die Fluoreszenzlicht Bank wird auch gezeigt, dass deutliche Unterschiede in Wachstum nicht zu produzieren.
Die Studie zeigt, Schwermetall verschmutzten Medien in Konzentrationen repräsentativ für die Integration mit Kohle Rauchgas wirkt sich negativ auf das Biomassenwachstum. Wiederholgenauigkeit in der Studie unterstreicht die Auswirkungen der Multi-Metall-System hat auf die Produktivität. Verschiedene Prozessschritte haben das Potenzial, das Wachstum negativ beeinflussen und verunreinigen das System erfordern sorgfältige Versuchsvorbereitung. Bestimmung des pH des Mediums vor dem Start des Experiments ist ein QC Schritt, zur Verifizierung, dass das Medium nicht angesäuert (zB resu ermöglichtlting unsachgemäße PBR Spülen nach Säure Einweichen). Angesäuerten Medium wird das Algenwachstum beeinflussen und verändern die Bioverfügbarkeit von Nährstoffen (zB Veränderungen im anorganischen Kohlenstoff Speziation und Metalle Artbildung) so beeinflussen die Wechselwirkungen zwischen Algen-Bindungsstellen, Nährstoffe und Metalle. Die sorgfältige Vorbereitung der Laborausstattung für diese Studien war erforderlich, so dass eine genaue Massenbilanz der eingesetzten Metalle können durchgeführt werden. Weitere Schritte in dem Verfahren haben das Potenzial, für Metalle die die Notwendigkeit für den Einsatz von richtigen Sorte Lösungsmittel und Chemikalien einzuführen vermisst. Proper QC durch den Prozess effektiv zu identifizieren, die Einführung von Schwermetallverunreinigungen.
Ergebnisse zeigen, eingeführt Verunreinigungen zwischen der Biomasse (Abbildung 3), Medien (Figur 4) und der Umwelt verteilt. Anorganischen Verunreinigungen auf dem geernteten N. gefunden salina legt nahe, dass diese Mikroalgen wird Incorporate mehrere der im Rauchgas enthaltenen anorganischen Verunreinigungen. Diese Assimilation kann ein Ergebnis der Adsorption an Zellwände aufgrund von geladenen Bindungsstellen, die Absorption innerhalb der Zelle aufgrund von Stoffwechselaktivität, und der Niederschlag von Komplexen mit in dem Medium 28 vorhandenen Elemente gebildet sein. Visuell die Reaktoren mit anorganischen Verunreinigungen nach ein paar Tagen erschien in der Farbe gelb, verglichen mit dem dunklen Grün der Steuerreaktoren. Kontaminierte geernteten Biomasse war optisch nicht anders als die schadstofffreie Biomasse nach der Pelletbildung nach der Ernte durch Zentrifugation. Die visuelle Farbunterschied vor der Ernte ist mit einer geringeren Dichte Biomasse zurückzuführen und betonte, Mikroalgen. Verunreinigungen nicht in der Biomasse entfernt haben das Potenzial, in den Medien zu akkumulieren, wie in Abbildung 4 dargestellt. Die Akkumulation in den Medien stellt eine potentielle maßstabs begrenzen, wie Medien Recycling stellt eine Notwendigkeit für die Wirtschaftlichkeit. Die Beschränkung würde diktiert werdendurch die Toleranz gegenüber Schwermetallverunreinigungen, die sein artspezifisch wird. Die Ergebnisse dieser Studie unterstreichen die Notwendigkeit, die möglichen negativen Auswirkungen auf die Integration von Mikroalgen Wachstum Systeme mit Abfallkohlenstoffquellen besser zu verstehen, und zwar auf Kohlebasis Rauchgas. Die Ergebnisse aus dieser Studie verdeutlichen den Bedarf, um die Produktivität der Folgen anderer Verunreinigungen erwartet im Abgas vorhanden sein zu verstehen, wie Oxide von Schwefel und Stickstoff, Feinstaub und organische Verunreinigungen, wie Dioxine und polychlorierte Dibenzo Dibenzo Furane. Zurück TEA und LCA Einschätzungen haben eine nahtlose Integration ohne Berücksichtigung der Auswirkungen von Schadstoffen wie Schwermetalle und anorganische Verunreinigungen auf Produktivität ausgegangen. Im allgemeinen sind die Ergebnisse aus dieser Arbeit hervorheben, die Auswirkungen eines Multimetallsystems auf die Produktivität und kann verwendet werden, um die Potentiale der Mikroalgen zu verstehen, um Verunreinigungen bioremediate werden.
Die Methodik präsentiert für th erlaubte Studium der anorganischen Verunreinigungen mit wiederholbare Ergebnisse für Mikroalgen. Einige anorganische Verunreinigungen in diesem Experiment verwendet werden traditionell in Wachstumssystemen bei niedrigen Konzentrationen festgestellt, aber die anderen haben keine bekannte Funktion in der Zelle. Als Folge der Mehrelementmischung aus As, Cd, Co, Cr, Cu, Hg, Mn, Ni, Pb, Sb, Se, Sn, V und Zn in einer Konzentration in Tabelle 4 Wachstumshemmung gezeigt. Quantifizieren der Menge an Verunreinigungen in der Biomasse kann als schwierig erweisen in Mehrmetallsystemen. Oft können Proben mit hohem Gehalt an organischen Stoffen und Salze Matrixinterferenzen, mehratomigen Interferenzen, körperliche Störungen und Salz produzieren aufzubauen in Zapfen, die schließlich führt zu ungenauen Messwerten und den Verlust der Analysegenauigkeit 29,30. Qualitätskontrollproben laufen zusammen mit den experimentellen Proben geholfen, die Genauigkeit und Präzision der Meßwerte zu bestimmen. Messung der Analyten unter Verwendung der für diese Studie entwickelten Protokolle hat gezeigt, dass ein seinccurate und präzise Herstellung von annehmbaren Ausbeuten, die innerhalb der akzeptablen Leistung für diese Art von Untersuchung sind 25,29. Verdau von Proben durch Mikrowelle wurde gezeigt, um wirksam zu sein, N. salina als verdauten Proben waren klar ohne Anwesenheit von Zelltrümmern oder nicht mischbar Portionen. Die Matrix in diesen Experimenten (Algenbiomasse und künstlichem Meerwasser) verwendet produziert Matrixinterferenzen, die von Matrix Verdünnung zu überwinden waren. Jedoch könnte höheren Biomasseprobengrößen als die in diesem Experiment verwendet werden, um Matrixstörungen führen und sollten daher QC für jeden spezifischen Szenario analysiert werden.
Subscription Required. Please recommend JoVE to your librarian.
Materials
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Sodium chloride | Fisher Scientific | S271-3 | |
| Calcium chloride dihydrate | Fisher Scientific | C79-500 | |
| Potassium chloride | Fisher Scientific | P217-500 | |
| Sodium meta silicate nonahydrate | Fisher Scientific | S408-500 | |
| Magnesium sulfate heptahydrate | Fisher Scientific | M63-500 | |
| Potassium nitrate | EMD Chemical | PX1520-5 | |
| Potassium phosphate monobasic | Fisher Scientific | P285-500 | |
| Ammonium ferric citrate | Fisher Scientific | I72-500 | |
| Boric acid | Fisher Scientific | A73-500 | |
| Sodium molybdate, dihydrate | EMD Chemical | SX0650-2 | |
| Manganese chloride tetrahydrate | Fisher Scientific | M87-500 | |
| Zinc sulfate heptahydrate | Fisher Scientific | Z68-500 | |
| Cupric sulfate pentahydrate | Fisher Scientific | C489-500 | |
| Biotin | Acros Organics | 230090010 | |
| Thiamine | Acros Organics | 148990100 | |
| Vitamin B12 | Acros Organics | 405920010 | |
| Copper (II) chloride dihydrate | Sigma-Aldrich | 221783-100G | Irritant, Dangerous to the Environment |
| Lead (II) chloride | Sigma-Aldrich | 268690-250G | Toxic, Dangerous to the Environment |
| Sodium dichromate dihydrate | Sigma-Aldrich | 398063-100G | Oxidizing, Highly Toxic, Dangerous to the Environment |
| Cobalt (II) chloride hexahydrate | Sigma-Aldrich | 255599-100G | Toxic, Dangerous to the Environment |
| Nickel (II) chloride hexahydrate | Sigma-Aldrich | 223387-500G | Toxic, Dangerous to the Environment |
| Sodium (meta) arsenite | Sigma-Aldrich | 71287 | Toxic, Dangerous to the Environment |
| Cadmium chloride | Sigma-Aldrich | 202908-10G | Highly Toxic, Dangerous to the Environment |
| Mercury (II) chloride | Sigma-Aldrich | 215465-100G | Toxic, Dangerous to the Environment |
| Tin (II) chloride dihydrate | Fisher Scientific | T142-500 | Corrosive. Suitable for Hg analysis. Very hazardous. |
| Manganese chloride tetrahydrate | Fisher Scientific | M87-500 | |
| Vanadium (V) oxide | Acros Organics | 206422500 | Dangerous to the Environment |
| Carbon dioxide | Air Liquide | I2301S-1 | Compressed |
| Hydrogen peroxide | H325-500 | Fisher Scientific | 30% in water |
| ICP-MS standard | ICP-MS-6020 | High Purity Standards | |
| Mercury standard | CGHG1-1 | Inorganic Ventures | 1000±6 µg/mL in 5% nitric acid |
| Argon | Air Liquide | Compressed | |
| Helium | Air Liquide | Compressed, ultra high purity | |
| Hydrogen | Air Liquide | Compressed, ultra high purity | |
| Nitric acid | Fisher Scientific | A509-P212 | 67-70% nitric acid, trace metal grade. Caution: manipulate under fume hood. |
| Hydrochloric acid | Fisher Scientific | A508-P212 | 35% hydrochloric acid, trace metal grade. Caution: manipulate under fume hood. |
| Equipment | |||
| Scientific prevacuum sterilizer | Steris | 31626A | SV-120 |
| Centrifuge | Thermo Fisher | 46910 | RC-6 Plus |
| Spectrophotometer | Shimadzu | 1867 | UV-1800 |
| pH controller | Hanna | BL981411 | X4 |
| Rotometer, X5 | Dwyer | RMA-151-SSV | T31Y |
| Rotometer, X5 | Dwyer | RMA-26-SSV | T35Y |
| Water bath circulator | Fisher Scientific | 13-873-45A | |
| Compact chiller | VWR | 13270-120 | |
| Freeze dryer | Labconco | 7752020 | |
| Stir plate | Fisher Scientific | 11-100-49S | |
| pH lab electrode | Phidgets Inc | 3550 | |
| Inductively coupled plasma mass spectrometer | Agilent Technologies | 7700 Series ICP-MS | Attached to autosampler CETAC ASX-520 |
| FIAS 100 | Perkin Elmer Instruments | B0506520 | |
| Atomic absorption spectrometer | Perkin Elmer Instruments | AAnalyst 800 | |
| Cell heater (quartz) | Perkin Elmer Instruments | B3120397 | |
| Microwave | Milestone | Programmable, maximum power 1,200 W | |
| Microwave rotor | Milestone | Rotor with 24-75 ml Teflon vessels for closed-vessel microwave assisted digestion. | |
| Materials | |||
| 0.2 μm syringe filter | Whatman | 6713-0425 | |
| 0.2 μm syringe filter | Whatman | 6713-1650 | |
| 0.45 μm syringe filter | Thermo Fisher | F2500-3 | |
| Polystyrene tubes | Evergreen | 222-2094-050 | 17 x 100 mm w/cap, 16 ml, polysteryne |
| Octogonal magnetic stir bars | Fisher scientific | 14-513-60 | Magnets encased in PTFE fluoropolymer |
References
- Dismukes, G. C., Carrieri, D., Bennette, N., Ananyev, G. M., Posewitz, M. C. Aquatic phototrophs: efficient alternatives to land-based crops for biofuels. Curr Opin Biotechnol. 19 (3), 235-240 (2008).
- Moody, J. W., McGinty, C. M., Quinn, J. C. Global evaluation of biofuel potential from microalgae. Proceedings of the National Academy of Sciences. 111 (23), 8691-8696 (2014).
- Pinto, E., et al. Heavy metal-induced oxidative stress in algae. J Phycol. 39 (6), 1008-1018 (2003).
- Gupta, A., Lutsenko, S. Evolution of copper transporting ATPases in eukaryotic organisms. Curr Genomics. 13 (2), 124-133 (2012).
- Perales-Vela, H. V., Peña-Castro, J. M., Cañizares-Villanueva, R. O. Heavy metal detoxification in eukaryotic microalgae. Chemosphere. 64 (1), 1-10 (2006).
- Sandau, E., Sandau, P., Pulz, O. Heavy metal sorption by microalgae. Acta Biotechnol. 16 (4), 227-235 (1996).
- Amer, L., Adhikari, B., Pellegrino, J. Technoeconomic analysis of five microalgae-to-biofuels processes of varying complexity. Bioresour Technol. 102 (20), 9350-9359 (2011).
- Benemann, J. R., Goebel, R. P., Weissman, J. C., Augenstein, D. C. Microalgae as a source of liquid fuels. Final Technical Report, US Department of Energy, Office of Research. , (1982).
- Benemann, J. R., Oswald, W. J. Report No. DOE/PC/93204--T5 Other: ON: DE97052880; TRN: TRN. Systems and economic analysis of microalgae ponds for conversion of CO2 to biomass. , (1996).
- Chisti, Y. Biodiesel from microalgae. Biotechnol Adv. 25 (3), 294-306 (2007).
- Davis, R., Aden, A., Pienkos, P. T. Techno-economic analysis of autotrophic microalgae for fuel production. Applied Energy. 88 (10), 3524-3531 (2011).
- Jones, S., et al. Process design and economics for the conversion of algal biomass to hydrocarbons: whole algae hydrothermal liquefaction and upgrading. U.S. Department of Energy Bioenergy Technologies Office. , (2014).
- Lundquist, T. J., Woertz, I. C., Quinn, N. W. T., Benemann, J. R. A realistic technology and engineering assessment of algae biofuel production. Energy Biosciences Institute. , Berkeley, CA. (2010).
- Nagarajan, S., Chou, S. K., Cao, S., Wu, C., Zhou, Z. An updated comprehensive techno-economic analysis of algae biodiesel. Bioresour Technol. 145, 150-156 (2011).
- Pienkos, P. T., Darzins, A. The promise and challenges of microalgal-derived biofuels. Biofuels Bioproducts & Biorefining-Biofpr. 3, 431-440 (2009).
- Richardson, J. W., Johnson, M. D., Outlaw, J. L. Economic comparison of open pond raceways to photo bio-reactors for profitable production of algae for transportation fuels in the Southwest. Algal Research. 1 (1), 93-100 (2012).
- Rogers, J. N., et al. A critical analysis of paddlewheel-driven raceway ponds for algal biofuel production at commercial scales. Algal Research. 4, 76-88 (1016).
- Sun, A., et al. Comparative cost analysis of algal oil production for biofuels. Energy. 36 (8), 5169-5179 (2011).
- Thilakaratne, R., Wright, M. M., Brown, R. C. A techno-economic analysis of microalgae remnant catalytic pyrolysis and upgrading to fuels. Fuel. 128, 104-112 (2014).
- Quinn, J. C., et al. Nannochloropsis production metrics in a scalable outdoor photobioreactor for commercial applications. Bioresour Technol. 117, 164-171 (2012).
- Borkenstein, C., Knoblechner, J., Frühwirth, H., Schagerl, M. Cultivation of Chlorella emersonii with flue gas derived from a cement plant. J Appl Phycol. 23 (1), 131-135 (2010).
- Douskova, I., et al. Simultaneous flue gas bioremediation and reduction of microalgal biomass production costs. Appl Microbiol Biotechnol. 82 (1), 179-185 (2009).
- Israel, A., Gavrieli, J., Glazer, A., Friedlander, M. Utilization of flue gas from a power plant for tank cultivation of the red seaweed Gracilaria cornea. Aquaculture. 249 (1-4), 311-316 (2012).
- Napan, K., Teng, L., Quinn, J. C., Wood, B. Impact of Heavy Metals from Flue Gas Integration with Microalgae Production. , Algal Research. (2015).
- Eaton, A. D., Clesceri, L. S., Rice, E. W., Greenberg, A. E. 3125B. Inductively coupled plasma/mass spectrometry (ICP/MS) method. Standard methods for the examination of water and wastewater. , (2005).
- Eaton, A. D., Clesceri, L. S., Rice, E. W., Greenberg, A. E. Standard methods for the examination of water and wastewater. , APHA-AWWA-WEF. (2005).
- Matrix effects in the ICP-MS analysis of selenium in saline water samples. Smith, M., Compton, J. S. Proceedings of the 2004 Water Institute of Southern Africa Biennial Conference, Cape Town, South Africa, , (2004).
- Mehta, S. K., Gaur, J. P. Use of algae for removing heavy metal ions from wastewater: progress and prospects. Crit Rev Biotechnol. 25 (3), 113-152 (2005).
- EPA, U. Method: 200.8: Determination of trace elements in waters and wastes by inductively coupled plasma - mass spectrometry. , (1994).
- Eaton, A. D., Clesceri, L. S., Rice, E. W., Greenberg, A. E. 3120B. Inductively coupled plasma (ICP) method. Standard methods for the examination of water and wastewater. , (2005).
Tags
Umweltwissenschaften Heft 101 Algen Schwermetalle,Get cutting-edge science videos from JoVE sent straight to your inbox every month.









