Fraccionamiento rápida y aislamiento de componentes de sangre total en las muestras obtenidas a partir de una configuración basada en la comunidad
Summary
We outline a methodology for the processing of whole blood to obtain a variety of components for further analysis. We have optimized a streamlined protocol that enables rapid, high-throughput simultaneous processing of whole blood samples in a non-clinical setting.
Abstract
Recogida y tratamiento de muestras de sangre entera en un entorno no-clínica ofrece una oportunidad única para evaluar los individuos residentes en la comunidad con y sin condiciones preexistentes. Procesamiento rápido de estas muestras es esencial para evitar la degradación de los componentes celulares clave. Aquí se incluyen métodos para periférica de células mononucleares de sangre simultánea (CMSP), el ADN, el ARN y el aislamiento suero de una sola extracción de sangre se realiza en los hogares de los participantes consienten a través de un área metropolitana, con el procesamiento de iniciarse dentro de 2 horas de la recolección. Hemos usado estas técnicas para procesar más de 1.600 muestras de sangre rendimiento, material de alta calidad consistente, que posteriormente ha sido utilizado con éxito en la metilación del ADN, genotipificación, expresión génica y análisis de citometría de flujo. Algunos de los métodos empleados son estándar; sin embargo, cuando se combinan en la forma descrita, permiten un procesamiento eficiente de las muestras de los participantes de la población y el / o comunidadestudios basados en que normalmente no se evaluaron en un entorno clínico. Por lo tanto, este protocolo tiene el potencial para obtener muestras (y posteriormente de datos) que son más representativos de la población general.
Introduction
Múltiples estudios han caracterizado las diferencias en la expresión génica, la metilación del ADN y subconjunto de células en la sangre entre individuos con y sin Mental (u otro) enfermedades a 1-4. Estos estudios, sin embargo, se han obtenido a partir de situaciones clínicas en las que las diferencias asociadas a la enfermedad pueden ser magnificados debido a la naturaleza en general más grave de las enfermedades para las que los pacientes están buscando tratamiento. Debido a los avances en "ómicas" enfoques, la última década ha sido testigo de una explosión de interés en la obtención de muestras biológicas de ajustes epidemiológicos 5-7 comunidad y / o, con el fin de proporcionar estimaciones poblacionales de prevalencia de la enfermedad y una imagen más amplia de la determinantes ambientales de estas enfermedades mentales y / o físicos.
Un desafío clave en este sentido es el requisito para el procesamiento rápido de las muestras recogidas. La degradación de las células mononucleares, componentes del sistema inmune clave que son frequently utilizado para evaluar la salud de un individuo, comienza inmediatamente después de la extracción de sangre con una disminución significativa en la recuperación después de 2 hr de la recogida de 8-10. Para hacer frente a este desafío, presentamos un protocolo optimizado en el que varios componentes de la sangre entera humana están simultáneamente aisladas de muestras obtenidas en los hogares de los sujetos que viven en una gran área metropolitana. El protocolo se basa en nuestra recopilación y modificación de las técnicas actuales, incluido el almacenamiento de todas las fracciones "extra" en el caso de las técnicas de futuros permiten un mayor aislamiento / análisis. Mientras que los métodos o kits alternativos pueden ser empleados en lugar de los métodos individuales descritos aquí, aquellos descritos han demostrado ser un medio fiable y eficaz para el procesamiento de muestras de una manera de alto rendimiento. Fracciones de alta calidad (PBMCs, ADN, suero y ARN) de la sangre fresca se pueden producir dentro de 2 horas de recogida y todos los especímenes de ensayo listos pueden estar disponibles dentro de 2 días (Figura 1).
Este protocolo fue desarrollado para permitir el procesamiento eficiente de las muestras obtenidas de la comunidad-vivienda, los residentes adultos de la ciudad de Detroit para la prueba en el Estudio de Salud Comunitario de Detroit (DNHS; DA022720, RC1MH088283, DA022720-05-S1) una base de población, estudio de los factores sociales y biológicos del trastorno de estrés postraumático (TEPT) y otras enfermedades mentales. La prevalencia del trastorno de estrés postraumático en Detroit es más del doble del promedio de 11,12 nacional. La identificación de los determinantes biológicos del trastorno de estrés postraumático en esta población puede ayudar a desarrollar farmacológico apropiado y / o intervenciones cognitivo-conductuales para ayudar a aquellos que sufren de la enfermedad, tanto en esta población urbana, y en otras poblaciones de alto riesgo (por ejemplo, los veteranos que regresan militares). Nuestro laboratorio, anteriormente ubicada en la Universidad Estatal de Wayne en Detroit, Michigan, fue seleccionado para el procesamiento basado en nuestra experiencia en el manejo de muestras de tejidos frescos derivados de una variedadde las fuentes, la necesidad de comenzar el procesamiento de las muestras dentro de las 2 horas de la recolección, y nuestra proximidad a los lugares de recolección. Con esta oportunidad única que nos ocupa, nuestro objetivo fue optimizar el procesamiento para mayor rendimiento de ADN, ARN, suero y células mononucleares de sangre periférica (CMSP) de cada muestra (un total de N = 1.639 muestras de más de 5 oleadas de recogida de muestras). Los procedimientos descritos aquí se pueden realizar de forma simultánea en un entorno no clínico, lo que produce el material (véase la Tabla 1 para los rendimientos medios) a partir de una multitud de aplicaciones posteriores incluyendo microarrays, epigenética, en tiempo real de RT-PCR, y citometría de flujo análisis.
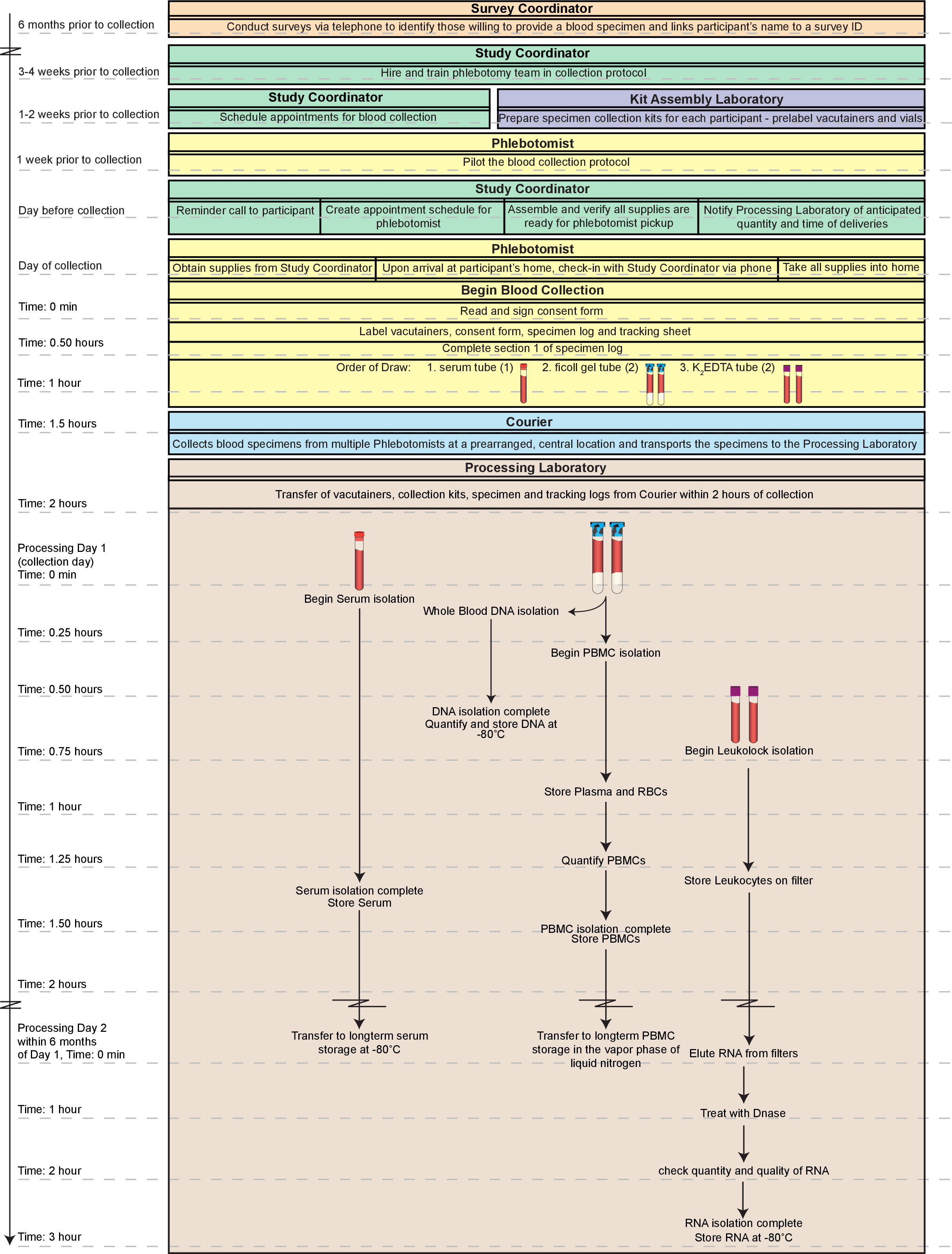
Figura 1. Flujo general de trabajo. El proceso global se muestra aquí incluye la logística de la obtención de las muestras de sangre de la identificación partic consintiendoipants a la sangre dibujan a sí mismo. De alta calidad, fracciones (células mononucleares de sangre periférica; CMSP, ADN, suero y ARN) de sangre entera fresca se puede producir dentro de 2 horas de recogida y todos los especímenes de ensayo preparada puede estar disponible dentro de 2 días. Por otra parte, las fracciones preparadas a través de este método son adecuados para el almacenamiento a largo plazo si las muestras no son para ser probado inmediatamente. Toda la línea de tiempo esbozado aquí se pudo completar en un solo día (~ 5 horas en total). Sin embargo, ese día sería muy laborioso especialmente para un solo técnico con amplia experiencia con las técnicas. Por lo tanto, se recomienda dividir los procedimientos en el Día 1 entre al menos dos técnicos y completar el procesamiento del ARN en el Día 2. Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
Hemos descrito un protocolo simplificado que se ha aplicado con éxito para procesar más de 1.600 muestras de sangre entera en el Estudio de Salud de Detroit Barrio. Aunque muchas de estas técnicas están disponibles en la literatura existente, nuestra compilación paso a paso, incluidas las modificaciones precisamente cronometrados entre cada paso, refleja una optimizado, protocolo eficiente que produce con éxito una variedad de muestras biológicas con una amplia gama de aplicaciones posteriores, incluyendo la meti…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We would like to thank Henriette Mair-Meijers for invaluable attention to detail and hours devoted to processing the blood collections. We are grateful for the graphic design expertise of Natalie Jameson Kiesling. We also appreciate the approval of the manufacturers (Qiagen (Valencia, CA), BD Biosciences (San Jose, CA), Life Technologies (Grand Island, NY)) mentioned herein to publish the use of their products as described. Funding for this work was generously provided by the National Institutes of Health award numbers DA022720, RC1MH088283, and DA022720-05-S1.
Materials
| QIAamp DNA Blood Mini Kit | Qiagen | 51104 | Day 1: DNA isolation |
| Phosphate-buffered saline (PBS) | Sigma | P5493-1L | Day 1: PBMC isolation |
| 5 ¾” Pasteur pipets | Fisher | 13-678-6A | Day 1: PBMC isolation |
| Fetal Bovine Serum (FBS), heat inactivated | Life Technologies | 10082147 | Day 1: PBMC isolation |
| Dimethyl Sulfoxide (DMSO) | Sigma | D8418-500ml | Day 1: PBMC isolation |
| RPMI Medium 1640, liquid | Invitrogen | 11875119 | Day 1: PBMC isolation |
| 0.4% trypan blue stain | Invitrogen | T10282 | Day 1: PBMC isolation |
| Countess Cell Counting Chamber | Invitrogen | C10283 | Day 1: PBMC isolation |
| Countess Automated Cell Counter or cell counting device such as a microscope and hemocytometer | Invitrogen | C10281 | Day 1: PBMC isolation |
| LeukoLOCK Fractionation & Stabilization Kit | Ambion | 1933 | Day 1: Leukocyte RNA isolation |
| 25G x 5/8 in. needles | Becton Dickinson | 305122 | Day 1: Leukocyte RNA isolation |
| Syringes (5ml) | Becton Dickinson | 309646 | Days 1 and 2: Leukocyte RNA isolation |
| Denaturing Lysis Solution | Ambion | 8540G | Day 2: Leukocyte RNA isolation |
| 5M NaCl | Life Technologies | 24740011 | Day 2: Leukocyte RNA isolation |
| TRI Reagent | Ambion | 9738 | Day 2: Leukocyte RNA isolation |
| Bromo-3-chloro-propane (BCP) | Sigma | B-9673 | Day 2: Leukocyte RNA isolation |
| spin cartridges | Ambion | 10051G | Day 2: Leukocyte RNA isolation |
| 0.1mM EDTA | Ambion | 9912 | Day 2: Leukocyte RNA isolation |
| DNA-free Kit | Ambion | AM1960 | Day 2: DNase treament |
| RNA 6000 Ladder | Agilent | 5067-1529 | Day 2: Bioanalyzer analysis |
| RNA 6000 Nano Series II Kit | Agilent | 5067-1511 | Day 2: Bioanalyzer analysis |
| RNaseZAP | Ambion | AM8782 | Day 2: Bioanalyzer analysis |
| Ethanol >99% | Sigma | E7023-500ml | |
| Isopropanol >99% | Sigma | I9516-500ml | |
| Nuclease-free ultra pure water | Invitrogen | 9938 | |
| Pipette tips (nuclease-free) | Eppendorf | 22491253 | |
| Pipetter (serological) | Eppendorf | 2223020-4 | |
| Pipetters (for volumes under 1ml) | Eppendorf | 3120000-054 | |
| Pipettes (serological) | Fisher | 13-678-27E | |
| Controlled rate freezing containers | Nalgene | 5100-0001 | |
| Cryoboxes (to hold 2ml and 5ml cryovials and 1.5ml microcentrifuge tubes) | Fisher | 03-395-464 | |
| Test tube rack | Thermo Scientific | 14-804-134 | |
| 15ml polypropylene tubes | Fisher | 14-959-49D | |
| 1.5ml and 0.65 microcentrifuge tubes | Fisher | 07-200-534 and 07-200-185 | |
| 2ml and 5ml cryovials | Fisher | 10-500-26 and 10-269-88F | |
| 8ml CPT vacutainer | BD Biosciences | 362761 | 2 tubes |
| 6ml K2 EDTA vacutainer | BD Biosciences | 367863 | 2 tubes |
| 8.5ml SST vacutainer | BD Biosciences | 367988 | 1 tube |
| Vortexer | Fisher | 2215365 | |
| Dry bath incubator with heating block for microcentrifuge tubes | Fisher | 11-715-1250 | |
| Filtration/vacuum system for use within the cell culture hood | Fisher | 01-257-87 | |
| Fixed-angle rotor for microcentrifuge tubes with aerosol-tight lid | Eppendorf | 22637002 | |
| Refrigerated centrifuge with a swing-bucket rotor and aerosol-tight caps for 16 x 125mm vacutainers and 15ml polypropylene tubes | Eppendorf | 22628157 | 2, one does not need to be refrigerated |
| Nanodrop 2000 (recommended for accuracy of small volumes) or other spectrophotometric device | Fisher | 13-400-411 | |
| Agilent Bioanalyzer | Agilent Technologies | G2940CA | |
| Liquid nitrogen tank | Thermo Scientific | 11-676-56 | |
| -80 ˚C freezer | Thermo Scientific | 992RAK | |
| Sharps container | Fisher | 22-037-970 | |
| Biological waste container | Thermo Scientific | 1223P52 | |
| Biosafety Level 2 certified cell culture hood | Thermo Scientific | 13-261-315 |
References
- Hernandez, M. E., Martinez-Fong, D., Perez-Tapia, M., Estrada-Garcia, I., Estrada-Parra, S., Pavon, L. Evaluation of the effect of selective serotonin-reuptake inhibitors on lymphocyte subsets in patients with a major depressive disorder. Eur Neuropsychopharmacol. 20, 88-95 (2010).
- Weigelt, K., et al. TREM-1 and DAP12 expression in monocytes of patients with severe psychiatric disorders EGR3, ATF3 and PU.1 as important transcription factors. Brain Behav Immun. 25, 1162-1169 (2011).
- Robertson, M. J., et al. Lymphocyte subset differences in patients with chronic fatigue syndrome, multiple sclerosis and major depression. Clin Exp Immunol. 141, 326-332 (2005).
- Rotter, A., Asemann, R., Decker, A., Kornhuber, J., Biermann, T. Orexin expression and promoter-methylation in peripheral blood of patients suffering from major depressive disorder. J Affect Disord. 131, 186-192 (2011).
- Klengel, T., et al. Allele-specific FKBP5 DNA demethylation mediates gene-childhood trauma interactions. Nat Neurosci. 16, 33-41 (2013).
- Segman, R. H., Shefi, N., Goltser-Dubner, T., Friedman, N., Kaminski, N., Shalev, A. Y. Peripheral blood mononuclear cell gene expression profiles identify emergent post-traumatic stress disorder among trauma survivors. Mol Psychiatry. 10, 500-513 (2005).
- Smith, B. H., et al. Cohort Profile: Generation Scotland: Scottish Family Health Study (GS:SFHS). The study, its participants and their potential for genetic research on health and illness. Int J Epidemiol. 42, 689-700 (2013).
- Mallone, R., et al. Isolation and preservation of peripheral blood mononuclear cells for analysis of islet antigen-reactive T cell responses: position statement of the T-Cell Workshop Committee of the Immunology of Diabetes Society. Clin Exp Immunol. 163, 33-49 (2011).
- Duvigneau, J. C., Hartl, R. T., Teinfalt, M., Gemeiner, M. Delay in processing porcine whole blood affects cytokine expression. J Immunol Methods. 272, 11-21 (2003).
- Debey, S., et al. Comparison of different isolation techniques prior gene expression profiling of blood derived cells: impact on physiological responses, on overall expression and the role of different cell types. Pharmacogenomics J. 4, 193-207 (2004).
- Uddin, M., et al. Epigenetic and immune function profiles associated with posttraumatic stress disorder. Proc Natl Acad Sci U S A. 107, 9470-9475 (2010).
- Kessler, R. C., Wang, P. S. The descriptive epidemiology of commonly occurring mental disorders in the United States. Annu Rev Public Health. 29, 115-129 (2008).
- . QIAamp® DNA Mini and Blood Mini Handbook Available from: https://www.qiagen.com/us/resources/resourcedetail?id=67893a91-946f-49b5-8033-394fa5d752ea (2010)
- Koenen, K. C., et al. SLC6A4 methylation modifies the effect of the number of traumatic events on risk for posttraumatic stress disorder. Depress Anxiety. 28, 639-647 (2011).
- Walsh, K., Uddin, M., Soliven, R., Wildman, D. E., Bradley, B. Associations between the SS variant of 5-HTTLPR and PTSD among adults with histories of childhood emotional abuse: Results from two African American independent samples. J Affect Disord. 161, 91-96 (2014).
- Bustamante, A. C., et al. Childhood maltreatment is associated with epigenetic differences in hypothalamic-pituitary-adrenal (HPA) axis genes in the Detroit Neighborhood Health Study. , (2013).
- Sipahi, L., et al. Longitudinal epigenetic variation of DNA methyltransferase genes is associated with vulnerability to post-traumatic stress disorder. Psychol Med. 44, 3165-3179 (2014).
- Uddin, M., Koenen, K. C., Aiello, A. E., Wildman, D., de los Santos, R., Galea, S. Epigenetic and inflammatory marker profiles associated with depression in a community-based epidemiologic sample. Psychol Med. 41, 997-1007 (2011).
- Uddin, M., et al. Post-traumatic stress disorder is associated with immunosenescent T cell phenotypes in the Detroit Neighborhood Health Study. , (2011).
- Uddin, M., et al. Post-traumatic stress disorder is associated with immunosenescent T cell phenotypes in the Detroit Neighborhood Health Study. , (2011).
- Uddin, M. Biological signatures of post-traumatic stress disorder in the Detroit Neighborhood Health Study. , (2010).
- Aiello, A. E. Cytomegalovirus antibodies as a marker of immunosenescence in the Detroit Neighborhood Health Study. , (2010).
- Bustamante, A. C., et al. . Distinct gene expression profiles characterize lifetime PTSD and childhood maltreatment in the Detroit Neighborhood Health Study. , (2013).

