현미경 및 염색: 그램, 캡슐 및 내생포자 염색
English
Share
Overview
출처: 리안논 M. 레베크1,나탈리아 마틴1,앤드류 J. 반 알스트1,빅터 J. 디리타1
1 미생물학 및 분자 유전학학과, 미시간 주립 대학, 이스트 랜싱, 미시간, 미국
박테리아는 지구상의 거의 모든 곳에서 발견되는 다양한 미생물입니다. 많은 속성은 그램 염색 유형, 모양 및 배열, 캡슐 생산 및 포자의 형성을 포함하되 이에 국한되지 않는 서로 구별하는 데 도움이됩니다. 이러한 특성을 관찰하기 위해, 하나는 빛 현미경 검사를 사용할 수 있습니다; 그러나, 일부 세균성 특성(예: 크기, 착색 부족 및 굴절 특성)은 빛 현미경(1, 2)으로만 박테리아를 구별하기 어렵게 만든다. 세균염색은 가벼운 현미경으로 세균성 모형을 구별할 때 필요합니다. 빛 현미경의 두 가지 주요 유형은 간단하고 화합물입니다. 그 중 가장 큰 차이점은 물체를 확대하는 데 사용되는 렌즈의 수입니다. 간단한 현미경 (예를 들어 확대 유리)에는 물체를 확대하는 렌즈가 하나뿐이지만 복합 현미경에는 배율을 높이기 위해 여러 개의 렌즈가 있습니다 (그림 1). 복합 현미경은 물체의 이미지를 만들기 위해 빛을 수집하는 물체에 가까운 객관적인 렌즈를 가지고 있습니다. 그러면 이미지를 확대하는 안구 렌즈(안구 렌즈)에 의해 확대됩니다. 객관적인 렌즈와 접안렌즈를 결합하면 단일 렌즈만 사용하는 것보다 배율이 높아질 수 있습니다. 전형적으로, 복합 현미경은 다른 배율을 허용하는 다양한 힘의 다중 객관적인 렌즈가 있습니다 (1, 2). 여기에서는 그램 얼룩, 캡슐 얼룩 및 내스포레 얼룩과 박테리아를 시각화하는 것을 논의 할 것입니다.

그림 1: 일반적인 복합 현미경. 현미경의 가장 중요한 부분은 표지됩니다.
1884년 덴마크 세균학자 한스 크리스찬 그램(1)이 개발한 그램 얼룩은 세포벽의 조성에 따라 박테리아를 분화한다(1, 2, 3, 4). 간단히 말해서, 세균성 얼룩은 현미경 슬라이드에 배치된 다음 열을 고정하여 세포를 슬라이드에 부착하고 더 쉽게 얼룩 (1)을 받아 들입니다. 열 고정 샘플은 크리스탈 바이올렛으로 염색되어 세포를 보라색으로 바꿔놓았습니다. 슬라이드는 크리스탈 바이올렛을 세포 벽에 고정시키는 요오드 용액으로 플러시되고, 디컬러라이저(알코올)가 들어와 고정되지 않은 크리스탈 바이올렛을 씻어내도록 합니다. 마지막 단계에서, 카운터스테인, 사프란, 색 세포에 빨간색(그림 2)이추가된다. 그람 양성 박테리아 얼룩 보라색 때문에 탈색제에 의해 쉽게 침투되지 않는 두꺼운 펩티도글리칸 층; 그람 음성 박테리아는 더 얇은 펩티도글리칸 층과 더 높은 지질 함량을 가지고 있으며, 탈색제로 탈염되어 사프란이 추가될 때 빨간색으로 대응된다(도 3). 그램 염색은 세포를 두 가지 유형(그램 양성 및 그람 음성)으로 분화하는 데 사용되며 세포 모양(구체 또는 코치, 막대, 곡선 막대 및 나선형) 및 배열(단일 세포, 쌍, 사슬, 그룹 및 클러스터)(1, 3)을 구별하는 데에도 유용합니다.
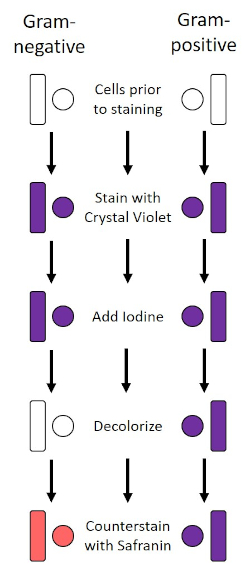
그림 2: 그램 염색 프로토콜의 회로도. 왼쪽 컬럼은 프로토콜의 각 단계에서 그람 음성 박테리아가 어떻게 반응하는지 보여줍니다. 오른쪽 열은 그람 양성 박테리아가 어떻게 반응하는지 보여줍니다. 또한, 도시된 두 가지 전형적인 세균성 세포 모양은 바실리(또는 막대)와 코치(또는 구)이다.
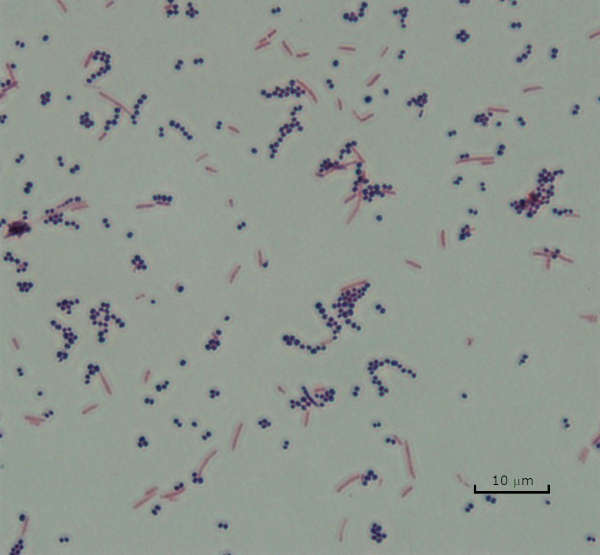
그림 3: 그램 염색 결과. 황색포도상구균(그람 양성 보라색 코치)과 에체리치아 대장균(그램 네거티브 레드 로드)의 혼합물의 그램 얼룩.
일부 박테리아는 캡슐 (3, 5)에게 불린 세포 외점성 외부 층을 생성합니다. 캡슐은 표면 및 기타 박테리아준수, 건조로부터의 보호, 식증으로부터의 보호 등 다양한 기능을 갖춘 보호 구조물입니다. 캡슐은 일반적으로 95% 이상의 물을 함유하는 다당류로 구성되어 있지만 일부는 폴리알코올과 폴리아민(5)을 함유할 수 있다. 그들의 대부분 비 이온 조성 및 얼룩을 격퇴 하는 경향으로 인해, 간단한 염색 방법은 캡슐으로 작동 하지 않습니다;; 대신, 캡슐 염색은 세포와 배경을 얼룩지게 하는 네거티브 염색 기술을 사용하여 캡슐을 세포 주위의 명확한 후광(1, 3) (도 4)로둡니다. 캡슐 염색은 현미경 슬라이드에 산성 얼룩으로 세균성 견본을 얼룩지게 관련시킵니다. 그램 염색과는 달리, 세균성 얼룩은 캡슐 얼룩 동안 열 고정되지 않습니다. 열 고정은 캡슐을 방해하거나 탈수하여 거짓 네거티브 (5)로 이어질 수 있습니다. 더욱이, 열 고정은 캡슐로 착각할 수 있는 세포 의 주위에 청산의 결과로 세포를 수축할 수 있습니다, 거짓 긍정으로 이끌어 내는 (3). 산성 얼룩은 슬라이드 배경을 색; 기본 얼룩, 크리스탈 바이올렛으로 후속 하는 동안, 크리스탈 바이올렛, 박테리아 세포 자체 색상, 캡슐을 염색 하 고 세포와 슬라이드 배경 사이 명확한 후광으로 나타나는 (그림 5). 전통적으로 인도 잉크는 이러한 입자가 캡슐을 관통할 수 없기 때문에 산성 얼룩으로 사용되어 왔습니다. 따라서 캡슐이나 세포는 인도 잉크에 의해 염색되지 않습니다. 대신 배경이 얼룩져 있습니다. 콩고 레드, 니게진, 또는 에오신은 인도 잉크 대신 사용할 수 있습니다. 캡슐 염색은 의사가 환자 샘플에서 배양을 볼 때 세균 감염을 진단하고 적절한 환자 치료를 안내하는 데 도움이 될 수 있습니다. 캡슐화된 박테리아에 기인한 일반적인 질병은 폐염, 뇌막염 및 살모넬라증을 포함합니다.
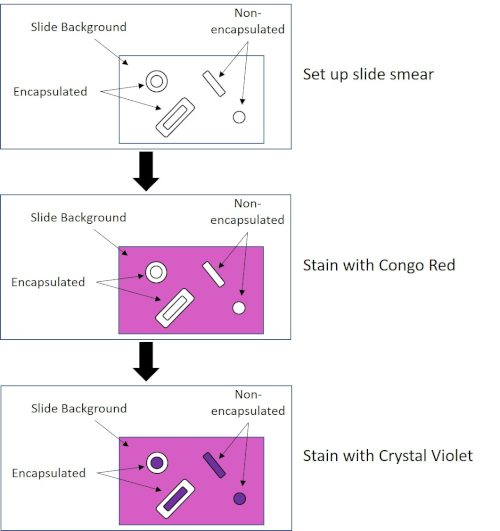
그림 4: 캡슐 염색 프로토콜의 회로도. 상단 패널은 얼룩 적용 전에 슬라이드 얼룩을 표시합니다. 중간 패널은 슬라이드와 박테리아가 기본 얼룩, 콩고 레드를 돌보는 방법을 보여줍니다. 최종 패널은 슬라이드와 박테리아가 카운터스테인 크리스탈 바이올렛을 돌보는 방법을 보여줍니다.
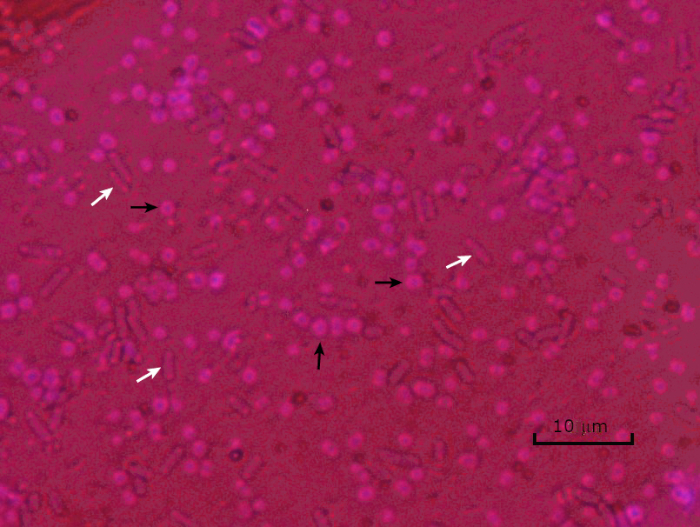
그림 5: 캡슐 염색 결과. 캡슐 에신에토박터 바우마니 (검은 화살로 표시) 및 비 캡슐 에체리치아 대장균 (흰색 화살표로 표시)의 캡슐 염색. 배경이 어둡고 A. 바우마니 세포는 보라색으로 얼룩져 있습니다. A. baumannii 세포 주위의 캡슐은 후광으로 분명하며 대장균에는 후광이 없습니다.
불리한 조건 (예를 들어 영양소 제한, 극한의 온도 또는 탈수)에서 일부 박테리아는 내구포를 생성하며, 신체적 및 화학적 손상에 내성이있는 대사비활성 구조 (1, 2, 8, 9). 내시경 은 박테리아가 세포의 유전 물질을 보호하여 가혹한 조건에서 살아남을 수 있도록; 일단 조건이 성장에 유리한, 포자 발화, 그리고 세균성 성장은 계속합니다. 내시경은 일반적으로 염색에 사용되는 염료에 침투할 수 없기 때문에 표준 염색 기술로 얼룩이 되기 어렵다(1, 9). 내측 포자를 염색하는 데 일상적으로 사용되는 기술은 Schaeffer-Fulton 방법 (도 6)으로,1 차 적인 얼룩 말라카이트 그린을 사용하는, 세포 물질및 열에 상대적으로 약하게 결합하는 수용성 얼룩, 그리고 열, 얼룩이 포자의 피질을 통해 돌파 할 수 있도록 (도 7). 이 단계는 성장하는 세포 (내시경 생물학의 맥락에서 식물 세포라고 불려짐), 내포및 모든 무료 포자 (더 이상 이전 세포 봉투 내에서)를 색을 물고 있습니다. 식물 세포는 말라카이트 그린을 제거하기 위해 물로 세척됩니다. 내포는 포자 내에서 말라카이트 그린을 가열하기 때문에 얼룩을 유지합니다. 마지막으로 식물 세포는 사프란과 함께 비색된다(그림 8). 내시경 포자에 대한 염색은 포자 전자와 비 포자 전자로 박테리아를 분화하는 데 도움이뿐만 아니라, 포자가 샘플에 존재하는지 여부를 결정, 존재하는 경우, 발아시 세균 성 오염으로 이어질 수 있습니다.
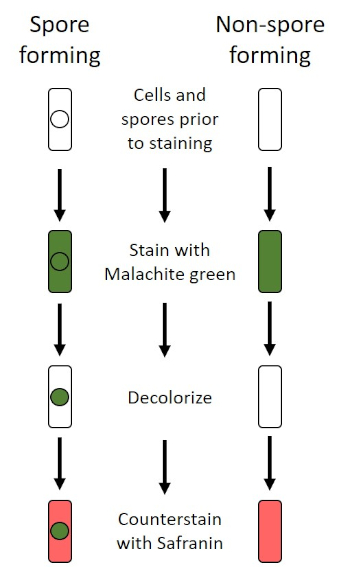
그림 6: 내시경 염색 프로토콜의 회로도. 왼쪽 컬럼은 포자 형성 박테리아가 프로토콜의 각 단계에서 어떻게 반응하는지 보여줍니다. 오른쪽 열은 비 포자 형성 박테리아가 반응하는 방법을 보여줍니다.
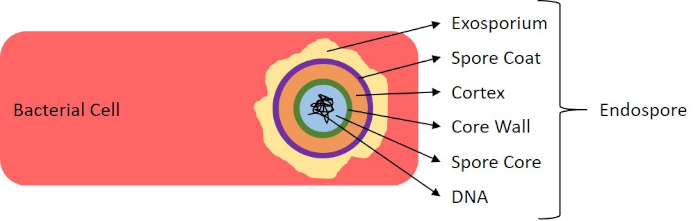
그림 7: 내시경 구조의 다이어그램. 표지된 각종 포자 구조물을 가진 내시경을 포함하는 세균성 세포.
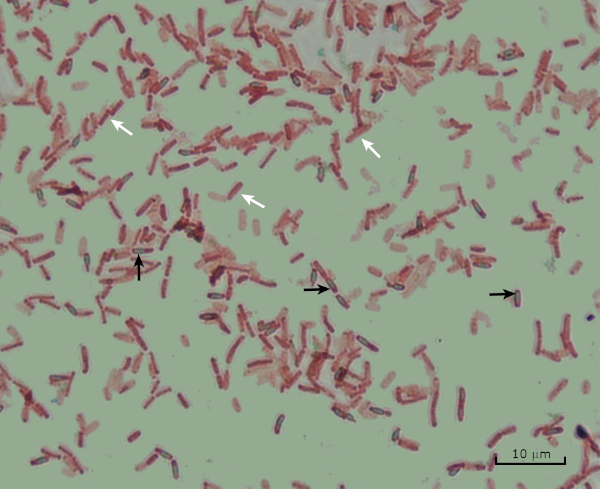
그림 8: 내시경 염색 결과. 바실러스 서브틸리스의내분포의 전형적인 염색. 식물 세포 (흰색 화살표로 표시)는 빨간색으로 얼룩지고 내시경포기 (검은 화살표로 표시)는 녹색으로 얼룩져 있습니다.
Procedure
Applications and Summary
Bacteria have distinguishing characteristics that can aid in their identification. Some of these characteristics can be observed by staining and light microscopy. Three staining techniques useful for observing these characteristics are Gram staining, Capsule staining, and Endospore staining. Each technique identifies different characteristics of bacteria and can be used to help physicians recommend treatments for patients, identify potential contaminants in samples or food products, and verify sample sterility.
References
- Black, J. G. Microbiology Principles and Explorations, 4th edition. Prentice-Hall, Inc., Upper Saddle River, New Jersey. (1999)
- Madigan, M. T. and J. M. Martinko. Brock Biology of Microorganisms, 11th edition. Pearson Prentice Hall, Upper Saddle River, New Jersey. (2006).
- Leboffe, M. J., and B. E. Pierce. A Photographic Atlas for the Microbiology Laboratory, 2nd ed. Morton Publishing Company, Englewood, Colorado. (1996).
- Smith, A. C. and M. A. Hussey. Gram stain protocols. Laboratory Protocols. American Society for Microbiology, Washington, DC. Available from: http://www.asmscience.org/content/education/protocol/protocol.2886. (2005).
- Hughes, R. B. and A. C. Smith. Capsule Stain Protocols Laboratory Protocols. American Society for Microbiology, Washington, DC. Available from: http://www.asmscience.org/content/education/protocol/protocol.3041. (2007).
- Anthony, E. E. Jr. A note on capsule staining. Science 73(1890):319-320 (1931).
- Finegold, S. M., W. J. Martin, and E. G. Scott. Bailey and Scott's Diagnostic Microbiology, 5th edition. The C. V. Mosby Company, St. Louis, Missouri. (1978).
- Gerhardt, P., R. G. E. Murray, W. A. Wood, and N. R. Krieg. Methods for general and molecular bacteriology. ASM Press, Washington, DC. (1994).
- Hussey, M. A. and A. Zayaitz. Endospore Stain Protocol. Laboratory Protocols. American Society for Microbiology, Washington, DC. Available from: http://www.asmscience.org/content/education/protocol/protocol.3112. (2007).
Transcript
Bacteria are microscopic living organisms that have many distinguishing characteristics such as shape, arrangement of cells, whether or not they produce capsules, and if they form spores. These features can all be visualized by staining and aid in the identification and classification of different bacterial species.
To examine the first two characteristics of cell shape and arrangement, we can use a simple technique called Gram staining. Here, crystal violet is applied to bacteria, which have been heat-fixed onto a slide. Next, Gram’s iodine solution is added to the slide, resulting in the formation of an insoluble complex between the crystal violet and the Gram’s iodine solution. A decolorizer is then applied and any bacteria with a thick peptidoglycan layer will stain purple, as this layer is not easily penetrated by the decolorizer. These bacteria are referred to as Gram-positive.
Gram-negative bacteria have a thinner peptidoglycan layer and will de-stain the decolorizer, losing the purple color. However, they will stain reddish-pink when a safranin counterstain is added, which binds to a lipopolysaccharide layer on their outside. Once stained, the cells can be observed for morphology, size, and arrangement, such as in chains or clusters, which further aids in classification and identification.
Another useful technique in the microbiologist’s toolkit is the capsule stain, used to visualize external capsules that surround some types of bacterial cells. Due to the capsule’s non-ionic composition and tendency to repel stains, simple staining methods won’t work. Instead, a negative staining technique is used, which first stains the background with an acidic colorant, such as Congo red, before the bacterial cells are stained with crystal violet. This leaves any capsule present as a clear halo around the cells.
The final major staining technique covered here can help determine if the bacteria being studied forms spores. In adverse conditions, some bacteria produce endospores, dormant, tough, non-reproductive structures whose primary function is to ensure the survival of bacteria through periods of environmental stress, like extreme temperatures or dehydration. However, not all bacterial species make endospores, and they are difficult to stain with standard techniques because they are impermeable to many dyes. The Schaeffer-Fulton method uses malachite green stain, which is applied to the bacteria fixed to a slide. The slide is then washed with water before being counterstained with Safranin. Vegetative cells will appear pinkish-red, while any endospores present will appear green. In this video, you will learn how to perform these common bacterial staining techniques and then examine the staining samples using light microscopy.
To begin the procedure, tie back long hair and put on the appropriate personal protective equipment, including a lab coat and gloves.
Then, clean a fresh microscope slide with a laboratory wipe. Next, pipette 10 microliters of 1X phosphate-buffered saline onto the first slide. Then, use a sterile pipette tip to select a single bacterial colony from the LB agar plate. Smear the bacterial colony in the liquid to produce a thin, even layer. Set the slide on the benchtop, and allow it to fully air dry.
Once dried, light a Bunsen burner to heat-fix the bacteria. Using tongs, pass the slide through the burner flame several times, with the bacteria side up, taking care not to hold the slide in the flame too long, which may distort the cells.
Now, working over the sink, hold the slide level and apply several drops of Gram’s crystal violet to completely cover the bacterial smear and then place the slide onto the bench to stand for 45 seconds. Next, hold the slide at an angle and gently squirt a stream of water onto the top of the slide, taking care not to squirt the bacterial smear directly. Now, holding the slide level again, apply Gram’s iodine solution to completely cover the stained bacteria and then allow it to stand for another 45 seconds. Next, carefully rinse the iodine from the slide, as shown previously. While holding the slide at an angle, add a few drops of Gram’s decolorizer to the slide, allowing it to run down over the stained bacteria, just until the run-off is clear, for approximately 5 seconds. Immediately, rinse with water as shown previously. This will limit over-decolorizing the smear. Next, holding the slide level again, apply Gram’s safranin counterstain to completely cover the stained bacteria. After 45 seconds, gently rinse the Safranin from the slide with water, as shown previously, and then blot dry with paper towels.
Finally, add a drop of immersion oil directly to the slide, and then examine the slide using a light microscope with a 100X oil objective lens.
To begin this staining protocol, first put on the correct personal protective equipment and then ensure that the glass slides that will be used are clean.
Next, prepare the solutions. To make 1% crystal violet solution, mix 0.25 grams of crystal violet powder with 25 milliliters of distilled water and vortex until dissolved. Then, prepare 1% Congo red solution by mixing 0.25 grams of Congo red powder with 25 milliliters of distilled water and vortex until dissolved. Now, pipette 10 microliters of the Congo red solution onto the slide. Using a clean, sterile pipette tip, select a single bacterial colony from the LB agar plate. Then, smear the bacterial colony into the dye to produce a thin, even layer. Completely air dry the bacterial slide for 5-7 minutes. Once the slide is dry, flood the smear with enough 1% crystal violet to cover the smear and let it sit for 1 minute. Now, hold the slide at an angle and gently squirt a stream of water onto the top of the slide, taking care not to squirt the bacteria directly. Continue holding the slide at a 45-degree angle until completely air-dried. Finally, add a drop of immersion oil directly to the slide, and then examine the slide using a light microscope with a 100X oil objective.
To perform endospore staining, first, prepare a 0.5% malachite green solution by mixing 0. 125 grams of malachite green powder with 25 milliliters of distilled water, and then vortex the solution until dissolved. Next, pipette 10 microliters of 1X PBS onto the center of the slide. Then, use a sterile pipette tip to select a single bacterial colony from the LB agar plate. Smear the bacteria into the liquid to produce a thin, even layer. Now, set the slide on the benchtop, and allow it to fully air dry. Once dried, light a Bunsen burner to heat-fix the bacteria. Pass the slide through the blue burner flame several times, with the bacteria side facing up. Then, once the slide has cooled, place a piece of precut lens paper over the heat-fixed smear. Next, turn on a hotplate to the highest setting, and bring a beaker of water to a boil.
Saturate the lens paper with the malachite green solution and, using tongs, place the slide on top of the beaker of boiling water to steam for 5 minutes. Keep the lens paper moist by adding more dye, one drop at a time, as needed. Next, again using tongs, pick up the slide from the beaker and remove and discard the lens paper. Allow the slide to cool for 2 minutes. Working over the sink, hold the slide at an angle, and gently squirt a stream of water onto the top of the slide. Now, hold the slide level and apply Safranin to completely cover the slide. Then, allow it to stand for 1 minute. Next, hold the slide at an angle and rinse as previously shown. Allow the slide to air dry on the benchtop. Finally, add a drop of immersion oil directly to the slide, and then examine the slide with a light microscope, with a 100X oil objective.
In the Gram staining protocol, two different colored stains can result. Dark purple staining indicates that the bacteria are Gram-positive and that they have retained the crystal violet stain. In contrast, reddish-pink staining is a characteristic of Gram-negative bacteria, which instead will be colored by the Safranin counterstain. Additionally, different shapes and arrangements of bacteria can be visualized after Gram staining. For example, it is possible to differentiate Cocci, or round bacteria, from rod-shaped Bacillus, or identify bacteria, which forms strands, compared to those which typically aggregate as clumps or occur singly.
In a capsule stained microscope image, the bacterial cells will typically be stained purple, and the background of the slide should be darkly stained. Against this dark background, the capsules of the bacteria, if present, will appear as a clear halo around the cells.
Lastly, in endospore staining, Vegetative cells will be stained red by the Safranin counterstain. If endospores are present in the sample, these will retain the malachite green stain and appear bluish-green in color.
