Summary
Målet med denna studie är att modifiera råtta orthotopic lever transplantation modell för att bättre representera människors levertransplantation och förbättra mottagarens överlevnad. Den presenterade metoden reestablishes lever kranskärlens inflöde genom att ansluta givaren leverns gemensamma lever gatan till mottagaren leverns korrekt lever gatan.
Abstract
Råtta orthotopic lever transplantation (OLT) modell är ett kraftfullt verktyg för att studera akut och kronisk avstötning. Det är dock inte en fullständig representation av mänskliga lever transplantation på grund av avsaknad av kranskärlens återanslutning. Beskrivs här är en modifierad transplantation förfarande som omfattar införlivandet av lever gatan (HA) återanslutning, vilket leder till en markant förbättring av transplantation resultat. Med en genomsnittlig anhepatisk tid på 12 min och 14 s resulterar HA återanslutning i förbättrad perfusion av den transplanterade levern och en ökning av långsiktig mottagaröverlevnad från 37,5% till 88,2%. Detta protokoll inkluderar användning av 3D-tryckta manschetter och hållare för att ansluta portalvenen och infrahepatic inferior vena cava. Det kan genomföras för att studera flera aspekter av levertransplantation, från immunsvar och infektion till tekniska aspekter av förfarandet. Genom att införliva en enkel och praktisk metod för arteriell återanslutning med hjälp av en mikrovaskulär teknik, denna modifierade råtta OLT-protokollet noggrant härmar aspekter av mänskliga lever transplantation och kommer att fungera som en värdefull och kliniskt relevant forskningsmodell.
Introduction
Den globala bördan av leversjukdom fortsätter att öka, med en 30% ökning av leversjukdom-relaterade dödsfall från 2005 till 20131,2. Levertransplantation är ofta den enda utvägen för patienter med leversjukdom i slutstadiet. Levern är den näst mest transplanterade fasta organ, och antalet levertransplantationer som utförs globalt ökade med 7,25% från 2015 till 20161,2. Trots dess prevalens, efter transplantation överlevnad har blivitstagnerade 3,4,5. Den 15 år patientens överlevnad rapporteras vara 53%, och den 20 år patienten överlevnad kan vara så låg som 21%3,5. Även om det finns spännande nya immunobiologi initiativ som kan leda till nya behandlingar och förbättrade kliniska resultat, det finns ännu inte en tillförlitlig små djur modell för att testa dem.
Råttan OLT-modellen har använts i stor utsträckning vid utredning av levertransplantation, inklusiveavstötning 6,7,8,9,10, immuntolerans11, transplantation ischemi-reperfusion skada12, immunsuppression13, och biliär trädskada14,15,16,17. En nackdel med modellen i sin nuvarande form är dock dess höga postoperativa sjuklighet ochdödlighet 18,19. Detta är en allvarlig nackdel som står i strid med den mänskliga operationen, och det äventyrar förmågan att dra kliniskt relevanta slutsatser från modellen20.
Dessutom kan en stor del av denna sjuklighet tillskrivas en frånvarande eller ofullkomlig leverartär (HA) återanslutning18. Även om ett kritiskt steg i mänskliga lever transplantation, tekniska svårigheter tenderar att äventyra HA återanslutning i modellen råtta OLT. Som ett resultat är gallgången (BD) anastomos svag och resulterar i höga andelen gallläckage och BD nekros21. Bortom den höga förekomsten av biliär komplikationer22, en avsaknad av arteriellt inflöde förändrar fysiologi graft levern efter transplantation23, med hypoxi i givaren levern graft24 och leverskador observerats i inflammerade lober19,25,26. Rat OLT utan arteriell återanslutning tenderar också att främja fibros27. Den råtta OLT protokoll beskrivs nedan behandlar dessa frågor genom att införliva en enkel HA återuppbyggnad steg med en tidigare publicerad råtta OLT metod28, vilket resulterar i bevarande av lever parenkym och förbättrad överlevnad priser.
Levertransplantation har tre faser: (1) utvinning av levertransplantatet från donatorn, (2) beredning av givarens levertransplantat och (3) ersättning av mottagarlever med levertransplantat. Förfarandet innebär manipulering av fem anatomiska strukturer: suprahepatic sämre vena cava (SHVC), portal ven (PV), infrahepatic sämre vena cava (IHVC), leverartären (HA), och gallgången (BD).
OLT i råttan först infördes av Lee et al. med hjälp av mikrosutur anastomos av SHVC, PV och IHVC, och en pull-through teknik för BD29. Denna modell förbättrades senare genom användning av tvåmanschetttekniken 197930. Sedan dess har flera alternativa tekniker föreslagits, med majoriteten fokuserar på venös anastomos och med hjälp av en två-manschett teknik med några ändringar31. Även om HA anastomos har beskrivits tidigare i råtta OLT-modellen med tekniker som mikrosutur, manschett, och intraluminal ärmar26,31,32,33,34, dessa tekniker kräver ofta högutbildade mikrokirurgiska färdigheter, avsevärt förändra råtta fysiologi, och hindras av trombos och /eller biliary komplikationer27,35.
Vidare kan valet av kirurgiskt ingrepp också påverka anhepatic tiden (tid från PV fastspänning till reperfusion av transplantat genom den rekonstituerade PV), vilket är avgörande för framgången för råtta lever transplantation. Specifikt, höga överlevnadstal observeras med anhepatic gånger 15-20 min36, och 30 min är den övre gränsen för framgång37,38. Därför är målet med denna metod att genomföra en mindre invasiv och lättare adoptable kirurgiska råtta OLT modell som är kunna återansluta den leverartär, främja effektiv perfusion av den transplanterade levern, upprätthålla flödet till mottagaren gallgången, och bevara mottagarens fysiologiska tillstånd.
Detaljerade här är alla steg i detta reviderade protokoll, inklusive manipulering av celiaki stammen av givaren levern samt användning av 1) en 1,5 mm stent att utföra en extraluminal hylsa samband med mottagaren korrekt HA, 2) en löpande sutur för SHVC-rekonstruktionen, 3) två 3D-tryckta plastmanschetter för PV och IHVC-rekonstruktion39,40, 4) en mikrovaskulär hylsans återanslutning för HA18,27,41 och 5) en tidigare beskriven BD-stentingteknik28. Två ytterligare steg ingår också: en kall spolning via PV, och en antibiotika regim som är baserad på tidigare resultat17. Denna optimerade OLT protokoll minimerar perioperativ komplikationer och sjuklighet och närmare modeller det kirurgiska operativa ingreppet som används i mänskliga lever transplantation.
Protocol
Studien utfördes enligt riktlinjerna för gnagare hantering och kirurgi, och studien protokollet godkändes av University Health Network Animal Care Committee (UHN AUP #: 5840.3) och följer riktlinjerna från den kanadensiska rådet för Animal Care. Studien använder manliga Lewis råttor (stam LEW /SsNHsd), 12-14 veckor gammal, väger mellan 250-300 g.
1. Uppställda utrustning
- Håll en 31 G skarp spets med en nålhållare och skapa en trubbig L-formad injektor genom att böja spetsen upprepade gånger fram och tillbaka tills spetsen snäpper av. Med hjälp av en platt metallfil, trubbig och släta slutet av injektorn.
- Skär upp portalvenen (PV) och infrahepatiska sämre vena cava (IHVC) manschetter från den 3D-tryckta basen med enskalpell ( Supplementary Material 1, Supplementary Material 2, Bild 1, Kompletterande Figur 1).
OBS: En 3D-designprogramvara används för att utforma manschetterna och hållarna, som är tryckta på en 3D-skrivare (Table of Materials) med hjälp av autoklaverbar harts39,40 (specifikationer för allt 3D-tryckt material som ingår i Supplementary Material 1-10). - Använd en ny skalpell för att skära 22 G-katetern i ett dubbelsidigt snedstäng (3,5 mm i längd). Med hjälp av skalpell, etsa försiktigt linjer på ytan av gallgången (BD) stent (skär inte genom väggen i röret). Dessa etsningar kommer att förhindra att slipsar glider under förfarandet.
- Använd en ny skalpell för att skära 24 G-katetern i ett ensidigt snedställt rör (2,0 mm i längd), och skapa flera repor på ytan av den nya arteriella stenten.
OBS: Förhindra förträngning eller ocklusion av lumen av BD-stent genom att undvika applicering av tryck på stenten. Om stenten är minskat eller ockluderas, kommer mottagarens överlevnad äventyras av gallans obstruktion.
- Skär upp portalvenen (PV) och infrahepatiska sämre vena cava (IHVC) manschetter från den 3D-tryckta basen med enskalpell ( Supplementary Material 1, Supplementary Material 2, Bild 1, Kompletterande Figur 1).
2. Givaroperation
- Ställ in en värmedyna på 37 °C och placera den under den kirurgiska plattformen. Sätt på temperaturvakten så att råttans kärntemperatur kan övervakas via rektalsond. Sätt upp anestesiapparaten isofluran.
OBS: Under operation, övervaka djup anestesi genom att notera andningsfrekvens, hjärtfrekvens, färgning av organen / slemhinnorna, och förekomst av eventuella reflexer pedal tillbakadragande. - Ordna den kirurgiskt draperade arbetsytan med alla nödvändiga instrument och material (dvs. sax, tövråkar, gasväv, heparin, upprullningsdon, midsection pad, bomullsspetsar, 4-0 silke, 7-0 silke, 8-0 icke-resorberbara steril sutur, och 10-0 icke resorberbara monofilament sutur) placeras bekvämt på sidorna av den kirurgiska plattformen.
- Ordna arbetsstationen med alla lösningar, inklusive Ringers laktatlösning och 300 IE av natrium heparin (se Tabell över material).
- Väg djuret. Söva donatorråttan genom att placera den i anestesikammaren med 5% isofluran, 5 L/min luftflöde, och 70% FiO2 för induktion. När råttan förlorar medvetandet, minska anestesi till 3% isofluran, 0,5 L/min luftflöde, och 70% FiO2. Kontrollera om det saknas pedalrespons genom att nypa tåen.
- Förbered huden på buken. Använd en elektrisk rakapparat, ta bort pälsen från den ventrala sidan. Uppmärksamt observera givarens andning takt tills den uppnår en stabil och djup takt.
- Lägg den kirurgiskt draperade råttan så att dess ventrala sida är vänd mot taket. Placera näsan i en anestesi asätare med 3% isofluran, 0,5 L/min luftflöde, och 70% FiO2. Förbered bukväggen med povidone-jod, arbetar från mittlinjen utåt, följt av 70% etanol.
- Gör ett snitt från xiphoid processen till blygd symphysis med hjälp av en rund-tippade kirurgiska sax, sedan förbättra exponeringen med en bilateral tvärgående snitt. Stoppa blödningen från bukväggen med hjälp av en bipolär elektrokirurgisk enhet för kauteri. Efter snittet, minska underhåll isofluran till 2%, 0,5 L/min luftflödet, och 70% FiO2.
OBS: Justera isoflurane SPRIDAREN för att uppnå en respirationshastighet på ungefär ett andetag per sekund och kom ihåg att regelbundet bedöma anestesidjupet under hela operationens gång. - Placera en 4-0 sidensöm i xiphoid processen och använd suturen att dra tillbaka bröstväggen cephalad. Tejpa silkestråden till toppen av strukturen som håller anestesi asätare på plats. Håll givarråttans kroppshåla öppen med 3D-tryckta upprullningsdon (se Tilläggsmaterial 3) som placeras på vardera sidan av buken (upprullningsdon hålls på plats med gummiband som är fästa på magneter på operationsplattformen).
OBS: Myggtofjer också kan användas för att greppa xiphoid processen och dra tillbaka cephalad. Fixa myggtens tyns på plats med hjälp av tejp. - Använd en nonwoven gasväv svamp (4 cm x 4 cm) dämpas av Ringers laktatlösning för att innesluta de små och stora tarmarna. Använd en liten, våt, nonwoven gasväv svamp (2 cm x 4 cm) för att försiktigt täcka levern.
- Placera en liten rullade gasbinda under midsection att lyfta buken och förbättra exponeringen av suprahepatic sämre vena cava (SHVC).
- Skär det förfalsknings- ligamentet. Separera den vänstra diafragmaven från SHVC med hjälp av mikro-tuppar. Ligate den vänstra diafragmaven med 7-0 siden, vistas nära SHVC.
OBS: Använd den lilla, våta, nonwoven gasväv svamp, dämpad med Ringers laktat och placeras på levern, att försiktigt dra tillbaka levern bort från xiphoid processen och exponera vänster diafragma ven. - Skär den vänstra triangulära och gastro-hepatic ligament med rund-tippade sax.
- Exponera caudatusloben genom att försiktigt dra tillbaka vänster och mellersta lober mot xiphoidprocessen med hjälp av en liten, våt, nonwoven gasväv svamp. Släpp ligament som skiljer caudatusloben från resten av levern med en rundspetsad sax.
- Dela och separera hepato-esofagus ligament med hjälp av en bi-polar elektrokirurgisk enhet nära matstrupen.
OBS: För försiktigt små- och tjocktarmen till bukhålans vänstra sida och täck dem med våt, fiberduk. - Dissekera retroperitoneum och fett som täcker IHVC. Exponera och isolera IHVC ner till vänster njurlymfknutor anda.
- Något tränger undan IHVC med en bomullspinne för att exponera och sedan cauterize eventuella små vener sammanslagning i den högra sidan av IHVC, med hjälp av bipolär elektrokirurgiska enheten. Även cauterize någon ländryggen vener sammanslagning i IHVC.
- Dela den högra suprarenal (adrenal) ven mellan två 7-0 siden ligaturer, vistas nära IHVC. Befria levern från dess bakre ligament genom att skära dessa under mild dragkraft.
- Isolera rätt renal anda från rätt njurlymfknutor gatan och från den angränsande vävnaden med hjälp av en fin-tip cautery. Försegla rätt njurvensöppning med en 8-0 icke resorberbar steril ligatur.
- Lösgör fettet som täcker PV för att lokalisera pyloric ven (höger magvenen) och den praktiska venen vid de punkter där de sammanfogar PV. Ligate dessa vener med 7-0 siden, förstärka sidan närmast PV med en 8-0 icke resorberbara steril sutursöm. Dela venerna mellan slipsarna.
OBS: Exponera PV genom att använda små, våta gasbinda för att dra tillbaka tolvfingertarmen. Införandet av manschetten är lättare om fett lösgörs från PV, vilket också förhindrar stenos i PV-manschetten. - Injicera 300 IE av heparinnatrium i IHVC, utspädd till 1 mL normal saltlösning, med hjälp av en 1 mL spruta (31 G nål).
- Gör ett snitt 5 mm under BD-bifurkationen och sätt in BD-stenten i den gemensamma BD. Säkra stenten med en 7-0 silkesligatur 1 mm ovanför snittet. En extra slips kan göras under snittet, som är 10 mm under bifurkationen. När stenten är säkrad, skär BD mellan dessa två band.
- Klipp aldrig BD eller korrekt leverartär (HA). Placera en 10-0 icke absorberbar sterila monofilament sutursöm vid 3 klockan position i BD vid snittet som en markör för att förhindra vridning efter återanslutning.
- Exponera rätt HA och dela gastroduodenal artär (GDA) mellan två 7-0 silke ligaturer. Exponera vänster mag artär, splenic artär, och celiac trunk. Bind de tre artärerna både distally och nära sina starter.
- Skär den vänstra magartären, splenic artär, och celiac stammen mellan artären band. Spruta långsamt in 20 mL kallt (4 °C) Ringers laktatlösning i PV, med hjälp av en 20 mL spruta med en 21,5 G-nål. Skär vena cava under den punkt där den vänstra njurvenen går samman med IHVC att tillåta spolutflöde.
OBS: Nålen ska så långt som möjligt hållas från hilum. Givaren lever kall perfusion bör pågå mellan 1-2 min. Medan spolning levern, använd den andra handen för att spruta kallt Ringers laktat på leverns yta. - Skär PV-stammen nedanför den präktiga venen efter spolningen. Skär IHVC strax ovanför den vänstra njurvenen. Kapa SHVC i direkt anslutning till membranet.
- Skär ligament och bindväv mellan levern och retroperitoneum.
OBS: Se till att det finns tillräckliga längder på de främre och bakre SHVC-väggarna för att underlätta den övre kavala anastomosen. Det är avgörande att skära omedelbart intill membranet att behålla så mycket längd som möjligt. - Efter att levern har avlägsnats från buken, placera den snabbt i en skål fylld med 4 °C Ringers laktatlösning. Placera skålen ovanpå en isdyna för att hålla en kall temperatur.
- Kassera donatorråttans kvarlevor, efter institutionella riktlinjer.
3. Beredning av donatorråttlever ("ryggbänk")
- Fyll den kalla petriskålen med en tillräcklig volym på 4 °C Ringers laktatlösning för att dränka givarens råttlever. Rotera försiktigt givaren levern flyter i skålen noga så att sämre yta ansikten uppåt. Sätt manschetterna för PV och IHVC (Tilläggsmaterial 1 respektive Tilläggsmaterial 2, i skålen.
- Dra PV genom PV-manschetten och vik änden av venen över manschetten. Bind PV säkert runt manschetten med hjälp av 7-0 silke. Spola PV med 10 mL av 4 °C Ringers laktatlösning.
- Upprepa steg 3.2 med IHVC, utan spolningen.
- Ta bort fettvävnaden runt celiakistammen. Bilda en större arteriell ärm manschetten genom att skära öppna bifurkation av celiac stammen, splenic artär, och vänster gastric artär (Figur 2A).
OBS: Det är svårt att föra in den arteriella stenten i den gemensamma HA. Sträck ut och räta ut artären med tång flera gånger innan stenten sätts in. Se till att stentens avfasning är vänd uppåt och att artären inte är vriden (Bild 2B). - Sätt 1,5 mm längd 24 G arteriell stent i givaren gemensamma HA via den arteriella manschetten. Säkra stenten med en 8-0 polypropylenligtur (Figur 2C) och spola stenten med Ringers laktatlösning (Bild 2D).
- Placera en mikro-klämma (4-6 mm i längd) på den proximala IHVC, som är avsedd att förhindra blodförlust efter portalreperfusion och undvika luftemboli.
- Rotera levern och exponera dess överlägsna sida. Sätt in två 8-0 polypropylen avsmalningspunkt suturer på laterala och mediala kanterna på SHVC.
- Håll levern vid 4 °C så att den är redo för transplantation i donatorn.
4. Mottagarens operation
- Se avsnittet om givaroperationen ovan och upprepa steg 2.1-2.4.
OBS: Male Lewis råttor i åldern 12-14 veckor gamla används här, väger 5-20 g tyngre än givarna. Under operationen, övervaka djupet av anestesi genom att antliggpa andningsfrekvens, hjärtfrekvens, färgning av organen/slemhinnorna, och närvaro av eventuella reflexer pedal tillbakadragande. - Lägg den kirurgiskt draperade råttan med dess ventrala sida vänd uppåt. Placera näsan i anestesisopvenger för isofluraninandning. Fukta ögonen med opthalamic smörjmedel. Förbered bukväggen med providone-jod först, sedan med 70% etanol.
- Injicera 5 mL av Ringers laktatlösning subkutant på båda nedre sidorna av den ventrala bukväggen. Använd en kirurgisk assistents medhjälpare för att injicera 0,5 mL på 200 mg/kg piperacillin natrium intramuskulärt i vänstra bukväggen innan laparotomi. Administrera dessutom 0,5 mL av 10 mg/mL bupivacain subkutant i den högra bukväggen.
OBS: Administrera samma dos piperacillinnatrium 1x/dag under 3 dagar post-operatively. - Förbered bukväggen igen med providone–jod först och sedan med 70% etanol. Gör ett mittlinjeansion från sternala xiphoid till 1 cm ovanför blygdsysset. Minska isofluran till 2%, 0,5 L/min luftflöde, och FiO2 70% för underhåll av anestesi efter att snittet.
OBS: Myggtofjer kan användas för att fatta tag i xiphoidprocessen och dra tillbaka cephalad. Fixa myggtens tyns på plats med hjälp av tejp. Kroppshålan hålls öppen av 3D-printade upprullningsdon (se Tilläggsmaterial 3) på båda sidor med gummiband magnetiskt hållna till den kirurgiska plattformen. - Linda in de små och stora tarmarna med en våt, nonwoven gasvävsvamp (4 cm x 4 cm) fuktad med Ringers laktatlösning. Använd en liten (2 cm x 4 cm), våt, nonwoven gasväv svamp dämpad med Ringers laktatlösning för att försiktigt täcka levern.
- Placera en liten 3D-tryckt stödplatta (rygghållare; se Supplementary Material 4) under rått-midsektionen för att öka exponeringen av SHVC genom att böja spinnet. Detta kan säkert utföras på råttor och utförs av en kirurg assistent.
- Skär falciform ligament och använda den lilla, våta nonwoven gasväv svamp för att försiktigt dra tillbaka levern bort xiphoid processen och exponera den vänstra diafragma ven. Separera den vänstra diafragmaven från SHVC med hjälp av mikro-tuppar. Ligate den vänstra diafragmaven med 7-0 siden nära membranet.
- Skär den vänstra triangulära och gastro-hepatic ligament med rund-tippade sax.
- Dra vänster och mellersta lober försiktigt mot xiphoid processen med en liten, våt fibervävd gasväv svamp för att avslöja caudate lob. Sever ligament som skiljer caudatus lob från återstoden av levern.
- Dela hepato-esofagus ligament och koagulera eventuella blödningspunkter med bipolär elektrokirurgiska enheten, vistas nära levern. Skär ligamenten vid den bakre aspekten av levern.
- Dra tillbaka de små och stora tarmarna försiktigt till vänster sida av bukhålan och täck dem med våt, nonwoven gasbinda.
- Dissekera retroperitoneum och fett på IHVC att exponera och isolera IHVC ner till höger njurlymfknutor ven. Något tränga undan IHVC med en bomullspinne och cauterize eventuella små vener som går samman i höger sida av IHVC, med hjälp av bipolär elektrokirurgiska enheten. På samma sätt, cauterize eventuella ryggradens vener in i IHVC.
- Dela den högra suprarenal (adrenal) ven mellan två 7-0 silke ligaturer. Befria levern från dess bakre ligament genom att skära dem under mild dragkraft.
- Använd liten, våt gasväv dämpad med Ringers laktatlösning för att dra tillbaka tolvfingertarmen och exponera PV: en. Lossa fett från bifurkation av PV och pyloric ven.
- Dela BD 0,5 cm under dess hilar bifurkation och sätt in en BD-stent i den distala gemensamma BD. Säkra stenten i läge med en 7-0 ligatur ca 0,2 mm under snittet. En extra slips kan placeras ovanför snittet, nära bifurkationen. Skär BD nära lever men distala till slips.
- Separera BD med tåtaningar och undvik att klippa BD eller korrekt HA. Placera en 10-0 icke absorberbar monofilament (t.ex., ethilon) söm vid klockan 3 i BD som en markör för att förhindra vridning efter återanslutning.
- Exponera rätt HA och bifurkation av den gemensamma HA och GDA. Exponera vänster HA, mitten HA, och höger HA. Bind de tre artärerna distala till CHA bifurkation och skär artärerna nära levern, ovanför banden.
- Sätt en lång tunn bit gasbinda bakom SHVC.
- Placera en 3D-printad IHVC-hållare eller "handtag" (Cava 150g 2.1; se Tilläggsmaterial 5) bakom IHVC, och sy ihop ändarna på det 3D-tryckta "handtaget" med hjälp av 10-0 icke resorberbara monofilamentsutur (figur 3A).
- Placera en 3D-printad PV-hållare eller "handtag" (Porta 1.4.1-se Supplementary Material 6) bakom PV, direkt sämre än levern, och sy ändarna på det 3D-tryckta "handtaget" tillsammans med hjälp av 10-0 icke resorberbar monofilamentsutur.
- Knyt löst en 7-0 sidenligtur under både 3D-tryckta hållare (IHVC och PV) (Figur 3A).
- Kläm fast IHVC precis ovanför den högra njurvenen, som ändå ska ligga under den 3D-tryckta kavalhållaren.
- Kläm fast PV strax ovanför pyloric venen, som bör ligga under den 3D-tryckta PV-hållaren. Spela in den anhepatiska tiden, som börjar på denna punkt. Minska till 0,5% isofluran, 0,5 L/min luftflöde, och 70% FiO2 för underhåll av anestesi.
- Spola 2 mL på 37 °C Ringers laktlösning via PV-modulens bifurkation med hjälp av en 3 mL-spruta med en 27 G-nål fastsatt.
- Kläm fast SHVC ovanför levern med en Kitzmillerklämma. Skär under samma klämma, stanna så nära levern som möjligt.
- Kapa ovanför de 3D-tryckta hållare för både PV och IHVC (Bild 3A). Ta bort mottagarens lever. Orientera försiktigt givarelever och placera den i mottagarens kroppshålighet på ett sådant sätt att den övre caval anastomos kan skapas.
- Använd en 8-0 polypropylen som kör sutur för att ansluta sig till givarens SHVC med mottagarens SHVC nära membranet. Först, plats vistelse suturer av 8-0 polypropylen till vänster och höger aspekter av givaren och mottagaren SHVC. Sedan, binda dessa ner på utsidan av ven väggen.
- Använd den vänstra 8-0 polypropylen att sy den bakre väggen av SHVC från vänster till höger och binda till höger 8-0 Polypropylen. Använd den vänstra 8-0 polypropylen att sy den främre väggen av SHVC anastomos från vänster till höger, lämnar de sista två tredjedelar av suturlinjen lös. Spola med hjälp av 20 mL av Ringers laktat mellan de lösa stygnen samtidigt som du ser till att extrahera eventuella luftbubblor.
- Dra åt de lösa stygnen och gör en slips på utsidan av SHVC. Kapa resterande 8-0 polypropylen sutur.
OBS: Klämman håller mottagarens SHVC på plats, vilket gör det lättare att sy ihop givaren och mottagarens SHVC. Registrera varaktigheten av SHVC-anastomos. Vid denna punkt är portahandtagen fästa vid hållararapparaten (hållararmen McGil + holder mini arm LAB + hållarm mjuk del 1.3; se Supplementary Material 7, Supplementary Material 8, respektive Supplementary Material 9, direkt sämre än levern. Denna apparat stöds av en 3D-printad hållare bas (hållare bas 3.1; se Tilläggsmaterial 10). - Sätt in PV-manschetten (Supplementary Material 1) från givaren i recipienten PV och dra åt 7-0 silkeslipsen. Spola givarens och mottagarens PV med Ringers laktatlösning värms upp till 37 °C före anslutningen.
- Ta bort den atraumatiska klämman från SHVC (först), därefter det mikrovaskulära klippet för PV (sekund). Åter genomfusera levern med varmt blod; vid denna punkt har anhepatic fas tiden avslutats. Spela in den här gången.
- Häll 10 mL varm Ringers laktatlösning ovanpå levern för att värma. Ta bort de 3D-tryckta hållarna med rundspetsad sax (kapa säkringsstygnet).
- Sätt in givaren IHVC manschett (Supplementary Material 2) i recipienten IHVC och säkra med en 7-0 sidenslips. Ta bort givaren IHVC-klippet först, sedan mottagarens klipp (Bild 3B). Cavan är fäst vid hållarapparaten och hållarbasen enligt ovan,
- Ta bort 3D-skrivarhållarna (porta och cava) med rundspetsad sax (kapa säkringsstygnet; Figur 3C), vilket resulterar i en ansluten IHVC (Bild 3D).
- Noggrant undersöka området runt levern för någon blödning. Ingjuta 3 mL av 37 °C Ringers laktatlösning inuti kroppshålan.
- Arteriell anastomos: skär av den del av celiac stammen från givaren som sträcker sig bortom stent.
- Kläm fast mottagarens ordentliga HA och skär av slipsen i änden. Skär av eventuell extra vävnad som omger kärlet (Bild 4A). Med Ringers laktatlösning spolar du lumen av både donator- och mottagarkärlsändar.
- Dra mottagaren ordentlig HA i ärmen på givaren HA stent att åstadkomma HA anastomos. Placera en 10-0 ethilon genom vänster aspekt av (givaren) HA, 2,5 mm ovanför stentens distala öppning (från utsidan till insidan), sedan ut genom stentens ände, med 10-0 ethilon (4 cm längd) som styrs av en böjd nål (Figur 4B).
- Transfix mottagaren korrekt HA 0,5 mm under kärlets öppning, placera stygnet först (från insidan till utsidan) till vänster sida av kärlet, sedan (från utsidan till insidan) till höger sida av artären.
- Placera suturen genom den högra väggen av (givaren) HA från insidan till utsidan, på ett avstånd från stentens kroppsöppning identisk med originalstygn. Dra upp på de två ändarna av 10-0 icke absorberbara monofilament, som kommer att glida mottagaren ordentlig HA upp och in i HA stent (Figur 4C).
OBS: Observera för pumpning av blod. Ett alternativ är att skära givaren GDA för att bekräfta att blodet pumpar genom anastomos. Se till att åter knyta artären innan du går vidare till nästa steg i förfarandet om GDA är avskurna. - Bind 10-0 icke resorberbar monofilament med sig själv, över givaren HA (Figur 4D). Den arteriella anastomosen är nu klar.
- Gallans anastomos: placera en slips löst runt mottagaren BD och stent (Bild 5A), ta sedan bort BD-stenten. Spola BD av både recipient och donator innan gallansanslutningen är klar.
- Sätt in givarens BD-stent i mottagarens gallgång (bild 5B) och dra åt den slips som tidigare placerades runt mottagaren BD (Bild 5C).
- Returnera tarmarna till kroppshålan. Ingjuta 2 mL av 37 °C Ringers laktatlösning i hålrummet för att spola den. Blötlägg en del av lösningen upp med gasväv.
- Se till att tarmarna är tillbaka i sitt ursprungliga läge innan du syr upp parietal bukhinnan och huden med 5-0 monocryl.
- Stäng snittet i två lager med 5-0 monocryl. Injicera 0,5 mL av 0,5% bupivakain runt det sydda parietalt peritoneum och upprepa detta när huden är ihopsydd.
- Försiktigt linda mottagaren råtta i en pappershandduk när du överför till buren. Ge djuret fri tillgång till vatten och mat från uppvaknandets tid. Håll en varm vatten-cirkulerande filt under hälften av buren i 24-38 h. En råtta är utsedd till en bur under den omedelbara postoperativa perioden.
5. Postoperativ vård
- Blötlägg matpellets i vatten och placera dem i en petriskål på burgolvet.
- Övervaka pulsen, andningsfrekvensen och hudfärgen på råttan.
- Administrera piperacillin på postoperativa dag 1, 2 och 3. Administrera buprenorfin subkutant och övervaka för eventuella tecken på smärta såsom eventuella beteendeförändringar, letargi, ungroomed päls, depression, stympning, eller aptitlöshet för de första 72 h.
OBS: Smärta bedöms minst 2x dagligen i 3 dagar efter transplantation, sedan minst 1x dagligen och framåt.
Representative Results
Medan upprättandet av en icke-HA anastomos råtta OLT modell med hjälp av en tidigare beskrivna protokoll28, observerade vårt team 50% och 37,5% överlevnad vid 21 dagar och 60 dagar efter operationen, respektive. Även om höga andelen långsiktiga överlevnad utan HA anastomos har rapporterats av vissa grupper28, dessa tidiga resultat belysa nackdelarna med att inte ha kranskärlens inflöde. Det optimerade återanslutningsförfarandet för HA ökade däremot överlevnaden på lång sikt från 37,5 % till 88,2 % (p = 0,015) (figur 6).
Histologisk analys av en representativ delmängd av transplanterade djur utan HA återanslutning (vid dag 6 och 13 efter operationen) visade tecken på hypoxisk leverskada med centrilobulär nekros (Figur 7). Omfattande levernekros var förknippad med oerhört förhöjda nivåer av alanin aminotransferas (ALT) och aspartat aminotransferas (AST) hos dessa djur (Figur 7). Däremot visade transplanterade råttor med HA återanslutning inga tecken på leverskada, och histologisk analys visade en normal lever parenkym struktur med organiserad acini, lobules (t.ex., central ven och portal triader med levervenen), artärer, och gallgången (Figur 7).
Även om medelanhepatisk tid under loppet av 23 separata operationer var acceptabel (12 min och 14 s [± 78 s]), är det fortfarande möjligt att överlevnaden i icke-HA återanslutningsmodellen så småningom kan förbättras med ökad praxis. Det är dock värt att notera att tre av de fyra djur som transplanterats utan HA återanslutning (som följdes för långsiktig överlevnad) avlivades på grund av nöd på dag 56, 96 och 111 efter operationen. Dessutom visade histologisk analys av levern reaktiva förändringar efter hypoxisk leverskada inklusive märkt gallgången spridning, periportal fibros och inflammation, och förvrängd lever parenkym (Kompletterande Figur 2). Förekomsten av morfologiska funktioner av hypoxisk lever skada styrker resultaten att HA återanslutning är viktigt för effektiv lever perfusion och normal funktion.

Figur 1: Schematisk återgivning av den 3D-tryckta manschettkonstruktionen för portalven och infrahepatisk underlägsen vena cava. Den första slipsen dras åt i spåret (ii) närmast handtaget (iii), och den andra slipsen dras åt i spåret (i) längst bort från handtaget. De utvändiga diametern är (iv) 2,38 mm för portalvenen (PV) och 2,15 mm för den infrahepatiska underlägsna vena cava (IHVC). Invändiga diametrar är (v) 1,74 mm för PV och 1,38 mm för IHVC. Längderna är (vi) 2,60 mm för PV och 2,15 mm för IHVC (exakta specifikationer för alla 3D-tryckta material finns i Tilläggsmaterial). Vänligen klicka här för att visa en större version av denna figur.

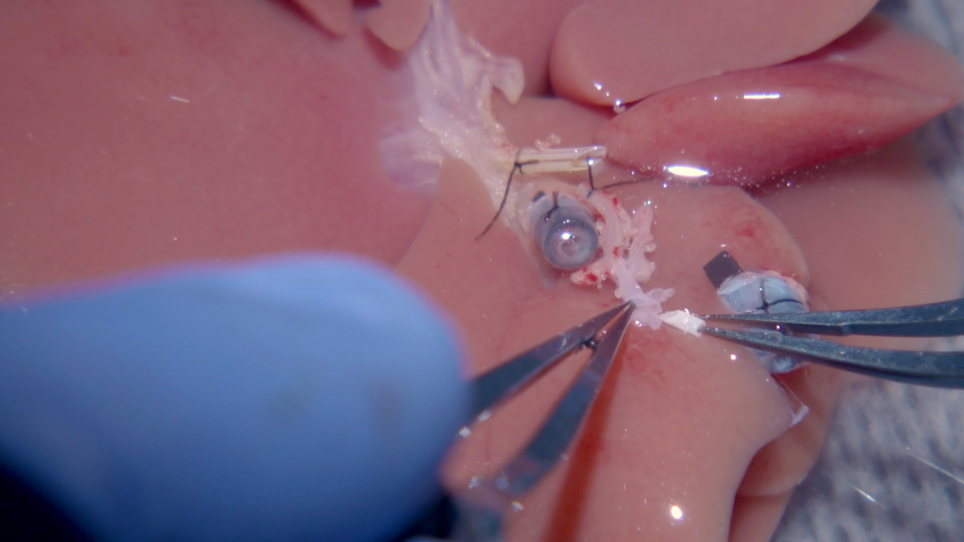
Figur 2: Hepatisk artärstent insättning i transplantat. (A) Den inledande änden av celiac stammen (i) breddas genom att skära splenic artär till vänster gastric artär, som utsätter bifurcation av den gemensamma HA. ii) BD-stenten är bunden före utvinning av donatorråtlever. iii) PV-manschetten och iv) IHVC-manschetten sätts in och knyts genom att kärlens ändar viks över manschetten. (B) (i) För att föra in HA-stenten sträcks den exponerade gemensamma HA flera gånger med tänjningar. (C) (i) HA-stenten placeras säkert i den gemensamma HA och bundna med 8-0 prolene. (D) (i) HA-stenten spolas med (ii) Ringers laktatlösning (BD = gallgången, IHVC = infrahepatisk sämre vena cava, HA = leverartär). Vänligen klicka här för att visa en större version av denna figur.

Figur 3: Infrahepatisk sämre vena cava-anslutning med hjälp av 3D-tryckt hållare. (A) PV:en (i) är ansluten med samma teknik som IHVC-anslutningen. Transplantatet är (ii) fastklämt ovanför (iii) IHVC-manschetten. Mottagaren IHVC öppning är (iv) sutured vid sidorna av öppningen till en 3D-tryckt hållare för att hålla den sträckt öppen. En lös (v) 7-0 siden är knuten runt mottagaren IHVC. (B) Manschetten på transplantatet IHVC är i) insatt inom mottagaren IHVC. Den lösa slipsen är nu åtdragen. (C) Klämman avlägsnas, och (i) den 3D-tryckta hållaren lösgörs med en sax. (D) En ytterligare (i) 7-0 silke är bunden runt anslutningen om inte säker, men typiskt en slips är tillräcklig (PV = portal ven, IHVC = infrahepatic sämre vena cava). Vänligen klicka här för att visa en större version av denna figur.

Bild 4: Mikrovaskulär hylsanslutning av den leverartären. (A) (i) BD-stenten är inte ansluten till mottagaren. ii HA-stenten placeras i transplantatet, som är kopplat till (iv) mottagarens riktiga HA. (iii) PV:en är ansluten. (B) 10-0 ethilon med en (i) böjd nål dras genom HA-stenten till sidorna av mottagaren HA öppningsänden. (C) Den 10-0 ethilon dras tillbaka genom HA stent; därför dras mottagarens riktiga HA genom stenten som en hylsa. (D) (i) En slips med 10-0 ethilon görs när mottagarens korrekt HA dras in i stenten till den del som först går genom HA-stenten. (E) Visas här är en schematisk av HA anastomos beskrivs i (B), (C), och (D) (BD = gallgången, HA = leverartär, PV = portal ven). *Den inledande änden av celiac stammen breddas genom att skära splenic artär till vänster gastric artär. Vänligen klicka här för att visa en större version av denna figur.

Bild 5: Gallgångsanslutning med hjälp av två stent. (A) (i) Graft BD-stent förs in i mottagaren BD med hjälp av (ii) stent löst bunden vid öppningen av mottagarens BD. (iii) PV är länkad före BD-anslutningen, som är placerad bakom BD. (B) Stenten i slutet av mottagarens BD avlägsnas och används som en vidgas öppning till (i) sätt in BD-stenten bunden till transplantatet. (C) Den slips som löst säkrar mottagarstent används nu för att binda anslutningen, och (i) ytterligare 7-0 silke används för att stadigt hålla stenten på plats för att undvika att stenten glider eller vrids. Vänligen klicka här för att visa en större version av denna figur.

Figur 6: Transplantation procent överlevnad. Orthotopic råtta lever transplantation utan HA återanslutning (n = 8) och med HA återanslutning (n = 17). Djur följs noga efter transplantation för tecken på leversvikt och/eller infektion i minst 60 dagar. Råttor som inte visade några komplikationer efter operationen ansågs vara överlevande (*p = 0,015, enligt kaplan- Meier skattningsberäkning [långt ranktest]). Vänligen klicka här för att visa en större version av denna figur.

Figur 7: Lever histopatologisk bedömning. Representativa hematoxylin och eosin-färgade sektioner hos djur (A) utan och (B) med hepatisk artär (HA) återanslutning vid dag 6 och 13 efter levertransplantation (LTx). (C) Normal lever parenkym visar portal triad (portal ven, artär, och gallgången), lobules inklusive centrala ven, och acini. Hepatocyter bredvid portaltriaden är zon 1 hepatocyter; hepatocyter bredvid den centrala venen inom lobules är zon 3 hepatocyter; och hepatocyter mellan zon 1 och 3 är zon 2 hepatocyter (ALT = alanin aminotransferas, AST = aspartat aminotransferas, CV = central ven). Vänligen klicka här för att visa en större version av denna figur.

Kompletterande figur 1: Stent- och manschettmått. Vänligen klicka här för att visa en större version av denna figur.

Kompletterande figur 2: Lever histopatologisk bedömning som visar störningar av leverparenkym. Representativa hematoxylin och eosinfärgade sektioner hos djur utan HA återanslutning vid dag 54, 96 och 111 efter LTx. Vänligen klicka här för att visa en större version av denna figur.
Kompletterande Material 1: Porta manschett 200g - stöd 2.0. Vänligen klicka här för att se denna fil (Högerklicka för att ladda ner).
Kompletterande Material 2: Cava manschett 200g - stöd 2.0. Vänligen klicka här för att se denna fil (Högerklicka för att ladda ner).
Kompletterande Material 3: Lever upprullningsdon 200g. Vänligen klicka här för att se denna fil (Högerklicka för att ladda ner).
TilläggSmaterial 4: Rygghållare - 1.2. Vänligen klicka här för att se denna fil (Högerklicka för att ladda ner).
Kompletterande Material 5: Cava 150g - 2.1. Vänligen klicka här för att se denna fil (Högerklicka för att ladda ner).
Kompletterande Material 6: Porta 1.4.1. Vänligen klicka här för att se denna fil (Högerklicka för att ladda ner).
Kompletterande Material 7: Innehavaren arm McGil. Vänligen klicka här för att se denna fil (Högerklicka för att ladda ner).
Kompletterande Material 8: Hållare mini arm LAB. Vänligen klicka här för att se denna fil (Högerklicka för att ladda ner).
TilläggSmaterial 9: Hållare och arm mjuk del 1.3. Vänligen klicka här för att se denna fil (Högerklicka för att ladda ner).
Tilläggsmaterial 10: Hållare bas - 3.1. Vänligen klicka här för att se denna fil (Högerklicka för att ladda ner).
Discussion
Små djur lever transplantation modeller är viktiga för att förstå transplantation immunitet och identifiera nya terapeutiska strategier32. Den idealiska smådjurs lever transplantation modellen replikerar alla steg i det mänskliga förfarandet, inklusive arteriell anastomos. Det kan vara utmanande att tolka resultat från råtta OLT-modellen, eftersom de flesta versioner inte innehåller en HA anastomos steg, vilket leder till högre frekvens av komplikationer och sjuklighet42. Vissa rekonstruktionsprocedurer har använt njurartären, vilket kräver avlägsnande av njuren27. Detta protokoll undviker avlägsnande av organ, eftersom det är bortom vad som sker i det mänskliga förfarandet.
Arteriella rekonstruktioner kan också utföras genom att manipulera råttan aorta31. Dessa metoder kräver dock omfattande dissektion och fastspänning av stora stora stora delar. Om klämman tiden är långvarig, då mottagaren råtta kommer att ha dåliga resultat relaterade till distala ischemi43. Hos människor innebär en LT kirurgisk teknik ligering och delning av mottagaren gastroduodenal artär (GDA). Men de fysiologiska och anatomiska funktionerna hos gnagare gör transplantation med hjälp av denna teknik mer fysiologiskt utmanande och kan leda till komplikationer (dvs. nekros i bukspottkörteln och gallgången35 och gallläckage44). Den arteriella återanslutning i detta protokoll är avsedd att kringgå denna utmaning, upprätthålla kanal blodflödet, och förbättra mottagarens resultatet.
Användningen av en hylsa och stenting teknik för återuppbyggnad av råttan HA har beskrivits tidigare27. I denna teknik, en stent används som en guide, och artären rekonstrueras från givaren celiac trunk till mottagaren gemensamma HA. Mottagaren gemensamma HA sedan dissekeras ut, och mottagaren GDA är bunden av27. Som ett resultat, blodtillförseln till den nedre delen av mottagaren BD och chef för bukspottkörteln kan bli äventyras. Man tror att säkerheten cirkulationen till detta område ofta ger otillräckligt blodflöde till gallgången. Till exempel, detta protokoll test-klämmer mottagaren GDA först med en mikrovaskulär klipp, sedan delar mottagaren BD. Med GDA fastklämd blöder inte den delade BD. Efter att GDA-klämman avlägsnats observeras rask blödning från BD. Detta protokoll, som upprätthåller bra flöde till den delade mottagaren gallgången, skyddar fysiologi mottagaren levervävnad genom att tillhandahålla adekvat lever blodperfusion och förhindra post-OLT hypoxisk lever skada.
På givarsidan, HA stent sätts in i celiac bålen under beredningen av transplantatet med lätthet genom att skapa ett plåster från celiac stammen, vänster mag artär och splenic gatan. Stenten kan sättas in genom den breda öppningen, vilket är mindre svårt än att försöka föra in stenten i celiacstammen ensam. Det har konstaterats att 24 G är en idealisk storlek att använda för HA-stenten. Stentens längd ska vara 1,0-1,5 mm lång, eftersom den fungerar som en öppen grind för att mottagarens rätta HA lätt ska dras in i donatorns gemensamma HA. Med noggrann uppmärksamhet på var 10-0 ethilon suturen är placerad, kommer blod som flyter genom denna anslutning aldrig röra stenten direkt, och mottagarens korrekt HA kommer att skydda den från insidan, vilket minskar risken för komplikationer. Viktigt är att donatorns HA aldrig kläms fast för att undvika vasospasm. Framgången för kranskärlens återuppbyggnad utvärderas genom att lämna givaren GDA öppen. Framgångsrika anastomos resulterar i bra blodflödet från givaren GDA när återuppbyggnaden är klar.
I detta protokoll, liknande andra, shvc återanslutning är det långsammaste steget och slutligen dikterar varaktigheten av anhepatic fasen. Eftersom varaktigheten av den anhepatic tiden ökar, risken ischemisk skada och leverdysfunktion ökar45. En annan kritisk komponent i OLT råtta modeller är storleken på transplantatet, stent, och manschetter. Om transplantatet är för litet kan transplantatet vridas eller vända, vilket hindrar kärlanslutningarna. Storleken på stent och manschetter kan kräva justeringar efter ålder, kön, vikt, och stam av råttan. Storleken på manschetterna som används här valdes som tidigare beskrivits28, och en manschettstorlek som kontrollerade för råttans storlek användes. Det fanns inga tecken på nöd eller komplikationer (dvs. lever trängsel, ödem, ascites eller splenomegali) under uppföljningsperioden (hittills: median = 133 dagar efter operationen, minimum = 115 dagar post-op, max = 161 dagar post-op). Ytterligare studier för att bestämma den lämpliga storleken på PV och IHVC för olika råtta stammar står för både ålder och kön är motiverade.
Detta modifierade RAT OLT-protokoll använder 3D-printade manschetter för PV och IHVC, som beskrivitstidigare 39,40. Befintliga metoder för att ansluta PV och IHVC inkluderar en mikrosuturteknik32, manschettteknik46, och mikrosutur-tillfällig skenateknik47. Den 3D-tryckta manschetttekniken valdes, eftersom den gör att manschettens storlek kan standardiseras enligt råttastammen och är lätt att förbereda och använda. Stora mängder manschetter med samma mått kan skrivas ut på en gång. Manschettens ytteryta har två räfflor som hjälpmedel med säkringsband och förhindrar glidning. En svans är också införlivas i manschetten design för att möjliggöra enklare manipulation av manschetten. Sammantaget, Man tror att införliva 3D-tryckta manschetter leder till hög framgång och reproducerbarhet av OLT-förfarandet genom att förkorta anhepatic tid. Det är fast att denna teknik också förkortar den kirurgiska inlärningskurvan.
Sammanfattningsvis fastställde det beskrivna protokollet en modell som är mer lik mänskliga lever transplantation genom att införliva en kranskärlens återanslutning steg. Detta protokoll kan anpassas för att studera många immunologiska och kirurgiska aspekter av lever transplantation och kan fungera som en modell för att testa nya terapeutiska interventioner relevanta för transplantation.
Disclosures
Författarna har inget att avslöja.
Acknowledgments
Denna forskning finansierades genom medel från Multi-Organ transplantation programmet vid UHN och stöd från Toronto General och Toronto Western Foundation.
Materials
| Name | Company | Catalog Number | Comments |
| 10-0 Ethilon | Ethicon | 2830G | 10-0 Ethilon Black 1X5" BV100-4 Taper |
| 10mL Syringe | BD | B302995 | Luer-Lok Tip, Sterile, Disposable |
| 1mL Syringe | BD | B309628 | Luer-Lok Tip, Sterile, Disposable |
| 20mL Syringe | BD | B301031 | Luer-Lok Tip, Sterile, Disposable |
| 3D Printed Cuff for IHVC | Custom | ||
| 3D Printed Cuff for PV | Custom | ||
| 3D Printed Holder for IHVC | Custom | ||
| 3D Printed Holder for PV | Custom | ||
| 3mL Syringe | BD | B309657 | Luer-Lok Tip, Sterile, Disposable |
| 4-0 Sofsilk | Coviden | GS-835 | Wx coded braided silk, 30", Suture 1-Needle 26 mm Length 1/2 Circle Taper Point Needle |
| 5-0 Monocryl | Ethicon | Y433H | Undyed Monofilament 1X27" TF |
| 5mL Syringe | BD | B309646 | Luer-Lok Tip, Sterile, Disposable |
| 7-0 Silk | Teleflex Medical | 103-S | Black |
| 8-0 Prolene | Ethicon | 2775G | 8-0 Prolene Blue 1X24" BV130-5 EVP Double Armed |
| Barraquer Micro Needle Holder Without Catch | Aesculap Surgical Instruments | FD231R | Curved 120 mm, 4 3/4″ |
| Barraquer Needle Holder, Extra Fine Jaws 8.0mm, Curved With Out Lock | Rumex International Co. | 8-025T | Small Size, Titanium |
| Barraquer Needle Holder, Fine Jaws 12.0mm, Curved With Out Lock | Rumex International Co. | 8-021T | Small Size, Titanium |
| BD Insyte Autoguard BC 22 GA x 1.00 IN | BD Angiocath / Autoguard | 382523 | 22 G x 1.00" (0.9 mm x 25 mm) Wingless catheter, 37 mL/min |
| BDPrecisionGlide Single-use Needles: Regular Bevel - Regular Wall. | BD | B305106 | PrecisionGlide stainless-steel needles with translucent, color-coded, polypropylene hubs. 22 G |
| BD Precisionglide Syringe Needle 21G | BD | 305167 | Gauge 21, length 1.5 inch, hypodermic needle |
| BD Precisionglide Syringe Needle 30G | BD | 305128 | Gauge 30, length 1 inch, hypodermic needle |
| Betadine Solution by Purdue Products LP | Purdue Products Lp | 67618-150-17 | 10% povidone–iodine topical solution USP |
| Bupivacaine Injection BP 0.5% | SteriMax Inc. | DIN:02443694 | 0.5% (100mg/20mL) |
| Curved Tying Forceps | Duckworth & Kent | 2-501E | 6mm tying platforms, straight shafts, flat handle, length 88mm |
| DC Temperature Controller | FHC Inc. | 40-90-8D | |
| DK Iris Scissors (Curved) | Duckworth & Kent | 1-211B | Blunt tips, cut length 4mm, tip to pivot length 11mm, round handle, length 107mm |
| Ethanol, 200 proof (100%), USP, Decon Labs | Decon Labs, Inc. | 2716 | Dilute to 70% with d2H2O |
| Fine Adjustable Wire Retractor | Fine Science Tools | 17004-05 | Maximum spread: 3.5cm, Depth 5cm |
| Harvard Apparatus Isoflurane Funnel-Fill Vaporizer | Harvard Appartus Limited | 34-1040SV | |
| Heparin LEO(heparin sodium) | LEO Pharma Inc. | DIN:00453811 | 10,000 i.u./10 mL |
| Ice-Pak | Cryopak | FIP88016 | 4.00 in. x 7.00 in., thickness 1.50 inch |
| Isoflurane United States Pharmacopeia (USP) 99.9% | Piramal Healthcare Limited | DIN: 02231929 | 250 mL, Inhalation Anesthetic, NDC 66794-017-25 |
| Khaw Transconjunctival Adjustable Suture Control Forceps | Duckworth & Kent | 2-502N | 5mm highly polished tying platforms, straight shafts, flat handle, length 84mm |
| Lactate Ringer's Injected USP, 1000mL | Baxter Co. | DIN: 00061085 | JB2324 |
| McPherson Tying Forceps | Duckworth & Kent | 2-500E | 6mm tying platforms, straight shafts, flat handle, length 90mm |
| Metzenbaum Scissors - 14.5 cm | Fine Science Tools | 14024-14 | Straight Sharp/Blunt |
| Micro Kitzmiller Clamp | Scanlan | 3003-630 | Jaw length 23mm, Length 11cm |
| Microscope-Leica M525 F20 | Leica Microsystems | No catalog number | |
| Non-woven Gauze Sponges | Fisherbrand | 22-028-556 | |
| Olsen-Hegar with Suture Cutter | Fine Science Tools | 12002-14 | 15 mm cutting edge, 2mm jaw surface - 14cm |
| OptixCare Eye Lube, 25gm | OptixCare | ES-KE8O-69U1 | Formerly Optixcare Surgical Eye Lubricant |
| Piperacillin sodium salt | Sigma-Aldrich | P8396 | Penicillin analog |
| Puritan 3" Standard Cotton Swab w/Wooden Handle | Puritan Medical Products Company LLC | 803-WC | Regular Cotton Tipped Applicator with Wooden Handle |
| Round Handled Needle Holder Straight w/ Lock | Fine Science Tools | 12075-12 | Round handles allow easy fingertip adjustments - 12.5cm |
| Shea Scissors Curved Blunt | Fine Science Tools | 14105-12 | Transplant scissors with light and delicate pattern - 12cm |
| Stainless Steel Micro Serrefines Curved - 4mm | Fine Science Tools | 18055-06 | Jaw length 4mm, Jaw width 0.75mm, Total length 16mm, Jaw pressure 125g |
| Stainless Steel Micro Serrefines Curved - 6mm | Fine Science Tools | 18055-05 | Jaw length 6mm, Jaw width 1mm, Total length 17mm, Jaw pressure 100g |
| Stainless Steel Micro Serrefines Straight - 6mm | Fine Science Tools | 18055-03 | Jaw length 6mm, Jaw width 1mm, Total length 15mm, Jaw pressure 100g |
| Surgical Platform | Custom, magnetic | ||
| SurgiVet Vaporstick Anesthesia Machine | General Anesthetic Services, Inc | V7015 | |
| T/Pump Localized Therapy | Stryker | TP700 Series | |
| Vacuum-Pressure Pump | Barnant Co. | 400-1901 | |
| Vannas Scissors with Microserrations Straight | Fine Science Tools | 15070-08 | Cutting edge: 5mm, Tip diameter: 0.1mm - 8.5cm |
| Vetergesic Buprenorphine | Ceva Animal Health Ltd | NAC No.:12380352 | 0.324 mg/ml buprenorphine hydochloride Solution for Injection for Dogs and Cats |
| Vetroson V-10 Bipolar Electrosurgical Unit | Summit Hill Laboratories | No catalog number | |
| Surgical Drape | PDC Healthcare | DRP1824 | Multi-purpose sterile clear plastic, 18" x 24", 40/case |
References
- Global Observatory on Donation and Transplantation. Organ Donation and Transplantation Activities. , http://www.transplant-observatory.org/download/2016-activity-data-report (2016).
- Asrani, S. K., Devarbhavi, H., Eaton, J., Kamath, P. S. Burden of liver diseases in the world. Journal of Hepatology. 70 (1), 151-171 (2019).
- Dopazo, C., et al. Analysis of adult 20-year survivors after liver transplantation. Hepatology International. 9 (3), 461-470 (2015).
- Schoening, W. N., et al. Twenty-year longitudinal follow-up after orthotopic liver transplantation: a single-center experience of 313 consecutive cases. American Journal of Transplantation. 13 (9), 2384-2394 (2013).
- Pischke, S., et al. Factors associated with long-term survival after liver transplantation: A retrospective cohort study. World Journal of Hepatology. 9 (8), 427-435 (2017).
- Hamdani, S., et al. Delayed and short course of rapamycin prevents organ rejection after allogeneic liver transplantation in rats. World Journal of Gastroenterology. 23 (38), 6962-6972 (2017).
- Endo, K., et al. Pretransplant replacement of donor liver grafts with recipient Kupffer cells attenuates liver graft rejection in rats. Journal of Gastroenterology and Hepatology. 30 (5), 944-951 (2015).
- Zhao, Z., et al. IL-34 Inhibits Acute Rejection of Rat Liver Transplantation by Inducing Kupffer Cell M2 Polarization. Transplantation. 102 (6), e265-e274 (2018).
- Nagakawa, Y., et al. Over-expression of AIF-1 in liver allografts and peripheral blood correlates with acute rejection after transplantation in rats. American Journal of Transplantation. 4 (12), 1949-1957 (2004).
- Gao, L. H., Zeng, L. X., Chen, H. M., Wan, R. H. Cytomegalovirus infection accelerates the process of chronic rejection in rat liver transplantation. Transplantation Proceedings. 45 (6), 2536-2538 (2013).
- Wu, Y., et al. Effects of combined genes of CTLA4Ig and IDO in post-liver transplantation immune tolerance of rats. Annals of Hepatology. 15 (5), 729-737 (2016).
- He, X. S., et al. Influence of warm ischemia injury on hepatic functional status and survival of liver graft in rats. Hepatobiliary and Pancreatic Diseases International. 2 (4), 504-508 (2003).
- Tamura, A., et al. Combination effect of tacrolimus and FTY720 in liver transplantation in rats. Transplantation Proceedings. 31 (7), 2785-2786 (1999).
- Wang, Z., et al. RhGH attenuates ischemia injury of intrahepatic bile ducts relating to liver transplantation. Journal of Surgical Research. 171 (1), 300-310 (2011).
- Jiang, J. W., et al. Chronic bile duct hyperplasia is a chronic graft dysfunction following liver transplantation. World Journal of Gastroenterology. 18 (10), 1038-1047 (2012).
- Tang, Y., et al. S-Adenosylmethionine attenuates bile duct early warm ischemia reperfusion injury after rat liver transplantation. Molecular Immunology. 95, 83-90 (2018).
- Nosaka, T., Bowers, J. L., Cay, O., Clouse, M. E. Biliary complications after orthotopic liver transplantation in rats. Surgery Today. 29 (9), 963-965 (1999).
- Howden, B., Jablonski, P., Grossman, H., Marshall, V. C. The importance of the hepatic artery in rat liver transplantation. Transplantation. 47 (3), 428-431 (1989).
- Post, S., et al. The impact of arterialization on hepatic microcirculation and leukocyte accumulation after liver transplantation in the rat. Transplantation. 54 (5), 789-794 (1992).
- Hori, T., et al. Impact of hepatic arterial reconstruction on orthotopic liver transplantation in the rat. Journal of Investigative Surgery. 25 (4), 242-252 (2012).
- Zhou, S., et al. New method of stent-facilitated arterial reconstruction for orthotopic mouse liver transplantation. Journal of Surgical Research. 187 (1), 297-301 (2014).
- Noack, K., Bronk, S. F., Kato, A., Gores, G. J. The greater vulnerability of bile duct cells to reoxygenation injury than to anoxia. Implications for the pathogenesis of biliary strictures after liver transplantation. Transplantation. 56 (3), 495-500 (1993).
- Imamura, H., Rocheleau, B., Cote, J., Huet, P. M. Long-term consequence of rat orthotopic liver transplantation with and without hepatic arterial reconstruction: a clinical, pathological, and hemodynamic study. Hepatology. 26 (1), 198-205 (1997).
- Reck, T., et al. Impact of arterialization on hepatic oxygen supply, tissue energy phosphates, and outcome after liver transplantation in the rat. Transplantation. 62 (5), 582-587 (1996).
- Zhao, D., Wheatley, A. M. Orthotopic liver transplantation in the rat: comparison of models with and without rearterialization of the graft. European Surgical Research. 25 (5), 294-302 (1993).
- Chaland, P., et al. Orthotopic liver transplantation with hepatic artery anastomoses. Hemodynamics and response to hemorrhage in conscious rats. Transplantation. 49 (4), 675-678 (1990).
- Liu, X., He, C., Huang, T., Gu, J. Development of a New Technique for Reconstruction of Hepatic Artery during Liver Transplantation in Sprague-Dawley Rat. PLoS One. 10 (12), e0145662 (2015).
- Oldani, G., Lacotte, S., Morel, P., Mentha, G., Toso, C. Orthotopic liver transplantation in rats. Journal of Visualized Experiments. (65), (2012).
- Lee, S., Charters, A. C., Chandler, J. G., Orloff, M. J. A technique for orthotopic liver transplantation in the rat. Transplantation. 16 (6), 664-669 (1973).
- Kamada, N., Calne, R. Y. Orthotopic liver transplantation in the rat. Technique using cuff for portal vein anastomosis and biliary drainage. Transplantation. 28 (1), 47-50 (1979).
- Kashfi, A., et al. A review of various techniques of orthotopic liver transplantation in the rat. Transplantation Proceedings. 37 (1), 185-188 (2005).
- Chong, A. S., Alegre, M. L., Miller, M. L., Fairchild, R. L. Lessons and limits of mouse models. Cold Spring Harbor Perspectives in Medicine. 3 (12), a015495 (2013).
- Hasuike, Y., et al. A simple method for orthotopic liver transplantation with arterial reconstruction in rats. Transplantation. 45 (4), 830-832 (1988).
- Hickman, R., Engelbrecht, G. H., Duminy, F. J. A technique for liver transplantation in the rat. Transplantation. 48 (6), 1080 (1989).
- Steffen, R., Ferguson, D. M., Krom, R. A. A new method for orthotopic rat liver transplantation with arterial cuff anastomosis to the recipient common hepatic artery. Transplantation. 48 (1), 166-168 (1989).
- Shi, Y., et al. Magnetic ring anastomosis of suprahepatic vena cava: novel technique for liver transplantation in rat. Transplant International. 28 (1), 89-94 (2015).
- Dippe, B. E., et al. An improved model for rat liver transplantation including arterial reconstruction and simplified microvascular suture techniques. Journal of Investigative Surgery. 5 (4), 361-373 (1992).
- Kobayashi, E., Kamada, N., Goto, S., Miyata, M. Protocol for the technique of orthotopic liver transplantation in the rat. Microsurgery. 14 (8), 541-546 (1993).
- Oldani, G., et al. Efficient nonarterialized mouse liver transplantation using 3-dimensional-printed instruments. Liver Transplation. 22 (12), 1688-1696 (2016).
- Oldani, G., et al. Manufacturing devices and instruments for easier rat liver transplantation. Journal of Visualized Experiments. (75), e50380 (2013).
- Li, J., et al. Modified sleeve anastomosis for reconstruction of the hepatic artery in rat liver transplantation. Microsurgery. 22 (2), 62-68 (2002).
- Li, G. L., et al. High incidence of biliary complications in rat liver transplantation: can we avoid it? World Journal of Gastroenterology. 17 (26), 3140-3144 (2011).
- Zammert, M., Gelman, S. The pathophysiology of aortic cross-clamping. Best Practice and Research: Clinical Anaesthesiology. 30 (3), 257-269 (2016).
- Gao, W., Lemasters, J. J., Thurman, R. G. Development of a new method for hepatic rearterialization in rat orthotopic liver transplantation. Reduction of liver injury and improvement of surgical outcome by arterialization. Transplantation. 56 (1), 19-24 (1993).
- Ijtsma, A. J., et al. The clinical relevance of the anhepatic phase during liver transplantation. Liver Transplation. 15 (9), 1050-1055 (2009).
- Miyata, M., Fischer, J. H., Fuhs, M., Isselhard, W., Kasai, Y. A simple method for orthotopic liver transplantation in the rat. Cuff technique for three vascular anastomoses. Transplantation. 30 (5), 335-338 (1980).
- Marni, A., Ferrero, M. E. A four-technique comparative study of orthotopic liver transplantation in the rat. American Journal of Surgery. 156 (3 Pt 1), 209-213 (1988).