Summary
Målet med denne studien er å endre rotte ortotopisk levertransplantasjon modell for å bedre representere menneskelig levertransplantasjon og forbedre mottaker overlevelse. Den presenterte metoden gjenoppretter leverarterial tilstrømning ved å koble donorleverens vanlige leverarterie til mottakerleverens riktige leverarterie.
Abstract
Rat ortotopisk levertransplantasjon (OLT) modellen er et kraftig verktøy for å studere akutt og kronisk avvisning. Det er imidlertid ikke en fullstendig representasjon av menneskelig levertransplantasjon på grunn av fravær av arteriell tilkobling. Beskrevet her er en modifisert transplantasjon prosedyre som inkluderer inkorporering av leverarterie (HA) reconnection, fører til en markert forbedring i transplantasjon utfall. Med en gjennomsnittlig levertid på 12 min og 14 s, resulterer HA-tilkobling i forbedret perfusjon av den transplanterte leveren og en økning i langsiktig mottakeroverlevelse fra 37,5% til 88,2%. Denne protokollen inkluderer bruk av 3D-trykte mansjetter og holdere for å koble portalvenen og infrarød inferior vena cava. Det kan implementeres for å studere flere aspekter av levertransplantasjon, fra immunrespons og infeksjon til tekniske aspekter av prosedyren. Ved å innlemme en enkel og praktisk metode for arteriell tilkobling ved hjelp av en mikrovaskulær teknikk, etterligner denne modifiserte rotte OLT-protokollen nøye aspekter ved menneskelig levertransplantasjon og vil tjene som en verdifull og klinisk relevant forskningsmodell.
Introduction
Den globale byrden av leversykdom fortsetter å øke, med en 30% økning i leversykdomsrelaterte dødsfall fra 2005 til 20131,2. Levertransplantasjon er ofte den eneste regressen for pasienter med end-stage leversykdom. Leveren er det nest hyppigst transplanterte faste organet, og antall levertransplantasjoner utført globalt økte med 7,25% fra 2015 til 20161,2. Til tross for utbredelsen har overlevelsesraten etter transplantasjon blittstagnert 3,4,5. Den 15 år lange overlevelsesraten for pasienter rapporteres å være 53 %, og den 20-årige pasientoverlevelsesraten kan være så lav som 21 %3,5. Mens det er spennende nye immunbiologiske initiativer som kan føre til nye behandlinger og forbedrede kliniske resultater, er det ennå ikke en pålitelig liten dyremodell for å teste dem.
Rotte OLT modellen har vært mye brukt i undersøkelsen av levertransplantasjon, inkludert avvisning6,7,8,,9,10, immuntoleranse11, transplantasjon iskemi-reperfusjon skade12, immunosuppression13, og galletre skade14,15,16,17. En ulempe med modellen i sin nåværende form er imidlertid dens høye postoperative sykelighet ogdødelighet 18,19. Dette er en alvorlig ulempe som er på kant med den menneskelige operasjonen, og det kompromitterer evnen til å trekke klinisk relevante konklusjoner fra modellen20.
I tillegg kan en stor andel av denne sykelighet tilskrives en fraværende eller ufullkommen leverarterie (HA) reconnection18. Selv om et kritisk skritt i menneskelig levertransplantasjon, har tekniske vanskeligheter en tendens til å kompromittere HA-tilkobling i rotte-OLT-modellen. Som et resultat er gallekanal (BD) anastomose fast og resulterer i høye hastigheter på gallelekkasje og BD-nekrose21. Utover den høye forekomsten av gallekomplikasjoner22, endrer fravær av arteriell tilsig fysiologien til graftleveren ettertransplantasjon 23, med hypoksi i donorlevertransplantatet24 og leverskade observert i betente fliker19,25,26. Rotte OLT uten arteriell tilkobling har også en tendens til å fremme fibrose27. Rotte-OLT-protokollen beskrevet nedenfor løser disse problemene ved å innlemme et enkelt HA-rekonstruksjonstrinn med en tidligere publisert rotte-OLT-metode28, noe som resulterer i bevaring av leverparenchyma og forbedret overlevelse.
Levertransplantasjon har tre faser: (1) ekstraksjon av levertransplantaten fra donoren, (2) fremstilling av donorlevertransplantatet, og (3) utskifting av mottakerleveren med levertransplantatet. Prosedyren innebærer manipulering av fem anatomiske strukturer: suprahepatic inferior vena cava (SHVC), portal vene (PV), infrahepatisk dårligere vena cava (IHVC), leverarterie (HA) og gallegang (BD).
OLT i rotten ble først introdusert av Lee et al. ved hjelp av mikrosutur anastomose av SHVC, PV og IHVC, og en pull-through teknikk for BD29. Denne modellen ble senere forbedret gjennom bruk av to-cuff teknikken i 197930. Siden da har flere alternative teknikker blitt foreslått, med flertallet som fokuserer på venøs anastomose og bruker en to-mansjettteknikk med noen modifikasjoner31. Selv om HA anastomose har blitt beskrevet tidligere i rotte OLT-modellen ved hjelp av teknikker som mikrosutur, mansjett og intraluminale ermer26,,31,,32,,33,,34, krever disse teknikkene ofte høyt utdannede mikrokirurgiske ferdigheter, endrer rottefysiologi betydelig og hindrers av trombose og / eller gallekomplikasjoner27,35.
Videre kan valget av kirurgisk prosedyre også påvirke den anhepatiske tiden (tid fra PV-klemming til reperfusjon av graft gjennom rekonstituert PV), noe som er avgjørende for suksessen til rottelevertransplantasjon. Spesielt observeres høye overlevelsesrater med anhepatiske tider på 15-20 min36,og 30 min er den øvre grensen for suksess37,38. Derfor er målet med denne metoden å implementere en mindre invasiv og lettere adopterbar kirurgisk rotte OLT-modell som er i stand til å koble til leverarterien igjen, fremme effektiv perfusjon av den transplanterte leveren, opprettholde flyten til mottakeren gallegang, og bevare mottakerens fysiologiske tilstand.
Detaljert her er alle trinnene i denne reviderte protokollen, inkludert manipulering av cøliakistammen i donorleveren, samt bruk av 1) en 1,5 mm stent for å utføre en ekstraluminal ermet forbindelse med mottakeren riktig HA, 2) en løpende sutur for SHVC rekonstruksjon, 3) to 3D-trykte plast mansjetter for PV og IHVC rekonstruksjon39,,40, 4) en mikrovaskulær ermet reconnection for HA18,27,41 og 5) en tidligere beskrevet BD stenting teknikk28. To ekstra trinn er også inkludert: en kald spyling via PV, og et antibiotikaregime som er basert på tidligere funn17. Denne optimaliserte OLT-protokollen minimerer perioperative komplikasjoner og sykelighet og modellerer nærmere den kirurgiske driftsprosedyren som brukes i menneskelig levertransplantasjon.
Protocol
Studien ble utført i henhold til retningslinjene for gnagerhåndtering og kirurgi, og studieprotokollen ble godkjent av University Health Network Animal Care Committee (UHN AUP #: 5840.3) og følger retningslinjene til Canadian Council of Animal Care. Studien bruker hann Lewis rotter (belastning LEW/SsNHsd), 12-14 uker gammel, veier mellom 250-300 g.
1. Oppsett av utstyr
- Hold en 31 G skarp spiss med en nålholder og lag en stump L-formet injektor ved å bøye spissen gjentatte ganger frem og tilbake til spissen klikker av. Ved hjelp av en flat metallfil, sløv og glatt enden av injektoren.
- Klipp portalvenen (PV) og infrahepatiske dårligere vena cava (IHVC) mansjetter fra 3D-trykt base med en skalpell (Tilleggsmateriale 1, Tilleggsmateriale 2, Figur 1, Supplerende figur 1).
MERK: En 3D-designprogramvare brukes til å designe mansjetter og holdere, som er trykt på en 3D-skriver (Materialstabell ) ved hjelp av autoklaverbar harpiks39,40 (spesifikasjoner for alt 3D-trykt materiale som er inkludert i tilleggsmaterialet 1-10). - Bruk en ny skalpell til å kutte 22 G kateteret i et dobbeltsidig skrårør (3,5 mm i lengde). Bruk skalpellen til å forsiktig etse linjer på overflaten av gallekanalen (BD) stent (ikke skjær gjennom veggen av røret). Disse etsninger vil hindre bånd fra å skli under prosedyren.
- Bruk en ny skalpell til å kutte 24 G kateteret i et ensidig skråkantrør (2,0 mm lang), og lag flere riper på overflaten av den nye arterielle stenten.
MERK: Unngå innsnevring eller okklusjon av lumen i BD-stenten ved å unngå trykk på stenten. Hvis stenten er innsnevret eller okkludert, vil mottakerens overlevelse bli kompromittert av galleobstruksjon.
- Klipp portalvenen (PV) og infrahepatiske dårligere vena cava (IHVC) mansjetter fra 3D-trykt base med en skalpell (Tilleggsmateriale 1, Tilleggsmateriale 2, Figur 1, Supplerende figur 1).
2. Donordrift
- Sett en varmepute til 37 °C og plasser den under den kirurgiske plattformen. Slå på temperaturmonitoren slik at rottens kjernetemperatur kan overvåkes via rektal sonde. Sett opp isoflurananestesiapparatet.
MERK: Under operasjonen, overvåk dybden av anestesi ved å merke seg pustehastighet, hjertefrekvens, fargelegging av organene /slimhinnene og tilstedeværelsen av eventuelle pedaluttaksreflekser. - Ordne det kirurgisk draperte arbeidsområdet med alle nødvendige instrumenter og materialer (det vil vil at saks, tang, gasbind, heparin, retractors, midsection pad, bomullsspisser, 4-0 silke, 7-0 silke, 8-0 ikke-absorberbar steril sutur, og 10-0 ikke absorberbar monofilament sutur) plassert beleilig på sidene av den kirurgiske plattformen.
- Ordne arbeidsstasjonen med alle løsninger, inkludert Ringers laktatløsning og 300 IE natrium heparin (se Materialtabell).
- Vei dyret. Bedøve donorrotten ved å plassere den i bedøvelseskammeret med 5 % isofluran, 5 l/min luftstrøm og 70 % FiO2 for induksjon. Når rotten mister bevisstheten, redusere anestesi til 3% isofluran, 0,5 l / min luftstrøm, og 70% FiO2. Kontroller at du ikke har pedalrespons ved å klemme tåen.
- Forbered huden på magen. Bruk en elektrisk barbermaskin til å fjerne pelsen fra ventralsiden. Følg nøye med på donorens respirasjonsrate til den oppnår en stabil og dyp hastighet.
- Legg den kirurgisk draperte rotten slik at ventralsiden vender mot taket. Plasser nesen i en anestesi scavenger med 3% isofluran, 0,5 l / min luftstrøm, og 70% FiO2. Forbered bukveggen med povidon-jod, som arbeider fra midtlinjen utover, etterfulgt av 70% etanol.
- Gjør et snitt fra xiphoid prosessen til kjønnssympikk ved hjelp av en rund-tipped kirurgisk saks, deretter forbedre eksponeringen med en bilateral tverrgående snitt. Stopp blødning fra bukveggen ved hjelp av en bipolar elektrokirurgisk enhet for cautery. Etter snittet reduseres vedlikeholdsisofluranen til 2 %, 0,5 l/min luftstrøm og 70 % FiO2.
MERK: Juster isofluranfordamperen for å oppnå en respirasjonshastighet på omtrent ett åndedrag per sekund, og husk å regelmessig vurdere anestesidybden gjennom hele operasjonen. - Legg en 4-0 silkesøm i xiphoid prosessen og bruk suturen til å trekke tilbake brystveggen cephalad. Tape silketråden til toppen av strukturen som holder anestesi scavenger på plass. Hold donorrottens kroppshulrom åpen med 3D-trykte retractorer (se Tilleggsmateriale 3) plassert på hver side av magen (retractors holdes på plass med gummibånd festet til magneter på den kirurgiske plattformen).
MERK: Mygg tang kan også brukes til å gripe xiphoid prosessen og trekke tilbake cephalad. Fest myggtrene på plass ved hjelp av tape. - Bruk en ikke-vevd gasbindsvamp (4 cm x 4 cm) fuktet av Ringers laktatløsning for å omslutte små og tykktarmen. Bruk en liten, våt, ikkevevd gasbind svamp (2 cm x 4 cm) for å forsiktig dekke leveren.
- Plasser en liten rullet gasbind under midtseksjonen for å løfte magen og forbedre eksponeringen av suprahepatic inferior vena cava (SHVC).
- Kutt falciform ligament. Skill venstre diafragmatisk vene fra SHVC ved hjelp av mikro-tang. Ligate venstre diafragmatisk vene med 7-0 silke, holde seg nær SHVC.
MERK: Bruk den lille, våte, ikke-vevde gasbindsvampen, fuktet med Ringers laktat og plassert på leveren, for å forsiktig trekke leveren bort fra xiphoidprosessen og utsette venstre diafragmatisk vene. - Klipp venstre trekantet og gastro-leverleddbånd med rund-tipped saks.
- Utsett caudate-fliken ved å forsiktig trekke tilbake venstre og midtre fliker mot xiphoidprosessen ved hjelp av en liten, våt, ikke-vevd gasbindsvamp. Slipp ligamentet som skiller caudate-fliken fra resten av leveren med en rund-tippet saks.
- Del og skill hepato-esophageal ligament ved hjelp av en bipolar elektrokirurgisk enhet nær spiserøret.
MERK: Skift forsiktig tynn- og tykktarmen til venstre side av bukhulen og dekk dem med våt, ikke-vevd gasbind. - Disseker retroperitoneum og fett som dekker IHVC. Utsett og isoler IHVC ned til venstre nyrevene.
- Fortrenge IHVC litt med en bomullspinne for å eksponere og deretter cauterize noen små årer fusjonere inn i høyre side av IHVC, ved hjelp av bi-polar elektrokirurgisk enhet. Også cauterize noen lumbale årer fusjonere inn i IHVC.
- Del høyre suprarenal (binyre) vene mellom to 7-0 silke ligaturer, holde seg nær IHVC. Frigjør leveren fra sine bakre leddbånd ved å kutte disse under mild trekkraft.
- Isoler høyre nyrevene fra høyre nyrearterie og fra nabovevet ved hjelp av en fin-tip cautery. Forsegle høyre nyreåreåpning med en 8-0 ikke absorberbar steril ligatur.
- Løsne fettet som dekker PV for å finne den pyloriske venen (høyre magevene) og miltvenen på punktene der de fusjonerer PV. Ligate disse venene med 7-0 silke, forsterke siden nærmest PV med en 8-0 ikke absorberbar steril sutursøm. Del venene mellom båndene.
MERK: Utsett PV ved hjelp av små, våte gasbind for å trekke tilbake tolvfingertarmen. Innsetting av mansjetten er lettere hvis fett er løsrevet fra PV, som også forhindrer stenose av PV mansjetten. - Injiser 300 IE heparinnatrium i IHVC, fortynnet til 1 ml normal saltvann, med en 1 ml sprøyte (31 G kanyle).
- Lag et snitt 5 mm under BD bifurcation og sett BD-stenten inn i felles BD. Fest stenten med en 7-0 silke ligatur 1 mm over snittet. Et ekstra slips kan gjøres under snittet, som er 10 mm under bifurcation. Når stenten er sikret, kutt BD mellom disse to båndene.
- Klipp aldri BD-en eller riktig leverarterie (HA). Plasser en 10-0 ikke-absorberbar steril kirurgisk monofilament sutursting ved 3-posisjon i BD ved snittet som markør for å hindre vridning etter tilkobling.
- Utsett riktig HA og del gastroduodenal arterien (GDA) mellom to 7-0 silke ligaturer. Eksponer venstre magearterie, miltarterie og cøliakistamme. Bind de tre arteriene både distally og nær sine take-offs.
- Klipp venstre magearterie, miltarterie og cøliakistamme mellom arteriebåndene. Injiser sakte 20 ml kald (4 °C) Ringers laktatoppløsning i PV- Skjær vena cava under punktet der venstre nyrevene fusjonerer med IHVC for å tillate flush utstrømning.
MERK: Nålen skal holdes så langt som mulig fra hilum. Donorleveren kald perfusjon bør vare mellom 1-2 min. Mens spyling leveren, bruk den andre siden til å sprute kaldt Ringer laktat på leveroverflaten. - Klipp PV-stammen under miltvenen etter spylingen. Klipp IHVC like over venstre nyrevene. Klipp SHVC rett ved siden av membranen.
- Skjær leddbåndene og bindevevet mellom leveren og retroperitoneum.
MERK: Sørg for at det er tilstrekkelige lengder på de fremre og bakre SHVC-veggene for å lette den øvre kavalerianatomosen. Det er avgjørende å kutte umiddelbart ved siden av membranen for å beholde så mye lengde som mulig. - Etter at leveren er fjernet fra magen, legg den raskt i en tallerken fylt med 4 ° C Ringer laktatløsning. Plasser parabolen på toppen av en ispute for å opprettholde en kald temperatur.
- Kast donorrottens levninger, etter institusjonelle retningslinjer.
3. Donor rotte leverforberedelse ("bakbenk")
- Fyll den kalde petriskålen med et tilstrekkelig volum på 4 °C Ringers laktatløsning for å senke donorrotteleveren. Roter donorleveren forsiktig i fatet slik at den dårligere overflaten vender oppover. Sett mansjettene for PV og IHVC (Supplerende materiale 1 og supplerende materiale 2,henholdsvis) i fatet.
- Trekk PV gjennom PV-mansjetten og brett enden av venen over mansjetten. Bind PV sikkert rundt mansjetten med 7-0 silke. Skyll PV med 10 ml 4 °C Ringers laktatoppløsning.
- Gjenta trinn 3.2 med IHVC, uten spyling.
- Fjern fettvevet rundt cøliakistammen. Form en større arteriell ermet mansjett ved å kutte åpne bifurcation av cøliaki stammen, miltarterien, og venstre magearterie (Figur 2A).
MERK: Det er vanskelig å sette arteriell stent inn i felles HA. Strekk og rett ut arterien med tang flere ganger før du setter inn stenten. Pass på at stankens skråkant vender oppover og at arterien ikke er vridd (figur 2B). - Sett den 1,5 mm lange 24 G arterielle stenten i donoren vanlig HA via arteriell mansjett. Fest stenten med en 8-0 polypropylen ligatur (figur 2C) og skyll stenten med Ringers laktatoppløsning (figur 2D).
- Plasser en mikroklemme (4-6 mm lengde) på den proksimale IHVC, som er ment å forhindre blodtap etter portalreperfusjon og unngå luftemboli.
- Roter leveren og eksponer sin overlegne side. Sett inn to 8-0 polypropylen taper punkt suturer på laterale og mediale kanter av SHVC.
- Hold leveren ved 4 °C slik at den er klar for transplantasjon i donoren.
4. Mottakeroperasjon
- Se avsnittet om donordrift ovenfor, og gjenta trinn 2.1-2.4.
MERK: Hann Lewis rotter i alderen 12-14 uker brukes her, veier 5-20 g tyngre enn donorene. Under operasjonen, overvåke dybden av anestesi ved å legge til pustefrekvens, hjertefrekvens, fargestoffer av organer / slimhinner, og tilstedeværelse av noen pedal uttak reflekser. - Legg den kirurgisk draperte rotten med ventral side vendt oppover. Plasser nesen i anestesi scavenger for isofluran innånding. Fukt øynene med opthalamus smøremiddel. Forbered bukveggen med å gion-jod først, deretter med 70% etanol.
- Injiser 5 ml ringers laktatoppløsning subkutant på begge nedre sider av den ventrale bukveggen. Bruk en kirurgisk assistent assistent til å injisere 0,5 ml 200 mg / kg piperacillin natrium intramuskulært inn i venstre bukvegg før laparotomi. I tillegg administrere 0,5 ml 10 mg/ml bupivakain subkutant inn i høyre bukvegg.
MERK: Administrer samme dose piperacillinnatrium 1x/dag i 3 dager etter operativt. - Forbered bukveggen igjen med å gien-jod først og deretter med 70% etanol. Lag et midtlinjet snitt fra sternal xiphoid til 1 cm over kjønnssympikken. Reduser isofluran til 2%, 0,5 l / min luftstrøm, og FiO2 70% for vedlikehold av anestesi etter å ha gjort snittet.
MERK: Mygg tang kan brukes til å gripe xiphoid prosessen og trekke tilbake cephalad. Fest myggtrene på plass ved hjelp av tape. Kroppshulen holdes åpen av 3D-trykte retractors (se Tilleggsmateriale 3) på begge sider med gummibånd magnetisk holdt til den kirurgiske plattformen. - Pakk tynn- og tykktarmen med en våt, ikke-vevd gasbindsvamp (4 cm x 4 cm) fuktet med Ringers laktatløsning. Bruk en liten (2 cm x 4 cm), våt, ikke vevd gasbind svamp fuktet med Ringers laktatløsning for å forsiktig dekke leveren.
- Plasser en liten 3D-trykt støttepute (ryggholder, se Tilleggsmateriale 4) under rottemidseksjonen for å øke eksponeringen for SHVC ved å bøye spinnet. Dette kan trygt utføres hos rotter og utføres av en kirurgassistent.
- Klipp falciform ligament og bruk den lille, våte, ikke-vevde gasbindsvampen til å forsiktig trekke leveren bort xiphoidprosessen og eksponere venstre diafragmatisk vene. Skill venstre diafragmatisk vene fra SHVC ved hjelp av mikro-tang. Ligate venstre diafragmatisk vene med 7-0 silke nær membranen.
- Klipp venstre trekantet og gastro-leverleddbånd med rund-tipped saks.
- Trekk venstre og midt lobes delikat mot xiphoid prosessen med en liten, våt ikkevevd gasbind svamp for å avsløre caudate lobe. Sever ligamentet som skiller caudate lobe fra resten av leveren.
- Del hepato-esophageal ligament og koaguler eventuelle blødningspunkter med den bipolare elektrokirurgiske enheten, hold deg nær leveren. Skjær leddbåndene på det bakre aspektet av leveren.
- Trekk små og tykktarmene forsiktig tilbake til venstre side av bukhulen og dekk dem med våt, ikke-vevd gasbind.
- Disseker retroperitoneum og fett på IHVC for å eksponere og isolere IHVC ned til høyre nyrevene. Fortrenge IHVC litt med en bomullspinne og cauterize noen små årer fusjonere inn i høyre side av IHVC, ved hjelp av bi-polar elektrokirurgisk enhet. På samme måte, cauterize noen lumbale årer inn i IHVC.
- Del høyre suprarenal (binyre) vene mellom to 7-0 silke ligaturer. Frigjør leveren fra sine bakre leddbånd ved å kutte dem under mild trekkraft.
- Bruk små, våte gasbind fuktet med Ringers laktatløsning for å trekke tilbake tolvfingertarmen og eksponere PV. Løsne fett fra bifurcation av PV og pyloric vene.
- Del BD 0,5 cm under hilarbifurcation og sett inn en BD-stent i den distale felles BD. Fest stenten i posisjon med en 7-0 ligatur ca 0,2 mm under snittet. Et ekstra slips kan plasseres over snittet, nær bifurcation. Kutt BD nær leveren, men distal til slipset.
- Skill BD med tang og unngå å klippe BD eller riktig HA. Plasser en 10-0 ikke-absorberbar monofilament (f.eks. ethilon) søm ved 3-posisjon i BD som markør for å hindre vridning etter tilkobling.
- Utsett riktig HA og bifurcation av felles HA og GDA. Eksponer venstre HA, midtre HA og høyre HA. Bind de tre arteriene distale til CHA bifurcation og kutte arteriene nær leveren, over båndene.
- Legg et langt tynt stykke gasbind bak SHVC.
- Plasser en 3D-trykt IHVC-holder eller "håndtak" (Cava 150g 2.1; se Tilleggsmateriale 5) bak IHVC, og sy endene av det 3D-trykte "håndtaket" sammen ved hjelp av 10-0 ikke-absorberbar monofilamentsug (figur 3A).
- Plasser en 3D-trykt PV-holder eller "håndtak" (Porta 1.4.1-see Tilleggsmateriale 6) bak PV, direkte dårligere enn leveren, og sy endene av det 3D-trykte "håndtaket" sammen ved hjelp av 10-0 ikke-absorberbar monofilamentsug.
- Bind en 7-0 silkeligatur løst under begge 3D-trykte holdere (IHVC og PV) (figur 3A).
- Klem fast IHVC like over høyre nyreåre, som fortsatt skal være under den 3D-trykte kavaleriholderen.
- Klem PV like over pylorisk vene, som skal være under den 3D-trykte PV-holderen. Registrer den anhepatiske tiden, som begynner på dette punktet. Reduser til 0,5 % isofluran, 0,5 l/min luftstrøm og 70 % FiO2 for vedlikehold av anestesi.
- Skyll 2 ml 37 °C Ringers laktatoppløsning via bifurcation av PV med en 3 ml sprøyte med en 27 G kanyle festet.
- Klem SHVC over leveren med en Kitzmiller klemme. Skjær under samme klemme, bor så nær leveren som mulig.
- Klipp over 3D-trykte holdere for både PV og IHVC (figur 3A). Fjern mottakerens lever. Orienter donorleveren forsiktig og plasser den i mottakerens kroppshulrom på en slik måte at den øvre kavaleranatomosen kan opprettes.
- Bruk en 8-0 polypropylen kjører sutur for å bli med i donorens SHVC med mottakerens SHVC nær membranen. Først plasser opphold suturer på 8-0 polypropylen til venstre og høyre aspekter av donor og mottaker SHVC. Deretter knytter disse ned på utsiden av venveggen.
- Bruk venstre 8-0 polypropylen for å sy den bakre veggen av SHVC fra venstre til høyre og knytte til høyre 8-0 Polypropylen. Bruk venstre 8-0 polypropylen for å sy den fremre veggen av SHVC anastomose fra venstre til høyre, slik at de siste to tredjedelene av suturlinjen løsner. Skyll med 20 ml ringerlaktat mellom de løse maskene, samtidig som du må trekke ut eventuelle luftbobler.
- Stram de løse maskene og lag et slips på utsiden av SHVC. Kutt de resterende 8-0 polypropylen sutur.
MERK: Klippet holder mottakerens SHVC på plass, noe som gjør det enklere å sy donoren og mottakerens SHVC sammen. Registrer varigheten av SHVC anastomose. På dette punktet er porta håndtakene festet til holderarmapparatet (holderarm McGil + holder mini arm LAB + holder arm myk del 1.3; se Tilleggsmateriale 7, Tilleggsmateriale 8og tilleggsmateriale 9, henholdsvis), direkte dårligere enn leveren. Dette apparatet støttes av en 3D-trykt holderbase (holderbase 3.1; se Tilleggsmateriale 10). - Sett PV-mansjetten (tilleggsmateriale 1) fra donoren inn i mottakerens PV og stram 7-0 silkeslipset. Skyll donorens og mottakerens PV med Ringers laktatoppløsning varmet opp til 37 °C før tilkoblingen.
- Fjern den atraumatiske klemmen fra SHVC (først), deretter den mikrovaskulære klemmen for PV (andre). Re-perfuse leveren med varmt blod; på dette punktet er den anhepatiske fasetiden avsluttet. Ta opp denne gangen.
- Hell 10 ml varm Ringers laktatoppløsning på toppen av leveren for å varme. Fjern de 3D-trykte holderne med rundspisssaks (kutt sikringsmasken).
- Sett donoren IHVC cuff (Tilleggsmateriale 2) inn i mottakerenS IHVC og fest med et 7-0 silkeslips. Fjern donor-IHVC-klippet først, deretter mottakerens klipp (figur 3B). Cava er festet til holderapparatet og holderbasen som beskrevet ovenfor,
- Fjern 3D-skriverholderne (porta og cava) med rundspisssak (kutt sikringsmasken; Figur 3C), noe som resulterer i en tilkoblet IHVC (figur 3D).
- Nøye undersøke området rundt leveren for blødning. Instil 3 ml 37 °C Ringers laktatoppløsning inne i kroppshulen.
- Arteriell anastomose: klipp av den delen av cøliakistammen fra donoren som strekker seg utover stenten.
- Klem fast mottakerens riktige HA og klipp av slipset på slutten. Klipp av ekstra vev rundt fartøyet (figur 4A). Med Ringers laktatløsning, skyll lumen til både donor- og mottakerfartøyet.
- Trekk mottakeren riktig HA inn i ermet på donor HA stent for å oppnå HA anastomose. Plasser en 10-0 ethilon gjennom venstre aspekt av (donor) HA, 2,5 mm over den distale åpningen av stenten (fra utsiden til innsiden), deretter ut gjennom enden av stenten, med 10-0 ethilon (4 cm lengde) styrt av en buet nål (figur 4B).
- Transfix mottakeren riktig HA 0,5 mm under fartøyet åpningen, plassere masken først (fra innsiden til utsiden) til venstre side av fartøyet, deretter (fra utsiden til innsiden) til høyre side av arterien.
- Plasser suturen gjennom høyre vegg av (donor) HA fra innsiden til utsiden, i en avstand fra stentåpningen som er identisk med den opprinnelige masken. Trekk opp på de to endene av 10-0 ikke absorberbar monofilament, som vil sette mottakeren riktig HA opp og inn i HA stent (Figur 4C).
MERK: Vær oppmerksom på pumping av blod. Ett alternativ er å kutte donorEN GDA for å bekrefte at blodet pumper gjennom anastomosen. Pass på at du knytter arterien på nytt før du går videre til neste trinn i prosedyren hvis GDA er kuttet. - Bind 10-0 ikke absorberbar monofilament med seg selv, over donor HA (Figur 4D). Arteriell anastomose er nå fullført.
- Biliær anastomose: Plasser et slips løst rundt mottakeren BD og stent (figur 5A), og fjern deretter BD-stenten. Skyll BD-en til både mottaker og donor før biliærtilkoblingen er fullført.
- Sett donorens BD-stent inn i mottakerens gallekanal (figur 5B) og stram slipset som tidligere ble plassert rundt mottakeren BD (figur 5C).
- Returner tarmene til kroppshulen. Innpod 2 ml 37 °C Ringers laktatoppløsning inn i hulrommet for å skylle den. Bløtlegg noe av oppløsningen med gasbind.
- Sørg for at tarmene er tilbake i sin opprinnelige posisjon før du syr opp parietal bukhinnen og huden med 5-0 monokryl.
- Lukk snittet i to lag med 5-0 monokryl. Injiser 0,5 ml 0,5 % bupivakain rundt det sys parietalperitoneumet og gjenta dette når huden sys sammen.
- Svøtt forsiktig mottakerrotten i et papirhåndkle når du overfører til buret. La dyret fri tilgang til vann og mat fra oppvåkningstiden. Hold et varmt vann-sirkulerende teppe under halvparten av buret i 24-38 timer. En rotte er utpekt til ett bur i den umiddelbare postoperative perioden.
5. Postoperativ behandling
- Bløtlegg matpellets i vann og legg dem i en petriskål på burgulvet.
- Overvåk hjertefrekvensen, pustefrekvensen og fargen på rotten.
- Administrer piperacillin på postoperative dager 1, 2 og 3. Administrer buprenorfin subkutant og overvåk for tegn på smerte som eventuelle atferdsendringer, sløvhet, ungroomed pels, depresjon, lemlestelse eller tap av appetitt for de første 72 h.
MERK: Smerte vurderes minst 2x daglig i 3 dager etter transplantasjon, deretter minst 1x daglig og utover.
Representative Results
Mens vi etablerte en ikke-HA anastomose rotte OLT-modell ved hjelp av en tidligere beskrevetprotokoll 28,observerte teamet vårt henholdsvis 50% og 37,5% overlevelse ved henholdsvis 21 dager og 60 dager etter operasjonen. Selv om høye forekomster av langsiktig overlevelse uten HA-anastomose er rapportert av enkeltegrupper 28,fremhever disse tidlige resultatene ulempene ved ikke å ha arteriell tilsig. Til sammenligning økte den optimaliserte HA-tilkoblingsprosedyren betydelig langsiktig overlevelse fra 37,5 % til 88,2 % (p = 0,015) (figur 6).
Histologisk analyse av en representativ undergruppe av transplanterte dyr uten HA-tilkobling (på dag 6 og 13 etter operasjonen) viste tegn på hypoksisk leverskade med centrilobular nekrose (figur 7). Omfattende levernekrose var forbundet med enormt forhøyede nivåer av alaninaminotransferase (ALAT) og aspartataminotransferase (ASAT) hos disse dyrene (figur 7). I motsetning viste transplanterte rotter med HA-tilkobling ingen tegn på leverskade, og histologisk analyse viste en normal leverparenchymastruktur med organisert acini, lobules (f.eks. sentrale vene- og portaltriader med levervene), arterier og gallegang (figur 7).
Selv om gjennomsnittlig levertid i løpet av 23 separate operasjoner var akseptabelt (12 min og 14 s [± 78 s]), er det fortsatt mulig at overlevelse i ikke-HA-tilkoblingsmodellen til slutt kan forbedres med økt praksis. Det er imidlertid verdt å legge til grunn at tre av de fire dyrene som ble transplantert uten HA-tilkobling (som ble fulgt for langsiktig overlevelse) ble eutanisert på grunn av nød på dag 56, 96 og 111 etter operasjonen. I tillegg viste histologisk analyse av leverene reaktive endringer etter hypoksisk leverskade, inkludert markert gallegangsproliferasjon, periportal fibrose og betennelse, og forvrengt leverparenchyma (supplerende figur 2). Tilstedeværelsen av morfologiske trekk ved hypoksisk leverskade bekrefter funnene om at HA-tilkobling er viktig for effektiv leverperfusjon og normal funksjon.

Figur 1: Skjematisk representasjon av den 3D-trykte mansjettdesignen for portalvene og infrarød inferior vena cava. Det første slipset er strammet i sporet (ii) nærmest håndtaket (iii), og det andre slipset strammes i sporet (i) lengst bort fra håndtaket. De ytre diameterne er (iv) 2,38 mm for portalvenen (PV) og 2,15 mm for infrahepatisk dårligere vena cava (IHVC). Innvendig diameter er (v) 1,74 mm for PV og 1,38 mm for IHVC. Lengdene er (vi) 2,60 mm for PV og 2,15 mm for IHVC (eksakte spesifikasjoner for alle 3D-trykte materialer finnes i supplerende materialer). Vennligst klikk her for å se en større versjon av denne figuren.

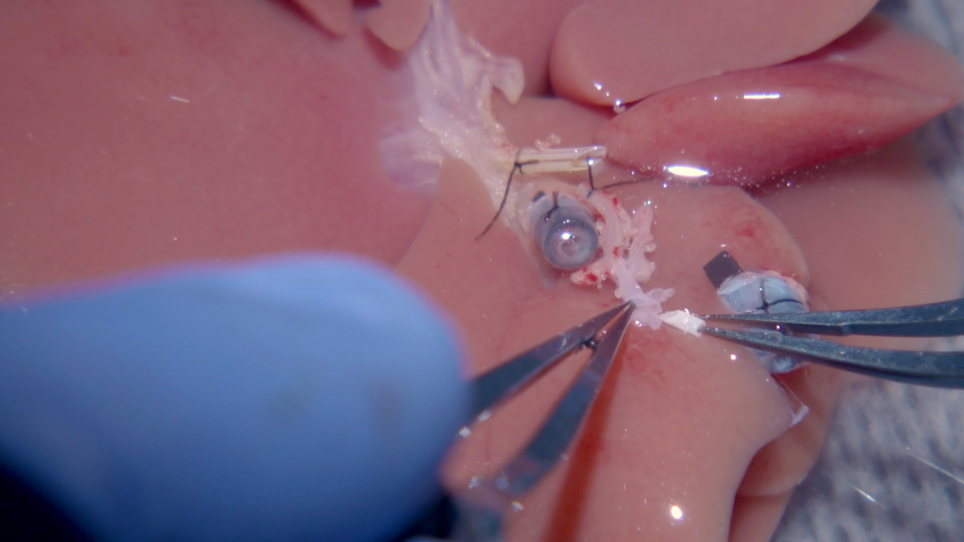
Figur 2: Hepatisk arterie stent innsetting i graft. (A)Åpningsenden av cøliakistammen (i) utvides ved å kutte miltarterien til venstre magearterie, som eksponerer bifurcation av den vanlige HA. (ii) BD-stenten er bundet før ekstraksjon av donorrotteleveren. (iii) PV-mansjetten og (iv) IHVC-mansjetten settes inn og knyttes ved å brette endene av karene over mansjetten. (B) (i) For å sette inn HA-stenten, strekkes den eksponerte felles HA flere ganger med tang. (C) (i) HA-stenten er plassert sikkert i felles HA og bundet med 8-0 prolene. (D) (i) HA-stenten skylles med (ii) Ringers laktatoppløsning (BD = gallegang, IHVC = infrahepatisk dårligere vena cava, HA = leverarterie). Vennligst klikk her for å se en større versjon av denne figuren.

Figur 3: Infrahepatic inferior vena cava-tilkobling ved hjelp av 3D-trykt holder. (A) (i) PV er koblet til med samme teknikk som IHVC-tilkoblingen. Transplantatet er (ii) klemt over (iii) IHVC-mansjetten. Mottakerens IHVC-åpning er (iv) suturert på sidene av åpningen til en 3D-trykt holder for å holde den strukket åpen. En løs (v) 7-0 silke er bundet rundt mottakeren IHVC. (B) Mansjetten på transplantatet IHVC er (i) satt inn i mottakerenS IHVC. Det løse slipset er nå strammet. Klemmenfjernes, og (i) 3D-skriverholderen er løsrevet med saks. (D) En ekstra (i) 7-0 silke er bundet rundt tilkoblingen hvis den ikke er sikker, men vanligvis er ett slips tilstrekkelig (PV = portalvene, IHVC = infrahepatisk dårligere vena cava). Vennligst klikk her for å se en større versjon av denne figuren.

Figur 4: Mikrovaskulær ermet tilkobling av leverarterien. (A) (i) BD-stenten er ikke koblet til mottakeren. (ii) HA-stenten er plassert i pode, som er knyttet til (iv) mottakerens riktige HA. (iii) PV er koblet til. (B) 10-0 ethilon med en (i) buet nål trekkes gjennom HA-stenten til sidene av mottakeren HA åpningsende. (C) 10-0 ethilon trekkes tilbake gjennom HA-stenten; Derfor trekkes mottakerens riktige HA gjennom stenten som en hylse. (D) (i) Et slips med 10-0 ethilon er laget når mottakerens riktige HA trekkes inn i stenten til den delen som først går gjennom HA-stenten. (E) Vist her er en skjematisk av HA anastomosis beskrevet i (B), (C) og (D) (BD = gallegang, HA = leverarterie, PV = portal vene). *Åpningsenden av cøliakistammen utvides ved å kutte miltarterien til venstre magearterie. Vennligst klikk her for å se en større versjon av denne figuren.

Figur 5: Gallekanaltilkobling ved hjelp av to stenter. (A) (i) Graft BD-stent settes inn i mottaker-BD ved hjelp av (ii) stenten løst bundet ved åpningen av mottakerens BD. (iii) PV er koblet før BD-tilkoblingen, som ligger bak BD. (B) Stenten på slutten av mottakerens BD fjernes og brukes som en utvidet åpning til (i) sett inn BD-stenten som er bundet til graftet. (C) Slipset som er løst sikring av mottakerstenten brukes nå til å knytte forbindelsen, og (i) ytterligere 7-0 silke brukes til å holde stenten på plass for å unngå å skli eller vristen. Vennligst klikk her for å se en større versjon av denne figuren.

Figur 6: Transplantasjon prosent overlevelse. Ortotopisk levertransplantasjon av rotte uten HA-tilkobling (n = 8) og med HA-tilkobling (n = 17). Dyr følges nøye etter transplantasjon for tegn på leversvikt og/eller infeksjon i minst 60 dager. Rotter som ikke viste komplikasjoner etter operasjonen ble ansett som overlevende (*p = 0,015, som beregnet av Kaplan-Meier estimering [lang rang test]). Vennligst klikk her for å se en større versjon av denne figuren.

Figur 7: Lever histopatologisk vurdering. Representative hematoksylin- og eosinfargede seksjoner hos dyr (A) uten og (B) med leverarterie (HA) tilkobling på dag 6 og 13 etter levertransplantasjon (LTx). (C) Normal leverparenchyma viser portal triade (portal vene, arterie, og gallegang), lobules inkludert sentral vene, og acini. Hepatocytes ved siden av portaltriaden er sone 1 hepatocytter; hepatocytter ved siden av den sentrale venen i lobules er sone 3 hepatocytter; og hepatocytter mellom soner 1 og 3 er sone 2 hepatocytter (ALAT = alanin aminotransferase, ASAT = aspartata aminotransferase, CV = sentral vene). Vennligst klikk her for å se en større versjon av denne figuren.

Tilleggsfigur 1: Stent- og mansjettdimensjoner. Vennligst klikk her for å se en større versjon av denne figuren.

Supplerende figur 2: Lever histopatologisk vurdering som viser forstyrrelse av leverparenchyma. Representative hematoksylin og eosin-farget seksjoner i dyr uten HA-tilkobling på dag 54, 96 og 111 etter LTx. Vennligst klikk her for å se en større versjon av denne figuren.
Tilleggsmateriale 1: Porta mansjett 200g - støtte 2.0. Vennligst klikk her for å se denne filen (Høyreklikk for å laste ned).
Tilleggsmateriale 2: Cava mansjett 200g - støtte 2.0. Vennligst klikk her for å se denne filen (Høyreklikk for å laste ned).
Tilleggsmateriale 3: Levertraktor 200g. Vennligst klikk her for å se denne filen (Høyreklikk for å laste ned).
Tilleggsmateriale 4: Bakholder - 1.2. Vennligst klikk her for å se denne filen (Høyreklikk for å laste ned).
Tilleggsmateriale 5: Cava 150g - 2.1. Vennligst klikk her for å se denne filen (Høyreklikk for å laste ned).
Tilleggsmateriale 6: Porta 1.4.1. Vennligst klikk her for å se denne filen (Høyreklikk for å laste ned).
Tilleggsmateriale 7: Holder arm McGil. Vennligst klikk her for å se denne filen (Høyreklikk for å laste ned).
Tilleggsmateriale 8: Holder mini arm LAB. Vennligst klikk her for å se denne filen (Høyreklikk for å laste ned).
Tilleggsmateriale 9: Holder og arm myk del 1.3. Vennligst klikk her for å se denne filen (Høyreklikk for å laste ned).
Tilleggsmateriale 10: Holder base - 3.1. Vennligst klikk her for å se denne filen (Høyreklikk for å laste ned).
Discussion
Små levertransplantasjonsmodeller for dyr er viktige for å forstå transplantasjonsimmunitet og identifisere nye terapeutiske strategier32. Den ideelle lille levertransplantasjonsmodellen for dyr replikerer alle trinnene i den menneskelige prosedyren, inkludert arteriell anastomose. Det kan være utfordrende å tolke resultater fra rotte OLT-modellen, da de fleste versjoner ikke inneholder et HA-anastomosetrinn, noe som fører til høyere forekomst av komplikasjoner og sykelighet42. Noen rekonstruksjonsprosedyrer har brukt nyrearterien, som krever fjerning avnyrene 27. Denne protokollen unngår organfjerning, da det er utover det som skjer i den menneskelige prosedyren.
Arterielle rekonstruksjoner kan også utføres ved å manipulere rotte aorta31. Imidlertid krever disse metodene omfattende disseksjon og klemming av aorta. Hvis klemmetiden forlenges, vil mottakerrotten ha dårlige resultater knyttet til distal iskemi43. Hos mennesker innebærer en LT kirurgisk teknikk ligation og delingen av mottakeren gastroduodenal arterie (GDA). Imidlertid gjør de fysiologiske og anatomiske egenskapene til gnagere transplantasjon ved hjelp av denne teknikken mer fysiologisk utfordrende og kan føre til komplikasjoner (det vil si nekrose i bukspyttkjertelen oggallegangen 35 og gallelekkasje44). Den arterielle tilkoblingen i denne protokollen er ment å omgå denne utfordringen, opprettholde kanalblodstrømmen og forbedre mottakerutfallet.
Bruk av ermet og stenting teknikk for rekonstruksjon av rotte HA har blitt beskrevet tidligere27. I denne teknikken brukes en stent som guide, og arterien rekonstrueres fra donorcøliakistammen til mottakeren vanlig HA. Mottakeren felles HA blir deretter dissekert ut, og mottakeren GDA er bundet av27. Som et resultat kan blodtilførselen til den nedre delen av mottakeren BD og hodet av bukspyttkjertelen bli kompromittert. Det antas at sikkerhetssirkulasjonen til dette området ofte gir utilstrekkelig blodstrøm til gallekanalen. Denne protokollen tester for eksempel mottakeren GDA først med et mikrovaskulært klips, og deler deretter mottakerenS BD. Med GDA fastklemt blør ikke den delte BD-en. Etter fjerning av GDA-klemmen observeres rask blødning fra BD. Denne protokollen, som opprettholder god flyt til delt mottaker galle kanal, beskytter fysiologien til mottakeren levervev ved å gi tilstrekkelig leverblod perfusjon og hindre post-OLT hypoksisk leverskade.
På donorsiden settes HA-stenten inn i cøliakistammen under podepreparatet med letthet ved å lage en fra cøliakistammen, venstre magearterie og miltarterie. Stenten kan settes inn gjennom den brede åpningen, noe som er mindre vanskelig enn å prøve å sette stenten inn i cøliakistammen alene. Det har blitt funnet at 24 G er en ideell størrelse å bruke for HA-stenten. Lengden på stenten skal være 1,0-1,5 mm lang, fordi den fungerer som en åpen port for å la mottakerens riktige HA lett trekkes inn i giverens felles HA. Med nøye oppmerksomhet til hvor 10-0 ethilon suturen er plassert, vil blod som strømmer gjennom denne forbindelsen aldri berøre stenten direkte, og mottakerens riktige HA vil skjerme den fra innsiden, noe som reduserer risikoen for komplikasjoner. Viktigere, donorens HA er aldri klemt for å unngå vasospasme. Suksessen med arteriell rekonstruksjon evalueres ved å la donoren GDA være åpen. Vellykket anastomose resulterer i god blodstrøm fra donor GDA når rekonstruksjonen er fullført.
I denne protokollen, lik andre, shvc reconnection er det tregeste trinnet og til slutt dikterer varigheten av anhepatisk fase. Etter hvert som varigheten av anhepatisk tid øker, øker risikoen iskemisk skade og leverdysfunksjon45. En annen kritisk komponent i OLT rottemodeller er størrelsen på transplantatet, stentene og mansjetter. Hvis transplantatet er for lite, kan transplantatet vri eller vende, noe som hindrer de vaskulære forbindelsene. Størrelsen på stenter og mansjetter kan kreve justeringer i henhold til alder, kjønn, vekt og belastning av rotten. Størrelsen på mansjettene som brukes her ble valgt som tidligere beskrevet28, og en mansjettstørrelse som kontrolleres for rottestørrelse ble brukt. Det var ingen tegn på nød eller komplikasjoner (det vil si leveroverbelastning, ødem, ascites eller splenomegali) i oppfølgingsperioden (til dags dato: median = 133 dager etter operasjonen, minimum = 115 dager etter operasjonen, maksimum = 161 dager etter operasjonen). Videre studier for å bestemme passende størrelse på PV og IHVC for ulike rottestammer som står for både alder og kjønn er berettiget.
Denne modifiserte ROTTE-OLT-protokollen bruker 3D-trykte mansjetter for PV og IHVC, som beskrevettidligere 39,40. Eksisterende metoder for tilkobling av PV og IHVC inkluderer en mikrosutur teknikk32,mansjettteknikk 46,og mikrosutur-midlertidig skinne teknikk47. Den 3D-trykte mansjettteknikken ble valgt, siden den gjør at størrelsen på mansjetten kan standardiseres i henhold til rottestamme og er enkel å forberede og bruke. Store mengder mansjetter med samme dimensjoner kan skrives ut samtidig. Den ytre overflaten av mansjetten har to spor for å hjelpe med å feste bånd og hindre glidning. En hale er også innlemmet i mansjetten design for å tillate enklere manipulering av mansjetten. Samlet sett antas det at å innlemme 3D-trykte mansjetter fører til høye suksessrater og reproduserbarhet av OLT-prosedyren ved å forkorte anhepatisk tid. Det er fastslått at denne teknikken også forkorter den kirurgiske læringskurven.
Til slutt etablerte den beskrevne protokollen en modell som ligner mer på menneskelig levertransplantasjon ved å innlemme et arteriell tilkoblingstrinn. Denne protokollen kan tilpasses for å studere mange immunologiske og kirurgiske aspekter ved levertransplantasjon og kan tjene som en modell for å teste nye terapeutiske inngrep som er relevante for transplantasjon.
Disclosures
Forfatterne har ingenting å avsløre.
Acknowledgments
Denne forskningen ble finansiert gjennom midler fra Multi-Organ transplantasjon programmet ved UHN og støtte fra Toronto General og Toronto Western Foundation.
Materials
| Name | Company | Catalog Number | Comments |
| 10-0 Ethilon | Ethicon | 2830G | 10-0 Ethilon Black 1X5" BV100-4 Taper |
| 10mL Syringe | BD | B302995 | Luer-Lok Tip, Sterile, Disposable |
| 1mL Syringe | BD | B309628 | Luer-Lok Tip, Sterile, Disposable |
| 20mL Syringe | BD | B301031 | Luer-Lok Tip, Sterile, Disposable |
| 3D Printed Cuff for IHVC | Custom | ||
| 3D Printed Cuff for PV | Custom | ||
| 3D Printed Holder for IHVC | Custom | ||
| 3D Printed Holder for PV | Custom | ||
| 3mL Syringe | BD | B309657 | Luer-Lok Tip, Sterile, Disposable |
| 4-0 Sofsilk | Coviden | GS-835 | Wx coded braided silk, 30", Suture 1-Needle 26 mm Length 1/2 Circle Taper Point Needle |
| 5-0 Monocryl | Ethicon | Y433H | Undyed Monofilament 1X27" TF |
| 5mL Syringe | BD | B309646 | Luer-Lok Tip, Sterile, Disposable |
| 7-0 Silk | Teleflex Medical | 103-S | Black |
| 8-0 Prolene | Ethicon | 2775G | 8-0 Prolene Blue 1X24" BV130-5 EVP Double Armed |
| Barraquer Micro Needle Holder Without Catch | Aesculap Surgical Instruments | FD231R | Curved 120 mm, 4 3/4″ |
| Barraquer Needle Holder, Extra Fine Jaws 8.0mm, Curved With Out Lock | Rumex International Co. | 8-025T | Small Size, Titanium |
| Barraquer Needle Holder, Fine Jaws 12.0mm, Curved With Out Lock | Rumex International Co. | 8-021T | Small Size, Titanium |
| BD Insyte Autoguard BC 22 GA x 1.00 IN | BD Angiocath / Autoguard | 382523 | 22 G x 1.00" (0.9 mm x 25 mm) Wingless catheter, 37 mL/min |
| BDPrecisionGlide Single-use Needles: Regular Bevel - Regular Wall. | BD | B305106 | PrecisionGlide stainless-steel needles with translucent, color-coded, polypropylene hubs. 22 G |
| BD Precisionglide Syringe Needle 21G | BD | 305167 | Gauge 21, length 1.5 inch, hypodermic needle |
| BD Precisionglide Syringe Needle 30G | BD | 305128 | Gauge 30, length 1 inch, hypodermic needle |
| Betadine Solution by Purdue Products LP | Purdue Products Lp | 67618-150-17 | 10% povidone–iodine topical solution USP |
| Bupivacaine Injection BP 0.5% | SteriMax Inc. | DIN:02443694 | 0.5% (100mg/20mL) |
| Curved Tying Forceps | Duckworth & Kent | 2-501E | 6mm tying platforms, straight shafts, flat handle, length 88mm |
| DC Temperature Controller | FHC Inc. | 40-90-8D | |
| DK Iris Scissors (Curved) | Duckworth & Kent | 1-211B | Blunt tips, cut length 4mm, tip to pivot length 11mm, round handle, length 107mm |
| Ethanol, 200 proof (100%), USP, Decon Labs | Decon Labs, Inc. | 2716 | Dilute to 70% with d2H2O |
| Fine Adjustable Wire Retractor | Fine Science Tools | 17004-05 | Maximum spread: 3.5cm, Depth 5cm |
| Harvard Apparatus Isoflurane Funnel-Fill Vaporizer | Harvard Appartus Limited | 34-1040SV | |
| Heparin LEO(heparin sodium) | LEO Pharma Inc. | DIN:00453811 | 10,000 i.u./10 mL |
| Ice-Pak | Cryopak | FIP88016 | 4.00 in. x 7.00 in., thickness 1.50 inch |
| Isoflurane United States Pharmacopeia (USP) 99.9% | Piramal Healthcare Limited | DIN: 02231929 | 250 mL, Inhalation Anesthetic, NDC 66794-017-25 |
| Khaw Transconjunctival Adjustable Suture Control Forceps | Duckworth & Kent | 2-502N | 5mm highly polished tying platforms, straight shafts, flat handle, length 84mm |
| Lactate Ringer's Injected USP, 1000mL | Baxter Co. | DIN: 00061085 | JB2324 |
| McPherson Tying Forceps | Duckworth & Kent | 2-500E | 6mm tying platforms, straight shafts, flat handle, length 90mm |
| Metzenbaum Scissors - 14.5 cm | Fine Science Tools | 14024-14 | Straight Sharp/Blunt |
| Micro Kitzmiller Clamp | Scanlan | 3003-630 | Jaw length 23mm, Length 11cm |
| Microscope-Leica M525 F20 | Leica Microsystems | No catalog number | |
| Non-woven Gauze Sponges | Fisherbrand | 22-028-556 | |
| Olsen-Hegar with Suture Cutter | Fine Science Tools | 12002-14 | 15 mm cutting edge, 2mm jaw surface - 14cm |
| OptixCare Eye Lube, 25gm | OptixCare | ES-KE8O-69U1 | Formerly Optixcare Surgical Eye Lubricant |
| Piperacillin sodium salt | Sigma-Aldrich | P8396 | Penicillin analog |
| Puritan 3" Standard Cotton Swab w/Wooden Handle | Puritan Medical Products Company LLC | 803-WC | Regular Cotton Tipped Applicator with Wooden Handle |
| Round Handled Needle Holder Straight w/ Lock | Fine Science Tools | 12075-12 | Round handles allow easy fingertip adjustments - 12.5cm |
| Shea Scissors Curved Blunt | Fine Science Tools | 14105-12 | Transplant scissors with light and delicate pattern - 12cm |
| Stainless Steel Micro Serrefines Curved - 4mm | Fine Science Tools | 18055-06 | Jaw length 4mm, Jaw width 0.75mm, Total length 16mm, Jaw pressure 125g |
| Stainless Steel Micro Serrefines Curved - 6mm | Fine Science Tools | 18055-05 | Jaw length 6mm, Jaw width 1mm, Total length 17mm, Jaw pressure 100g |
| Stainless Steel Micro Serrefines Straight - 6mm | Fine Science Tools | 18055-03 | Jaw length 6mm, Jaw width 1mm, Total length 15mm, Jaw pressure 100g |
| Surgical Platform | Custom, magnetic | ||
| SurgiVet Vaporstick Anesthesia Machine | General Anesthetic Services, Inc | V7015 | |
| T/Pump Localized Therapy | Stryker | TP700 Series | |
| Vacuum-Pressure Pump | Barnant Co. | 400-1901 | |
| Vannas Scissors with Microserrations Straight | Fine Science Tools | 15070-08 | Cutting edge: 5mm, Tip diameter: 0.1mm - 8.5cm |
| Vetergesic Buprenorphine | Ceva Animal Health Ltd | NAC No.:12380352 | 0.324 mg/ml buprenorphine hydochloride Solution for Injection for Dogs and Cats |
| Vetroson V-10 Bipolar Electrosurgical Unit | Summit Hill Laboratories | No catalog number | |
| Surgical Drape | PDC Healthcare | DRP1824 | Multi-purpose sterile clear plastic, 18" x 24", 40/case |
References
- Global Observatory on Donation and Transplantation. Organ Donation and Transplantation Activities. , http://www.transplant-observatory.org/download/2016-activity-data-report (2016).
- Asrani, S. K., Devarbhavi, H., Eaton, J., Kamath, P. S. Burden of liver diseases in the world. Journal of Hepatology. 70 (1), 151-171 (2019).
- Dopazo, C., et al. Analysis of adult 20-year survivors after liver transplantation. Hepatology International. 9 (3), 461-470 (2015).
- Schoening, W. N., et al. Twenty-year longitudinal follow-up after orthotopic liver transplantation: a single-center experience of 313 consecutive cases. American Journal of Transplantation. 13 (9), 2384-2394 (2013).
- Pischke, S., et al. Factors associated with long-term survival after liver transplantation: A retrospective cohort study. World Journal of Hepatology. 9 (8), 427-435 (2017).
- Hamdani, S., et al. Delayed and short course of rapamycin prevents organ rejection after allogeneic liver transplantation in rats. World Journal of Gastroenterology. 23 (38), 6962-6972 (2017).
- Endo, K., et al. Pretransplant replacement of donor liver grafts with recipient Kupffer cells attenuates liver graft rejection in rats. Journal of Gastroenterology and Hepatology. 30 (5), 944-951 (2015).
- Zhao, Z., et al. IL-34 Inhibits Acute Rejection of Rat Liver Transplantation by Inducing Kupffer Cell M2 Polarization. Transplantation. 102 (6), e265-e274 (2018).
- Nagakawa, Y., et al. Over-expression of AIF-1 in liver allografts and peripheral blood correlates with acute rejection after transplantation in rats. American Journal of Transplantation. 4 (12), 1949-1957 (2004).
- Gao, L. H., Zeng, L. X., Chen, H. M., Wan, R. H. Cytomegalovirus infection accelerates the process of chronic rejection in rat liver transplantation. Transplantation Proceedings. 45 (6), 2536-2538 (2013).
- Wu, Y., et al. Effects of combined genes of CTLA4Ig and IDO in post-liver transplantation immune tolerance of rats. Annals of Hepatology. 15 (5), 729-737 (2016).
- He, X. S., et al. Influence of warm ischemia injury on hepatic functional status and survival of liver graft in rats. Hepatobiliary and Pancreatic Diseases International. 2 (4), 504-508 (2003).
- Tamura, A., et al. Combination effect of tacrolimus and FTY720 in liver transplantation in rats. Transplantation Proceedings. 31 (7), 2785-2786 (1999).
- Wang, Z., et al. RhGH attenuates ischemia injury of intrahepatic bile ducts relating to liver transplantation. Journal of Surgical Research. 171 (1), 300-310 (2011).
- Jiang, J. W., et al. Chronic bile duct hyperplasia is a chronic graft dysfunction following liver transplantation. World Journal of Gastroenterology. 18 (10), 1038-1047 (2012).
- Tang, Y., et al. S-Adenosylmethionine attenuates bile duct early warm ischemia reperfusion injury after rat liver transplantation. Molecular Immunology. 95, 83-90 (2018).
- Nosaka, T., Bowers, J. L., Cay, O., Clouse, M. E. Biliary complications after orthotopic liver transplantation in rats. Surgery Today. 29 (9), 963-965 (1999).
- Howden, B., Jablonski, P., Grossman, H., Marshall, V. C. The importance of the hepatic artery in rat liver transplantation. Transplantation. 47 (3), 428-431 (1989).
- Post, S., et al. The impact of arterialization on hepatic microcirculation and leukocyte accumulation after liver transplantation in the rat. Transplantation. 54 (5), 789-794 (1992).
- Hori, T., et al. Impact of hepatic arterial reconstruction on orthotopic liver transplantation in the rat. Journal of Investigative Surgery. 25 (4), 242-252 (2012).
- Zhou, S., et al. New method of stent-facilitated arterial reconstruction for orthotopic mouse liver transplantation. Journal of Surgical Research. 187 (1), 297-301 (2014).
- Noack, K., Bronk, S. F., Kato, A., Gores, G. J. The greater vulnerability of bile duct cells to reoxygenation injury than to anoxia. Implications for the pathogenesis of biliary strictures after liver transplantation. Transplantation. 56 (3), 495-500 (1993).
- Imamura, H., Rocheleau, B., Cote, J., Huet, P. M. Long-term consequence of rat orthotopic liver transplantation with and without hepatic arterial reconstruction: a clinical, pathological, and hemodynamic study. Hepatology. 26 (1), 198-205 (1997).
- Reck, T., et al. Impact of arterialization on hepatic oxygen supply, tissue energy phosphates, and outcome after liver transplantation in the rat. Transplantation. 62 (5), 582-587 (1996).
- Zhao, D., Wheatley, A. M. Orthotopic liver transplantation in the rat: comparison of models with and without rearterialization of the graft. European Surgical Research. 25 (5), 294-302 (1993).
- Chaland, P., et al. Orthotopic liver transplantation with hepatic artery anastomoses. Hemodynamics and response to hemorrhage in conscious rats. Transplantation. 49 (4), 675-678 (1990).
- Liu, X., He, C., Huang, T., Gu, J. Development of a New Technique for Reconstruction of Hepatic Artery during Liver Transplantation in Sprague-Dawley Rat. PLoS One. 10 (12), e0145662 (2015).
- Oldani, G., Lacotte, S., Morel, P., Mentha, G., Toso, C. Orthotopic liver transplantation in rats. Journal of Visualized Experiments. (65), (2012).
- Lee, S., Charters, A. C., Chandler, J. G., Orloff, M. J. A technique for orthotopic liver transplantation in the rat. Transplantation. 16 (6), 664-669 (1973).
- Kamada, N., Calne, R. Y. Orthotopic liver transplantation in the rat. Technique using cuff for portal vein anastomosis and biliary drainage. Transplantation. 28 (1), 47-50 (1979).
- Kashfi, A., et al. A review of various techniques of orthotopic liver transplantation in the rat. Transplantation Proceedings. 37 (1), 185-188 (2005).
- Chong, A. S., Alegre, M. L., Miller, M. L., Fairchild, R. L. Lessons and limits of mouse models. Cold Spring Harbor Perspectives in Medicine. 3 (12), a015495 (2013).
- Hasuike, Y., et al. A simple method for orthotopic liver transplantation with arterial reconstruction in rats. Transplantation. 45 (4), 830-832 (1988).
- Hickman, R., Engelbrecht, G. H., Duminy, F. J. A technique for liver transplantation in the rat. Transplantation. 48 (6), 1080 (1989).
- Steffen, R., Ferguson, D. M., Krom, R. A. A new method for orthotopic rat liver transplantation with arterial cuff anastomosis to the recipient common hepatic artery. Transplantation. 48 (1), 166-168 (1989).
- Shi, Y., et al. Magnetic ring anastomosis of suprahepatic vena cava: novel technique for liver transplantation in rat. Transplant International. 28 (1), 89-94 (2015).
- Dippe, B. E., et al. An improved model for rat liver transplantation including arterial reconstruction and simplified microvascular suture techniques. Journal of Investigative Surgery. 5 (4), 361-373 (1992).
- Kobayashi, E., Kamada, N., Goto, S., Miyata, M. Protocol for the technique of orthotopic liver transplantation in the rat. Microsurgery. 14 (8), 541-546 (1993).
- Oldani, G., et al. Efficient nonarterialized mouse liver transplantation using 3-dimensional-printed instruments. Liver Transplation. 22 (12), 1688-1696 (2016).
- Oldani, G., et al. Manufacturing devices and instruments for easier rat liver transplantation. Journal of Visualized Experiments. (75), e50380 (2013).
- Li, J., et al. Modified sleeve anastomosis for reconstruction of the hepatic artery in rat liver transplantation. Microsurgery. 22 (2), 62-68 (2002).
- Li, G. L., et al. High incidence of biliary complications in rat liver transplantation: can we avoid it? World Journal of Gastroenterology. 17 (26), 3140-3144 (2011).
- Zammert, M., Gelman, S. The pathophysiology of aortic cross-clamping. Best Practice and Research: Clinical Anaesthesiology. 30 (3), 257-269 (2016).
- Gao, W., Lemasters, J. J., Thurman, R. G. Development of a new method for hepatic rearterialization in rat orthotopic liver transplantation. Reduction of liver injury and improvement of surgical outcome by arterialization. Transplantation. 56 (1), 19-24 (1993).
- Ijtsma, A. J., et al. The clinical relevance of the anhepatic phase during liver transplantation. Liver Transplation. 15 (9), 1050-1055 (2009).
- Miyata, M., Fischer, J. H., Fuhs, M., Isselhard, W., Kasai, Y. A simple method for orthotopic liver transplantation in the rat. Cuff technique for three vascular anastomoses. Transplantation. 30 (5), 335-338 (1980).
- Marni, A., Ferrero, M. E. A four-technique comparative study of orthotopic liver transplantation in the rat. American Journal of Surgery. 156 (3 Pt 1), 209-213 (1988).