Summary
С учетом того, что GPCRs являются привлекательными целевыми показателями, пригодными для наркотиков, скрининг лиганда GPCR, таким образом, необходим для идентификации свинцовых соединений и для проведения исследований по дефанфанизации. К этим усилиям мы описываем PRESTO-Tango, ресурсную платформу с открытым исходным кодом, используемую для одновременного профилирования переходного набора на работу в формате приблизительно 300 GPCRs с использованием речевого агентства TEV.
Abstract
Как крупнейшая и наиболее универсальная генная суперсемейство и посредники гаммы клеточных сигнальных путей, G-белковые рецепторы (GPCRs) представляют собой одну из наиболее перспективных целей для фармацевтической промышленности. Ergo, дизайн, реализация и оптимизация GPCR лиганд скрининга анализы имеет решающее значение, так как они представляют собой дистанционного управления инструментами для обнаружения наркотиков и для манипулирования GPCR фармакологии и результатов. В прошлом, G-белковых ипотеческих анализов типифицировали эту область исследований, обнаружения лиганд-индуцированных событий и количественного поколения вторичных посланников. Однако, с появлением функциональной избирательности, а также повышение осведомленности о нескольких других G белка независимых путей и ограничения, связанные с G-белок зависимых анализов, есть больший толчок к созданию альтернативных GpCR лиганд скрининга анализы. Для этого мы описываем применение одного такого ресурса, платформы PRESTO-Tango, системы на основе репортеров, которая позволяет параллельно и одновременно проводить допрос человека GPCR-ome, подвиг, который ранее считался технически и экономически неосуществимым. Основываясь на независимом исследовании вербовки G-protein, при посредничестве группы по борьбе с торговлей людьми и сигнализации в GPCRs делает PRESTO-TANGO подходящим инструментом для изучения примерно 300 необоняемых ГПКР, в том числе около 100 сиротских рецепторов. Чувствительность и надежность PRESTO-Tango делают его пригодным для первичных высокопроизводительных экранов с использованием сложных библиотек, используемых для выявления новых целей GPCR для известных препаратов или для открытия новых лиганд для рецепторов сирот.
Introduction
G-белковые рецепторы (GPCRs) представляют собой самое большое и разнообразное семейство трансмембранных белков, работающих в качестве связующих интерфейсов между клеткой и ее окружающей средой1. Универсальность GPCRs подчеркивается их способность обнаруживать разнообразный спектр лигандов от нейротрансмиттеров до нуклеотидов, пептидов до фотонов, и многое другое, а также их способность регулировать многочисленные вниз по течению сигнальных каскадов, участвующих в клеточном росте, миграции, дифференциации, апоптоза, стрельбы клеток и т.д.2,3. Учитывая их повсеместность и участие во множестве физиологических процессов, это семейство рецепторов имеет первостепенное терапевтическое значение, продемонстрированное тем фактом, что более трети имеющихся в настоящее время предписанных лекарств нацелены на GPCRs4. Тем не менее, эти существующие терапевтические только целевой небольшой подмножество суперсемьи (по оценкам, 10%), и фармакология многих GPCRs остается необезвеченной. Кроме того, более 100 GPCRs существуют как сиротские рецепторы, так как они не были сопоставлены с эндогеннымлигандом 5. Таким образом, скрининг GPCR ligand имеет решающее значение в дефанфанизации и разработке лекарств, поскольку он прокладывает путь к открытию и оптимизации свинца, и, возможно, к стадии клинических испытаний.
Методы скрининга GPCR ligand традиционно упали в одной из двух категорий, G-белковая зависимость или G-белок независимых функциональных анализов6. Сигнализация GPCR регулируется гетеротримыми G-белками (ГЗЗ), которые активируются в виде обмена GTP на ВВП, связанных на субъединице7. Сигналы от активированного рецептора передаются G-белками через вторичные посланники, такие как cAMP, Кальций, DAG и IP3, чтобы посредничать вниз по течению сигнализации на вниз по течению эффекторов8. Характер функциональных последствий G-белковой сигнализации был использован для создания клеточных анализов, которые отражают активацию рецепторов. Эти методы, которые измеряют проксимальные (прямые) или дистальные (косвенные) события в G-белковой сигнализации, наиболее часто используются для скрининга лиганд GPCR и в основном используются в исследованиях десиротенизации6. Примеры анализов, которые непосредственно измеряют активацию G-белка при посредничестве GPCR, включают в себя связывающую асссид «35S»GTP-S, которая измеряет связывание радиомаркированных и негидроизируемых аналогов GTP с субъединицей ГЗ, и Фюрстер/биолюминесценционный резонансный рецензионный перенос энергии (FRET/BRET, соответственно) зонды для мониторинга GPCR-G и ГЗ /ГЗ взаимодействий, которые набирают больше тяги на протяжении9лет,10. Анализы, которые отслеживают дистальные события, являются наиболее часто используемыми инструментами для профилирования GPCR; например, анализы cAMP и IP1/3 измеряют внутриклеточное накопление G-белковых зависимых вторичных посланников, в то время как «Ca2»- поток и репортирующие анализы, связанные с конкретными элементами реакции, вовлеченными в активацию G-белка (CRE, NFAT-RE, SRE, SRF-RE), изучают события, далее вниз по течению сигнального каскада11. В то время как большинство вышеупомянутых анализов могут быть выполнены на высоком уровне пропускной записи, являются довольно чувствительными, и похвастаться определенными ассаем-специфических преимуществ (например, дискриминация между полными / частичными агонистов, нейтральных антагонистов и обратных агонистов в случае связывания GTP, или анализ функциональности на живых клетках, таких как "Ca2"и IP1/3)6, Есть, к сожалению, нет существующих G белково-зависимых методов быть подходящим допроса всего druggable GPCR.ru. Это в значительной степени связано с родной связи нескольких G-белковых подсемейств с GPCRs, в результате чего сигнализации на нескольких каскадах и неизвестных G-белков ойс на сиротах GPCRs. Чтобы смягчить эту проблему, анализы были разработаны, чтобы заставить беспорядочную G-белок связи через один общий сигнализации считывания, такие как cAMP, и Ca2 ",хотя большинство из них имеют низкую пропускную силу12.
Важным аспектом жизненного цикла GPCR является прекращение G-белково-зависимой сигнализации, которая происходит в значительной степени за счет набора q-arrestins, который вызывает диссоциацию G-белка, и в конечном итоге десенсибилизации рецептора, который предназначен для клатрин покрытием интернализации13. Наиболее повсеместно выраженными изоформами з-арестина являются невизуальные q-arrestin1 и q-arrestin2, также обозначенные как arrestin-2 и arrestin-3, соответственно14. Введите G-протеиновые независимые анализы на основе клеток, которые добавляют новое измерение скринингу лиганда GPCR; торговля рецепторами, без этикетки целые ячейки, и к-арестин вербовки анализы все примечательные примеры. GPCR торговли анализы использовать флюорофор помечены лиганды или совместно интернализированных антител, направленных на рецептор15, в то время как этикетка свободных целых клеток анализы использовать биосенсоры, которые переводят клеточные изменения, вызванные лиганд связывания в количественных выходов, таких как электрические или оптические сигналы16. Примечательно, что квинтэссенцией GPCR-- - арестин взаимодействий моды на набор анализ q-arrestin как привлекательный инструмент в репертуаре функциональных анализов17. Система танго, впервые разработанная Барнеа и др. всего десять лет назад, включает в себя введение трех экзогенных генетических элементов: синтез белка, состоящий из q-arrestin2 с протеазой вируса табачного etch (TEVp), тетрациклинового трансактиватора (tTA), который привязан к GPCR через табак etch вирус протеаза расщепления сайта (TEVcs) и предшествует последовательность из C-терминус V2 вазопрессин рецептор (V2 хвост) для содействия арестин вербовки, и репортер luciferase гена, транскрипция которого вызвана tTA транскрипции фактор транскрипции транскрипции транслокации в ядро, которое освобождается от мембраны якорь после q-arrestin2 вербовки (Рисунок 1)18. Количественные показания активации GPCR и набора q-arrestin2 могут быть впоследствии определены путем чтения для люминесценции. Заметным отличием является то, что в то время как торговля рецепторами и этикетки свободных целых клеточных методов являются относительно низкой пропускной способом, танго имеет ряд преимуществ, в том числе селективного чтения, что характерно для целевого рецептора и чувствительность из-за интеграции сигнала, которые делают его подходящим кандидатом для лиганда скрининга в большей шкале18.
В связи с этими стратегическими особенностями, Kroeze et al. разработаны PRESTO-Tango (Параллельное выражение и скрининг рецепторов и скрининг атлетизм через транскрипционный выход-Танго), высокопроизводительная платформа с открытым исходным кодом, которая использует подход Tango для профиля наркотического GPCR-ome в параллельной и одновременной манере19. Используя «неразборчивый» набор q-arrestin2 почти для всех GPCRs, PRESTO-Tango является первым в своем роде с точки зрения функциональных анализов на основе клеток, что позволяет быстро "первый раунд" скрининга малых молекулных соединений почти на всех необонятельных GPCRs, в том числе сирот, независимо от G-белка подсемейства.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Первичный скрининг: культура клеток и посев пластин
- Для приготовления поли-L-лизин (PLL) покрытием пластин, обойтись 20 л /хорошо 25 мкг/мл бульона раствор PLL в белом или черном 384-пуговый оптический нижний пластины с помощью электронного многоканального пипетка или реагента дозатор. Инкубировать пластины при комнатной температуре 0,5-2 ч.
ПРИМЕЧАНИЕ: При использовании черных 384-колодцев, ожидайте, что фоновый сигнал будет ниже по сравнению с белыми пластинами. Черные пластины рекомендуется уменьшить кровотечение через люминесценции между соседними скважинами. - Чтобы сохранить покрытием пластин и смыть избыток PLL, удалить PLL, стряхивая его над раковиной, кран сухой над бумажным полотенцем, и добавить 40 Л / хорошо разбавленного 1x раствор антибиотик-антимикотик с помощью электронного многоканального пипетки или реагента дозатор. Храните пластины с покрытием PLL при 4 градусах По Цельсию до готовности к посевной пластины.
- Поддерживать htLA клеток (любезно предоставляемые д-р Ричард Аксель) - человеческой эмбриональной линии клеток почек (HEK293T) застойно выражая q-arrestin2-TEV и tTA-управляемых luciferase-в полном Dulbecco в модифицированной среде Eagle (DMEM) дополнены 5% плода сыворотки, 5% сыворотки из телячьей коровки, 2,5 мкг/мл пуромицина, 50 мкг/мл гигромицина, 100 U/mL пенициллин, и 100 мкг/мл стрептомицина при 37 градусах По Цельсия в увлажненном инкубаторе, содержащем 5% CO2.
- Культура HTLA клеток в 150 мм посуды и проходят клетки два раза в неделю с коэффициентом разбавления 1:10, с оптимальным номером прохода клеток 5-25. Убедитесь, что достаточное количество 150 мм посуды сливится в день 384-хорошо посева пластины, в зависимости от масштаба первичного экрана.
ПРИМЕЧАНИЕ: Использование клеток HTLA больше, чем проход 25 может привести к снижению жизнеспособности, что дает неоптимальные результаты. - Чтобы семена htLA клеток для первичного экрана, аккуратно промыть конфлятор 150 мм блюдо (es) с 1x фосфат-буфера солей (PBS), рН 7.4. Отсоединить клетки с примерно 6 мл 0,05% Трипсин /0,53 мМ EDTA, и передать в центрифуге трубки, содержащие по крайней мере равное количество полного Dulbecco в модифицированной среде Eagle (DMEM) для нейтрализации трипсина.
- Спин вниз HTLA клеток на 500 х г в течение 3 мин и resuspend клеточной гранулы при плотности 0,22 х 106 клеток / мл в полном DMEM, опуская добавление 2,5 мкг/мл пуромицина и 50 мкг/мл гигромицина, поскольку они могут уменьшить эффективность трансфекции.
- Инкубировать необходимые 384-хорошо PLL покрытием пластин при 37 градусов по Цельсию, чтобы согреть их перед посевными клетками. Удалите раствор для хранения 1x антибиотик-антимикотизм из 384-хорошо PLL покрытием пластины (ы), щелкнув пластины над раковиной и лентой его на бумажное полотенце, чтобы высохнуть.
- Семенные клетки в 384-хорошо PLL покрытием пластин при окончательной плотности 10000 клеток / хорошо путем дозирования 45 зл и 0,22 х 106 ячеек / мл HTLA подвески с помощью электронного многоканального пайпе. Инкубировать пластины при 37 градусах Цельсия на ночь. Если в тот же день трансфекции является предпочтительным, семенные клетки при плотности 16000 клеток / хорошо и выполнять трансфекции 4 ч позже.
ПРИМЕЧАНИЕ: Для высокой эффективности трансфекции, 50-70% клеточной выпуклости является оптимальным.
2. Первичный скрининг: подготовка пластин ДНК и трансфекции
- Чтобы подготовить 384-хорошо ДНК источник пластины для трансфекции, как показано на рисунке 2, распространять плазмид cDNAs кодирования GPCR-Танго конструкций интерес в 96-колодец пластины, с другой GPCR / хорошо. Плазмидная ДНК должна быть приостановлена в 0.1x Tris-EDTA (TE) буфера в концентрации 50 нг / Л.
ПРИМЕЧАНИЕ: 96-колодские пластины ДНК могут быть запечатаны и сохранены при -20 градусов по Цельсию, и повторно использованы для нескольких экспериментов скрининга. Все конструкции cDNA, кодируя GPCR-Tango, доступны на коммерческой основе (см. Таблицу Материалов)и клонируются в плазмидpc pcDNA3.1. Комплект PRESTO-Tango GPCR состоит из четырех 96-колодных пластин, которые включают в себя 80 GPCRs каждый, пару скважин с пустым вектором в качестве отрицательного контроля, и положительные контрольные скважины, которые держат рецептор допамина D2 (DRD2), и колодцы, которые несут плазмид, кодирующую флуоресцентизирующую белковую (YFP) для отслеживания эффективности трансфекции. - Используя многоканальный пипетки, вручную переносите раствор ДНК из 96-ну хорошо в 384-пуговую исходную пластину ДНК, добавляя 10 л на 384 скважины. Для того, чтобы каждое условие эксперимента анализировалось в четырехсторонней, половина 96-ну а ДНК пластины (ряды A-D или E-H) будет охватывать полный 384-ну хорошо пластины путем распределения каждого GPCR в двух квадрантов (первый квадрант - соединение, второй квадрант - соединение), таким образом, что тот же GPCR будет трансфицироваться в 8 скважин из 384 пластины.
- Соберите следующие трансфекционные реагенты, необходимые для метода выпадения фосфатов кальция, как описано Иорданией и др.20: 0,1x TE буфер (1 мм Tris-HCl и 0,1 мм EDTA); 2.5 M CaCl2 решение; 2x Hepes буфер, рН 7.05 (50 mM HEPES, 280 mM NaCl, 1.5 mM Na2HPO4). Стерилизовать все растворы путем фильтрации и хранить при 4 градусах Цельсия. День трансфекции, позволяют реагентам достичь комнатной температуры перед использованием.
- Разбавить 2,5 M CaCl2 стокового раствора в 0.1x TE (1:8 разбавления) до конечной концентрации 0.313 M CaCl2 и вихря. Передача 40 зл 0,313 M CaCl2 на 384-ну хорошо ДНК источник пластины и смешивать путем pipetting вверх и вниз с ручным многоканальным пипеткой или автоматизированной скамейке 384-канальный пипетки.
- Добавьте 50 qL буфера 2x Hepes к плите источника дна 384-наилучшим образом, смешайте снова путем pipetting вверх и вниз и препятствуйте стоять на 1 min; каждый 384-хорошо будет иметь достаточное количество ДНК / трансфекционной смеси для трансфекции девяти 384-коловидной пластины, в зависимости от количества соединений, которые должны быть проверены. Перенесите 10 qL смеси ДНК/трансфекции из 384-хорошо исходной пластины ДНК в семенае клетки HTLA и инкубировать пластины на ночь при 37 градусах Цельсия.
3. Первичный скрининг: Стимуляция клеток
- Двадцать четыре часа спустя, decant транс-инфицированных клеток, мягко щелкая 384-ну пластины над раковиной и лентой его на бумажное полотенце, или с головкой аспиратора. Медленно добавьте 40 qL голодающих носителей (DMEM дополнен1% диализированной сыворотки крупного рогатого скота плода (dFBS) и 1x антибиотик / антимикотический), стараясь, чтобы избежать прикосновения к клеткам непосредственно.
- Пипет капота 20 л соединения интереса в 3x концентрации (окончательная концентрация препарата в клеточной пластине будет 1x) в чередующихся строках с стимуляцией с (я) стимуляцией, и 20 qL буфера транспортного средства для чередующихся рядов без (-) соединения. Вернуть клеточную пластину при 37 градусах Цельсия в 5% CO2 и инкубировать, по крайней мере 16 ч.
4. Первичный скрининг: Чтение люминесценции
- Подготовка glo реагент, модифицированный из Бейкер и Бойс21: 108 мМ Tris-HCl; 42 мМ Трис-База, 75 мм NaCl, 3 мМ MgCl2, 5 мМ Дитиотрей-тол (DTT), 0,2 мМ Кофермент А, 0,14 мг/мл D-Люциферин, 1,1 мм ММ АТФ, 0,25% v/v Triton X-100, 2 мМ гидросульфит.
ПРИМЕЧАНИЕ: Фондовые растворы реагентов могут быть сделаны заранее, за исключением D-Люциферина, который всегда только что добавляется в реагент Glo в его порошкообразной форме. Если черные пластины были использованы, количество D-люциферин может быть увеличена до 0,25 мг /мл. - На 16-24 ч после стимуляции, decant транс-инфицированных клеток, мягко щелкая 384-ну пластины над раковиной и лентой его на бумажное полотенце. Добавьте 20 л/также реагента Glo и инкубировать пластину при комнатной температуре в течение 5-20 мин. Прочитайте пластины с помощью счетчика люминесценции микроплиты, с интеграцией время 1 с/хорошо.
5. Первичный скрининг: анализ данных
- Экспорт сохраненных файлов из счетчика люминесценции в виде электронной таблицы; результаты будут зарегистрированы в относительных единицах люминесценции (RLU). На основе макета 384-хорошо пластины, рассчитать активации (изменение склада) каждого рецептора с помощью следующей формулы:
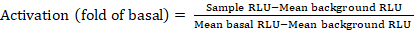
ПРИМЕЧАНИЕ: Здесь образец RLU относится к значению каждой из четырех репликации скважин стимулируемого (я м. соединения) квадранта, Средний фон RLU является средним отрицательным контролем на пластине, и средний базальный RLU относится к среднему необработанного квадранта того же рецептора (- соединения). Кроме того, вычислить стандартное отклонение 4 точек данных для проверки качества результатов. Рекомендуется выполнить преобразование log2 на среднем износе изменений для исправления любой гетероскедности; log2 база является практическим выбором, чтобы помочь определить положительные хиты. Эмпирически установить положительные пороги попадания; следует отметить, что некоторые рецепторы могут иметь как низко как 2-кратное увеличение и до 40-кратного увеличения для других с полным агонистом. - На основе полученных результатов выберите GPCRs, которые являются потенциальными положительными хитами для вторичного скрининга.
6. Вторичный скрининг: посев клеток и трансфекции
- Субкультура HTLA клеток в 100 мм посуды при общей плотности клеток 5 х 106 ячеек в 11 мл полного носителя (4,55 х 105/мл) и инкубировать при 37 градусов по Цельсию на 24 ч. Если в тот же день трансфекции является предпочтительным, семенные клетки при плотности 7,5 х 106 клеток и выполнить трансфекции 4 ч позже.
- Предварительно разогреть реагенты, необходимые для выпадения фосфатов кальция при комнатной температуре. Объедините 450 л 0,1x TE буфера с 50 зл и 2,5 М CaCl2 и быстро вихрь; эти количества специфичны для одной 100-мм тарелки, исходя из объема медиума роста, который она удерживает.
- В трубке добавьте 500 кЛ раствора TE/CaCl2 до 10 мкг GPCR cDNA и вихря. Добавьте 500 л буферного раствора 2x Hepes в трубку, энергично встряхните (не вихрь) и инкубируют в течение 1 мин.
ПРИМЕЧАНИЕ: 1 мкг любой плазмиды, кодирующей флуоресцентный белок (например, YFP, mCherry и т.д.), может быть со-трансэфектом с 9 мкг GPCR cDNA в общей сложности 10 мкг. Флуоресцентный белок используется для отслеживания эффективности трансфекции, и это минимальное количество не будет мешать анализу. - Сразу же после короткой инкубации, распределять раствор 1 мл dropwise на клетки. Аккуратно раскачивать тарелку взад и вперед, чтобы равномерно распределить осадок, позаботившись о том, чтобы не закружить тарелку, и инкубировать при 37 градусах По Цельсию в течение 24 ч.
- На следующий день, наблюдать эффективность трансфекции, глядя на выражение флуоресцентного белка под флуоресцентным изображением клетки; трансфекции более 50% охвата являются идеальными.
- Инкубировать необходимую 384-пуговую пластину с покрытием PLL (ы) в инкубаторе при 37 градусах Цельсия, чтобы согреть ее перед посевными клетками. Удалите раствор для хранения 1x антибиотик-антимикотизм из 384-хорошо PLL покрытием пластины (ы), щелкнув пластины над раковиной и лентой его на бумажное полотенце, чтобы высохнуть.
- Аккуратно промыть трансинфицированные клетки раствором Versene (1X PBS, pH 7.4; 0.53 mM EDTA), и отсоедините, добавив 3 мл 0,05% трипсин/0,53 мМ EDTA к блюду. Перенесите содержимое в центрифужную трубку, содержащую по крайней мере равное количество полного DMEM, чтобы нейтрализовать трипсин.
- Спин вниз клетки на 500 х г в течение 3 мин и повторного действия клеток при плотности 0,4 х 106 клеток / мл в голодающих средств массовой информации. Семенные клетки в 384-хорошо PLL покрытием пластины (ы) при окончательной плотности 25000 клеток / хорошо путем дозирования 45 л клеточной подвески с помощью электронного многоканального пипетки. Верните пластины к 37 градусов по Цельсию в течение как минимум 4 ч, что позволяет клеткам должным образом прикрепляться к колодцам, прежде чем приступить к стимуляции.
7. Вторичный скрининг: Препарат пластины подготовки к 16-точечной (половина журнала) доза кривой
- В 96-хорошо пластины, добавить 270 л 1X HBSS наркотиков буфера (1x Хэнка сбалансированное решение соли "HBSS", 20 мМ HEPES рН 7,4, 1x антибиотик-антимикот), за исключением последнего ряда (ряд H) пластины, как показано на рисунке 4.
ПРИМЕЧАНИЕ: Для пептидов, коллоидных молекул, и плохо водорастворимых соединений, добавление 0,1-1% BSA предлагается. Для предотвращения окисления препарата, до 0,01% аскорбиновой кислоты также могут быть добавлены. - Из лекарственного запаса подготовьте лекарственный раствор (называемый "высокой" концентрацией) путем расчета окончательной концентрации в 3 раза (окончательная концентрация препарата в клеточной пластине составит 1x). В качестве примера, для кривой дозы-реакции с 10 мкм в качестве самой высокой концентрации, приготовьте "высокую" концентрацию на уровне 30 мкм. Пипетка 300 л "высокой" концентрации в скважинах в ряду H.
- В другой трубке подготовьте "низкую" концентрацию, которая представляет собой "высокую" концентрацию, разделенную на 3,16 (половина журнала). Исходя из предыдущего примера, концентрация "низкая" составит 9,49 мкм. Труба 300 л "низкой" концентрации в скважинах в ряду H, прилегающих к скважинам "Высокий".
ПРИМЕЧАНИЕ: Общее количество 96 скважин, необходимых в строке H, будет зависеть от количества клеток и условий стимуляции. Четыре скважины (два "высоких" и два "Низкий") будет иметь достаточное решение наркотиков, чтобы стимулировать весь 384 хорошо пластины. - Выполните серийное разбавление путем трубоукладки 30 зл и снадобья раствора от "Высокого" и "Низкого" скважин строки H до предыдущей строки (ряд G) и смешайте вручную пайпеттинг вверх и вниз, или, как рекомендуется, используя электронный многоканальный пипеткс с функцией "Pipette and Mix". Повторите этот шаг до первого и наиболее разбавленного ряда (строка А), отбрасывая советы между разбавлениями.
ПРИМЕЧАНИЕ: При желании, серийные разбавления могут быть остановлены до строки А, представляющие внутренний контроль без наркотиков, другими словами, "истинный ноль". - Используя Рисунок 4 в качестве эталона, стимулируйте трансинфицированные клетки путем прокладки 20 qL "Низкий" колонки разбавления от 96-ну хорошо пластины на ряды A-O ранее семенами 384-хорошо пластины, а также 20 зл "Высокий" столбец разбавления скважин B-P. Инкубировать пластину при 37 градусов по Цельсию для минимума 16 h.
8. Вторичный скрининг: luminescence чтения и анализа данных
- На 16-24 ч после стимуляции, decant транс-инфицированных клеток, мягко щелкая 384-ну пластины над раковиной и лентой его на бумажное полотенце. Добавьте 20 л/также реагента Glo и инкубировать пластину при комнатной температуре в течение 5-20 мин. Прочитайте пластины с помощью счетчика люминесценции микроплиты, с интеграцией время 1 с/хорошо.
- Экспорт сохраненных файлов из счетчика люминесценции в виде электронной таблицы; результаты будут зарегистрированы в относительных единицах люминесценции (RLU). Передача данных 384-хорошо пластины в статистическое программное обеспечение для анализа результатов с помощью встроенного xY анализа для нелинейной кривой регрессии подходят. Выберите встроенную функцию стимуляции 3-параметра для дозы-реакции "Log (агонист) против ответа (три параметра)",

ПРИМЕЧАНИЕ: Здесь верхний и нижний являются плато в единицах оси Y, соответственно максимальная реакция и базальный уровень, EC50 является концентрация агониста, который генерирует 50% ответ между верхней и нижней, и X относится к концентрации журнала агониста. Эта модель предполагает, что кривая доза-реакция имеет стандартный наклон холма 1.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Используя протокол PRESTO-Tango, представленный в настоящем, экстракт гранулы хромаффина (CG) был проверен против 168 необонворных целей GPCR, при этом большинство из них являются сиротскими рецепторами. Профилирование указанного экстракта было выполнено путем изучения мобилизации на выбранных рецепторах, основанного на принципе, разработанном Barnea et al.18 (рисунок 1). Плазмидки GPC, представляющие интерес, были взяты из комплекта PRESTO-Tango GPCR Kit и собраны в двух 96 хорошо стыковых пластинах в нужном макете. В общей сложности, четыре 384-колодские пластины, посеянные с клетками HTLA были трансинфицированы, так как каждая половина из 96-ну ну днк пластин ы была сделана в полную пластину 384 колодца, в результате чего каждый рецептор трансфицируется в двух квадрантах (восемь 384 колодцев в общей сложности). Один из двух квадрантов был стимулирован с экстрактом CG; по-разному, чередующиеся строки C-D, G-H, K-L, и O-P представлены (к) стимуляции (Рисунок 2). Из 168 GPCRs, которые были допрошены в первичном скрининге, только два рецептора были претендентами в качестве потенциальных активных целей, в частности, дофаминовый рецептор D3 (DRD3) и opsin 5 (OPN5). DRD3 произвелзначительное изменение log2fold 4.70, тогда как OPN5 произвело немножко более низкую реакцию 2.39, оба встречая порог отсечения изменения створки log2 qgt;2. Для сравнения, положительный контроль для первичного экрана был DRD2 стимулировали с quinpirole, селективный агонист этого рецептора, и производится log2 раз изменения 4,58 (Рисунок 3). Чтобы воспроизвести эти сигнальные окна и исключить возможность ложноположительных попаданий, был проведен вторичный экран с вышеупомянутыми рецепторами. Помимо тестирования экстрактcg, учитывая, что DRD3 является несиротатом рецептором, другое условие было подготовлено в качестве положительного контроля, в частности стимуляции с quinpirole, один из его селективных агонистов. С другой стороны, OPN5 является рецептором сироты и как таковой, ни одна ссылка агонистом может быть проверена наряду с экстрактом CG в качестве положительного контроля; только буфер был протестирован как отрицательный контроль. Дальнейшая фармакологическая характеристика этих двух GPCRs была выполнена путем подготовки 16-точечных кривых доз в диапазоне от 10-5 М до 10-12,5 М. В частности, экстракт CG и растворы квинпирола на уровне 10 мМ были разбавлены до 30 мкм и 9,49 мкм, соответствующие "Высокие" и "низкие" концентрации в нижнем ряду (ряд Н) 96-й пластины; эти составы станут 10-5 М и 10-5,5 М после того, как 20 л распределяется на трансинфицированных клеток в 40 л голодали среды, в общей сложности 60 Л в течение каждого 384-хорошо. Как уже говорилось ранее, серийные разбавления были выполнены таким образом, что наиболее разбавленные лекарственные образования на 10-12 М и 10-12,5 М находятся в верхнем ряду (ряд А)(рисунок 4). Кривые дозы ответа от вторичного скрининга были созданы с помощью GraphPad Prism для оценки потенции и эффективности лиганд. По сравнению с quinpirole, экстракт CG произвел аналогичные сигнальные окна и значения EC50, подтверждающие его действительность как активного попадания на DRD3. Тем не менее, плоская кривая дозы, похожая на отрицательный контроль, была произведена для OPN5, исключая его в качестве возможной цели для экстракта CG(рисунок 5).

Рисунок 1: Модульная конструкция конструкций TANGO (A) и общая схема для рекрутингового асса (B) (B). (A) Конструкции GPCR Tango состоят из различных элементов модуля в следующем порядке: тег HA сигнала/FLAG, GPCR CDS, рецептор вазопрессина 2 C-терминала хвост, TEV protease расщепления сайта, и tTA транскрипции фактор. (B) Принцип танго анализ включает в себя переходно ежевременный трансфекции GPCR Танго плазмиды в клетках HTLA, HEK293T клетки застойно выражая й-arrestin2-TEV протеазы синтеза белка и luciferase репортер ген, экспрессия которого активируется tTA. Активация GPCR в конечном итоге приведет к мобилизации q-arrestin2-TEV к рецептору, в результате чего протеазы в непосредственной близости от места расщепления. В результате, tTA расщепляется с хвоста GPCR, освобождая транскрипционный фактор для перемещения в ядро и активировать выражение люциферазы. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2: Layouts из 96-хорошо пластины кДНК и 384-хорошо клеточной пластины для трансфекции и стимуляции в PRESTO-TANGO первичного скрининга. Изображая подготовку 384-хорошо cDNA исходной пластины для трансфекции, GPCR танго конструкции сначала передаются из половины 96-ну хорошо пластины в полный 384-ну пластины, с каждым рецептором трансфицируются в octuplicate. В этой обстановке, стимуляция клеток с (к) и без (-) препарат (ы) интерес будет происходить в четыре раза для каждого отдельного рецептора. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 3: Графические представления идентификации хита с первичного скрининга PRESTO-Tango. В качестве доказательства концепции была проанализирована биологическая активность экстракта гранулы хромаффина (CG) на GPCRome. Клетки HTLA были трансфицированы в 384 скважинных пластинах с 168 конструкциями танго GPCR, и либо стимулировались экстрактом CG (соединением) или с буфером транспортного средства (- соединение). pcDNA3.1 был использован в качестве отрицательного контроля, и рецептор DRD2 стимулируется quinpirole был использован в качестве положительного контроля. Окна сигнала(A)и изменение разы log2 (B) в активации рецептора были рассчитаны между скважинами в отсутствии или присутствии экстракта CG. Все бары ошибок представляют SD (n - четыре измерения). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 4: Укладка 96-хорошо препарат пластины подготовки для стимуляции во вторичном скрининге. Изображая подготовку 96-хорошо пластины препарата для стимуляции клеток, серийные разбавления для 16-точечной дозы кривой диапазон начинается с 10-5 М (окончательная концентрация) в строке H, с полулоги интервалы между каждой точкой до 10-12,5 М в строке A. "Высокий" и "Низкий" наркотиков столбцов используются для стимулирования чередования строк семян 384-хорошо пластины. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 5: Реакция на дозу кривой для комплексного профилирования и демонстрации набора в GPCRs во вторичном скрининге. Клетки HTLA были преходяще трансфицированы рецепторами DRD3 (A) и OPN5 (B). Оба трансинфицированных условиябыли были простимулированы с экстрактом CG в половинных бревенчатых приращениях, так же как DRD3 специфический агонист quinpirole как положительный контроль, и буфер корабля для OPN5 как отрицательный контроль. Все бары ошибок представляют SD (n - три измерения). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Конформно динамические GPCRs являются электростанциями трансдукции сигналов. Физиохимические свойства связывающих карманов этих гептахелевых рецепторов, а также их физиологическая актуальность подчеркивают необходимость инструментов скрининга лиганда GPCR. Как указано выше, престо-Танго ассс является быстрым, чувствительным и удобным для пользователей, кредитуя себя разработки лекарственных средств. Это не только агонист-индуцированной активации, но он также может быть использован для количественной оценки деятельности антагонистов и аллостерных модуляторов19. В свете функциональной избирательности, концепция, которая предполагает, что различные структуры наркотиков может вызвать различные рецепторы сигнализации каскадов на одном рецепторе, сравнивая активацию G-белка пути с использованием G-белка зависимых анализов с й-арестин вербовки с помощью PRESTO-Танго может обеспечить сигналы для проектирования свинца соединений с уменьшенными негативными побочными эффектами. Примечательно, что его независимость от обнаружения Связывания G-белка помогает определить партнеров по соединению для сирот GPCRs, которые не были бы ранее обнаружены G-белковых анализов.
Для обеспечения согласованности и надежности экранов PRESTO-Tango необходимо проявлять осторожность на всех этапах протокола, так как возмущения, введенные, будут увеличены в связи с характером этой платформы. Конечно, есть общие меры, общие для всех экранов HTS, которые должны быть приняты во внимание, такие как использование реагентов одного и того же лота / формулировки для обеспечения одинаковой стабильности и биологической активности во всем, а также поддержание условий в системе HTS последовательной, таких как плотность посева клеток и время инкубации наркотиков. Миниатюрный формат PRESTO-Tango требует внимания к нескольким критическим моментам: вариация плотности посева клеток и их однородное распределение (слипание по сравнению с одноклеточной подвеской) между скважинами, низкая эффективность трансфекции и плохая стимуляция соединения и доставка предотвратят изо дня в день и репроцизируемость пластин. С этой целью, triturate подвески клетки HTLA для того чтобы гомогензировать разрешение перед засеять и обеспечить 50-70% стежка клетки перед transfection. Транспортное средство для доставки соединений должно быть проверено, с диметилсульфодом является наиболее распространенным носителем. Как правило, самая высокая концентрация наших кривых доз составляет 10 км, но это может измениться в зависимости от характера и потенции соединения; важно проверить различные концентрации, чтобы вывести клеточной толерантности и токсичности.
С учетом того, что некоторые GPCRs имеют высокую составную активность, одна из проблем, которая может возникнуть во время скрининга, заключается в уменьшении динамического диапазона и фоновом сигнале, который выше, чем ожидалось. Это может быть несколько смягчен, гарантируя, что сыворотка голодают осуществляется с DMEM среды дополняется 1% dFBS. Следует учитывать, что если выход люминесценции достаточно высок, то все еще может быть кровоизлияние через соседние скважины, что может привести к ошибочно рассчитанным изменениям складок. Необнаруживаемые или низкие сигналы (при условии, что ответ ожидается) может быть объяснено несколькими способами, а именно плохое выражение GPCR (ы) в клетках HTLA, биологическая активность соединения теряется, делая его неэффективным, или рецептор (ы) в вопросе не внутренне набирать -arrestin2. Соответственно, оценка количества и качества транс-инфицированной плазмидной рецепторной ДНК, тестирование других препаратов/много неэффективного соединения, о котором идет речь, и выполнение ортолотовых белково-белковых методов взаимодействия, таких как BRET/FRET или совместное иммунопреципция, являются некоторыми предлагаемыми решениями этой проблемы. Кроме того, экспрессия рецепторов может быть также улучшена путем подклонирования рецепторов танго (ы) интереса к лентивирным векторатам и преобразовывания клеток HTLA, генерируя стабильную клеточную линию HTLA-GPCR. Сдвиг ожидаемой потенции агониста во время вторичного скрининга может означать, что время стимуляции препарата и/или концентрация соединения, необходимого для стимулирования реакции, недостаточны, или что серийные разбавления пластины препарата были неправильно подготовлены. Использование электронного многоканального пипетки или автоматизированной системы пипетки без изменения советов между ними при создании наркотиков серийных разбавлений может быть проблемой при работе с липкими соединениями.
Заметные различия между оригинальным танго-самосха, разработанный Barnea et al.18 и платформой PRESTO-Tango, включают в себя дизайн рецептора в модульном формате, состоящем из оптимизированных последовательностей, которые улучшают экспрессию рецепторов в клетках млекопитающих, эпитопные теги для проверки указанного выражения и места ограничения, которые фланговые GPCRs, Хвост V2 и TEVcs-tTA, позволяющие высежочки. Самое главное, PRESTO-Tango превосходит танго анализ с точки зрения скрининга власти и экспериментального дизайна. Четырехстороннее пробное тестирование примерно 300 GPCRs выполняется только в 8 384 скважинах, при этом учитываются отрицательные фоновые средства контроля и положительные средства контроля для контроля эффективности трансфекции. В то время как PRESTO-Tango подходит для скрининга GPCR-ом только с одним соединением интереса, допрос с несколькими лигандами также может быть выполнен, хотя и при увеличении стоимости и использования ресурсов, таких, как с объединенными или массивными небольшими библиотеками молекулилитарных соединений или биологическими образцами, которые состоят из смесей различных химических образований. Конечно, этот вопрос можно смягчить за счет сокращения числа соединений для допроса путем проведения химического сходства и анализа разнообразия соответствующих библиотек. В то время как платформа PRESTO-Tango более применима для целей первичного скрининга, вторичное профилирование может быть выполнено в меньших масштабах, в средних или малопроходимых форматах, чтобы подтвердить функциональные последствия стимуляции лиганда. Однако, как и во всех других анализов GPCR, следует признать, что нет подходящих положительных элементов управления для рецепторов сирот во время вторичного скрининга с танго анализ. Тем не менее, потенциальные положительные результаты могут быть определены, если выходные данные могут быть установлены на кривой реакции сигмоидальной дозы,с вычисленной окном сигнала и значением EC50. Важно также отметить, что механизм активности лиганд, будь то для сирот или не-сирот рецепторов, не может быть выяснена без параллельного анализов.
Со всеми компонентами PRESTO-Tango уже оптимизированы, в том числе HTLA клеточной линии и GPCR танго конструкций, мало места для модификации требуется, кроме выбора соединения формулировки (ы), которые будут использоваться для стимуляции наркотиков. При желании, линия клеток HTLA, устойчиво выражающая рецептор, может быть легко сгенерирована путем клонирования указанного рецептора GPCR-Tango в рекомендуемом векторе pIRESbleo3 (Clonetech) и выбора клонов с помощью зеоцина. Что касается свопа с pcDNA3.1 на pIRESbleo3, просто переварить конструкцию GPCR Tango с NotI и XbaI и вставьте в вектор назначения на местах ограничения NotI и NheI. Несмотря на это, существуют возможности для адаптации и оптимизации этой технологии. Одним из столпов этой технологии являются htLA-клетки, клеточная линия HEK293T, устойчиво выражающая ген синтеза з-arrestin2-TEV и репортера люциферазы, зависящих от ТТА, любезно поставляемого из лаборатории Ричарда Акселя. Хотя важнейший компонент PRESTO-Tango, в настоящее время нет других альтернатив с точки зрения происхождения клеточной линии, или генов, которые они выражают. Кроме того, будущие инженерные клеточные линии могут быть созданы, чтобы выразить другие гены синтеза TEV для отслеживания других белков, кроме q-arrestin2, в частности, те, которые ранее были показаны для взаимодействия или найдены в резиденции gPCRs, таких как 14-3-322, SAP9723, и -arrestin1, который является более распространенной изоформной невизуальных арестов у позвоночных24. Это может быть достигнуто с помощью родительских клеток HTL, которые содержат исключительно luciferase репортер контролируется tetO7 промоутер. Одним из ограничений preSTO-Tango является неспецифическая активация промоутера репортера. Основываясь на тетрациклино-зависимой системе регулирования (тет-система), тетрациклин-ответный элемент (TRE) контролирует выражение репортера люциферазы вниз по течению. Тем не менее, предыдущие исследования продемонстрировали "утечка" выражение люциферазы из-за эндогенных факторов транскрипции25,26. В результате, некоторые соединения могли активировать репортера независимо от набора в q-arrestin2 или активации GPCR, увеличивая число ложных срабатываний. Другой вопрос, который возникает, также общие для других методов HTS, являются "часто нападающих", беспорядочный соединений, которые стимулируют существенные ответы в нескольких целей27. Тем не менее, параллельная настройка скрининга PRESTO-Tango облегчает идентификацию этих артефактов, которые могут быть дополнительно протестированы для подтверждения их влияния на активность люциферазы. В целом,PRESTO-Tango заложила прочную основу для изучения вербовки арестов в ГПКР и в более широкой схеме обнаружения наркотиков в качестве утильного инструмента скрининга и дефанфанизации ГПКР.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Authours объявить не конкурирующих интересов.
Acknowledgments
Эта работа была поддержана Канадскими институтами исследований в области здравоохранения (CIHR грант #MOP142219).
Materials
| Name | Company | Catalog Number | Comments |
| 384 Well Optical Bottom Plates, Polystyrene Polymer Base, Cell Culture Treated, BLACK, with lid, Sterile | NUNC | 12-566 | |
| 384 Well Optical Bottom Plates, Polystyrene Polymer Base, Cell Culture Treated, White, with lid, Sterile | NUNC | 12-566-1 | |
| 384 Well Round Bottom, Polypropylene, Non-Treated, Blue, non-sterile, without lid | ThermoFisher | 12-565-390 | |
| Antibiotic-Antimycotic | Wisent | 450-115-EL | |
| D-Luciferin, sodium salt | GoldBio | LUCNA | |
| DMEM with L-Glutamine, 4.5g/L Glucose and Sodium Pyruvate | Corning | 10-013-CV | |
| Eppendorf Xplorer, 12-channel, variable, 15–300 µL | Eppendorf | 4861000155 | |
| Eppendorf Xplorer, 12-channel, variable, 5–100 µL | Eppendorf | 4861000139 | |
| Matrix Platemate 2x3 | ThermoFisher | 801-10001 | |
| MicroBeta 1450 Wallac | Perkin Elmer | ||
| Penicilin-Streptomycin | Wisent | 450-201-EL | |
| Poly-L-Lysine hydrobromide | Millipore-Sigma | P2636-500MG | |
| Roth Lab PRESTO-Tango GPCR Kit | Addgene | Kit #1000000068 |
References
- Liapakis, G., et al. The G-protein coupled receptor family: actors with many faces. Current pharmaceutical design. 18 (2), 175-185 (2012).
- Pierce, K. L., Premont, R. T., Lefkowitz, R. J. Seven-transmembrane receptors. Nature Reviews Molecular Cell Biology. 3 (9), 639-650 (2002).
- Kroeze, W. K., Sheffler, D. J., Roth, B. L. G-protein-coupled receptors at a glance. Journal of cell science. 116, Pt 24 4867-4869 (2003).
- Rask-Andersen, M., Almén, M. S., Schiöth, H. B. Trends in the exploitation of novel drug targets. Nature Reviews Drug Discovery. 10 (8), 579-590 (2011).
- Ngo, T., et al. Identifying ligands at orphan GPCRs: current status using structure-based approaches. British journal of pharmacology. 173 (20), 2934-2951 (2016).
- Zhang, R., Xie, X. Tools for GPCR drug discovery. Acta pharmacologica Sinica. 33 (3), 372-384 (2012).
- Kimple, A. J., Bosch, D. E., Giguere, P. M., Siderovski, D. P. Regulators of G-Protein Signaling and Their G Substrates: Promises and Challenges in Their Use as Drug Discovery Targets. Pharmacological Reviews. 63 (3), 728-749 (2011).
- Wettschureck, N., Offermanns, S. Mammalian G Proteins and Their Cell Type Specific Functions. Physiological Reviews. 85 (4), 1159-1204 (2005).
- Denis, C., Saulière, A., Galandrin, S., Sénard, J. -M., Galés, C. Probing heterotrimeric G protein activation: applications to biased ligands. Current Pharmaceutical Design. 18 (2), 128-144 (2012).
- Yin, H., et al. Lipid G protein-coupled receptor ligand identification using beta-arrestin PathHunter assay. The Journal of Biological Chemistry. 284 (18), 12328-12338 (2009).
- Cheng, Z., et al. Luciferase Reporter Assay System for Deciphering GPCR Pathways. Current Chemical Genomics. 4, 84-91 (2010).
- Roth, B. L., Kroeze, W. K. Integrated Approaches for Genome-wide Interrogation of the Druggable Non-olfactory G Protein-coupled Receptor Superfamily. The Journal of Biological Chemistry. 290 (32), 19471-19477 (2015).
- Jean-Charles, P. -Y., Kaur, S., Shenoy, S. K. G Protein-Coupled Receptor Signaling Through β-Arrestin-Dependent Mechanisms. Journal of Cardiovascular Pharmacology. 70 (3), 142-158 (2017).
- Smith, J. S., Rajagopal, S. The β-Arrestins: Multifunctional Regulators of G Protein-coupled Receptors. The Journal of Biological Chemistry. 291 (17), 8969-8977 (2016).
- Böhme, I., Beck-Sickinger, A. G. Illuminating the life of GPCRs. Cell Communication and Signaling. 7 (1), 16 (2009).
- Fang, Y. Label-Free Receptor Assays. Drug discovery today. Technologies. 7 (1), 5-11 (2011).
- Wang, T., et al. Measurement of β-Arrestin Recruitment for GPCR Targets. Assay Guidance Manual. Eli Lilly & Company and the National Center for Advancing Translational Sciences. , (2004).
- Barnea, G., et al. The genetic design of signaling cascades to record receptor activation. Proceedings of the National Academy of Sciences of the United States of America. 105 (1), 64-69 (2008).
- Kroeze, W. K., et al. PRESTO-Tango as an open-source resource for interrogation of the druggable human GPCRome. Nature Structural & Molecular Biology. 22 (5), 362-369 (2015).
- Jordan, M., Schallhorn, A., Wurm, F. M. Transfecting Mammalian Cells: Optimization of Critical Parameters Affecting Calcium-Phosphate Precipitate Formation. Nucleic Acids Research. 24 (4), 596-601 (1996).
- Baker, J. M., Boyce, F. M. High-throughput functional screening using a homemade dual-glow luciferase assay. Journal of Visualized Experiments. (88), 50282 (2014).
- Li, H., Eishingdrelo, A., Kongsamut, S., Eishingdrelo, H. G-protein-coupled receptors mediate 14-3-3 signal transduction. Signal Transduction and Targeted Therapy. 1 (1), 16018 (2016).
- Walther, C., Ferguson, S. S. G. Minireview: Role of intracellular scaffolding proteins in the regulation of endocrine G protein-coupled receptor signaling. Molecular Endocrinology. 29 (6), Baltimore, Md. 814-830 (2015).
- Gurevich, E. V., Benovic, J. L., Gurevich, V. V. Arrestin2 expression selectively increases during neural differentiation. Journal of Neurochemistry. 91 (6), 1404-1416 (2004).
- Shaikh, S., Nicholson, L. F. B. Optimization of the Tet-On system for inducible expression of RAGE. Journal of Biomolecular Techniques JBT. 17 (4), 283-292 (2006).
- Blau, H. M., Rossi, F. M. Tet B or not tet B: advances in tetracycline-inducible gene expression. Proceedings of the National Academy of Sciences of the United States of America. 96 (3), 797-799 (1999).
- Roche, O., et al. Development of a Virtual Screening Method for Identification of "Frequent Hitters" in Compound Libraries. Journal of Medicinal Chemistry. 45 (1), 137-142 (2002).