2.1: 화학 반응
균형 잡힌 화학 방정식은 화학 적 변화에 관련된 반응제 및 제품의 화학 적 공식정보를 제공합니다. 반응의 stoichiometry는 원하는 양의 제품을 생산하기 위해 얼마나 많은 반응제가 필요한지 예측하는 데 도움이 되며, 어떤 경우에는 특정 양의 반응제에서 얼마나 많은 제품이 형성될지 예측하는 데 도움이 됩니다.
균형 잡힌 화학 방정식으로 표현되는 반응제 및 제품의 상대적 양은 종종 금식형 양이라고합니다. 그러나 실제로, 반응제가 항상 균형 잡힌 방정식으로 표시된 금식양에 존재하는 것은 아니다.
화학 반응에서, 먼저 소비되는 반응제는 형성된 제품의 양을 제한하고, 제한 반응제이며, 다른 물질은 과잉 반응제가 된다. 하나 이상의 반응물질을 초과하는 것은 종종 다른 반응제를 제품으로 완전히 변환하는 데 사용됩니다.
방정식으로 표시되는 물의 형성에 대한 반응을 고려하십시오.
Stoichiometry는 수소의 두더지와 산소의 한 두더지가 물의 두 두 더지를 생성하기 위하여 반응한다는 것을 표시합니다; 즉, 수소와 산소는 2:1 비율로 결합됩니다.
수소 5두더지와 2개의 두더지가 존재하는지 상상해 보십시오. 반응제의 비율은 이제 5:2 (또는 2.5:1)이며, 이는 2:1의 stoichiometric 비율보다 큽니다. 따라서 수소는 과잉으로 존재하며 산소는 제한 반응제이다. 제공된 모든 산소(2 mol)의 반응은 제공된 수소 5mol의 4 mol을 소비하여 1 mol의 수소가 반응하지 않습니다. 제공된 각 반응제의 어금량을 계산하고 균형 잡힌 화학 방정식에 표시되는 금식형 양과 비교하는 것은 제한 및 과잉 반응제를 식별하는 한 가지 방법입니다.
반응 속도는 단위 시간당 반응제 또는 제품의 양이 변화합니다. 따라서 반응 속도는 반응제 또는 제품 양과 관련될 수 있는 일부 특성의 시간 의존성을 측정하여 결정됩니다.
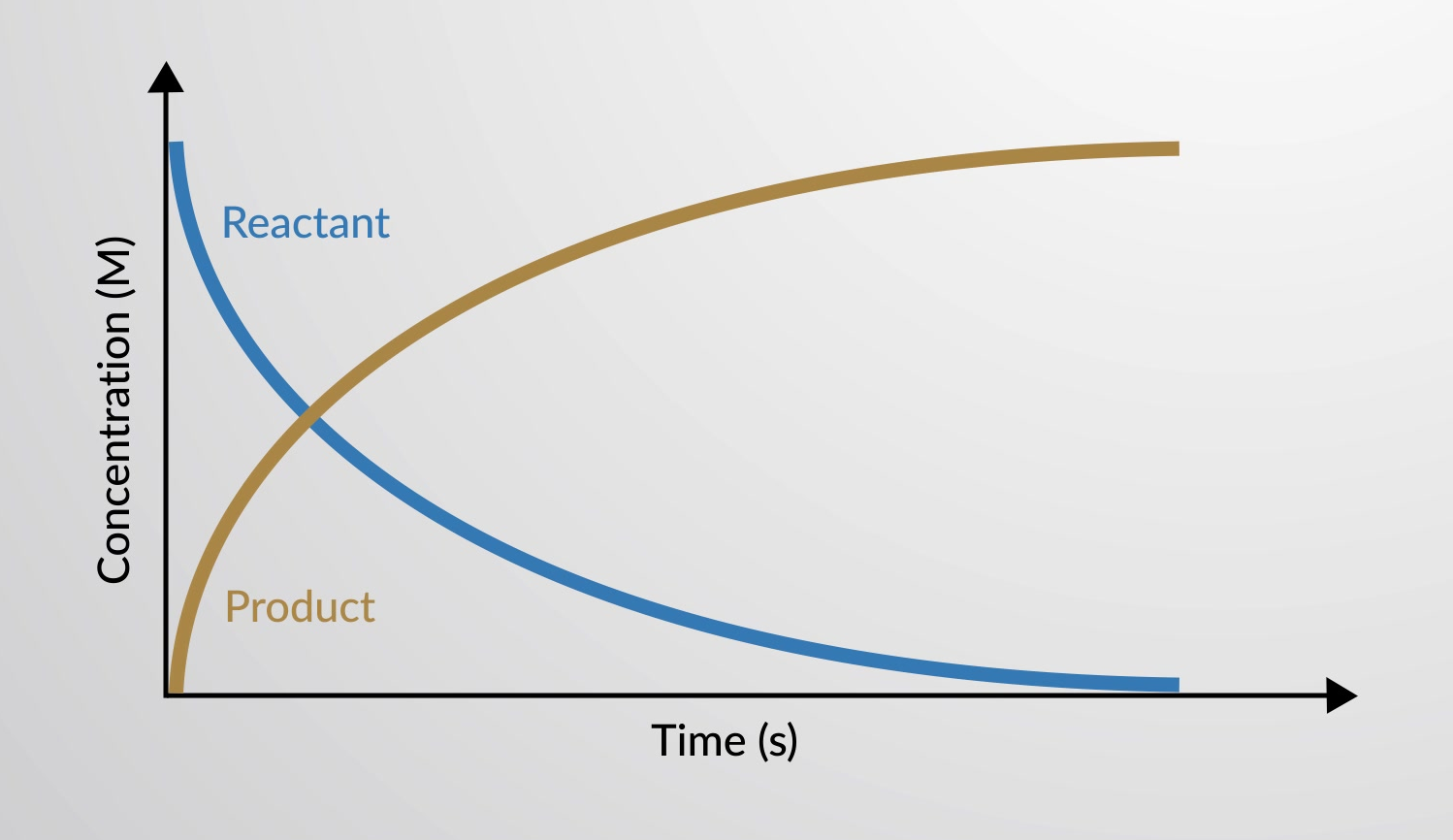
화학 반응의 속도는 시간의 함수로서 반응및 제품의 농도의 분산으로 그래프로 플롯 될 수있다.
가역적인 화학 반응은 전방(왼쪽에서 오른쪽) 및 역(오른쪽에서 왼쪽) 방향으로 진행되는 화학 공정을 나타냅니다. 가역반응의 상태는 반응지수(Q)를평가하여 편리하게 평가된다. 에 의해 설명된 뒤집을 수 있는 반응의 경우
반응 지수는 균형 방정식의 stoichiometry에서 직접 파생됩니다.
여기서 하위 스크립트 c는 표현식에서 어금니 농도의 사용을 나타낸다.
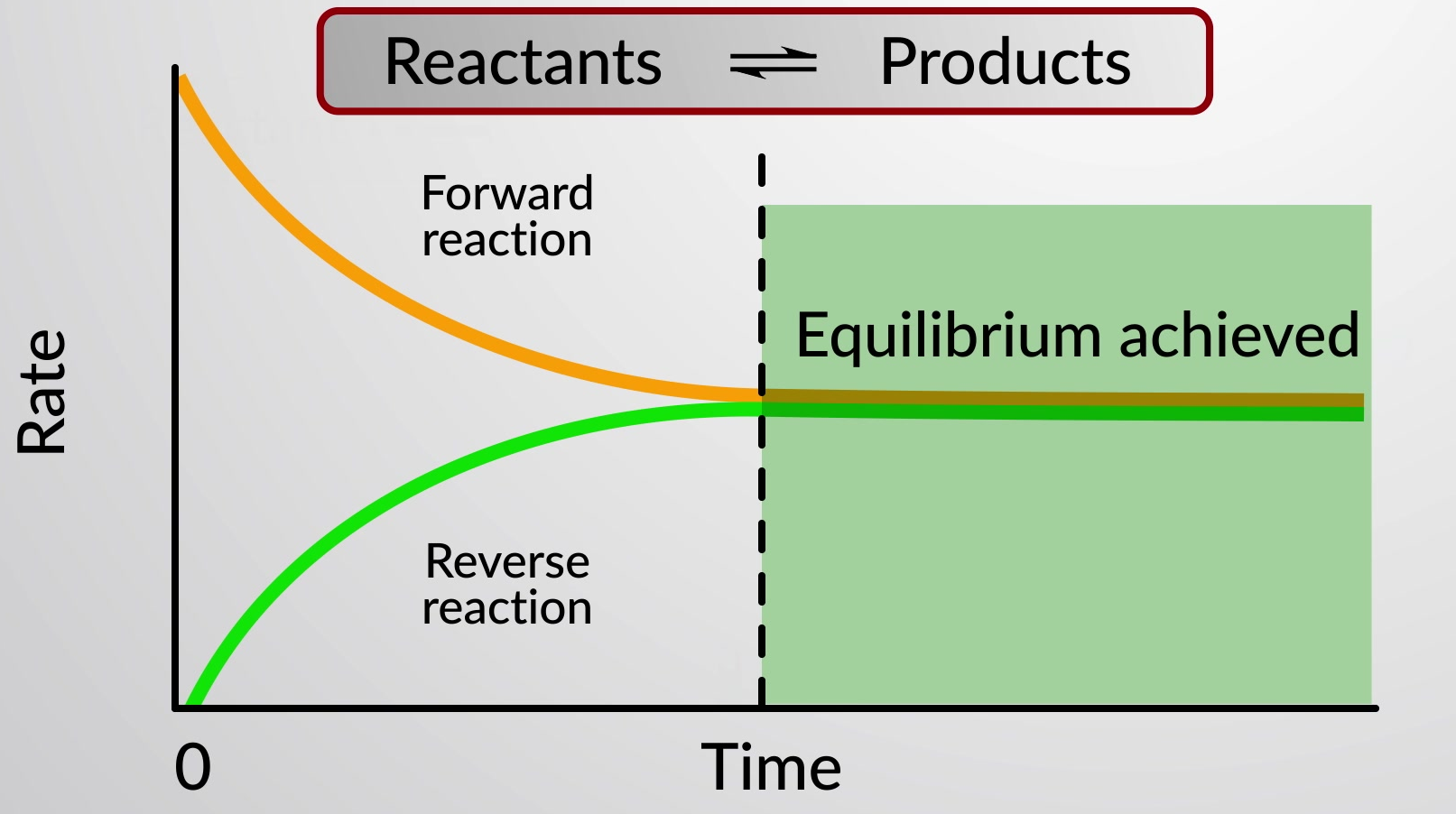
전방 및 역반응의 비율이 같을 때, 반응제와 제품 종의 농도는 시간이 지남에 따라 일정하게 유지되고 시스템이 평형에 있습니다. 특수 이중 화살표는 반응의 가역적 특성을 강조하는 데 사용됩니다.
이 텍스트는 OpenStax 화학 2e, 섹션 4.3에서 적응: 반응 stoichiometry; 섹션 4.4: 반응 수율; 섹션 12.1: 화학 반응 비율; 섹션 13.1 화학 평형, 섹션 13.2 평형 상수.


