Summary
介绍了一种在单个分子水平上测量DNA的位点特异性裂解高度平行的方法。该协议演示了使用限制内核糖 NdeI 的技术。该方法可以很容易地修改,以研究任何过程,导致现场特异性DNA裂解。
Abstract
站点特异性DNA裂解(SSDC)是许多细胞过程中的关键步骤,对基因编辑至关重要。这项工作描述了一个动力学测定,能够同时测量许多单DNA分子中的SSDC。珠系基板DNA,每个包含目标序列的单个副本,在微流体流通道中准备。外部磁铁对顺磁珠施以弱力。使用宽场低放大镜目对暗场成像下的微珠进行可视化,可监控多达 1,000 个单个 DNA 的完整性。注射限制内核糖,NdeI,启动裂解反应。视频显微镜用于通过观察相关珠子在目标焦平面上移的帧来记录每个 DNA 裂解的确切时刻。帧按帧的珠数可量化反应,指数拟合确定反应速率。此方法允许在单个实验中收集单个分子 SSDC 反应的定量和具有统计显著性的数据。
Introduction
现场特异性DNA裂解(SSDC)是许多基因组交易中的关键步骤。例如,细菌限制修饰 (RM)1 和 CRISPR2 系统通过识别和切割特定序列中的异质核子,保护细胞免受噬菌体和质粒的攻击。在II型RM中,限制性内核糖核酸(ES)通过蛋白-核酸相互作用识别短4~8基对(bp)序列。CRISPR 相关的内端体(如 Cas9)通过将 crRNA 绑定到内端体4的目标站点杂交绑定到站点。建立站点特定的双搁浅断裂(DSB)也是许多DNA重组事件5的第一步。例如,V(D)J 重组创建的抗原结合区域的多样性要求识别和裂解特定目标位点 6。一些转子已知以特定的DNA序列为目标,以及7。毫不奇怪,这些过程中涉及的许多特定站点的核酸酶,如Cas9,是基因编辑技术8的关键组成部分。此外,还设计了新的现场特异性内分酶(即锌指核酶9 和塔伦NS10)来编辑基因组。
许多方法已被用于测量核酸的位点特异性裂解的动力学。其中包括凝胶分析、荧光11、12,12和基于测序的方法13。微珠的系绳取得了重大进展,它允许DNA单分子中的DSB在链分离后通过珠子的运动来检测。在这些方法中,使用不同类型的力来确保珠子的链分离和后裂隙的运动。在一个案例中,EcoRV 14已经用光学陷阱来测量DNA的裂解。在这些实验中,目标搜索是调查的目标,优化了条件,使特定于站点的绑定是速率限制步骤。光学陷阱的一个缺点是一次只能观察到一个DNA。此外,必须应用周期性大拉力来测试绞线分离。
另一种技术使用流动和弱磁力的组合,以连续的方式拉上珠子15。这样,通过 NdeI 测量扩散有限裂解。采用的方法允许同时测量几百个DNA,从而在单个实验中达到统计显著性。还使用了基于磁性钳子的实验。在一项此类研究中,通过在插入寡核苷酸16中加入DSB进行了研究逆转录病毒性整质。成功的集成导致DSB在系绳DNA中加入,并丢失所附珠子。在一项类似的研究ATP依赖III型限制内核糖酶EcoPI,在一个单一的实验17中观察到了数十个DNA。磁钳具有在反应过程中可以控制和监测张力以及DNA循环的优势。
这里介绍的是一种用于测量SSDC动力学的极平行单分子方法,它利用了最近DRNA大规模系绳的改进。这种方法是以往用于测量DNA复制18、DNA19的轮廓长度和由REs15进行裂解的方法的改进和扩展。在这项技术中,包含识别序列单一副本的线性DNA在一端用生物素和二恶合宁在另一端进行准备。生物素结合链球菌素,它与顺磁微珠共价附着。DNA珠复合物被注入一个微流体通道,该通道已经用抗二恶英FAB片段功能化。然后,DNA 将二恶由多宁与吸附的 FAB 片段结合,将附着到表面附着点。使用永磁体施加的弱磁力防止珠子非专门粘在表面。样品可快速注入流通道(<30 s),以激活裂解反应。在数据收集过程中,流已关闭。当每个DNA被切割时,可以通过记录珠子向上和移出目标焦点图的框架来确定裂解的确切时间,从而从视频记录中消失。剩余珠子的帧计数可用于量化反应进度。
下面介绍的是完整的协议以及使用 NdeI 收集的数据示例数据。作为如何应用该技术的一个例子,一系列蛋白质浓度的裂解率以镁的两种不同浓度(一种重要的金属辅助因子)进行测量。虽然该协议的这种应用使用NdeI,但该方法可以通过改变DNA基板设计,适用于任何场内特异性核酸酶。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. 制作流动细胞
- 清洗盖玻片
- 将盖玻片放在染色罐中,用乙醇 (EtOH) 进行声波处理,然后用 1 M KOH(每个 30 分钟)。为避免在 EtOH 中出现 KOH 沉淀,在洗涤之间用 ddH2O 彻底冲洗。
- 重复 EtOH 和 KOH 洗涤步骤 1x,总共洗涤四次(两次 EtOH 和两次 KOH)。将清洁的盖玻片存放在 ddH2O 中染色罐中。
- 使用干净的剃须刀切割装载和退出管(8 厘米长),并插入干净的玻璃滑梯中的孔中。使用PE-20作为入口,使用PE-60作为出口。环氧树脂 5 分钟,用于固定管材并修剪掉任何多余的管材。
注:玻璃滑梯测量 2'' x 3' x 1 mm。孔钻成15毫米的对。每对形成单个通道的任一端。带较小 ID 的油管用于入口,因为这样可以减少上游死体积,从而缩短所需的混合时间(图 1)。 - 将预切双面胶带与通道图案切割在玻璃幻灯片上的孔上进行排队和应用。用塑料钳子平滑,实现良好的密封。
注:本实验中使用的双面胶带厚度为120 μm,通道宽2毫米,长15毫米。通道是使用刀打印机切割的(材料表)。在单个盖玻片上最多可以安装四个通道。有关 流单元格的图像 ,请参阅图 1。 - 剥落背衬后,在胶带上涂抹干净的盖玻片(用压缩空气干燥),然后用塑料钳子再次平滑,以获得良好的密封。
- 环氧树脂边缘关闭盖玻片密封流动细胞,让它固化。
2. 准备标记DNA进行系绳
- 在PCR管中,制备含有0.02 U/μL高保真DNA聚合酶、200μM dNTPs、0.5 μM前向底材、0.5μM反向底材和250 ng的M13mp18载体DNA的PCR反应混合物。
注:在这里,选择前底像(生物素-CCAACTTAATCGCCTTGC)和反向底土(二恶八八(二恶八八)放大一个约1,000bp长的区域,从M13mp18DNA的圆形基因组中的位置6338到107。放大区域中间有一个 NdeI 站点。正向底5ʹ标有二恶名宁,将抗二恶名宁绑在盖玻片上。反向底5ʹ生物素,与链球菌涂层的珠子结合。 - 将 PCR 管插入热循环器中,然后按照循环进行,如 表 1 所示。
- 按照制造商的协议使用 PCR 清理套件净化 PCR 产品。
注:使用材料表中 指定的试剂盒,典型的DNA产量为±2μg。
3. DNA和珠子的束缚
- 准备10 mL的缓冲器A(1 M Tris-HCl [pH = 7.5],50 mM NaCl,2 mM MgCl2, 1 mg/mL β-卡辛,1毫克/mL普鲁里尼奇F-127)。真空干燥器中的脱气至少 1 小时。
- 要使流细胞功能化,在PBS中注入25μL的抗二恶英FAB片段(20μg/mL)。使用凝胶加载技巧,以适合PE-60管。在室温(RT)下孵育30分钟。
- 孵育后,使用注射器将0.5 mL缓冲器 A 拉过通道,冲洗通道。注意不要将空气引入通道。
- 功能化后,将流动细胞安装在倒置的显微镜上。将出口管连接到注射器泵,将进气管放入含有缓冲液 A 的微离心管中。
- 手动拉取至少 0.5 mL 的缓冲器 A 以冲洗系统并给泵提供压力。让泵以 10 μL/min 运行至少 5 分钟,使系统平衡。
- 要将珠子(材料表)制备,将10mg/mL库存珠的1.6μL的储存瓶和移液器漩涡制备成50μL的缓冲器 A,然后涡流。
- 使用磁性分离器,移液器出缓冲液,然后重新悬浮在50μL的缓冲器 A 中,然后涡流。
- 重复步骤 3.7 2x,总共洗三次。对于最后一次洗涤,重新在100μL的缓冲液 A和涡流中,以达到160μg/mL的最终浓度。
- 为了将DNA和珠子进行复合,首先在缓冲液 A 中制备 480 μL 的 0.5 pM 标记 DNA 基质。然后,移液器在20μL的160μg/mL珠子悬浮,确保在移液前旋转珠子。放在旋转器上 3 分钟。
- 3 分钟后,立即以 10 μL/min 的流量加载到通道中,时间为 ±15 分钟,或直到观察到足够的珠子系绳。
注:珠子不应如此密集,以致于它们表面上相互交互(参见讨论部分)。 - 要清洗所有自由珠的通道,请将进气管切换到缓冲器 A 的新鲜管,并在 50 μL / min 入至少 10 分钟,或直到未观察到松动的珠子。
4. 数据收集和分析
- 为准备数据收集,将进气管放入缓冲器 A 中至少含有 100 μL NdeI (0.25±4.00 U/mL) 的微离心管中。
注:在数据收集过程中,使用悬臂光学柱将两个环形稀土磁铁(环氧树脂)聚集在一起,在流道的有源表面上方8毫米。鹅颈灯用于轴外灯课程。 - 使用商业显微镜、摄像机和数据收集软件(材料表)。 在软件中,单击"曝光"选项卡,将"曝光时间"设置为10 ms。单击"延时"选项卡,将"图像计数"设置为 600,"持续时间"设置为 20 分钟,将"间隔"设置为 2 秒。单击"运行"以开始数据收集。
- 在注射器泵上,将流量设置为 150 μL/min,将注射量设置为 80 μL。Run喷射后,关闭泵并关闭阀门,以防止数据收集过程中出现流量。
- 收集数据后,打开图像分析软件(材料表)。在 "文件"选项卡下,选择 "导入" | [图像序列]。在弹出式菜单中找到图像文件,然后单击"打开"。
- 在"图像"下拉菜单下选择"调整位置"来设置阈值。使用滑块条设置阈值,以识别与图像中的珠子对应的亮点。
- 单击"分析"下拉菜单中的"分析粒子"来计算每一帧的亮点。单击 "确定",然后选择"是"来处理所有图像。保存结果文件。
注意:这将保存一个数据文件,其中包含每个录制的视频帧中的珠数。 - 打开数据分析软件(材料表),通过点击"文件"下拉菜单中的"从文本文件导入"导入结果文件。绘制珠子计数数据与时间。
- 单击"分析"下拉菜单中的"曲线拟合",以适合珠子数量与时间。选择 [自然指数] 方程, 然后单击 [尝试适合]""好的".
注:仅应将样品喷射后记录的数据包含在拟合区域中。拟合函数指数中的拟合参数将是裂解率。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
利用这项技术,测量了两种不同浓度镁(2 mM 和 4 mM)的一系列蛋白质浓度(0.25~4.00 U/mL)的 NdeI SSDC 速率。每个条件至少复制两次,每个实验有几百到 1,000 个系绳 DNA。 图 2 描述了实验设计。 图 3 显示了数据收集和分析详细信息的示例。 图4 说明了该速率如何取决于两种镁浓度的蛋白质浓度。可以观察到,在足够低的蛋白质浓度下,该速率与蛋白质成正比,与镁无关。对于足够高的蛋白质浓度,该速率取决于镁,但独立于蛋白质浓度。
| 步 | 描述 | 温度 (°C) | 时间 |
| 1 | 变性 | 98 | 30 |
| 2 | 融化 | 98 | 10 |
| 3 | 退火 | 60 | 30 |
| 4 | 扩展 | 72 | 30 |
| 5 | 最终扩展 | 72 | 120 |
表 1:PCR 参数。 所示为协议步骤 2.2 中使用的热循环程序步骤的温度和持续时间。熔体、退火和扩展步骤(步骤 2、3 和 4)重复 30 倍。
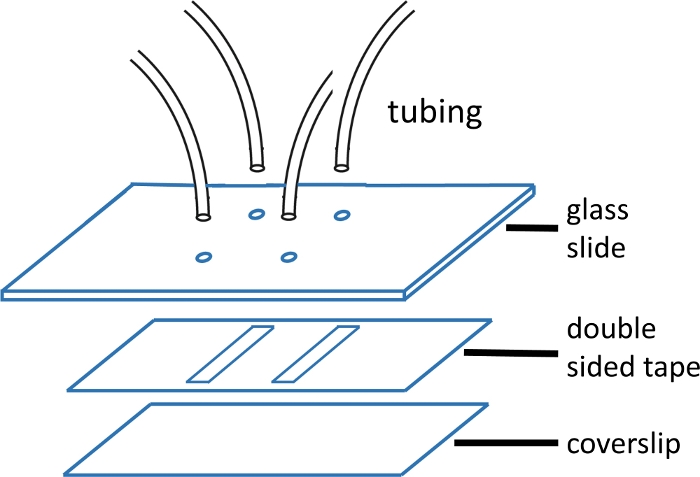
图1:微流体流动细胞结构。
顶部玻璃滑梯(2'' x 3',1 mm 厚)预钻,并预钻孔,与通道图案相匹配。进气管和出口管插入孔中,在连接胶带和盖玻璃之前用环氧树脂固定。双面胶带使用通道图案预切割。底部幻灯片(#1或 #1.5 盖玻璃)以前使用主文本中描述的协议进行清洁。组装后,盖玻璃的边缘用环氧树脂密封。 请单击此处查看此图的较大版本。

图2:实验设计。
(A) DNA系绳的方法。双链DNA(1 kbp)标有二氧化基5ʹ端通过抗迪格西格宁-迪戈西格宁相互作用附着在流动细胞表面。DNA 3ʹ端,标有生物素,通过链球菌素-生物素相互作用附着在微珠上。NdeI 裂解位点位于 DNA 的中心。(B) 在显示磁体和客观位置的数据收集过程中进行实验设置。在裂解反应期间,永磁体在珠子上保持微弱的向上力。 请单击此处查看此图的较大版本。
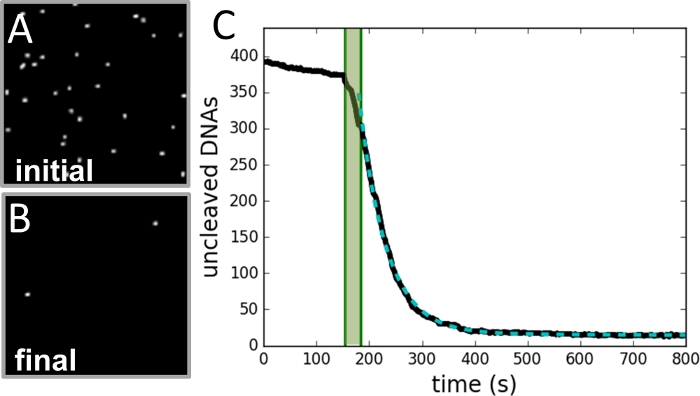
图3:数据收集和分析示例。
(A) 在开始分裂反应之前拍摄的珠子区域图像。(B) 反应完成后同一区域的图像。(C) 从视频记录的每一帧确定的珠子数与时间(黑色曲线)的绘图。阴影绿色区域标志着酶的注射周期,不包括在拟合中。数据拟合单个指数曲线(虚线绿色曲线),衰减常数等于反应速率。 请单击此处查看此图的较大版本。

图4:NdeI裂解取决于蛋白质和镁的浓度。
测量的 NdeI SSDC 速率图,用于两种不同浓度镁的蛋白质浓度:2 mM(蓝色圆圈)和 4 mM(绿色正方形)。错误栏表示 SEM。虚线曲线是趋势线,不代表符合理论。 请单击此处查看此图的较大版本。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
该协议可用于测量任何SSDC系统的动力学,前提是在实验中观察到链分离。通过观察系绳珠的分离而影响裂解的检测,因此标志着链分离的瞬间。所有上述步骤都发生在检测到裂痕之前;因此,只记录总的运输时间。
流细胞盖玻片通过抗体蛋白对清洁玻璃的非特异性吸附功能化。清洁不足的玻璃可能会影响抗体的结合。在系绳中,珠子密度应足够低,以便珠子不相互作用。附件点的表面密度可以通过抗体在功能化过程中浓度控制。珠子的总数取决于视场的大小。在这种情况下,几百到1000个系绳珠足以进行良好的统计,并避免了珠珠相互作用。在珠子喷射过程中,通过实时视频监控表面系绳。当估计珠数在 500 到 1,000 珠之间时,珠子注射停止。
可准确测量的最快裂解速率受流细胞混合时间限制。层流细胞的混合时间受多种因素的影响。扩散到表面是关键步骤;因此,混合时间取决于反应物的扩散系数。入口管中发生的显著剪切,将样品从样品储液罐运送到流通道,可增加所需时间,以确保在通道中的反应表面进行充分混合。研究发现,通过减少上游死体积和增加流速,可以缩短混合时间。入口管的内径为380μm,最大长度为8厘米(流量为150μL/min),可将注射时间缩短至±20秒,而不影响测量的裂解率。由于混合时间取决于反应物的扩散系数,因此应分别确定所研究的每种酶或裂解活化剂。
系绳方法允许非特异性系绳破裂,大概是由于二恶原抗体复合物分离或抗体从表面释放。这导致在注射+3 x10-4 s-1 酶之前存在可重复的背景珠损耗率。可以通过从测量的裂解率中减去背景速率,或通过对拟合方程中的背景进行建模来纠正这种系统效应。然而,低于此下限的裂解率将不太可靠。
不完美的表面钝化可能导致不正确的系绳。这要么导致"卡住"珠子的分数增加,在实验the过程中不会消失,要么导致将珠子固定不当,这些珠子与表面分离得非常缓慢。这将在已处理的数据中创建更高且可能倾斜的基线。研究发现,使用正确清洁的盖板和新鲜β卡芬库存解决方案,这些效果对大多数数据集的影响最小。对于显示此值的偶发数据集,修改拟合函数(以包括倾斜基线)可以更正此效果。
可以通过多种方式扩展当前协议。靶点结合后进一步分离机械步骤,可以使用预结合格式执行,在缺乏基本辅助因子的情况下注射蛋白质。这个想法在缺乏镁的情况下通过注射 NdeI 进行测试。在这些条件下,蛋白质结合到其同源位点,但不会切割DNA。 在此结合步骤后注入 镁激活 裂解,导致快速珠子损失。实验设置还允许通过改变磁铁配置或添加流量来控制DNA构象和张力。在这些实验中的低力下,DNA变得部分盘绕。稍微改变力对DNA的构象有戏剧性的影响。例如,在目标搜索是速率限制的缓冲区条件下,改变DNA的构象可以测试跳跃对目标搜索的影响。在水解步骤速率限制的缓冲条件下,变化力可以探寻DNA张力对磷酸二酯键水解的影响。应当指出,在使用的低放大倍率下,这些构象变化是无法观察到的。珠子位置产生的小运动必须以较高的放大率进行跟踪,以验证DNA构象可以控制。
数据分析可以通过多种方式进行扩展。此工作应用简单的珠子计数方法,然后是单个指数函数的曲线拟合。基于居住时间分析的方法,以及20。然后,可以通过曲线拟合或使用更复杂的技术(如时刻21的通用方法)分析单个DNA的居住时间分布。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
作者没有利益冲突要披露。
Acknowledgments
这项工作得到了国家科学基金会资助MCB-1715317。
Materials
| Name | Company | Catalog Number | Comments |
| 5 minute Epoxy | Devcon | 14250 | |
| anti-digoxigenin FAB fragments | Roche Diagnostics | 11214667001 | |
| camera and software | Jenoptik | GRYPHAX SUBRA | |
| data analysis software | Vernier Inc. | LP | |
| double sided tape | Grace Biolabs | SA-S-1L | |
| Dulbeccos Phosphate Buffered Saline | Corning | 21-031-CV | |
| ethanol 95% | VWR | 89370-082 | |
| forward primer: digoxigenin-CCAACTTAATCGCCTTGC | Integrated DNA Technologies | n/a | |
| image analysis software | National Institutes of Health | ImageJ | |
| inverted microscope | Nikon | TE2000 | |
| knife printer | Silhouette | ||
| M13mp18 DNA | New England Biolabs | N4040S | |
| MyOne streptavidin beads | Thermo Fisher Scientific | 65601 | |
| NdeI enzyme | New England Biolabs | R0111S | |
| PCR cleanup kit | Qiagen | 28104 | |
| pluronic F-127 | Anatrace | P305 | |
| polyethylene tubing PE-20 | BD Intramedic | 427406 | |
| polyethylene tubing PE-60 | BD Intramedic | 427416 | |
| Q5 Mastermix | New England Biolabs | M0492S | |
| rare earth magnet 0.5" OD 0.25" ID | National Imports | NSN0814 | |
| rare earth magnet 0.75" OD 0.5" ID | National Imports | NSN0615 | |
| reverse primer: biotin-TGACCATTAGATACATTTCGC | Integrated DNA Technologies | n/a | |
| syringe pump | Kent Scientific | Genie Plus | |
| β-Casein from bovine Milk | Sigma-Aldrich | C6905 |
References
- Tock, M. R., Dryden, D. T. The biology of restriction and anti-restriction. Current Opinion in Microbiology. 8 (4), 466-472 (2005).
- Garneau, J. E., et al. The CRISPR/Cas bacterial immune system cleaves bacteriophage and plasmid DNA. Nature. 468 (7320), 67-71 (2010).
- Pingoud, A., Fuxreiter, M., Pingoud, V., Wende, W. Type II restriction endonucleases: structure and mechanism. Cellular and Molecular Life Sciences. 62 (6), 685-707 (2005).
- Sternberg, S. H., Redding, S., Jinek, M., Greene, E. C., Doudna, J. A. DNA interrogation by the CRISPR RNA-guided endonuclease Cas9. Nature. 507 (7490), 62-67 (2014).
- Sadowski, P. D. Site-specific genetic recombination: hops, flips, and flops. The FASEB Journal. 7 (9), 760-767 (1993).
- Schatz, D. G. Antigen receptor genes and the evolution of a recombinase. Seminars in Immunology. 16 (4), 245-256 (2004).
- Craig, N. L. Tn7: a target site-specific transposon. Molecular Microbiology. 5 (11), 2569-2573 (1991).
- Gori, J. L., et al. Delivery and Specificity of CRISPR/Cas9 Genome Editing Technologies for Human Gene Therapy. Human Gene Therapy. 26 (7), 443-451 (2015).
- Urnov, F. D., Rebar, E. J., Holmes, M. C., Zhang, H. S., Gregory, P. D. Genome editing with engineered zinc finger nucleases. Nature Reviews Genetics. 11 (9), 636-646 (2010).
- Joung, J. K., Sander, J. D. TALENs: a widely applicable technology for targeted genome editing. Nature Reviews Molecular Cell Biology. 14 (1), 49-55 (2013).
- Alves, J., Urbanke, C., Fliess, A., Maass, G., Pingoud, A. Fluorescence stopped-flow kinetics of the cleavage of synthetic oligodeoxynucleotides by the EcoRI restriction endonuclease. Biochemistry. 28 (19), 7879-7888 (1989).
- Deng, J., Jin, Y., Chen, G., Wang, L. Label-free fluorescent assay for real-time monitoring site-specific DNA cleavage by EcoRI endonuclease. Analyst. 137 (7), 1713-1717 (2012).
- Becker, W. R., et al. High-throughput analysis reveals rules for target RNA binding and cleavage by AGO2. Molecular Cell. 75 (4), 741-755 (2019).
- vanden Broek, B., Lomholt, M. A., Kalisch, S. M., Metzler, R., Wuite, G. J. How DNA coiling enhances target localization by proteins. Proceedings of the National Academy of Sciences. 105 (41), 15738-15742 (2008).
- Gambino, S., et al. A single molecule assay for measuring site-specific DNA cleavage. Analytical Biochemistry. 495, 3-5 (2016).
- Jones, N. D., et al. Retroviral intasomes search for a target DNA by 1D diffusion which rarely results in integration. Nature Communications. 7, 11409 (2016).
- van Aelst, K., et al. Type III restriction enzymes cleave DNA by long-range interaction between sites in both head-to-head and tail-to-tail inverted repeat. Proceedings of the National Academy of Sciences. 107 (20), 9123-9128 (2010).
- Williams, K., et al. A single molecule DNA flow stretching microscope for undergraduates. American Journal of Physics. 79 (11), 1112-1120 (2011).
- Song, D., et al. Tethered particle motion with single DNA molecules. American Journal of Physics. 83 (5), 418-426 (2015).
- Etson, C. M., Todorov, P., Walt, D. R. Elucidating Restriction Endonucleases Reaction Mechanisms via Dwell-Time Distribution Analysis. Biophys Journal. 106 (2), 22 (2014).
- Piatt, S., Price, A. C. Analyzing dwell times with the Generalized Method of Moments. PLoS One. 14 (1), 0197726 (2019).



