14.5: حاصل قسمة التفاعل
يتم تقييم حالة التفاعل القابل للعكس بشكل ملائم من خلال تقييم حاصل قسمة التفاعل (Q. بالنسبة إلى رد الفعل القابل للعكس الموضح بواسطة m A + n B ⇌ x C + y D، حاصل قسمة التفاعل مشتق مباشرة من قياس العناصر المتوازنة للمعادلة المتوازنة مثل
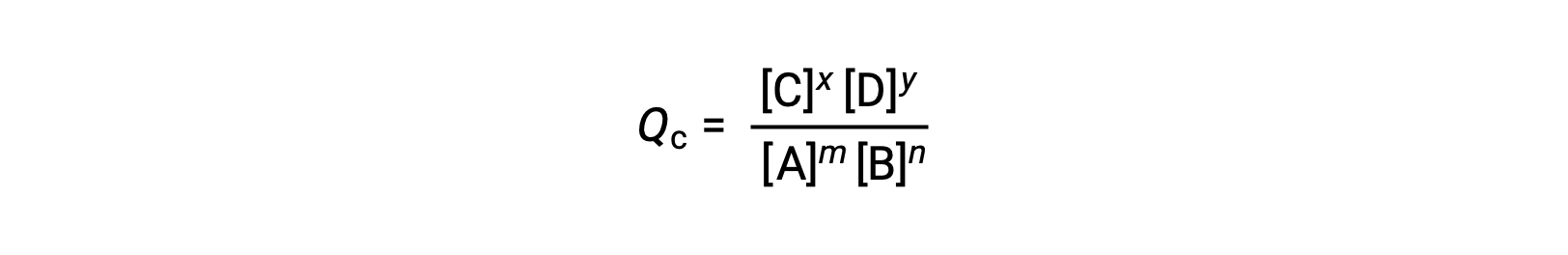
حيث يشير الرمز السفلي c إلى استخدام التركيزات المولية في التعبير. إذا كانت المواد المتفاعلة والمنتجات غازية ، فيمكن اشتقاق حاصل التفاعل بالمثل باستخدام الضغوط الجزئية:
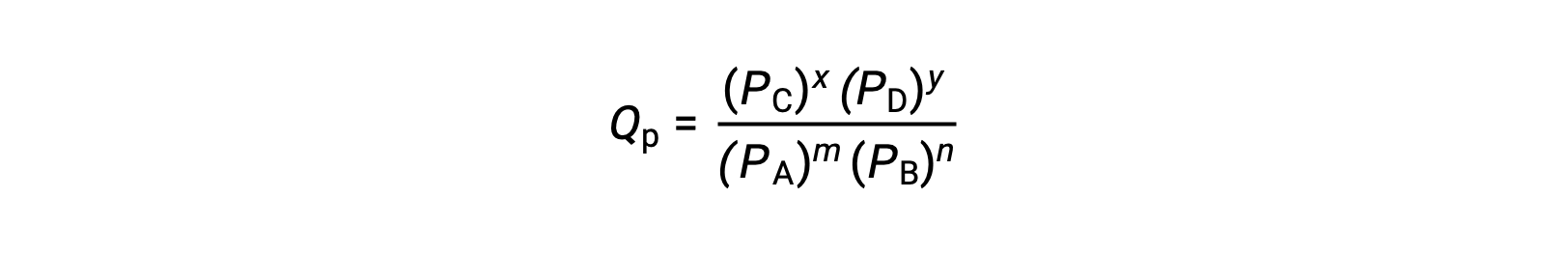
لاحظ أن معادلات حاصل رد الفعل أعلاه هي تبسيط لتعبيرات أكثر صرامة تستخدم قيمًا نسبية للتركيزات والضغوط بدلاً من القيم المطلقة. قيم التركيز والضغط النسبية هذه بلا أبعاد (لا تحتوي على وحدات) ؛ وبالتالي ، كذلك حاصل قسمة التفاعل.
تختلف القيمة العددية لـ Q مع تقدم التفاعل نحو التوازن ؛ لذلك ، يمكن أن يكون بمثابة مؤشر مفيد لحالة التفاعل’. لتوضيح هذه النقطة ، ضع في اعتبارك أكسدة ثاني أكسيد الكبريت:
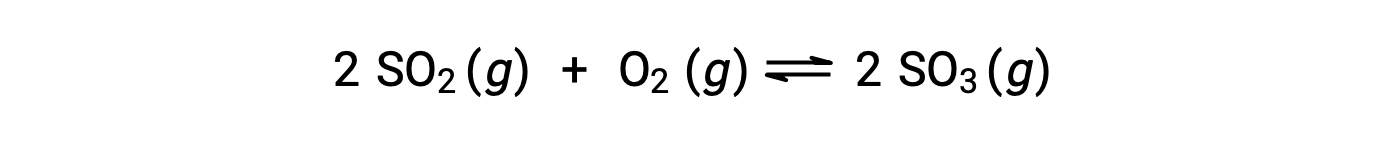
هناك سيناريوهان تجريبيان مختلفان ممكنان هنا ، أحدهما يبدأ فيه هذا التفاعل بمزيج من المواد المتفاعلة فقط ، SO2 و O2، والآخر يبدأ بـ المنتج الوحيد ، SO3. بالنسبة للتفاعل الذي يبدأ بخليط من المواد المتفاعلة فقط ، فإن Q تساوي في البداية صفرًا:
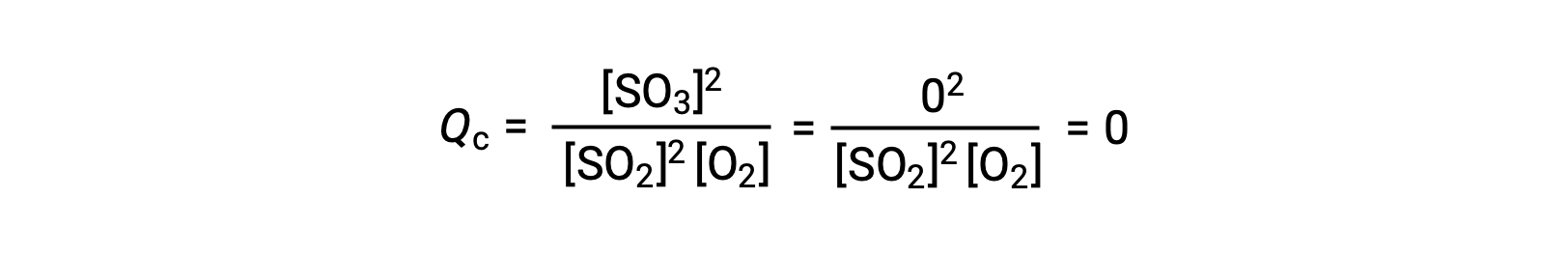
مع تقدم التفاعل نحو التوازن في الاتجاه الأمامي ، تنخفض تركيزات المادة المتفاعلة (كما يفعل مقام Qc) ، ويزداد تركيز المنتج (كما يفعل بسط Qc) ، وبالتالي يزيد حاصل التفاعل. عند تحقيق التوازن، تظل تركيزات المواد المتفاعلة والمنتج ثابتة، كما هو الحال مع قيمة Q c .
إذا بدأ التفاعل مع وجود المنتج فقط ، فإن قيمة Qc تكون في البداية غير محددة (كبيرة بشكل لا يقاس ، أو لانهائية):
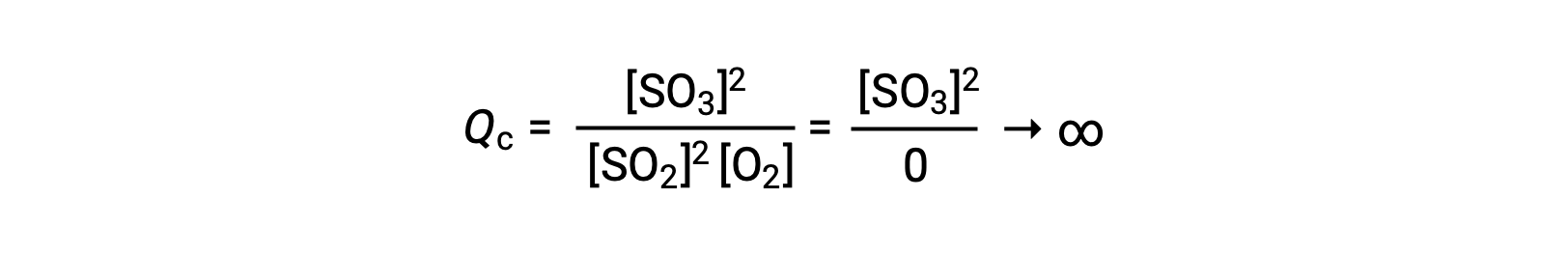
في هذه الحالة ، يتقدم التفاعل نحو التوازن في الاتجاه العكسي. تركيز منتج وبسط Qc يتناقصان بمرور الوقت ، وتركيزات المادة المتفاعلة ومقام Qc يزداد، وبالتالي ينخفض حاصل قسمة التفاعل حتى يصبح ثابتًا عند التوازن. تسمى القيمة الثابتة لـ Q التي يعرضها نظام عند التوازن بثابت التوازن ، K:
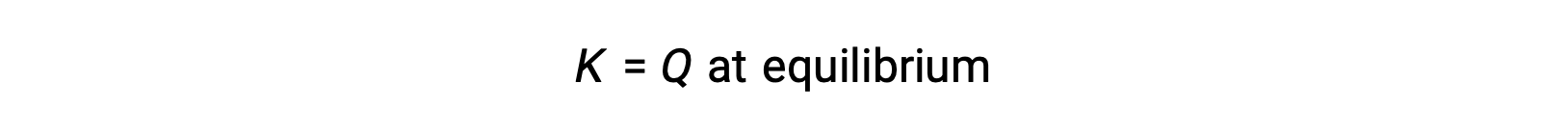
تقييم حاصل قسمة التفاعل
يشكل ثاني أكسيد النيتروجين الغازي رباعي أكسيد ثنائي النيتروجين وفقًا لهذه المعادلة:
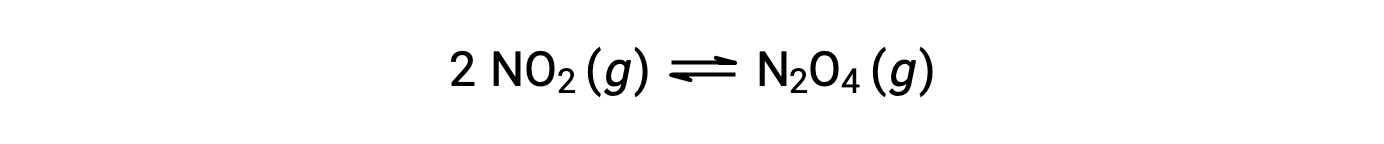
عند إضافة 0.10 مول NO2 إلى دورق سعة 1.0 لتر عند 25 °C، يتغير التركيز بحيث عند التوازن ، [NO2] = 0.016 M و [N2 O 4] = 0.042 M. قبل تكوين أي منتج ، [NO2] = 0.10 M و [ N 2O4] = 0 M. وهكذا ،
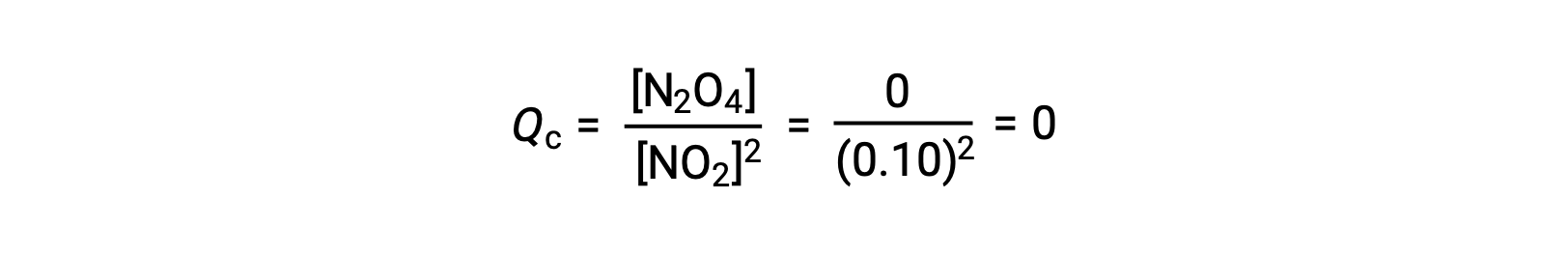
في حالة التوازن ،
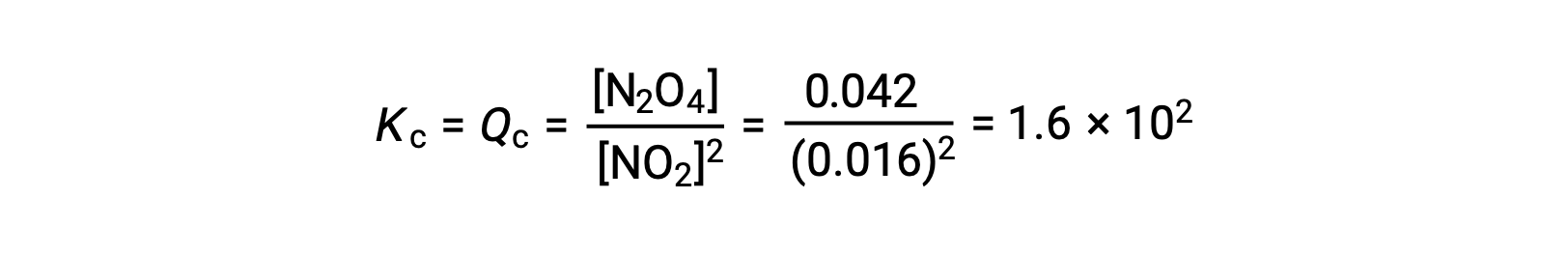
تم اقتباس هذا النص من Openstax, Chemistry 2e, Section 13.2 Equilibrium Constants.


