13.10: Passos Determinantes da Velocidade
Relacionamento de Mecanismos de Reação
Em um mecanismo de reação multipassos, um dos passos elementares progride de forma significativamente mais lenta do que os outros. Este passo mais lento é designado por passo de limitação da velocidade (ou passo de determinação da velocidade). Uma reação não pode avançar mais rapidamente do que o seu passo mais lento e, por conseguinte, o passo que determina a velocidade limita a velocidade geral da reação.
O conceito de passo determinante da velocidade pode ser percebido a partir da analogia de uma auto-estrada de 4 faixas com uma curta parte de engarrafamento de trânsito causado pelo fecho de uma faixa. Tal como o engarrafamento que afeta a velocidade global a que os veículos poderiam circular, o passo elementar mais lento influencia a velocidade líquida da reação.
As leis de velocidade podem ser derivadas diretamente das equações químicas equilibradas para reações elementares. No entanto, este não é o caso da maioria das reações químicas, onde equações equilibradas representam frequentemente a mudança geral no sistema químico, resultante de mecanismos de reação multipassos. Por conseguinte, a lei da velocidade deve ser determinada a partir de dados experimentais e o mecanismo de reação deve ser posteriormente deduzido da lei da velocidade.
Por exemplo, considere a reação de NO2 e CO:
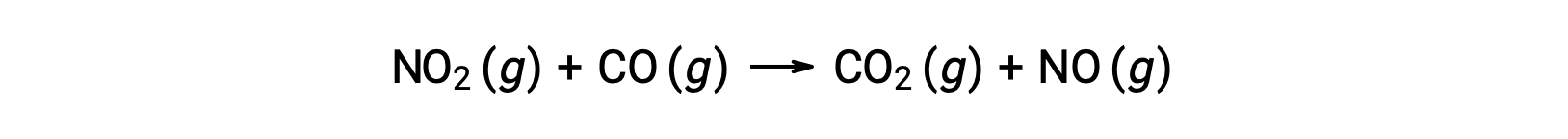
A lei experimental relativa a esta reação a temperaturas superiores a 225 °C é:
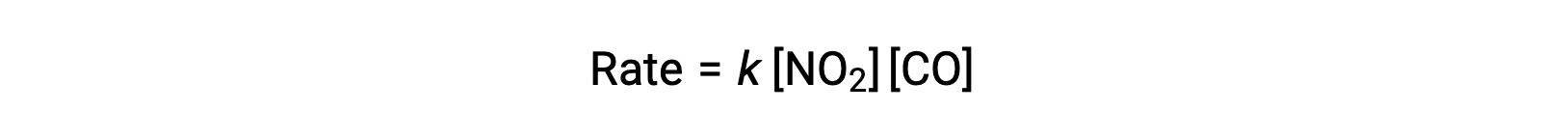
De acordo com a lei da velocidade, a reação é de primeira ordem no que diz respeito ao NO2 e de primeira ordem no que diz respeito ao CO. Isto é consistente com um mecanismo bimolecular de passo único, e é possível que este mecanismo de reação seja válido para este processo químico a altas temperaturas.
No entanto, a temperaturas inferiores a 225 °C, a reação é descrita por uma lei de velocidade diferente, que é de segunda ordem no que diz respeito ao NO2:
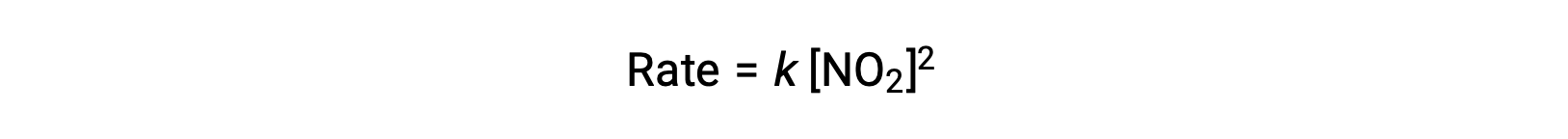
Esta lei de velocidade não é consistente com o mecanismo de passo único, mas é consistente com o seguinte mecanismo de dois passos:
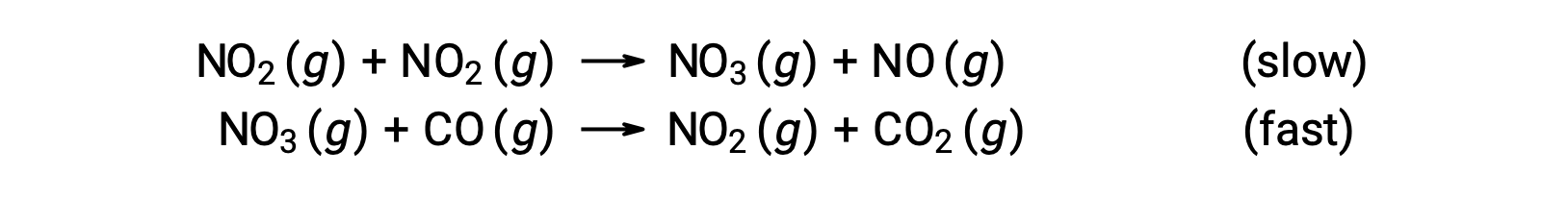
O passo de determinação de velocidade (mais lento) dá uma lei de velocidade que mostra dependência de segunda ordem na concentração de NO2, e a soma das duas equações elementares dá a reação líquida global.
No geral, quando o passo de determinação de velocidade (mais lento) é o primeiro passo no mecanismo de reação, a lei de velocidade para a reação geral é a mesma que a lei de velocidade para este passo. No entanto, quando o passo de determinação de velocidade é precedido por um passo elementar que envolve uma reação rapidamente reversível, a lei de velocidade para a reação geral pode ser mais difícil de derivar, muitas vezes devido à presença de intermediários de reação.
Nesses casos, pode ser utilizado o conceito de que uma reação reversível está em equilíbrio quando as velocidades dos processos direto e inverso são iguais.
Por exemplo, considere a reação elementar reversível em que NO dimeriza para produzir uma espécie intermediária N2O2. Quando esta reação está em equilíbrio:
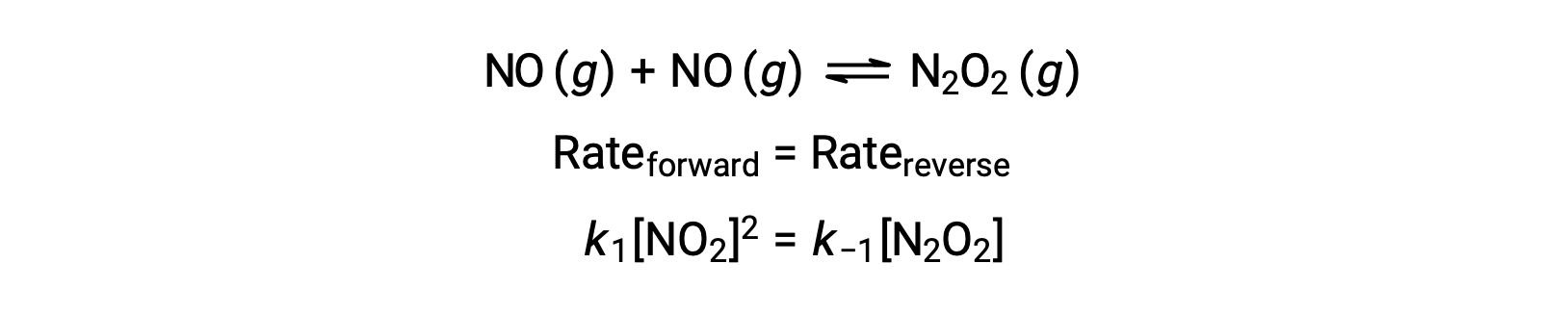
Esta expressão pode ser reorganizada para apresentar a concentração do intermediário em termos do reagente NO:
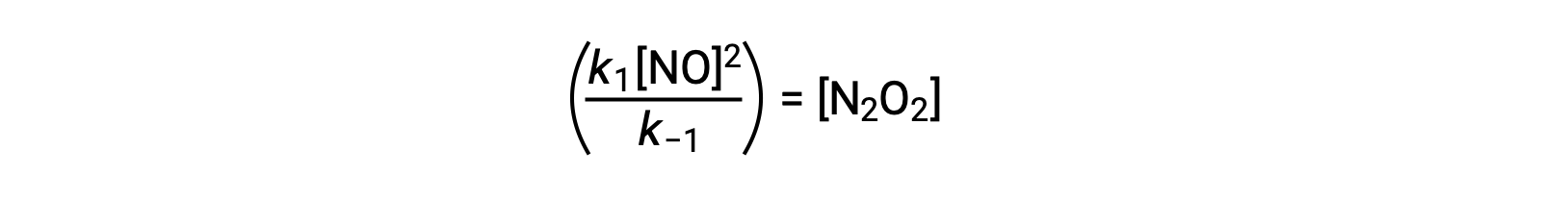
Esta abordagem pode ser utilizada na formulação de leis de velocidade para reações gerais quando estão presentes intermediários de reação.
Exemplo de Derivação de Lei de Velocidade de um Mecanismo de Reação
Considere uma reação entre o monóxido de azoto e o cloro molecular, para a qual é proposto um mecanismo de dois passos, como indicado:
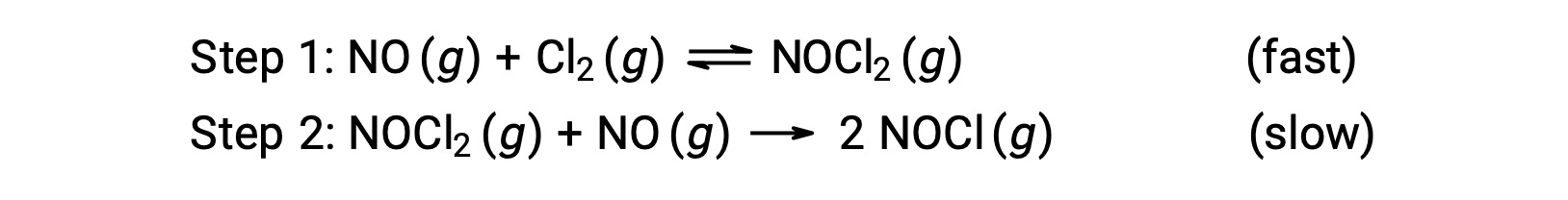
Este mecanismo pode ser usado para derivar a equação e prever a lei de velocidade para a reação geral. Inicialmente, adicionando as duas reações elementares, obtém-se a equação para a reação geral.
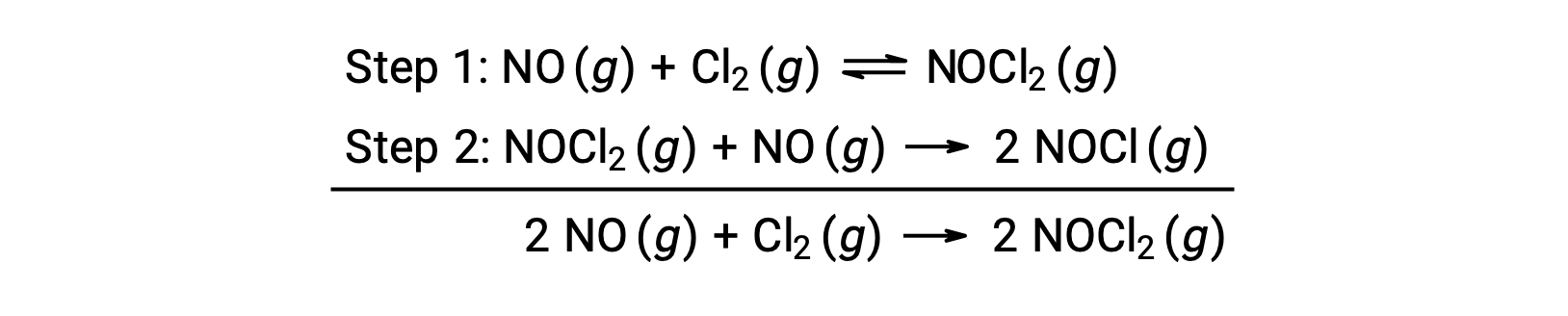
Para derivar uma lei de velocidade deste mecanismo, as leis de velocidade para cada um dos dois passos elementares são escritas:
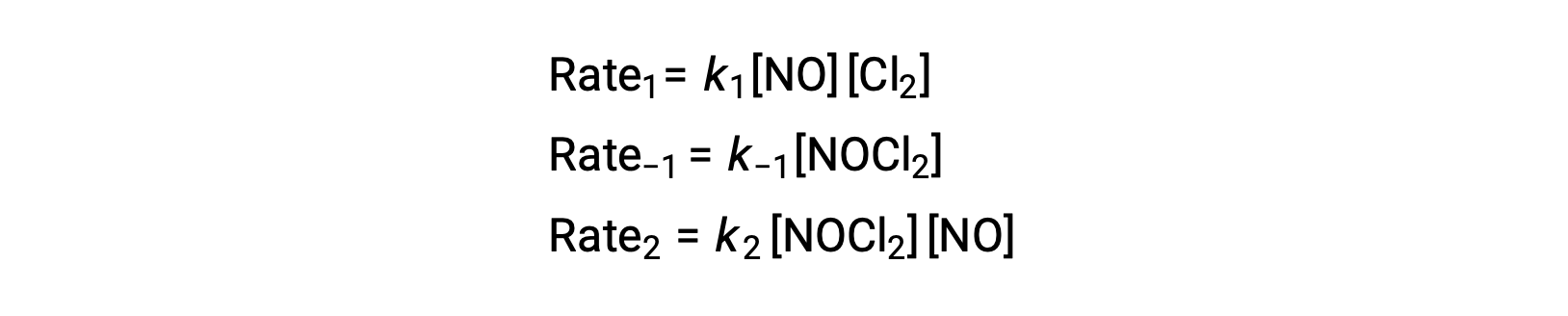
De acordo com o mecanismo de reação proposto, o Passo 2 é o passo determinante da velocidade. Assim, a lei de velocidade para a reação geral deve ser a mesma que a lei de velocidade para este passo elementar. No entanto, a lei de velocidade para o Passo 2 contém uma concentração de espécies intermediárias, [NOCl2]. Para modificar isso, a lei de velocidade do primeiro passo elementar é utilizada para obter uma expressão para a concentração intermédia em termos de concentrações de reagentes.
Assumindo que o Passo 1 está em equilíbrio;
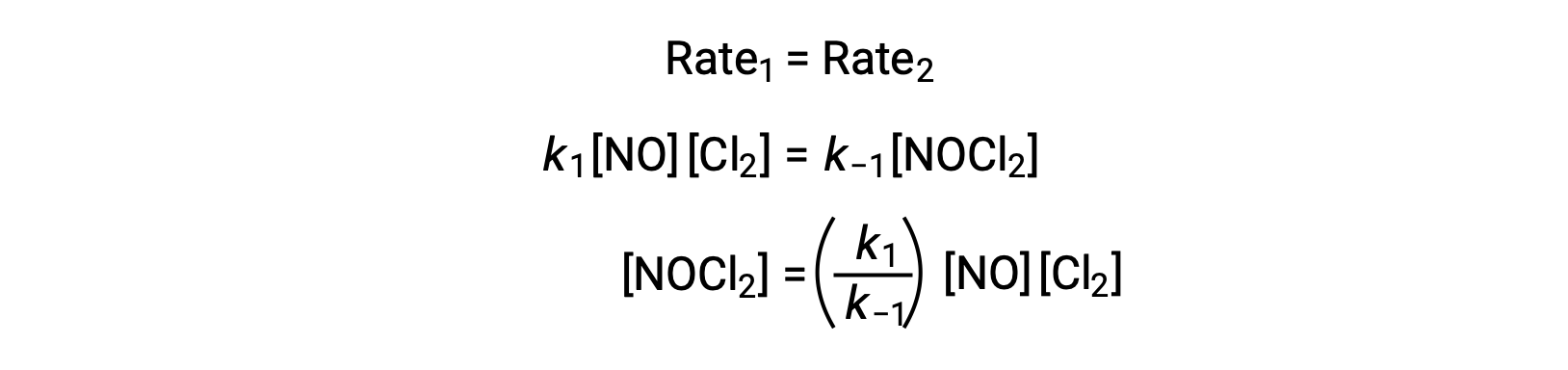
Substituindo esta expressão pela lei de velocidade para o Passo 2 obtemos:
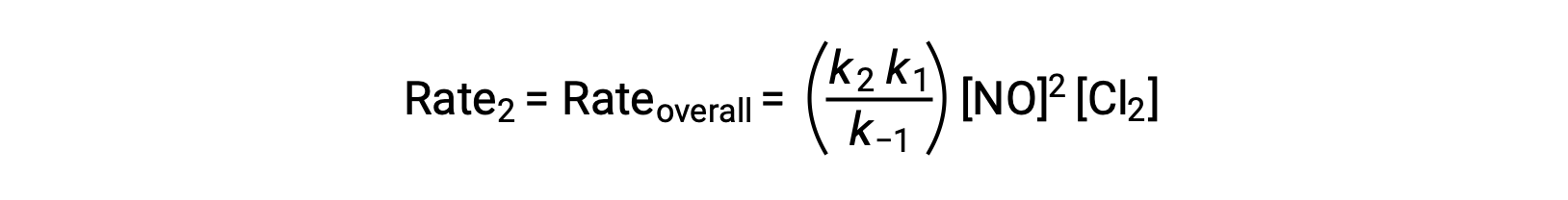
Este texto é adaptado de Openstax, Chemistry 2e, Section 12.6: Reaction Mechanisms.


