12.10: انحدار نقطة التجمّد وارتفاع نقطة الغليان
ارتفاع نقطة الغليان
نقطة غليان السائل هي درجة الحرارة التي يكون عندها ضغط بخاره مساوياً للضغط الجوي المحيط. نظراً لانخفاض ضغط بخار المحلول بسبب وجود مواد مذابة غير متطايرة ، فمن المنطقي زيادة نقطة غليان المحلول لاحقًا. يزداد ضغط البخار مع زيادة درجة الحرارة، وبالتالي سيتطلب المحلول درجة حرارة أعلى من المذيب النقي لتحقيق أي ضغط بخار معين، بما في ذلك ضغط مكافئ لضغط الهواء المحيط. الزيادة في نقطة الغليان التي لوحظت عند إذابة مادة مذابة غير متطايرة في مذيبΔ Tb، تسمى ارتفاع نقطة الغليان وتتناسب بشكل مباشر مع التركيز المولي للأنواع المذابة:
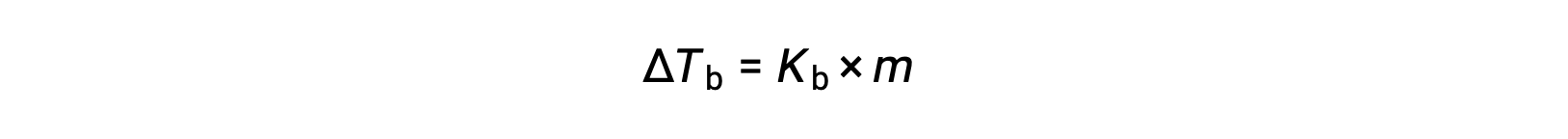
حيث Kb هو ثابت ارتفاع نقطة الغليان، أو ثابت إيبوليوسكوبي و m هو التركيز المولالي (مولاليتي) لجميع المواد المذابة محيط. ثوابت ارتفاع نقطة الغليان هي خصائص مميزة تعتمد على هوية المذيب.
انخفاض نقطة التجمد
تتجمد المحاليل عند درجات حرارة أقل من السوائل النقية. يتم استغلال هذه الظاهرة في وسائل “إزالة التجميد” التي تستخدم الملح أو كلوريد الكالسيوم أو اليوريا لإذابة الجليد على الطرق والأرصفة، وفي استخدام جلايكول الإيثيلين ك “مضاد للتجمد” في مشعات السيارات. تتجمد مياه البحر عند درجة حرارة أقل من درجة حرارة المياه العذبة، وبالتالي تظل محيطات القطب الشمالي والقطب الجنوبي غير مجمدة حتى في درجات حرارة أقل من 0 °C (مثل سوائل الأجسام عند الأسماك وغيرها من الحيوانات البحرية ذوات الدم البارد التي تعيش في هذه المحيطات).
يُطلق على تناقص نقطة التجمد لمحلول ما مخفّف مقارنةً بالمذيب النقي ΔTf بانخفاض نقطة التجمد وهو تناقص طردي يتناسب مع التركيز المولالي للمذاب
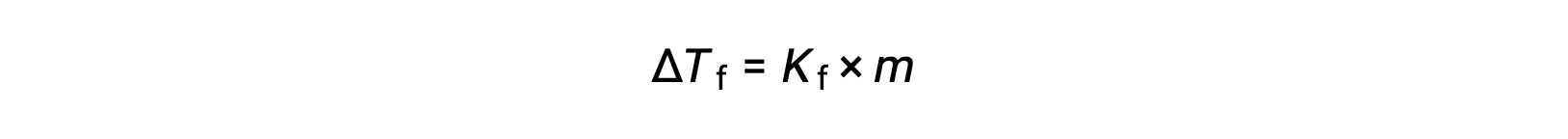
حيث m هو التركيز المولالي للمذاب و Kf يسمى ثابت انخفاض نقطة التجمد (أو ثابت التجميد). تماماً كما هو الحال بالنسبة لثوابت ارتفاع نقطة الغليان، فهذه خصائص مميزة تعتمد قيمها على الهوية الكيميائية للمذيب.
تحديد الكتل المولية
يتناسب الضغط الأسموزي والتغيرات في درجة التجمد ونقطة الغليان وضغط البخار بشكل طردي مع عدد الأنواع المذابة الموجودة في كمية معينة من المحلول. وبالتالي، فإن قياس إحدى هذه الخصائص لمحلول مُعد باستخدام كتلة معروفة من المذاب يسمح بتحديد الكتلة المولية للمذاب.
على سبيل المثال، محلول من 4.00 غ مكون من مركب غير إلكتروليت مذاب في 55.0 غ من البنزين ليتجمد عند 2.32 °C. بافتراض سلوك المحلول المثالي، ما الكتلة المولية لهذا المركب؟
لحل هذه المشكلة، أولاً، يتم حساب التغير في درجة التجمد من نقطة التجمد المرصودة ونقطة التجمد للبنزين النقي:
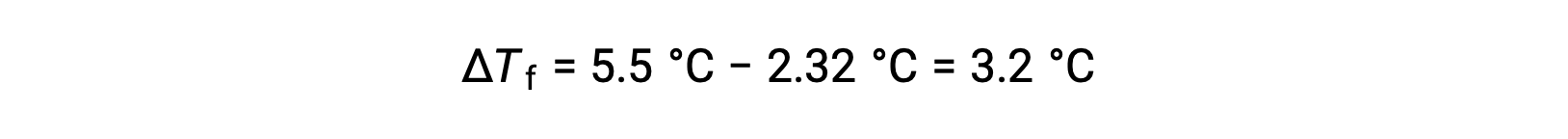
بعد ذلك، يتم تحديد التركيز المولالي من Kf، ثابت انخفاض نقطة التجمد للبنزين، و ΔTf:
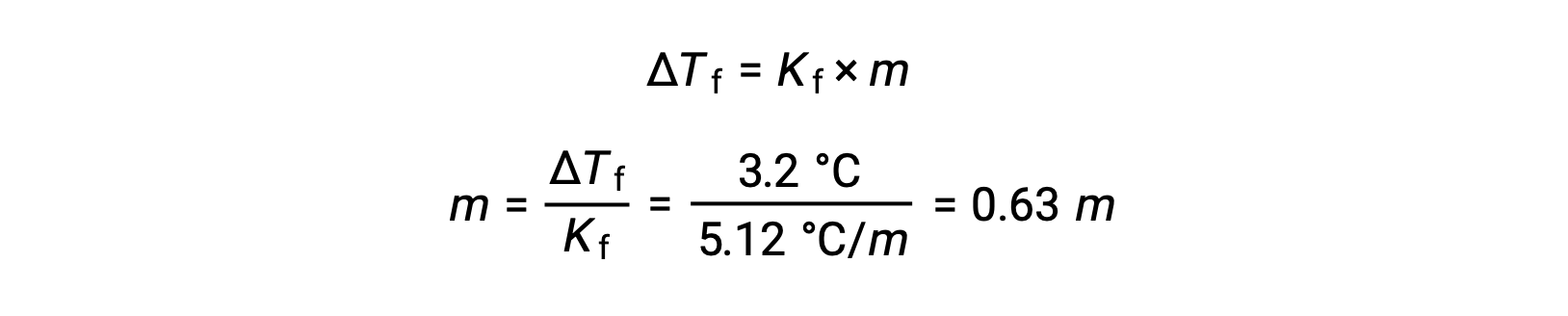
بعد ذلك، يتم حساب عدد مولات المركب في المحلول من التركيز المولالي وكتلة المذيب المستخدمة في صنع المحلول.
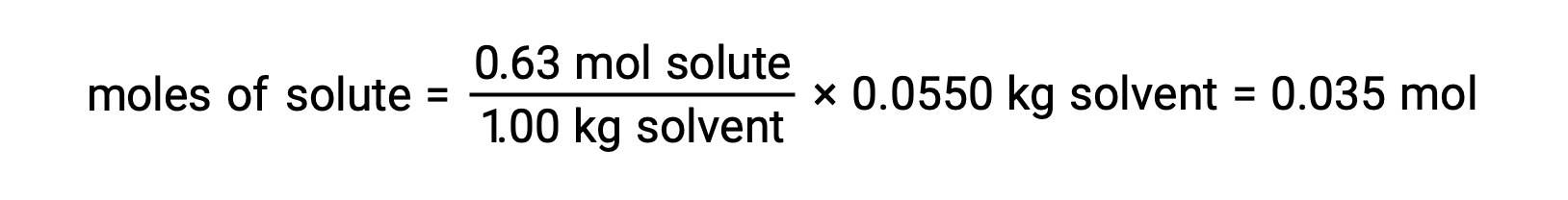
أخيراً، يتم تحديد الكتلة المولية من كتلة المذاب وعدد المولات في تلك الكتلة.
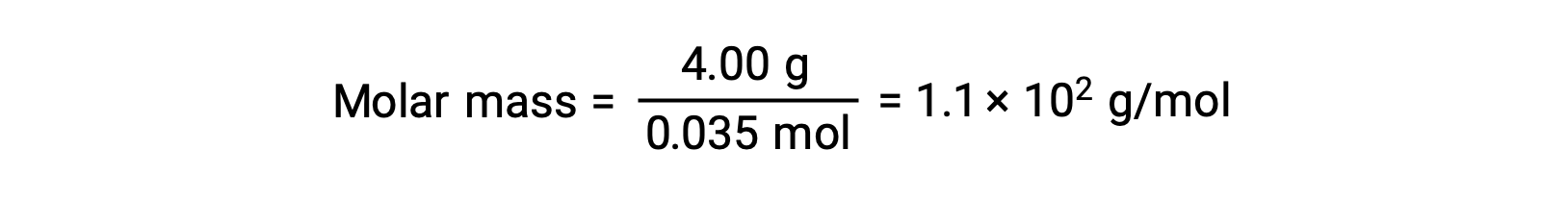
تم اقتباس هذا النص من Openstax, Chemistry 2e, Section 11.4: Colligative Properties.


