17.9: 非標準状態の自由エネルギーの変化
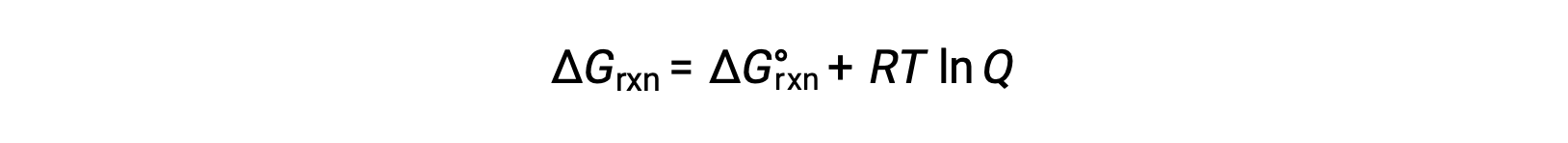
ここで、Rは気体定数(8.314 J/K·mol)、Tはケルビン単位の絶対温度、Qは反応商を表します。この式は、任意の条件下におけるある過程の自発性を予測するために使用されます。
反応商 (Q)
可逆反応における系の状態は、その反応商Qを計算することで簡単に知ることができます。下記のとおり記述される可逆反応に対して、
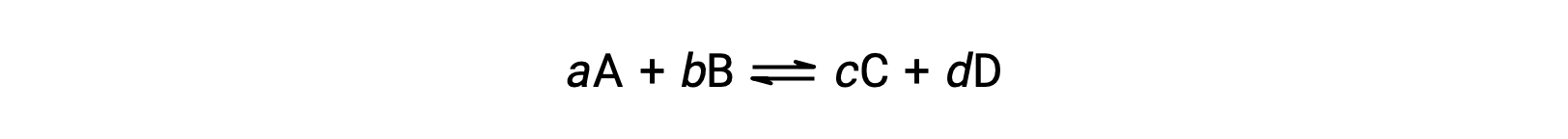
反応商は、平衡式の化学量論から次のように直接計算できます。
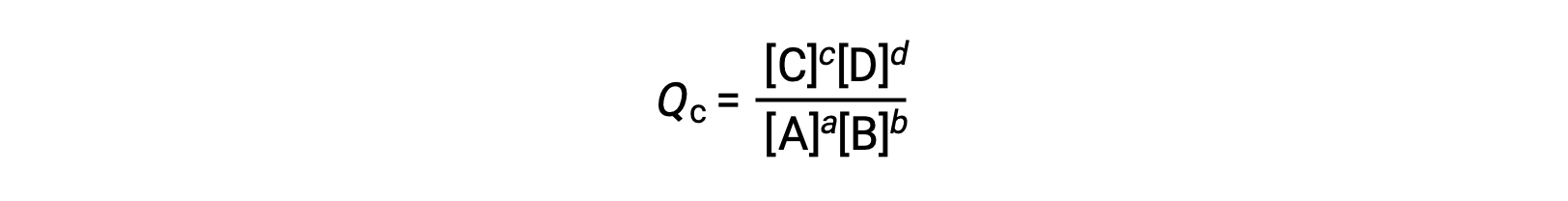
ここで、添字のcは式中でのモル濃度の使用を示します。凝縮相における平衡では、濃度に基づく反応商、Qcが用いられます。反応物と生成物が気体の場合は、分圧を用いて同様に反応商を計算することが出来ます。
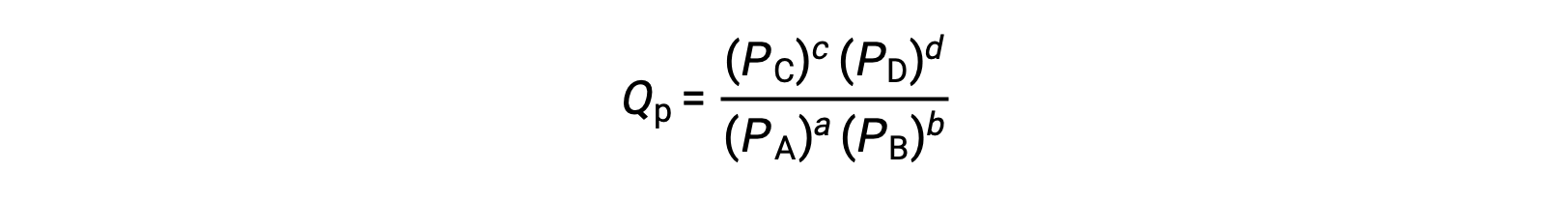
標準状態では、反応物と生成物の溶液濃度は1 mol/L、または気体の圧力は1 barであり、Qは1に等しいです。 したがって、標準状態では、
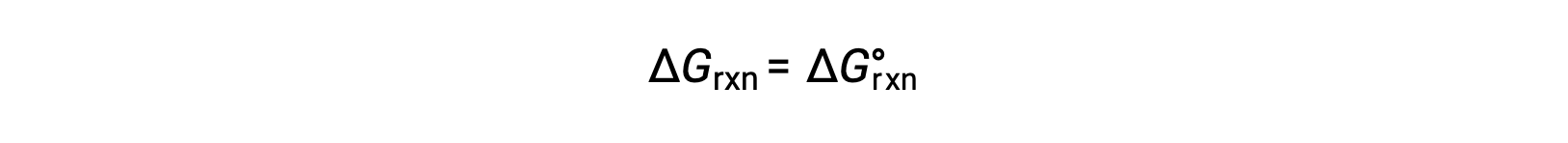
非標準条件では、Qを計算する必要があります。
Qの値は、反応が平衡に近づくにつれて変化するため、反応の状態を知る上で有用な指標となります。例えば、二酸化硫黄の酸化反応を考えよう。
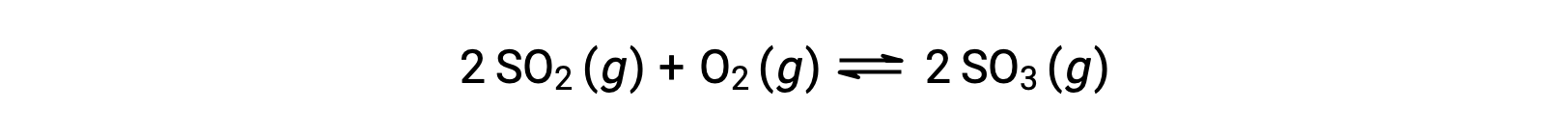
この反応を、反応物であるSO2とO2のみの混合物で開始する場合と、生成物であるSO3のみで開始する場合の2つの異なる実験を考えます。反応物の混合物のみから始まる反応では、Qは最初は0に等しいです。
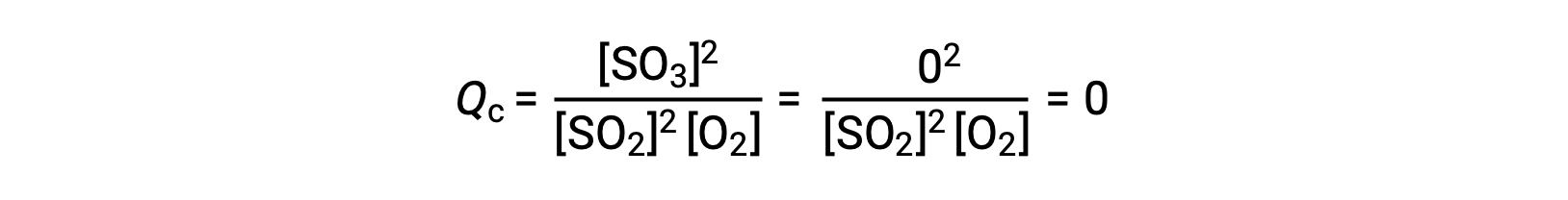
反応が平衡に向かって順方向に進むと、反応物の濃度は減少し(Qcの分母も同様に減少)、生成物の濃度は増加し(Qcの分子も同様に増加)、結果的に反応商は増加します。平衡状態になると、反応物と生成物の濃度は一定になり、Qcの値も一定となります。
Qcの値は、生成物だけが存在する状態で反応が始まった場合、最初は無限大です。 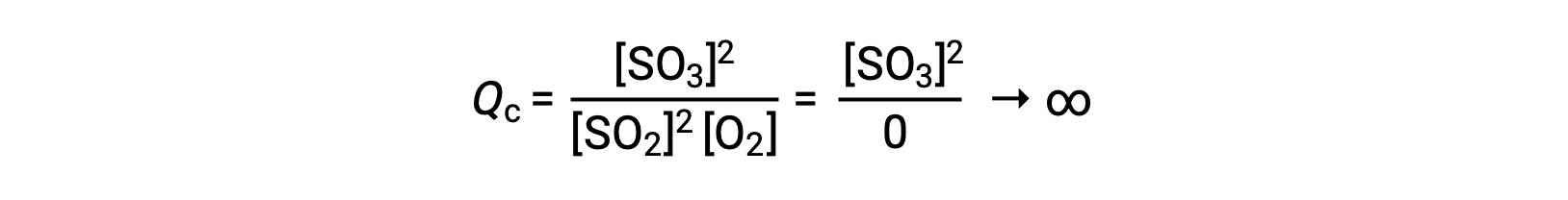
この場合、反応は逆方向に向かって進む。生成物の濃度とQcの分子は時間とともに減少し、それとともに反応物の濃度とQcの分母は増加します。その結果、反応商は平衡状態で一定になるまで減少します。
上記の文章は以下から引用しました。Openstax, Chemistry 2e, Chapter 16.4: Free Energy and Openstax, Chemistry 2e, Chapter 13.2: Equilibrium Constants.


