14.3: 気相反応及び不均一系反応の平衡
気相反応における均一系平衡
気相反応の場合、平衡定数は、反応物と生成物のモル濃度(Kc)または分圧(Kp)のいずれかで表すことができます。これら2つのK値の関係は、理想気体の方程式とモル度の定義から簡単に導き出すことができます。理想気体の方程式によると、次が成立します。
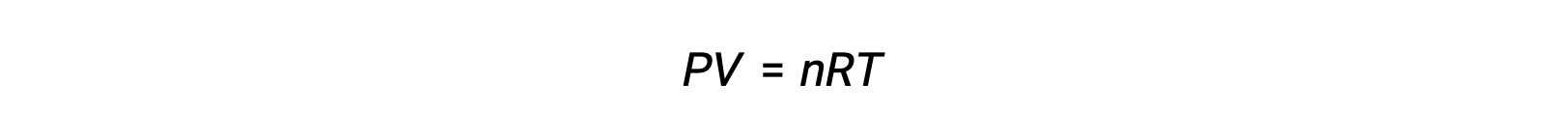
モル濃度または、モル数を体積で割って求められます。
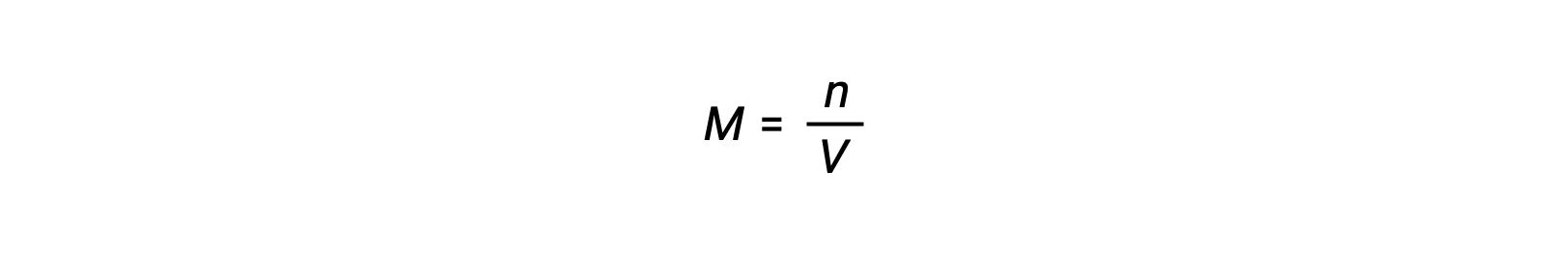
そのため、次が成立します。
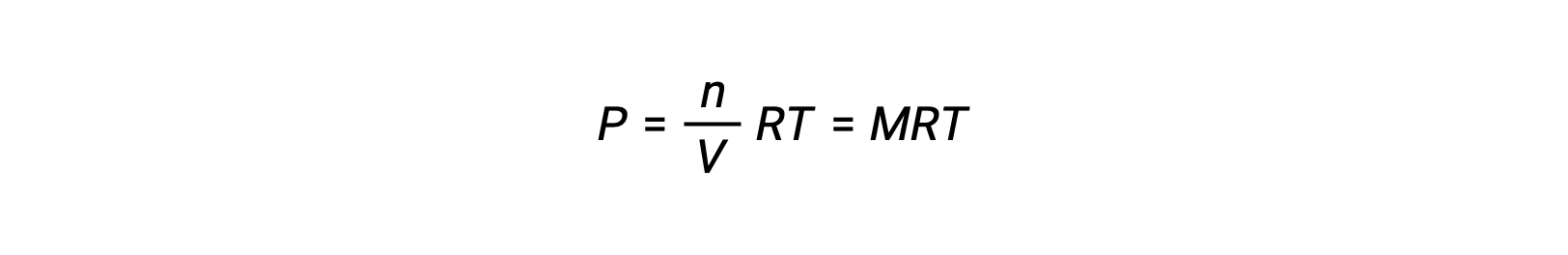
ここで、Pは分圧、Vは体積、nはモル数、Rは気体定数、Tは温度、Mはモル濃度です。
気相反応の場合 m A + n B ⇌ x C + y D です。
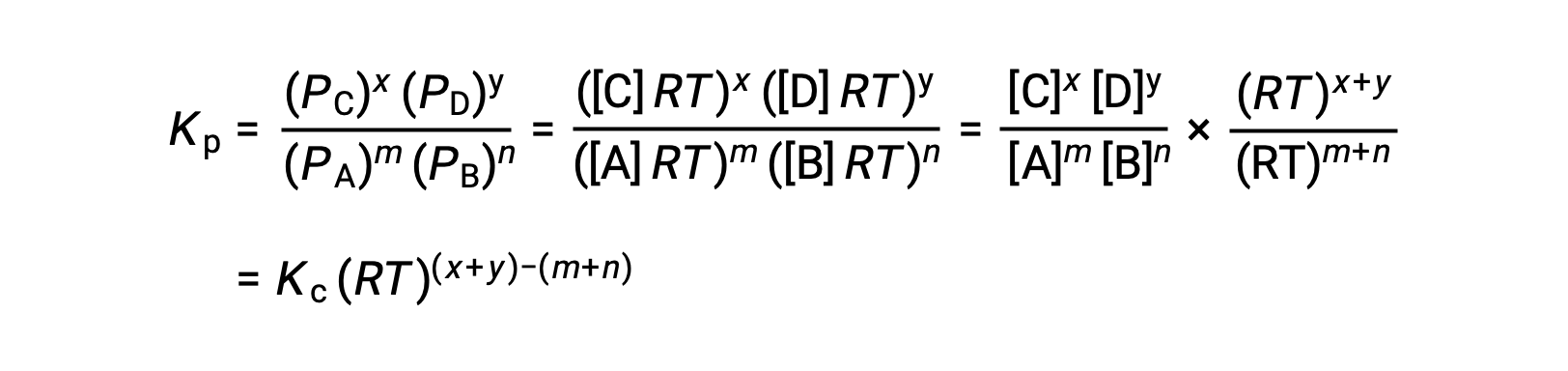
そのため、KcとKPの関係は、次の通りです。
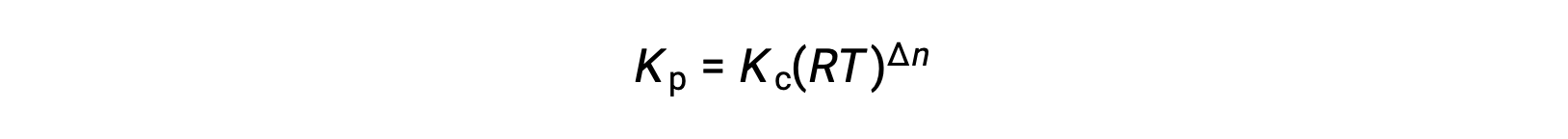
ここで Δn は、この場合、生成物と反応物の気体のモル量の差です。
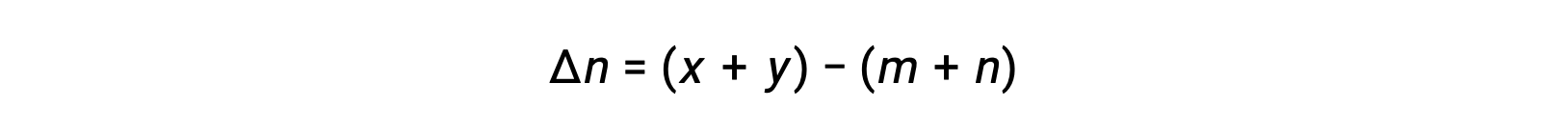
上記の文章は以下から引用しました。 Openstax, Chemistry 2e, Section 13.2 Equilibrium Constants.


