4.1: 反应化学计量
一个平衡的化学方程式以非常简洁的格式提供了大量信息。化学式提供了涉及化学变化的反应物和产物的身份,从而可以对反应进行分类。系数提供了这些化学种类的相对数量,从而可以定量评估反应所消耗和产生的物质量之间的关系。这些定量关系称为反应的化学计量,该术语源自希腊语 stoicheion (意思是“元素”)和 metron (意思是“度量”) ;)。
反应的化学计量可帮助预测需要多少反应物才能生成所需量的产物,或者在某些情况下,由特定量的反应物会形成多少产物。
化学方程式的系数表示每种物质的摩尔数。例如,考虑氮气和氢气反应生成氨。化学计量学表明,一摩尔的氮与三摩尔的氢反应生成两摩尔的氨。
由于一个摩尔包含's阿伏伽德罗分子数,所以分子的相对数与摩尔的相对数相同。读该方程式的另一种方法是“一个氮分子和三个氢分子反应生成两个氨分子。
基于此,得出以下化学计量因素:
对于由氮和氢形成氨的平衡化学反应,N 2 和NH 3 之间的以下化学计量摩尔比为1:2。然后,通过将氮的摩尔量乘以与两种感兴趣的物质有关的化学计量转换因子,得出氨的摩尔量。
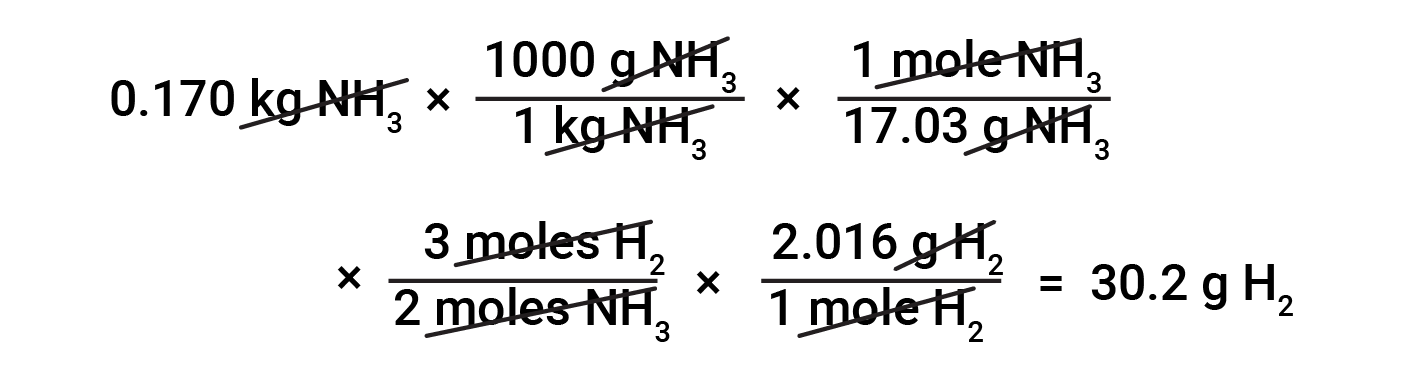
基于化学计量的物质质量转换需要了解摩尔比和摩尔质量。例如,为了找到产生0.170千克氨所需的氢质量,首先,使用氨的摩尔质量将氨的质量转换为氨的量(以摩尔计)。然后,来自平衡方程式的合适的化学计量因子将氨的量(以摩尔计)转换为氢的量(以摩尔计)。最后,氢的摩尔质量将氢的量(以摩尔计)转换为氢的质量。
本文改编自 OpenStax 化学2e,第4.3节:反应化学计量。
化学计量系数

化学计量因素
平衡化学方程式用于确定与给定量的另一种反应物反应或产生给定量的产物所需的一种反应物的量,等等。平衡方程式中的系数用于导出允许计算所需数量的化学计量因子。在氢和氮的反应中,由氢分子以2:3的比例产生氨分子。这意味着三摩尔的氢在化学计量上相当于两摩尔的氨。
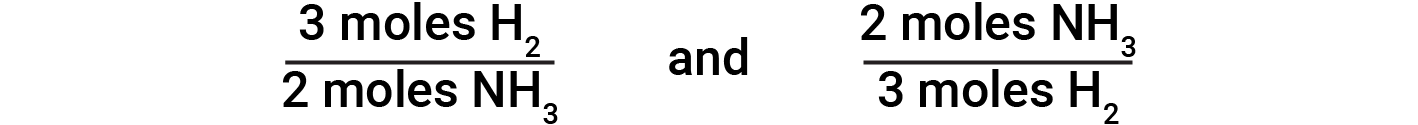
分子到分子的转换

质量到质量的转换
Tags
Reaction Stoichiometry
Balanced Chemical Reaction
Quantitative Relationship
Reactants
Products
Molecules
Stoichiometric Coefficients
Moles
Synthesis Of Ammonia
Mole Ratio
Conversion Factor
Mass Estimation


